락토스 오페론
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
락토스 오페론은 대장균에서 락토스 대사를 조절하는 유전자 집단으로, 3개의 구조 유전자(lacZ, lacY, lacA), 프로모터, 오퍼레이터, 조절 유전자로 구성된다. lacZ는 락토스를 포도당과 갈락토스로 분해하는 효소인 β-갈락토시다제를, lacY는 락토스 투과효소를, lacA는 락토스 대사에서의 역할이 불분명한 β-갈락토사이드 트랜스아세틸라제를 암호화한다. 락토스 오페론은 락토스 유무와 포도당 농도에 따라 음성 및 양성 조절을 받으며, 락토스가 없을 때는 억제자가 오퍼레이터에 결합하여 전사를 억제하고, 락토스가 존재할 때는 알로락토스와 같은 유도 물질이 억제자를 불활성화하여 전사를 유도한다. 또한, 포도당이 부족할 때 cAMP와 CAP 복합체가 프로모터에 결합하여 전사를 촉진하는 양성 조절도 일어난다. 락토스 오페론 연구는 유전자 발현 조절 연구의 모델 시스템으로 활용되고 있으며, 락토스 유전자와 그 유도체는 리포터 유전자로 사용되기도 한다.
더 읽어볼만한 페이지
- 오페론 - 트립토판 오페론
트립토판 오페론은 세균에서 트립토판 생합성에 필요한 효소를 암호화하는 유전자 그룹으로, 트립토판 농도에 따라 억제자 또는 감쇠 메커니즘을 통해 전사가 조절되며, 바실루스 서브틸리스에서는 TRAP 단백질을 통한 감쇠 조절이 특징적이다. - 오페론 - L-아라비노스 오페론
L-아라비노스 오페론은 대장균에서 L-아라비노스 분해에 관여하는 유전자들의 집합체이며, 조절 단백질 AraC에 의해 L-아라비노스 유무에 따라 전사가 조절되고, 단백질 발현 시스템에 활용된다. - 유전자 발현 - RNA 간섭
RNA 간섭은 이중가닥 RNA에 의해 유전자 발현이 억제되는 과정으로, 다이서 효소에 의해 생성된 작은 간섭 RNA가 RNA 유도 침묵 복합체와 결합하여 표적 mRNA를 분해하거나 번역을 억제하며, 바이러스 방어, 발생 조절, 유전체 안정성 유지 등 다양한 기능과 응용 분야를 가진다. - 유전자 발현 - 유전자 재조합
유전자 재조합은 유성 생식 생물의 염색체 유전자 교차를 통한 유전자 재배열 현상으로, 유전적 변이를 증가시키고 유전학적 지도 작성에 활용되며, 생명공학 등 다양한 분야에서 기술로 이용된다.
| 락토스 오페론 | |
|---|---|
| 개요 | |
| 유형 | 오페론 |
| 기능 | 대장균에서 젖당 대사에 관여하는 유전자 발현 조절 |
| 구성 요소 | 조절 유전자 (lacI) 프로모터 (lacP) 작동 부위 (lacO) 구조 유전자 (lacZ, lacY, lacA) |
| 상세 구성 | |
| lacI | 젖당 억제 단백질 코딩 |
| lacZ | β-갈락토시데이스 코딩 (젖당을 포도당과 갈락토오스로 분해) |
| lacY | 젖당 투과 효소 코딩 (세포 내 젖당 수송) |
| lacA | 갈락토시드 아세틸전이효소 코딩 |
| 조절 메커니즘 | |
| 억제자 | 젖당이 없을 때, lacI 유전자에 의해 생성된 억제 단백질이 작동 부위에 결합하여 RNA 중합효소의 결합을 방해하고 전사를 억제함 |
| 유도자 | 젖당 존재 시, 젖당의 이성질체인 알로락토스가 억제 단백질에 결합하여 작동 부위로부터 억제 단백질을 분리시키고, RNA 중합효소가 프로모터에 결합하여 전사 시작 |
| 추가 정보 | |
| 중요성 | 유전자 조절 연구의 중요한 모델 시스템 |
| 발견 | 자크 모노, 프랑수아 자코브 |
2. 구조
''lac'' 오페론은 3개의 구조 유전자(`lacZ`, `lacY`, `lacA`)와 프로모터, 오퍼레이터, 조절 유전자로 구성되어 있다. 3개의 구조 유전자는 락토스 대사에 관여하는 단백질을 암호화한다.
- ''lacZ''는 β-갈락토시다제(LacZ)를 암호화하며, 이당류인 젖당을 포도당과 갈락토스로 분해하는 효소이다.
- ''lacY''는 β-갈락토사이드 투과효소(LacY)를 암호화하며, β-갈락토사이드를 세포 안으로 수송하는 막횡단 단백질이다.
- ''lacA''는 β-갈락토사이드 트랜스아세틸라제(LacA)를 암호화하며, 아세틸기를 전달하는 효소이다.
젖당 이화 작용에는 ''lacZ''와 ''lacY''만 필요한 것으로 보인다. 락토스 오페론은 ''lacZYA''라고도 불리는데, 이는 락토스 오페론이 락토스 대사계의 세 가지 구조 유전자 ''lacZ'', ''lacY'', ''lacA''로 구성되어 있기 때문이다.
thumb
bp 수로 따지면 ''lacI''는 1100bp, ''lacZ''는 3000bp, ''lacY''는 800bp, ''lacA''는 800bp이며, 3bp는 1개의 아미노산에 해당한다.[5]
한편, 전사 빈도를 결정하는 조절 유전자는 ''lacP'' (프로모터 서열), ''lacO'' (오퍼레이터 서열)와 프로모터 상류에 존재하는 CAP 결합 부위의 세 가지이다.
2. 1. 유전자 명명법
대장균을 포함한 세균의 표현형은 세 글자 약어로 표시한다. 예를 들어, Lac은 젖당를 사용할 수 있는 능력을 나타내고, His는 아미노산 히스티딘을 합성할 수 있는 능력을, Mot는 수영 운동성을, SmR은 항생제 스트렙토마이신에 대한 저항성을 의미한다.유전자는 표현형과 관련된 세 글자를 소문자, 이탤릭체로 표기하며, 추가 문자로 구별한다. 예를 들어, ''lacZ'', ''lacY'', ''lacA''는 락토스 오페론에서 각각 β-갈락토시다제, β-갈락토사이드 투과효소, β-갈락토사이드 트랜스아세틸라제를 암호화하는 유전자이다. ''lacI''는 락토스 억제자를 암호화하는 네 번째 ''lac'' 유전자이다.
단백질은 표현형 명명법을 확장하여 사용한다. 예를 들어, LacZ는 ''lacZ'' 유전자의 단백질 생성물인 β-갈락토시다제를 나타낸다.
유전자 발현에 영향을 미치는 DNA 서열(프로모터, 오퍼레이터)도 표현형 명명법을 사용한다. 예를 들어, ''lac p''는 ''lac'' 프로모터를, ''lac o''는 ''lac'' 오퍼레이터를 나타낸다.
3. 조절
락토스 오페론의 조절은 락토스 유무와 포도당 농도에 따라 두 가지 방식으로 이루어진다. 락토스가 없을 때는 음성 조절이 일어나 ''lac'' 억제자가 작동자에 결합하여 전사를 억제하고, 락토스가 존재하면 억제자가 작동자에서 떨어져 나가 전사가 일어난다. 포도당 농도가 낮으면 cAMP 농도가 높아져 CAP-cAMP 복합체가 형성되고, 이 복합체가 프로모터에 결합하여 RNA 중합효소의 결합을 도와 전사를 촉진하는 양성 조절이 일어난다.
- 음성 조절: ''lacI'' 유전자는 ''lac'' 억제자(LacI)를 생성하는데, 이 억제자는 락토스가 없을 때 ''lac'' 오페론의 오퍼레이터(''lacO'')에 결합하여 RNA 중합효소가 프로모터에 결합하는 것을 막는다. 락토스가 존재하면 락토스 대사 산물인 알로락토스가 억제자와 결합하여 구조를 변화시켜 오퍼레이터에 결합하지 못하게 한다. 그러면 RNA 중합효소가 프로모터에 결합하여 ''lac'' 유전자를 전사할 수 있게 된다.[7]
- 양성 조절: 포도당 농도가 낮으면 세포 내 cAMP 농도가 높아진다. cAMP는 CAP(카타볼라이트 활성 단백질)와 결합하여 CAP-cAMP 복합체를 형성한다. 이 복합체는 프로모터 상류의 CAP 결합 부위에 결합하여 RNA 중합효소의 프로모터 결합을 촉진한다.[8]
포도당이 존재하면 카타볼라이트 억제가 일어나는데, 이는 포도당 수송 시스템이 락토스 투과효소를 억제하여 락토스가 세포 내로 들어오는 것을 막고, 아데닐산 시클라제를 억제하여 cAMP 농도를 낮추기 때문이다. 결과적으로 CAP-cAMP 복합체가 형성되지 않아 *lac* 오페론의 발현이 억제된다.[9]
결론적으로, 락토스 오페론은 락토스가 존재하고 포도당이 부족한 조건에서만 발현된다.
3. 1. 음성 조절
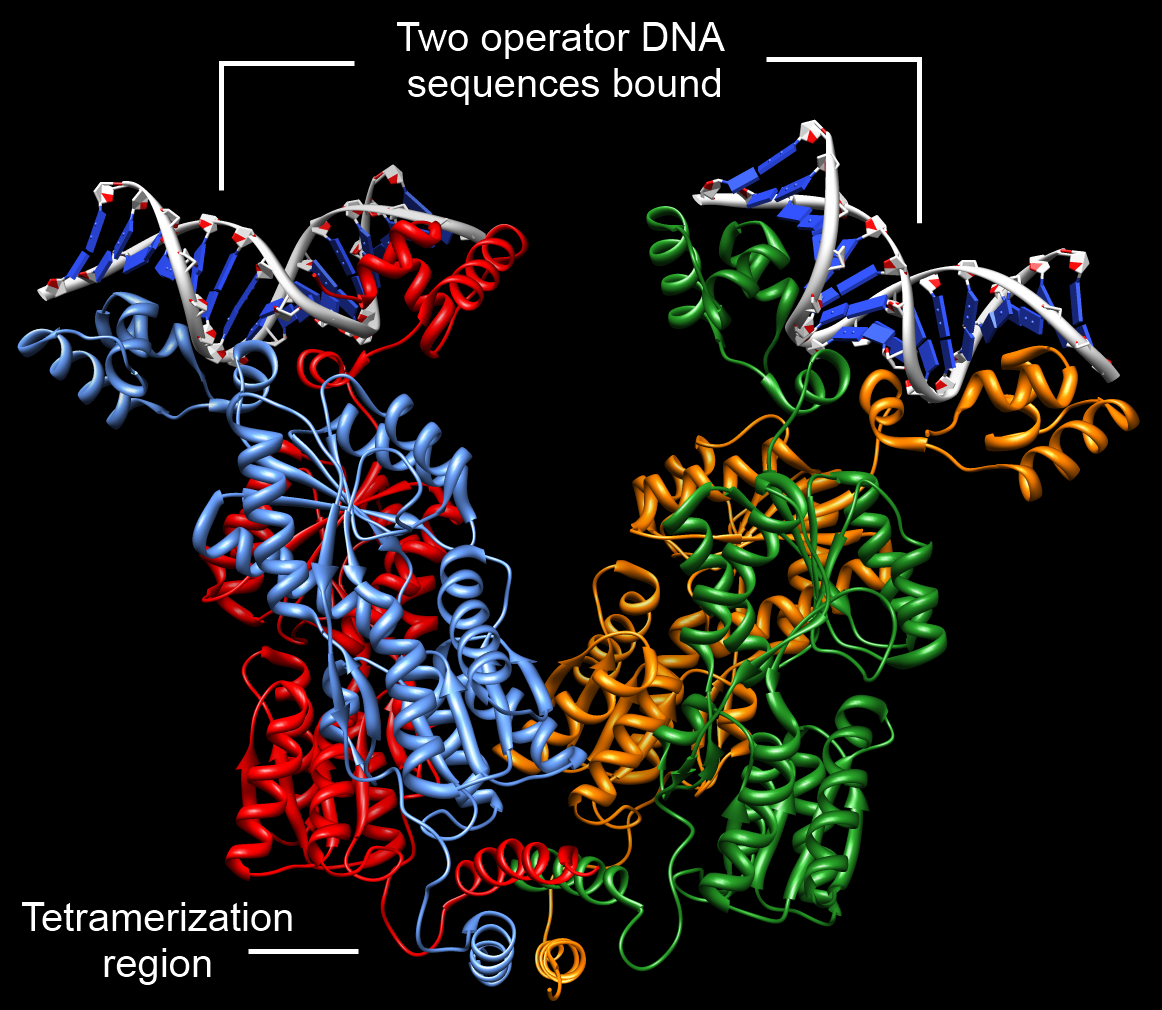
''lac'' 오페론은 음성 조절을 통해 유전자 발현을 조절한다. 음성 조절은 유전자가 전사되지 않도록 억제하는 기작이다. 락토스 오페론의 경우, ''lacI'' 유전자가 암호화하는 ''lac'' 억제자(LacI)라는 단백질이 이 역할을 담당한다. ''lac'' 억제자는 프로모터 바로 아래에 있는 ''lac'' 오퍼레이터(''lac''O)에 결합하여 RNA 중합효소가 프로모터에 결합하는 것을 방해한다.[7]''lac'' 억제자는 4개의 동일한 소단위체로 구성된 4량체 단백질이며, 각 소단위체는 DNA에 결합할 수 있는 헬릭스-턴-헬릭스 모티프를 가지고 있다. 억제자가 결합하는 오퍼레이터 부위는 역반복 대칭성을 가지는 DNA 서열이며, 오퍼레이터의 두 DNA 절반 부위가 억제자의 두 소단위체에 각각 결합한다.[10]
락토스가 없을 때, ''lac'' 억제자는 오퍼레이터에 강하게 결합하여 RNA 중합효소가 프로모터에 결합하는 것을 막고, 결과적으로 ''lacZYA'' mRNA 전사는 매우 낮은 수준으로만 일어난다. 그러나 락토스가 존재하면, 락토스 대사 산물인 알로락토스가 억제자와 결합하여 억제자의 구조를 변화시킨다. 이로 인해 억제자는 오퍼레이터에 결합할 수 없게 되고, RNA 중합효소는 ''lac'' 유전자를 전사하여 해당 단백질들의 수준을 높인다.[8]
억제자는 알로스테릭 단백질로서, 두 가지 다른 형태 중 하나를 가질 수 있다. 한 형태에서는 오퍼레이터 DNA에 높은 특이성으로 결합하고, 다른 형태에서는 특이성을 잃는다. 알로락토스나 IPTG와 같은 유도제가 억제자에 결합하면, 억제자의 형태 분포가 DNA 비결합 형태로 안정화된다. 하지만 억제자가 DNA에 이미 결합된 상태에서도 유도제가 결합할 수 있다는 점은 여전히 밝혀지지 않았다.[11]


3. 1. 1. 억제자 구조
lac 억제자는 동일한 서브유닛 4개로 구성된 단백질, 즉 4량체이다.[26] 각 서브유닛은 DNA에 결합할 수 있는 헬릭스-턴-헬릭스(HTH) 모티프를 포함한다. 억제자가 결합하는 오퍼레이터 부위는 역반복 대칭성을 가진 DNA 서열이다. 오퍼레이터의 두 DNA 절반 부위는 함께 억제자의 두 서브유닛에 결합한다. 초기 모델에서 억제자의 나머지 두 서브유닛은 아무 역할도 하지 않는 것으로 여겨졌으나, 수년 동안 이 특성은 밝혀지지 않았다.[10]''lac'' 억제자(LacI)는 기능적으로 두 개의 이량체이다. 구성 단위 단량체의 경우, 1~59번 아미노산은 '''헤드피스'''라고 불리는 DNA 결합 도메인이며, 나머지 부분은 '''코어'''이다. 헤드피스는 트립신 소화로 잘라낼 수 있다.[26] N말단(아미노 말단)의 DNA 결합 모티프는 헬릭스-턴-헬릭스이다. 코어는 코어 도메인 1과 2로 나뉘며, 둘 다 공통 구조를 갖는다. 6개의 나란한 β-시트가 양쪽에 두 개씩의 α-나선으로 끼워져 있다.[26] 이 영역은 코어 도메인 1과 2에서 활성 인자를 끼워 넣기 위한 오목부를 만든다. C말단(카르복실 말단)에는 7개의 잔기가 떨어진 두 개의 류신 반복 서열을 포함하는 α-나선이 있다.[26] 이는 올리고머 형성 도메인으로, 4개의 단량체가 모일 때 결합시킨다.
이량체는 코어의 N말단 측 부분, 활성 인자가 끼워지는 오목부 가장자리 부분, 소수성 코어 도메인의 각 결합으로 접촉을 유지한다.[26] 서로의 C말단 영역은 평행하게 돌출된다.[26] 반대쪽에서 헤드피스가 모인다.[26] 이량체 두 개가 만나 사량체를 형성하는데, 이때 결합시키는 것이 C말단의 α-나선 묶음이다.
''lac'' 억제자 LacI는 프로모터 바로 아래 '''''lac'' 오퍼레이터'''(''lac''O)에 결합한다. 오퍼레이터에는 주 오퍼레이터와 보조 오퍼레이터가 있으며, 두 개의 서브유닛이 동시에 결합하여 DNA를 더 강하게 포착하고 억제를 더 효과적으로 만든다. 사이 DNA 영역은 '''루프 형성'''을 한다.[26]
결국, ''lac'' 조절에 관여하는 두 개의 추가 오퍼레이터가 밝혀졌다.[10] 하나(O3)는 ''lacI'' 유전자 끝부분에서 O1보다 약 -90 bp 상류에 있고, 다른 하나(O2)는 ''lacZ'' 초기 부분에서 O1보다 약 +410 bp 하류에 있다. 이 두 부위는 중복 기능을 가지며, 개별 돌연변이가 억제에 큰 영향을 주지 않아 초기에 발견되지 않았다. O2 또는 O3 단일 돌연변이는 2~3배 영향만 주지만, O2와 O3 모두 결함이 있는 이중 돌연변이는 억제 기능이 크게 감소하여 약 70배 정도 탈억제된다.[10]
현재 모델에서 ''lac'' 억제자는 주 오퍼레이터 O1과 O2 또는 O3에 동시에 결합한다. 그 사이 DNA는 복합체에서 루프를 형성한다. 두 보조 오퍼레이터의 중복 특성은 특정 루프 복합체가 중요하다는 것을 시사한다. 한 가지 가설은 테더링을 통해 시스템이 작동한다는 것이다. 결합된 억제자가 O1에서 일시적으로 해제되면, 보조 오퍼레이터에 결합하여 근처에 유지되므로 빠르게 재결합할 수 있다. 이는 O1에 대한 억제자 친화력을 증가시킨다.
3. 1. 2. 유도 메커니즘
lac영어 오페론의 유도 메커니즘은 락토스에 대한 조절 반응으로, 락토스 억제자라는 세포 내 조절 단백질을 사용하여 락토스가 없을 때 β-갈락토시다아제의 생산을 방해한다. 억제자를 코딩하는 ''lacI'' 유전자는 ''lac'' 오페론 근처에 있으며 항상 발현된다(''구성적''). 락토스가 성장 배지에 없으면 억제자는 ''lacZ''의 시작 부분 근처의 프로모터 바로 아래에 있는 짧은 DNA 서열, 즉 ''lac 작동자''에 매우 강하게 결합한다. 억제자가 작동자에 결합하면 RNA 중합효소(RNAP)가 프로모터에 결합하는 것을 방해하므로 LacZ와 LacY를 코딩하는 mRNA는 매우 낮은 수준으로만 생성된다.[7] 하지만 락토스가 존재할 때 세포를 배양하면 ''lacZ'' 유전자의 산물에 의해 락토스에서 생성된 알로락토스라는 락토스 대사 산물이 억제자에 결합하여 알로스테릭 변화를 일으킨다. 이러한 변화로 인해 억제자는 작동자에 결합할 수 없게 되어 RNAP가 ''lac'' 유전자를 전사하여 코딩된 단백질의 수준이 높아진다.[8]lac 억제자는 동일한 서브유닛을 가진 4개의 부분으로 구성된 단백질, 즉 4량체이다. 각 서브유닛은 DNA에 결합할 수 있는 헬릭스-턴-헬릭스 모티프(HTH)를 포함한다. 억제자가 결합하는 오퍼레이터 부위는 역반복 대칭성을 가진 DNA 서열이다. 오퍼레이터의 두 개의 DNA 하프 사이트는 함께 억제자의 두 개의 서브유닛에 결합한다.[10]
억제자는 알로스테릭 단백질로, 서로 균형을 이루는 두 가지 약간 다른 형태 중 하나를 가질 수 있다. 한 형태에서 억제자는 높은 특이성으로 오퍼레이터 DNA에 결합하고, 다른 형태에서는 특이성을 잃는다. 유도에 대한 고전적 모델에 따르면, 유도제, 즉 알로락토스 또는 이소프로필-β-D-티오갈락토피라노사이드(IPTG)가 억제자에 결합하면 두 형태 사이의 억제자 분포에 영향을 미친다. 따라서 유도제가 결합된 억제자는 DNA 비결합 형태에서 안정화된다. 그러나 억제자가 DNA에 매우 안정적으로 결합되어 있지만 유도제를 첨가하면 빠르게 방출되므로 이 간단한 모델만으로는 모든 것을 설명할 수 없다. 따라서 유도제는 억제자가 이미 DNA에 결합되어 있을 때도 억제자에 결합할 수 있는 것으로 보인다. 결합의 정확한 메커니즘이 아직 완전히 알려지지 않았다.[11]
락 오페론의 억제와 유도에 있어서 DNA에 대한 억제 단백질의 비특이적 결합은 중요한 역할을 한다. 락 억제 단백질의 특이적 결합 부위는 오퍼레이터이다. 비특이적 상호작용은 주로 전하-전하 상호작용에 의해 매개되는 반면, 오퍼레이터에 결합하는 것은 소수성 상호작용에 의해 강화된다. 또한, 억제 단백질이 결합할 수 있는 비특이적 DNA 서열이 풍부하게 존재한다. 본질적으로, 오퍼레이터가 아닌 모든 서열은 비특이적으로 간주된다. 연구에 따르면, 비특이적 결합이 없으면 유도제 포화 수준에서도 락 오페론의 유도(또는 억제 해제)가 일어날 수 없다. 비특이적 결합이 없으면 유도의 기초 수준이 정상적으로 관찰되는 것보다 만 배 더 작다는 것이 입증되었다. 이는 비특이적 DNA가 억제 단백질의 일종의 "싱크" 역할을 하여 오퍼레이터로부터 억제 단백질의 주의를 분산시키기 때문이다. 비특이적 서열은 세포 내에서 사용 가능한 억제 단백질의 양을 감소시킨다. 이는 차례로 시스템의 억제를 해제하는 데 필요한 유도제의 양을 감소시킨다.[12]
- -'''상단''': 유전자는 본질적으로 꺼져 있다. 알로락토스가 없어서 ''lac'' 억제자를 억제할 수 없으므로, 억제자는 오퍼레이터에 단단히 결합하여 RNA 중합효소가 프로모터에 결합하는 것을 방해하고, 그 결과 ''laczya'' mRNA 전사체가 생성되지 않는다.
'''하단''': 유전자가 켜져 있다. 알로락토스는 억제자를 억제하여 RNA 중합효소가 프로모터에 결합하여 유전자를 발현하도록 하여 LacZYA의 생산을 유도한다. 결국 효소는 모든 락토스를 소화하여 억제자에 결합할 수 있는 알로락토스가 더 이상 없을 때까지 진행된다. 그런 다음 억제자가 오퍼레이터에 결합하여 LacZYA 유전자의 전사를 중단한다.]]
- 이소프로필-β-D-티오갈락토피라노사이드(IPTG)는 생리학적 연구를 위해 lac영어 오페론 유도제로 자주 사용된다.[13] IPTG는 억제 물질에 결합하여 비활성화시키지만, β-갈락토시다아제의 기질은 아니다.
- Allolactose(알로락토스)는 락토스의 이성질체이며, lac영어 오페론의 유도제이다. 락토스는 갈락토스-β(1→4)-글루코스인 반면, 알로락토스는 갈락토스-β(1→6)-글루코스이다. 락토스는 가수분해 반응과 다른 반응으로 β-갈락토시다아제에 의해 알로락토스로 전환된다.
3. 2. 양성 조절
카타볼라이트 활성 단백질(CAP)은 사이클릭 아데노신 일인산(cAMP)과 결합하여 CAP-cAMP 복합체를 형성한다. 이 복합체는 프로모터 상류의 CAP 결합 부위에 결합하여 RNA 중합효소의 결합을 촉진한다.[8] 포도당 농도가 낮으면 cAMP 농도가 높아져 CAP-cAMP 복합체 형성이 증가하고, 락토스 오페론의 전사가 촉진된다.thumb(전사를 종료시키는 서열), 오른쪽 Promoter: 락토스 오페론의 프로모터, Operator: 락토스 오페론의 오퍼레이터, ''lacZ'', ''lacY'', ''lacA'', 오른쪽 Terminator: 락토스 오페론의 종결자]]
CAP-cAMP 복합체는 -35 박스 바로 상류에 있는 활성제 결합 부위(CAP 결합 부위)에 결합하여 RNA 중합효소가 프로모터에 결합하도록 돕는다.[26] CAP 및 cAMP가 작용하는 오페론에서 프로모터는 일반적으로 매우 약하며, -35 박스는 공통 서열과 유사하지 않다. 이는 활성 인자의 역할을 유지하기 위한 것으로, 강한 프로모터는 포도당 존재 하에서도 무의미한 전사를 일으킬 수 있기 때문이다.
3. 2. 1. 카타볼라이트 억제 (Catabolite repression)
포도당이 존재하면 포도당 수송 시스템이 작동하여 락토스 투과효소를 억제한다. 이는 락토스가 세포 내로 유입되는 것을 막는 역할을 한다.[9] 포도당은 또한 아데닐산 시클라제를 억제하여 cAMP 농도를 낮춘다. cAMP 농도가 낮아지면 CAP-cAMP 복합체 형성이 억제되어 *lac* 오페론의 발현이 억제된다.[8]포도당의 세포 내 운반은 PEP 의존성 포스포트랜스퍼라제 시스템을 통해 이루어진다. 이 과정에서 포스포에놀피루브산의 인산기가 여러 단계를 거쳐 포도당 특이 PTS 단백질로 전달된다. 포도당 수송은 EIIBGlc의 인산화를 동반하며, 이는 다른 PTS 단백질에서 인산기를 고갈시킨다. 인산화되지 않은 EIIAGlc는 *lac* 투과효소에 결합하여 락토스의 세포 내 유입을 막는다.[9]
결론적으로, 포도당과 락토스가 모두 존재할 때, 포도당 수송은 *lac* 오페론의 유도 물질인 락토스의 수송을 차단하는 방식으로 작동한다.[9]
3. 2. 2. 유인 (Recruitment)
CAP-cAMP 복합체는 RNA 중합효소를 프로모터로 유인하여 전사를 촉진한다. 이를 유인(Recruitment)이라고 한다. 유인 과정에서 CAP-cAMP 복합체는 RNA 중합효소의 α 소브유닛 C-말단 도메인(αCTD)과 상호작용하여 결합을 강화한다.[8]구체적으로, CAP의 활성화 영역 I (ARI)과 RNA 중합효소 α 서브유닛의 카르복시 말단 도메인 (αCTD)이 직접적으로 연결된다. 전사를 시작하는 단계의 RNA 중합효소(홀로효소)는 α 서브유닛을 2개 포함하는데, 하나는 DNA에만, 다른 하나는 DNA와 CAP 모두에 결합한다. 전자를 αCTDDNA로, 후자를 αCTDCAP,DNA로 표기한다. CAP-cAMP 복합체는 DNA를 약 100° 굽히는데, 이는 단백질과 DNA 간의 최적의 상호작용에 필수적인 것으로 보인다.
유인은 두 단계로 이루어진다.[26]
1. 폐쇄형 복합체(RPc) 형성 보조
2. 개방형 복합체(RP0)로의 이행 보조
윌리엄 맥클루어는 이 과정을 다음과 같은 식으로 정리했다.
:
(R: RNA 중합효소, P: 프로모터, RPc: 폐쇄형 복합체, RP0: 개방형 복합체)
전체 반응의 평형 상수는 KB, 후반응의 반응 속도 상수는 k2이다. 맥클루어는 각 반응 속도를 측정하는 방법을 개발했고, 그 결과 CAP-cAMP 복합체가 KB를 증가시키는 것을 확인했다.
CAP-cAMP 복합체는 cAMP와 CAP (cAMP 수용체 단백질, CRP라고도 함)으로 구성된다. 이 복합체는 -35 박스 바로 상류에 있는 활성제 결합 부위 (CAP 결합 부위)에 결합하여 RNA 중합효소가 프로모터에 결합하도록 돕는다.[26] 황산 디메틸 노출 실험에서 CAP-cAMP 복합체가 결합된 DNA의 구아닌이 메틸화로부터 보호되는 것을 통해, 이 복합체가 특히 서열 중 구아닌에 강하게 결합한다는 것을 알 수 있다.
CAP 및 cAMP가 작용하는 오페론에서는 일반적으로 프로모터가 매우 약하다. -35 박스는 공통 서열과 유사하지 않으며, 대부분은 공통 서열로 인식할 수 없다. 이는 활성 인자의 역할을 유지하기 위한 것으로, 만약 강한 프로모터가 있다면 충분한 글루코스 존재 하에서도 무의미한 전사를 일으킬 수 있기 때문이다.
3. 3. 기타 양성 조절
CAP-cAMP 복합체는 또 다른 프로모터(P2)에서의 전사를 감소시켜 주요 프로모터(P1)를 통한 전사를 상대적으로 촉진하는 효과를 낼 수 있다.[8] P2에 결합하는 RNA 중합효소의 양을 제한함으로써 결과적으로 P1을 유도할 수 있다. 우수한 프로모터를 선택함으로써, 전사를 더 효율적으로 할 수 있다고 여겨진다.[8]4. 락토스 유사체
이소프로필-β-D-티오갈락토피라노사이드(IPTG)는 락토스 오페론 연구에 자주 사용되는 물질이다. IPTG는 억제 물질에 결합하여 비활성화시키지만, β-갈락토시데이스의 기질은 아니다. 생체 내 연구에서 IPTG를 사용하는 이유는 ''대장균''에서 대사되지 않아 농도가 일정하게 유지되기 때문이다. 이는 ''lac p/o''로 제어되는 유전자의 발현 속도가 실험에서 변수가 아니라는 장점으로 작용한다.[13]
페닐-β-D-갈락토스(페닐-Gal)는 β-갈락토시데이스의 기질이지만, 억제 물질을 비활성화시키지 않아 유도제가 아니다. 억제 물질이 없는 돌연변이는 페닐-Gal에서 성장할 수 있다는 특징이 있다.
티오메틸 갈락토사이드(TMG)는 락토스 유사체로, lacI 억제 물질을 억제한다.
ONPG(ONPG)는 β-갈락토시데이스에 의해 분해되면 orthonitrophenol(오르토니트로페놀)이라는 노란색 화합물을 생성한다. 이 특징을 이용하여 β-갈락토시데이스 생체 외 분석에 사용된다.[15]
X-gal(5-브로모-4-클로로-3-인돌릴-β-D-갈락토사이드)은 B-갈락토시다아제에 의해 분해되면 짙은 파란색을 띠는 물질을 생성한다. 따라서 β-갈락토시데이스를 생성하는 콜로니는 X-gal에 의해 파란색으로 변한다.[16]
Allolactose(알로락토스)는 락토스의 이성질체이며, ''lac'' 오페론의 유도제이다. 락토스는 β-갈락토시데이스에 의해 알로락토스로 전환된다.
5. 돌연변이
락토스 오페론의 돌연변이는 락토스 대사 과정에 다양한 영향을 미칠 수 있다.
오페레이터의 돌연변이는 구조 유전자를 전혀 발현시키지 않거나(비유도형 돌연변이), 음성 제어를 받지 않고 항상 발현하게 한다(구성적 돌연변이). 구성적 돌연변이의 경우, ''lac'' 억제자(리프레서)가 결합하지 못하는 것이 원인이다. 오퍼레이터는 직접 연결된 유전자에만 작용(시스 작용)하기 때문에, 세포 내에 다른 대립 유전자가 있어도 영향을 받지 않는다. 이러한 유전자 돌연변이를 시스 우성이라고 하며, 다른 락토스 오페론의 정상/이상 여부와 관계없이 발현에 영향을 준다.[26]
''lac'' 억제자를 만드는 ''lacI'' 유전자의 돌연변이(''lacI''-)도 구성적 돌연변이를 일으킨다. 하지만 이 경우는 세포 내 모든 락토스 오페론에 영향을 주는 트랜스 작용을 한다. 정상 유전자(''lacI''+)를 도입하면 음성 제어가 회복되므로 시스 열성이다.[26] 반면 시스 우성인 오퍼레이터 돌연변이는 정상 유전자가 도입되어도 영향을 받지 않는다.
락토스 오페론의 비유도형 돌연변이는 유전학적으로 두 가지로 나뉜다. 하나는 프로모터에 대한 것으로 시스 우성이다.[26] 다른 하나는 ''lac'' 억제자가 유도 인자와 결합하지 못하게 되는 것(''lacI''S)이다.[26] 이 변형된 억제자는 양성 제어를 무시하고 항상 오퍼레이터와 결합하여 활성 인자나 정상 ''lac'' 억제자가 떼어낼 수 없다.
''lac'' 억제자는 돌연변이에 의해 다양한 형태가 존재하며, 사량체이므로 서로 다른 종류의 서브유닛이 회합하는 경우도 있다. 이를 대립 유전자 간 상호 보완성이라고 한다. 어떤 억제자 돌연변이는 음성 상호 보완성을 일으킨다. 예를 들어 ''lacI-d''와 ''lacI+'' 유전자 조합에서 ''lacI-d''는 오퍼레이터에 결합할 수 없는 ''lac'' 억제자를 생산하여 음성 제어에 기여하지 못한다. 원래 트랜스 작용 유전자의 돌연변이는 열성이지만, ''lacI-d''는 정상 ''lacI'' 유전자가 있어도 음성 제어를 상실시킨다. 생산된 "나쁜" 서브유닛이 자신뿐 아니라 사량체의 일부로서 "좋은" 서브유닛이 오퍼레이터에 결합하는 것도 방해하기 때문이다.[26] 이러한 돌연변이를 도미넌트 네거티브 돌연변이라고 한다.
6. 역사
프랑수아 자코브와 자크 모노는 실험에 일반적인 실험실 세균인 ''대장균''(E. coli)을 사용했지만, 그들이 발견한 많은 기본적인 조절 개념은 모든 유기체의 세포 조절에 기본이 된다.[17]
오페론의 역사는 1940년 자크 모노가 β-갈락토시다아제의 발현에 대해 연구를 시작하면서 시작되었다. 락토스를 대사하는 이 효소는 락토스나 다른 갈락토사이드의 존재에 의해 증가한다는 것을 발견했다. 모노와 멜빈 콘(Melvin Cohn) 등은 항체를 사용하여 이를 확인하고, 유전자가 유도되는 것이 원인임을 알았다.[26]
모노는 β-갈락토시다아제를 생산할 수 있지만 락토스를 영양으로 증식할 수 없는 돌연변이에 대한 연구를 통해 동시에 전사되는 유전자군의 존재를 알게 되었다. 야생형과 돌연변이형에 방사성 갈락토사이드를 투여했을 때, β-갈락토시다아제 유전자가 유도되지 않으면 둘 다 섭취할 수 없었다. 유도하면 야생형은 할 수 있지만, 돌연변이형은 할 수 없었다. 이것은 돌연변이형이 갈락토사이드를 섭취하는 데 필요한 물질이 부족하며, 그것은 β-갈락토시다아제와 함께 발현된다는 것을 의미한다. 이 가상 물질을 모노는 갈락토사이드 퍼미아아제라고 명명했다. 그러나 분리하여 존재를 확인하기 전에 단백질을 명명한 것은 공동 연구자들의 비난을 받았다. 모노는 나중에 "전통적인 두 명의 영국 신사는 서로 이름과 평판을 잘 알고 있더라도, 정식으로 소개되기 전까지는 서로 말을 걸지 않는다는 이야기를 떠올렸다"고 말했다.[26] 실험 후 갈락토사이드 퍼미아아제의 정제를 실시했지만, 그 과정에서 갈락토사이드 트랜스아세틸라아제도 얻었다. 이 단백질은 β-갈락토시다아제 및 갈락토사이드 퍼미아아제와 함께 발현되기 때문이다.
1950년대까지 모노는 3개의 효소가 갈락토사이드를 동시에 유도한다는 것을 확인했다. 또한, 유도를 필요로 하지 않는 '''구성적 돌연변이체'''(constitutive mutation)도 발견했다. 이것은 항상 3개의 유전자를 깨어 있게 한다. 유전학 연구를 진전시키기 위해 파스퇴르 연구소에서 프랑수아 자코브와 공동 연구를 시작했다.[26] 아서 파디의 협력으로 유도를 필요로 하는('''유도성''') 야생형 대립 유전자와 구성적 돌연변이체를 모두 가진 '''부분 이배체'''(merodiploid)를 제작했다.[26] 유도성 대립 유전자가 우성이라는 것이 증명되었고, 유도 전에 발현을 막는 것은 유전자가 아닌 다른 물질임이 판명되었다. 구성적 돌연변이체는 ''lac'' 억제자 유전자(''lacI'')가 결손되어 있다는 것을 확인했다.
''lac'' 억제자(LacI)가 DNA의 특정 영역에 결합한다고 예상하는 것은 쉬운 일이다. 자코브와 모노는 이 영역을 오퍼레이터라고 명명하고, 돌연변이의 영향이 크다고 생각했다. 존재를 확인하기 위해 ''lacI''와 다른 곳에서의 돌연변이가 구성적 돌연변이를 일으키는 것을 증명했다. ''lacI'' 돌연변이는 우성, 오퍼레이터 돌연변이는 열성이라는 이론으로, 자코브는 세균 부분 이배체의 유도성과 구성적 돌연변이의 두 오퍼레이터를 집의 문을 제어하는 두 라디오 수신기에, 두 리프레서 유전자를 문을 닫은 상태로 유지하는 신호를 보내는 송신기에 비유했다.[26] 하나의 리프레서 유전자가 돌연변이하면 송신기 하나가 고장 나지만, 다른 송신기가 살아있어 두 문은 닫힌다. 즉, 두 유전자군은 억제되므로 이 돌연변이는 열성이다. 구성적 돌연변이의 이상이 오퍼레이터에서 일어나면 수신기 하나가 고장 나 문은 열린 상태로 유지된다. 다른 기능하는 수신기의 문은 닫힌 채로 유지되어 유전자 발현이 가능하므로 이 돌연변이는 우성이다. 이처럼 같은 유전자에 대해서만 우성이고, 부분 이배체의 다른 DNA 상에서는 열성인 돌연변이를 '''시스 우성'''(''cis''-dominant)이라고 한다. 자코브와 모노는 시스 우성('''구성적 오퍼레이터''' operator constitutive에서 Oc로 표시)을 발견하고 오퍼레이터 존재를 증명했다.
자코브와 모노의 연구 후, 1960년대에 월터 길버트와 Benno Muller-Hill은 ''lac'' 억제자를 부분적으로 정제했다.[26] 유전자 클로닝은 아직 개발되지 않았고, 가장 민감도가 높은 생물학적 분석은 '''이소프로필티오갈락토사이드'''(IPTG)였다. 세포 추출액의 ''lac'' 억제자 농도가 너무 낮아 검출할 수 없어, IPTG에 강하게 결합하는 변이 ''lacIt''를 가진 대장균을 사용했다.
DNA와 결합한 ''lac'' 억제자(LacI)는 니트로셀룰로스 필터 결합법으로 검출할 수 있다. 길버트의 방법으로 정제한 ''lac'' 억제자를 농도별로 나누어, 멜빈 콘은 IPTG 유무에 따라 결합 비율을 조사했다.[26] 이 결과는 유도 인자가 오퍼레이터 접근을 억제함을 나타낸다. 콘 등은 구성적 돌연변이 오퍼레이터(''lacOc'')를 포함하는 DNA는 야생형보다 고농도를 요구한다는 것도 밝혔다. 자코브와 모노가 오퍼레이터로 정의한 DNA 영역은 리프레서에 결합된다는 것을 확인할 수 있다.
오퍼레이터 점유가 왜 음성 조절로 이어지는지에 대해서는 여러 설이 있지만, 전사를 실행하는 효소 '''RNA 중합효소'''(RNA polymerase)를 방해한다고 생각된다. RNA 중합효소는 전사를 시작하기 위해 프로모터에 결합해야 하는데, 프로모터는 오퍼레이터 바로 옆이다. 음성 조절 해명은 우여곡절을 겪었다. ''lac'' 억제자는 프로모터 접근을 막는 장애물로 생각되었으나, 1971년 Ira Pastan은 ''lac'' 억제자 존재 하에서도 강력한 결합이 일어난다는 것을 밝혔다.[26] 1987년 Susan Straney와 Donald Crothers 등은 두 개가 DNA에 동시에 결합할 수 있다는 것을 확인했다.[26] ''lac'' 억제자는 DNA 결합 후 RNA 중합효소에 영향을 준다고 생각하게 되었다. Barbara Krummel과 Michael Chamberlin 등은 초기 전사 복합체의 탈출을 억제한다고 생각했다.[26] 이 가설이 옳다면 어보티브 전사체[26]가 만들어지지만, Jookyung Lee와 Alex Goldfarb 등은 ''lac'' 억제자 존재 하에서 6nt의 RNA를 얻었다.[26] Lee와 Goldfarb 등의 실험과 인용된 다른 실험 조건은 RNA 중합효소와 ''lac'' 억제자 농도가 큰 등 생체 조건과 달랐다. Thomas Record 등은 생체에 가까운 조건에서 어보티브 전사체의 합성 속도를 측정했다.[26] RNA 중합효소와 락토스 오페론 프로모터 복합체를 만들고, (1) 단독 (2) 전사 억제제 헤파린 첨가 (3) ''lac'' 억제자 첨가 (4) 복합체 없음의 4가지 경우를 실험했다. (1)에서는 어보티브 전사체가 문제없이 합성되었지만, (2)와 (3)은 유사한 억제가 일어났다. 헤파린은 유리 상태일 때 결합하고 DNA와 결합하지 않도록 하는 단백질로, DNA와 RNA 중합효소 중 어느 쪽이 먼저 만나는지 경쟁한다. 경쟁적 억제 양식이며, ''lac'' 억제자가 이 형식의 억제제임이 분명하다. 현재는 DNA 결합을 RNA 중합효소와 경쟁한다는 초기 가설이 유력하다.
1978년 윌리엄 레즈니코프는 락토스 오페론의 주요 프로모터 22bp 상류에 다른 프로모터가 있다는 것을 발견했다.
1984년 Wing Wu와 도널드 크로더스는 CAP-cAMP에 의한 '''DNA 굴곡'''을 전기 영동으로 측정했다. DNA는 굽으면 이동도가 작아지고, 꺾인 부분이 중앙에 가까울수록 현저해진다. 크로더스는 활성제 결합 부위가 다른 동일 길이 DNA 단편을 여러 개 준비하고 CAP-cAMP 복합체에 결합시켰다. 전기 영동으로 이동도 차이를 측정해 굴곡 각도를 90°로 추정했다. 1991년 토마스 A. 스테이츠에 의해 약 100°로 수정되었다.
1996년 미첼 루이스는 ''lac'' 억제자 및 오퍼레이터를 포함하는 21bp DNA 단편과의 복합체를 X선 결정 구조 분석했다.[26] ''lac'' 억제자 사량체의 두 이량체는 각각 DNA의 다른 부위에 결합한다는 것이 명백해졌다.
2002년 리처드 에브라이트는 DNA와 CAP-cAMP 복합체, RNA 중합효소 αCTD 복합체를 X선 결정 구조 분석했다. αCTD가 결합하기 쉽도록 CAP 결합 부위에 인접한 서열을 친화성이 큰 A-T 고함유 서열(5'-AAAAAA-3')로 바꿨다.
7. 분자생물학에서의 활용
''lac'' 유전자와 그 유도체는 투-하이브리드 분석과 같은 여러 세균 기반 선택 기술에서 리포터 유전자로 사용될 수 있다. 이는 성공적인 전사 활성 인자가 특정 프로모터 서열에 결합했는지 여부를 결정해야 하기 때문이다.[16] X-gal을 포함한 LB 배지에서 흰색 집락이 파란색 음영으로 바뀌는 것은 약 20–100 β-갈락토시다제 단위에 해당하며, 테트라졸륨 락토스 및 MacConkey 락토스 배지는 100–1000 단위 범위를 가진다. 이 범위의 높고 낮은 부분에서 각각 가장 민감하다.[16] MacConkey 락토스 및 테트라졸륨 락토스 배지는 모두 락토스 분해 산물에 의존하므로, ''lacZ'' 유전자와 ''lacY'' 유전자 모두의 존재가 필요하다. 따라서 ''lacZ'' 유전자만 포함하는 많은 ''lac'' 융합 기술은 X-gal 배지[16] 또는 ONPG 액체 배지에 적합하다.[24]
참조
[1]
서적
An Introduction to Genetic Analysis
Freeman, W.H. & Company
2015
[2]
웹사이트
Genetics, Inducible Operon
http://www.ncbi.nlm.[...]
StatPearls Publishing
2024-06-20
[3]
웹사이트
Prokaryotic Gene Expression
https://www.ndsu.edu[...]
2017-05-19
[4]
웹사이트
Prokaryotic Gene Expression
https://www.ndsu.edu[...]
2017-05-19
[5]
웹사이트
2.6: The lac Operon; CAP site; DNA footprinting
https://bio.libretex[...]
2024-06-20
[6]
논문
Transcription activation by catabolite activator protein (CAP)
[7]
논문
Transcription and translation initiation frequencies of the Escherichia coli ''lac'' operon
1977-07
[8]
논문
Mechanism of CRP-cAMP Activation of ''lac'' Operon Transcription Initiation Activation of the P1 Promoter
1984-12
[9]
논문
Carbon catabolite repression in bacteria: many ways to make the most out of nutrients
2008-08
[10]
논문
The three operators of the ''lac'' operon cooperate in repression
[11]
서적
Modern Genetic Analysis
https://archive.org/[...]
W. H. Freeman
1999
[12]
논문
Non-specific DNA binding of genome regulating proteins as a biological control mechanism: I. The ''lac'' operon: equilibrium aspects
1974-12
[13]
논문
The effect of the lacY gene on the induction of IPTG inducible promoters, studied in ''Escherichia coli'' and ''Pseudomonas fluorescens''
http://link.springer[...]
1998-06
[14]
논문
''lac'' operon induction in Escherichia coli: Systematic comparison of IPTG and TMG induction and influence of the transacetylase LacA
2012-01
[15]
웹사이트
ONPG (β-Galactosidase) test
http://rothlab.ucdav[...]
SAPS
2007-10-25
[16]
논문
A bacterial two-hybrid selection system for studying protein–DNA and protein–protein interactions
[17]
웹사이트
Milestone 2 – A visionary pair : Nature Milestones in gene expression
http://www.nature.co[...]
2015-12-27
[18]
서적
The ''lac'' Operon, a Short History of a Genetic Paradigm
Walter de Gruyter
[19]
서적
Transcriptional Regulation
https://archive.org/[...]
Cold Spring Harbor Laboratory Press
[20]
논문
Genetic regulatory mechanisms in the synthesis of proteins
1961-06
[21]
논문
Transcriptional regulation by cyclic AMP
1997
[22]
논문
Cyclic AMP in prokaryotes.
1992-03
[23]
논문
Impact of the solvent capacity constraint on E. coli metabolism
[24]
웹사이트
Induction of the ''lac'' operon in E. coli
http://www.saps.org.[...]
SAPS
[25]
문서
라크토스의 정의
[26]
문서
알로스테릭 조절
[27]
문서
아보티브 전사 산물
[28]
문서
CAP와 CRP
[29]
서적
Biology 8th edition
BenjaminCummings
2007-11-27
[30]
서적
HIGH TOP 생명과학2
두산동아
2016-01-12
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

