바베스열원충속
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
바베스열원충속은 척추동물을 감염시키는 원생동물 기생충의 한 속으로, 주로 가축 포유류와 조류에 감염되며 드물게 인간에게도 감염된다. 텍사스 소 열병, 진드기 열병 등을 유발하며, 인간에게 발생하는 질병을 바베시아증이라고 한다. 바베스열원충속에는 텍사스바베스열원충, 쇠바베스열원충 등 다양한 종이 속해 있다. 1888년 빅토르 바베스가 이 질병의 원인체를 처음 확인했고, 1893년 테오발드 스미스와 프레드 킬본이 진드기를 전파 매개체로 확인했다. 감염은 진드기, 수혈, 선천성 전파를 통해 이루어지며, 기후와 계절에 따라 전파율이 달라진다. 치료는 약물과 수혈 교환을 통해 이루어지며, 예방을 위해서는 진드기 노출을 피하는 것이 중요하다.
더 읽어볼만한 페이지
- 진드기 매개 질병 - 일본홍반열
일본홍반열은 일본홍반열 리케차에 의해 발생하는 감염 질환으로, 숲에 서식하는 진드기에 물려 감염되며 발열, 발진, 진드기 물린 자국 등의 증상을 보이고, 백신이 없어 진드기 물림 예방이 중요하며 항생제 치료로 증상을 완화할 수 있다. - 진드기 매개 질병 - 야토병
야토병은 야토병균에 의해 발생하는 인수공통감염병으로, 절지동물 매개, 감염 동물 접촉, 오염 물질 섭취 등으로 전파되며, 다양한 임상 형태와 증상을 보이고, 항생제 치료로 회복 가능하지만 생물학 무기로 개발된 사례도 있는 북반구 질병이다. - 정단복합체충류 - 톡소포자충
톡소포자충은 고양이과 동물을 종숙주로, 사람을 포함한 다양한 동물들을 중간숙주로 삼는 세포 내 기생 원생생물로, 덜 익힌 고기 섭취나 고양이 분변 등을 통해 사람에게 감염될 수 있으며, 면역력이 약한 사람에게는 심각한 질병을 일으킬 수 있고 숙주의 행동 변화와도 관련이 있다는 연구가 진행 중이다. - 정단복합체충류 - 말라리아원충
말라리아원충은 아피콤플렉사문에 속하는 진핵생물로서, 적혈구 내 무성 생식, 헤모조인 생성, 곤충과 척추 숙주를 오가는 복잡한 생활사, 다양한 종과 아속을 가지며, 인간에게 말라리아를 유발하는 병원체이다.
| 바베스열원충속 - [생물]에 관한 문서 | |
|---|---|
| 개요 | |
 | |
| 학명 | Babesia |
| 명명자 | Starcovici, 1893 |
| 분류 | |
| 하위 분류군 계급 | 종 |
| 하위 분류군 | Babesia annae Babesia ardeae Babesia behnkei Babesia bennetti Babesia bicornis Babesia bigemina Babesia bovis Babesia caballi Babesia canis Babesia canis canis Babesia canis rossi Babesia canis vogeli Babesia capreoli Babesia crassa Babesia divergens Babesia gibsoni Babesia hongkongensis Babesia kiwiensis Babesia lohae Babesia mackerrasorum Babesia major Babesia motasi Babesia muratovi Babesia occultans Babesia odocoilei Babesia orientalis Babesia ovata Babesia ovis Babesia pecorum Babesia peircei Babesia poelea Babesia ugwidiensis Babesia uriae Babesia venatorum Babesia vesperuginis Babesia vitalii B. microti ("Archaeopiroplasmida" 그룹) Babesia felis Babesia leo Babesia microti Babesia rodhaini Babesia vulpes 서부 미국 ("Prototheilerids") 그룹 Babesia conradae Babesia duncani Babesia lengau Babesia sp. 'North Carolina dog' |
| 과거 명칭 | |
| 이전 명칭 | Nuttallia |
2. 분류
바베스열원충속은 원생생물의 일종으로, 피로플라스마목에 속하는 기생충이다. 이들은 주로 가축 포유류와 조류를 감염시키지만, 드물게 사람에게도 감염을 일으킨다.
바베스열원충속의 하위 종은 다음과 같다.
| 종 |
|---|
| 텍사스바베스열원충 (Babesia bigemina) |
| 쇠바베스열원충 (Babesia bovis) |
| Babesia canis |
| Babesia cati |
| 분기바베스열원충 (Babesia divergens) |
| Babesia duncani |
| Babesia felis |
| 개바베스열원충 (Babesia gibsoni) |
| Babesia herpailuri |
| Babesia jakimovi |
| Babesia major |
| 쥐바베스열원충 (Babesia microti) |
| Babesia ovate |
| Babesia pantherae |
''B. microti''가 유발하는 질병은 텍사스 소 열병, 적뇨열, 진드기 열병, 낸터킷 열병 등으로 불린다.[8] 사람에게서 발생하는 바베시아증은 피로플라스마증이라고도 한다.[7]
쥐바베스열원충(''Babesia microti'')은 과거 바베스열원충속으로 분류되었으나, 현재는 다른 속으로 분류된다. 역사적인 분류 오류로 인해 ''Nuttallia'' 등 여러 이름으로 불렸으며,[4] 2006년에는 ''테일레리아 미크로티''(''Theileria microti'')로 이름이 변경되었다. 2012년 DNA 염기서열 분석 결과, 이 종은 ''바베시아''나 ''테일레리아'' 어느 쪽에도 속하지 않고 별도의 속에 속하는 것으로 밝혀졌다.[9] 또 다른 "서부" 그룹 또한 핵심 ''바베시아''와는 별개이다.
조류의 바베스열원충 종은 고리 모양, 아메바 모양, 부채꼴 또는 십자 모양의 사분열체 분열소체를 가지는 것이 특징이다. 발달 중인 기생충은 적혈구에서만 관찰된다.[10]
2. 1. 하위 종
- 텍사스바베스열원충 (''Babesia bigemina'')
- 쇠바베스열원충 (''Babesia bovis'')
- ''Babesia canis''
- ''Babesia cati''
- 분기바베스열원충 (''Babesia divergens'')
- ''Babesia duncani''
- ''Babesia felis''
- 개바베스열원충 (''Babesia gibsoni'')
- ''Babesia herpailuri''
- ''Babesia jakimovi''
- ''Babesia major''
- 쥐바베스열원충 (''Babesia microti'')
- ''Babesia ovate''
- ''Babesia pantherae''
3. 역사
수세기 동안 이 동물 질병은 야생 및 가축, 특히 소에게 심각한 질병으로 알려져 있었다. 1888년, 루마니아의 빅토르 바베스는 이 질병의 원인체를 처음으로 확인하고, 자신이 명명한 세균인 ''Haematococcus bovis''에 의한 것으로 여겼다. 그는 소와 양에게서만 나타나는 심각한 용혈성 질환의 징후를 묘사하여 이 질병을 기록했다.[8][11]
1893년, 미국의 테오발드 스미스와 프레드 킬본은 바베스가 묘사한 것과 동일한 질병인 텍사스 소 열병의 원인으로 이 기생충을 확인했다. 그들은 또한 진드기를 전파 매개체로 확인했는데, 이는 절지동물이 질병 매개체로 작용한다는 개념을 처음으로 제시한 발견이었다.[12]
이 질병은 인간이 아닌 포유류에게만 영향을 미치는 것으로 여겨졌지만, 1957년에 인간에게서 처음으로 바베시아증 사례가 발견되었다.[7] 1969년까지 바베시아증으로 진단받은 모든 사람은 비장 절제술을 받은 상태였으나, 1969년에 비장이 있는 사람에게서 바베시아증 첫 사례가 진단되면서, 이 기생충이 누구에게나 잠재적인 병원체라는 것이 입증되었다.[13]
4. 유전학
''바베스열원충속'' 종은 숙주 특이성을 나타내어, 각기 다른 종류의 척추동물을 감염시키는 다양한 아종이 출현할 수 있게 한다.[14] B. bovis와 Babesia bigemina는 열대 환경에서 소를 감염시키는 것을 선호하지만, 흰꼬리사슴과 같은 다른 동물도 감염시킬 수 있다.[14] 이 유기체는 숙주 특이성을 통해 전파 효율을 높이지만, 여전히 다양한 숙주를 감염시킬 수 있는 능력을 가지고 있다.[14] 이는 돌연변이와 자연 선택을 통해 달성되며, 서로 다른 환경에서 개별 원생동물은 돌연변이를 일으켜 적합도가 증가하면 개체 수가 증가할 수 있다. 이러한 특이성은 ''바베스열원충속'' 종이 큰 유전적 다양성을 갖는 이유를 설명한다.[14]
4. 1. 유전체학
''바베스열원충''의 게놈 서열 분석 결과, 이 종은 ''바베시아'' 또는 ''테일레리아''에 속하지 않고 별도의 속에 속한다는 것이 밝혀졌다.[9] 미토콘드리아 게놈은 서열 분석된 다른 아피콤플렉사 미토콘드리아 게놈과 같이 선형인 것으로 알려져 있으며, 처음에는 원형으로 보고되었다.[15]개 피로플라스마의 부분적인 RNA 시퀀싱을 통해 다수의 추가 종이 확인되었다.
5. 생활사
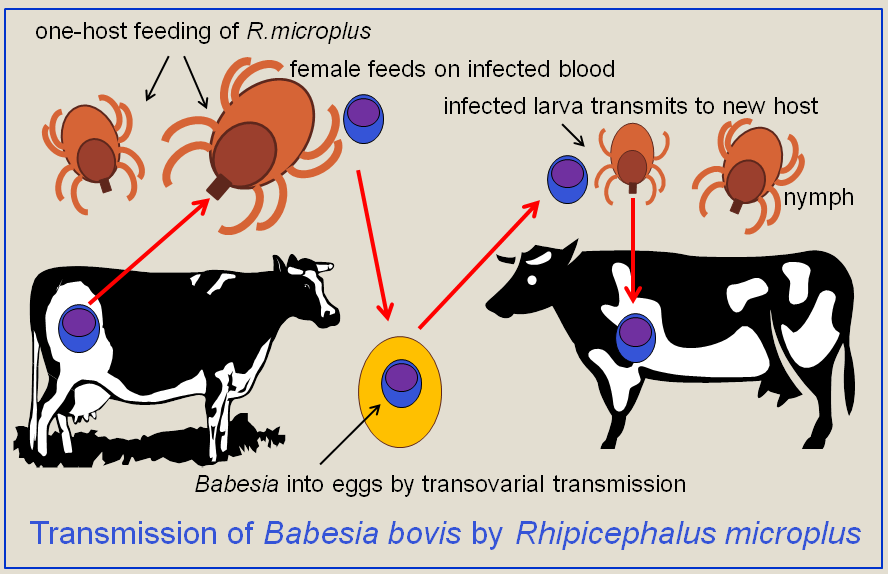
''바베스열원충속'' 기생충의 일반적인 특징을 보이는 ''B. microti''의 생활사는 숙주인 설치류 또는 사슴에서 생물학적 단계를 거쳐야 한다. 이러한 숙주 사이에서는 진드기과 참진드기과의 진드기에 의해 전파된다. 먼저, 종숙주인 진드기가 혈액을 섭취하기 위해 부착될 때 생식모세포를 섭취하면서 감염된다. 또한 혈액을 섭취할 때 중간 숙주(예: 소)에게 ''바베시아''를 주입한다. ''바베시아''가 동물의 적혈구로 들어가면 이를 분열모충이라고 한다. 적혈구 내에서 원충은 순환하며 영양체 환으로 발달한다. 영양체는 분열소체로 변태하며, 이는 몰타 십자 형태를 띤 사분체 구조를 갖는다.[16] 영양체와 분열소체의 증식은 숙주 적혈구를 파열시켜 감염성 기생충체인 충체를 방출시키고, 이는 혈액 전체로 원충을 빠르게 확산시킨다.[7] 점점 더 많은 영양체를 생산하기보다는, 일부 분열소체는 생식세포를 생성한다. 배우자는 진드기 장에서 수정되어 침샘에서 분열모충으로 발달한다. 이들은 감염된 진드기가 중간 숙주를 물 때 주입하는 분열모충이다.
우발적 숙주인 인간에서도 기생충에서 발생하는 위상 변화는 생물학적 숙주와 동일하다. ''바베시아''는 영양체 단계에서 진단할 수 있으며, 진드기 매개체, 수혈, 또는 선천성 전파(감염된 어머니가 아기에게)를 통해 인간에서 인간으로 전파될 수도 있다.[17][5]
''바베시아'' 속은 진드기가 물 때 진드기의 타액을 통해 전파된다. 이미 약충 단계에서 진드기는 혈액을 섭취하기 위해 피부를 문다. 진드기는 제거하지 않으면 3~4일 동안 붙어 있으며, 더 긴 기간 동안 섭식할수록 기생충 획득 가능성이 더 높다. 기생충은 진드기가 다양한 발달 단계를 거치면서 탈피하는 동안 진드기 안에서 생존할 수 있으며, 이로 인해 모든 진드기 단계가 잠재적으로 감염성을 갖게 된다. 일부 ''바베시아'' 종은 암컷 진드기에서 자손에게 전파될 수 있으며, 섭식을 위해 타액선으로 이동하기 전에 전파된다.[7] 사람에게 가장 흔한 종인 ''B. microti''는 경난소 전파되지 않는 것으로 나타났다.[5]
''바베시아''를 전파하고 많은 질병을 유발하는 가축 진드기에는 매우 널리 퍼진 소 진드기인 ''Rhipicephalus'' (''Boophilus'') ''microplus''와 ''R.(B.) decoloratus''가 있다. 이 진드기들은 소에 대한 엄격한 단일 숙주 섭식 주기를 가지고 있으므로, ''바베시아''는 경난소 경로를 통해서만 전파될 수 있다.
아메리카 대륙에서 ''Ixodes scapularis''는 가장 흔한 매개체이다. 일반적으로 사슴 진드기로 알려진 이 단단한 진드기는 라임병과 같은 다른 진드기 관련 질환의 매개체이기도 하다. 많은 ''바베시아'' 종은 비인간 포유류 숙주, 가장 흔하게 소, 말, 양만 감염시킨다. ''B. microti''와 ''B. divergens''는 사람에게서 두 개의 주요 병원성 종이다. 이들의 저장소는 흰발쥐(''Peromyscus leucopus''), ''Microtus'' 속의 밭쥐, 그리고 흰꼬리사슴 (''Odocoileus virginianus'')으로 추정된다.[21] 이러한 삼림 종은 질병을 보유하고 있는 것으로 알려져 있지만, 완전한 저장소 능력이 아직 증명되지 않았기 때문에 저장소로 추정된다.[22]
사람 간의 전파 사례의 대부분은 진드기 매개체로 인한 것으로 여겨진다. 2003년 기준으로 질병통제예방센터(CDC)는 농축 적혈구 (PRBC) 수혈로 인해 감염된 40건 이상의 바베시아증 사례와 장기 이식으로 인해 기록된 2건의 감염을 인정했다. 감염을 유발하는 PRBC 수혈은 혈액 공여자를 ''B. microti'' 항체 검사를 통해 확인했다.[23]
전파는 또한 선천성 전파 (감염된 산모에서 아기에게)를 통해 가능하다. 증상이 나타나지 않을 수 있으므로 많은 여성들이 임신 중에 감염된 사실을 모를 수 있으며, 따라서 선천성 전파율 측정은 현재 알 수 없다.[17]
현재, 조류 ''바베시아''에 대한 매개체는 확인되지 않았지만, 진드기로 추정된다.[10] ''바베시아'' 종은 전파 주기를 유지하기 위해 유능한 척추동물 및 무척추동물 숙주가 필요하다.[24]
''바베시아'' 종은 적혈구의 포자소체 단계에서 침투한다. 적혈구 내에서 원생동물은 순환하며 영양체 고리로 발달한다. 영양체는 분열하여 메로조이트로 변하는데, 메로조이트는 몰타 십자 형태의 사분체 구조를 갖는다.[16] 얇은 혈액 도말의 김자 염색에서 보이는 이러한 사분체 형태는 ''바베시아'' 고유의 특징으로, 말라리아를 유발하는 유사한 형태의 원생동물인 ''열대열 말라리아 원충''과 구별된다. 영양체와 메로조이트의 성장은 숙주 적혈구를 파열시켜 감염성 기생체인 버미큘을 방출하며, 이는 혈액 전체로 원생동물을 빠르게 확산시킨다.[7]
''바베시아''의 특정 형태를 혈액 도말에서 주의 깊게 관찰하는 것이 중요한데, 이는 말라리아 기생충인 ''열대열 말라리아 원충''과 매우 유사하기 때문이다. 이로 인해 바베시아증 환자들이 오진되는 경우가 많다. ''바베시아''를 구별하는 몇 가지 특징으로는 다양한 모양과 크기의 원생동물, 공포를 포함할 가능성, 색소 생성의 부재 등이 있다. 적혈구 내에서 사분체 형태로 나타나는 영양체 또한 ''바베시아''를 나타낸다.
간접 형광 항체 (IFA) 검사를 통해 진단을 내려야 하는데, 이는 염색된 혈액 도말보다 훨씬 높은 특이도를 갖는다.[5]
6. 계절성
차가운 날씨는 바베스열원충의 전파를 완전히 방해한다.[18] 진드기 매개 질병의 출현은 기후 변화와 일치하는 것으로 밝혀졌지만,[19] 기후 변화와 진드기 매개 질병 발생률 사이의 상관관계는 주요 요인으로 간주될 만큼 강하지 않다.[19]
높은 습도와 강우량은 진드기가 옮기는 ''바베시아''를 수용하기 좋은 환경이다.[20] 이는 메갈라야의 산악 지역에서 소의 ''B. bigemina'' 감염이 증가한 이유를 설명할 수 있다.[20] ''B. microplus''의 수명과 세대 수는 유충의 수명 연장 및 연간 세대 수 증가와 상관관계가 있다.[20] 반면, 따뜻하고 건조한 날씨는 진드기 내 ''바베시아''의 생명 주기를 방해한다.[18] 따뜻하고 습한 날씨는 감염 강도를 증가시키는데, 이는 상대적으로 유동적인 환경으로 인해 개체수가 번성하고 물과 영양소에 더 쉽게 접근할 수 있기 때문이다.[18]
7. 전파
빅토르 바베스가 루마니아에서 처음으로 이 질병의 원인체를 확인한 1888년 이후, 수세기 동안 이 동물 질병은 야생 및 가축, 특히 소에게 심각한 질병으로 알려져 있었다. 그는 소와 양에게서만 나타나는 심각한 용혈성 질환의 징후를 묘사하여 이 질병을 기록했다.[8][11] 1893년, 미국의 테오발드 스미스와 프레드 킬본은 바베스가 묘사한 것과 동일한 질병인 텍사스 소 열병의 원인으로 이 기생충을 확인했다. 그들은 또한 진드기를 전파 매개체로 확인했는데, 이는 절지동물이 질병 매개체로 작용한다는 개념을 처음으로 제시한 발견이었다.[12]
바베스열원충속 기생충의 일반적인 특징을 보이는 ''B. microti''의 생활사는 숙주인 설치류 또는 사슴에서 생물학적 단계를 거쳐야 한다. 이러한 숙주 사이에서는 진드기과 참진드기과의 진드기에 의해 전파된다. 먼저, 종숙주인 진드기가 혈액을 섭취하기 위해 부착될 때 생식모세포를 섭취하면서 감염된다. 또한 혈액을 섭취할 때 중간 숙주(예: 소)에게 ''바베시아''를 주입한다. ''바베시아''가 동물의 적혈구로 들어가면 이를 분열모충이라고 한다. 적혈구 내에서 원충은 순환하며 영양체 환으로 발달한다. 영양체는 분열소체로 변태하며, 이는 몰타 십자 형태를 띤 사분체 구조를 갖는다.[16] 영양체와 분열소체의 증식은 숙주 적혈구를 파열시켜 감염성 기생충체인 충체를 방출시키고, 이는 혈액 전체로 원충을 빠르게 확산시킨다.[7] 일부 분열소체는 생식세포를 생성한다. 배우자는 진드기 장에서 수정되어 침샘에서 분열모충으로 발달한다. 이들은 감염된 진드기가 중간 숙주를 물 때 주입하는 분열모충이다.
우발적 숙주인 인간에서도 기생충에서 발생하는 위상 변화는 생물학적 숙주와 동일하다. ''바베시아''는 영양체 단계에서 진단할 수 있으며, 진드기 매개체, 수혈, 또는 선천성 전파(감염된 어머니가 아기에게)를 통해 인간에서 인간으로 전파될 수도 있다.[17][5]
차가운 날씨는 전파를 완전히 방해한다.[18] 높은 습도와 강우량은 진드기가 옮기는 ''바베시아''를 수용한다.[20] 따뜻하고 건조한 날씨는 진드기 내 ''바베시아''의 생명 주기를 방해한다.[18] 따뜻하고 습한 날씨는 감염 강도를 증가시키는데, 이는 상대적으로 유동적인 환경으로 인해 개체수가 번성할 수 있고, 물과 영양소를 더 쉽게 접근할 수 있게 하기 때문이다.[18]
''바베시아'' 속은 진드기가 물 때 진드기의 타액을 통해 전파된다. 약충 단계에서 진드기는 혈액을 섭취하기 위해 피부를 문다. 진드기는 제거하지 않으면 3~4일 동안 붙어 있으며, 더 긴 기간 동안 섭식할수록 기생충 획득 가능성이 더 높다. 기생충은 진드기가 다양한 발달 단계를 거치면서 탈피하는 동안 진드기 안에서 생존할 수 있으며, 이로 인해 모든 진드기 단계가 잠재적으로 감염성을 갖게 된다. 일부 ''바베시아'' 종은 암컷 진드기에서 자손에게 전파될 수 있으며, 섭식을 위해 타액선으로 이동하기 전에 전파된다.[7] 사람에게 가장 흔한 종인 ''B. microti''는 경난소 전파되지 않는 것으로 나타났다.[5]
''바베시아''를 전파하고 많은 질병을 유발하는 가축 진드기에는 매우 널리 퍼진 소 진드기인 ''Rhipicephalus'' (''Boophilus'') ''microplus''와 ''R.(B.) decoloratus''가 있다. 이 진드기들은 소에 대한 엄격한 단일 숙주 섭식 주기를 가지고 있으므로, ''바베시아''는 경난소 경로를 통해서만 전파될 수 있다.
아메리카 대륙에서 ''Ixodes scapularis''는 가장 흔한 매개체이다. 일반적으로 사슴 진드기로 알려진 이 단단한 진드기는 라임병과 같은 다른 진드기 관련 질환의 매개체이기도 하다. 많은 ''바베시아'' 종은 비인간 포유류 숙주, 가장 흔하게 소, 말, 양만 감염시킨다. ''B. microti''와 ''B. divergens''는 사람에게서 두 개의 주요 병원성 종이다. 이들의 저장소는 흰발쥐(''Peromyscus leucopus''), ''Microtus'' 속의 밭쥐, 그리고 흰꼬리사슴 (''Odocoileus virginianus'')으로 추정된다.[21]
사람 간의 전파 사례의 대부분은 진드기 매개체로 인한 것으로 여겨진다. 2003년 기준으로 질병통제예방센터(CDC)는 농축 적혈구 (PRBC) 수혈로 인해 감염된 40건 이상의 바베시아증 사례와 장기 이식으로 인해 기록된 2건의 감염을 인정했다. 감염을 유발하는 PRBC 수혈은 혈액 공여자를 ''B. microti'' 항체 검사를 통해 확인했다.[23]
전파는 또한 선천성 전파 (감염된 산모에서 아기에게)를 통해 가능하다. 증상이 나타나지 않을 수 있으므로 많은 여성들이 임신 중에 감염된 사실을 모를 수 있으며, 따라서 선천성 전파율 측정은 현재 알 수 없다.[17]
현재, 조류 ''바베시아''에 대한 매개체는 확인되지 않았지만, 진드기로 추정된다.[10] ''바베시아'' 종은 전파 주기를 유지하기 위해 유능한 척추동물 및 무척추동물 숙주가 필요하다.[24]
8. 역학
1888년, 빅토르 바베스는 루마니아에서 소와 양에게서만 나타나는 심각한 용혈성 질환의 원인체를 처음 확인하고 ''Haematococcus bovis''라고 명명했다.[8][11] 1893년, 미국의 테오발드 스미스와 프레드 킬본은 텍사스 소 열병의 원인으로 이 기생충을 확인하고, 진드기를 전파 매개체로 지목했는데, 이는 절지동물이 질병 매개체로 작용한다는 개념을 처음 제시한 발견이었다.[12]
1957년에 인간에게서 처음으로 바베시아증 사례가 발견되었고,[7] 1969년에는 비장이 있는 사람에게서도 바베시아증 사례가 진단되어 누구에게나 잠재적인 병원체라는 것이 입증되었다.[13]
''바베시아'' 속은 진드기가 물 때 진드기의 타액을 통해 전파된다. 약충 단계의 진드기는 혈액 섭취를 위해 피부를 물며, 제거하지 않으면 3~4일 동안 붙어 있는데, 섭식 기간이 길수록 기생충 획득 가능성이 높다. 일부 ''바베시아'' 종은 암컷 진드기에서 자손에게 전파될 수 있다.[7] 사람에게 가장 흔한 종인 ''B. microti''는 경난소 전파되지 않는 것으로 나타났다.[5]
''바베시아''를 전파하는 가축 진드기에는 소 진드기인 ''Rhipicephalus (Boophilus) microplus''와 ''R.(B.) decoloratus''가 있다. 아메리카 대륙에서 ''Ixodes scapularis''는 가장 흔한 매개체이며, 라임병과 같은 다른 진드기 관련 질환의 매개체이기도 하다.
많은 ''바베시아'' 종은 비인간 포유류 숙주(소, 말, 양)만 감염시킨다. ''B. microti''와 ''B. divergens''는 사람에게서 두 개의 주요 병원성 종이며, 저장소는 흰발쥐(''Peromyscus leucopus''), 밭쥐류(Microtus), 흰꼬리사슴 (''Odocoileus virginianus'')으로 추정된다.[21]
사람 간의 전파 사례 대부분은 진드기 매개체로 인한 것이지만, 2003년 질병통제예방센터(CDC)는 농축 적혈구 (PRBC) 수혈로 인한 감염 40건 이상, 장기 이식으로 인한 감염 2건을 인정했다. PRBC 수혈을 통한 ''바베시아'' 전파 발생은 혈액 공여 선별 검사에 대한 표준 조치를 강화하도록 압력을 가하고 있다. 전파는 선천성 전파 (감염된 산모에서 아기에게)를 통해서도 가능하다.[17]
조류 ''바베시아''의 매개체는 확인되지 않았지만, 진드기로 추정된다.[10] ''바베시아'' 종은 전파 주기를 유지하기 위해 유능한 척추동물 및 무척추동물 숙주가 필요하다.[24]
인간을 감염시키는 종 중에서는, ''B. microti''가 아메리카 대륙에서 가장 흔하며, ''B. divergens''는 유럽에서 주로 발견된다. 풍토병 발생 지역은 미국 북동부의 삼림 지역과 유럽의 온대 지역을 포함한다.[31] ''B. microti''의 진드기 매개체인 참진드기과(Ixodidae)는 보렐리아 부르그도르페리(라임병의 원인균)도 전파한다. 라임병과 바베스열원충증이 모두 풍토병으로 발생되는 지역에서는 라임병의 전파가 우세하다.[7] 말라리아 유행 지역에서의 바베스열원충증 유병률은 말라리아로 오진될 가능성 때문에 아직 알려져 있지 않다.[30]
바베스열원충증의 유병률은 주로 진드기 활동이 높은 풍토병 지역에서 5월부터 9월 사이에 기록된다.[31]
조류 ''바베시아''에는 15종이 포함되어 있으며, 해양 숙주에서는 4종의 ''바베시아''가 보고되었다.
- ''B. poelea''는 중태평양 존스턴 환초의 갈색 부비(''Sula leucogaster'')에서 처음 기술되었고,[25] 데스노프 섬(Desnoeufs Island), 아미란테 제도(Amirantes), 세이셸의 얼굴 바다오리(''Sula dactylatra melanops'')에서 보고되었다.[26]
- ''B. peircei''는 남아프리카의 검은발가마우지(''Sphenicus demersus'')와 호주 남부의 작은 펭귄(''Eduyptula minor'')에서 관찰되었다.[27][28]
- ''B. bennetti''는 스페인 해안의 베니도름 섬에서 발견된 노란발갈매기(''Larus cachinnans'')와 관련이 있다.[28]
- ''B. uriae''는 캘리포니아의 바다쇠오리에서 발견되었다.
유럽에서는 ''바베시아'' 속의 적혈구 내 원생동물 감염(적혈구 내 원생동물)에 의해 발생하는 인간 바베스열원충증 사례가 약 40건 보고되었다.[29]
9. 질병
수세기 동안 이 동물 질병은 야생 및 가축, 특히 소에게 심각한 질병으로 알려져 있었다. 1888년, 빅토르 바베스는 루마니아에서 처음으로 이 질병의 원인체를 확인하고, 이를 자신이 명명한 세균인 ''Haematococcus bovis''에 의한 것으로 여겼다. 그는 소와 양에게서만 나타나는 심각한 용혈성 질환의 징후를 묘사하여 이 질병을 기록했다.[8][11]
1893년, 미국의 테오발드 스미스와 프레드 킬본은 바베스가 묘사한 것과 동일한 질병인 텍사스 소 열병의 원인으로 이 기생충을 확인했다. 그들은 또한 진드기를 전파 매개체로 확인했는데, 이는 절지동물이 질병 매개체로 작용한다는 개념을 처음으로 제시한 발견이었다.[12]
이 질병은 인간이 아닌 포유류에게만 영향을 미치는 것으로 여겨졌지만, 1957년, 인간에게서 처음으로 바베시아증 사례가 발견되었다.[7] 1969년까지 바베시아증으로 진단받은 모든 사람은 비장 절제술을 받은 상태였으나, 1969년에 비장이 있는 사람에게서 바베시아증 첫 사례가 진단되면서, 이 기생충이 누구에게나 잠재적인 병원체라는 것이 입증되었다.[13]
''바베시아'' 종은 숙주 특이성을 나타내어, 각기 다른 종류의 척추동물을 감염시키는 다양한 아종의 ''바베시아''가 출현할 수 있게 한다.[14] ''B. bovis''와 ''Babesia bigemina''는 열대 환경에서 소를 감염시키는 것을 선호하지만, 흰꼬리사슴과 같은 다른 동물도 감염시킬 수 있다.[14] 따라서 이 유기체는 숙주 특이성을 나타내어 전파 효율을 높일 수 있는 능력을 가지고 있지만, 여전히 다양한 숙주를 감염시킬 수 있다.[14] 이는 돌연변이와 자연 선택을 통해 달성된다. 서로 다른 환경에서 개별 원생동물은 돌연변이를 일으킬 수 있으며, 이는 원생동물의 적합도를 증가시키면 개체 수를 증가시킬 수 있다. 이러한 특이성은 ''바베시아'' 종이 이토록 큰 유전적 다양성을 갖는 이유를 설명한다.[14]
''바베시아''는 숙주의 시스템 내에서 장기적으로 이기적으로 생존한다. 숙주는 기생충 침입으로부터 어떠한 이점도 얻지 못하고 고통만 겪는다. 이는 기생충이 숙주가 제공하는 모든 자원을 활용하여 개체 수를 늘리고 전파율을 높일 수 있게 한다.[14] 지나치게 치명적인 감염은 숙주의 죽음을 초래하고 기생충은 확산될 수 없게 되는데, 이는 진화론적 관점에서 손실이다.[14] 서로 다른 종의 ''바베시아''는 숙주의 면역 체계가 가하는 스트레스를 견딜 수 있다. 감염은 일반적으로 선천 면역 체계를 자극하며, 체액성 면역 체계를 자극하지 않는다.[14] 이는 감염을 제어하지만, 기생충을 제거하지 못하고 지속되게 한다.[14]
바베스열원충속 기생충의 일반적인 특징을 보이는 ''B. microti''의 생활사는 숙주인 설치류 또는 사슴에서 생물학적 단계를 거쳐야 한다. 이러한 숙주 사이에서는 진드기과 참진드기과의 진드기에 의해 전파된다. 먼저, 종숙주인 진드기가 혈액을 섭취하기 위해 부착될 때 생식모세포를 섭취하면서 감염된다. 또한 혈액을 섭취할 때 중간 숙주(예: 소)에게 ''바베시아''를 주입한다. ''바베시아''가 동물의 적혈구로 들어가면 이를 분열모충이라고 한다. 적혈구 내에서 원충은 순환하며 영양체 환으로 발달한다. 영양체는 분열소체로 변태하며, 이는 몰타 십자 형태를 띤 사분체 구조를 갖는다.[16] 영양체와 분열소체의 증식은 숙주 적혈구를 파열시켜 감염성 기생충체인 충체를 방출시키고, 이는 혈액 전체로 원충을 빠르게 확산시킨다.[7] 점점 더 많은 영양체를 생산하기보다는, 일부 분열소체는 생식세포를 생성한다. 배우자는 진드기 장에서 수정되어 침샘에서 분열모충으로 발달한다. 이들은 감염된 진드기가 중간 숙주를 물 때 주입하는 분열모충이다.
우발적 숙주인 인간에서도 기생충에서 발생하는 위상 변화는 생물학적 숙주와 동일하다. ''바베시아''는 영양체 단계에서 진단할 수 있으며, 진드기 매개체, 수혈, 또는 선천성 전파(감염된 어머니가 아기에게)를 통해 인간에서 인간으로 전파될 수도 있다.[17][5]
인간을 감염시키는 종 중에서는, ''B. microti''가 아메리카 대륙에서 가장 흔하며, ''B. divergens''는 유럽에서 주로 발견되는 균주이다. 풍토병 발생 지역은 진드기 서식지, 예를 들어 미국 북동부의 삼림 지역과 유럽의 온대 지역을 포함한다.[31] ''B. microti''의 진드기 매개체인 참진드기과(Ixodidae)는 또한 더 잘 알려진 보렐리아 부르그도르페리(Borrelia burgdorferi), 즉 라임병의 원인균도 전파한다. 명확하지 않은 이유로, 라임병과 바베스열원충증이 모두 풍토병으로 발생되는 지역에서는 라임병의 전파가 우세하며, 해당 지역에서 더 흔하게 나타난다.[7] 말라리아 유행 지역에서의 바베스열원충증 유병률은 말라리아로 오진될 가능성 때문에 아직 알려져 있지 않다.[30] 이 질병은 많은 무증상 환자를 발생시키기 때문에, 많은 인구 집단이 질병에 대한 문서화 없이 높은 혈청 유병률을 가질 수 있다. 예를 들어, 로드아일랜드와 낸터킷에서는 혈청 유병률이 20–25%로 측정되었다.[7] 바베스열원충증의 유병률은 주로 진드기 활동이 높은 풍토병 지역에서 5월부터 9월 사이에 기록된다.[31]
조류 ''바베시아''에는 15종이 포함되어 있으며, 해양 숙주에서는 4종의 ''바베시아''가 보고되었다. ''B. poelea''는 중태평양 존스턴 환초의 갈색 부비(''Sula leucogaster'')에서 처음 기술되었다.[25] ''B. poelea''는 데스노프 섬(Desnoeufs Island), 아미란테 제도(Amirantes), 세이셸의 얼굴 바다오리(''Sula dactylatra melanops'')에서 보고되었다.[26] ''B. peircei''는 남아프리카의 검은발가마우지(''Sphenicus demersus'')와 호주 남부의 작은 펭귄(''Eduyptula minor'')의 두 종의 펭귄에서 관찰되었다.[27][28] ''B. bennetti''는 스페인 해안의 베니도름 섬에서 발견된 노란발갈매기(''Larus cachinnans'')와 관련이 있다.[28] ''B. uriae''는 캘리포니아의 바다쇠오리에서 발견되었다.
유럽에서는 ''바베시아'' 속의 적혈구 내 원생동물 감염(적혈구 내 원생동물)에 의해 발생하는 인간 바베스열원충증 사례가 약 40건 보고되었다.[29] 소 바베스열원충증은 ''B. 보비스''(Babesia bovis)에 의해 발생하며, 전 세계 소 산업에 중요한 제약 요인으로 작용한다.
''B. microti''에 감염된 징후는 일반적으로 감염된 진드기에 물린 후 1~8주 후에 나타난다.[31] ''B. divergens'' 감염의 잠복기는 더 짧아 보통 1~3주 정도이다.[30] ''B. microti'' 감염의 심각성은 다양하다. 성인의 경우 25%, 어린이의 경우 50%에서 질병은 무증상이거나 독감과 유사한 증상으로 나타난다. 다른 경우에는 불규칙한 발열, 오한, 두통, 전반적인 무기력, 통증 및 불쾌감이 증상으로 나타난다.[7] 심각한 경우 용혈성 빈혈, 황달, 숨 가쁨, 혈색소뇨증과 같은 기생충 증식의 영향이 기록되어 있다.[8][30] 정상적인 면역 기능과 건강한 비장을 가진 개인은 종종 치료 없이 회복된다.[7]
비장 절제술을 받은 환자는 질병에 걸리기 쉽고 증상이 나타난 지 5~8일 이내에 사망할 수 있다.[31] 이들은 심각한 용혈성 빈혈을 앓고 있으며, 때때로 간 비대가 기록되었다. 기생충 혈증 수치는 비장이 없는 환자의 경우 최대 85%까지, 비장과 효과적인 면역 체계를 가진 개인의 경우 1~10%까지 나타날 수 있다.[30]
합병증으로는 급성 호흡 부전, 울혈성 심부전, 신부전 등이 있다. 감염은 입원 환자의 5~10%에서 치명적일 수 있으며, 면역 저하, 노인, 라임병에 감염된 환자에게서 사망 위험이 증가한다.[30] ''B. divergens'' 감염은 훨씬 더 높은 사망률(42%)을 보이며 더 심각한 증상으로 나타난다. 감염된 개인은 혈색소뇨증, 황달, 지속적인 고열, 오한 및 발한을 경험한다. 치료하지 않으면 ''B. divergens'' 감염은 쇼크와 유사한 증상, 폐부종 및 신부전으로 발전할 수 있다.[30]
'''조류에서'''
바다오리류에 대한 ''B. uriae''의 병원성은 현재 알려지지 않았다. 조류는 병변, 빈혈 및 호흡 곤란을 보였으며, 조류 숙주의 조직이 영향을 받았다.[10] ''B. peircei'' 감염은 아프리카 펭귄에서 경미한 빈혈, 백혈구 증가증 및 간 기능 장애를 유발할 수 있다.[32]
10. 진단
''바베스열원충속'' 종은 적혈구의 포자소체 단계에서 침투한다. 적혈구 내에서 원생동물은 순환하며 영양체 고리로 발달한다. 영양체는 분열하여 메로조이트로 변하는데, 메로조이트는 몰타 십자 형태의 사분체 구조를 갖는다.[16] 얇은 혈액 도말의 김자 염색에서 보이는 이러한 사분체 형태는 ''바베스열원충속'' 고유의 특징으로, 말라리아를 유발하는 유사한 형태의 원생동물인 ''열대열 말라리아 원충''과 구별된다. 영양체와 메로조이트의 성장은 숙주 적혈구를 파열시켜 감염성 기생체인 버미큘을 방출하며, 이는 혈액 전체로 원생동물을 빠르게 확산시킨다.[7]
''바베스열원충속''의 특정 형태를 혈액 도말에서 주의 깊게 관찰하는 것이 중요한데, 이는 말라리아 기생충인 ''열대열 말라리아 원충''과 매우 유사하기 때문이다. 이로 인해 바베스열원충증 환자들이 오진되는 경우가 많다. ''바베스열원충속''을 구별하는 몇 가지 특징으로는 다양한 모양과 크기의 원생동물, 공포를 포함할 가능성, 색소 생성의 부재 등이 있다. 적혈구 내에서 사분체 형태로 나타나는 영양체 또한 ''바베스열원충속''을 나타낸다.
바베스열원충증과 말라리아에 대한 많은 연구에도 불구하고, 혈액 도말을 통한 오진은 빈번하고 문제가 될 수 있다. 혈액 도말을 보완하기 위해, 감염된 환자의 88-96%에서 항체 검출이 가능한 간접 형광 항체 (IFA) 검사를 통해 진단을 내려야 하는데, 이는 염색된 혈액 도말보다 훨씬 높은 특이도를 갖는다.[5] 항체 검사를 통한 진단 방법은 또한 무증상 개인의 혈청 유병률을 파악하는 데 특히 유용하다. ''바베스열원충속''은 수혈을 통해 전염될 수 있으므로, IFA 검사는 헌혈 시 질병을 선별하는 효과적인 수단이 될 수 있다.
원생동물 기생충인 바베스열원충속 감염을 확인하는 가장 효과적인 방법은 혈액 배양을 통한 혈액 검사이다. 과거에는 바베스열원충증 진단을 위해 ''B. microti''의 경우 햄스터를, ''B. divergens''의 경우 저빌을 사용하여 제노진단법을 수행했다.[7] 이 진단 기술은 더 빠른 진단 방법으로 대체되었다.
11. 치료
사람의 경우, 많은 사람들이 자발적으로 회복하며, 질병으로 진단되지 않은 가벼운 증상만을 경험한다. 이는 미국에서 일반적으로 더 흔하게 나타나는 ''B. microti'' 감염에서 거의 항상 나타난다. ''B. divergens'' 감염 및 더 심각한 ''B. microti'' 감염의 경우, 증상이 있는 사람에 대한 과거의 표준 치료법은 경구 또는 정맥 클린다마이신과 경구 퀴닌이었다.[5] 그러나 2000년에 완료된 연구 결과에 따라, 치료 요법은 경구 아토바쿠온과 경구 아지트로마이신을 사용하는 쪽으로 점점 더 기울어지고 있다. 후자는 가장 심각한 경우를 제외하고 모두 동일하게 효과적이며, 관련된 부작용이 적기 때문에 선호된다.[33] 심각한 경우에는, 개인의 기생충 부하를 줄이기 위해 수혈 교환을 수행해 왔다.[7] 다른 조치로는 비정상적인 임상 징후를 해결하고 수정하는 것이 있다.[8]
바닷새의 경우, 프리마퀸은 감염된 숙주에 대한 효과적인 치료를 보여주는 연구에서 사용되었다.[34] 바베스열원충증 치료는 프리마퀸(1mg/kg, 10일 동안 24시간마다 경구 투여, 프리마퀸 phosphate|인산염영어 1.76% m/v 안정화 용액, Primaquin Solution, MedPet Ltd, 벤로스, 남아프리카 공화국)으로 구성되었다. 그 후, 프리마퀸의 잠재적인 간독성 효과를 완화하기 위한 시도로, 인지질 보충제(1 캡슐/새, 12일 동안 24시간마다 경구 투여, 탈유, 강화된 인지질은 콩에서 추출, 300mg/캡슐, Essentiale Extreme, 사노피 아벤티스 Ltd, 미드랜드, 남아프리카 공화국)를 투여했다. ''바베시아'' 및 기타 진드기 매개 병원체의 전파를 예방하기 위해, 육안으로 보이는 외부 기생충이 있는 모든 조류는 입원 시 살충제 분말(카바릴 50g/kg)로 치료하고, 시설은 매일 철저히 청소한다.[34]
12. 예방
바베스열원충에 대한 가장 효과적인 공중 보건 조치는 진드기에 물리지 않도록 예방하는 것이다. 특히 진드기 활동이 활발한 5월부터 9월 사이에 진드기가 많은 지역을 피하고, 야외 활동 시 밝은 색 옷으로 몸을 가려야 한다. 또한 야외 활동 후에는 반드시 진드기가 몸에 붙어 있는지 확인하고, 발견 즉시 제거해야 한다.[30]
DEET를 함유한 일반적인 진드기 및 곤충 기피제를 사용하는 것도 도움이 된다. DEET에 부작용이 있는 사람은 다른 곤충 기피제를 사용해야 한다.[30] 주(state) 차원에서는 보건 당국의 의지에 따라 진드기 제거 작업을 실시할 수 있다. 실제로 1906년 미국에서는 소 바베스열원충증의 매개체인 진드기를 근절하려는 노력이 시작되어 40년 후 성공적으로 완료되었다.[8]
가축 진드기가 ''B. bovis'' 및 ''B. bigemina'' 감염 발생률을 줄이기 위해 화학 살충제로 정기적으로 관리되는 지역에서는 이러한 기생충으로 인한 사람의 감염 위험이 감소한다. 하지만 매개체 관리를 통한 완전한 질병 근절은 장기적인 사업이며, 라임병과 바베스열원충증의 발병률을 줄일 수는 있지만, 공중 보건 부서의 재정 부족으로 인해 개인 예방 조치가 더 권장된다.
사람에게서 바베스열원충증 발병률은 비교적 낮고, 여러 동물 저장소가 존재하기 때문에 백신 개발 대상이 되지 못했다.
참조
[1]
논문
Phylogeny and evolution of the Piroplasmida as inferred from 18S rRNA sequences
[2]
서적
The Neurological Manifestations of Pediatric Infectious Diseases and Immunodeficiency Syndromes
Humana Press
[3]
웹사이트
Babesia
https://www.ncbi.nlm[...]
[4]
논문
The blood picture resulting from Nuttallia (= Babesia) rodhaini and Nuttallia (= Babesia) microti infections in rats and mice
1969-11
[5]
웹사이트
DPDx: Laboratory Identification of Parasites of Public Health Concern. Babesiosis
http://www.dpd.cdc.g[...]
CDC
2009-03-05
[6]
논문
Ecology of Ixodes Dammini-Borne Human Babesiosis and Lyme Disease
1985-01
[7]
서적
Parasitic Diseases
https://books.google[...]
Springer-Verlag
[8]
서적
Malaria and Babesiosis: Research Findings and Control Measures
https://books.google[...]
M. Nijhoff
[9]
논문
Sequencing of the smallest Apicomplexan genome from the human pathogen Babesia microti
2012-10
[10]
논문
Description of Novel Babesia Species and Associated Lesions from Common Murres (Uria aalge) from California
https://www.research[...]
2009-05-01
[11]
논문
Human babesiosis
2012-06
[12]
논문
Photo Quiz: Theobald Smith
2008-12
[13]
서적
Clinical parasitology
https://books.google[...]
Lea & Febiger
[14]
논문
Babesia and its hosts: adaptation to long-lasting interactions as a way to achieve efficient transmission
2009-04-21
[15]
논문
Whole genome mapping and re-organization of the nuclear and mitochondrial genomes of Babesia microti isolates
[16]
논문
Molecular characterization of a non-Babesia divergens organism causing zoonotic babesiosis in Europe
2003-08
[17]
웹사이트
CDC2 - Babesiosis
https://www.cdc.gov/[...]
Centers for Disease Control and Prevention
2018-09-20
[18]
논문
Infection rate of Babesia spp. sporokinetes in engorged Boophilus microplus from an area of enzootic stability in the State of Minas Gerais, Brazil
2003-12
[19]
논문
Evidence that climate change has caused 'emergence' of tick-borne diseases in Europe?
2004
[20]
논문
Morphology, epidemiology, and phylogeny of Babesia: An overview
2015
[21]
논문
Zoonotic reservoir of Babesia microti in Poland
[22]
논문
Reservoir competence of white-footed mice for Babesia microti
1993-01
[23]
논문
Transfusion-associated babesiosis after heart transplant
2003-01
[24]
논문
Babesiosis
2000-07-01
[25]
논문
Description and Epizootiology of Babesia poelea n. sp. in Brown Boobies (Sula leucogaster (Boddaert)) on Sand Island, Johnston Atoll, Central Pacific
1997-08
[26]
논문
Nuttallia França, 1909 (babesiidae) preoccupied by Nuttallia Dall, 1898 (psammobiidae): A re-appraisal of the taxonomic position of the avian piroplasms
1975-06
[27]
논문
Babesia peirceisp. nov. from the jackass penguin
1993-01
[28]
논문
Babesia bennetti n. sp. from the Yellow-Legged Gull (Larus cachinnans, Aves, Laridae) on Benidorm Island, Mediterranean Sea
1998-04
[29]
논문
Babesiosis: Recent insights into an ancient disease
2008-09
[30]
서적
Harrison's Principles of Internal Medicine, 17e
McGraw-Hill's Access Medicine
2008-03-06
[31]
웹사이트
Babesiosis
http://www3.niaid.ni[...]
National Institute of Allergy and Infectious Diseases, National Institutes of Health
2009-02-19
[32]
논문
Health evaluation of African penguins (Spheniscus demersus) in southern Africa
2016-03-09
[33]
논문
Atovaquone and azithromycin for the treatment of babesiosis
2000-11
[34]
논문
Empirical Primaquine Treatment of Avian Babesiosis in Seabirds
2019-09-09
[35]
웹사이트
Cattle Fever Ticks
https://www.aphis.us[...]
USDA
[36]
웹사이트
DPDx: Laboratory Identification of Parasites of Public Health Concern. Babesiosis
http://www.dpd.cdc.g[...]
CDC
2009-03-05
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com