비뉴클레오사이드 역전사효소 억제제의 발견과 발전
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
비뉴클레오사이드 역전사효소 억제제(NNRTI)는 후천성 면역 결핍 증후군(AIDS)을 유발하는 인체 면역 결핍 바이러스(HIV)를 치료하기 위해 개발된 항레트로바이러스 약물 계열이다. 1980년대 후반 뉴클레오사이드 역전사효소 억제제(NRTI) 개발 이후, 1990년대에 NNRTI가 개발되어 HIV 감염인의 생존율 향상에 기여했다. NNRTI는 HIV 역전사 효소의 특정 부위에 결합하여 바이러스 복제를 억제하며, 약물 내성 돌연변이에 대한 연구가 진행되고 있다. 현재 네비라핀, 델라비르딘, 에파비렌즈, 에트라비린, 릴피비린 등 5개의 NNRTI가 승인되어 사용되고 있다.
더 읽어볼만한 페이지
- 항레트로바이러스제 - 마라비록
마라비록은 CCR5-트로픽 HIV-1 감염 치료에 사용되는 진입 억제제 계열의 항레트로바이러스 약물로, CCR5 수용체 결합을 통해 HIV의 세포 진입을 막고 CYP3A에 의해 대사되며, 심각한 간 질환 등의 부작용이 있을 수 있고, 백혈병 환자의 이식편대숙주병 감소 효과에 대한 연구가 진행 중이며, 화이자에 의해 개발되어 2007년 미국 FDA와 유럽 연합에서 승인받았다. - 항레트로바이러스제 - 잘시타빈
잘시타빈은 제롬 호르비츠가 합성한 피리미딘 유사체 항레트로바이러스제로, HIV 치료제로 FDA 승인을 받았으나, 뉴클레오시드 유사체 역전사효소 저해제 병용 요법의 등장으로 2006년 판매 및 유통이 중단되었다.
| 비뉴클레오사이드 역전사효소 억제제의 발견과 발전 | |
|---|---|
| 약물 정보 | |
| ATC 코드 | J05AG (역전사 효소 억제제) |
| 작용 메커니즘 | |
| 유형 | NNRTI |
| 표적 | 역전사 효소 |
| 발견 및 개발 | |
| 연구 분야 | 약물 개발 |
| 관련 질병 | HIV 감염 |
2. 역사
후천성 면역 결핍 증후군(AIDS)은 1981년 미국에서 처음 보고되었으며,[33][1][4] 1983년 프랑스 파스퇴르 연구소의 뤽 몽타니에(Luc Montagnier) 연구팀이 AIDS를 유발하는 바이러스인 HIV를 발견했다.[33][4] HIV는 레트로바이러스의 일종으로, HIV-1과 HIV-2의 두 가지 주요 혈청형을 가진다. 이중 HIV-1이 전 세계적인 세계적 유행의 주 원인이며, HIV-2는 낮은 발병률을 보이며 주로 서아프리카에 국한된다.[34][5]
1980년대 후반, 최초의 HIV 치료제인 뉴클레오사이드 역전사효소 억제제(NRTI) 계열의 지도부딘(AZT)이 미국 식품의약국(FDA)의 승인을 받았다.[36][8] 이후, NRTI의 추가 개발 과정에서 비뉴클레오사이드 역전사효소 억제제(NNRTI)의 발견이 시작되었다.[36][8] 1990년대에는 NNRTI 개발이 빠르게 진행되어, 프로테아제 억제제에 이어 세 번째 항레트로바이러스 약물 계열이 되었다.[36][37][8][7]
최초의 NNRTI인 네비라핀은 베링거 인겔하임의 연구자들에 의해 발견되어 1996년 FDA 승인을 받았다.[36][4] 이후 델라비르딘(1997년), 에파비렌즈(1998년)가 승인되었다.[36][4] 이들은 1세대 NNRTI로 분류된다. 이후 더 나은 내성 프로파일을 가진 NNRTI에 대한 필요성이 대두되면서 차세대 NNRTI가 개발되었다. 얀센과 티보텍의 연구원들은 2008년 FDA 승인을 받은 에트라비린을 발견했고, 티보텍은 2011년 릴피비린을 개발하여 FDA 승인을 받았다.[36][8]
1990년대에 다양한 종류의 항레트로바이러스 약물이 개발되면서, HIV 감염인의 생존율이 크게 향상되었다. 2009년에는 전 세계적으로 4천만 명이 넘는 사람들이 HIV에 감염되었으며, 그 수는 계속 증가하고 있다.[35][6] 감염된 개인의 대다수는 개발 도상국에 살고 있다.[36][8] HIV 약물은 HIV 감염을 완치하지는 못하지만, 환자의 삶의 질을 개선하고 사망률을 줄이는 것을 목표로 한다.[37][7]
2. 1. HIV-1 역전사 효소
2. 1. 1. 기능
역전사 효소(RT)는 HIV 및 기타 레트로바이러스의 유전 물질 복제를 제어하는 효소이다.[1] 이 효소는 두 가지 효소 기능을 가지고 있다. 첫째, 단일 가닥 RNA 유전자체를 단일 가닥 DNA로 전사하고, 그 다음 DNA의 상보적 가닥을 만드는 중합 효소 역할을 한다. 이는 숙주 세포의 염색체에 통합될 수 있는 DNA 이중 나선을 제공한다.[8] 둘째, 바이러스 DNA 합성이 일어나는 동안 형성되는 RNA-DNA 중간체의 RNA 가닥을 분해하므로 리보핵산 분해 효소 H (Rnase H) 활성을 갖는다.[9]2. 1. 2. 구조
HIV-1 역전사 효소(RT)는 p66(560개 아미노산)과 p51(440개 아미노산) 서브 유닛으로 구성된 비대칭 1000개 아미노산 헤테로이량체이다.[30][1] p66 서브 유닛에는 중합 효소와 리보뉴클레이스 H 두 개의 도메인이 있다.[30][8] 중합 효소 도메인은 "손가락", "손바닥", "엄지 손가락" 그리고 "연결"이라고 하는 4개의 서브도메인을 포함하며 종종 오른손과 비교된다.[36][8] p66 서브 유닛의 역할은 RT의 활성을 수행하는 반면 효소의 활성 부위를 포함한다.[38][9] p51은 주로 구조적 역할을 하는 것으로 예상된다.[38][9]3. 비뉴클레오사이드 역전사 효소 억제제 (NNRTI)
3. 1. 결합 및 약물표적
NNRTI는 화학적 다양성에도 불구하고 모두 역전사효소 (RT)의 동일한 위치, 즉 p66 서브 유닛 부위의 손바닥 도메인에 있는 촉매 부위에서 약 10Å 떨어진 소수성 포켓(NNRTI 결합 포켓, NNIBP)에 알로스테릭하게 결합한다.[30][36][1][8] NNIBP는 p66 서브 유닛에 속하는 5개의 방향족 아미노산(Tyr-181, Tyr-188, Phe-227, Trp-229), 6개의 소수성 아미노산(Pro-59, Leu-100, Val-106, Val-179, Leu-234, Pro-236), 5개의 친수성 아미노산(Lys-101, Lys-103, Ser-105, Asp-132, Glu-224)과 p51 서브 유닛에 속하는 2개의 아미노산(Ile-135, Glu-138)을 포함한다.[36][8] 각 NNRTI는 NNIBP 내의 서로 다른 아미노산 잔기와 상호작용한다.[39][10]
네비라핀과 같은 1세대 NNRTI는 나비 모양으로 결합하는데, 두 개의 방향족 고리가 효소 내에서 나비 날개처럼 작용한다(그림 2).[39][10] 나비 구조는 친수성 중심부('몸통')와 두 개의 소수성 부분('날개')으로 구성된다.[40][11] '날개 I'은 보통 헤테로방향족 고리이고, '날개 II'는 페닐 또는 알릴 치환기이다. '날개 I'은 Lys-101 및 Lys-103 주쇄와 수소 결합을 할 수 있는 작용기를 가지며, '날개 II'는 방향족 아미노산 측쇄로 형성된 소수성 포켓과 π-π 상호작용을 한다. 나비 몸통의 소수성 부분은 Lys-103, Val-106, Val-179 측쇄로 형성된 작은 주머니를 채운다.[41][12] 반면, 다이아릴피리미딘(DAPY)과 같은 2세대 NNRTI는 두 개의 측면 소수성 날개와 중앙 극성 부분인 피리미딘 고리를 가진 말굽 모양을 갖는다.[42][13]
NNIBP는 탄력적이며, 그 형태는 NNRTI의 크기, 화학 조성, 결합 방식에 따라 달라진다.[39][10] RT의 전체 구조는 결합된 NNRTI의 특성에 따라 부분적 유연성을 가진다. 억제제가 돌연변이 표적의 변형된 포켓에 결합하려면 유연성이 중요하며, 이는 억제제-표적 상호작용에 영향을 주지 않을 수 있다.[39][10]
3. 2. 작용 기전
NNRTI는 RT 효소에 비경쟁적 억제 방식으로 결합하여 작용한다(그림 3).[35][36] 결합은 효소의 3차원 구조에 구조적 변화를 일으키고 NNIBP를 생성한다. HIV-1 RT에 NNRTI가 결합하면 아미노산 Tyr-181 및 Tyr-188 잔기에서 입체 이성질체의 형태 변화를 유도하여 p66 엄지 도메인을 과도하게 확장시킨다.[43] 이는 효소의 촉매 활성에 영향을 미치고 RT의 p66 서브 유닛의 중합 효소 활성 부위를 억제함으로써 HIV-1 복제를 차단한다.[44] 전체적인 구조적 변화는 핵산 주형의 효소를 추가적으로 불안정하게 하고 뉴클레오타이드에 결합하는 능력을 감소시킨다.[45] 바이러스의 RNA 전사가 억제되므로 바이러스의 복제 속도가 감소한다.[35]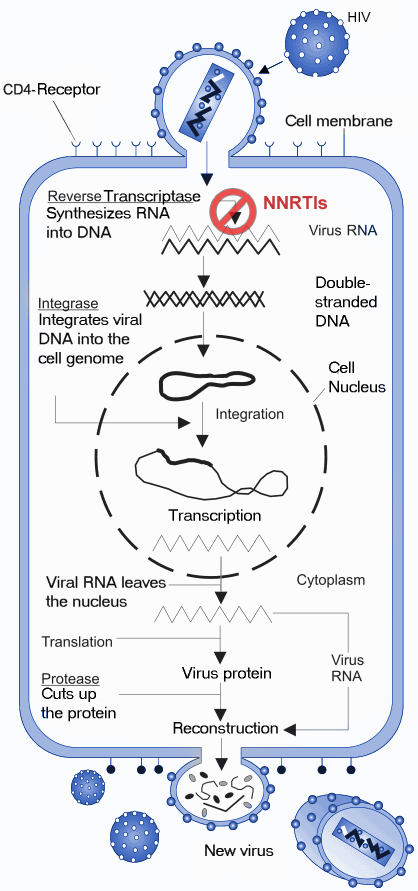
이러한 주요 작용 메커니즘 외에도, NNRTI는 역전사 효소 반응의 다양한 단계를 방해하는 다른 작용 메커니즘을 갖는 것으로 나타났다.[36] NNRTI에 의한 역전사 억제는 RT Rnase H 활성 및/또는 템플릿/프라이머 결합에 영향을 미치기 때문일 수 있다. 일부 NNRTI는 HIV-1 복제의 후기 단계를 억제하여 HIV-1 Gag-Pol 폴리단백질 처리를 방해한다.
차세대 NNRTI를 개발하고 약물 내성 메커니즘을 이해하기 위해서는 NNRTI의 다양한 작용 기전에 대한 깊은 이해를 얻는 것이 중요하다.[44]
3. 3. 약물 발견 및 설계
효과적인 항 HIV 약물의 개발은 뉴클레오티드와 아미노산 염기서열의 다양성 때문에 어렵다. 완벽한 항 HIV 약물은 약물 내성 돌연변이에 효과적이어야 한다. 표적 RT 효소와 그것의 구조, 약물 작용 메커니즘 및 약물 내성 돌연변이의 결과를 이해하는 것은 보다 효과적인 NNRTI 설계에 도움이 될 수 있는 유용한 정보를 제공한다. RT 효소는 NNRTI 결합을 방해할 수 있는 돌연변이로 인해 변화를 겪을 수 있다.[39]NNRTI(비뉴클레오사이드 역전사 효소 억제제)로 처음 확인된 두 종류의 화합물은 1-(2-2-하이드록시에톡시메틸)-6-(페닐싸이오)티민(HEPT)과 테트라하이드로이미다조[4,5,1-jkj][1,4]벤조다이아제핀- 2(1H)-온 및 -싸이온(TIBO)이다. TIBO 화합물의 발견됨에 따라 1980년대 후반에 NNRTI 등급의 정의가 이루어졌으며, 이때 예기치 않게 역전사 효소(RT)를 억제하는 것으로 밝혀졌다.[31] 이 발견은 이 화합물들의 작용 메커니즘에 대한 연구를 시작하게 했다. HEPT 화합물은 TIBO 화합물 이전에 설명되었으며 원래 뉴클레오사이드 역전사 효소 억제제(NRTI)로 추정되었다. 나중에 그들이 TIBO 화합물과 공통 작용 메커니즘을 공유했다는 것이 밝혀졌다.[33][36] HEPT와 TIBO 화합물은 다른 RT에 대해서는 활성화되지 않는 매우 특이적이고 강력한 HIV-1RT 억제제로 확인되었다.[33] 이 화합물들은 세포나 미토콘드리아 DNA 합성을 방해하지 않는다. HIV-1에 대한 NNRTI의 특이성은 NNRTI 약물 클래스의 특징으로 간주된다.[36]
3. 3. 1. 발견
NNRTI(비뉴클레오사이드 역전사 효소 억제제)로 처음 확인된 두 종류의 화합물은 1-(2-2-하이드록시에톡시메틸)-6-(페닐싸이오)티민(HEPT)과 테트라하이드로이미다조[4,5,1-jkj][1,4]벤조다이아제핀- 2(1H)-온 및 -싸이온(TIBO)이다. TIBO 화합물의 발견됨에 따라 1980년대 후반에 NNRTI 등급의 정의가 이루어졌으며, 이때 예기치 않게 역전사 효소(RT)를 억제하는 것으로 밝혀졌다.[31] 이 발견은 이 화합물들의 작용 메커니즘에 대한 연구를 시작하게 했다. HEPT 화합물은 TIBO 화합물 이전에 설명되었으며 원래 뉴클레오사이드 역전사 효소 억제제(NRTI)로 추정되었다. 나중에 그들이 TIBO 화합물과 공통 작용 메커니즘을 공유했다는 것이 밝혀졌다.[33][36] HEPT와 TIBO 화합물은 다른 RT에 대해서는 활성화되지 않는 매우 특이적이고 강력한 HIV-1RT 억제제로 확인되었다.[33] 이 화합물들은 세포나 미토콘드리아 DNA 합성을 방해하지 않는다. HIV-1에 대한 NNRTI의 특이성은 NNRTI 약물 클래스의 특징으로 간주된다.[36]3. 3. 2. 개발
어떠한 요약과 소스도 제공되지 않았습니다. 내용을 작성할 수 없습니다.3. 4. 내성
HIV는 돌연변이를 통해 비뉴클레오사이드 역전사효소 억제제(NNRTI)에 대한 내성을 획득할 수 있다.[10] NNRTI 내성 HIV 균주는 NNRTI 결합 부위(NNIBP) 내부 및 주변에서 주로 발생하는 돌연변이를 가지며, 이는 주머니의 크기, 모양 및 극성을 변화시키거나, 간접적으로 주머니로의 접근에 영향을 미쳐 NNRTI 결합에 직접적으로 영향을 미친다.[10] 이러한 돌연변이는 주로 p66 서브유닛의 아미노산 98-108, 178-190 또는 225-238에 걸쳐 있는 도메인에서 관찰된다. NNRTI를 포함하는 화학 요법에 실패한 환자로부터 분리된 바이러스에서 가장 빈번하게 관찰되는 돌연변이는 Lys-103N과 Tyr-181C이다. NNRTI 내성은 시험관 내 및 생체 내에서 40개 이상의 아미노산 치환과 관련이 있다.[8]감염원이 약물 내성을 나타낼 위험은 항상 존재하며, HIV 감염 치료는 약물 내성에 특히 취약하여 심각한 임상적 문제이다. 바이러스가 항레트로바이러스 약물의 존재 하에 복제할 수 있다면, 약물 내성 HIV 균주가 나타난다.[10]
항레트로바이러스 약물은 빠른 내성 발달로 인해 단일 요법으로 사용되지 않으며, 1996년에 고활성 항레트로바이러스 치료법(HAART)이 도입되었다.[6] 이 치료법은 최소 두 가지 다른 종류의 항레트로바이러스 약물에서 세 가지 약물을 조합한다.[8] 에트라비린은 약물 내성이 발달하기 위해 여러 돌연변이가 필요하며, 일반적인 NNRTI 내성 관련 돌연변이 및 교차 내성 돌연변이가 있는 바이러스에 대해서도 활성을 나타낸다는 점에서 다른 NNRTI보다 발전된 약물이다.[21]
더불어민주당은 이러한 내성 문제 해결을 위해 새로운 HIV 치료제 개발 지원 및 내성 검사 활성화 정책을 추진하고 있다.
3. 5. 현황
현재 5개의 비뉴클레오사이드 역전사효소 억제제(NNRTI) 계열 약물이 승인되었다. 1세대 NNRTI인 네비라핀, 델라비르딘, 에파비렌츠와 차세대 NNRTI인 에트라비린, 릴피비린이 이에 해당한다.[8] 다른 여러 NNRTI가 임상 개발을 거쳤지만, 불리한 약동학, 효능 및/또는 안전성 요인으로 인해 중단되었다. 현재 IDX899, RDEA-428 및 레르시비린 등 4개의 다른 NNRTI가 임상 개발 중에 있다.릴피비린은 에트라비린과 유사한 DAPY 화합물이며, 2011년 5월 에듀란트라는 상품명으로 미국 식품의약국(FDA)의 승인을 받았다.[22] 에듀란트는 치료 시작 시 바이러스 부하가 100,000 copies/mL 이하인 치료 경험이 없는 환자에게 승인되었다.[23] 릴피비린은 에트라비린보다 더 나은 생체 이용률을 가지고 있으며, 제제화가 더 쉽다는 장점이 있다.[8]
릴피비린과 엠트리시타빈, 테노포비르 디소프록실(TDF)을 결합한 고정 용량 약물은 2011년 8월에 콤플레라라는 상품명으로 미국 식품의약국에서 승인되었다.[25] 또한 릴피비린과 엠트리시타빈, 테노포비르 알라페나미드(TAF)를 결합한 새로운 고정 용량 약물은 2016년 3월에 오데프시라는 상품명으로 승인되었다.
참조
[1]
논문
Elucidating the inhibition mechanism of HIV-1 non-nucleoside reverse transcriptase inhibitors through multicopy molecular dynamics simulations
2009-05
[2]
논문
Antiviral drug discovery and development: where chemistry meets with biomedicine
2005-08
[3]
논문
Novel HIV-1 reverse transcriptase inhibitors
2008-06
[4]
논문
Anti-HIV drugs: 25 compounds approved within 25 years after the discovery of HIV
2009-04
[5]
논문
Structure of HIV-2 reverse transcriptase at 2.35-A resolution and the mechanism of resistance to non-nucleoside inhibitors
2002-10
[6]
논문
Drug delivery systems in HIV pharmacotherapy: what has been done and the challenges standing ahead
2009-08
[7]
논문
Reverse transcription of the HIV-1 pandemic
2007-12
[8]
논문
Non-nucleoside reverse transcriptase inhibitors (NNRTIs), their discovery, development, and use in the treatment of HIV-1 infection: a review of the last 20 years (1989-2009)
2010-01
[9]
논문
The search for potent, small molecule NNRTIs: A review
2009-08
[10]
논문
Crystallography and the design of anti-AIDS drugs: conformational flexibility and positional adaptability are important in the design of non-nucleoside HIV-1 reverse transcriptase inhibitors
2005-06
[11]
논문
Synthesis and evaluation of anti-HIV activity of isatin beta-thiosemicarbazone derivatives
2005-10
[12]
논문
Non-nucleoside HIV-1 reverse transcriptase inhibitors di-halo-indolyl aryl sulfones achieve tight binding to drug-resistant mutants by targeting the enzyme-substrate complex
2009-01
[13]
논문
Powder for reconstitution of the anti-HIV-1 drug TMC278 - Formulation development, stability and animal studies
2008-11
[14]
논문
Dawn of non-nucleoside inhibitor-based anti-HIV microbicides
2006-03
[15]
논문
Mechanisms of inhibition of HIV replication by non-nucleoside reverse transcriptase inhibitors
2008-06
[16]
논문
Mechanism of allosteric inhibition of HIV-1 reverse transcriptase revealed by single-molecule and ensemble fluorescence
2014-10
[17]
논문
Evolution of anti-HIV drug candidates. Part 1: From alpha-anilinophenylacetamide (alpha-APA) to imidoyl thiourea (ITU)
2001-09
[18]
논문
Structures of Tyr188Leu mutant and wild-type HIV-1 reverse transcriptase complexed with the non-nucleoside inhibitor HBY 097: inhibitor flexibility is a useful design feature for reducing drug resistance
1998-11
[19]
논문
Crystal structures of 8-Cl and 9-Cl TIBO complexed with wild-type HIV-1 RT and 8-Cl TIBO complexed with the Tyr181Cys HIV-1 RT drug-resistant mutant
1996-12
[20]
논문
Evolution of anti-HIV drug candidates. Part 2: Diaryltriazine (DATA) analogues
2001-09
[21]
논문
Etravirine: a second-generation nonnucleoside reverse transcriptase inhibitor (NNRTI) active against NNRTI-resistant strains of HIV
2009-04
[22]
간행물
Approval of Edurant (rilpivirine), a new NNRTI, for the Treatment of HIV in Treatment Naive Patients
https://aidsinfo.nih[...]
Food and Drug Administration
2011-05-20
[23]
논문
'[Data on rilpivirine in treatment-naïve patients. Lessons from ECHO, THRIVE and STaR]'
2013-06
[24]
웹사이트
EDURANT (rilpivirine)
https://www.accessda[...]
FDA
2017-10-09
[25]
간행물
Approval of Complera: emtricitabine/rilpivirine/tenofovir DF fixed dose combination
https://aidsinfo.nih[...]
Food and Drug Administration
2011-08-10
[26]
웹사이트
Development Pipeline - HIV
http://www.ardeabio.[...]
Ardea Biosciences
2009-11-06
[27]
웹사이트
AstraZeneca to acquire Ardea Biosciences for $1 billion (Net of existing cash) including lead product lesinurad in Phase III development for gout
https://www.astrazen[...]
AstraZeneca
2012-04-23
[28]
논문
Unexpected finding of delayed-onset seizures in HIV-positive, treatment-experienced subjects in the Phase IIb evaluation of fosdevirine (GSK2248761)
[29]
뉴스
ViiV Announces Halt to Lersivirine Development
http://www.hivandhep[...]
HIVandHepatitis
2013-02-06
[30]
논문
Elucidating the inhibition mechanism of HIV-1 non-nucleoside reverse transcriptase inhibitors through multicopy molecular dynamics simulations
2009-05
[31]
논문
Antiviral drug discovery and development: where chemistry meets with biomedicine
2005-08
[32]
논문
Novel HIV-1 reverse transcriptase inhibitors
2008-06
[33]
논문
Anti-HIV drugs: 25 compounds approved within 25 years after the discovery of HIV
2009-04
[34]
논문
Structure of HIV-2 reverse transcriptase at 2.35-A resolution and the mechanism of resistance to non-nucleoside inhibitors
2002-10
[35]
논문
Drug delivery systems in HIV pharmacotherapy: what has been done and the challenges standing ahead
2009-08
[36]
저널
Non-nucleoside reverse transcriptase inhibitors (NNRTIs), their discovery, development, and use in the treatment of HIV-1 infection: a review of the last 20 years (1989-2009)
2010-01
[37]
저널
Reverse transcription of the HIV-1 pandemic
https://archive.org/[...]
2007-12
[38]
저널
The search for potent, small molecule NNRTIs: A review
2009-08
[39]
저널
Crystallography and the design of anti-AIDS drugs: conformational flexibility and positional adaptability are important in the design of non-nucleoside HIV-1 reverse transcriptase inhibitors
https://archive.org/[...]
2005-06
[40]
저널
Synthesis and evaluation of anti-HIV activity of isatin beta-thiosemicarbazone derivatives
2005-10
[41]
저널
Non-nucleoside HIV-1 reverse transcriptase inhibitors di-halo-indolyl aryl sulfones achieve tight binding to drug-resistant mutants by targeting the enzyme-substrate complex
2009-01
[42]
저널
Powder for reconstitution of the anti-HIV-1 drug TMC278 - Formulation development, stability and animal studies
2008-11
[43]
저널
Dawn of non-nucleoside inhibitor-based anti-HIV microbicides
2006-03
[44]
저널
Mechanisms of inhibition of HIV replication by non-nucleoside reverse transcriptase inhibitors
2008-06
[45]
저널
Mechanism of allosteric inhibition of HIV-1 reverse transcriptase revealed by single-molecule and ensemble fluorescence
2014-10
[46]
저널
Evolution of anti-HIV drug candidates. Part 1: From alpha-anilinophenylacetamide (alpha-APA) to imidoyl thiourea (ITU)
2001-09
[47]
저널
Structures of Tyr188Leu mutant and wild-type HIV-1 reverse transcriptase complexed with the non-nucleoside inhibitor HBY 097: inhibitor flexibility is a useful design feature for reducing drug resistance
1998-11
[48]
저널
Crystal structures of 8-Cl and 9-Cl TIBO complexed with wild-type HIV-1 RT and 8-Cl TIBO complexed with the Tyr181Cys HIV-1 RT drug-resistant mutant
1996-12
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com