암모늄 이온
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
암모늄 이온은 암모니아(NH3)가 브뢴스테드 산과 반응하여 생성되는 약산성 양이온이다. 암모늄 이온은 암모늄염 형태로 존재하며, 다양한 염에서 발견된다. 암모늄염은 알칼리 수산화물과 가열 시 암모니아 기체를 방출하며, 네슬러 시약 등으로 검출할 수 있다. 암모늄 이온은 질소 원자와 수소 이온 간의 배위 결합으로 형성되며, 정사면체 구조를 갖는다. 암모늄 이온의 수소 원자가 유기기로 치환된 유기 암모늄 이온은 1차, 2차, 3차, 4차로 분류되며, 4차 암모늄 이온은 용해도 증가 등에 사용된다. 생물학적으로 암모늄은 동물의 대사 과정에서 생성되는 노폐물이며, 미생물에 의해 질산화되어 질소 흐름에 기여한다. 또한, 식물의 질소원으로 사용되지만, 과도한 암모늄은 생태계에 영향을 줄 수 있다. 암모늄 이온은 무거운 알칼리 금속 이온과 유사한 성질을 가지며, 고압 환경에서 금속으로 존재할 것으로 예상된다.
더 읽어볼만한 페이지
- 양이온 - 양성자
양성자는 양(+) 전하를 띠는 기본 입자이자 원자핵을 구성하는 핵자이며, 수소 원자핵으로 화학에서 수소 이온을 의미하며, 브뢴스테드-로우리 산-염기 이론에서 양성자 주개로 정의된다. - 양이온 - 하이드로늄 이온
하이드로늄 이온(H₃O⁺ )은 수용액에서 자체 이온화되거나 강산 첨가 시 생성되는 이온으로, 삼각뿔 형태의 분자 구조를 가지며 수용액의 산성도 pH 결정 및 성간 매질 분자 구름 내 화학 반응에 중요한 역할을 한다. - 암모늄 화합물 - 질산 암모늄
질산 암모늄은 질산과 암모니아의 반응으로 만들어지는 염으로, 질소 비료와 폭약의 재료로 사용되며, 물에 용해될 때 흡열 반응을 일으키는 특성이 있지만 가열되거나 특정 조건에서는 폭발할 수 있어 안전 관리가 중요하다. - 암모늄 화합물 - 암모니아수
암모니아수는 암모니아(NH3)가 물(H2O)에 용해된 수용액으로, 염기성을 띠며 세척제, 산업용, 식품 첨가물, 실험실 시약 등 다양한 용도로 사용된다. - 표시 이름과 문서 제목이 같은 위키공용분류 - 라우토카
라우토카는 피지 비치레부섬 서부에 위치한 피지에서 두 번째로 큰 도시이자 서부 지방의 행정 중심지로, 사탕수수 산업이 발달하여 "설탕 도시"로 알려져 있으며, 인도에서 온 계약 노동자들의 거주와 미 해군 기지 건설의 역사를 가지고 있고, 피지 산업 생산의 상당 부분을 담당하는 주요 기관들이 위치해 있다. - 표시 이름과 문서 제목이 같은 위키공용분류 - 코코넛
코코넛은 코코넛 야자나무의 열매로 식용 및 유지로 사용되며, 조리되지 않은 과육은 100g당 354kcal의 열량을 내는 다양한 영양 성분으로 구성되어 있고, 코코넛 파우더의 식이섬유는 대부분 불용성 식이섬유인 셀룰로오스이며, 태국 일부 지역에서는 코코넛 수확에 훈련된 원숭이를 이용하는 동물 학대 문제가 있다.
| 암모늄 이온 - [화학 물질]에 관한 문서 | |
|---|---|
| 일반 정보 | |
 | |
 | |
 | |
| IUPAC 명칭 | 암모늄 이온 |
| 관용명 | 암모늄 |
| 화학식 | NH4+ |
| 분자량 | 18.03851 g mol−1 |
| 짝염기 | 암모니아 |
| 식별 정보 | |
| CAS 등록번호 | 14798-03-9 |
| PubChem | 16741146 |
| ChemSpider ID | 218 |
| SMILES | [NH4+] |
| InChI | 1/H3N/h1H3/p+1 |
| InChIKey | QGZKDVFQNNGYKY-IKLDFBCSAZ |
| 표준 InChI | 1S/H3N/h1H3/p+1 |
| 표준 InChIKey | QGZKDVFQNNGYKY-UHFFFAOYSA-O |
| RTECS | 해당 없음 |
| MeSH 명칭 | D000644 |
| ChEBI | 28938 |
| UNII | 54S68520I4 |
| 성질 | |
| pKa | 9.25 |
| 구조 | |
| 분자 모양 | 정사면체 |
| 위험성 | |
| 주요 위험 | 해당 없음 |
| 인화점 | 해당 없음 |
| 자연 발화점 | 해당 없음 |
| 관련 화합물 | |
| 관련 화합물 | 암모늄 라디칼 •NH4 |
| 기타 양이온 | 포스포늄 • 아르소늄 • 하이드로늄 • 설포늄 • 플루오로늄 • 클로로늄 • 브로모늄 • 아이오도늄 • 카보늄 • 삼수소 양이온 |
2. 산-염기 반응
암모늄 이온은 탄산암모늄, 염화암모늄, 질산암모늄 등과 같은 염에서 발견된다. 대부분의 단순한 암모늄염은 물에 매우 잘 녹는다. 헥사클로로백금산암모늄은 예외적으로 과거에 암모늄 검출 시험에 사용되었다.[3] 질산암모늄과 과염소산염의 암모늄염은 폭발성이 강하며, 이 경우 암모늄 이온은 환원제로 작용한다.
암모늄 이온은 약염기인 암모니아가 브뢴스테드 산(양성자 주개)과 반응할 때 생성된다.
: H+ + NH3 → [NH4]+
암모늄 이온은 약산성이며, 브뢴스테드 염기와 반응하여 중성의 암모니아 분자로 돌아간다.
: [NH4]+ + B- → HB + NH3
따라서, 암모늄염의 진한 용액을 강염기로 처리하면 암모니아가 생성된다. 암모니아가 물에 녹으면, 아주 적은 양이 암모늄 이온으로 변환된다.
: H2O + NH3 ⇌ OH- + [NH4]+
암모니아가 암모늄 이온을 형성하는 정도는 용액의 pH에 따라 달라진다. pH가 낮으면 평형이 오른쪽으로 이동하여 더 많은 암모니아 분자가 암모늄 이온으로 변환된다. pH가 높으면(수소 이온 농도가 낮고 수산화 이온 농도가 높으면) 평형이 왼쪽으로 이동하여 수산화물 이온이 암모늄 이온에서 양성자를 빼앗아 암모니아를 생성한다.
암모늄 화합물의 형성은 기체상에서도 일어날 수 있다. 예를 들어, 암모니아 증기가 염화수소 증기와 접촉하면 염화암모늄의 흰 구름이 형성되고, 결국 표면에 얇은 흰 층으로 고체로 침전된다.
3. 암모늄염
특이한 과정으로, 암모늄 이온은 아말감을 형성한다. 이러한 물질은 염화암모늄 용액에 나트륨 아말감을 첨가하여 제조하며,[3] 이 아말감은 결국 분해되어 암모니아와 수소를 방출한다.[4]
3. 1. 암모늄염의 검출
암모늄염은 알칼리 수산화물과 반응하여 특징적인 냄새를 가진 암모니아 기체를 방출한다.[3]
암모니아는 염산(HCl)과 반응하여 염화암모늄의 흰 연기를 생성하며, 황산구리(II) 용액과 반응하면 진한 파란색의 슈바이처 시약을 생성한다.
네슬러 시약을 사용하면 염기성 환경에서 밀리언 염기의 아이오딘화물로 알려진 갈색 침전물이 생성되어 암모늄 이온을 검출할 수 있다.
다음은 침전 반응을 이용한 암모늄 이온 검출 방법이다.
4. 구조와 결합
암모니아의 질소 원자에 있는 비공유 전자쌍(고립 전자쌍)은 양성자와 배위 결합을 형성한다.[1] 그 후, 네 개의 N-H 결합은 모두 동등하며, 극성 공유 결합이다.[1] 이 이온은 정사면체 구조를 가지며,[1] 메테인과 붕소수소화물 음이온과 등전자성을 가진다.[1] 크기 측면에서 암모늄 양이온(''r''이온 = 175pm)은 세슘 양이온(''r''이온 = 183pm)과 유사하다.
5. 유기 암모늄 이온
암모늄 이온의 수소 원자는 알킬기 또는 다른 유기기로 치환되어 치환된 암모늄 이온(IUPAC 명명법: 아미늄 이온)을 형성할 수 있다. 유기기의 수에 따라 암모늄 양이온은 1차, 2차, 3차 또는 4차로 불린다. 4차 암모늄 양이온을 제외하고, 유기 암모늄 양이온은 약산이다.
암모늄 이온을 형성하는 반응의 예로는 디메틸아민((dimethylamine영어)과 산이 반응하여 디메틸암모늄(dimethylammonium) 양이온을 생성하는 반응이 있다.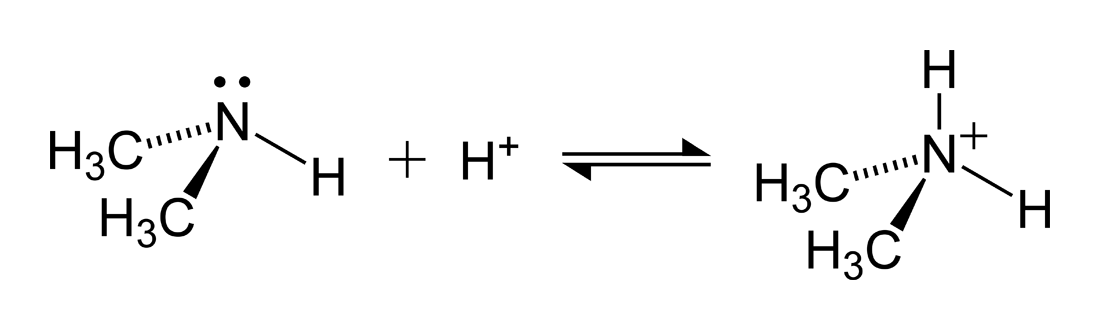
4차 암모늄 양이온은 질소 원자에 4개의 유기기가 결합되어 있으며, 질소 원자에 결합된 수소 원자가 없다. 테트라-''n''-부틸암모늄 양이온과 같은 이러한 양이온은 때때로 나트륨 또는 칼륨 이온을 대체하여 관련 음이온의 유기 용매에서의 용해도를 높이는 데 사용된다. 1차, 2차 및 3차 암모늄 염도 같은 기능을 하지만 친유성이 낮다. 또한 상전이 촉매 및 계면활성제로도 사용된다.
6. 생물학
암모늄 이온(NH₄⁺)은 동물의 대사 과정에서 생성되는 노폐물이다. 어류나 수생 무척추동물은 물속으로 직접 배설한다. 포유류, 상어, 양서류는 요소 회로를 통해 독성이 덜한 요소로 전환하여 배설한다. 조류, 파충류, 육상 달팽이는 요산으로 전환하여 고체 형태로 배설함으로써 물 손실을 최소화한다.[25]
암모늄은 질소를 필요로 하는 생화학 반응을 매개하는 효소에 사용되기 때문에, 일부 미생물과 식물에게 중요한 질소 공급원이다.[5] 특히 저산소 토양에서 자라는 식물에게 중요하다. 그러나 곡물에게는 독성을 나타내기 때문에 단일 질소원으로 사용되는 경우는 드물다.[26]
암모늄은 산화를 통해 질산화 과정을 거쳐 질산염과 아질산염으로 전환될 수 있다.[6] 이 과정은 ''니트로소모나스'', ''니트로박터'', ''니트로솔로부스'', ''니트로스피라'' 등에서 흔히 볼 수 있는 독립 영양의 한 형태이다.
질산염과 아질산염은 질소 동화 작용을 통해 다시 암모늄 이온으로 환원될 수 있으며,[10] 환원된 암모늄 이온은 단백질과 DNA 합성에 이용된다.[11]
질산화가 느리거나 억제되는 저산소 토양에서는 암모늄 이온이 축적될 수 있다.[12] 균근은 식물과 균류 간의 공생 관계에서 암모늄 이온 이동의 주요 요인 중 하나이다.[13]
6. 1. 인간에 대한 영향
최근 몇 년 동안 가축 배설물의 휘발과 비료 사용량 증가로 인해 대기 중 암모늄 침착량이 증가했다.[16] 순 일차 생산이 종종 질소에 의해 제한되기 때문에 암모늄 수준의 증가는 이에 의존하는 생물 군집에 영향을 미칠 수 있다. 예를 들어, 질소 함량의 증가는 식물 성장을 증가시키는 것으로 나타났지만, 토양 인 수준을 악화시켜 미생물 군집에 영향을 미칠 수 있다.[17]7. 금속
암모늄 양이온은 무거운 알칼리 금속 양이온과 매우 유사한 성질을 가지며, 종종 가까운 등가물로 간주된다.[18][19][20] 암모늄은 매우 높은 압력 하에서, 예를 들어 거대 행성인 천왕성과 해왕성의 내부와 같이, 금속(전자 바다 속의 이온)으로 작용할 것으로 예상된다.[19][20]
일반적인 조건에서는 암모늄은 순수한 금속으로 존재하지 않지만, 아말감( 수은과의 합금)으로는 존재한다.[21]
참조
[1]
RedBook
[2]
논문
Chapter 12 - The Global Cycles of Nitrogen, Phosphorus and Potassium
https://www.scienced[...]
Academic Press
2024-03-08
[3]
웹사이트
Pseudo-binary compounds
http://www.hull.ac.u[...]
2007-10-12
[4]
백과사전
Ammonium Salts
http://www.vias.org/[...]
[5]
논문
Chapter 12 - The Global Cycles of Nitrogen, Phosphorus and Potassium
https://www.scienced[...]
Academic Press
2024-03-08
[6]
논문
Microbiological regulation of the biogeochemical nitrogen cycle / Regulación microbiana del ciclo bíogeoquímico del nitrógeno
https://www.jstor.or[...]
1982
[7]
논문
The Nitrogen Balance of Arctic Tundra: Pathways, Rates, and Environmental Implications
https://acsess.onlin[...]
1975-01
[8]
논문
Seasonal patterns of ammonium and nitrate uptake in nine temperate forest ecosystems
https://doi.org/10.1[...]
1984-10-01
[9]
서적
Biology
http://archive.org/d[...]
San Francisco : Benjamin Cummings
2002
[10]
논문
Assimilatory and Dissimilatory Nitrate Reduction: Perspectives and Methodology for Simultaneous Measurement of Several Nitrogen Cycle Processes
https://www.jstor.or[...]
1981
[11]
논문
Arginine and nitrogen storage
https://www.scienced[...]
2008-12-01
[12]
논문
Constrained preferences in nitrogen uptake across plant species and environments
https://onlinelibrar[...]
2011-03
[13]
논문
Arbuscular mycorrhiza and nitrogen: implications for individual plants through to ecosystems
https://doi.org/10.1[...]
2015-01-01
[14]
논문
Ammonia and ammonium fluxes between photolithotrophs and the environment in relation to the global nitrogen cycle
https://nph.onlineli[...]
1992-05
[15]
논문
Root growth as a function of ammonium and nitrate in the root zone
https://onlinelibrar[...]
1993-03
[16]
논문
Global Estimates of Inorganic Nitrogen Deposition Across Four Decades
https://agupubs.onli[...]
2019-01
[17]
논문
Effects of Nitrogen Addition on Plant Properties and Microbiomes Under High Phosphorus Addition Level in the Alpine Steppe
2022-06-20
[18]
서적
Inorganic Chemistry
Academic Press/De Gruyter
[19]
논문
Does metallic ammonium exist?
1975-11-20
[20]
논문
Metallic Ammonium
1954-02-03
[21]
논문
Lecture demonstration of ammonium amalgam
1929-10-01
[22]
문서
代置命名法においては、NH4+はアザニウム(azanium)と呼ばれる。
[23]
웹사이트
Pseudo-binary compounds
http://www.hull.ac.u[...]
[24]
백과사전
Ammonium Salts
http://www.vias.org/[...]
[25]
서적
Biology
Pearson Education, Inc
[26]
논문
NH4+ toxicity in higher plants: a critical review
http://www.utsc.utor[...]
[27]
서적
Inorganic Chemistry
Academic Press
[28]
논문
Does metallic ammonium exist?
https://www.nature.c[...]
Nature Publishing Group
2012-01-13
[29]
논문
Metallic Ammonium
https://articles.ads[...]
Wiley-Blackwell for the Royal Astronomical Society
2012-01-13
[30]
RedBook
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
