유전체 편집
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
유전체 편집은 생명체의 DNA를 인위적으로 변형하는 기술로, 1990년대에 초기 기술이 개발된 이후 메가뉴클레아제, 아연 핑거 뉴클레아제, TALEN, CRISPR/Cas9 시스템 등의 발전을 거쳐왔다. 2010년대 이후 CRISPR/Cas9 기술의 등장으로 유전체 편집 연구가 활발해졌으며, 인간 배아 유전자 조작, 유전자 편집 동·식물 개발 등 다양한 분야에 응용되고 있다. 유전체 편집 기술은 DNA 이중 가닥 절단 후 세포의 수선 기작을 활용하며, ZFN, TALEN, CRISPR/Cas9 등 다양한 조작된 핵산분해효소를 이용한다. 현재, 유전체 편집 기술은 농작물 개량, 질병 치료, 모델 동물 제작 등 다양한 분야에 적용되고 있으며, 기술 발전과 함께 윤리적 문제 및 안전성 문제에 대한 사회적 논의가 활발하게 진행되고 있다.
더 읽어볼만한 페이지
| 유전체 편집 |
|---|
2. 역사
유전체 편집은 1990년대에 개척되었으며,[3] 이는 현재 널리 사용되는 뉴클레아제 기반 유전자 편집 플랫폼이 등장하기 전이었으나, 편집 효율이 낮아 사용에 제한이 있었다. 유전 공학은 1972년 폴 버그 등이 세균에 감염되는 바이러스의 DNA를 원숭이에 감염되는 바이러스의 DNA에 삽입하는 데 성공하면서 시작되었다.[105] 1973년에는 허버트 보이어와 스탠리 노먼 코헨이 이 기술을 생물 종에도 적용했다.[106] 1970년대 후반에는 유전자 공학에 의한 인슐린 대량 생산이 이루어졌다. 그러나 이러한 기존 유전자 공학에는 특정 유전자를 조작하는 정확성이 떨어지고, 유전자 배열이나 생물 종에 의존하지 않는 보편적인 적용이 어렵다는 두 가지 큰 과제가 있었다.
유전체 편집의 핵심은 DNA 이중 가닥 절단(Double Strand Break, DSB)과 그 수선 메커니즘을 이해하는 것이다. DNA 이중 가닥 절단은 DNA 두 가닥 사이의 약한 수소 결합을 분해하는 특정 효소의 작용으로 일어난다. 이중 가닥 절단의 수선에는 크게 두 가지 경로가 있다. 상동재조합(Homologous Recombination, HR)과 비상동말단연결(Non-homologous end joining, NHEJ)이다. 이들은 모두 DNA 수선 기작이지만, 발생하는 시기가 다르다.[206]
1990년대에 들어와 DNA를 특정 위치에서 절단할 수 있는 단백질인 제한 효소가 발전하면서 정확성 문제는 해결되었다. 응용성 문제 또한 2005년 이후 각종 게놈 편집 기술이 등장하면서 해결되었다. 2011년 네이처 메서드는 엔지니어링된 뉴클레아제를 이용한 유전체 편집, 즉 아연 핑거 뉴클레아제(ZFN), 전사 활성자 유사 효과기 뉴클레아제(TALEN), 엔지니어링된 메가뉴클레아제의 3가지 주요 효소 종류를 올해의 방법으로 선정했다.[4]
2012년 8월, 엠마뉘엘 샤르팡티에와 제니퍼 다우드나 등은 CRISPR가 원핵생물의 게놈 편집에도 활용될 수 있다는 것을 발견했다.[107] 그들은 연쇄구균의 RNA를 CRISPR의 가이드 RNA로 활용하는 데에도 성공하여, CRISPR/Cas9를 이용한 고효율 게놈 편집을 가능하게 했다. 진핵생물 게놈 편집에 CRISPR/Cas9를 응용한 것은 펑 장이 처음이며, 그는 관련 기술 특허를 취득했다.[108] CRISPR-Cas 시스템은 사이언스에서 2015년 올해의 획기적인 기술로 선정되었다.[5]
2014년, 중국에서 CRISPR/Cas9를 이용한 세계 최초의 유전자 변형 원숭이가 탄생했다.[109] 다음 해인 2015년, 중국에서 CRISPR/Cas9를 사용한 세계 최초의 인간 수정란 유전자 조작이 이루어져 국제적인 논란을 일으켰다.[100][110] 이 실험을 주도한 황쥔지우(Junjiu Huang)는 불임 치료 목적의 체외 수정에서 두 개의 정자가 수정된 이상 수정란을 사용했으며, 이는 원래 폐기될 예정이었다. 황쥔지우의 보고에 따르면, 목표 유전자를 의도대로 바꾼 것은 86개 중 4개뿐이었고, 오프 타겟(off-target) 효과가 발생한 수정란도 있어 기술적 개선의 필요성이 제기되었다.[111] 황쥔지우는 Nature에서 선정한 2015년의 10인에 포함되었다.[112] 이 연구를 계기로 인간 수정란에 대한 게놈 편집의 윤리 문제가 새로운 과제로 떠올랐다.[113]
2016년, 중국 정부는 제13차 5개년 계획에서 게놈 편집을 국가 전략으로 설정했고, 같은 해 두 번째 인간 수정란 게놈 편집도 중국에서 이루어졌다.[114] 2016년 10월에는 세계 최초의 게놈 편집 임상 시험이,[115][116] 2017년 3월에는 세계 최초의 "정상적인" 인간 수정란에 대한 게놈 편집이[117] 중국에서 이루어졌다. 2018년에는 중국에서 86명의 유전자가 CRISPR/Cas9에 의해 변형되었다.[118] 같은 해 11월 26일, 난팡 과학기술대학의 허젠쿠이 부교수는 게놈 편집된 쌍둥이 여자아이 Lulu and Nana|루루와 나나영어의 탄생을 발표했다. 그는 게놈 편집이 후천성 면역 결핍 증후군(AIDS)에 대한 내성을 갖게 하기 위한 것이라고 주장했지만, 이는 세계적인 파문을 일으켰다.[119][120]
2018년에는 엔지니어링된 뉴클레아제, 즉 "분자 가위"가 유전체 편집의 일반적인 방법으로 사용되었다. 이러한 뉴클레아제는 유전체의 원하는 위치에 특정 위치의 이중 가닥 절단(DSB)을 생성한다. 유도된 이중 가닥 절단은 DNA 복구 과정에서 비상동 말단 연결(NHEJ) 또는 상동 재조합(HR)을 통해 표적 돌연변이(편집)를 발생시킨다.
2019년 5월, 중국의 변호사들은 허젠쿠이가 주장한 최초의 유전자 편집 인간 생성과 관련하여, CRISPR과 같은 유전자 편집 기술로 인간 유전체를 조작하는 사람은 관련 부작용에 대해 책임을 져야 한다는 규정을 초안하고 있다고 보고했다.[11]
에든버러 대학교 로슬린 연구소는 연간 26억달러의 비용이 발생하는 돼지 생식기 및 호흡기 증후군을 유발하는 바이러스에 저항하는 유전자 편집 돼지를 개발했다.[13]
2020년 2월, 미국 임상 시험에서 3명의 암 환자를 대상으로 한 CRISPR 유전자 편집이 안전하게 수행되었음을 보여주었다.[14] 같은 해, 이완을 촉진한다고 알려진 아미노산을 더 많이 생성하는 토마토 품종인 시칠리아 루즈 하이 GABA가 일본에서 판매 허가를 받았다.[13]
2021년, 잉글랜드 (영국 전체가 아님)는 유전자 편집 식물과 동물에 대한 규제를 완화하여, 유럽 연합(EU) 규정을 준수하는 규정에서 미국 및 기타 일부 국가와 더 유사한 규칙으로 전환할 계획을 세웠다. 같은 해 4월, 유럽 위원회 보고서는 현재의 규제 체제가 유전자 편집에 적합하지 않다는 "강한 징후"를 발견했다.[13]
3. DNA 이중가닥 절단과 수선
비상동말단연결은 주로 세포 주기 중 G1 시기에 일어나며, 오류를 일으키기 쉬운 수선 방식이다. 마이코박테리아 (mycobacteria)의 이중 가닥 절단부에서 50% 확률로 돌연변이를 유발하며, 백혈병에서 변이 축적과 관련이 있다고 알려져 있다.[207][208] 이 방식은 다양한 효소를 이용하여 이중 가닥 절단의 끝을 직접 연결한다. DNA 이중 가닥 절단 말단에 Ku70/80 이형다량체가 붙고, 이 복합체는 DNA-PKcs를 불러들인다. DNA-PKcs는 자기인산화를 통해 Artemis가 DNA 끝을 가공하게 하고, XRCC4/DNA ligase IV 복합체가 DNA 양 끝을 이어붙여 수선을 완료한다.[206]
반면, 상동재조합은 DNA가 복제되는 S기나 G2기에 주로 일어나며, 상동성 있는 서열을 가진 DNA 공여체를 주형으로 사용하기 때문에 원하는 변이를 정확하게 만들어낼 수 있다. DNA 이중 가닥 절단이 일어나면 PARP1이 절단 부위에 붙고, MRN 복합체(MRE11, Rad50, Nbs1)를 불러들인다. MRN 복합체는 DNA 이중 가닥 말단에 붙고, 인산화된 CtIP를 불러들인다. CtIP는 MRE11의 앤도뉴클레아제 부분을 활성화시키고, BRCA1, BARD1과 함께 상동재조합 초기 단계를 중재한다. 활성화된 MRE11는 3' 말단의 짧은 단일 가닥 DNA 꼬리를 만들고, EXO1과 DNA2/BLM은 광범위한 절단을 통해 긴 ssDNA 가닥을 만든다. 생성된 ssDNA에 RAD51이 붙어 DNA 가닥 사이의 침입을 통해 상동재조합을 유도한다.[206]
상동재조합을 기반으로 하는 유전체 편집은 유전자적중법과 유사하지만, 이중 가닥 절단이 만들어지고 상동재조합 기반 수선이 일어날 때 재조합 빈도가 1000배 가량 높아진다. 이는 보다 효율적이고, positive, negative 선별과정을 필요로 하지 않기 때문이다.[209]
결론적으로, 유전체 내 특정 위치에 이중 가닥 절단을 만들면 세포의 자체적 수선 기작을 활용하여 원하는 변이를 얻을 수 있다.
4. 조작된 핵산분해효소
조작된 핵산분해효소는 유전체 편집에 사용되는 효소로, 특정 DNA 서열을 인식하고 절단하여 유전자 편집을 가능하게 한다.
1980년대 후반에 발견된 메가뉴클레아제는 긴 DNA 서열(14~40 염기쌍)을 인식하고 절단하는 앤도뉴클레아제 효소이다.[210][211] 인식 서열이 매우 길어(>14bp) 특이성이 높지만, 유전체 내 모든 서열을 대상으로 하기에는 부족하다는 단점이 있다.[211] 이를 극복하기 위해 특정 서열을 인식하도록 변형된 메가뉴클레아제 변종을 만들거나,[211] 다양한 메가뉴클레아제들을 섞어 새로운 서열을 인식하는 잡종 효소를 만들기도 하였다.[212]
징크핑거 뉴클레아제(ZFN)와 TALEN 기술은 염기서열 비특이적인 DNA 절단 도메인을 기반으로 하며, 이 DNA 절단 도메인은 DNA 인식 펩타이드(징크핑거, 탈렌(TALEs, transcription activator-like effectors))와 연결될 수 있다.[213] 징크핑거 뉴클레아제는 비특이적인 DNA 절단 도메인과 징크핑거 모티프의 DNA 결합 도메인을 결합하여 이용하는 기술이다. 징크핑거 모티프는 여러 전사 인자에서 발견되며, 아연 이온을 포함하여 3차원 구조 형성에 중요한 역할을 한다. 징크핑거의 c-말단 부분은 DNA 서열을 특이적으로 인식한다.
일반적으로 징크핑거 뉴클레아제는 두 개의 DNA 결합 단백질(3~6개의 zinc finger 포함)과 핵산분해효소인 Fok1의 제한 도메인을 결합시킨다. 두 단백질은 몇 개의 뉴클레오타이드가 떨어져 있는 두 개의 DNA 서열을 인식한다. Fok1은 핵산분해효소 활성을 갖기 위해 이량체가 필요하며, 각 핵산분해효소 파트너가 독특한 DNA 염기 서열을 인식함에 따라 특이성이 증가한다.[215][216]
TALEN은 전사 활성화 인자 유사 이펙터 뉴클레아제(Transcription Activator-Like Effector Nuclease)라고도 불린다. 제한 효소인 Fok1을 DNA 절단 도메인으로 하고, 식물 병원성 세균 크산토모나스속(Xanthomonas)에서 분비되는 TALE 단백질의 DNA 결합 도메인을 융합시킨 인공 효소이다.[134][135] TALE 단백질로 구성된 DNA 결합 도메인은 34개 정도의 아미노산 반복 구조를 가지는데, 이 반복 단위를 모듈이라고 한다. 그중에서 아미노산 12번째와 13번째가 가변적으로 되어 있으며, 표적 서열과 결합하는 부분으로 "반복 가변 이잔기"(RVD)라고 불린다. TALEN은 FokI가 절단 활성을 나타내기 위해서는 적절한 거리를 유지하여 이량체를 형성해야 한다.[134][136]
징크핑거 뉴클레아제와 탈렌 구조의 핵산분해효소는 비슷한 성질을 가지고 있지만, DNA를 인식하는 펩타이드에 차이가 있다. 징크핑거 뉴클레아제는 Cys2-His2, 탈렌은 탈이펙터(Transcription activator-like effector)의 구조에 의존한다.[217]
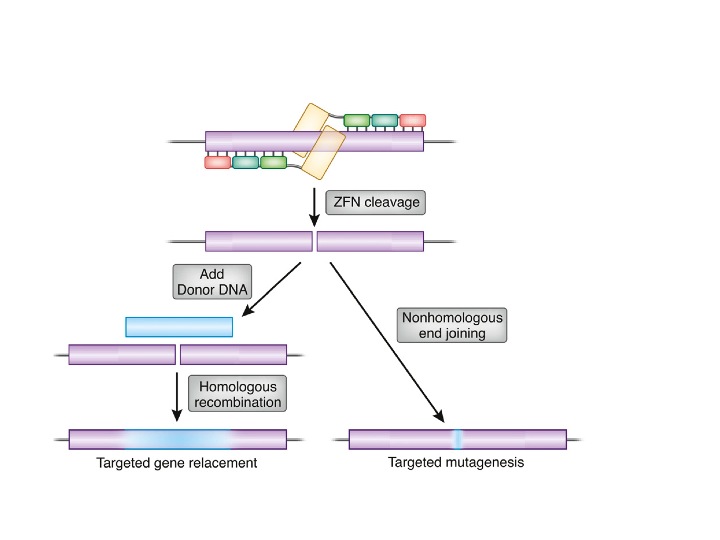
ZFN, TALEN, CRISPR/Cas9는 특정 염기 서열을 표적으로 DNA를 절단하여 의도적인 DNA 개변을 가능하게 한다. DNA 절단 후에는 세포의 원래 기능에 의해 DNA 수복이 일어난다. 이때 특정 염기 서열을 단편으로 제공하면 절단 부위에 삽입하는 녹인이 가능하며, 녹인을 하지 않고 수복을 하더라도 염기 서열이 변하지 않는 한 DNA 절단이 반복되므로 변이가 발생하여 특정 유전자의 기능을 멈추는 녹아웃에도 활용된다.
4. 1. 크리스퍼 유전자 가위 (CRISPR-Cas9)
CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats, 규칙적으로 간격을 둔 짧은 회문 반복 서열)는 박테리아가 바이러스로부터 보호하기 위해 사용하는 일종의 획득 면역과 같은 유전 요소이다.[38] Cas (CRISPR 관련 단백질)는 이러한 서열을 처리하고 일치하는 바이러스 DNA 서열을 절단한다.[38] Cas 유전자와 특별히 구성된 CRISPR를 포함하는 플라스미드를 진핵 세포에 도입함으로써, 진핵 세포 게놈은 원하는 위치에서 절단될 수 있다.[38]
원핵생물에서 발견된 획득 면역 기구를 CRISPR/Cas 시스템이라고 한다. 이 시스템 중, Cas9라고 불리는 뉴클레아제와, 표적이 되는 DNA 서열로 이끄는 가이드 RNA를 복합화하여, 이를 DNA의 개변에 응용한 기술을 CRISPR/Cas9라고 한다.
ZNF, TALEN이 각각 하나의 단백질인 것에 반해, CRISPR/Cas9에서는 가이드 RNA와 Cas9라는 2개의 별개의 분자로 구성되는 것이 특징적이다. DNA의 표적 부위와 상보적인 서열을 가이드 RNA에 준비하므로, 가이드 RNA는 표적 부위에 특이적으로 결합할 수 있다. 그러면 가이드 RNA와 DNA를 덮듯이 Cas9 단백질이 결합하여, DNA를 절단한다. Cas9 자체는 재사용이 가능하며, 목표에 따라 가이드 RNA만 생성하면 된다.[122]
CRISPR/Cas9는 다른 뉴클레아제 중에서 부위 특이성이 낮고, 그에 따른 오프 타겟 문제가 과제이다. 오프 타겟의 많고 적음은 DNA 수복 기구가 비상동 말단 결합 (NHEJ) 또는 상동 재조합 수복 (Homology Directed Repair: HDR) 인가에 따라서도 다르다.[122] HDR가 NHEJ보다 오프 타겟에 대해 더 안전하지만, 더 많은 수고가 들고 서로 사용 조건이 제한된다. 이를 극복하기 위해 니커제 개변형 Cas를 사용하여 표적마다 2종류의 가이드 RNA를 제공하는 방법이 개발되었다.[102][123] 또한, NHEJ와 HDR의 경쟁 개선 수단으로서 NHEJ 억제제인 SCR7[124], HDR 촉진제인 L755,507[125]이 있으며, 반대로 NHEJ 촉진제로는 Azidothymidine (AZT)[125]가 있다.
게놈 편집 대상인 핵 내 DNA에 접근하기 위해 Cas9와 가이드 RNA를 세포 내, 더 나아가 핵 내로 도입해야 한다. 이를 위한 도입 매체, 즉 벡터로서 플라스미드나 바이러스가 사용된다.[126] 플라스미드나 벡터를 거치지 않고 직접 단백질 형태로 도입[127]하는 방법으로는 일렉트로포레이션법이 있다.[128] 2015년 현재 기술 수준에서는 어떤 도입 수단이 효율이 높은지 단정할 수 없는 경우가 많아 실험적으로 확인하는 경우가 많다. 또한, 플라스미드에 대해서는 비영리 리포지토리가 존재한다.[129]
가이드 RNA 설계 도구 및 라이브러리라고 불리는 제품이 각 회사에서 판매되고 있다.[128][130] 국내에서는 라이프 사이언스 통합 데이터베이스 센터 (DBCLS)가 [http://crispr.dbcls.jp/ CRISPRdirect]라는 가이드 RNA 설계 도구를 제공하고 있다.[131][132]
올바르게 서열이 도입되었는지, 그리고 여분의 삽입이나 결실이 없는지 확인하기 위한 프로토콜이 제안되었으며, 검증용 제품도 판매되고 있다.[128][133]
5. 유전체 편집 기술의 응용
지난 수십 년 동안, 효율적인 유전체 편집 기술은 식물에서 동물에 이르기까지 다양한 범위에서 발전해왔으며, 임상적 관심을 넘어 연구실의 표준 실험 전략으로 자리 잡고 있다.[225] 유전체 편집은 유전자 기능 연구, 질병 모델 동물 제작, 유전 질환 치료, 품종 개량 등 다양한 분야에 응용될 수 있다.
조작된 핵산분해효소를 이용한 유전체 편집은 식물이나 동물의 유전자 기능 연구에서 인간의 유전자 치료에 이르기까지 생명과학의 많은 분야에 기여할 것으로 기대된다. 예를 들어, 세포나 유기체가 고유 기능을 하도록 조작하는 것을 목적으로 하는 합성 생물학 분야에서, 조작된 핵산분해효소는 유전인자의 첨가나 제거에 이용될 수 있으며, 이는 복잡한 시스템을 만드는 데 기여할 수 있다.[225]
일반적인 유전자 편집은 DNA 이중 가닥 절단 (DSB) 복구 메커니즘에 의존한다. DSB를 복구하는 주요 경로는 비상동 말단 결합 (NHEJ)과 상동 재조합 (HDR)이다. NHEJ는 DNA 말단을 직접 연결하고, HDR은 상동 서열을 템플릿으로 사용하여 절단 지점의 DNA 서열을 재생성한다. HDR 기반 유전자 편집은 상동 재조합 기반 유전자 표적화와 유사하지만, 재조합 속도가 최소 3배 이상 증가한다.[20]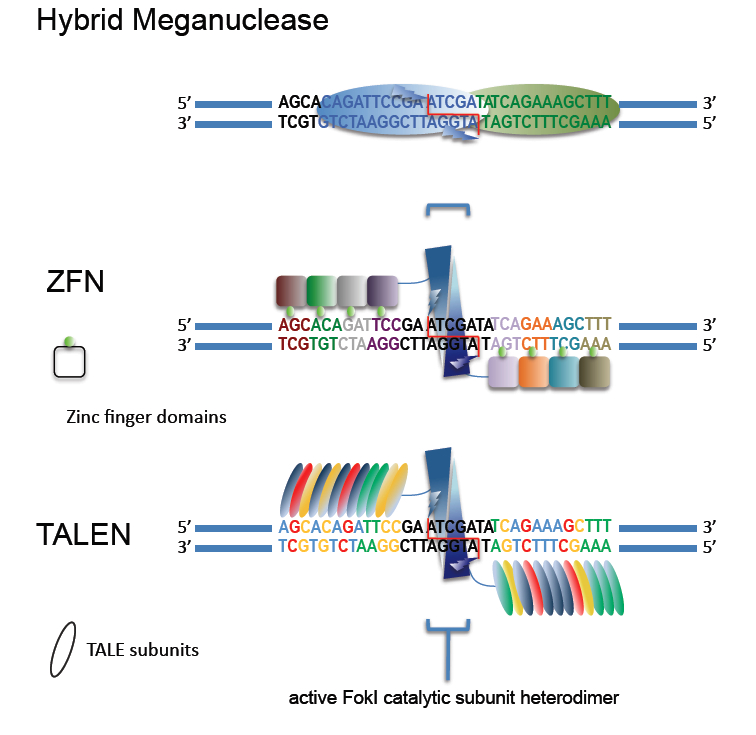
유전체 편집의 핵심은 유전체의 특정 지점에서 DSB를 생성하는 것이다. 이를 위해 아연 핑거 뉴클레아제(ZFNs), 전사 활성자 유사 이펙터 뉴클레아제(TALEN), 메가뉴클레아제, CRISPR/Cas9 시스템 등이 사용된다.
메가뉴클리에이스(Meganuclease),[52] ZFN, 그리고 TALEN을 이용한 유전자 편집은 식물에서 유전자 조작을 위한 새로운 전략을 제공하며, 내생 유전자를 수정하여 원하는 식물 형질을 엔지니어링하는 데 도움을 줄 가능성이 높다.
최근에는 유전자 편집 기술과 소 번식 기술의 발전으로 수정된 난모세포에서 직접 유전자 편집이 가능해졌다. 특히 CRISPR/Cas9 시스템은 포유류 접합자에 대한 세포질 직접 주사(CDI)를 통해 한 번에 여러 가이드 RNA를 사용하여 동시 녹아웃(KO)을 가능하게 한다.[48]
유전자 편집은 양식업의 대서양 연어와 같은 특정 유형의 물고기에 적용될 수 있다. 성장, 질병 저항성, 불임, 통제된 번식 및 색상 조절과 같은 특성을 개선하여 지속 가능한 환경과 물고기 복지를 개선할 수 있다.[49] 아쿠아어드밴티지 연어는 AquaBounty Technologies에서 개발한 유전자 변형 대서양 연어이다. 대서양 연어의 성장 호르몬 조절 유전자는 태평양 친 연어의 성장 호르몬 조절 유전자와 대서양 멸치에서 유래한 프로모터 서열로 대체되었다.[50]
단일 세포 전사체학, 유전자 편집 및 새로운 줄기 세포 모델의 병렬 개발 덕분에, 기능 유전학이 동물 모델에 국한되지 않고 인간 샘플에서 직접 수행될 수 있게 되었다. 전사체 데이터를 실험 지침으로 사용하여 CRISPR 기반 유전자 편집 도구는 인간 환경에서 기능을 규명하기 위해 핵심 유전자를 파괴하거나 제거할 수 있다.[51]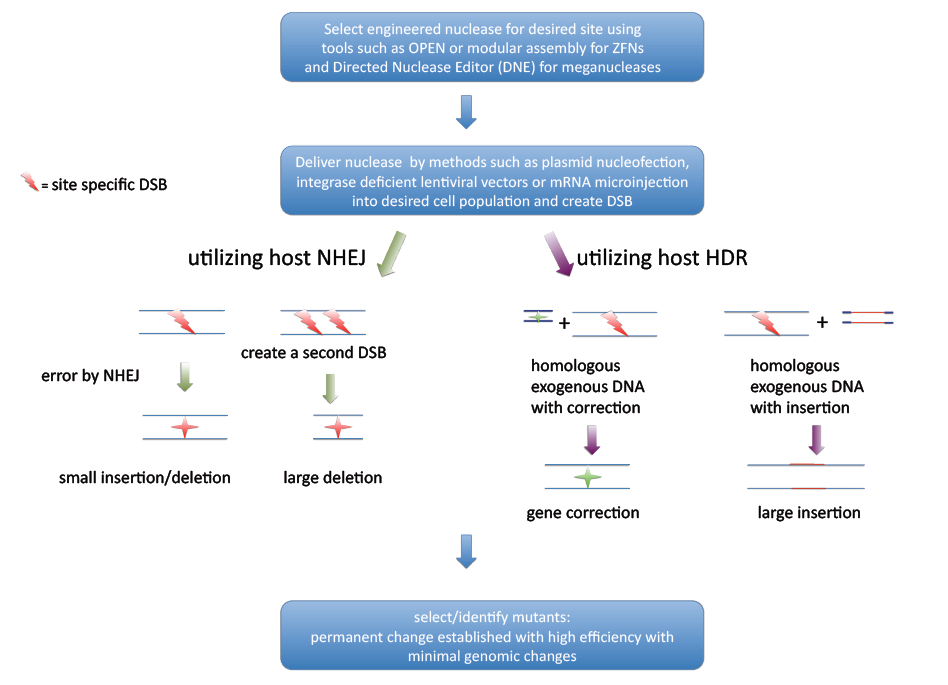
작물 개선에 유전자 편집 기술을 성공적으로 적용한 사례는 바나나에서 찾을 수 있다. 과학자들은 CRISPR/Cas9 편집을 사용하여 바나나의 B 게놈(''Musa'' spp.)에서 내생 바나나 줄무늬 바이러스를 비활성화하여 바나나 번식의 주요 과제를 극복했다.[57]
또한, TALEN 기반 유전자 엔지니어링은 식물에서 사용하기 위해 광범위하게 테스트되고 최적화되었다.[58] TALEN 융합은 미국의 식품 성분 회사인 Calyxt[59]에서 콩기름 제품의 품질을 개선하고[60] 감자의 저장 잠재력을 증가시키는 데 사용되었다.[61]
식물에서 CRISPR/Cas9의 일반적인 전달 방법은 ''Agrobacterium'' 기반 형질전환이다.[63] T-DNA는 T4SS 메커니즘에 의해 식물 게놈에 직접 도입된다. Cas9 및 gRNA 기반의 발현 카세트는 식물 적용을 위해 ''Agrobacterium''에서 형질전환되는 Ti 플라스미드로 전환된다.[63] 살아있는 식물에서 Cas9 전달을 개선하기 위해 바이러스가 더 효과적인 유전자 전달에 사용되고 있다.[63]
이상적인 유전자 치료는 결함이 있는 유전자를 정상 대립 유전자로 자연 위치에서 대체하는 것이다. 이는 바이러스로 전달되는 유전자보다 유리한데, 유전자의 작은 부분만 변경하면 되는 경우가 많으므로 전체 코딩 서열과 조절 서열을 포함할 필요가 없기 때문이다.[64][65]
TALEN 기반 유전자 편집의 첫 번째 임상 사용은 2015년 11개월 된 어린이의 CD19+ 급성 림프구성 백혈병 치료에 있었다. 변형된 공여 T세포는 백혈병 세포를 공격하고, 알렘투주맙에 저항하며, 도입 후 숙주 면역 체계에 의한 감지를 피하도록 설계되었다.[66][67]
CRISPR-Cas9를 사용하여 다운 증후군, 이분 척추, 무뇌증, 터너 증후군, 클라인펠터 증후군과 같은 유전 질환을 일으키는 유전적 돌연변이를 교정하기 위한 연구가 세포와 동물에서 광범위하게 진행되어 왔다.[68]
2019년 2월, 캘리포니아주 리치먼드에 본사를 둔 상가모 테라퓨틱스(Sangamo Therapeutics)의 의학 과학자들은 DNA를 영구적으로 변경하는 최초의 "체내" 인간 유전자 편집 치료법을 헌터 증후군 환자에게 적용했다고 발표했다.[69] 아연 핑거 뉴클레아제(Zinc finger nuclease, ZFN)를 사용한 유전자 편집과 관련된 상가모의 임상 시험이 진행 중이다.[70]
연구자들은 유전자 드라이브 CRISPR-Cas9를 사용하여 말라리아 매개체인 ''A. gambiae''의 불임과 관련된 유전자를 변형시켰다.[71] 이 기술은 황열, 뎅기열, 지카와 같은 다른 매개체 전염병을 근절하는 데 추가적인 영향을 미친다.[72]
CRISPR-Cas9 시스템은 임상 유전자형 또는 역학적 분리주를 표적으로 하여 모든 세균 종의 집단을 조절하도록 프로그래밍할 수 있다. 병원균을 제거하여 유익한 세균 종이 유해한 종보다 선택적으로 활성화될 수 있으며, 이는 광범위 항생제보다 유리하다.[46]
HIV, 헤르페스 및 B형 간염 바이러스와 같은 인간 바이러스를 표적으로 하는 치료법에 대한 항바이러스 응용 프로그램이 연구 중에 있다. CRISPR는 바이러스 또는 숙주를 표적으로 하여 바이러스 세포 표면 수용체 단백질을 암호화하는 유전자를 파괴하는 데 사용할 수 있다.[44]
2019년 1월, 중국 과학자들은 최초의 복제 원숭이인 중중과 화화와 돌리 양에 사용된 것과 동일한 복제 기술과 최초의 유전자 변형 인간 아기인 루루와 나나를 만드는 데 허젠쿠이가 사용했다고 주장하는 동일한 유전자 편집 Crispr-Cas9 기술을 사용하여 다섯 마리의 동일한 복제된 유전자 편집 원숭이를 만들었다고 보고했다. 원숭이 복제는 여러 의학 질환을 연구하기 위해 만들어졌다.[74][75]
유전체 편집 기술은 다음과 같은 다양한 분야에 응용될 수 있다.
- 농작물, 가축, 양식[145](GM 작물도 참조)
- 벼 (CRISPR)[146]
- 돼지 (Platinum TALEN)[147]
- 소
- 참돔 (CRISPR)[148]
- 참복[149]
- 멸치 (TALEN, CRISPR)[150]
- 토마토 (CRISPR)[151]
- 인간 질환의 치료[97]
- 질환의 모델 동물 제작[97]
- 스크리닝에 의한 유전자 기능 해석 및 신약 개발 (CRISPR)[165][166]
- 유전자 드라이브 (유전자 공학에 의한 종의 개변)
- 말라리아의 근절 (CRISPR)[167]
- 뎅기열의 근절[168]
- 라임병의 근절[168]
- 주혈 흡충증의 근절[168]
- 바이오 연료[145]
2021년 9월 15일, 유전자 편집 기술을 사용하여 품종 개량한 토마토의 판매가 인터넷상에서 시작되었다. 유전자 편집을 한 식품의 일반 판매는 일본 국내에서 처음이다.[169]
2021년 9월 17일, 유전자 편집 기술을 사용하여 살이 잘 오르게 한 참돔이 "유전자 편집 식품"으로 국가에 신고되었다. 유전자 편집 식품의 신고는 2020년 12월, "GABA"의 축적량을 통상보다 약 5배 높인 토마토에 이어서 2번째 사례이다.[170]
2021년 10월 29일, 교토 대학 발 바이오 기업이 유전자 편집으로 성장 속도를 빠르게 한 참복을 유전자 편집 식품으로 국가에 신고하고 예약 판매를 시작했다.[171]
인간의 수정란 등 생식 세포에 응용될 수 있고, 디자이너 베이비[172]로 이어질 수 있다는 윤리적인 우려가 제기되었지만[173], 착상시키는 조작이 국제적인 학회의 합의에 의해 자율 규제되게 되었다.[174]
2015년 12월 미국 워싱턴 D.C.에서 열린 제1회 인간 게놈 편집에 관한 국제 회의(International Summit on Human Genome Editing)에서는, 같은 해 4월 중국에서 행해진 인간 배아의 유전자 조작을 염두에 두고, 현 시점에서 수정란에 게놈 편집을 하여 아이를 출산하는 것은 무책임하다며 해서는 안 된다는 생각을 표명했다.[191][176]。 하지만, 2018년 11월 홍콩에서 개최된 제2회 회의에서, 중국의 연구자가 세계 최초로 게놈을 편집한 아기를 만들었다고 주장하여 세계에 충격을 주었고,[177] 일본 의사회와 일본 의학회 등 일본 및 각국의 학회도 이 행위를 비난하는 사태가 벌어졌다.[180] 같은 날, 중국 과학기술성은 유전자 편집 실험 관여자에 대한 활동 중지 명령을 내렸고,[181], 그 후 중국 당국의 조사에서 임상 실험과 아기의 실존이 확인되어 아기는 광둥성 정부의 의학적 감시하에 놓이게 되었다.[182] 이를 받아, 같은 해 12월 세계 보건 기구(WHO)는 게놈 편집의 국제 기준 제정을 목표로 게놈 편집의 문제점을 검증하는 전문 위원회를 설치한다고 발표했다.[185][186]。
2018년 11월 시점에서의 각국의 인간 수정란에 대한 게놈 편집에 대한 규제 상황은 다음과 같다.[191]。
- 독일, 프랑스 - 법률에 의해 금지.
- 영국 - 기초 연구는 인정, 모체에 돌려 아이를 출산하는 것은 제한.
- *정상적인 인간 수정란에 대한 게놈 편집이 세계 최초로 실시 가능[187]。
- 미국 - 연구에 미국 연방 정부의 자금 투입을 금지, 기부 등의 연구 자금으로는 가능.
- 중국 - 국가 지침으로 아이를 출산하는 것은 금지.
일본 국내에서는, 후생노동성의 가이드라인에 의해 생식 세포와 수정란의 유전자 변형을 착상의 가부를 불문하고 전면적으로 금지하고 있다.[188] 2018년 11월 28일, 생식 보조 의료에 도움이 되는 기초 연구에 한해 허용하는 지침안이 승인되어, 이르면 2019년 4월에도 해금될 예정이다.[191]
실제로 환자에 대한 임상 시험을 실시함에 있어서, 환자에게 오프 타겟에 의한 암 등의 위험[193]을 적절하게 설명하고, 설명 진술 동의를 확립할 수 있을지 여부, 또한 오프 타겟의 위험과 환자의 이익의 관계 위에서 적절한 치료로서 성립될 수 있는지 여부가 과제로 되어 있다. 더욱이, 매우 고가의 치료가 될 것으로 예측되는 것도 과제이다.[194][195]
또한, 유전자 변형 작물(GMO)로서의 취급에 대해서도 문제가 발생하고 있다.[196][197] 기존의 GMO와는 달리, 게놈 편집 작물의 경우는 1염기 단위에 가까운 개변이 가능하다. 그로 인해 개변되었음에도 불구하고, 개변의 흔적이 남기 어려운 작물이 생긴다. 이 때문에, 새로운 규제 모델이 제창되고 있다.[198]
대학 등의 연구 기관이나 기업에 소속되지 않은 개인이나 그룹이, 게놈 편집을 포함한 수법으로, 자택 등에서 실험이나 자신의 육체를 대상으로 한 유전자 치료, 애완동물의 유전자 개변 등을 하는 "DIY 바이오", "바이오해킹"이 미국 등에서 확산되고 있다. 게놈 편집 기술이 인터넷을 통해 널리 퍼지고, 필요한 약품이나 기재도 온라인 쇼핑몰에서 입수하기 쉬워지고 있는 것이 배경이며, 규제가 따라가지 못하고 있다.[200]
바이오 테러리즘으로의 응용을 우려하는 목소리도 있다.[201]
5. 1. 대한민국 현황
대한민국에서는 유전체 편집 기술이 농업, 식품, 의료 등 다양한 분야에서 연구 및 활용되고 있다.농촌진흥청은 유전체 편집 기술을 활용하여 병충해에 강하고 수확량이 많은 농작물을 개발하는 연구를 진행하고 있다.[146] 식품의약품안전처는 유전체 편집 식품의 안전성 평가 기준을 마련하고 있으며, 유전자 편집 식품의 안전성 및 표시 제도에 대한 논의도 이루어지고 있다.[170]
의료계에서는 유전 질환 치료와 암 치료 등을 위한 임상 연구가 진행되고 있다.[97] 예를 들어, 근이영양증, 백혈병, AIDS, 관상 동맥 질환 등 다양한 질병에 대한 유전체 편집 치료 연구가 이루어지고 있다.[152][153][154][155][156]
하지만, 유전체 편집 기술의 윤리적 문제와 안전성 문제는 여전히 논란거리다. 특히 인간 배아에 대한 유전자 편집은 디자이너 베이비[172] 탄생으로 이어질 수 있다는 우려가 제기되고 있으며, 국제적인 논의가 진행 중이다.[173][174] 대한민국 정부는 생식 세포와 수정란의 유전자 변형을 착상 여부와 관계없이 전면적으로 금지하고 있지만,[188] 생식 보조 의료에 도움이 되는 기초 연구에 한해 허용하는 방안을 검토하고 있다.[191]
6. 윤리적 문제와 사회적 논의
유전체 편집 기술은 지난 수십 년 동안 식물에서 동물에 이르기까지 다양한 분야에서 발전해 왔으며, 이제는 연구실에서 표준적인 실험 방법으로 자리 잡았다.[225] 이 기술은 유전자 기능 연구부터 인간의 유전자 치료에 이르기까지 생명과학의 여러 분야에 기여할 것으로 기대된다.[225] 예를 들어, 합성 생물학 분야에서는 유전자를 추가하거나 제거하여 세포나 유기체를 조작하는 데 사용될 수 있다.[225]
하지만 유전체 편집 기술은 윤리적, 사회적 문제를 야기할 수 있다. 특히, 인간 유전자 향상에 대한 논의가 활발하게 이루어지고 있다. 일부 트랜스휴머니스트들은 유전자 편집을 통해 인간의 능력을 향상시킬 수 있다고 주장한다.[80][81][82] 예를 들어, 야간 시력이나 후각을 개선하거나, 수면 요구량을 줄이고, 알츠하이머병을 예방하는 등 인지 능력을 향상시킬 수 있다는 것이다.[92][84][85][86]
그러나 이러한 유전자 변형은 예측 불가능한 결과를 초래할 수 있으며, 미래 세대에게까지 영향을 미칠 수 있다는 점에서 윤리적 문제가 제기된다.[92][84] 또한, 유전자 편집 기술이 대량 살상 무기로 악용될 수 있다는 우려도 있다.[89][90][91] 예를 들어, CRISPR과 같은 기술을 사용하여 주요 작물을 파괴하는 역병을 일으키는 해충을 만들 수 있다.[91]
바이오해커들이 유전자 편집 실험을 통해 유전자 변형 생물을 만들어낼 수 있다는 점도 문제로 지적된다.[92][84] 또한, 유전자 드라이브를 야생에 방출할 경우 생태학적 위험을 초래할 수 있다는 우려도 제기되고 있다.[84][94][95]
미국 국립 과학 아카데미와 국립 의학 아카데미는 2017년 보고서에서 유전자 편집 임상 시험을 "엄격한 감독하에 심각한 질병에 대해서만" 허용할 수 있다고 밝혔다.[87][88]
6. 1. 대한민국의 입장
대한민국 정부는 유전체 편집 기술의 잠재적 가치를 인정하면서도, 윤리적 문제와 안전성에 대한 신중한 접근이 필요하다고 강조한다. 더불어민주당은 인간 배아 유전자 편집에 대해 신중한 입장을 유지하며, 사회적 합의가 필요하다고 강조한다. 시민단체들은 유전자 편집 기술의 안전성과 윤리적 문제에 대해 감시하고 비판하는 활동을 전개한다. 대한민국에서는 유전체 편집 기술과 관련된 사회적 논의가 활발하게 진행되고 있으며, 윤리적, 사회적 문제를 최소화하면서 기술 발전을 이루기 위한 노력이 필요하다.7. 전망과 한계
미래에는 유전체 교정에 있어서 핵산분해효소의 안전성과 특이성을 높이기 위한 노력이 주를 이룰 것이다. 예를 들어, 원하지 않는 부분에 교정이 일어나는 오프타겟(Off-target) 현상을 확인할 수 있는 능력이 높아진다면, 이를 막을 수 있는 방법을 고안해낼 수 있을 것이다. ZFNs에 이용되는 아연 핑거(zinc-fingers)는 특이성이 높지 않아 세포 독성이 있을 수 있지만, 절단을 위한 서열을 일부 변형하여 특이성을 높임으로써 독성을 줄일 수 있다.[76]
또한, 데이나 캐롤의 연구에 의하면 조작된 핵산분해효소를 이용하는 과정에서 재조합 및 DNA 수선 기술에 대한 전반적인 이해가 높아졌음을 확인할 수 있었다. 미래에는 2차 타겟을 구별해낼 수 있는 방식이 개발되어 ZFNs를 발현하는 세포로부터 부서진 말단을 인식해내고, 고해상도 염기서열분석을 이용해 그 주변 DNA 서열을 분석해낼 수 있게 될 것으로 전망한다.[65]
전사 활성 인자 유사 핵산 분해 효소(TALEN)는 33개 또는 34개 아미노산 반복 서열을 특징으로 하는 특정 DNA 결합 단백질이다. TALEN은 뉴클레아제의 DNA 절단 도메인을 TALE 도메인에 융합하여 설계된 인공 제한 효소로, 고유한 DNA 서열을 특별히 인식하도록 맞춤화할 수 있다. 이러한 융합 단백질은 살아있는 세포에서 서열 삽입, 삭제, 복구 및 교체와 같은 표적 유전자 변형을 수행할 수 있는 유전자 편집 응용 분야를 위한 쉽게 표적화할 수 있는 "DNA 가위" 역할을 한다.[36] TALEN 표적 인식 시스템은 예측하기 쉬운 코드를 기반으로 하며, 30개 이상의 염기쌍 결합 부위의 길이에 부분적으로 기인하여 표적에 특이적이다. TALEN은 전체 게놈에서 단일 뉴클레오티드의 6개 염기쌍 범위 내에서 수행할 수 있다.[37]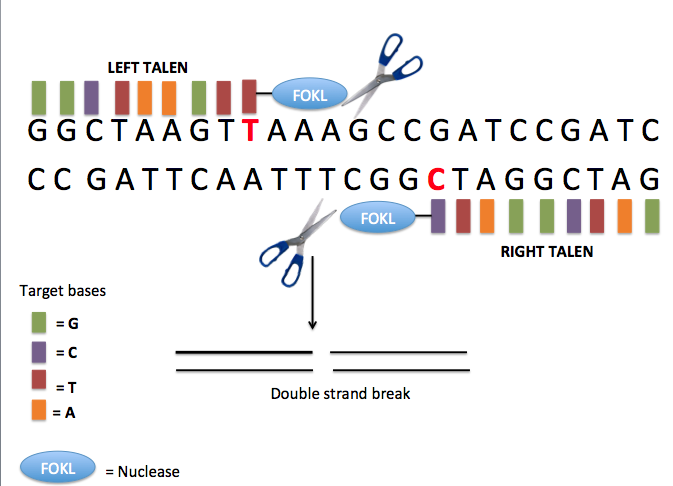
TALEN 구조는 설계된 아연 핑거 뉴클레아제와 유사한 방식으로 사용되며 표적 돌연변이 유발에서 세 가지 장점이 있다. (1) DNA 결합 특이성이 더 높고, (2) 표적 외 효과가 낮으며, (3) DNA 결합 도메인의 구성이 더 쉽다.
CRISPR는 사용 편의성과 비용 효율성 때문에 현재 광범위한 연구가 진행되고 있다. CRISPR의 발견이 비교적 최근임에도 불구하고, 현재 ZFN과 TALEN보다 더 많은 CRISPR 관련 출판물이 있다.[44] CRISPR과 TALEN 모두 정밀성과 효율성 때문에 대규모 생산에 구현하기에 선호되는 선택지이다.
유전자 편집은 인공적인 유전자 조작 없이 자연적인 과정으로도 발생한다. 유전자 코드를 편집할 수 있는 능력 있는 에이전트는 바이러스 또는 바이러스보다 작은 RNA 에이전트이다.[226]
GEEN은 역유전학에서 다른 많은 방법보다 효율성이 높지만, 여전히 효율성이 높지 않다. 많은 경우, 처리된 개체군의 절반 미만이 원하는 변화를 얻는다.[53] 예를 들어, 돌연변이를 생성하기 위해 세포의 NHEJ를 사용하려는 경우, 세포의 HDR 시스템도 더 낮은 돌연변이율로 DSB를 수정하는 작업을 수행한다.
전통적으로, 생쥐는 질병 모델의 숙주로서 연구자들이 가장 흔하게 선택하는 대상이었다. CRISPR는 돼지, 개, 비인간 영장류와 같은 더 큰 동물에서 형질전환 질병 모델을 생성함으로써 이 모델과 인간 임상 시험 간의 격차를 좁히는 데 도움이 될 수 있다.[77][78] CRISPR-Cas9 시스템을 사용하면, 프로그래밍된 Cas9 단백질과 sgRNA를 수정된 유전자를 얻기 위해 수정된 접합자에 직접 도입할 수 있다. 이를 통해 형질전환 계통을 생성할 때 일반적인 세포 표적화 단계를 우회할 수 있으며, 결과적으로 생성 시간을 90% 단축할 수 있다.[78]
CRISPR가 가진 잠재력 중 하나는 이식 이식의 응용이다. 이전 연구에서, CRISPR는 내인성 레트로바이러스를 표적으로 제거하여 질병 전파 위험을 줄이고 면역 장벽을 낮추는 능력을 보여주었다.[44] 이러한 문제를 제거하면 공여 장기의 기능이 향상되어 이 응용이 현실에 더 가까워진다.
식물에서, 유전자 편집은 생물 다양성 보존을 위한 실행 가능한 솔루션으로 여겨진다. 유전자 드라이브는 침입종의 생식률을 변경하는 잠재적인 도구이지만, 상당한 위험이 따른다.[79]
참조
[1]
논문
Genome Editing: Revolutionizing the Crop Improvement
2021-03
[2]
논문
Gene Editing on Center Stage
https://pubmed.ncbi.[...]
2018-08
[3]
논문
Therapeutic repair of mutated nucleic acid sequences
https://www.nature.c[...]
1998-04
[4]
논문
Method of the Year 2011
2012-01
[5]
웹사이트
Breakthrough of the Year: CRISPR makes the cut
https://www.science.[...]
2015-12-17
[6]
논문
Genome-scale engineering for systems and synthetic biology
[7]
서적
Advances in Genetics
[8]
논문
Gene targeting in plants: 25 years later
2013
[9]
웹사이트
Rewriting the book of life: a new era in precision genome editing
https://www.bcgpersp[...]
Boston Consulting Group
2015-11-30
[10]
웹사이트
The future of genetic codes and BRAIN codes
https://www.youtube.[...]
NIHvcast
2017-02-09
[11]
논문
China set to introduce gene-editing regulation following CRISPR-baby furore
https://www.nature.c[...]
2019-05-20
[12]
논문
Black Swans of CRISPR: Stochasticity and Complexity of Genetic Regulation
2019-07
[13]
웹사이트
U.K. set to loosen rules for gene-edited crops and animals
https://www.science.[...]
2021-05-27
[14]
웹사이트
US Trial Shows 3 Cancer Patients Had Their Genomes Altered Safely by CRISPR
https://www.sciencea[...]
2020-02-09
[15]
논문
The widespread IS200/IS605 transposon family encodes diverse programmable RNA-guided endonucleases
2021-10-01
[16]
웹사이트
New programmable gene editing proteins found outside of CRISPR systems
https://www.broadins[...]
2021-10-04
[17]
서적
Molecular Cell Biology
https://archive.org/[...]
W. H. Freeman and Company
[18]
논문
From Gene Targeting to Genome Editing: Transgenic animals applications and beyond
2015-08
[19]
웹사이트
The Nobel Prize in Physiology or Medicine 2007
http://nobelprize.or[...]
The Nobel Foundation
2008-12-15
[20]
논문
Genetic manipulation of genomes with rare-cutting endonucleases
1996-06
[21]
논문
Homing endonuclease structure and function
2005-02
[22]
논문
Primer: genome editing with engineered nucleases
2012-01
[23]
논문
A combinatorial approach to create artificial homing endonucleases cleaving chosen sequences
2006
[24]
논문
Mutations altering the cleavage specificity of a homing endonuclease
2002-09
[25]
논문
Design, activity, and structure of a highly specific artificial endonuclease
2002-10
[26]
논문
Engineering of large numbers of highly specific homing endonucleases that induce recombination on novel DNA targets
2006-01
[27]
간행물
Rationally-designed meganucleases with altered sequence specificity and DNA-binding affinity
https://patents.goog[...]
2018-08-11
[28]
논문
Computational reprogramming of homing endonuclease specificity at multiple adjacent base pairs
2010-09
[29]
논문
Molecular basis of xeroderma pigmentosum group C DNA recognition by engineered meganucleases
2008-11
[30]
논문
Gene-editing nucleases
2012-01
[31]
논문
Induction of angiogenesis in a mouse model using engineered transcription factors
2002-12
[32]
논문
Hybrid restriction enzymes: zinc finger fusions to Fok I cleavage domain
1996-02
[33]
논문
Genome editing with engineered zinc finger nucleases
2010-09
[34]
논문
Zinc finger nucleases targeting the glucocorticoid receptor allow IL-13 zetakine transgenic CTLs to kill glioblastoma cells in vivo in the presence of immunosuppressing glucocorticoids
[35]
논문
Human hematopoietic stem/progenitor cells modified by zinc-finger nucleases targeted to CCR5 control HIV-1 in vivo
2010-08
[36]
논문
ZFN, TALEN, and CRISPR/Cas-based methods for genome engineering
2013-07
[37]
논문
An improved method for TAL effectors DNA-binding sites prediction reveals functional convergence in TAL repertoires of Xanthomonas oryzae strains
2013-07-15
[38]
웹사이트
Genome Surgery
http://www.technolog[...]
2017-11-02
[39]
논문
Toward the therapeutic editing of mutated RNA sequences
1995-08
[40]
논문
To cleave or not to cleave: therapeutic gene editing with and without programmable nucleases
2017-04
[41]
논문
Programmable editing of a target base in genomic DNA without double-stranded DNA cleavage
2016-05
[42]
논문
APOBECs orchestrate genomic and epigenomic editing across health and disease
2021
[43]
논문
Genome-Editing Technologies: Concept, Pros, and Cons of Various Genome-Editing Techniques and Bioethical Concerns for Clinical Application
Elsevier BV
2019-06-07
[44]
논문
Applications of CRISPR technologies in research and beyond
2016-09
[45]
논문
A guide to genome engineering with programmable nucleases
2014-05
[46]
논문
Rapid editing and evolution of bacterial genomes using libraries of synthetic DNA
2014-10
[47]
논문
Gene editing: not just for translation anymore
2011-12
[48]
논문
Embryonic POU5F1 is Required for Expanded Bovine Blastocyst Formation
2018-05
[49]
논문
Application of genome editing in aquatic farm animals
https://link.springe[...]
2021-04-29
[50]
논문
Characterization and multi-generational stability of the growth hormone transgene (EO-1α) responsible for enhanced growth rates in Atlantic Salmon
[51]
논문
Functional genetics of early human development
2018-10
[52]
논문
The I-CreI meganuclease and its engineered derivatives: applications from cell modification to gene therapy
2011-01
[53]
논문
High-frequency modification of plant genes using engineered zinc-finger nucleases
2009-05
[54]
논문
High frequency targeted mutagenesis in Arabidopsis thaliana using zinc finger nucleases
2010-06
[55]
논문
Site-directed mutagenesis in Arabidopsis using custom-designed zinc finger nucleases
2010-06
[56]
논문
Precise genome modification in the crop species Zea mays using zinc-finger nucleases
2009-05
[57]
논문
CRISPR/Cas9 editing of endogenous ''banana streak virus'' in the B genome of ''Musa'' spp. overcomes a major challenge in banana breeding
2019-01-31
[58]
논문
Recent developments in genome editing for potential use in plants
2017-01-01
[59]
웹사이트
These Are Not Your Father's GMOs
https://www.technolo[...]
MIT Technology Review
2017-12-19
[60]
논문
Improved soybean oil quality by targeted mutagenesis of the fatty acid desaturase 2 gene family
2014-09
[61]
논문
Improving cold storage and processing traits in potato through targeted gene knockout
2016-01
[62]
논문
Breaking news: plants mutate right on target
2010-06
[63]
논문
CRISPR/Cas9 for plant genome editing: accomplishments, problems and prospects
2016-07
[64]
논문
ASPsiRNA: A Resource of ASP-siRNAs Having Therapeutic Potential for Human Genetic Disorders and Algorithm for Prediction of Their Inhibitory Efficacy
2017-09
[65]
논문
Progress and prospects: zinc-finger nucleases as gene therapy agents
2008-11
[66]
뉴스
A Cell Therapy Untested in Humans Saves a Baby With Cancer
https://www.nytimes.[...]
2015-11-30
[67]
논문
CANCER IMMUNOTHERAPY. Baby's leukemia recedes after novel cell therapy
2015-11
[68]
논문
Epigenomic engineering for Down syndrome
2016-12
[69]
뉴스
Tests suggest scientists achieved 1st 'in body' gene editing
https://www.apnews.c[...]
2019-02-07
[70]
웹사이트
Ascending Dose Study of Genome Editing by the Zinc Finger Nuclease (ZFN) Therapeutic SB-913 in Subjects With MPS II
https://clinicaltria[...]
"[[U.S. National Library of Medicine]]"
2019-02-07
[71]
논문
A CRISPR-Cas9 gene drive system targeting female reproduction in the malaria mosquito vector Anopheles gambiae
2016-01
[72]
뉴스
Mutant mosquitoes: Can gene editing kill off malaria?
https://www.telegrap[...]
The Telegraph
2018-08-12
[73]
뉴스
Amid uproar, Chinese scientist defends creating gene-edited babies - STAT
https://www.statnews[...]
STAT
2018-11-28
[74]
뉴스
Gene-edited disease monkeys cloned in China
https://www.eurekale[...]
EurekAlert!
2019-01-24
[75]
뉴스
China's Latest Cloned-Monkey Experiment Is an Ethical Mess
https://gizmodo.com/[...]
Gizmodo
2019-01-24
[76]
논문
Variability in Genome Editing Outcomes: Challenges for Research Reproducibility and Clinical Safety
2020-06
[77]
논문
Applications of CRISPR/Cas9 for Gene Editing in Hereditary Movement Disorders
2016-09
[78]
논문
Development and applications of CRISPR-Cas9 for genome engineering
2014-06
[79]
논문
Is there a future for genome-editing technologies in conservation?
https://digitalcommo[...]
2016-04-01
[80]
웹사이트
Geneticists Are Concerned Transhumanists Will Use CRISPR on Themselves
https://motherboard.[...]
Vice Motherboard
2016-12-26
[81]
뉴스
How DIY bio-hackers are changing the conversation around genetic engineering
https://www.washingt[...]
The Washington Post
2016-12-26
[82]
웹사이트
Human Enhancement
http://www.pewintern[...]
Pew Research Center
2016-12-26
[83]
웹사이트
Engineering the Perfect Baby
https://www.technolo[...]
MIT Technology Review
2016-12-26
[84]
웹사이트
Genome editing: an ethical review
http://nuffieldbioet[...]
Nuffield Council on Bioethics
2016-12-27
[85]
뉴스
George Church told us why he's listing "superhuman" gene hacks
https://futurism.com[...]
Futurism
2021-07-25
[86]
웹사이트
Protective alleles
https://arep.med.har[...]
2021-07-25
[87]
뉴스
Human Gene Editing Receives Science Panel's Support
https://www.nytimes.[...]
The New York Times
2017-02-17
[88]
웹사이트
Scientists OK genetically engineering babies
https://nypost.com/2[...]
Reuters
2017-02-17
[89]
웹사이트
Worldwide Threat Assessment of the US Intelligence Community
https://www.dni.gov/[...]
2016-12-26
[90]
웹사이트
Genome editing: Is it a national security threat?
https://www.geneticl[...]
2016-12-26
[91]
웹사이트
Top U.S. Intelligence Official Calls Gene Editing a WMD Threat
https://www.technolo[...]
MIT Technology Review
2016-12-26
[92]
뉴스
Experts warn home 'gene editing' kits pose risk to society
https://www.theguard[...]
The Guardian
2016-12-26
[93]
논문
The mousepox experience. An interview with Ronald Jackson and Ian Ramshaw on dual-use research. Interview by Michael J. Selgelid and Lorna Weir
2010-01
[94]
뉴스
Australians Create a Deadly Mouse Virus
https://www.nytimes.[...]
The New York Times
2016-12-27
[95]
뉴스
Lab creates killer virus by accident
https://www.theguard[...]
The Guardian
2016-12-27
[96]
웹사이트
The Nobel Prize in Chemistry 2020
https://www.nobelpri[...]
Nobel Foundation
2020-10-07
[97]
웹사이트
遺伝子操作技術 “ゲノム編集”が世界を変える
http://www.nhk.or.jp[...]
日本放送協会
2015-12-25
[98]
논문
Highly efficient endogenous human gene correction using designed zinc-finger nucleases
http://mcb.berkeley.[...]
2015-12-25
[99]
논문
De novo-engineered transcription activator-like effector (TALE) hybrid nuclease with novel DNA binding specificity creates double-strand breaks
http://www.pnas.org/[...]
2015-12-25
[100]
웹사이트
ヒト受精卵に世界初の遺伝子操作-中国チーム、国際的な物議
http://jp.wsj.com/ar[...]
『[[ウォール・ストリート・ジャーナル]]』
2015-12-25
[101]
논문
High-frequency off-target mutagenesis induced by CRISPR-Cas nucleases in human cells
http://www.ncbi.nlm.[...]
2015-12-25
[102]
논문
Double nicking by RNA-guided CRISPR Cas9 for enhanced genome editing specificity
http://www.sciencedi[...]
2015-12-25
[103]
논문
Method of the Year 2011
[104]
뉴스
「ゲノム編集」で話題の2人の女性科学者がノーベル賞有力候補に
https://web.archive.[...]
『[[日刊工業新聞]]』, Yahoo Japan
2015-12-25
[105]
논문
Biochemical Method for Inserting New Genetic Information into DNA of Simian Virus 40: Circular SV40 DNA Molecules Containing Lambda Phage Genes and the Galactose Operon of Escherichia coli
1972-10-01
[106]
웹사이트
Recircularization and Autonomous Replication of a Sheared R-Factor DNA Segment in Escherichia coli Transformants — PNAS
http://www.pnas.org/[...]
Pnas.org
2015-12-26
[107]
논문
A programmable dual-RNA–guided DNA endonuclease in adaptive bacterial immunity
http://diyhpl.us/~br[...]
2015-12-27
[108]
웹사이트
遺伝子技術「CRISPR-Cas9」の特許バトルに裁定、の意味
https://www.gizmodo.[...]
ギズモード
2019-11-15
[109]
웹사이트
First monkeys with customized mutations born
http://www.nature.co[...]
ネイチャー
2016-08-12
[110]
논문
Don't edit the human germ line
[111]
웹사이트
遺伝病に対する遺伝子治療の方法
http://jsgt.jp/INFOR[...]
2015-12-30
[112]
웹사이트
Cover Story: この1年を語る10の物語:2015年の重要人物10人
http://www.natureasi[...]
Nature Japan K.K.
2016-01-04
[113]
웹사이트
ゲノム編集、受精卵も容認 米英中の科学者団体が声明
http://digital.asahi[...]
朝日新聞社
2015-12-16
[114]
웹사이트
「ゲノム編集」で操作…中国チーム2例目
https://mainichi.jp/[...]
毎日新聞
2016-08-12
[115]
웹사이트
「ゲノム編集」初の人体応用
https://www.nikkei.c[...]
日本経済新聞
2016-11-26
[116]
웹사이트
CRISPR gene-editing tested in a person for the first time
http://www.nature.co[...]
ネイチャー
2016-11-16
[117]
웹사이트
正常なヒト受精卵で世界初のゲノム編集
http://www3.nhk.or.j[...]
NHK
2017-03-10
[118]
웹사이트
ゲノム編集技術「CRISPR/Cas9」を用いて中国では既に86人の遺伝子改変が行われたことが判明
https://gigazine.net[...]
GIGAZINE
2018-02-07
[119]
웹사이트
特報:世界初「遺伝子編集ベビー」が 中国で誕生、その舞台裏
https://www.technolo[...]
MIT Tech Review
2018-11-29
[120]
웹사이트
Chinese scientist claims world's first gene-edited babies, amid denial from hospital and international outcry
https://edition.cnn.[...]
CNN
2018-11-27
[121]
웹사이트
The World of Nucleases
https://www.genoway.[...]
genOway
2015-12-26
[122]
웹사이트
CRISPR-Cas9 システム概要
http://www.cosmobio.[...]
コスモ・バイオ株式会社
2015-12-25
[123]
논문
CRISPR-Cas systems for editing, regulating and targeting genomes
http://europepmc.org[...]
2015-12-26
[124]
논문
Increasing the efficiency of homology-directed repair for CRISPR-Cas9-induced precise gene editing in mammalian cells
[125]
논문
Small molecules enhance CRISPR genome editing in pluripotent stem cells
http://med.stanford.[...]
2015-12-30
[126]
웹사이트
ORIGENE社 CRISPR-Cas9 ゲノム編集用ベクター
http://www.cosmobio.[...]
コスモ・バイオ株式会社
2015-12-25
[127]
웹사이트
ゲノム編集がひろげるサイエンス・ワンダーランド
http://www.thermofis[...]
ThermoFisher SCIENTIFIC
2015-12-30
[128]
논문
Genome engineering using the CRISPR-Cas9 system
http://zlab.mit.edu/[...]
2015-12-27
[129]
웹사이트
CRISPR/Cas9 Plasmids and Resources
https://www.addgene.[...]
Addgene
2016-01-04
[130]
웹사이트
CRISPR-Cas9 gRNA ライブラリー
http://www.cosmobio.[...]
コスモ・バイオ株式会社
2015-12-25
[131]
웹사이트
報道発表資料:ゲノム編集のためのガイドRNA設計ソフトウェアCRISPRdirectを公開
http://rc.rois.ac.jp[...]
DBCLS/東京大学
2016-06-17
[132]
웹사이트
設計ツール CRISPRdirectを使ってCRISPR/Cas法のガイドRNA配列を設計する。
http://togotv.dbcls.[...]
DBCLS TogoTV
2015-12-27
[133]
웹사이트
GeneCopoeia社 TALEN / CRISPR-Cas9 挿入欠損検出システム
http://www.cosmobio.[...]
コスモ・バイオ株式会社
2015-12-25
[134]
웹사이트
TALEN による遺伝子破壊マウスの作製と変異個体スクリーニング法の確立
http://reposit.lib.k[...]
熊本大学
2015-12-26
[135]
문서
en:Transcription activator-like effector nuclease#TALE DNA-binding domain
[136]
웹사이트
CRISPRとTALENの利点と欠点を解説
https://www.cosmobio[...]
コスモ・バイオ株式会社
2015-12-26
[137]
논문
Efficient design and assembly of custom TALEN and other TAL effector-based constructs for DNA targeting
[138]
웹사이트
新しい人工ヌクレアーゼPlatinum TALENを用いたゲノム編集によって高効率にカエルやラットの遺伝子改変が可能に!
http://www.hiroshima[...]
広島大学
2016-01-06
[139]
논문
Repeating pattern of non-RVD variations in DNA-binding modules enhances TALEN activity
[140]
웹사이트
Plasmids from Article
https://www.addgene.[...]
Addgene
2016-01-06
[141]
웹사이트
研究成果 ゲノム編集技術を用いた効率的な遺伝子挿入法(PITChシステム)のプロトコールを発表
http://www.hiroshima[...]
広島大学
2016-01-06
[142]
논문
MMEJ-assisted gene knock-in using TALENs and CRISPR-Cas9 with the PITCh systems
[143]
웹사이트
Plasmids from Article
https://www.addgene.[...]
Addgene
2016-01-06
[144]
웹사이트
Nucleases
http://www.cellectis[...]
CALYXT, INC.
2016-01-06
[145]
웹사이트
ゲノム編集 ~遺伝子操作技術をビジネスにいかせ~
http://www.nhk.or.jp[...]
NHK
2015-12-25
[146]
웹사이트
CRISPR/Cas9システムによるイネの高効率ゲノム編集に成功
http://www.nias.affr[...]
農業生物資源研究所
2015-12-26
[147]
논문
Efficient modification of the myostatin gene in porcine somatic cells and generation of knockout piglets
2015-11-09
[148]
논문
水産生物へのゲノム編集技術活用に向けて 現状と可能性
https://katosei.jsbb[...]
2016-01-04
[149]
논문
水産物におけるゲノム編集の現状と展望 5. ゲノム編集によるトラフグの育種戦略水産育種技術としての展開について
[150]
논문
水産物におけるゲノム編集の現状と展望 4. カタクチイワシの飼育系とゲノム編集
[151]
웹사이트
腐らぬトマトで食糧難解消 農業変えるゲノム編集
https://www.nikkei.c[...]
Nikkei Inc.
2016-02-10
[152]
웹사이트
現在の研究内容
http://www.cira.kyot[...]
京都大学iPS細胞研究所
2015-12-25
[153]
뉴스
遺伝子操作した細胞使い白血病治療 英の病院、1歳女児に
https://www.nikkei.c[...]
日本経済新聞社
2015-12-25
[154]
웹사이트
New kind of 'designer' immune cells clear baby's leukemia
http://www.reuters.c[...]
REUTERS
2016-01-04
[155]
논문
Gene editing of CCR5 in autologous CD4 T cells of persons infected with HIV
[156]
웹사이트
「クリスパーで遺伝子治療」の可能性、MITから報告 コレステロールを激減させる
https://www.mededge.[...]
DeNA Life Science, Inc.
2015-12-25
[157]
논문
Gene editing in human stem cells using zinc finger nucleases and integrase-defective lentiviral vector delivery
[158]
웹사이트
Gene Editing Technique Crispr May Treat Inherited Blindness Retinitis Pigmentosa
http://www.techtimes[...]
Tech Times
2016-01-29
[159]
논문
1. 部位特異的ヌクレアーゼを基盤とするゲノム編集技術
https://doi.org/10.2[...]
2015-12-30
[160]
웹사이트
CRISPR/Cas9を用いたモデルマウス作製
http://www.cosmobio.[...]
コスモ・バイオ株式会社
2015-12-26
[161]
논문
Correction of a genetic disease in mouse via use of CRISPR-Cas9.
[162]
웹사이트
筋ジストロフィーの症状を再現したラットを作製 - 筋ジストロフィー研究に新たなモデル動物 -
https://www.a.u-toky[...]
東京大学
2015-12-26
[163]
논문
2. 水産・医薬モデルメダカの作出
[164]
논문
Targeted mutagenesis using CRISPR/Cas system in medaka
https://journals.bio[...]
[165]
웹사이트
CRISPRを網羅的遺伝子改変による網羅的分子探索(Science誌オンライン版)
http://aasj.jp/news/[...]
AASJ
2015-12-27
[166]
논문
Genome-scale CRISPR-Cas9 knockout screening in human cells
http://zlab.mit.edu/[...]
2015-12-27
[167]
웹사이트
遺伝子工学で外来種を駆除
https://natgeo.nikke[...]
Nikkei National Geographic Inc.
2015-12-26
[168]
웹사이트
Kevin Esvelt がメディアラボに着任
http://joi.ito.com/j[...]
2016-02-04
[169]
뉴스
ゲノム編集トマト、国内初の一般販売:朝日新聞デジタル
https://www.asahi.co[...]
2021-09-16
[170]
뉴스
ゲノム編集の肉厚マダイ、販売へ:朝日新聞デジタル
https://www.asahi.co[...]
2021-09-19
[171]
뉴스
ゲノム編集食品、普及への課題は トマトに続き、マダイやトラフグ販売:朝日新聞デジタル
https://www.asahi.co[...]
2021-11-23
[172]
서적
バイオ化する社会 「核時代」の生命と身体
青土社
[173]
웹사이트
「ゲノム編集」妥当性議論を
http://mainichi.jp/a[...]
毎日新聞社
2015-12-25
[174]
웹사이트
ゲノム編集、受精卵も容認 米英中の科学者団体が声明
http://digital.asahi[...]
朝日新聞社
2015-12-13
[175]
웹사이트
生殖目的のゲノム編集「使用禁止を」 米英中の科学者団体
https://www.nikkei.c[...]
日本経済新聞社
2015-12-13
[176]
논문
Global summit reveals divergent views on human gene editing.
https://www.nature.c[...]
[177]
웹사이트
"世界初のゲノム編集赤ちゃん」の正当性主張 中国科学者"
https://www.bbc.com/[...]
2018-11-29
[178]
웹사이트
ゲノム編集の双子、脳機能も強化? マウス実験から示唆
https://www.asahi.co[...]
『[[朝日新聞]]』
2019-02-26
[179]
웹사이트
遺伝子編集ベビー問題 科学者らが指摘する隠された「もう1つの狙い」
https://www.technolo[...]
MITテクノロジーレビュー
2019-02-26
[180]
웹사이트
中国「ゲノム編集出産」 日本の学会からも強い非難
https://mainichi.jp/[...]
2018-11-30
[181]
웹사이트
中国・科技省、遺伝子編集活動の中止を命令
https://www.afpbb.co[...]
2018-11-29
[182]
웹사이트
中国でゲノム編集された双子の実在を確認、臨床実験を行った中国の科学者は警察の捜査対象に
https://gigazine.net[...]
GIGAZINE
2019-01-22
[183]
웹사이트
"遺伝子編集した双子の誕生に中国政府が援助していた」との報道"
https://www.newsweek[...]
『[[ニューズウィーク]]』
2019-02-27
[184]
웹사이트
遺伝子編集ベビー誕生に大物科学者らが関与の疑いスタンフォード大も調査へ
https://www.technolo[...]
MITテクノロジーレビュー
2019-02-20
[185]
웹사이트
ゲノム編集で専門委設置 WHO、倫理面も検討
https://www.nikkei.c[...]
2018-12-16
[186]
웹사이트
WHO、国際基準作成へ ゲノム編集、来月に諮問委
https://web.archive.[...]
2019-02-15
[187]
웹사이트
First UK licence to create three-person baby granted by fertility regulator
https://www.theguard[...]
2017-03-16
[188]
웹사이트
遺伝子治療等臨床研究に関する指針
https://www.mhlw.go.[...]
후생노동성
2015-08-12
[189]
Twitter
[190]
웹사이트
생명윤리전문조사회(제93회)의사차제
https://www8.cao.go.[...]
내각부
[191]
웹사이트
히토수정란의 게놈 편집「기초연구만 용인」지침안을 양해
https://web.archive.[...]
2018-11-28
[192]
웹사이트
바이오스테-이션
https://bio-sta.jp/
농연기구, (공사)농진수산・식품산업기술진흥협회
[193]
웹사이트
"게놈 편집 어디까지 인정되는가」(시론・공론) - 해설 아카이브스"
http://www.nhk.or.jp[...]
일본방송협회|NHK
2016-02-24
[194]
논문
Providing Appropriate Risk Information on Genome Editing for Patients
http://www.sciencedi[...]
[195]
웹사이트
체세포 게놈 편집 치료에 관한 논문을 발표
http://researchmap.j[...]
2016-01-29
[196]
뉴스
遺伝子操作、消える痕跡 徳島大・広島大が作物で新技術
2012-08-22
[197]
뉴스
農作物の遺伝子組み換え 技術複雑に どこまで「組み換え」と言えるのか?言えないのか?海外で議論進む中日本政府の対応に鈍く
2012-08-18
[198]
웹사이트
사회는 유전자 개변의 흔적이 없는 작물을 받아들일까: 게놈 편집 작물의 규제와 표시에 관한 제언
https://www.hokudai.[...]
北海道大学
2015-02-26
[199]
논문
바이오사이언스스코프 게놈 편집 기술과 극복해야 할 중요 과제
[200]
뉴스
"DIY바이오 증식/대학・기업에 속하지 않고 자택에서 실험/게놈 편집의 방법 넷으로 입수/규제는 후쫓기에"
https://www.asahi.co[...]
2018-06-30
[201]
웹사이트
노벨상 후보・게놈 편집 기술「CRISPR/Cas9시스템」
http://www.huffingto[...]
The Huffington Post Japan, Ltd.
2015-10-06
[202]
저널
Genome-scale engineering for systems and synthetic biology.
[203]
저널
Precision editing of large animal genomes.
[204]
저널
Gene targeting in plants: 25 years later.
[205]
서적
"Altering the genome by homologous recombination"
[206]
저널
The elephant and the blind men: making sense of PARP inhibitors in homologous recombination deficient tumor cells
[207]
서적
Mechanism of nonhomologous end-joining in mycobacteria: a low-fidelity repair system driven by Ku, ligase D and ligase C.
[208]
서적
DNA double strand breaks (DSB) and non-homologous end joining (NHEJ) pathways in human leukemia.
[209]
서적
"Genetic manipulation of genomes with rare-cutting endonucleases"
[210]
서적
Primer: genome editing with engineered nucleases.
[211]
논문
A combinatorial approach to create artificial homing endonucleases cleaving chosen sequences
2006
[212]
논문
Chevalier, B.S. et al., Design, Activity, and Structure of a Highly Specific Artificial Endonuclease
2002
[213]
저널
Gene-editing nucleases
2012-01
[214]
저널
Hybrid restriction enzymes: zinc finger fusions to Fok I cleavage domain
1996-02
[215]
저널
Genome editing with engineered zinc finger nucleases
2010-09
[216]
저널
Genome editing with engineered zinc finger nucleases
2010-09
[217]
저널
Primer: genome editing with engineered nucleases
2012-01
[218]
저널
The genome editing revolution: A CRISPR-Cas TALE off-target story
https://onlinelibrar[...]
2016-07-01
[219]
저널
TAL Effectors: Customizable Proteins for DNA Targeting
http://science.scien[...]
2011-09-30
[220]
저널
Differential integrity of TALE nuclease genes following adenoviral and lentiviral vector gene transfer into human cells
https://academic.oup[...]
2013-03-01
[221]
저널
BurrH: a new modular DNA binding protein for genome engineering
https://www.nature.c[...]
2014-01-23
[222]
저널
Intervening Sequences of Regularly Spaced Prokaryotic Repeats Derive from Foreign Genetic Elements
https://link.springe[...]
2005-02-01
[223]
저널
The CRISPRdb database and tools to display CRISPRs and to generate dictionaries of spacers and repeats
https://bmcbioinform[...]
2018-04-23
[224]
저널
A Programmable Dual-RNA–Guided DNA Endonuclease in Adaptive Bacterial Immunity
http://science.scien[...]
2012-08-17
[225]
논문
Gene editing: not just for translation anymore
2012
[226]
저널
The agents of natural genome editing
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

