이산화 염소
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
이산화 염소는 염소와 오존과 유사한 냄새를 가진 적황색 기체로, 강한 산화제이며 열과 빛에 의해 분해된다. 물에 잘 녹아 수용액을 형성하며, 종이, 펄프, 섬유의 표백, 물의 소독 및 정화, 식품 산업 등 다양한 용도로 사용된다. 공업적으로는 염소산 염을 염화 수소로 반응시키거나 아염소산 염을 염소와 반응시켜 제조하며, 실험실에서는 염소산 칼륨과 옥살산 반응으로 얻을 수 있다. 흡입, 피부 접촉, 안구 접촉 시 자극을 유발하며, 유해성이 있어 인체 노출 제한이 필요하다. 이산화 염소는 공공 위기 상황에서 소독제로 사용되기도 하지만, 소아 자폐증 및 코로나19 등 질병 치료에 대한 허위 의학 정보와 함께 섭취가 권장되어 논란이 있다. 한국에서는 유해 물질로 지정되어 배출이 규제되며, 공간 살균 제품의 안전성에 대한 주의가 요구된다.
더 읽어볼만한 페이지
- 표백제 - 이산화 질소
이산화 질소는 매캐한 냄새가 나는 적갈색 기체로 질산 제조, 화약류 제조, 밀 표백제, 살균제 등에 사용되며, 자연적·인위적 발생으로 대기 오염을 일으키고 산성비, 식물 피해, 인체 건강 악영향 등 환경 문제를 야기하여 대한민국에서는 농도 규제 및 저감 노력을 하고 있다. - 표백제 - 과산화 수소
과산화 수소는 표백, 소독, 화학 합성 등에 사용되는 물보다 약간 점성이 있는 무색 액체 화합물로, 과거 과산화 바륨을 이용해 제조되었지만 현재는 주로 안트라퀴논 공정으로 생산되며, 농도에 따라 물리화학적 성질과 안전성 관련 특성이 다르고 생체 내에서도 중요한 역할을 한다. - 염소 산화물 - 염소산염
염소산염은 화학식 ClO3−를 갖는 염소의 옥시음이온으로, 금속 염소산염은 특정 방식으로 제조되거나 산업적으로 합성되며, 자연적으로 건조 지역이나 화성에서도 발견되고 독성과 산화성으로 인해 규제를 받는다. - 염소 산화물 - 아염소산염
아염소산염은 아염소산의 염으로 불안정하지만, 알칼리 금속 및 알칼리 토금속 아염소산염 형태로 존재하며, 특히 아염소산 나트륨은 표백 및 이산화 염소 생성에 널리 쓰이나 고농도 노출 시 건강에 유해할 수 있다.
| 이산화 염소 - [화학 물질]에 관한 문서 | |
|---|---|
| 일반 정보 | |
 | |
 | |
 | |
| IUPAC 명칭 | 이산화 염소 |
| 다른 이름 | 염소(IV) 산화물 |
| 식별 정보 | |
| CAS 등록번호 | 10049-04-4 |
| PubChem 식별자 | 24870 |
| ChemSpider ID | 23251 |
| UNII | 8061YMS4RM |
| UN 번호 | 9191 |
| EINECS 번호 | 233-162-8 |
| MeSH 이름 | 이산화 염소 |
| ChEBI | 29415 |
| RTECS | FO3000000 |
| Gmelin | 1265 |
| SMILES | O=[Cl]=O |
| SMILES (alternative) | O=Cl[O] |
| 표준 InChI | 1S/ClO2/c2-1-3 |
| 표준 InChI 키 | OSVXSBDYLRYLIG-UHFFFAOYSA-N |
| InChI | 1/ClO2/c2-1-3 |
| InChI 키 | OSVXSBDYLRYLIG-UHFFFAOYAC |
| 속성 | |
| 원소 구성 | Cl=1 | O=2 |
| 외관 | 노란색에서 붉은색을 띠는 기체 |
| 냄새 | 자극적인 냄새 |
| 밀도 | 2.757 g/dm−3 |
| 녹는점 | -59 °C |
| 끓는점 | 11 °C |
| 용해도 | 20 °C에서 8 g/L |
| 다른 용매에 대한 용해도 | 알칼리성 용액 및 황산에 용해됨 |
| pKa | 3.0(5) |
| 증기압 | >1 atm |
| 열화학 | |
| 표준 생성 엔탈피 | 104.60 kJ/mol |
| 엔트로피 | 257.22 J K−1 mol−1 |
| 위험성 | |
| 주요 위험 | 급성 독성 |
| 안전 데이터 시트 (SDS) | 안전 데이터 시트 보관 |
| GHS 신호어 | 위험 |
| NFPA 704 | 보건: 3 화재: 0 반응성: 4 특별: OX |
| LD50 | 쥐, 경구: 94 mg/kg |
| LCLo | 쥐, 2시간: 260 ppm |
| PEL (허용 노출 기준) | TWA 0.1 ppm (0.3 mg/m3) |
| IDLH (즉시 생명 또는 건강에 위험한 농도) | 5 ppm |
| REL (권장 노출 기준) | TWA 0.1 ppm (0.3 mg/m3), ST 0.3 ppm (0.9 mg/m3) |
2. 성질
상온에서는 염소나 오존과 비슷한 자극적인 냄새가 나는 적황색 또는 주황색에서 노란색을 띠는 기체로 존재한다. 농도에 따라 냄새와 색조가 다를 수 있으며, 공기보다 무겁다.[62] 액체 상태에서는 적갈색을 띠며 비중은 0°C에서 1.64이다. 고체 상태는 등황색을 띤다.[62][89] 녹는점은 -59°C이고 끓는점은 11°C이다.[89]
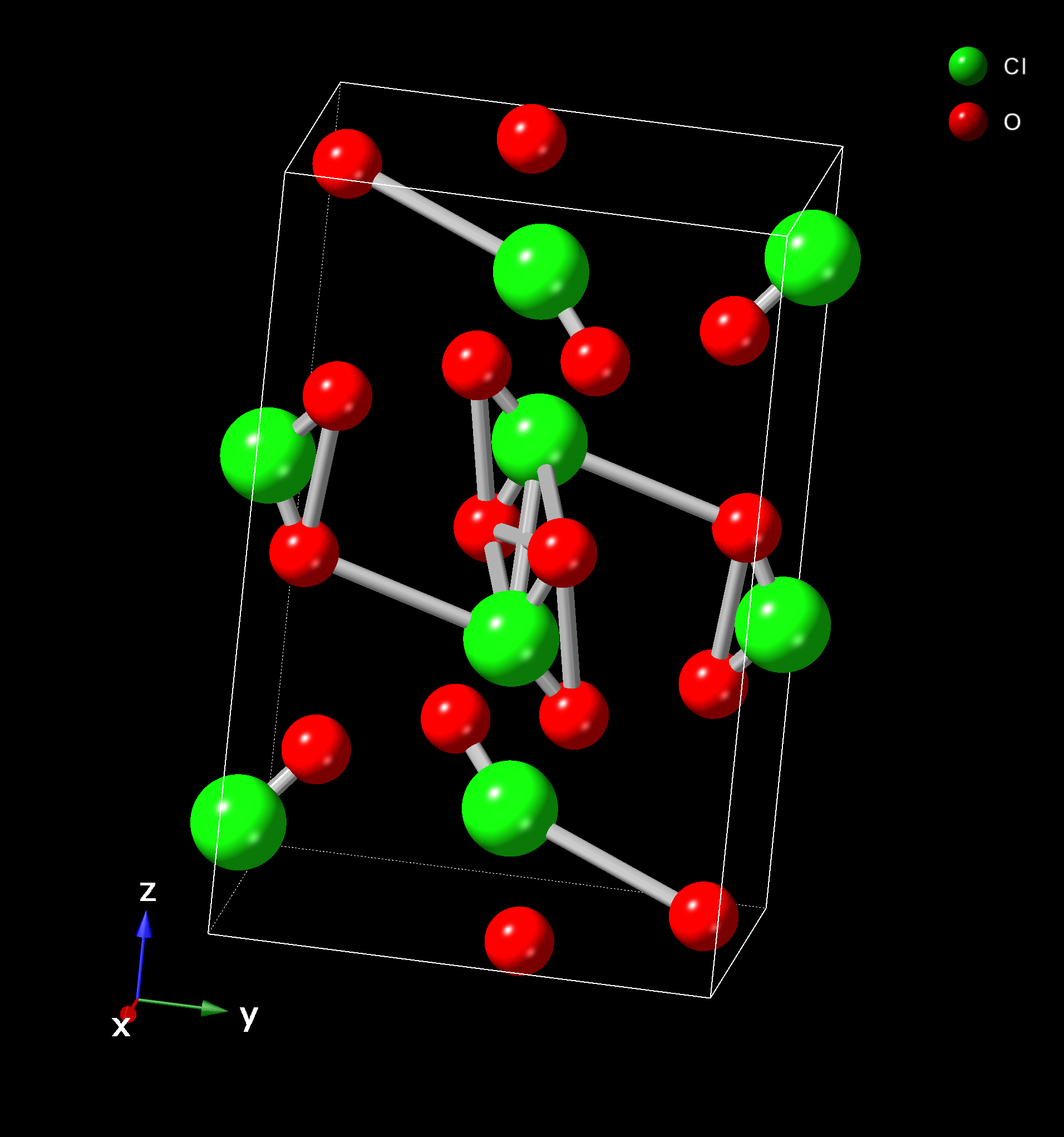
이산화 염소(ClO2)는 홀수의 원자가 전자를 가진 상자성 라디칼이다.[5] 이는 이량체화되지 않고 안정적으로 존재하는 드문 홀전자 분자 중 하나이다.[5] 결정 구조는 사방정계 Pbca 공간군에 속한다.[6]
이산화 염소는 원소 염소와는 매우 다른 성질을 가진다.[13] 물에 대한 용해도가 높아, 특히 차가운 물에 잘 녹는다. 20°C에서 물 100mL당 0.8g까지 녹을 수 있다.[62] 물과 가수분해 반응을 하지 않고 용액 내에 용해된 기체 상태로 존재하며, 염소보다 물에 약 10배 더 잘 녹는다.[13] 용해도는 온도에 매우 민감하여, 온도가 낮을수록 잘 녹으므로 고농도(리터당 3g 이상) 용액 보관 시에는 보통 5°C 정도의 냉수를 사용한다.[13] 물에 녹으면 황갈색의 수용액을 만드는데, 이 수용액은 어두운 곳에서는 비교적 안정하지만 빛에 노출되면 분해되어 염산과 염소산을 생성한다.[89]
이산화 염소는 강한 산화제로 작용하며 반응성이 매우 높다.[89][62] 열과 빛에 매우 불안정하여 쉽게 분해된다.[89] 부분 압력이 10kPa 이상이거나 STP에서 공기 중 농도가 10%를 초과하면 화학 분해를 통해 폭발적으로 분해될 수 있다. 이러한 분해는 빛, 고온, 화학 반응, 압력 충격 등에 의해 시작될 수 있다.[13] 따라서 이산화 염소는 순수한 기체 상태로 취급되지 않으며, 보통 리터당 0.5~10g 농도의 수용액 형태로 사용된다. 불안정성 때문에 장기 보존이 어렵고, 미국 등 많은 국가에서는 운송이 금지되어 있어 사용 현장에서 직접 생산하는 경우가 많다.[13][84] 일부 국가에서는 낮은 농도의 용액 운송이 허용되기도 하지만, 이 역시 빠르게 분해되는 경향이 있다.[13] 시중의 공간 살균 제품 등에서는 장기 보존을 위해 안정화 성분을 첨가하거나, 아염소산 나트륨 등을 사용하여 필요할 때 이산화 염소를 발생시키는 방식을 사용한다.[83][84] "안정화 이산화 염소"라는 용어는 특정 화학물질을 지칭하는 것이 아니며, 제품마다 성분과 성질이 다를 수 있다.[84]
2. 1. 분자 구조 및 결합

이산화 염소(ClO2) 분자는 홀수의 원자가 전자를 가지고 있어 상자성을 띠는 라디칼이다. 이는 이량체화되지 않고 안정적으로 존재하는 홀전자 분자의 드문 예시 중 하나이다(다른 예시로는 일산화 질소가 있다).[5] 산소 원자와 염소 원자 사이의 결합 길이는 1.491±0.14Å이며, O-Cl-O 결합각은 116.5±2.5°이다.[89]
분자 구조에 대한 설명은 역사적으로 발전해왔다. 1933년, 라이너스 폴링의 제자였던 로렌스 O. 브록웨이는 3전자 결합과 두 개의 단일 결합으로 이루어진 구조를 제안했다.[7] 반면, 폴링 자신은 그의 저서 ''일반 화학''에서 하나의 산소 원자와는 이중 결합을, 다른 산소 원자와는 단일 결합 및 3전자 결합을 형성하는 구조를 제시했다. 원자가 결합 이론에서는 이러한 구조들이 공명을 이루는 혼성체로 이산화 염소 분자를 설명한다.[8] 3전자 결합은 일반적인 이중 결합보다 약한 결합으로 간주된다. 분자 궤도 이론에서는 이산화 염소의 홀전자가 반결합성 궤도에 위치하는 것으로 설명하며, 이는 3전자 결합이 상대적으로 약하다는 개념과 일치한다. 이후의 연구를 통해 최고 점유 분자 궤도가 실제로 불완전하게 채워진 반결합성 궤도라는 것이 확인되었다.[9]
2. 2. 화학 반응
이산화 염소는 강 산화제로 작용한다. 열에 대해서 극히 불안정하며, 열이 가해질 경우 산소와 염소로 분해된다. 빛에 의해서도 분해하며, 이 경우 산소, 염소 외에 삼산화 염소를 생성한다. 수분이 존재할 경우 삼산화 염소, 하이포아염소산, 아염소산, 염소산, 과염소산을 생성한다. 수소와의 혼합물은 가열하면 폭발하며, 황, 인, 황화물 등과는 접촉하면 폭발한다. 수은, 암모니아와 반응하지만 황산과는 반응하지 않고 흡수된다. 물에 매우 잘 녹아 황갈색의 수용액을 만든다. 수용액은 어두운 곳에서는 안정하지만 빛에 의해서 분해되어 염산과 염소산을 생성한다.[89]이 외에 이산화 염소가 관여된 반응은 주로 다음과 같은 것이 있다.[89]
- 염소 또는 아이오딘과 반응하여 각각 염소산 또는 아이오딘산을 생성한다.
- 아이오딘화 칼륨과는 수소 이온 농도에 따라 반응의 양상이 달라진다. 이중 산성 환경에서의 반응은 정량에 사용된다. 반응식은 다음과 같다.
::산성 : 2 ClO2 + 10 KI + 8 HCl → 10 KCl + 4 H2O + 5 I2
::중성 : 6 ClO2 + 10 KI + 4 H2O → 4 KIO3 + 6 KCl + 8 KOH + I2
::약염기성 : 2 ClO2 + 2 KI → 2 KClO2 + I2
::KMnO4 + 3 ClO2 + H2O → MnO2 + KClO3 + 2 HClO3
::2 ClO2 + 10 FeSO4 + 5 H2SO4 → 2 HCl + 5 Fe2(SO4)3 + 4 H2O
3. 제조 방법
이산화 염소는 1811년 험프리 데이비에 의해 처음으로 제조되었다.[10] 이 물질은 희석되지 않은 상태에서는 격렬하게 분해될 수 있는 불안정한 특성이 있어, 제조 시 종종 기체 상태를 거치지 않고 바로 용액 형태로 만드는 방법이 선호된다.
공업적으로 이산화 염소를 생산하는 주된 방법은 염소산 나트륨과 같은 염소산염을 환원제를 사용하여 환원시키는 것이다. 이 방식은 특히 펄프 표백 용도로 널리 사용되며, 메탄올, 과산화 수소, 염산, 이산화 황 등이 환원제로 쓰일 수 있다.[13][14] 또한, 아염소산염을 염소와 같은 산화제로 산화시키는 방법도 공업 및 실험실 규모에서 사용된다.[12]
실험실 환경에서는 소량의 이산화 염소를 얻기 위해 염소산 칼륨에 진한 황산을 반응시키거나, 염소산 칼륨과 옥살산을 함께 가열하는 방법을 사용하기도 한다.[89]
3. 1. 아염소산염 산화
실험실에서는 염소로 아염소산 나트륨을 산화시켜 이산화 염소(ClO2)를 제조한다.[12]: NaClO2 + 1/2 Cl2 → ClO2 + NaCl
소독용 이산화 염소는 전통적으로 다음과 같은 방법으로 제조되었다.
- 아염소산 나트륨–차아염소산염 방식:
:: 2 NaClO2 + 2 HCl + NaOCl → 2 ClO2 + 3 NaCl + H2O
- 아염소산 나트륨–염산 방식:
:: 5 NaClO2 + 4 HCl → 5 NaCl + 4 ClO2 + 2 H2O
- 아염소산염–황산 방식:
:: 4 ClO2- + 2 H2SO4 → 2 ClO2 + HClO3 + 2 SO42- + H2O + HCl
이 세 가지 방법 모두 높은 전환율로 아염소산염에서 이산화 염소를 얻을 수 있다. 특히 아염소산염–황산 방식은 염소를 전혀 사용하지 않는다는 장점이 있지만, 같은 양의 이산화 염소를 만들기 위해 아염소산염이 25% 더 필요하다는 단점이 있다. 소규모 생산에는 과산화 수소를 사용하는 것이 효율적일 수 있다.[13]
매우 순수한 이산화 염소는 아염소산염 용액을 전기 분해하여 얻을 수도 있다.[15]
: NaClO2 + H2O → ClO2 + NaOH + 1/2 H2
고순도 이산화 염소 기체(공기 또는 질소 중 7.7%)는 기체-고체 방식으로 만들 수도 있는데, 이는 묽은 염소 기체를 고체 아염소산 나트륨과 반응시키는 방식이다.[15]
: NaClO2 + 1/2 Cl2 → ClO2 + NaCl
3. 2. 염소산염 환원
실험실에서는 염소산 칼륨과 옥살산의 반응으로 이산화 염소를 제조할 수 있다.: KClO3 + H2C2O4 → 1/2 K2C2O4 + ClO2 + CO2 + H2O
또는 옥살산과 황산으로도 제조할 수 있다.
: KClO3 + 1/2 H2C2O4 + H2SO4 → KHSO4 + ClO2 + CO2 + H2O
오늘날 전 세계에서 생산되는 이산화 염소의 95% 이상은 펄프 표백에 사용하기 위해 염소산 나트륨을 환원시켜 만든다. 이는 메탄올, 과산화 수소, 염산 또는 이산화 황과 같은 적절한 환원제를 사용하여 강산 용액에서 고효율로 생산된다.[13] 최신 기술은 메탄올 또는 과산화 수소를 기반으로 하는데, 이러한 화학 반응은 경제성이 높고 원소 염소를 함께 생성하지 않기 때문이다. 전체 반응식은 다음과 같이 쓸 수 있다.[14]
: 염소산염 + 산 + 환원제 → 이산화 염소 + 부산물
단일 반응기에서 염소산 나트륨과 염산의 반응은 다음과 같은 경로를 통해 진행되는 것으로 여겨진다.
: ClO3- + Cl- + H+ → ClO2- + HOCl
: ClO3- + ClO2- + 2 H+ → 2 ClO2 + H2O
: HOCl + Cl- + H+ → Cl2 + H2O
전체 반응은 다음과 같다.
: 2 ClO3- + 2 Cl- + 4 H+ → 2 ClO2 + Cl2 + 2 H2O
상업적으로 더 중요한 생산 경로는 메탄올을 환원제로 사용하고 황산을 산으로 사용하는 방식이다. 염화물 기반 공정을 사용하지 않는 두 가지 장점은 원소 염소가 형성되지 않고, 펄프 공장에서 유용한 화학 물질인 황산 나트륨이 부산물로 생성된다는 점이다. 이러한 메탄올 기반 공정은 고효율을 제공하며 매우 안전하게 만들 수 있다.[13]
1999년부터 염소산 나트륨, 과산화 수소, 황산을 사용하는 방식은 물 처리 및 기타 소규모 소독제 응용 분야에 점점 더 많이 사용되고 있다. 이는 95% 이상의 고효율로 염소가 없는 제품을 생산하기 때문이다.
3. 3. 기타 방법
염소와 산소가 자외선이 있는 상태에서 순간 광분해 반응을 하면 미량의 이산화 염소가 생성될 수 있다.[11]: Cl2 + 2 O2 → 2 ClO2 (UV 조건 하)
실험실에서는 염소산 칼륨과 옥살산을 반응시켜 이산화 염소를 만들기도 한다.
: KClO3 + H2C2O4 → 1/2 K2C2O4 + ClO2 + CO2 + H2O
또는 염소산 칼륨에 옥살산과 황산을 함께 사용하여 제조할 수도 있다.
: KClO3 + 1/2 H2C2O4 + H2SO4 → KHSO4 + ClO2 + CO2 + H2O
4. 용도
- 종이, 펄프, 섬유의 표백에 주로 사용된다. 특히 목재 펄프 표백 시 염소와 함께 쓰이거나, ECF(무원소 염소) 표백 공정에서 단독으로 사용된다.[16][17][29] ECF 공정은 중간 산성 pH (3.5 ~ 6)에서 진행되며, 생성되는 유기염소 화합물의 양을 최소화하는 장점이 있다.[19] 현재 전 세계적으로 표백된 크라프트 펄프의 약 95%가 ECF 공정의 이산화 염소를 사용하여 만들어질 정도로 중요한 표백 방법이다.[20] 과거 염소 가스를 사용했을 때보다 셀룰로스 산화에 따른 펄프의 기계적 강도 저하를 줄일 수 있다.
- 우지, 어유 등의 정제 및 표백에도 사용된다.[89]
- 녹말, 밀가루 등의 표백 및 품질 개선에도 사용되며, 이때는 10~20ppm 정도의 농도로 사용된다.[89][21]
소독 및 정화이산화 염소는 강력한 소독 능력으로 다양한 수처리 및 살균 용도로 사용된다.[13][17][18]
- 수처리:
- 수돗물 및 음용수 처리: 1944년 미국 뉴욕주 나이아가라 폭포의 정수장에서 맛과 냄새를 유발하는 페놀 화합물 제거를 위해 처음 사용되었고,[17][29] 1956년 벨기에 브뤼셀에서 대규모 음용수 소독제로 도입되었다.[29] 주로 음용수 염소 처리 전에 산화제로 사용하여, 원수 속 자연 유기물과 염소가 반응해 생성되는 발암성 의심 물질인 트리할로메탄의 생성을 억제한다.[22][23][24][25] 이산화 염소는 염소나 표백제보다 할로메탄 생성을 70% 줄일 수 있다.[26]
- 염소 대비 장점: pH 7 이상에서도 효과적이며,[17] 암모니아 및 아민 존재 시,[27] 배수 시스템 내 바이오필름 제어에 더 우수하다.[24] 또한 염소보다 부식성이 적고 ''레지오넬라'' 박테리아 제어에 뛰어나다.[29][30] pH 변화나 시간 경과에 따른 효능 저하가 적고, 박테리아 내성이 생기지 않으며, 일반적인 식수 부식 억제제(실리카, 인산염)의 영향을 받지 않는다. 미국에서는 EPA 등록 살생물제이다.
- 병원체 제거: 바이러스,[31] 박테리아, 원생동물(특히 ''지알디아'' 미생물 낭포, ''크립토스포리디움'' 오시스트) 등 수인성 병원체 제거에 염소보다 효과적이다.[17]
- 부산물 및 규제: 사용 시 부산물로 아염소산염이 생성될 수 있어, 미국 EPA는 음용수 내 아염소산염 농도를 최대 1ppm으로 제한하고 있다.[17] 이 때문에 사용이 고품질 물이나, 철 기반 응집제를 사용하여 아염소산염을 염화물로 환원시킬 수 있는 처리수로 제한될 수 있다.[32] WHO도 1ppm 투여량을 권장한다.[26]
- 기타 수처리: 냉각탑, 공정수, 석유 및 가스 분야의 물 처리, 폐수 내 페놀 파괴 등 산업용 수처리에서 살생물제로 사용된다.[18][28][17] 취수구의 얼룩무늬담치 및 가시벌조개 방제에도 쓰인다.[17]
- 식품 및 기타 소독:
- 식품 산업: 식품 가공 소독,[18] 도살 후 가금류 살포 또는 담가 소독,[39] 곰팡이 및 효모 발생 방지를 위한 과일(블루베리, 라즈베리, 딸기 등) 훈증 처리[38] 등에 사용된다.
- 의료 기기 소독: 내시경 소독에 사용될 수 있으며, 예를 들어 Tristel이라는 상표명으로 판매된다.[40] 또한 계면활성제로 사전 세척하고 탈이온수와 저농도 산화 방지제로 헹구는 3단계 방식의 제품도 있다.[41]
- 휴대용 정수: 캠핑 중 물 정화를 위해 이산화 염소를 함유한 소독정은 가정용 표백제보다 병원균 제거에 더 효과적이지만, 일반적으로 비용이 더 많이 든다.[43][44]
- 해충 방제: 빈대를 박멸하는 데 효과적인 것으로 나타났다.[42]
냄새 제거 및 기타
- 물의 냄새 제거.[89]
- 동물 부산물(렌더링) 공장의 공기 세정기에서 냄새 제어.[17]
- 자동차나 보트의 탈취제로도 사용되며, 물로 활성화하여 사용하는 이산화 염소 발생 패키지 형태가 있다.
- 묽은 농도로 일부 구강 청결제에서 방부제 및 소취 성분으로 사용된다.[45][46]
- 메탄의 산화 목적으로도 사용된다.
- 젤화제 등을 혼합한 조성물을 틈새가 있는 용기에 넣어 사용하는 계절성 소독/소취 상품도 유통되고 있다.
5. 안전성
이산화 염소는 인체에 유해하며 취급 시 주의가 필요하다.
'''흡입''' 시 기도에 심한 자극을 줄 수 있으며, 기관지 경련이나 폐수종이 발생할 수 있다. 심각한 두통을 유발하기도 하며, 증상이 즉시 나타나지 않고 오래 지속될 수 있다. 장기간 노출될 경우 만성 기관지염이 생길 수 있다.[90]
'''피부 접촉''' 시 기체 또는 용액 형태 모두 심한 자극을 줄 수 있다.[90]
'''안구 접촉''' 시에도 심한 자극을 유발하며, 노출될 경우 빛 번짐 등 시력 장애가 나타날 수 있다.[90]
이산화 염소는 유독성 물질이므로 안전한 사용을 위해 인체 노출 제한 기준이 마련되어 있다. 미국 환경 보호청(EPA)은 식수에 포함될 수 있는 이산화 염소의 최대 농도를 0.8 mg/L로 설정했다.[49] 미국 노동부 산하 산업안전보건청(OSHA)은 작업 환경에서의 8시간 허용 노출 한계(TWA)를 공기 중 0.1 ppm (0.3 mg/m3)으로 규정하고 있다.[50][70] 또한 미국 산업 위생 전문가 회의(ACGIH)는 하루 8시간 또는 주 40시간 노출(TLV-TWA) 기준으로 0.1 ppm, 15분 단시간 노출 한계(TLV-STEL)로는 0.3 ppm을 권고하며,[72][73] 미국 국립 직업안전위생연구소(NIOSH)도 별도의 노출 한계 기준을 설정하고 있다.[73] 다만 이러한 기준들은 주로 공장 등에서의 성인 직업성 노출을 고려한 값이다.
일본에서는 노동 안전 위생법[74]에 따라 "명칭 등을 통지해야 할 위험물 및 유해물"로 지정되어 있으며, 일부 지방 자치 단체에서 배출을 규제하고 있으나 국가적인 노출 한계 기준은 없다. 업계 단체인 "일반 사단 법인 일본 이산화 염소 공업회"는 공간 살균 제품에 대한 실내 농도 지침치(자주 기준)를 0.01 ppm으로 설정했지만,[75] 이는 정상 상태의 농도 수준일 뿐 최대 허용 농도나 유효 농도를 의미하는 것은 아니다.[76]
이산화 염소는 물리적으로도 불안정한 특성이 있다. 부분압이 10kPa 이상이거나 표준 온도 및 압력(STP)에서 공기 중 농도가 10%를 초과하면, 빛, 고온, 화학 반응, 압력 충격 등에 의해 염소와 산소로 폭발적으로 화학 분해될 수 있다.[13] 이 때문에 순수한 기체 형태로는 거의 취급되지 않으며, 주로 리터당 0.5~10 g 농도의 수용액으로 다룬다. 용해도는 저온에서 증가하므로, 3 g/L 이상 농도로 보관 시에는 냉수(5°C)를 사용하는 것이 일반적이다.[13] 또한 불안정성 때문에 미국 등 많은 국가에서는 운송이 금지되어 현장에서 직접 생산하여 사용한다.[13] 일부 국가에서는 저농도(3 g/L 미만) 용액의 육로 운송을 허용하기도 하지만, 이 역시 빠르게 분해되는 경향이 있다. 가연성 물질과 접촉 시 자연 발화 또는 폭발 위험도 존재한다.[47][48]
과거 일본에서는 조류 인플루엔자 유행 우려 속에서 공간 소독 용도로 이산화 염소 가스가 주목받기도 했으나,[64][65] 장기간 저농도 가스 노출에 대한 안전성 검증(독성 시험)은 불안정하고 반응성이 높은 특성 때문에 세계적으로도 충분하지 않은 상황이다. ACGIH 기준상 산화력은 염소보다 낮고,[68] 쥐 실험에서의 LC50(반수 치사 농도)도 염소보다 낮아 독성이 약하다는 견해도 있으나[69], 안전성에 대한 논란은 여전하다. 2017년에는 일본 국립병원기구 센다이의료센터 연구진이 신체 착용형 이산화 염소 방출 제품이 제조사의 주장과 달리 병원체 억제 효과가 없었다고 보고하기도 했다.[77]
시중에는 "안정화 이산화 염소"라는 이름의 제품도 있으나, 이는 특정 화학물질을 지칭하는 것이 아니며 제품마다 성분이 다르다. 따라서 그 물성이나 안전성 역시 순수한 이산화 염소와는 구별되어야 한다.[84]
5. 1. 공공 위기 상황에서의 사용
이산화 염소는 산화제 또는 소독제로서 다양한 용도로 사용되며,[13] 공기 소독에도 사용될 수 있다.[33] 여러 공공 위기 상황에서 활용된 사례는 다음과 같다.- 2001년 탄저병 테러: 미국에서 탄저균에 오염된 건물을 소독하는 데 주요 물질로 사용되었다.[34]
- 허리케인 카트리나 (2005년): 미국 루이지애나주 뉴올리언스와 주변 걸프 해안 지역이 허리케인으로 큰 피해를 입었을 때, 침수된 주택 내부의 위험한 곰팡이를 제거하는 데 이산화 염소가 사용되었다.[35]
- 조류 인플루엔자 (2008년): 일본에서는 고병원성 H5N1형 조류 인플루엔자의 세계적 유행 우려 속에서 공간 소독을 위한 이산화 염소 가스가 주목받았다. 이는 당시 일본의 경제 보도 프로그램[64]에서도 다루어졌으며, 이후 프로 야구단 등에서도 사용된다는 보도[65]가 있었다. 2010년에는 인플루엔자 유사 질환 발생을 줄일 수 있다는 연구 결과도 보고되었다.[66]
- 코로나19 범유행: 미국 환경 보호국(EPA)은 코로나19 범유행에 대응하여, 원인 바이러스인 코로나바이러스에 효과적인 환경 소독제 목록을 게시했다.[36][37] 이 목록에 포함된 일부 제품은 아염소산 나트륨을 이산화 염소로 활성화시켜 사용하는 방식이다. 다만, 이름이 비슷한 차아염소산 나트륨 기반 소독제와는 화학적 작용 방식이 다르므로 혼동해서는 안 된다.
5. 2. 거짓 의학 정보
이산화 염소는 소아 자폐증[51] 및 코로나바이러스를 포함한 광범위한 질병에 대한 섭취 가능한 치료법으로 사기적이고 불법적으로 판매되어 왔다.[52][53][54] 특히 "미라클 미네랄 보충제"(Miracle Mineral Supplement|미라클 미네랄 서플리먼트eng, MMS)라는 이름으로 판매되었는데, 이는 지침에 따라 준비하면 이산화 염소를 생성하는 물질이다. MMS는 HIV, 암, 자폐증, 여드름, 그리고 코로나19 등 다양한 질병의 치료제로 허위 광고되었다.[58] 소아 자폐증 치료를 위해 이산화 염소 관장을 받은 어린이들이 생명을 위협하는 심각한 부작용을 겪은 사례도 보고되었다.[51]2010년 7월 30일과 10월 1일, 미국 식품의약국(FDA)은 MMS 사용에 대해 공식적으로 경고했다. 많은 소비자들이 MMS 사용 후 메스꺼움, 설사, 심한 구토, 탈수로 인한 생명을 위협하는 저혈압 등 심각한 부작용[56]과 심지어 사망 사례[57]까지 FDA에 보고했다.[58][59] FDA는 MMS가 건강에 심각한 해를 끼칠 수 있다고 경고했다.[58]
이후 FDA는 2019년 8월 12일과 2020년 4월 8일에 다시 한번 MMS의 위험성을 강조하며 경고를 반복했다. FDA는 MMS를 섭취하는 것이 표백제를 마시는 것과 같이 위험하며, 이산화 염소가 의학적으로 유익하다는 어떠한 과학적 증거도 없다고 밝혔다. 따라서 소비자들에게 어떠한 이유로든 MMS 제품을 사용하거나 어린이에게 주지 말 것을 강력히 권고했다.[60][61] FDA는 희석된 농도를 사용하여 전문가의 감독 하에 구강 헹굼을 하는 경우를 제외하고, 이산화 염소의 섭취 또는 기타 내부 사용은 어떠한 건강상의 이점도 없으며 절대 사용해서는 안 된다고 명확히 했다.[55][61]
6. 한국의 사용 현황 및 규제
2008년 강독성 H5N1형 조류 인플루엔자의 세계적 유행 우려 속에서 공간 소독약으로 이산화 염소 가스가 주목받았으며, 일본의 경제 보도 프로그램[64]과 스포츠 신문 등에서 일본 프로 야구 구단 사용 사례[65] 등이 소개되었다. 2010년에는 인플루엔자 유사 질환 발생 감소 가능성이 보고되기도 했다[66].
그러나 이산화 염소는 경구 섭취에 대한 안전성은 확인되었으나[67], 불안정하고 반응성이 높은 가스 특성상 장기간 저농도 노출에 대한 안전성 검증(독성 시험)은 세계적으로도 충분하지 않은 상황이다. 일부에서는 이산화 염소가 염소보다 독성이 약하다고 보기도 하지만[69], 쥐 실험에서는 염소보다 낮은 농도에서 반수 치사 농도(LC50)를 보였다는 점도 고려해야 한다.
미국의 경우, 노동 안전 보건청(OSHA)은 하루 8시간 시간 가중 평균(TWA) 노출 한계를 0.1ppm으로 설정했으며[70], 미국 산업 위생 전문가 회의(ACGIH)는 TWA 0.1ppm 및 15분 단시간 노출 한계(TLV-STEL) 0.3ppm을[72][73], 국립 노동 안전 보건 연구소(NIOSH)도 별도 조건 하의 노출 한계를 설정하고 있다[73]. 일본의 일부 제조업체는 OSHA 기준을 공간 소독 제품의 잠정적 안전 기준으로 제시하기도 하지만[71], 이러한 기준들은 공장 등에서의 직업성 노출을 전제로 한 값이며 일반 가정 환경에 그대로 적용하기는 어렵다는 점에 유의해야 한다.
일본에서는 노동 안전 위생법[74]에 따라 "명칭 등을 통지해야 할 위험물 및 유해물"로 지정되어 있으며, 일부 지방 자치 단체의 조례나 지침 등에서 배출 규제가 이루어지고 있다. 하지만 노출 한계에 대한 명확한 기준은 없는 실정이다. 일본의 업계 단체인 "일반 사단 법인 일본 이산화 염소 공업회"는 공간 살균 제품의 실내 농도 지침치(자주 기준)를 0.01ppm으로 설정했지만[75], 이는 정상 상태 농도 수준일 뿐 최대 허용 농도나 유효 농도를 의미하는 것은 아니라고 밝히고 있다[76].
2017년 일본 국립병원기구 센다이의료센터 연구진은 신체 착용형 이산화 염소 방산 제제가 제조사의 주장과 달리 병원체 억제 효과가 없었다고 보고했다.[77] 또한 일본 독립행정법인 국민생활센터의 조사[69]에 따르면, 공간 제균을 표방하는 제품 중 상당수가 이산화 염소를 방출하지 않거나, 냄새로 인한 신체 이상 증상을 유발하고, 자체적인 유효성 및 안전성 확인이 미흡한 것으로 나타났다. 목에 거는 형태의 제품 중 일부는 화학 화상을 유발할 수 있는 피부 부식성이나 안전성을 과신하게 만드는 표시가 확인되어 개선이 요구되기도 했다[78].
일본에서는 이산화 염소 제품이 바이러스 감염 예방 효과를 표시하려면 후생노동성의 의약품 제조 판매 승인이 필요하지만[79], 현재 의약품으로 승인된 제품은 없다. 잡화로 판매되면서도 부적절한 표시·광고를 하는 제품이 발견되고 있다. 이러한 문제에 대응하기 위해 업계 단체[80]가 설립되었음에도 불구하고, 일부 가맹 기업 제품에서 우량 오인 및 유리 오인 표시가 적발되어 경품 표시법 위반으로 조치 명령을 받기도 했다[81][82].
참조
[1]
CRC91
[2]
서적
Chlorine dioxide (gas)
https://apps.who.int[...]
World Health Organization.
2002
[3]
IDLH
Chlorine dioxide
[4]
PGCH
[5]
Greenwood&Earnshaw2nd
[6]
웹사이트
mp-23207: ClO2 (Orthorhombic, Pbca, 61)
https://materialspro[...]
2022-11-03
[7]
논문
The Three-Electron Bond in Chlorine Dioxide
http://authors.libra[...]
1933-03
[8]
서적
General chemistry
https://archive.org/[...]
Dover Publications
[9]
논문
Core-level excitation and fragmentation of chlorine dioxide
[10]
간행물
A Review of Chlorine Dioxide in Drinking Water Treatment
http://www.jstor.org[...]
1986
[11]
논문
Studies of free radical reactivity by the methods of flash photolysis. The photochemical reaction between chlorine and oxygen
http://xlink.rsc.org[...]
1953
[12]
서적
Inorganic Syntheses
[13]
Ullmann
Chlorine Oxides and Chlorine Oxygen Acids
2010
[14]
conference
Mechanism of the Methanol Based ClO2 Generation Process
http://www.tappi.org[...]
TAPPI
[15]
서적
The handbook of chlorination and alternative disinfectants
John Wiley
[16]
서적
Inorganic Chemistry: An Industrial and Environmental Perspective
https://archive.org/[...]
Academic Press
[17]
citation
Alternative Disinfectants and Oxidants Manual, chapter 4: Chlorine Dioxide
https://www.epa.gov/[...]
US Environmental Protection Agency: Office of Water
1999-04
[18]
서적
Practical Chlorine Dioxide
Greg D. Simpson & Associates
2005
[19]
서적
Wood Chemistry: Fundamentals and Applications
Academic Press
[20]
웹사이트
AET – Reports – Science – Trends in World Bleached Chemical Pulp Production: 1990–2005
http://www.aet.org/s[...]
2016-02-26
[21]
논문
Maturing and Bleaching Agents in Producing Flour
1952
[22]
논문
Trihalomethane formation during chemical oxidation with chlorine, chlorine dioxide and ozone of ten Italian natural waters
[23]
논문
A pilot study on trihalomethane formation in water treated by chlorine dioxide
[24]
논문
Implementation of chlorine dioxide disinfection: Effects of the treatment change on drinking water quality in a full-scale distribution system
[25]
논문
Trihalomethanes as initiators and promoters of carcinogenesis
[26]
웹사이트
Guidelines for drinking-water quality, 4th edition, incorporating the 1st addendum
https://www.who.int/[...]
World Health Organization
2021-11-29
[27]
웹사이트
Chlorine dioxide as a disinfectant
https://www.lenntech[...]
Lenntech
2021-11-25
[28]
논문
Chlorine dioxide wash of shrimp and crawfish an alternative to aqueous chlorine
[29]
서적
Disinfection, Sterilization, and Preservation
Lippincott, Williams & Wilkins
[30]
논문
Safety and Efficacy of Chlorine Dioxide for ''Legionella'' control in a Hospital Water System
http://www.legionell[...]
2009-11-27
[31]
논문
Protective effect of low-concentration chlorine dioxide gas against influenza A virus infection
2008-01
[32]
웹사이트
Chlorine Dioxide & Chlorite {{!}} Public Health Statement {{!}} ATSDR
https://wwwn.cdc.gov[...]
Centers for Disease Control and Prevention
2021-11-25
[33]
논문
Air Disinfection with Chlorine Dioxide in Saps
http://www.csa.com/p[...]
[34]
웹사이트
Anthrax spore decontamination using chlorine dioxide
http://www.epa.gov/o[...]
Environmental Protection Agency
2009-11-27
[35]
논문
Efficacy of Gaseous Chlorine Dioxide as a Sanitizer for Killing Salmonella, Yeasts, and Molds on Blueberries, Strawberries, and Raspberries
International Association for Food Protection
[36]
웹사이트
How we know disinfectants should kill the COVID-19 coronavirus
https://cen.acs.org/[...]
2020-03-28
[37]
웹사이트
List N: Disinfectants for Use Against SARS-CoV-2
https://www.epa.gov/[...]
2020-03-28
[38]
간행물
Chlorine Dioxide Pouches Can Make Produce Safer and Reduce Spoilage
https://www.ars.usda[...]
USDA Agricultural Research Service
2018-06-21
[39]
웹사이트
The truth behind the chlorinated chicken panic
https://www.bigissue[...]
2020-02-05
[40]
논문
An evaluation of the use of chlorine dioxide (Tristel One-Shot) in an automated washer/disinfector (Medivator) fitted with a chlorine dioxide generator for decontamination of flexible endoscopes
[41]
웹사이트
Tristel Wipes System Product Information
https://web.archive.[...]
2012-11-01
[42]
논문
Gaseous chlorine dioxide as an alternative for bedbug control
[43]
웹사이트
How to Treat Backcountry Water on the Cheap
https://www.sierracl[...]
Sierra Club
2021-02-10
[44]
웹사이트
A Guide to Drinking Water Treatment and Sanitation for Backcountry & Travel Use
https://www.cdc.gov/[...]
Centers for Disease Control and Prevention
2021-02-10
[45]
논문
Effects of Chlorine Dioxide on Oral Hygiene - A Systematic Review and Meta-analysis
2020
[46]
논문
Daily use of chlorine dioxide effectively treats halitosis: A meta-analysis of randomised controlled trials
2023
[47]
웹사이트
Toxicological Profile for Chlorine Dioxide and Chlorite
https://web.archive.[...]
Agency for Toxic Substances and Disease Registry, US HHS
[48]
논문
Explosive decomposition of gaseous chlorine dioxide
http://xlink.rsc.org[...]
1994
[49]
웹사이트
ATSDR: ToxFAQs™ for Chlorine Dioxide and Chlorite
https://wwwn.cdc.gov[...]
[50]
웹사이트
Occupational Safety and Health Guideline for Chlorine Dioxide
https://web.archive.[...]
2012-12-08
[51]
웹사이트
Parents are poisoning their children with bleach to 'cure' autism. These moms are trying to stop it.
2019-05-21
[52]
웹사이트
Fake news: Chlorine dioxide won't stop coronavirus
https://www.detroitn[...]
2020-04-03
[53]
뉴스
E.P.A. Threatens Legal Action Against Sellers of Fake Coronavirus Cleaners
https://www.nytimes.[...]
2020-04-03
[54]
웹사이트
Those coronavirus 'cures' you're hearing about? They're fake. Don't drink chlorine dioxide.
https://www.usatoday[...]
2020-04-03
[55]
웹사이트
Drinking bleach will not cure cancer or autism, FDA warns
2019-08-13
[56]
웹사이트
Group of SoCal parents secretly try to cure kids with autism using bleach
https://abc7news.com[...]
American Broadcasting Company
2019-03-24
[57]
웹사이트
The fake cures for autism that can prove deadly
https://www.theguard[...]
2019-03-24
[58]
웹사이트
Press Announcements – FDA Warns Consumers of Serious Harm from Drinking Miracle Mineral Solution (MMS)
https://www.fda.gov/[...]
[59]
웹사이트
'Miracle' Treatment Turns into Potent Bleach
https://www.fda.gov/[...]
U.S. Food and Drug Administration
2017-12-06
[60]
웹사이트
FDA Warns Consumers of Serious Harm from Drinking Miracle Mineral Solution (MMS)
https://web.archive.[...]
Food and Drug Administration
2018-04-05
[61]
웹사이트
FDA warns consumers about the dangerous and potentially life threatening side effects of Miracle Mineral Solution
https://www.fda.gov/[...]
Food and Drug Administration
2019-08-16
[62]
문서
ICSC 0127
https://www.ilo.org/[...]
[63]
문서
Determination of the structure of liquid containing free radical molecules: Inter-molecular correlations in liquid chlorine dioxide. Molecular Physics vol.111, No.8, 1015-1022(2013)
[64]
뉴스
二酸化塩素をガス化して噴出させるエアコンを電機メーカーが開発中であり、ホテルやオフィスからの問い合わせが増加した、との内容であった。
テレビ東京
2008-05-02
[65]
뉴스
星野監督 インフル対策の秘密兵器を大量注文
https://www.sponichi[...]
2012-02-09
[66]
논문
二酸化塩素放出薬のインフルエンザ様疾患に対する予防効果
https://doi.org/10.4[...]
日本環境感染学会
2010
[67]
문서
Toxiological Profile for Chroline Dioxide and Chlorite, U.S. Department of Health and Human Services, Public Health Service Agency for Toxic Substances and Disease Registry, 2004
https://www.atsdr.cd[...]
[68]
문서
TWAで、塩素が0.5ppmなのに対して二酸化塩素は0.1ppm。
[69]
간행물
二酸化塩素による除菌をうたった商品-部屋等で使う据置タイプについて-
http://www.kokusen.g[...]
国民生活センター
2010-11-11
[70]
문서
TABLE Z-1 Limits for Air Contaminants. - 1910.1000 TABLE Z-1
http://www.osha.gov/[...]
[71]
웹사이트
二酸化塩素とは? 日本二酸化塩素工業会
http://chlorinedioxi[...]
2013-01-06
[72]
문서
[73]
웹사이트
Occupational Safety and Health Guideline for Chlorine Dioxide
http://www.osha.gov/[...]
2013-01-06
[74]
문서
[75]
웹사이트
"二酸化塩素の自主運営基準設定のための評価について-ガス製品-"
http://chlorinedioxi[...]
[76]
웹사이트
-二酸化塩素ガスの室内濃度指針値の公開に際して-(日本二酸化塩素工業会自主運営基準設定のための評価について)
http://chlorinedioxi[...]
[77]
논문
身体装着型の二酸化塩素放散製剤の検証
https://doi.org/10.4[...]
2017
[78]
웹사이트
首から下げるタイプの除菌用品の安全性-皮膚への刺激性を中心に-
https://www.kokusen.[...]
独立行政法人国民生活センター
2013-12-07
[79]
문서
[80]
PDF
"「一般社団法人 日本二酸化塩素工業会」を設立"
http://chlorinedioxi[...]
同会Press Release
[81]
PDF
二酸化塩素を利用した空間除菌を標ぼうするグッズ販売業者17社に対する景品表示法に基づく措置命令について
http://www.caa.go.jp[...]
消費者庁
2014-03-27
[82]
PDF
大幸薬品株式会社に対する景品表示法に基づく措置命令について
https://www.caa.go.j[...]
消費者庁
2022-01-20
[83]
문서
[84]
웹사이트
二酸化塩素FAQ
https://www.finex21.[...]
2018-12-12
[85]
CRC
[86]
서적
Chlorine dioxide (gas)
https://apps.who.int[...]
World Health Organization
2002
[87]
IDLH
[88]
PGCH
[89]
서적
이산화염소
世和
2001
[90]
웹인용
이산화 염소 MSDS
http://www.pureline.[...]
2008-06-05
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
