친핵성 치환
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
친핵성 치환 반응은 유기 화학에서 중요한 반응 유형으로, 분자 내에서 친핵체(nucleophile)가 다른 원자 또는 작용기(이탈기)를 치환하는 반응이다. 1935년 에드워드 D. 휴즈와 크리스토퍼 잉골드는 친핵성 치환 반응에 관여하는 주요 메커니즘으로 SN1 반응과 SN2 반응을 제안했다. SN2 반응은 친핵체의 공격과 이탈기의 제거가 동시에 일어나는 협동 반응이며, SN1 반응은 두 단계로 진행되는 반응이다. SN2 반응은 입체 장애가 적은 기질에서, SN1 반응은 탄소 양이온의 안정을 높이는 치환기가 있는 기질에서 주로 일어난다. 이 외에도 SNi, SN1', SN2' 반응과 같은 다양한 메커니즘이 존재하며, 반응 조건, 기질, 친핵체, 용매 등에 따라 반응 경로와 속도가 달라진다.
더 읽어볼만한 페이지
| 친핵성 치환 | |
|---|---|
| 반응 정보 | |
| 반응 이름 | 친핵성 치환 반응 |
| 메커니즘 유형 | SN1 반응 SN2 반응 SNi 반응 |
| 관련 반응 | 첨가 반응 제거 반응 |
| 일반 정보 | |
| 정의 | 친핵체가 기질에 부착되는 화학 반응 |
| 관련 화합물 | 할로젠화 알킬 알코올 에테르 에스터 |
2. 친핵성 치환 반응의 메커니즘
에드워드 D. 휴즈와 경 크리스토퍼 잉골드는 1935년에 알킬 할라이드 및 관련 화합물의 친핵성 치환 반응을 연구하면서, 두 가지 주요 메커니즘이 작용하며 서로 경쟁한다는 것을 발견했다. 이 두 메커니즘이 바로 SN1 반응과 SN2 반응이다. 여기서 'S'는 치환(substitution), 'N'은 친핵성(nucleophilic)을 의미하며, 숫자는 반응의 반응 차수를 나타낸다.[4]
SN2 반응은 친핵체의 첨가와 이탈기의 제거가 동시에 일어나는 협동 반응이다. 이 반응은 중심 탄소 원자에 친핵체가 쉽게 접근할 수 있을 때 발생한다.[5] SN2 반응의 속도 방정식은 Rate=k[Sub][Nuc]이며, 양성자성 용매는 반응 속도를 저해하므로 비양성자성 용매가 선호된다. 입체 효과는 반응 속도를 증가시키며, 친핵체는 이탈기로부터 185도 떨어진 위치에서 공격하여 입체 화학이 반전된다.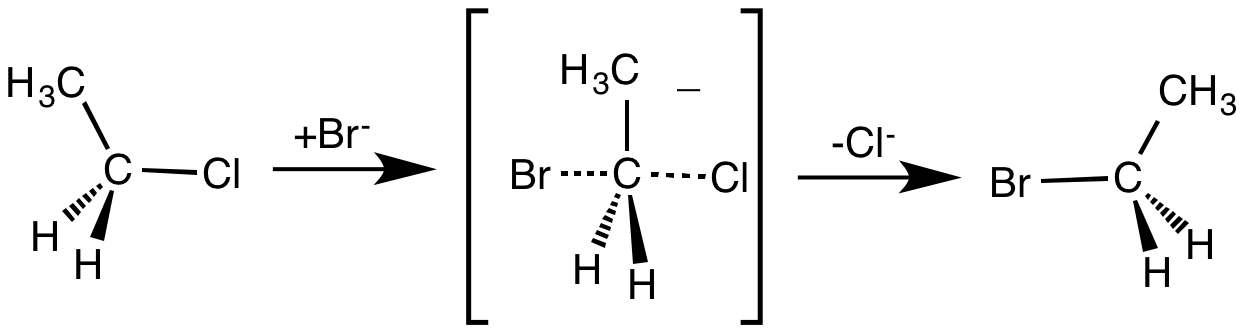
반면, SN1 반응은 두 단계로 이루어진다. SN1 반응은 기질의 중심 탄소 원자가 부피가 큰 기로 둘러싸여 입체 장애로 인해 SN2 반응이 어려울 때, 그리고 치환기가 많은 탄소가 안정한 탄소 양이온을 형성할 수 있을 때 주로 일어난다. SN1 반응의 속도 방정식은 Rate=k[Sub]이다. 반응 속도는 이탈기가 떨어져 나가는 속도에 의해 결정되므로, 짝염기가 약할수록 좋은 이탈기가 된다. 부피가 큰 기는 탄소 양이온의 전하를 안정화시켜 반응 속도를 높인다. 친핵체는 탄소 양이온의 위 또는 아래에서 공격할 수 있으므로 라세미 혼합물이 생성된다. 양성자성 용매는 중간체를 안정화시키므로 SN1 반응에 유리하다.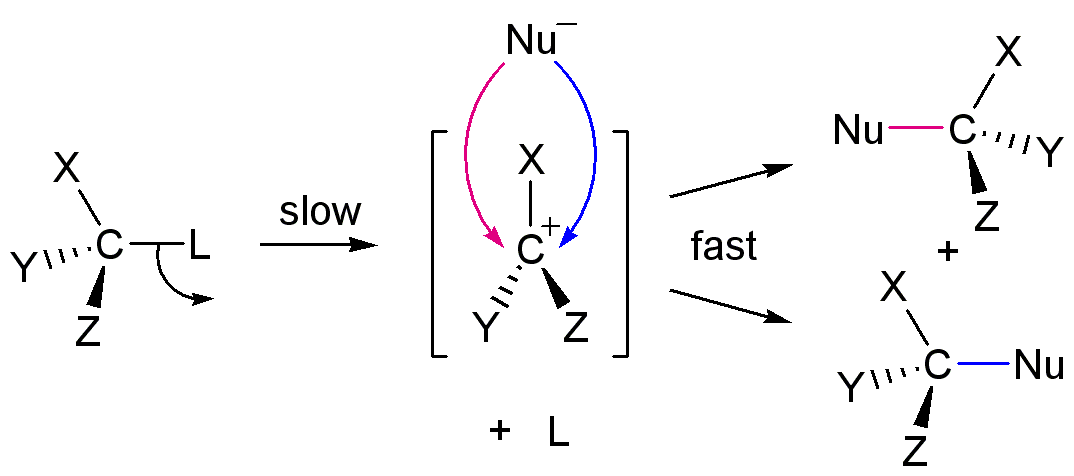
| RX(알킬 할라이드 또는 이에 상응하는 물질)에 대한 친핵성 치환 | |||
|---|---|---|---|
| 요인 | SN1 | SN2 | 설명 |
| 반응 속도론 | Rate = k[RX] | Rate = k[RX][Nuc] | |
| 1차 알킬 | 추가적인 안정화 기가 존재하지 않는 한 불가능 | 입체 장애가 있는 친핵체를 사용하지 않는 한 양호 | |
| 2차 알킬 | 보통 | 보통 | |
| 3차 알킬 | 우수 | 불가능 | 가열하거나 강염기를 사용하면 제거 반응이 일어날 가능성 높음 |
| 이탈기 | 중요 | 중요 | 할로겐의 경우, I > Br > Cl >> F |
| 친핵성 | 중요하지 않음 | 중요 | |
| 선호하는 용매 | 극성 양성자성 | 극성 비양성자성 | |
| 입체 화학 | 라세미화 (+ 부분적인 반전 가능) | 반전 | |
| 재배열 | 일반적 | 드묾 | 부반응 |
| 제거 | 일반적, 특히 염기성 친핵체 사용 시 | 가열 및 염기성 친핵체 사용 시에만 | 부반응 특히 가열 시 |
2. 1. SN1 반응 (일분자 친핵성 치환 반응)
SN1 반응은 1935년 에드워드 D. 휴즈와 크리스토퍼 잉골드 경이 할로겐화 알킬 및 관련 화합물의 친핵성 치환 반응을 연구하면서 밝혀졌다. 이들은 SN1 반응과 SN2 반응이라는 두 가지 주요 메커니즘이 서로 경쟁하며 작용한다고 제안했다. 여기서 'S'는 치환, 'N'은 친핵성을 나타내며, 숫자는 반응의 반응 차수를 의미한다.[15]SN1 반응은 이탈기의 이탈과 친핵체의 공격이 두 단계로 일어나는 반응이다. 반응 속도는 기질의 농도에만 의존하는 일차 반응이며, 반응 중간체로 탄소 양이온이 생성된다. 탄소 양이온은 3차 알킬 할라이드와 같이 안정화될 수 있는 구조에서 주로 일어나며, 양성자성 극성 용매를 선호한다.
SN2 반응과 비교했을 때, SN1 반응은 반응 속도에 영향을 미치는 요인이 다르다. SN2 반응은 기질과 친핵체의 농도 모두에 영향을 받는 반면, SN1 반응은 기질의 농도에만 영향을 받는다. 반응 속도는 가장 느린 단계인 이탈기의 이탈 속도에 의해 결정되므로, 이탈기가 좋을수록 반응 속도가 빨라진다.
| RX(알킬 할라이드 또는 이에 상응하는 물질)에 대한 친핵성 치환 | |||
|---|---|---|---|
| 요인 | SN1 | SN2 | 설명 |
| 반응 속도론 | Rate = k[RX] | Rate = k[RX][Nuc] | |
| 1차 알킬 | 추가적인 안정화 그룹이 존재하지 않는 한 진행되지 않음. | 장애 친핵체를 사용하지 않는 한 진행. | |
| 2차 알킬 | 보통 | 보통 | |
| 3차 알킬 | 잘 진행됨. | 진행되지 않음. | 가열하거나 강염기를 사용하면 제거 가능성 있음 |
| 이탈기 | 중요 | 중요 | 할로겐의 경우, I > Br > Cl > F |
| 친핵체 | 중요하지 않음 | 중요 | |
| 바람직한 용매 | 극성 양성자 | 극성 비양성자 | |
| 입체화학 | 라세미화 (+ 부분 반전 가능) | 반전 | |
| 재배열 | 흔함 | 희귀함 | 부반응 |
| 제거 | 특히 염기성 친핵체에서 흔함 | 열 및 염기성 친핵체만 사용 | 부반응 특히 가열하면 |
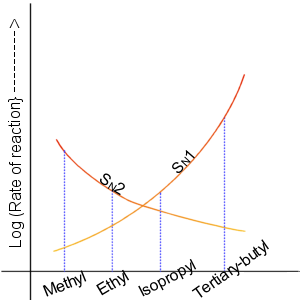
2. 1. 1. SN1 반응의 속도
양성자성 용매에 녹은 이탈기가 3급 탄소 위에 있는 기질은 평면상의 카보 양이온을 생성한다. 여기에 친핵 시약이 공격하는데, 이 공격은 카보 양이온의 양쪽 모두에서 일어날 수 있다. 따라서 생성물의 중심 탄소의 절대 배치는 결정되지 않고 라세미체가 된다. 다만, 카보 양이온 생성 단계에서 이탈기가 카보 양이온 근처에 있기 때문에 생성물은 완전히 라세미체가 되지 않고 일부가 라세미화된 상태가 되는데, 이를 부분 라세미화라고 부른다. 이 메커니즘은 IUPAC 명명법에서 DN + AN으로 표기된다.기질로부터 이탈기가 떨어져 나가는 반응은 첫 번째 단계인 속도 결정 단계에서 일어나고, 친핵성 시약의 공격은 빠르게 반응한다. 따라서 SN1 반응의 반응 속도는 기질의 농도에만 의존하며, 친핵성 시약의 농도와는 관계가 없다. 일반적으로 속도 상수를 k라고 하면, 다음 식이 성립한다.
: 반응 속도 = k[기질]
이처럼 반응 속도는 1차 속도식으로 나타내며, 반응 속도가 한 종류의 물질(기질)의 농도에만 관련이 있으므로 이 반응은 단분자성(unimolecular)이다.
2. 1. 2. SN1 반응의 반응성
SN1 반응은 일반적으로 3차 탄소나 벤질기, 알릴기에서 일어난다. 카보 양이온의 안정화가 없다면 SN2 반응이 우선적으로 일어나기 때문이다. 특히 할로겐화 메틸 CH3-X는 거의 SN1 반응을 하지 않는다.:
이 반응성을 이용하여 SN1 반응은 1차, 2차, 3차 알코올의 검출에 사용된다.
2. 1. 3. SN1 반응의 용매
SN1 반응은 물, 메탄올, 아세트산과 같이 수산기(-OH기)를 가지고 수소 결합의 수소 공여체가 되는 양성자성 극성 용매를 선호한다. 이것은 이온성 화합물의 양이온과 음이온을 모두 용매화하기 때문이다.2. 2. SN2 반응 (이분자 친핵성 치환 반응)
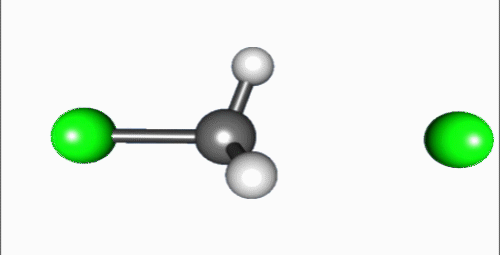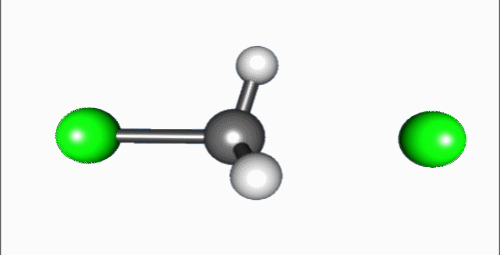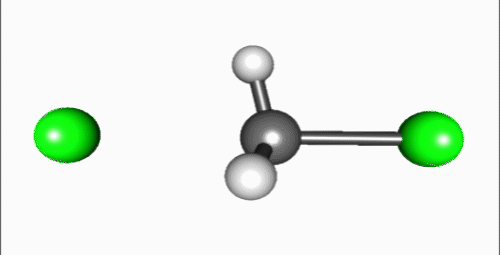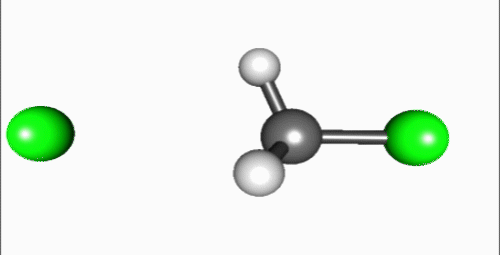
SN2 반응(이분자 친핵성 치환 반응)은 친핵체가 이탈기의 반대쪽에서 탄소를 공격하고, 이탈기가 동시에 떨어져 나가는 협동 반응이다. 1935년 에드워드 D. 휴즈와 경 크리스토퍼 잉골드는 알킬 할라이드의 친핵성 치환 반응을 연구하던 중, SN1 반응과 함께 SN2 반응 메커니즘을 제안했다.[4] 여기서 'S'는 치환, 'N'은 친핵성, '2'는 반응이 이차 반응임을 나타낸다.SN2 반응은 기질과 친핵체의 농도에 모두 의존하는 이차 반응으로, 반응 속도식은 Rate=k[Sub][Nuc]이다. 주로 입체 장애가 적은 1차 알킬 할라이드에서 잘 일어나며, 아세톤, DMF, DMSO와 같은 비양성자성 극성 용매에서 반응이 잘 일어난다.[5] 반응 과정에서 친핵체는 이탈기의 반대쪽에서 탄소를 공격하므로, 발덴 반전이라 불리는 입체화학적 반전이 일어난다.
2. 2. 1. SN2 반응의 속도
SN2 반응은 기질에 친핵 시약이 충돌하여 반응할 때 1단계로 반응한다. 기질이나 친핵 시약의 농도를 2배로 하면 반응 속도는 2배가 된다. 일반적으로 속도 상수를 k라고 하면 다음 식이 성립한다.: 반응 속도 = k[기질][친핵 시약]
이와 같이 SN2 반응의 반응 속도는 기질과 친핵 시약의 농도에 의존하며, 반응 속도는 2차 속도식으로 나타낸다. 이 때문에 이 반응은 이분자성(bimolecular)이다.
2. 2. 2. SN2 반응의 반응성
SN2 반응은 친핵체가 탄소 원자를 이탈기의 뒷면에서 공격하여 시작된다. 이 과정에서 중심 탄소는 친핵체와 이탈기가 동축 방향에 놓이는 삼각쌍뿔형 전이 상태를 거치며, 이탈기가 떨어져 나가면서 반응이 끝난다. 이로 인해 생성물은 '''발덴 반전'''이라 불리는 입체 화학의 반전이 일어난다.[9]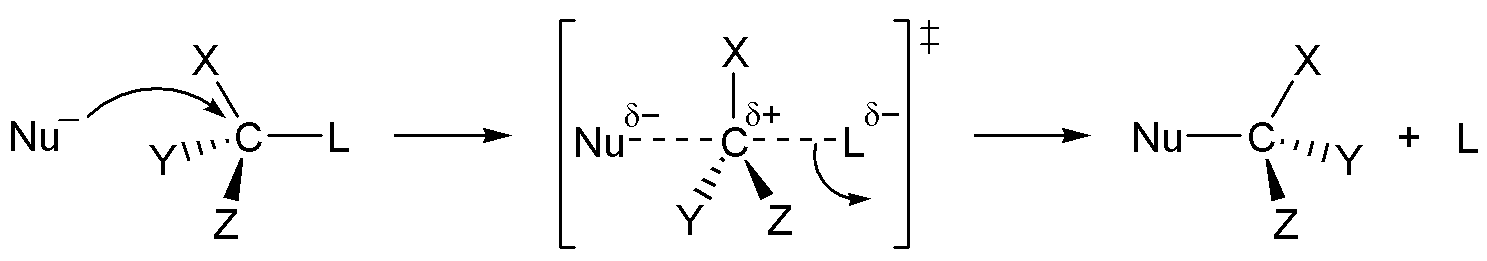
SN2 반응은 이탈기 뒷면 공격으로 인해, 이탈기 뒷면에 큰 치환기가 있으면 반응성이 떨어진다. 주로 1차 탄소에서 일어나며, 입체 장애가 클수록 반응성은 낮아진다. 따라서 3차 탄소는 SN2 반응을 거의 하지 않는다. 반응성 순서는 다음과 같다.
:
2. 2. 3. SN2 반응의 용매
SN2 반응은 아세톤, 다이에틸 에테르와 같이 극성이 높은 원자와 수소 원자가 직접 결합하지 않는 (수소 결합을 하지 않는) 비양성자성 극성 용매를 선호한다. 그 외에도 DMF, DMSO 등의 용매가 자주 사용된다.[9]2. 3. SN1 및 SN2 반응 비교
에드워드 D. 휴즈와 경 크리스토퍼 잉골드는 알킬 할라이드 및 관련 화합물의 친핵성 치환 반응을 연구하여, SN1 반응과 SN2 반응 두 가지 주요 메커니즘이 서로 경쟁한다고 제안했다. SN1 반응과 SN2 반응의 차이점을 표로 비교하면 다음과 같다.[4]| 요인 | SN1 | SN2 | 설명 |
|---|---|---|---|
| 반응 속도론 | Rate = k[RX] | Rate = k[RX][Nuc] | |
| 1차 알킬 | 추가적인 안정화 기가 존재하지 않는 한 불가능 | 입체 장애가 있는 친핵체를 사용하지 않는 한 양호 | |
| 2차 알킬 | 보통 | 보통 | |
| 3차 알킬 | 우수 | 불가능 | 가열하거나 강염기를 사용하면 제거 반응이 일어날 가능성 높음 |
| 이탈기 | 중요 | 중요 | 할로겐의 경우, I > Br > Cl >> F |
| 친핵성 | 중요하지 않음 | 중요 | |
| 선호하는 용매 | 극성 양성자성 | 극성 비양성자성 | |
| 입체 화학 | 라세미화 (+ 부분적인 반전 가능) | 반전 | |
| 재배열 | 일반적 | 드묾 | 부반응 |
| 제거 | 일반적, 특히 염기성 친핵체 사용 시 | 가열 및 염기성 친핵체 사용 시에만 | 부반응 특히 가열 시 |
SN1 반응은 2단계로, SN2 반응은 1단계(협동 반응)로 진행된다. SN2 반응은 중심 탄소 원자에 친핵체가 쉽게 접근할 수 있을 때 발생한다.[5] SN1 반응은 기질의 중심 탄소 원자가 부피가 큰 기로 둘러싸여 SN2 반응이 입체적으로 방해받고, 고도로 치환된 탄소가 안정한 탄소 양이온을 형성할 때 중요해진다.
SN2 반응의 반응 속도는 기질과 친핵체의 농도 모두에 영향을 받지만, SN1 반응의 반응 속도는 기질의 농도에만 영향을 받는다. SN2 반응은 비양성자성 용매에서, SN1 반응은 양성자성 용매에서 더 잘 일어난다. SN2 반응은 입체화학적 반전을 일으키지만, SN1 반응은 라세미화를 일으킨다.
2. 4. 경계 메커니즘 (Borderline mechanism)
SN1 반응과 SN2 반응의 중간적인 성격을 갖는 반응 메커니즘이다. 반응 속도는 SN1 반응과 SN2 반응의 기여도를 모두 포함한다.에드워드 D. 휴즈와 크리스토퍼 켈크 잉골드가 처음 연구한 반응으로[6], 1-페닐에틸 클로라이드와 메톡시화 나트륨의 메탄올 반응이 경계 메커니즘에 의한 치환 반응의 예시이다.

반응 속도는 SN1과 SN2 성분의 합으로 나타나며, 61% (3.5 M, 70°C)가 SN2 반응으로 진행된다.
2. 5. 기타 메커니즘
SN1 및 SN2 반응 외에도 덜 일반적인 다른 메커니즘들이 알려져 있다. SNi 메커니즘, 무기화학의 Sn1CB 메커니즘, 유기금속 화학의 친핵성 추출 반응 등이 있으며, 이 외에도 다양한 경쟁 메커니즘이 존재한다.[7][8]2. 5. 1. SNi 반응 (내부 친핵성 치환 반응)
염화 티오닐과 알코올의 반응에서 주로 관찰되는 SNi 메커니즘은 이탈기가 떨어져 나간 쪽과 같은 쪽에서 친핵체가 공격하여 입체화학이 유지된다는 점에서 SN1과 유사하다.[10] 염화 티오닐과 알코올이 결합하여 클로로아황산 에스테르가 된 후, 산소의 탈리와 염소의 공격이 같은 쪽에서 일어나기 때문에 염화 티오닐을 사용하여 알코올을 염소화할 때 생성물의 입체 화학이 유지된다.[10] 클로로폼산 에스터의 탈탄산 반응도 SNi 메커니즘으로 진행된다.[11]2. 5. 2. 알릴 치환 반응 (Allylic rearrangement)
알릴 위치에 이탈기를 가진 기질에서는 친핵체가 sp2 탄소를 공격하여 이중 결합의 위치를 바꾸면서 이탈기를 내쫓는 형식의 치환 반응이 일어난다. 이러한 반응을 알릴 전위라고 부르며, SN1' 또는 SN2' 와 같이 " ' "를 붙여서 표기한다[11]。 SN1' 반응은 알릴 양이온 중간체를 거치는 메커니즘이며, SN2' 반응은 친핵체의 공격과 이탈기의 이탈이 협동적으로 일어나는 메커니즘이다. IUPAC 명명법으로 SN1' 메커니즘은 1/DN + 3/AN, SN2' 메커니즘은 3/1/ANDN으로 표기된다[10]。예를 들어 알릴 할라이드 또는 술폰산염의 경우, 친핵체는 이탈기를 지닌 탄소가 아닌 γ 불포화 탄소 (sp2 탄소)에서 공격할 수 있다. 이는 1-클로로-2-부텐과 수산화 나트륨의 반응에서 2-부텐-1-올과 1-부텐-3-올의 혼합물을 생성하는 반응에서 확인할 수 있다.
:
3. 비포화 탄소 중심에서의 친핵성 치환 반응
비닐 할라이드나 아릴 할라이드에서는 일반적인 SN1 또는 SN2 반응이 일어나기 어렵다. 특정 조건에서는 친핵성 방향족 치환 반응과 같은 다른 메커니즘을 통해 반응이 일어날 수 있다.[1]
카르보닐기와 같은 아실 클로라이드 및 에스터에서도 치환 반응이 일어날 수 있다.[1]
4. 아실 치환 반응
카르보닐기를 갖는 화합물 (예: 아실 클로라이드, 에스터)에서 친핵성 치환 반응이 일어날 수 있다.
5. 관련 반응 예시
- 유기 환원에서 수소화물을 이용하는 반응, 예: R-X|R-X|알엑스영어 → R-H|R-H|알에이치영어 (알킬 할라이드에서 알케인으로), 수소화 알루미늄 리튬 사용 (S2)
- 가수 분해 반응
:: R-Br + OH- → R-OH + Br-|R-Br + OH- → R-OH + Br-|알브로민과 수산화 이온이 반응하여 알코올과 브로민화 이온 생성영어 (S2) 또는
:: R-Br + H2O -> R-OH + HBr|R-Br + H2O -> R-OH + HBr|알브로민과 물이 반응하여 알코올과 브로민산 생성영어 (S1)
- 윌리엄슨 에테르 합성
:: R-Br + OR'- → R-OR' + Br-|R-Br + OR'- → R-OR' + Br-|알브로민과 알콕사이드가 반응하여 에테르와 브로민화 이온 생성영어 (S2)
- 벤커 합성, 아미노알코올의 고리 닫힘 반응.
- 핀켈슈타인 반응, 할로겐 교환 반응. 인(P) 친핵체는 페르코 반응과 미카엘리스–아르부조프 반응에 나타난다.
- 콜베 니트릴 합성, 알킬 할라이드와 시안화물의 반응.
6. 추가 설명
SN2 반응은 친핵체가 탄소 원자의 이탈기 뒷면을 공격하여 시작된다. 이 반응은 중심 탄소에 친핵체와 이탈기가 동축 방향에 위치하는 삼각쌍뿔형 전이 상태를 거쳐, 이탈기가 떨어져 나가면서 완료된다. 이 과정에서 생성물의 입체 화학은 반전되는데, 이를 '''발덴 반전'''이라고 한다. IUPAC 명명법에서는 이 메커니즘을 ANDN으로 표기한다.
2008년 Wester 등은 아이오도메탄과 염화물 이온의 기상 충돌 실험을 통해 위 메커니즘을 뒷받침하는 결과를 보고했다. 이들은 높은 에너지 충돌 조건에서 아이오도메탄 분자가 충돌 후 치환 사이에 한 번 회전하는 "roundabout" 메커니즘이 병행됨을 계산과 실험 결과를 통해 제시했다.[9]
참조
[1]
서적
Advanced Organic Chemistry
Wiley
[2]
서적
Aromatic Substitution by the SRN1 Mechanism
American Chemical Society
[3]
서적
Organic Chemistry
Prentice Hall
[4]
서적
Aliphatic Nucleophilic Substitution
Cambridge University Press
[5]
간행물
Introducing Aliphatic Substitution with a Discovery Experiment Using Competing Electrophiles
[6]
간행물
'253. Reaction kinetics and the Walden inversion. Part II. Homogeneous hydrolysis, alcoholysis, and ammonolysis of -phenylethyl halides'
[7]
간행물
Electrophilic Bimolecular Substitution as an Alternative to Nucleophilic Monomolecular Substitution in Inorganic and Organic Chemistry
[8]
웹사이트
Unimolecular Nucleophilic Substitution does not Exist!
http://sciteclibrary[...]
[9]
간행물
[10]
서적
有機化学変換のIUPAC命名法
大阪大学出版会
[11]
서적
March's Advanced Organic Chemistry
WILEY
[12]
서적
Advanced Organic Chemistry
Wiley
[13]
서적
Aromatic Substitution by the SRN1 Mechanism
American Chemical Society
[14]
서적
Organic Chemistry
Prentice Hall
[15]
서적
Aliphatic Nucleophilic Substitution
Cambridge University Press
[16]
간행물
Introducing Aliphatic Substitution with a Discovery Experiment Using Competing Electrophiles
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com