HIV 백신 개발
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
HIV 백신 개발은 1980년대 HIV 발견 이후 주요 과제였으나, 바이러스의 특성과 면역 반응의 복잡성으로 인해 어려움을 겪고 있다. HIV는 변이 속도가 빠르고, 면역 체계를 회피하는 능력이 뛰어나 기존 백신 방식으로는 효과를 보기 어렵다. 현재까지 다양한 백신 후보 물질들이 개발되었지만, 임상 시험에서 HIV 감염을 완전히 예방하는 데 성공한 사례는 없다. HIV 백신 개발에는 경제적 문제와 동물 모델의 한계, 임상 시험의 어려움 등 여러 난관이 존재하며, 다양한 접근 방식과 기술들이 연구되고 있다.
더 읽어볼만한 페이지
- HIV/AIDS 예방 - 콘돔
콘돔은 발기된 음경에 씌워 피임과 성병 예방을 위해 사용되는 얇은 막 형태의 피임 도구이며, 다양한 재질과 형태로 만들어지고 올바른 사용 시 높은 피임 효과를 보이지만, 부작용과 사회적 인식에 따른 사용의 차이가 존재한다. - HIV/AIDS 예방 - 노출후 예방요법
노출후 예방요법(PEP)은 광견병, 파상풍, HIV 등 특정 병원체에 노출된 후 감염 위험을 줄이기 위해 백신 접종, 면역글로불린 투여, 항생제 복용 등의 예방적 조치를 즉시 취하는 것을 의미하며, HIV의 경우 72시간 이내 항레트로바이러스 약물 복용이 중요하고 A형 간염, B형 간염, C형 간염, 탄저병, 라임병, 코로나19, 폭스바이러스 등 다양한 감염병에 대한 예방 요법이 존재한다. - 가상 기술 - 인공 일반 지능
인공 일반 지능(AGI)은 추론, 지식 표현, 학습 등의 능력을 갖춘 인공지능 시스템을 의미하며, 기아와 빈곤 해결 등의 이점을 제공하지만 통제력 상실과 같은 위험도 존재한다. - 가상 기술 - 초지능
초지능은 모든 분야에서 인간의 인지 능력을 능가하는 가설상의 지능으로, 인공지능 기술 발전과 함께 인공 초지능의 실현 가능성이 논의되며 윤리적, 안전 문제가 제기되고 있다. - 백신 - 코로나19 백신
코로나19 백신은 코로나19 감염을 예방하기 위해 개발되었으며, 다양한 기술 플랫폼을 기반으로 전 세계적으로 사용되었으나, 백신 접근성 불평등, 허위 정보, 법적 책임 문제 등 논란과 변이 바이러스 출현으로 인한 효과 감소, 부작용 등의 문제도 존재한다. - 백신 - 종두
종두는 천연두 예방 접종법으로, 중국의 인두법에서 시작하여 제너의 우두법으로 발전했으며, 한국에서는 정약용의 인두법 시행과 지석영의 우두법 도입을 거쳐 정부 차원에서 장려되었다.
| HIV 백신 개발 | |
|---|---|
| HIV 백신 개발 개요 | |
 | |
| 목표 | HIV 감염 예방 또는 치료 |
| 접근 방식 | 예방 백신 치료 백신 |
| 연구 단계 | 임상 시험 중 |
| 성공적인 백신 | 아직 없음 |
| 예방 백신 | |
| 목표 | HIV 감염 예방 |
| 작용 메커니즘 | 면역 체계를 자극하여 HIV에 대한 보호 반응 유도 |
| 주요 전략 | 단백질 기반 백신 바이러스 벡터 백신 DNA 백신 mRNA 백신 |
| 임상 시험 | 여러 백신 후보가 임상 시험 진행 중 |
| RV144 임상 시험 | 태국에서 실시된 RV144 임상 시험은 HIV 감염 위험을 약간 감소시키는 결과를 보였으나, 효과는 제한적이었음 |
| 치료 백신 | |
| 목표 | HIV 감염자의 면역 체계를 강화하여 바이러스 억제 |
| 작용 메커니즘 | HIV에 특이적인 T 세포 반응을 강화하여 감염 세포 제거 |
| 주요 전략 | 세포 기반 백신 유전자 치료 백신 |
| 임상 시험 | 여러 백신 후보가 임상 시험 진행 중 |
| 도전 과제 | |
| 높은 다양성 | HIV는 유전적 다양성이 높아 효과적인 백신 개발이 어려움 |
| 잠복 감염 | HIV는 잠복 감염 상태로 존재하여 면역 체계 회피 |
| 면역 회피 | HIV는 면역 체계의 공격을 회피하는 다양한 메커니즘 보유 |
| 윤리적 문제 | 임상 시험 설계 및 참가자 모집에 대한 윤리적 고려 필요 |
| 연구 동향 | |
| 광범위 중화 항체 (bnAbs) | 광범위 중화 항체를 유도하는 백신 개발 연구 활발 |
| mRNA 백신 | mRNA 기술을 이용한 HIV 백신 개발에 대한 관심 증가 |
| 유전자 편집 | CRISPR-Cas9 등의 유전자 편집 기술을 이용한 HIV 치료 연구 진행 |
| 참고 문헌 | |
| 참고 문헌 | Gray GE, Laher F, Lazarus E, Ensoli B, Corey L. Approaches to preventative and therapeutic HIV vaccines. Curr Opin Virol. 2016 Apr;17:104-109. The Moon Landing of HIV Vaccine Research: RV144, Ten Years Later 2004 update on the global AIDS epidemic from UNAIDS. 1 October News. Clin Infect Dis. 2012 Oct 1;55(7):i-ii. Gray GE, Laher F, Doherty T, Abdool Karim S, Hammer S, Mascola J, Beyrer C, Corey L. Which New Health Technologies Do We Need to Achieve an End to HIV/AIDS? PLoS Biol. 2016 Mar 2;14(3):e1002372. |
2. 백신 개발의 어려움
1984년 HIV가 AIDS의 원인으로 밝혀진 후, 당시 미국 보건복지부 장관이었던 마거릿 해클러는 2년 안에 백신이 개발될 것이라고 예상했다.[154][2] 그러나 바이러스 외피 단백질을 인식하여 적응 면역을 유도하는 기존의 백신 개발 방식은 HIV에 효과가 없었으며,[154] 이후 HIV 백신 개발은 다른 일반적인 백신 개발 과정과는 다른 여러 가지 근본적인 어려움에 직면하게 되었다.[155][3]
이러한 어려움에는 HIV 바이러스 자체의 고유한 특성, 인체 면역 반응의 복잡성, 적절한 동물 모델의 부재, 임상 시험 진행의 현실적인 제약 등 다양한 요인이 복합적으로 작용한다.[3] 예를 들어, 일반적인 백신은 감염 후 회복된 사람에게서 나타나는 자연 면역을 모방하지만 AIDS는 자연 회복 사례가 거의 없고,[3] HIV는 감염 후 오랜 잠복기를 거치며,[3] 전통적인 사멸 백신이나 약독화 생백신 형태를 적용하기 어렵다는 문제[3] 등이 초기부터 제기되었다. 또한 HIV는 극도로 변이가 심하고 유전적으로 다양하며,[3] 감염을 효과적으로 막기 위해 어떤 종류의 면역 반응이 필요한지에 대한 명확한 해답도 아직 부족하다.
1996년 등장한 HAART 요법은 HIV 감염자의 증상과 바이러스 수치를 안정시키는 데 큰 효과를 보였지만, HIV 감염의 전 세계적인 확산을 막지는 못했으며, 특히 AIDS 피해가 심각한 국가에서는 안전한 성관계 등의 예방 조치만으로는 한계가 있었다. 따라서 진단되지 않은 감염자를 통한 확산을 막고 AIDS의 세계적 유행을 통제하기 위해서는 효과적인 예방 백신 개발이 여전히 중요한 과제로 남아있다.
미국 국립 알레르기·전염병 연구소(NIAID)의 에이즈 연구 부문장 잭 킬렌 박사가 제시한 이상적인 HIV 백신의 기준은 이러한 개발의 어려움을 잘 보여준다. 이상적인 백신은 안전하고 부작용이 거의 없으며, 모든 HIV 아형과 감염 경로에 대해 강력하고 장기적인 면역 반응을 유도하고, 저렴하게 생산되어 전 세계 어디서든 쉽게 보관하고 투여할 수 있어야 한다. HIV 질병의 근본적인 생물학적 메커니즘에 대한 이해가 깊어질수록 이러한 기준을 충족하는 안전하고 효과적인 백신 설계가 가능해질 것으로 기대된다.
2. 1. HIV의 특성
HIV 백신 개발이 다른 일반적인 백신 개발과 다른 이유는 여러 요인에서 비롯된다.[155][3]
- 자연 면역의 부재: 일반적인 백신은 특정 감염병에서 회복된 사람에게서 나타나는 자연 면역(재감염 방지 능력)을 모방하여 개발된다. 그러나 AIDS로부터 자연적으로 회복되는 경우는 극히 드물다.
- 긴 잠복기: 대부분의 백신은 감염 자체가 아닌 질병의 발현을 막는 것을 목표로 한다. 하지만 HIV는 감염 후 AIDS 증상이 나타나기까지 오랜 잠복기를 가질 수 있다. 따라서 백신은 감염 초기 단계뿐 아니라 긴 잠복기 동안에도 효과를 발휘해야 한다.
- 백신 형태의 한계: 효과적인 백신들은 주로 바이러스를 완전히 사멸시키거나 독성을 약화시킨 형태를 사용한다. 그러나 사멸된 HIV-1은 면역 반응을 유도하는 능력(항원성)을 제대로 유지하지 못하며, 살아있는 약독화 레트로바이러스 백신은 인체에 통합될 수 있는 바이러스의 특성상 안전성 문제를 일으킬 수 있다.
HIV 자체의 생물학적 특성 또한 백신 개발을 어렵게 만드는 주요 요인이다.
- 높은 변이성: HIV는 변이가 매우 심한 바이러스이다. 인체의 면역계가 바이러스를 공격하면(선택적 압력), HIV는 항체를 이용한 체액 면역과 T 세포를 이용한 세포 매개 면역 모두를 회피하는 방향으로 빠르게 변이하며 진화한다.[156][132] 이 때문에 한 가지 형태의 바이러스에 맞춰 개발된 백신이 다른 변이 바이러스에는 효과를 보이지 못할 수 있다.
- 유전적 다양성: HIV는 유전적으로 매우 다양하여 여러 아형(subtype)으로 나뉜다. 효과적인 백신이 되려면 이러한 다양한 아형들을 모두 방어할 수 있을 만큼 광범위한 면역 반응을 유도해야 한다.[134]
- 항원 결정기의 은폐: 바이러스 표면에는 면역 체계가 인식하는 항원 결정기가 존재하는데, HIV의 경우 이 항원 결정기들이 다른 바이러스보다 훨씬 변이가 심하다. 특히, 바이러스가 세포에 침투하는 데 중요한 역할을 하는 외피 단백질(gp120)의 기능적 항원 결정기들은 글리코실화, 단백질 구조 변화(트리머화, 수용체 결합 시 변화) 등을 통해 면역 체계, 특히 중화 항체로부터 스스로를 효과적으로 가린다. HIV 외피 단백질(Env)은 바이러스 표면에서 돌출된 삼량체 구조로, 각 단위는 gp120과 gp41로 구성된다.[9] 이러한 구조적 복잡성 때문에 효과적인 항체 반응을 유도하기 어렵다.
이러한 특성들로 인해 신뢰할 만한 항체 반응을 유도하기 어려워, 세포독성 T세포 반응을 자극하는 백신 개발[4][157] 등 다양한 접근법이 시도되고 있다. 또한, HIV 감염 경로가 주로 성기 점막 등을 통하기 때문에[142] 혈액 내 면역 반응뿐 아니라 점막 면역의 활성화도 중요한 과제로 남아있다.
2. 2. 면역 반응의 복잡성
전통적인 백신 개발 방식은 특정 질병에 걸렸다가 회복한 사람에게서 나타나는 자연 면역력을 모방하는 전략을 사용한다. 하지만 AIDS의 경우, 감염 후 회복되는 사례가 극히 드물어[3] 이러한 접근법을 적용하기 어렵다. 또한 대부분의 백신은 감염 자체보다는 질병의 발현을 막는 데 초점을 맞추지만, HIV는 AIDS로 발전하기 전까지 오랜 잠복기를 가질 수 있다는 특징이 있다.[3]HIV 백신 개발이 어려운 핵심적인 이유 중 하나는 바이러스 자체의 극심한 변이성이다.[3] HIV 바이러스 외피의 항원 결정기는 다른 바이러스들에 비해 훨씬 변화가 심하다. 특히, 바이러스가 세포에 침투하는 데 중요한 역할을 하는 gp120 단백질의 기능적 부위는 당화, 삼량체화, 수용체 결합 시의 구조적 변화 등으로 인해 면역 체계, 특히 중화 항체의 접근이 어렵도록 가려져 있다. HIV는 면역 체계의 공격 (항체 및 T 세포 반응)을 회피하도록 빠르게 진화하며,[132] 감염된 사람 안에서도 다양한 변이 바이러스가 나타난다. 더욱이 HIV는 유전적으로 다양한 여러 아형(subtype)으로 나뉘기 때문에,[134] 효과적인 백신은 이러한 광범위한 변이성을 모두 아우를 수 있어야 한다.[3]
HIV의 주된 감염 경로는 성 접촉 등을 통한 점막 감염이다.[142] 따라서 혈액 내 면역 반응뿐만 아니라, 감염이 시작되는 점막에서의 특이적인 면역 반응을 유도하는 것이 중요하다. 효과적인 HIV 백신은 바이러스를 직접 무력화하는 중화 항체 반응과 감염된 세포를 제거하는 세포 독성 T 림프구(CTL) 반응을 모두 강력하게 유도해야 할 것으로 여겨진다.[4][5] 하지만 현재까지 개발된 백신 후보 물질들은 이 두 가지 면역 반응을 동시에 효과적으로 유도하는 데 어려움을 겪고 있다.[135][136] 어떤 종류의 면역 반응(혈액/점막, 항체/세포성)이 HIV 감염을 가장 효과적으로 방어하는지에 대한 연구자들의 의견도 아직 완전히 일치하지는 않는다.
전통적인 백신에 사용되는 사멸(killed) 바이러스나 약독화(live attenuated) 생백신 방식 역시 HIV에는 적용하기 어렵다. 사멸된 HIV는 항원성을 제대로 유지하지 못하며,[3] 약독화된 생 레트로바이러스 백신은 레트로바이러스가 숙주 세포의 DNA에 통합될 수 있는 특성 때문에 안전성 문제를 일으킬 수 있다.[3][140]
2. 3. 동물 모델의 한계

백신 연구의 대표적인 동물 모델은 원숭이, 특히 마카크이다.[10][100][101] 원숭이는 연구 목적으로 SIV나 키메라 SHIV에 감염될 수 있다. 이는 HIV가 SIV에서 유래했을 가능성이 제기되기 때문이다.
그러나 SIV와 HIV 사이에는 여러 차이점이 존재하여 동물 모델 연구 결과를 인간에게 직접 적용하기 어렵다는 한계가 있다.[13][163] 실제로 바이러스 외피 기반 백신 중 일부는 침팬지나 마카크를 동종 바이러스 감염으로부터 보호했지만,[11][103][161] 유사한 백신을 접종한 사람이 추후 HIV-1에 노출되었을 때는 감염을 막지 못했다.[12][104][162] 또한, 백신 접종을 통해 항체를 유도하는 기존 방식으로는 다양한 종류의 실제 HIV 바이러스(이종 1차 HIV)를 중화시키는 항체를 만들어내는 데 큰 어려움이 따르고 있다.[10][160]
HIV 감염 후 AIDS로 진행되는 과정을 정확히 재현하는 동물 모델이 없다는 점도 큰 제약이다. 침팬지는 인간 외에 HIV-1에 감염되는 유일한 영장류이지만, 감염되어도 AIDS 증상을 나타내지는 않는다.[105] 침팬지는 인간과 유전적으로 유사하여 연구에 활용되었으나, 멸종위기종으로 지정되고 동물 실험에 대한 윤리적 문제가 제기되면서 최근 사용이 줄어들고 있다.[105] 이러한 동물 모델의 한계와 윤리적 논쟁은 백신 개발의 어려움을 가중시키는 요인이다.[13][163]
이러한 한계를 극복하기 위해 인간 HIV 감염과 유사한 환경을 만드는 새로운 동물 모델 연구가 진행 중이다. 예를 들어, 특정 면역 세포(CD4+ T세포)를 조절하거나[14][15][164][165] 특정 백신 연구를 위해 인간화된 유전자를 가진 쥐 모델[16] 등이 개발되고 있다. 쥐에서 발생하는 MAIDS(Murine AIDS) 모델 또한 바이러스 복제 없이 질병이 발생하는 기전 연구 등 특정 가설 검증에 유용하게 사용된다.[17]
2. 4. 임상 시험의 어려움
HIV 백신 개발은 다른 일반적인 백신 개발과 비교했을 때 여러 가지 독특한 어려움에 직면해 있다.[155][3]우선, HIV의 생물학적 특성 자체가 백신 개발을 어렵게 만든다.
- 자연 면역 부재: 일반적인 백신은 감염 후 회복된 사람에게서 나타나는 자연 면역을 모방하는 방식으로 개발되지만, AIDS에서 자연적으로 회복되는 경우는 극히 드물어 모방할 대상이 없다.[3]
- 긴 잠복기: HIV는 감염 후 AIDS 증상이 나타나기까지 오랜 시간 동안 잠복 상태를 유지할 수 있어, 백신이 감염 자체를 막는지 아니면 질병의 발현을 막는지 평가하기 어렵다.[3]
- 백신 형태의 한계: 효과적인 백신으로 알려진 사멸 또는 약독화 생백신 형태를 HIV에 적용하기 어렵다. 사멸시킨 HIV는 면역 반응을 유발하는 능력(항원성)을 유지하기 어렵고, 살아있는 약독화 레트로바이러스 백신은 HIV가 숙주 세포의 DNA에 통합되는 특성 때문에 안전성 문제를 일으킬 수 있다.[3] 만약 비활성화 과정이 불완전하여 살아있는 바이러스가 남게 되면, 오히려 질병을 유발할 위험이 있다.
- 높은 변이성: HIV는 알려진 어떤 바이러스보다 변이 속도가 빠르다.[56] 이 때문에 특정 HIV 변이주에 효과적인 백신이라도 다른 변이주에는 효과가 없을 수 있어, 광범위한 예방 효과를 지닌 백신 개발이 매우 어렵다.
- 면역 반응의 불확실성: 어떤 종류의 면역 반응(예: 항체 생성, 세포성 면역, 혈액 내 반응, 점막 반응)이 HIV 감염을 효과적으로 방어하는지에 대한 명확한 지표(예방 관련 요인)가 아직 확립되지 않았다. 이는 백신 개발의 목표 설정과 효과 평가를 어렵게 만든다.
- 점막 면역의 중요성: 주요 감염 경로인 성관계를 통한 점막 감염을 막기 위해서는 혈액 내 면역 반응뿐 아니라, 성기 등 점막에서의 특이적인 면역 반응, 특히 세포독성 T 세포(CTL)를 포함한 세포성 면역의 활성화가 중요할 것으로 여겨진다. 하지만 점막 면역을 효과적으로 유도하고 측정하는 것은 기술적으로 매우 어렵다.
임상 시험 진행 자체에도 여러 제약 조건이 따른다.
- 적절한 동물 모델 부재: HIV 감염 및 AIDS 발병 과정을 정확히 재현하는 실험 동물이 없어, 백신 후보 물질의 초기 안전성과 유효성을 평가하기 어렵다. 이로 인해 연구자들은 초기 단계부터 인간을 대상으로 하는 임상 시험에 의존할 수밖에 없다.
- 지리적·인프라적 문제: HIV/AIDS 감염자의 대다수가 개발도상국에 집중되어 있지만, 이들 지역에서는 대규모 임상 시험을 수행하고 향후 백신을 보급하는 데 필요한 의료 및 연구 인프라가 부족한 경우가 많다.
- 경제적 문제: 효과적인 백신 개발에는 막대한 연구 개발 비용이 소요되며, 이는 백신 개발의 중요한 장애 요인 중 하나이다.
이러한 복합적인 문제들로 인해 1984년 HIV가 AIDS의 원인으로 밝혀진 직후 2년 내 백신 개발을 예상했던 것과 달리[154][2], 효과적인 HIV 백신 개발은 여전히 중요한 과제로 남아 있다.
3. HIV의 구조 및 복제
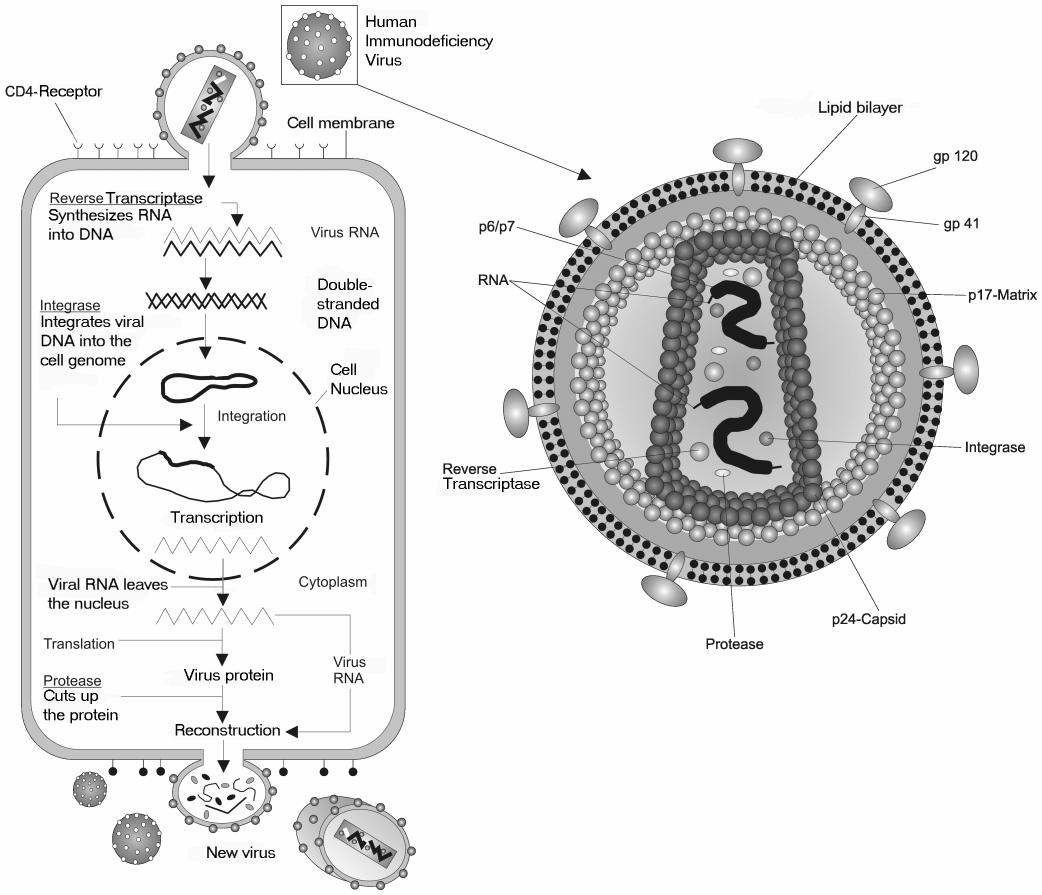
인간 면역 결핍 바이러스(HIV)는 후천성 면역 결핍 증후군(AIDS)을 일으키는 레트로바이러스이다.[59] 1984년 HIV가 AIDS의 원인으로 확인된 후, 당시 미국 보건복지부 장관이었던 마거릿 해클러는 2년 안에 백신이 개발될 것이라고 예측했으나[2], 이는 HIV의 복잡한 특성으로 인해 실현되지 못했다.
HIV는 주로 면역 체계의 핵심 세포인 CD4 양성 T세포를 공격하여 면역 기능을 점진적으로 파괴하며[71], 숙주 세포 내에서 자신의 유전 물질인 RNA를 DNA로 바꾸어 숙주 유전체에 삽입하는 방식으로 복제한다.[73][74] (자세한 내용은 HIV의 구조 및 HIV의 복제 과정 참조)
효과적인 HIV 백신 개발은 다음과 같은 여러 요인으로 인해 매우 어려운 과제로 남아있다.[3]
- 높은 변이성: HIV는 복제 과정에서 유전적 변이가 매우 빈번하게 일어나 면역 체계의 공격을 회피하도록 빠르게 진화한다.[156] 또한 다양한 아형이 존재하여 특정 아형에 효과적인 백신이라도 다른 아형에는 효과가 없을 수 있으므로, 백신은 이러한 광범위한 변이성을 극복해야 한다.
- 항원 결정기의 은폐: 바이러스 표면의 외피 단백질(gp120)에 있는 항원 결정기는 면역 반응의 주요 표적이지만, 다른 바이러스보다 변이가 심할 뿐 아니라 당화, 삼량체화, 수용체 결합 시 구조 변화 등을 통해 중화 항체의 접근으로부터 효과적으로 가려져 있다. 이로 인해 항체를 이용한 바이러스 무력화가 어렵다.
- 자연 면역 부재: 일반적인 백신은 자연 감염 후 회복된 사람에게서 나타나는 면역 반응을 모방하여 개발되지만, HIV 감염에서 자연적으로 회복된 사례는 거의 없다.
- 잠복 감염: HIV는 감염 후 면역 세포 등에 숨어 활동하지 않는 잠복 상태로 오랫동안 존재할 수 있으며, 백신이 감염 자체를 완벽하게 막지 못하면 결국 AIDS로 진행될 수 있다.
이러한 어려움 때문에, 항체 반응 유도에 어려움을 겪자 세포독성 T세포 반응을 유도하는 백신 개발[157][158]이나, 여러 변종에 걸쳐 변이가 적은 부분을 표적으로 하는 펩타이드 백신 개발[159] 등 다양한 접근법이 시도되고 있다.
3. 1. HIV의 구조
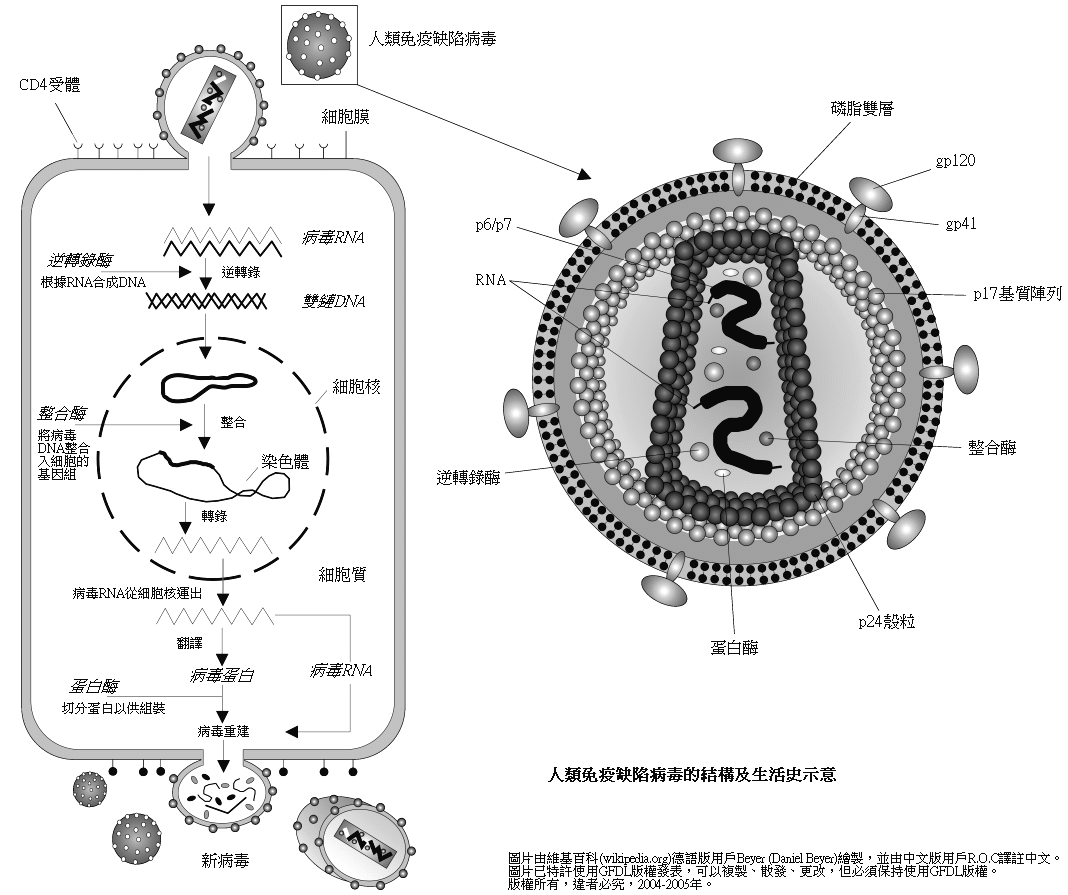
인간 면역 결핍 바이러스(HIV)는 레트로바이러스과에 속하는 바이러스이다. 레트로바이러스는 대체로 유사한 구조, 게놈 구성, 복제 방식을 공유한다. HIV 입자(비리온)는 숙주 세포막에서 유래한 외피(envelope)로 둘러싸여 있다. 이 외피에는 바이러스가 숙주 세포에 부착하고 침투하는 데 중요한 역할을 하는 단백질 돌기가 존재한다. 이 돌기는 표면 당단백질(gp120)과 막 관통 당단백질(gp41)으로 구성된다.[59] 외피 당단백질 gp120은 숙주 세포 표면의 특정 수용체(주로 CD4 수용체)에 결합하며[71], gp41은 바이러스 외피와 숙주 세포막의 융합을 매개하여 바이러스 내용물이 세포 안으로 들어갈 수 있도록 한다. 외피 당단백질 gp120과 gp41은 원래 하나의 전구체 단백질인 gp160으로 합성된 후, 세포 내에서 절단되어 각각의 기능을 수행한다.[62]
HIV 외피의 항원 결정기는 다른 많은 바이러스에 비해 변이가 매우 심하다. 특히, gp120 단백질에서 기능적으로 중요한 항원 결정기 부위는 당화(glycosylation), 단백질 삼량체 형성(삼량체화), 수용체 결합에 따른 구조 변화 등으로 인해 면역 체계, 특히 중화 항체의 접근이 어렵게 가려져 있다. 이러한 특성은 효과적인 HIV 백신 개발을 어렵게 만드는 주요 요인 중 하나이다.
외피 안쪽과 캡시드 바깥쪽 사이에는 매트릭스 단백질(MA, p17) 층이 있어 바이러스 구조를 지지하고 조립 과정에 기여한다. 그 안쪽에는 주요 캡시드 단백질(CA, p24)로 구성된 정이십면체 모양의 캡시드가 있다.
캡시드 내부에는 동일한 단일 가닥 RNA 게놈 두 분자가 존재한다. 이 RNA 게놈은 염기성 핵단백질(NC, p7)과 결합하여 뉴클레오캡시드 복합체를 이룬다.[60][61] 또한 캡시드 안에는 바이러스 복제에 필수적인 효소들인 역전사 효소, 인테그라제[63], 프로테아제[64]가 포함되어 있다. 숙주 세포에서 유래한 tRNA는 역전사 개시에 필요한 프라이머 역할을 한다.[65]
HIV는 외피와 캡시드로 구성된 복잡한 구조를 가지며, 유전 물질인 RNA와 복제 효소들을 내부에 포함하는 레트로바이러스이다.[69]
3. 2. HIV의 복제 과정
인간 면역 결핍 바이러스(HIV)는 레트로바이러스에 속하며, 스스로 생명 활동을 할 수 없고 숙주 세포의 기능을 이용하여 복제한다.[69] HIV는 주로 면역 체계에서 중요한 역할을 하는 CD4 양성 T 림프구(T 세포)를 공격 대상으로 삼는다. 바이러스 복제 과정은 다음과 같은 단계로 이루어진다.# 부착 및 침투: HIV 입자 표면에는 돌기 형태의 외피 단백질(gp120과 gp41)이 존재한다.[59] 이 중 gp120 단백질이 숙주 세포 표면의 CD4 수용체에 먼저 결합한다.[71] 이후, 바이러스가 세포 안으로 들어가기 위해서는 케모카인 수용체와 같은 보조 수용체와의 결합이 추가로 필요하다.[72] 이 결합 과정을 통해 바이러스의 외피와 숙주 세포의 세포막이 융합되고, 바이러스 내부의 유전 물질(RNA)과 효소들이 세포 안으로 들어간다.[71]
# 역전사: 세포질로 들어온 HIV의 RNA 유전 정보는 역전사 효소에 의해 DNA 형태로 변환된다. 이 과정에서 RNA-DNA 혼성 분자를 거쳐 최종적으로 이중 가닥 DNA(프로바이러스)가 만들어진다.[73][74]
# 삽입: 생성된 프로바이러스는 숙주 세포의 핵 안으로 이동한다. 이후 인테그라제라는 효소의 도움을 받아 숙주 세포의 염색체 DNA에 끼어 들어간다. 이렇게 삽입된 프로바이러스는 숙주 세포 유전자의 일부처럼 안정적으로 존재하게 된다.[74]
# 전사 및 번역: 숙주 세포의 전사 기구를 이용하여 프로바이러스 DNA로부터 바이러스 RNA와 mRNA가 만들어진다. 이 mRNA는 숙주 세포의 번역 기구를 통해 바이러스 복제에 필요한 효소들과 구조 단백질들로 번역된다.[74]
# 조립: 새로 만들어진 바이러스 RNA와 단백질들은 세포 내부에서 조립되어 새로운 HIV 입자의 형태를 갖춘다. 이 과정에서 프로테아제라는 효소가 바이러스 단백질들을 적절한 크기로 잘라 성숙한 바이러스 입자를 만드는 데 중요한 역할을 한다.[75][74]
# 방출: 조립된 바이러스 입자는 숙주 세포의 세포막 표면으로 이동하여 바깥으로 빠져나온다(출아). 이 과정에서 바이러스는 숙주 세포막의 일부를 자신의 외피로 획득하게 된다.[74] 방출된 HIV 입자는 다시 다른 세포를 감염시킬 수 있으며, 이 과정에서 원래의 숙주 세포는 파괴되어 사멸한다.[75]
HIV는 이러한 복제 주기를 반복하며 체내에서 증식하고 면역 체계를 점진적으로 파괴한다.
3. 3. HIV의 계통군
인간 면역 결핍 바이러스(HIV)는 발견 초기 다양한 이름으로 불렸다. 1983년 프랑스 파스퇴르 연구소의 뤽 몽타니에 연구팀은 림프절병 관련 바이러스(LAV)를 분리했고, 1984년 미국 샌프란시스코 캘리포니아 대학교의 제이 레비 연구팀은 에이즈 관련 레트로바이러스(ARV)를 발견했다. 같은 해 미국 국립 암 연구소의 로버트 갤로 연구팀은 인간 T세포 림프구성 바이러스 III형(HTLV-III)을 분리하여 발표했다. 이 바이러스들은 T4 보체 세포를 공격하는 특징을 공유했지만, HTLV-I이나 HTLV-II와는 달리 감염된 T세포를 파괴하는 특성을 보였다.초기에는 LAV, ARV, HTLV-III 등 여러 이름이 혼용되었으나, 연구가 진행되면서 이들이 동일한 바이러스임이 밝혀졌다. 한편, 1985년에서 1986년 사이 서아프리카에서 인간 HIV와 유사하지만 다른 새로운 레트로바이러스가 발견되었다. 미국 연구팀은 이를 HTLV-IV, 프랑스 연구팀은 LAV-2라고 명명했다. 이 바이러스는 이후 연구를 통해 인간 에이즈 바이러스보다는 원숭이 면역 결핍 바이러스(Simian Immunodeficiency Virus, SIV)와 더 유사한 것으로 밝혀졌다.
이러한 명칭 혼란을 해결하기 위해 1986년 국제 바이러스 분류 위원회는 공식 명칭을 제정했다. 기존에 LAV, ARV, HTLV-III 등으로 불리던 바이러스는 인간 면역 결핍 바이러스 1형(HIV-1)으로, 서아프리카에서 발견된 LAV-2 계열의 바이러스는 인간 면역 결핍 바이러스 2형(HIV-2)으로 명명되었다. 이에 따라 오늘날 HIV-1은 HTLV-III, LAV, ARV 등의 모든 분리주를 포괄하며, HIV-2는 LAV-2 및 관련 분리주를 지칭하는 공식 명칭으로 사용된다.
3. 4. HIV의 유전체 구조
인간 면역 결핍 바이러스(HIV)는 레트로바이러스과에 속하는 바이러스이다. 레트로바이러스들은 다양한 발병 양상을 보이지만, 대체로 유사한 구조, 게놈 구성, 복제 방식을 공유한다.[59] HIV 입자(비리온)는 숙주 세포의 세포막에서 유래한 외피(envelope)로 둘러싸여 있으며, 이 외피에는 돌기 형태의 단백질 복합체가 존재한다. 이 복합체는 숙주 세포 수용체와 결합하는 외부 당단백질 gp120(SU)과 이를 외피에 고정시키는 막 관통 단백질 gp41(TM)으로 구성된다.[59][62] 외피 내부에는 주요 캡시드 단백질 CA(p24)로 구성된 정이십면체 모양의 캡시드(핵)가 있으며, 캡시드와 외피 사이에는 매트릭스 단백질 MA(p17)가 존재한다. 캡시드 안에는 동일한 단일 가닥 RNA 게놈 두 개가 핵단백질 NC(p7)와 결합하여 뉴클레오캡시드를 형성하고 있다.[60][61] 또한, 바이러스 복제에 필수적인 효소들인 역전사 효소, 프로테아제, 인테그라제 등도 캡시드 내에 포함되어 있다.[63][64]
HIV의 RNA 게놈은 바이러스의 생존과 복제에 필요한 여러 유전자를 포함하고 있다. 크게 구조 단백질을 만드는 주요 유전자들과 바이러스 복제 및 숙주와의 상호작용을 조절하는 조절/보조 유전자들로 나눌 수 있다.
HIV 게놈에는 gag, pol, env라는 세 가지 주요 유전자가 존재한다.[67]
| 유전자 | 코딩하는 단백질 | 주요 기능 |
|---|---|---|
| gag | 핵 단백질 (CA, NC), 매트릭스 단백질 (MA) | 바이러스 입자의 기본 구조(캡시드, 매트릭스, 핵단백질) 형성 |
| pol | 역전사 효소, 프로테아제, 인테그라제, 리보뉴클레아제 | 바이러스 RNA를 DNA로 변환하고, 단백질을 자르며, 숙주 DNA에 바이러스 DNA를 삽입하는 등 복제 과정에 필수적인 효소 생산 |
| env | 외피 당단백질 (gp160 전구체에서 gp120과 gp41 생성) | 바이러스가 숙주 세포 표면에 부착(gp120)하고 세포 안으로 침투(gp41)하는 데 관여하는 외피 단백질 생산 |
주요 유전자 외에도 pol과 env 유전자 사이에는 다양한 기능을 수행하는 조절 및 보조 유전자들이 위치한다.[67]
| 유전자 | 주요 기능 |
|---|---|
| vif | 바이러스 입자가 성숙하는 데 필요하며, 세포 밖 바이러스의 감염 능력을 강화 |
| vpr | 바이러스 유전자의 전사(RNA 복제)를 활성화시키는 역할 |
| vpu | 새로 만들어진 바이러스 입자가 숙주 세포 밖으로 나가는 과정(출아)에 필요 |
| nef | 바이러스 복제를 촉진하고 숙주 면역 반응을 회피하는 데 관여 |
| tat | 바이러스 유전자 전사를 매우 강력하게 활성화 |
| rev | 바이러스의 구조 단백질(gag, pol, env) 유전자가 발현되도록 조절 |
바이러스 게놈의 양쪽 끝에는 LTR(Long Terminal Repeat, 긴 말단 반복 서열)이라는 특수한 구조가 존재한다. LTR은 U3, R, U5라는 세 부분으로 구성되며, 바이러스 RNA가 역전사 과정을 통해 DNA로 바뀔 때 형성된다. LTR은 숙주의 전사 인자들이 결합하여 바이러스 유전자의 발현을 조절하고, 생성된 바이러스 DNA가 숙주 세포의 염색체에 삽입되는 과정에도 중요한 역할을 한다.[67] 특히, 바이러스 RNA의 5’ 말단에 있는 U5 서열은 역전사 시작에 필요한 tRNA 프라이머가 결합하는 부위이며, 3’ 말단의 U3 서열은 DNA 프로바이러스의 전사 조절에 중요하다.[67]
4. 임상 시험 현황
1984년 HIV가 AIDS의 원인으로 밝혀진 후, 당시 미국 보건복지부 장관이었던 마거릿 해클러는 2년 안에 백신 개발이 가능할 것이라고 발표했다.[2] 그러나 기존의 백신 개발 방식, 즉 바이러스 외피 단백질을 인식하도록 적응 면역 체계를 자극하는 방법은 HIV 감염 예방에 효과를 보이지 못했다.[2]
HIV 백신 개발은 여러 가지 이유로 다른 일반적인 백신 개발과 다르다.[3]
- 대부분의 백신은 감염 후 회복된 사람에게서 나타나는 자연 면역(재감염 방지)을 모방하는데, AIDS에서 완전히 회복된 사례는 거의 없다.
- 많은 백신이 감염 자체보다는 질병 발생을 막는 데 초점을 맞추지만, HIV는 감염 후 AIDS 증상이 나타나기까지 오랜 잠복기를 가질 수 있다.
- 효과적인 백신은 주로 바이러스를 완전히 죽이거나(사백신) 독성을 약화시킨(생백신) 형태인데, 사멸된 HIV-1은 면역 반응을 잘 유도하지 못하고(항원성 부족), 약독화된 레트로바이러스 백신은 안전성 문제가 제기된다.
이러한 어려움에도 불구하고 다양한 백신 후보 물질들이 여러 단계의 임상 시험을 거치고 있다. 1988년부터 1996년 중반까지 NIAID의 지원을 받는 에이즈 백신 평가 그룹(AVEG)은 미국 내에서 HIV에 감염되지 않은 건강한 성인 1,900명 이상을 대상으로 25건의 1상 및 2상 임상 시험을 진행했다.[108] 임상 시험은 일반적으로 안전성을 확인하는 1상, 효과와 단기 안전성을 평가하는 2상, 그리고 더 많은 사람을 대상으로 안전성, 효과, 적정 용량을 최종 확인하는 3상으로 나뉜다.[109]
1996년 중반까지 전 세계적으로 최소 36개의 HIV 예방 백신 후보에 대한 소규모 임상 시험이 진행되었다. NIAID는 유망한 후보 물질이 나오면 대규모 임상 시험을 통해 그 효과를 검증하는 것을 목표로 삼고, HIV 외피 단백질의 구조와 기능 연구, 백신 및 질병 진행 연구를 위한 동물 모델 개선, 효과적인 면역 반응 유도를 위한 생체 내 항원 처리 과정 이해 등 기초 연구를 지원했다. 또한, 연구 자원 제공 및 HIV 예방 임상 시험 네트워크(HIVNET) 프로그램을 통해 감염 위험이 높은 지역사회 기반 연구를 지원했다.[110][111]
AVEG가 초기 임상 시험에서 평가한 후보 물질들은 주로 유전자 재조합 기술로 만든 HIV 단백질(gp160 또는 gp120과 같은 외피 당단백질)을 이용한 서브유닛 백신이었다. 이후 연구는 합성 펩타이드, 약독화된 바이러스나 세균을 운반체로 사용하는 벡터 백신, 새로운 면역 증강제나 전달 방식, 그리고 변화가 심한 외피 단백질과 상대적으로 안정적인 내부 단백질을 조합한 백신 등으로 확장되었다.[115] 1999년에는 우간다에서 현지 유행 HIV 아형(A형, D형)에 대한 임상 시험이 시작되는 등 연구 범위가 국제적으로 확대되었다.
초기 연구는 주로 HIV 외피 단백질, 특히 생산이 비교적 용이한 gp120에 집중되었다. 이후 카나리아두창 바이러스 벡터와 같이 세포독성 T세포(CTL) 반응을 유도할 수 있는 새로운 접근법들이 시도되었다. 백신 개발의 주요 목표는 다양한 HIV 변이에 효과적인 중화 항체 생성, 강력한 CTL 반응 유도, 그리고 바이러스의 주요 침입 경로인 점막에서의 면역 반응 유도 등이다. 이러한 목표 달성을 위해 유망한 전략 중 하나로 프라임-부스트 기법이 주목받고 있다. 이는 서로 다른 종류의 백신(예: 벡터 백신으로 세포성 면역을 유도하고, 서브유닛 백신으로 항체 반응을 강화)을 순차적으로 투여하여 각 백신의 장점을 결합하는 방식이다.[118]
4. 1. 제1상 임상 시험
초기 HIV 백신 개발은 주로 바이러스의 외피 단백질인 gp120과 gp160에 초점을 맞추었다. 미국에서는 에이즈 백신 평가 그룹(AVEG)을 중심으로 최소 13종류의 외피 단백질 후보가 평가되었으며, 이 중 생산이 더 용이한 gp120 기반 연구가 주를 이루었다.[3] 이러한 초기 백신 후보들은 다양한 집단에서 안전성과 면역원성이 확인되었고, 접종자의 거의 100%에서 중화 항체를 유도하는 성과를 보였다. 그러나 바이러스 감염 세포를 직접 파괴하는 세포독성 T세포(CTL) 반응을 유도하는 데는 한계가 있었다. 또한, 여러 차례의 추가 접종에도 불구하고 바이러스 감염을 효과적으로 막을 수 있는 높은 수준의 항체 역가를 유지하기는 어려웠다.[3]이후 카나리아두창 바이러스와 같은 재조합 바이러스 벡터를 활용하는 연구가 진행되었다. 단순히 벡터의 양을 늘리는 것보다 더 많은 HIV 유전자나 항원결정기를 포함시켜 벡터의 복잡성을 높이는 것이 CTL 반응을 유도하는 데 더 효과적이었다. 이렇게 유도된 CTL은 실제 HIV에 감염된 말초 혈액 단핵세포(PBMC)를 파괴할 수 있었으며, 이는 백신으로 유도된 면역 반응이 생물학적 의미를 가질 수 있음을 시사했다. 특히 카나리아두창 바이러스 벡터는 서로 다른 HIV 아형(클레이드)에 감염된 세포에도 반응하는 교차 클레이드 CTL 반응을 유도한 최초의 후보 백신이었다. 1999년에는 아프리카 우간다에서 현지 유행 아형(A형, D형)에 대한 1상 임상 시험이 시작되었다. 2015년에는 남아프리카에서 HVTN 100이라는 1상 시험이 진행되었는데, 카나리아두창 바이러스 벡터(ALVAC)와 C형 HIV gp120 단백질, 그리고 면역 보조제 MF59를 조합한 백신이 강력한 면역 반응을 유도하며 안전성을 입증했다.[18]
외피 단백질과 바이러스 벡터 외에도 다양한 전략이 1상 임상 시험 단계까지 연구되었다. 여기에는 펩타이드 백신, 리포펩타이드 백신, DNA 백신, 약독화된 ''살모넬라''균을 이용한 벡터 백신, HIV의 p24 단백질 기반 백신 등이 포함된다. 이러한 연구들은 공통적으로 다음과 같은 목표를 추구했다.[19]
몇몇 구체적인 후보 백신들이 1상 임상 시험에서 주목할 만한 결과를 보였다.
- MVA-B: 2011년, 마드리드 국립생명공학센터 연구팀이 개발한 백신으로, 1상 시험에서 건강한 참가자의 92%에서 면역 반응을 유도했다.[20]
- SAV001: 2016년 결과가 발표된 불활화 전체 HIV-1 백신이다. 캐나다 웨스턴 온타리오 대학교 슐리치 의학 및 치의학 대학원에서 개발했으며, 방사선을 이용하여 바이러스를 화학적, 물리적으로 불활성화시킨 형태이다. 2012년 캐나다에서 진행된 1상 시험에서 안전성을 확인했고, HIV-1에 대한 항체를 성공적으로 유도했다.[21] 이 백신을 개발한 강칠용 박사에 따르면, 백신 접종 후 gp120 및 p24에 대한 항체가 각각 8배 및 64배 증가했다.[22]
- V520: NIAID와 제약사 Merck & Co.가 공동 개발한 재조합 아데노바이러스-5 벡터 백신이다. HIV 유전자(''gag'', ''pol'', ''nef'')를 체내로 전달하여 T세포 반응을 유도하도록 설계되었다. 초기 소규모 시험에서는 안전성과 함께 참가자 절반 이상에서 세포성 면역 반응을 유도하는 가능성을 보였다.[172] 그러나 2004년 시작된 대규모 2b상 임상 시험(STEP 연구) 도중인 2007년 9월, 일부 참가자에게서 오히려 HIV 감염 위험이 증가한다는 우려가 제기되어 시험이 중단되었다. 이는 참가자 중 상당수가 백신 벡터로 사용된 아데노바이러스에 이전에 노출된 경험이 있어, 벡터 자체에 대한 면역 반응이 HIV 항원에 대한 면역 반응을 방해했을 가능성이 제기되었다.[174] 이 사건은 HIV 백신 개발 전략 전반에 대한 재검토를 촉발하는 계기가 되었다.[175]
- mRNA 백신: 최근에는 코로나19 백신 개발을 통해 주목받은 mRNA 기술을 활용한 HIV 백신 연구가 활발하다. VRC01 연구 라인에서 개발된 eOD-GT8 항원을 이용한 mRNA 백신 후보 물질들이 개발되어, 2022년부터 IAVI와 모더나, NIH 주도로 여러 1상 임상 시험이 시작되었다.[24][25][26]
1상 임상 시험은 주로 백신 후보 물질의 안전성을 평가하고, 인체에서 어떤 종류의 면역 반응을 얼마나 유도하는지(면역원성) 확인하는 초기 단계이다. NIAID가 지원하는 에이즈 백신 평가 그룹(AVEG)은 1988년부터 1996년까지 미국에서 25건의 1상 및 2상 임상 시험을 수행하며 초기 HIV 백신 연구를 주도했다.[108] 이 과정에서 다양한 종류의 백신 후보(서브유닛, 펩타이드, 벡터 등)와 전달 방식, 면역 보조제 등이 시험되었다. 특히, 서로 다른 종류의 백신(예: 벡터 백신 + 서브유닛 백신)을 순차적으로 접종하여 각각의 장점을 결합하는 '프라임-부스트' 전략은 중화 항체와 CTL 반응을 모두 효과적으로 유도하는 유망한 접근법으로 평가받고 있다.[118]
4. 2. 제2상 임상 시험
재조합 아데노바이러스-5 HIV 백신(V520)은 제2b상 임상 시험인 STEP 연구와 Phambili 연구에서 평가되었다. 2004년 12월 13일 시작된 STEP 연구는 북미, 남미, 카리브해, 호주 등에서 3,000명을 대상으로 진행되었으며,[171][27] NIAID와 제약사 Merck & Co.가 공동으로 자금을 지원했다.[171][27] V520 백신은 약독화된 아데노바이러스를 벡터로 사용하여 3가지 HIV 유전자(''gag'', ''pol'', ''nef'')를 전달함으로써, HIV에 감염된 세포를 파괴하는 T세포 생성을 유도하는 세포 매개 면역을 목표로 개발되었다.[172][28] 초기 소규모 실험에서는 안전성이 확인되었고, 참가자의 절반 이상에서 세포 매개 면역 반응이 유도되었다.[172][28] 그러나 2007년 9월, V520 백신 접종이 일부 피험자에서 오히려 HIV 감염 위험을 높인다는 결과가 나옴에 따라 임상 시험이 중단되었다.[174][29][85] 이는 백신 개발에 사용된 아데노바이러스 벡터에 대해 기존에 면역력을 가진 사람이 많아, 백신 투여 시 빠른 2차 면역 반응이 일어나 HIV 항원에 대한 T세포 반응 발달을 저해했기 때문으로 분석된다.[174][30][86] 이 결과는 향후 HIV 백신 개발 전략을 재검토하는 계기가 되었다.[175][31]다른 제2b상 임상 시험인 HVTN 505는 2009년에 시작되었으나, 2013년에 백신이 효과가 없다는 결론에 따라 중단되었다.
2016년 5월에는 HVTN과 HIV Prevention Trials Network(HPTN)가 협력하여 항체 매개 예방(Antibody Mediated Prevention, AMP) 임상 시험(HVTN 703, HVTN 704)을 시작했다. 이는 단일 클론 항체인 VRC01을 이용하여 수동 면역 방식으로 HIV 감염을 예방할 수 있는지 평가하는 첫 제2b상 시험이었다.[176][32] VRC01은 HIV가 세포에 결합할 때 사용하는 CD4 결합 부위를 표적으로 하지만, 연구 결과 HIV 감염 예방 효과는 없는 것으로 확인되었다.[33]
2017년에는 Janssen과 HVTN이 HVTN 705/Imbokodo라는 제2b상 임상 시험을 시작했다. 이 시험에서는 다양한 HIV 아형에 대응하기 위해 설계된 '모자이크' 백신 후보물질인 Ad26.Mos4.HIV(바이러스 벡터 백신)와 C형 HIV의 외피 단백질(gp140)을 조합하여 사용했다.[34] 그러나 2021년, NIH는 해당 백신 조합이 통계적으로 유의미한 HIV 감염 예방 효과를 보이지 못했다고 발표하며 연구가 중단되었다.
4. 3. 제3상 임상 시험
미국의 백신 개발 기업 VaxGen이 개발한 AIDSVAX 백신은 2003년 태국에서 RV 144라는 이름으로 3상 임상 시험이 시작되었다.[92][93][94] 이는 HIV 백신 개발 역사상 중요한 대규모 임상 시험 중 하나였다.- V520 (Merck Ad5 vector): Merck & Co.가 개발한 V520 백신은 재조합 아데노바이러스-5 벡터를 사용하여 HIV 유전자(''gag,'' ''pol,'' ''nef'')를 전달, 세포 매개 면역 반응을 유도하도록 설계되었다.[172] 2004년 시작된 STEP 연구 (Phase 2b/3) 등[171][27]에서 평가되었으나, 2007년 일부 참가자에게서 HIV 감염 위험이 증가하는 경향이 나타나 시험이 중단되었다.[29] 이는 참가자 다수가 보유한 기존 아데노바이러스 항체가 백신 벡터에 대한 빠른 면역 반응을 일으켜 HIV 항원에 대한 T세포 반응을 방해했기 때문으로 분석되었다.[174][30] 이 결과는 백신 개발 전략에 큰 영향을 미쳤다.[175][31]
- RV 144 (AIDSVAX B/E + ALVAC): 2003년 태국에서 시작된 이 3상 임상 시험은 프라임-부스트 전략을 사용했다. ALVAC 백신(카나리아두창 바이러스 벡터 기반)으로 먼저 면역 반응을 유도하고, AIDSVAX B/E 백신(gp120 단백질 기반)으로 추가 접종하는 방식이었다. 2009년 발표된 결과, 16,000명 이상의 참가자 중 백신 접종군은 위약군 대비 HIV 감염률이 31.2% 낮게 나타나, 부분적인 예방 효과를 최초로 입증했다.[97] 하지만 효과가 제한적이었고, 후속 분석에서 특정 항체 반응(V1V2 루프에 대한 IgG)은 감염 위험 감소와 연관된 반면, 다른 항체 반응(혈장 IgA)은 오히려 감염 위험 증가와 연관될 수 있다는 복잡한 결과가 나왔다.[98]
- HVTN 702 ("Uhambo"): RV 144의 후속 연구로, 남아프리카공화국에서 진행된 대규모 3상 임상 시험이다. RV 144에서 사용된 ALVAC/gp120 백신 조합을 남아공의 유행 HIV 아형(C형)에 맞게改良하고 면역증강제 MF59를 추가하여 시험했다. (기초 연구인 HVTN 100에서 안전성과 초기 면역 반응을 확인[18]) 그러나 2020년, 중간 분석 결과 HIV 예방 효과가 없는 것으로 나타나 조기 종료되었다.
- HVTN 705/Imbokodo & HVTN 706/Mosaico: Janssen과 HVTN 등이 협력하여 개발한 "모자이크" 백신 후보를 평가한 대규모 2b/3상 임상 시험들이다. 여러 HIV 아형의 유전 정보를 조합하여 만든 Ad26 벡터 백신(Ad26.Mos.HIV)과 단백질 백신(Clade C gp140)을 함께 사용하는 방식이었다.[34] Imbokodo(HVTN 705)는 아프리카 남부 여성들을 대상으로 진행되었으나 2021년 예방 효과 입증에 실패했다. Mosaico(HVTN 706)는 북미, 남미, 유럽의 남성 동성애자 및 트랜스젠더를 대상으로 진행되었으나, 2023년 역시 효과 부족으로 중단되었다.
이 외에도 HVTN 505 (2009년 시작, 2013년 중단) 등 다른 3상(또는 후기 2상) 임상 시험들이 진행되었으나, 아직까지 광범위하고 효과적인 HIV 예방 백신 개발에는 이르지 못하고 있다. 단일 클론 항체 VRC01을 이용한 항체 매개 예방(AMP) 임상 시험(HVTN 703, HVTN 704) 역시 HIV 감염 예방에 실패했다.[33]
5. 가능성 있는 백신 분류
1984년 AIDS의 원인인 HIV가 확인된 후, 당시 미국 보건복지부 장관이었던 마거릿 해클러는 2년 안에 백신이 개발될 것이라고 발표했다.[2][154] 그러나 바이러스 외피 단백질을 인식하여 적응 면역을 유도하는 기존의 백신 개발 방식은 HIV에는 효과가 없었으며,[155] HIV 백신 개발은 여러 가지 이유로 다른 일반적인 백신 개발과 다른 어려움에 직면했다.[3][155]
HIV 백신 개발이 특히 어려운 주요 요인은 다음과 같다.
- '''자연 면역의 부재''': 다른 감염병과 달리, AIDS에서 회복하여 자연적으로 면역력을 획득한 사례가 거의 없다. 따라서 백신 개발 시 모방할 자연 면역 모델이 부족하다.[3]
- '''질병 진행 양상''': 대부분의 백신은 감염 자체가 아닌 질병 발생을 예방하는 데 초점을 맞춘다. 하지만 HIV는 감염 후 AIDS 증상이 나타나기까지 오랜 잠복기를 가질 수 있다.[3]
- '''백신 형태의 한계''': 효과적인 백신은 주로 바이러스 전체를 사멸시키거나 약독화시킨 형태를 사용한다. 그러나 사멸된 HIV-1은 항원성을 제대로 유지하지 못하며, 살아있는 약독화된 레트로바이러스 백신은 안전성 문제를 일으킬 수 있다.[3]
- '''높은 변이성''': HIV는 유전적으로 매우 다양하며 변이가 심하다. 바이러스 외피의 항원 결정기는 다른 바이러스보다 훨씬 가변적이며, 여러 아형으로 나뉜다. 이 때문에 특정 HIV 변종에 효과적인 백신이 다른 변종에는 효과가 없을 수 있다.[156] 면역 체계의 압력에 빠르게 적응하여 항체나 T 세포의 공격을 회피하도록 진화한다.[156]
- '''항원 결정기 은폐''': 바이러스가 세포에 결합하는 데 중요한 역할을 하는 gp120 단백질의 항원 결정기는 당화(glycosylation), 삼량체화(trimerization), 수용체 결합 시 구조 변화 등으로 인해 중화 항체가 효과적으로 접근하기 어렵게 숨겨져 있다.[156]
이론적으로 HIV 백신은 바이러스가 인체 내에서 증식하는 과정, 즉 바이러스 복제 주기의 특정 단계를 방해하거나 중단시키는 방식으로 작용해야 한다.[46] HIV 바이러스 복제 주기는 다음과 같은 주요 단계로 구성된다.[46]
# '''자유 상태 (Free state)''': 바이러스 입자가 혈액 등 체액 내에 떠다니는 단계
# '''부착 (Attachment)''': 바이러스가 숙주 세포 표면에 달라붙는 단계
# '''침투 (Penetration)''': 바이러스가 숙주 세포 안으로 들어가는 단계
# '''탈피 (Uncoating)''': 바이러스의 외피가 벗겨지고 유전 물질이 노출되는 단계
# '''복제 (Replication)''': 바이러스의 유전 물질(RNA)이 숙주 세포의 기구를 이용하여 역전사 과정을 거쳐 DNA로 변환되고, 이를 바탕으로 새로운 바이러스 구성 요소들이 만들어지는 단계
# '''조립 (Assembly)''': 새로 만들어진 바이러스 구성 요소들이 모여 새로운 바이러스 입자를 형성하는 단계
# '''방출 (Release)''': 새로 조립된 바이러스 입자가 숙주 세포 밖으로 나오는 단계
이러한 복제 주기의 각 단계를 표적으로 삼아, 바이러스를 직접 제거하거나 활동하지 못하게 포획하는 방법(바이러스 제거 및 포획), 바이러스 입자 자체를 파괴하거나 손상시키는 방법(바이러스 파괴 및 손상), 바이러스의 복제 과정을 차단하거나 이미 감염된 세포의 기능을 억제하는 방법(복제 차단 및 감염 세포 기능 억제) 등 다양한 전략의 백신 개발이 시도되고 있다.
백신 개발의 주요 과제 중 하나는 어떤 종류의 면역 반응(예: 항체를 통한 체액성 면역, T 세포를 통한 세포성 면역, 점막에서의 면역 반응)이 HIV 감염을 효과적으로 예방할 수 있는지 명확히 밝혀내는 것이다. 또한, 비활성화 백신의 잠재적 위험성, 바이러스의 높은 변이성 극복, 주요 감염 경로인 성 접촉 시 점막 면역 유도 방법, 효과적인 백신 후보를 시험할 적절한 동물 모델 부재, 그리고 개발된 백신을 전 세계, 특히 감염자가 많은 개발도상국에 보급하고 접종하는 데 따르는 경제적, 사회적 문제 등 해결해야 할 과제가 많다.
HIV 백신은 크게 감염 자체를 예방하는 '''예방 백신'''과 이미 HIV에 감염된 사람들의 면역 반응을 강화하여 질병의 진행을 늦추거나 멈추게 하려는 '''치료 백신'''으로 나눌 수 있다. 조너스 소크와 같은 연구자들은 HIV 감염 후 증상 발현까지 시간이 걸린다는 점에 착안하여, 감염자의 면역 방어를 강화하는 '면역 요법' 개념의 치료 백신 연구를 진행하기도 했다.[120][121]
초기 백신 연구는 주로 바이러스 외피 단백질인 gp160이나 gp120을 기반으로 했으나, 이들은 중화 항체를 유도하는 데는 어느 정도 성공했지만 효과적인 세포 면역 반응을 이끌어내지는 못했다.[122] 이에 따라 세포독성 T 세포(CTL) 반응을 유도하는 백신[4][5], 다양한 HIV 변이체에 공통적으로 존재하는 부분을 이용한 펩타이드 백신[6], 감염되고도 오랫동안 증상이 나타나지 않는 사람들(장기 비진행자)에게서 발견되는 광범위 중화 항체(BNAbs)의 생성을 유도하는 백신[7], DNA 백신, 그리고 유전자 조작된 바이러스나 입자를 전달체로 사용하는 재조합 벡터 백신 또는 가짜 바이러스 백신[122] 등 새로운 접근법들이 연구되고 있다.
5. 1. 바이러스 제거 및 포획
혈액 내 HIV를 제거하거나 포획하는 다양한 접근법이 연구되고 있다. 이러한 방법들은 생물학적, 화학적, 물리적 원리를 기반으로 한다.- '''생물학적, 화학적, 물리적 접근법''': 혈액에서 HIV 비리온을 직접 제거하는 것을 목표로 하는 다양한 방식들을 포함한다.
- '''식작용''': 면역 세포 등이 HIV 입자를 직접 삼켜서 분해하고 제거하는 생물학적 방식이다.
- '''화학적 또는 유기적 포획''': 특정 화학 물질이나 유기 분자를 이용하여 HIV 비리온 주위에 인위적인 막을 형성시켜, 비리온을 활동하지 못하게 가두는 방식이다.
- '''화학적 또는 유기적 부착''': 특정 화학 물질이나 유기 분자를 사용하여 HIV 비리온 표면에 달라붙게 함으로써, 비리온이 세포에 감염하는 것을 방해하거나 면역계에 의해 쉽게 제거되도록 만드는 방식이다.
5. 2. 바이러스 파괴 및 손상
HIV 백신 개발에서 "손상"은 HIV 바이러스 입자(비리온)가 복제 주기(아래 표 참조)의 특정 단계(2단계~7단계)를 수행하는 능력을 억제하거나 중단시키는 것을 의미한다.[46] 바이러스 또는 바이러스 구성 요소를 파괴하거나 손상시키는 접근 방식은 크게 다음과 같이 분류할 수 있다.
- 방법의 특성에 따른 분류:
- 물리적 방법 (복제 주기 1단계~7단계에 영향)
- 화학적 및 생물학적 방법 (복제 주기 1단계~7단계에 영향)
- HIV 바이러스 입자 구조의 손상 표적에 따른 분류:[47][48] 이론적으로 모든 가능한 HIV 백신은 HIV 바이러스 복제 주기를 억제하거나 중단시켜야 하며, 다음과 같은 구조적 요소를 표적으로 삼을 수 있다.
| 표적 | 설명 | 영향받는 복제 주기 단계[46] |
|---|---|---|
| 도킹 당단백질 gp120 | 바이러스가 숙주 세포에 부착하는 데 사용되는 외피 단백질.[59] | 1단계(자유 상태)~3단계(침투), 6단계(조립), 7단계(방출)[49] |
| 막관통 당단백질 gp41 | gp120과 연결되어 바이러스 외피와 숙주 세포막 융합에 관여하는 단백질.[59][62] | 1단계~3단계, 6단계, 7단계[50] |
| 바이러스 입자 기질(매트릭스) | 캡시드와 외피 사이의 단백질 층 (MA, p17).[59] | 1단계~3단계, 6단계, 7단계 |
| 바이러스 캡시드 | 바이러스의 유전 물질(RNA)을 둘러싸는 단백질 껍질 (CA, p24).[59] | 1단계~3단계, 6단계, 7단계 |
| 역전사 효소 | 바이러스의 RNA 유전체를 DNA로 변환하는 효소.[64] | 1단계~7단계 |
| RNA | 바이러스의 유전 정보.[59] | 1단계~7단계 |
이러한 표적, 특히 외피 당단백질 gp120을 효과적으로 공략하는 데에는 여러 어려움이 따른다. HIV 외피의 항원 결정기는 다른 많은 바이러스보다 변이성이 훨씬 크다. 또한, gp120의 기능적으로 중요한 부분은 글리코실화(당화), 삼량체화, 그리고 세포 수용체와 결합 시 발생하는 구조적 변화 때문에 중화 항체로부터 가려져 있어 접근하기 어렵다.[156] 이러한 높은 변이성은 특정 백신이 생성하는 면역 반응이 모든 다양한 HIV 아형에 효과를 발휘하기 어렵게 만드는 주요 요인이다.[156]
신뢰할 수 있는 항체 반응 유도의 어려움 때문에, 세포독성 T 세포 반응을 자극하는 백신 개발 시도[157][158][4][5]나, 알려진 모든 HIV 변종 중 변이가 가장 적은 부분을 이용한 펩타이드 백신 개발[159][6] 등이 이루어지고 있다.
5. 3. 복제 차단 및 감염 세포 기능 억제
이론적으로, 모든 가능한 HIV 백신은 HIV 바이러스의 복제 주기를 억제하거나 중단시키는 것을 목표로 한다.[46] 이를 위해 다양한 접근법이 연구되고 있다.바이러스 복제 차단HIV가 인체 세포를 감염시키는 과정을 막는 방법이다.
- 바이러스 표면의 gp120 단백질에 결합하는 물질을 사용하여 바이러스가 세포에 부착하는 것을 방해한다. 이는 CD4 세포막 조각이나 이를 모방한 화학, 유기 화합물 등이 될 수 있다.
- 인체 세포 표면의 CD4 수용체에 결합하는 물질을 사용하여 바이러스가 세포에 접근하지 못하게 한다.
- 바이러스가 세포에 부착한 이후의 과정, 즉 세포 침투, 캡시드 탈피, 유전 정보 통합, 복제, 새로운 바이러스 조립 및 방출 등의 단계를 생물학적, 화학적, 또는 물리적 방법으로 억제한다.
감염 세포 기능 억제이미 HIV에 감염된 세포의 활동을 억제하여 바이러스 증식을 막는 방법이다.
- 감염된 세포의 대사 과정을 억제한다.
- 감염된 세포의 에너지 교환을 방해하여 세포 기능을 약화시킨다.
6. 경제적 문제 및 기타 고려 사항
HIV 백신 개발에는 막대한 자금이 투입되고 있다. 2012년 보고서에 따르면 2011년 한 해에만 HIV 백신 연구 및 개발(R&D)에 8.45억달러가 투자된 것으로 추산된다.[182][44][107] 이는 HIV 예방 및 치료법 개발의 시급성을 보여주는 동시에, 백신 개발의 경제적 어려움을 시사한다.
백신 개발의 주요 경제적 문제 중 하나는 개발 후 가격 책정 및 접근성 확보이다. 특히 HIV 감염자가 많은 개발도상국에서는 높은 가격의 백신을 구매하기 어렵다.[106] 개발도상국 대부분의 사람들이 백신을 접종하기 어렵고, 현지에서 백신을 생산할 재료나 설비도 부족한 실정이다. 이러한 문제를 해결하기 위해, 백신이 개발되면 정부나 비정부 기구(NGO)가 사전 시장 약정(Advance Market Commitment, AMC)과 같은 제도를 통해 미리 구매를 약속하여 제약회사의 개발을 유도하고, 이후 백신 가격을 한계 비용 수준으로 낮추는 방안이 필요하다는 주장이 제기된다.[183][45][106]
한편, G형 간염 바이러스라고도 불리는 GB 바이러스 C(GBV-C)에 동시 감염된 HIV 환자가 그렇지 않은 환자보다 더 오래 생존할 수 있다는 연구 결과가 있다. 모든 환자에게 동일하게 적용되는 것은 아니지만[184][51], GBV-C 바이러스가 HIV 진행을 늦추는 메커니즘을 이해한다면, 이를 활용하여 새로운 HIV 백신 개발 전략을 세울 수 있을 것으로 기대된다.[184][51]
또한, 유전자 변형 작물을 이용한 백신 개발도 주목받고 있다. 이 방식은 백신 생산 비용을 절감하고, 열에 안정적인 형태로 만들어 저온 유통(cold chain) 문제를 해결할 수 있다는 장점이 있다. 유전자 변형 작물을 통해 만들어진 백신은 기존 백신과 비교하여 생산 효율성과 면역 반응 유도 효과 면에서 경쟁력을 보일 가능성이 있으며[143], 경구 투여 등 다양한 방식으로 활용될 수 있는 잠재력을 가지고 있다.[144][145]
7. 향후 전망
인간면역결핍 바이러스(HIV)가 AIDS의 원인으로 밝혀진 1984년, 미국 보건복지부 장관 마거릿 해클러는 2년 내 백신 개발을 선언했지만[2], 이는 실현되지 못했다. 적응 면역 체계를 자극해 바이러스 외피 단백질을 인식하게 하는 기존 방식은 HIV 감염 예방에 실패했다. HIV 백신 개발은 여러 요인으로 인해 다른 일반적인 백신 개발보다 훨씬 복잡하고 어려운 과제로 남아있다.[3]
HIV 백신 개발이 어려운 주요 이유는 다음과 같다.[3]
- 자연 면역 부재: 일반적인 백신은 감염 후 회복된 사람에게서 나타나는 자연 면역을 모방하지만, AIDS에서 완전히 회복된 사례는 거의 없다.
- 질병이 아닌 감염 방지: 대부분의 백신은 질병 발생을 막지만, HIV는 감염 후 AIDS 발병까지 오랜 잠복기를 가질 수 있어 감염 자체를 막아야 한다.
- 백신 형태의 한계: 효과적인 백신 형태인 전신 사멸 또는 약독화 생백신 적용이 어렵다. 사멸된 HIV-1은 항원성을 유지하기 어렵고, 살아있는 레트로바이러스를 이용한 생백신은 안전성 문제가 제기된다. 이 안전성 우려로 인해 약독화 생 HIV-1 백신의 임상 개발은 이루어지지 못하고 있다.
- 바이러스 변이성: HIV는 알려진 어떤 바이러스보다 변이가 빠르고 다양하여, 특정 HIV 변이주에 효과적인 백신이 다른 변이주에는 효과가 없을 수 있다. 실용적인 백신 개발을 위해서는 이러한 변이성 문제를 극복해야 한다.
- 주요 감염 경로: 가장 흔한 감염 경로인 성 접촉을 통한 점막 감염을 막기 위해서는 혈액 내 면역 반응뿐 아니라, 점막에서의 특이적 면역 반응, 특히 바이러스 감염 세포를 직접 공격하는 세포독성 T림프구(CTL)의 활성화가 필요할 수 있다.
- 실험 모델 부재: HIV에 감염되어 AIDS를 일으키는 적절한 실험 동물이 없어 백신 후보 물질의 효과를 시험하기 어렵고, 연구는 주로 인간 자원자에 의존해야 한다.
이러한 어려움 속에서도 백신 개발 노력은 계속되고 있다. 1996년 등장한 HAART 요법은 단백질 분해 효소 억제제 등을 이용해 HIV 감염자의 증상과 바이러스 수치를 안정시키는 데 큰 효과를 보였지만, HIV 감염의 세계적 확산을 막지는 못했다. 특히 피해가 심각한 국가들에서 안전한 성관계 실천 등의 조치만으로는 감염 확산을 막는 데 한계가 있어, 예방 접종을 통한 HIV 백신 개발은 여전히 에이즈 유행을 멈출 중요한 방법으로 여겨진다.
새로운 접근법들도 연구되고 있다. GB 바이러스 C(GBV-C)에 동시 감염된 HIV 환자가 더 오래 생존한다는 보고는 GBV-C가 향후 백신 개발에 활용될 가능성을 시사한다.[51] 또한 바이러스의 코돈을 조작하여 인체에 없는 특정 비단백질 아미노산에 의존해야만 복제되도록 유전자를 변형시키는 방법[52]이나, HIV에 대한 보편적인 CAR NK 세포를 이용하는 연구[53][54] 등 새로운 전략들이 모색되고 있다. 1987년 조너스 소크는 HIV 감염자를 위한 치료 목적의 예방 접종 개념을 제안하기도 했다.[56]
백신 개발에는 기술적 문제 외에도 여러 과제가 남아있다. HIV/AIDS 감염자 대다수가 개발도상국에 집중되어 있어, 이들 국가 국민 대다수가 백신을 접종하기 어렵고 현지 생산을 위한 재료나 설비도 부족하다는 점, 그리고 백신 개발 자체에 막대한 비용이 드는 경제적인 문제 등이 해결되어야 한다.
미국 국립 알레르기·전염병 연구소(NIAID)의 에이즈 연구 부문장 잭 킬렌 박사는 이상적인 HIV 백신이 갖춰야 할 조건으로 안전성, 낮은 부작용, 모든 HIV 아형에 대한 강력하고 장기적인 면역 반응 유도(특히 점막 감염 방지), 저렴한 생산 비용, 쉬운 보관 및 투여 등을 제시했다. HIV 질병의 근본적인 생물학적 기전에 대한 이해가 깊어질수록 효과적인 백신 설계가 용이해질 것으로 기대된다.
과거 2012년에는 2019년까지 효과적인 백신이 완성될 것이라는 예측도 있었으며[147], 캐나다에서 개발된 SAV001 백신은 동물 모델 실험 성공 후 인체 임상 시험 단계에 진입하기도 했다.[148] 비록 획기적인 돌파구 마련에는 시간이 더 필요하지만, HIV 백신 개발을 위한 연구는 계속 진행 중이다.
참조
[1]
논문
Approaches to preventative and therapeutic HIV vaccines
2016-04
[2]
서적
And the Band Played On: Politics, People, and the AIDS Epidemic
https://archive.org/[...]
St. Martin's Press
[3]
논문
An HIV vaccine: breaking the paradigms
[4]
논문
HIV vaccine efficacy trials: towards the future of HIV prevention
2007-03
[5]
논문
The hope for an HIV vaccine based on induction of CD8+ T lymphocytes--a review
2008-03
[6]
논문
Design and pre-clinical evaluation of a universal HIV-1 vaccine
2007-10
[7]
논문
Structural basis for germ-line gene usage of a potent class of antibodies targeting the CD4-binding site of HIV-1 gp120.
2012-07-24
[8]
논문
Vaccine genetics of IGHV1-2 VRC01-class broadly neutralizing antibody precursor naïve human B cells
2021-09-06
[9]
웹사이트
Key HIV Protein Structure Revealed
https://www.nih.gov/[...]
2023-01-05
[10]
논문
Neutralizing antibodies have limited effects on the control of established HIV-1 infection in vivo
1999-04
[11]
논문
Protection of chimpanzees from infection by HIV-1 after vaccination with recombinant glycoprotein gp120 but not gp160
1990-06
[12]
논문
Immunological and virological analyses of persons infected by human immunodeficiency virus type 1 while participating in trials of recombinant gp120 subunit vaccines
1998-02
[13]
논문
The use of nonhuman primate models in HIV vaccine development
2008-08
[14]
논문
Generalized immune activation as a direct result of activated CD4+ T cell killing
[15]
논문
Life and death as a T lymphocyte: from immune protection to HIV pathogenesis
[16]
논문
HIV-1 VRC01 Germline-Targeting Immunogens Select Distinct Epitope-Specific B Cell Receptors.
2020-10-13
[17]
서적
Experimental Animal Models of HIV/AIDS for Vaccine Trials
https://www.intechop[...]
IntechOpen
2018-11-05
[18]
논문
Subtype C ALVAC-HIV and bivalent subtype C gp120/MF59 HIV-1 vaccine in low-risk, HIV-uninfected, South African adults: a phase 1/2 trial
2018-06
[19]
논문
Recent progress in HIV vaccines inducing mucosal immune responses
2014-07
[20]
뉴스
New Vaccine Could Turn HIV Into Minor Infection
https://www.foxnews.[...]
2011-09-29
[21]
논문
First Phase I human clinical trial of a killed whole-HIV-1 vaccine: demonstration of its safety and enhancement of anti-HIV antibody responses
2016-11
[22]
뉴스
New HIV Vaccine Proves Successful In Phase 1 Human Trial
http://www.medicalda[...]
2013-09-04
[23]
뉴스
Experimental MRNA HIV Vaccine Safe, Shows Promise In Animals - ScienceMag
https://scienmag.com[...]
2022-01-16
[24]
논문
A multiclade env–gag VLP mRNA vaccine elicits tier-2 HIV-1-neutralizing antibodies and reduces the risk of heterologous SHIV infection in macaques
2021-12
[25]
웹사이트
IAVI and Moderna launch trial of HIV vaccine antigens with mRNA te
https://www.iavi.org[...]
2022-02-14
[26]
웹사이트
STEP Study Locations
http://www.stepstudi[...]
2008-11-04
[27]
웹사이트
AIDS epidemic update
https://www.who.int/[...]
World Health Organization
2014-04-22
[28]
웹사이트
Efficacy Results from the STEP Study (Merck V520 Protocol 023/HVTN 502): A Phase II Test-of-Concept Trial of the MRKAd5 HIV-1 Gag/Pol/Nef Trivalent Vaccine
http://www.hvtn.org/[...]
[29]
논문
The failed HIV Merck vaccine study: a step back or a launching point for future vaccine development?
2008-01
[30]
논문
The aftermath of the Merck's HIV vaccine trial
2008-07
[31]
논문
A Phase 1, Randomized, First-in-human, Open-label Study to Evaluate the Safety and Immunogenicity of eOD-GT8 60mer mRNA Vaccine (mRNA-1644) and Core-g28v2 60mer mRNA Vaccine (mRNA-1644v2-Core) in HIV-1 Uninfected Adults in Good General Health
https://clinicaltria[...]
2021-11-30
[32]
논문
Two Randomized Trials of Neutralizing Antibodies to Prevent HIV-1 Acquisition
2021-03-18
[33]
웹사이트
Candidate for new AIDS vaccine advances to next phase of pre-approval trials
https://www.firstpos[...]
2018-07-08
[34]
웹사이트
HIV Vaccine Candidate Does Not Sufficiently Protect Women Against HIV Infection
https://www.nih.gov/[...]
2021-08-31
[36]
웹사이트
Cure for HIV/AIDS: Cuba makes a Breakthrough, NIH and Gate Foundation will Donate for Future Research
https://thegeekheral[...]
2019-12-27
[37]
웹사이트
Successful Clinical Trials of HIV Vaccine in Cuba
https://www.cmhw.cu/[...]
[38]
학술지
Intradermal injection of a Tat Oyi-based therapeutic HIV vaccine reduces of 1.5 log copies/mL the HIV RNA rebound median and no HIV DNA rebound following cART interruption in a phase I/II randomized controlled clinical trial
2016-04
[39]
학술지
Vaccination with ALVAC and AIDSVAX to prevent HIV-1 infection in Thailand
2009-12
[40]
학술지
Clues emerge to explain first successful HIV vaccine trial
2011-09-16
[41]
웹사이트
Experimental HIV vaccine regimen ineffective in preventing HIV
NIH
2020-02-03
[42]
웹사이트
NIH and partners to launch HIV vaccine efficacy trial in the Americas and Europe
https://www.nih.gov/[...]
National Institutes of Health
2019-07-15
[43]
웹사이트
Experimental HIV vaccine regimen safe but ineffective, study finds
https://www.nih.gov/[...]
2023-01-18
[44]
웹사이트
Investing to End the AIDS Epidemic: A new Era for HIV Prevention Research and Development
http://www.hivresour[...]
[45]
학술지
Advanced Purchase Commitments for a Malaria Vaccine: Estimating Costs and Effectiveness
http://eprints.lse.a[...]
2005-04
[46]
서적
Virology
Hodder Education Publishers
1998
[47]
학술지
A common mechanism underlying promiscuous inhibitors from virtual and high-throughput screening
2002-04
[48]
문서
[49]
보고서
HIV Sequence Compendium
Theoretical Biology and Biophysics Group, Los Alamos National Laboratory, NM, LA-UR 17-25240
[50]
학술지
Crystal structure of the simian immunodeficiency virus (SIV) gp41 core: conserved helical interactions underlie the broad inhibitory activity of gp41 peptides
1998-08
[51]
학술지
Potential utility of GB virus type C as a preventive vaccine for HIV-1
2012-03
[52]
학술지
Construction of a live-attenuated HIV-1 vaccine through genetic code expansion
2014-05
[53]
학술지
NK cell-based therapies for HIV infection: Investigating current advances and future possibilities
https://academic.oup[...]
2022-03-25
[54]
학술지
A universal CAR-NK cell approach for HIV eradication
2021
[55]
문서
『エイズの辞典』p.532
[56]
문서
『エイズの辞典』p.445
[57]
웹사이트
AIDS epidemic update
http://www.unaids.or[...]
World Health Organization
[58]
문서
UNAIDS (2004) Report on the global AIDS epidemic, July 2004
[59]
문서
エンベロープには主要組織適合性複合体MHCクラスⅡ分子等の宿主細胞蛋白質が含まれる。
[60]
문서
ヌクレオカプシドはレトロウイルスの属によって形態的に異なる。
[61]
문서
『イラストレイテッド微生物学 第2版』p.319-320
[62]
문서
『エイズの辞典』p.202
[63]
문서
ウイルスDNA合成や宿主細胞の染色体に組み込む際に必要とされる。
[64]
문서
ウイルスの集合に重要。
[65]
문서
『イラストレイテッド微生物学 第2版』p.320
[66]
문서
『エイズの辞典』p.237-239
[67]
문서
『イラストレイテッド微生物学 第2版』p.321
[68]
문서
『HIV Q&A改訂版』p.15
[69]
문서
『エイズの辞典』p.250
[70]
문서
『エイズの辞典』p.401
[71]
서적
『エイズの辞典』
[72]
서적
『イラストレイテッド微生物学 第2版』
[73]
서적
『エイズの辞典』
[74]
서적
『イラストレイテッド微生物学 第2版』
[75]
서적
『エイズの辞典』
[76]
서적
『エイズの辞典』
[77]
서적
『エイズの辞典』
[78]
서적
『エイズの辞典』
[79]
뉴스
New Vaccine Could Turn HIV Into Minor Infection
http://www.foxnews.c[...]
2011-09-29
[80]
서적
『医学英和辞典第2版』
[81]
서적
『医学英和辞典第2版』
[82]
문서
Loading Dendritic Cells from HIV-1 Infexted Patients with PLA-p24 Nanoparticles or MVA Expressing HIV Genes Induces HIV-1-Specific T Cell Responses
[83]
문서
아데노바이러스는, [[풍사]]등의 병기를 궤도에서 일으키는 주된 바이러스.
[84]
웹사이트
STEP Study Locations
http://www.stepstudi[...]
2008-11-04
[85]
웹사이트
Efficacy Results from the STEP Study (Merck V520 Protocol 023/HVTN 502): A Phase II Test-of-Concept Trial of the MRKAd5 HIV-1 Gag/Pol/Nef Trivalent Vaccine
http://www.hvtn.org/[...]
[86]
문서
현재에서도 아데노바이러스 매개나, 다른 바이러스 매개는 HIV 백신으로서 이용되어, 바이러스에 대하여 기억 세포의 반응을 유도한다.
[87]
논문
The failed HIV Merck vaccine study: a step back or a launching point for furture vaccine development?
[88]
뉴스
AIDS vaccine may have raised risk of infection
http://seattletimes.[...]
The Washington Post
2007-10-25
[89]
논문
The failed HIV Merck vaccine study: a step back or a launching point for future vaccine development?
http://www.jem.org/c[...]
[90]
뉴스
Failure of AIDS vaccine punctures soaring hopes
http://seattletimes.[...]
Seattle Times
2007-11-08
[91]
논문
The aftermath of the Merck's HIV vaccine trial
http://www.retroviro[...]
[92]
문서
AIDSVAX는 외피당단백질GP120의 면역 반응과 현지의 주민들에게 감염에 대해 백신의 정확도를 측정하는 것이 목표였다
[93]
뉴스
Renewed Hope
http://www.scientifi[...]
2009-11
[94]
문서
2003년 2월, VaxGen사([[w:VaxGen|en]])는, 통계적으로 [[북아메리카]]에서의 HIV 감염자수의 감소만으로는 측정할 수 없는 것을 이유로 HIV 백신AIDSVAX([[w:AIDSVAX|en]])의 임상 시험이 실패했다고 발표.
[95]
서적
『エイズの辞典』
[96]
문서
약학적으로 불활성인 물질로, 신약과 같은 외모와 맛이 되도록 만들어진 것. 약학적 활성화 물질의 임상적 반응을 측정할 때 통제로서 사용되는 것이 많다.
[97]
문서
ALVAC®‐HIV and AIDSVAX® B/E Prime‐Boost HIV‐1 Preventive Vaccine Regimen
[98]
문서
The RV144 ALVAC/HIV Prime,rgp120 B/E trial:immune correlates analysis
[99]
서적
『エイズの辞典』
[100]
문서
원숭이에게는 [[원숭이 면역 부전 바이러스]](SIV) 또는 2개 이상의 다른 세포나 유전자를 가진 키메라[[원숭이 면역 부전 바이러스]](SHIV)가 연구 목적에서 감염될 수 있다.
[101]
논문
The Use of Nonhuman Primate Models in HIV Vaccine Development
http://medicine.plos[...]
[102]
서적
『エイズの辞典』
[103]
논문
Protection of chimpanzees from infection by HIV-1 after vaccination with recombinant glycoprotein gp120 but not gp160
[104]
논문
Immunological and Virological Analyses of Persons Infected by Human Immunodeficiency Virus Type 1 while Participating in Trials of Recombinant gp120 Subunit Vaccines
http://jvi.asm.org/c[...]
[105]
서적
『エイズの辞典』
[106]
웹사이트
SSRN-Advanced Purchase Commitments for a Malaria Vaccine: Estimating Costs and Effectiveness by Ernst Berndt, Rachel Glennerster, Michael Kremer, Jean Lee, Ruth Levine, Georg Weizsacker, Heidi Williams
http://papers.ssrn.c[...]
2009-01-10
[107]
문서
Funding the Critical Path from Research to Reality:Sustaining HIV Vaccine R&D Amidst Economic Uncertainty
[108]
문서
『エイズの辞典』p.530
[109]
문서
『エイズの辞典』p.96
[110]
문서
『エイズの辞典』p.529
[111]
문서
AVEGは、大学を拠点とする臨床試験6ヶ所、主な免疫学研究所2ヶ所、そしてデータ統合・分析センター1ヶ所から成る。
[112]
문서
『エイズの辞典』p.382
[113]
문서
ペプチドTによってエイズの認知症、披露、苦痛を含むHIVの神経系及び、認知的効果を遅らせる、もしくは回復させる事が出来るとされたが、米国立精神衛生研究所(NIMH)の研究ではそうした有利な効果を示す事は無かった。ペプチドTは[[腫瘍壊死因子アルファ]](TNFα)の濃度を下げると見られてきた、過度のTNFαは疲労症候群、HIVの増加した複製、免疫細胞機能障害、神経細胞損傷、死の一因と広く言われている。
[114]
학술지
Design and Pre-Clinical Evaluation of a Universal HIV-1 Vaccine
http://www.plosone.o[...]
[115]
문서
『エイズの辞典』p.530
[116]
문서
『医学英和辞典第2版』p.934
[117]
문서
『医学大辞典』p.2450
[118]
문서
『エイズの辞典』p.530
[119]
문서
『エイズの辞典』p.494
[120]
문서
『エイズの辞典』p.531-532
[121]
문서
ソークの研究を引き継いでいるチーム(ソークは1995年に亡くなっている)は、感染者の免疫システムが持つ感染細胞を破壊する、細胞性免疫を強化する事によって発症を予防することが出来ると考えている。
[122]
문서
『エイズの辞典』p.533-534
[123]
문서
『エイズの辞典』p.119
[124]
문서
『医学英和辞典第2版』p.1382
[125]
문서
『医学大辞典』p.718
[126]
문서
『医学英和辞典第2版』p.952
[127]
문서
『医学英和辞典第2版』p.1483
[128]
문서
induction of HIV Mucosal Immunity at Distal Sites After Encapsulation of NOD1 and NOD2 Ligands in Biodegradable Nanocarriers
[129]
문서
このタンパク質の濃度を測定する方法をP24抗原検査と呼ぶ
[130]
문서
『エイズの辞典』p.368-369
[131]
학술지
Challenges and opportunities for development of an AIDS vaccine
[132]
문서
『エイズの辞典』p.534
[133]
문서
『メディカル免疫学』p.125
[134]
문서
『エイズの辞典』p.532
[135]
학술지
HIV vaccine efficacy trials: towards the future of HIV prevention
http://linkinghub.el[...]
[136]
학술지
The hope for an HIV vaccine based on induction of CD8+ T lymphocytes - A Review
http://www.scielo.br[...]
[137]
문서
『医学英和辞典第2版』p.601
[138]
문서
An HIV vaccine: breaking the paradigms
[139]
문서
『エイズの辞典』p.532
[140]
문서
『医学大辞典』p.2933
[141]
논문
Basic HIV Vaccine Development
http://www.iasusa.or[...]
[142]
문서
『エイズの辞典』p.535
[143]
URL
http://www.ncbi.nlm.[...]
[144]
문서
『医学英和辞典第2版』p.1382
[145]
URL
http://www.ncbi.nlm.[...]
[146]
웹사이트
FDA approves first pill to help prevent HIV
http://today.msnbc.m[...]
NBC News
2012-07-16
[147]
웹사이트
Scientists see AIDS vaccine within reach after decades | Reuters
http://www.reuters.c[...]
2012-07-17
[148]
뉴스
Canadian-developed HIV vaccine approved for human testing
http://www.theglobea[...]
2011-12-21
[149]
저널
Approaches to preventative and therapeutic HIV vaccines
http://dx.doi.org/10[...]
2016-04
[150]
뉴스
The Moon Landing of HIV Vaccine Research: RV144, Ten Years Later
https://www.medpaget[...]
[151]
저널
2004 update on the global AIDS epidemic from UNAIDS
http://dx.doi.org/10[...]
2004-07-08
[152]
저널
1 October News
https://academic.oup[...]
2012-10-01
[153]
저널
Which New Health Technologies Do We Need to Achieve an End to HIV/AIDS?
https://dx.plos.org/[...]
2016-03-02
[154]
서적
And the Band Played On: Politics, People, and the AIDS Epidemic
https://archive.org/[...]
St. Martin's Press
[155]
저널
An HIV vaccine: breaking the paradigms
[156]
저널
Design and pre-clinical evaluation of a universal HIV-1 vaccine
2007-10
[157]
저널
HIV vaccine efficacy trials: towards the future of HIV prevention
https://archive.org/[...]
2007-03
[158]
저널
The hope for an HIV vaccine based on induction of CD8+ T lymphocytes--a review
2008-03
[159]
저널
Design and pre-clinical evaluation of a universal HIV-1 vaccine
2007-10
[160]
저널
Neutralizing antibodies have limited effects on the control of established HIV-1 infection in vivo
1999-04
[161]
저널
Protection of chimpanzees from infection by HIV-1 after vaccination with recombinant glycoprotein gp120 but not gp160
1990-06
[162]
저널
Immunological and virological analyses of persons infected by human immunodeficiency virus type 1 while participating in trials of recombinant gp120 subunit vaccines
https://archive.org/[...]
1998-02
[163]
저널
The use of nonhuman primate models in HIV vaccine development
2008-08
[164]
저널
Generalized immune activation as a direct result of activated CD4+ T cell killing
[165]
저널
Life and death as a T lymphocyte: from immune protection to HIV pathogenesis
[166]
저널
Subtype C ALVAC-HIV and bivalent subtype C gp120/MF59 HIV-1 vaccine in low-risk, HIV-uninfected, South African adults: a phase 1/2 trial
2018-06
[167]
저널
Recent progress in HIV vaccines inducing mucosal immune responses
2014-07
[168]
뉴스
New Vaccine Could Turn HIV Into Minor Infection
http://www.foxnews.c[...]
2011-09-29
[169]
저널
First Phase I human clinical trial of a killed whole-HIV-1 vaccine: demonstration of its safety and enhancement of anti-HIV antibody responses
2016-11
[170]
뉴스
New HIV Vaccine Proves Successful In Phase 1 Human Trial
http://www.medicalda[...]
2013-09-04
[171]
웹인용
STEP Study Locations
http://www.stepstudi[...]
2008-11-04
[172]
웹인용
AIDS epidemic update
https://www.who.int/[...]
[[World Health Organization]]
2005-12
[173]
URL
Efficacy Results from the STEP Study (Merck V520 Protocol 023/HVTN 502): A Phase II Test-of-Concept Trial of the MRKAd5 HIV-1 Gag/Pol/Nef Trivalent Vaccine
https://web.archive.[...]
2011-07-26
[174]
저널
The failed HIV Merck vaccine study: a step back or a launching point for future vaccine development?
2008-01
[175]
저널
The aftermath of the Merck's HIV vaccine trial
2008-07
[176]
논문
Modeling cumulative overall prevention efficacy for the VRC01 phase 2b efficacy trials
2018-04
[177]
논문
Intradermal injection of a Tat Oyi-based therapeutic HIV vaccine reduces of 1.5 log copies/mL the HIV RNA rebound median and no HIV DNA rebound following cART interruption in a phase I/II randomized controlled clinical trial
2016-04
[178]
논문
Vaccination with ALVAC and AIDSVAX to prevent HIV-1 infection in Thailand
2009-12
[179]
논문
Clues emerge to explain first successful HIV vaccine trial
2011-09-16
[180]
웹인용
Experimental HIV vaccine regimen ineffective in preventing HIV
https://www.nih.gov/[...]
NIH
2020-02-03
[181]
웹인용
NIH and partners to launch HIV vaccine efficacy trial in the Americas and Europe
https://www.nih.gov/[...]
National Institutes of Health
2019-07-15
[182]
웹인용
Investing to End the AIDS Epidemic: A new Era for HIV Prevention Research and Development
http://www.hivresour[...]
2010-12-13
[183]
논문
Advanced Purchase Commitments for a Malaria Vaccine: Estimating Costs and Effectiveness
2005-04
[184]
논문
Potential utility of GB virus type C as a preventive vaccine for HIV-1
2012-03
[185]
논문
Construction of a live-attenuated HIV-1 vaccine through genetic code expansion
2014-05
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com