질소고정효소
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
질소 고정 효소는 대기 중의 질소를 암모니아로 환원시키는 반응을 촉매하는 효소로, 생명체에 필수적인 질소 고정 과정에 관여한다. 이 효소는 몰리브덴, 바나듐, 철을 활성 중심에 포함하는 세 가지 유형으로 분류되며, 몰리브덴을 포함하는 효소가 가장 널리 연구되었다. 질소 고정 반응은 복잡한 메커니즘을 거치며, 전자 공여체, ATP, 금속 이온 등이 관여하며, Nif 유전자군을 비롯한 여러 유전자의 발현 조절을 받는다. 질소 고정 효소는 산소에 의해 비활성화되므로, 산소 내성 기작을 통해 보호되며, 원핵생물에 널리 분포한다. 질소 고정 효소 활성은 다양한 방법으로 측정할 수 있으며, 아세틸렌 환원 검정법이 널리 사용된다.
더 읽어볼만한 페이지
| 질소고정효소 | |
|---|---|
| 효소 정보 | |
| 이름 | 질소고정효소 |
| EC 번호 | 1.18.6.1 |
| CAS 등록번호 | 9013-04-1 |
| IUBMB EC 번호 | 1/18/6/1 |
| GO 코드 | 0016163 |
 | |
| 단백질 군 정보 | |
| Pfam | PF00148 |
| 심볼 | Oxidored_nitro |
| InterPro | IPR000510 |
| SCOP | 1mio |
| 니트로게나제 철 단백질 NifH (구성 요소 2) | |
| 심볼 | NifH |
| CDD | cd02040 |
| InterPro | IPR005977 |
| SCOP | d1fp6a_ |
| CATH | 1fp6 |
| 대체 니트로게나제 (구성 요소 1) 델타 소단위 | |
| Pfam | PF03139 |
| 심볼 | AnfG_VnfG |
| InterPro | IPR004349 |
2. 반응
분자 수소와 질소로부터 암모니아의 평형 형성은 전체적으로 음의 반응 엔탈피를 갖지만, 활성화 에너지는 매우 높다.[1] 질소고정효소는 촉매 역할을 하여 이 에너지 장벽을 낮춰 반응이 실온에서 일어날 수 있도록 한다.
일반적인 구성은 두 가지 구성 요소로 이루어져 있다.
- 높은 환원력을 가지고 있으며 전자를 공급하는 역할을 하는 동종 이량체 Fe-only 단백질인 환원 효소.
- N2를 NH3로 환원하기 위해 제공된 전자를 사용하는 이종 사량체 MoFe 단백질인 질소고정효소.

질소 고정 반응에서 가장 특징적인 것은, '''질소 분자의 강력한 삼중 결합을 해리하여 무기 질소 화합물로 변환하는''' 점에 있다. 이 삼중 결합은 매우 안정적이며, 화학적으로 질소에서 암모니아를 합성하는 하버-보슈법의 반응 조건으로도 뒷받침된다.
:N2 + 3H2 → 2NH3 (ΔG = -8 kcal/mol N2; 450 ℃, 200 atm)
상기 조건에서의 반응은 발에르곤 반응이지만, 고온 고압 조건에서만 수행된다. 반면, 생물에 의한 질소 고정 반응은 기본적으로 표준 상태(25 ℃, 1 atm, pH 7.0)에서 수행된다. 니트로게나제가 담당하는 표준 상태에서의 암모니아 생산 반응은 다음 식으로 나타낸다.
:N2 + 6H+ + 6e- + 12ATP + 12H2O → 2NH3 + 12ADP + 12P''i'' (ΔG’ = -136 kcal/mol N2)・・・반응식1[52]
수소 대신, 전자 공여체(페레독신 등)로부터의 전자 및 고에너지 인산 화합물의 가수 분해 에너지를 사용하여 암모니아 생산 반응을 수행한다.
2. 1. 질소 고정 반응
질소고정효소는 대기 중의 질소(N₂)를 암모니아(NH₃)로 환원시키는 질소 고정 반응을 촉매하며, 이는 지구 생태계 유지에 필수적이다.[9] 질소고정효소는 질소 분자의 강력한 삼중 결합을 끊어 무기 질소 화합물로 변환하는 특징을 갖는다.질소고정효소의 질소 고정 반응은 다음과 같다.
: N₂ + 8H⁺ + 8e⁻ + 16 ATP → 2NH₃ + H₂ + 16ADP + 16Pᵢ・・・반응식 2[52]
이 반응을 통해 대기 중의 질소가 환원되어 암모니아로 고정된다. 고정된 질소는 다른 세균에 의해 글루탐산염이나 질산염으로 변환되어 식물이 이용 가능한 형태가 된다.
질소고정효소는 반응 특이성이 낮아, ATP 가수분해와 연계된 수소(H₂) 생성 부반응을 일으키기도 한다.
:2H⁺ + 2e⁻ + 4ATP + 4H₂O → H₂ + 4ADP + 4Pᵢ・・・반응식 3
이 부반응과 암모니아 생성 반응이 결합하여 반응식 2가 나타난다. 반응식 2는 최적 조건에서의 반응식이며, 실제 생리적 조건에서는 20-30 ATP가 소모되는 것으로 알려져 있다.
몰리브데넘(Mo) 질소고정효소, 바나듐(V) 질소고정효소, 철(Fe) 전용 질소고정효소의 세 가지 유형이 있는데, 콩과 식물 관련 Rhizobia와 같은 다이아조트로프에서 발견되는 몰리브데넘 질소고정효소가 가장 잘 연구되었다.[10][11][12]
2. 2. 부반응
질소고정효소는 질소 분자 환원 외에도 양성자를 이수소로 환원시키는데, 이는 질소고정효소가 탈수소 효소임을 의미한다.[42][43] 질소고정효소는 반응 특이성이 낮아 다양한 부반응을 일으킨다. 주요 부반응 물질로는 일산화이질소, 시안, 아세토니트릴, 아자이드, 아세틸렌, 사이클로프로펜, 시아나미드, 디아지린 등이 있다.[42][43][44][45]질소고정효소의 주요 부반응은 다음과 같다.[42][43]
- HC≡CH → H2C=CH2
- N–=N+=O → N2 + H2O
- N=N=N– → N2 + NH3
- → CH4, NH3, H3C–CH3, H2C=CH2 (CH3NH2)
- N≡C–R → RCH3 + NH3
- C≡N–R → CH4, H3C–CH3, H2C=CH2, C3H8, C3H6, RNH2
- O=C=S → CO + H2S[44][45]
- O=C=O → CO + H2O [44]
- S=C=N– → H2S + HCN [45]
- O=C=N– → H2O + HCN, CO + NH3 [45]
- N2O + 2H+ + 2e- → N2 + H2O
- CN- + 7H+ + 6e- → CH4 + NH3
- CH3NC + 6H+ + 6e- → CH3NH2 + CH4
- N3- + 3H+ + 2e- → N2 + NH3
- C2H2 + 2H+ + 2e- → C2H4
- CH2CHCH + 2H+ + 2e- → CH2CH2CH2
- H2N-CN + 6H+ + 6e- → NH3 + CH3NH2
- CH2NN + 6H+ + 6e- → CH3NH2 + NH3
위의 반응 중에서 질소를 생산하는 일산화이질소만이 경쟁적 저해제이며, 다른 기질은 비경쟁적 저해제가 된다. 일산화이질소의 환원에 의해 생성된 질소는 그대로 일반적인 질소 고정 반응에 사용된다.
이수소는 경쟁적 저해제로 작용하고,[46] 일산화 탄소는 비경쟁적 저해제로 작용하며,[42][43] 이황화 탄소는 질소 고정 효소의 급속 평형 저해제로 작용한다.[44]
바나듐 질소 고정 효소는 피셔-트롭쉬 공정과 유사한 반응을 통해 CO를 알칸으로 전환하는 것을 촉매한다.
'''아세틸렌 환원 반응은 질소 고정 효소의 간이 측정법으로 유효하며, 생성된 에틸렌을 기체 크로마토그래피로 분석함으로써 질소 고정 효소 활성을 검출할 수 있다'''.
2. 3. 전자 공여체
환원제(예: 페레독신 또는 플라보독신)에서 질소고정효소 단백질로 전자를 전달하는 역할을 하는 것은 Fe 단백질이다.[2] 페레독신 또는 플라보독신은 다음 여섯 가지 메커니즘 중 하나에 의해 환원될 수 있다.[3]1. 피루브산:페레독신 산화환원효소에 의해
2. 양방향 수소화 효소에 의해
3. 광합성 반응 중심에서
4. 전자 전달계의 전자 흐름을 양성자 구동력의 소산에 연결함으로써
5. 전자 분기에 의해
6. 페레독신:NADPH 산화환원효소에 의해
이러한 전자의 전달에는 ATP의 결합 및 가수분해로부터 오는 화학 에너지의 투입이 필요하다.[4]
질소 고정 반응에 사용되는 전자는 주요 대사계(발효, 피루브산의 산화 등)에 의해 환원된 전자 전달체에 의해 제공된다. 혐기성 그람 양성 세균인 ''Clostridium pasteurianum''은 페레독신을 전자 공여체로 사용한다.[57] ''Azotobacter vinelandii''와 같은 공생 질소 고정 미생물은 페레독신에 비해 산화 환원 전위가 높은 플라보독신을 사용한다.[58] 또한, 뿌리혹박테리아나 ''Thiocapsa roseopersicina''와 같은 광합성 세균에서는 환원적 ATP 아제 활성에 의해 생성된 수소를 uptake-수소화 효소에 의해 재산화하여 전자 공여체의 재환원에 사용한다.[59]
3. 분류
질소고정효소는 활성 중심에 포함된 금속 종류에 따라 세 가지로 분류된다.[10]
- 몰리브덴(Mo) 함유 질소고정효소: 가장 일반적인 유형으로, 대부분의 질소고정세균이 가지고 있으며 자연계 질소 고정의 대부분을 담당한다.[62]
- 바나듐(V) 함유 질소고정효소: 몰리브덴이 부족한 환경에서 대체 질소고정효소로 작용한다.[63]
- 철(Fe) 함유 질소고정효소: 몰리브덴이 부족한 환경에서 대체 질소고정효소로 작용한다.[63]
바나듐 및 철 함유 질소고정효소는 몰리브덴 함유 질소고정효소와 전체 구조는 유사하지만, 분포가 제한적이며 대체 질소고정효소(Alternative nitrogenase)라고 불린다.[63]
다음은 질소고정효소 유형에 따른 분포 예시이다.
| 질소고정효소 유형 | 세균 종류 | 비고 |
|---|---|---|
| 몰리브덴, 바나듐, 철 함유 | 아조토박터 비넬란디 (Azotobacter vinelandii)[64] | 3가지 유형 모두 보유 |
| 몰리브덴, 철 함유 | 로도박터 캅슐라투스 (Rhodobacter capsulatus),[65] 로도스피릴룸 루브럼 (Rhodospirillum rubrum)[66] | |
| 몰리브덴, 바나듐 함유 | 아나베나 바리아빌리스 (Anabaena variablis)[67] | |
| 몰리브덴 함유 | 폐렴막대균 (Krebsiella pneumoniae)[68] | 가장 일반적인 유형 |
모든 질소고정세균은 몰리브덴 함유 질소고정효소를 가지며, 바나듐 및 철 함유 질소고정효소만 갖는 경우는 아직 발견되지 않았다.[62]
방선균의 일종인 ''Streptomyces thermoautotrophicus''에서는 기존 질소고정효소와 전혀 다른 네 번째 그룹이 발견되었는데, 이 효소는 몰리브도프테린을 활성 중심으로 가지며 서브 유닛 구성 등이 다르다.[69]
4. 구조
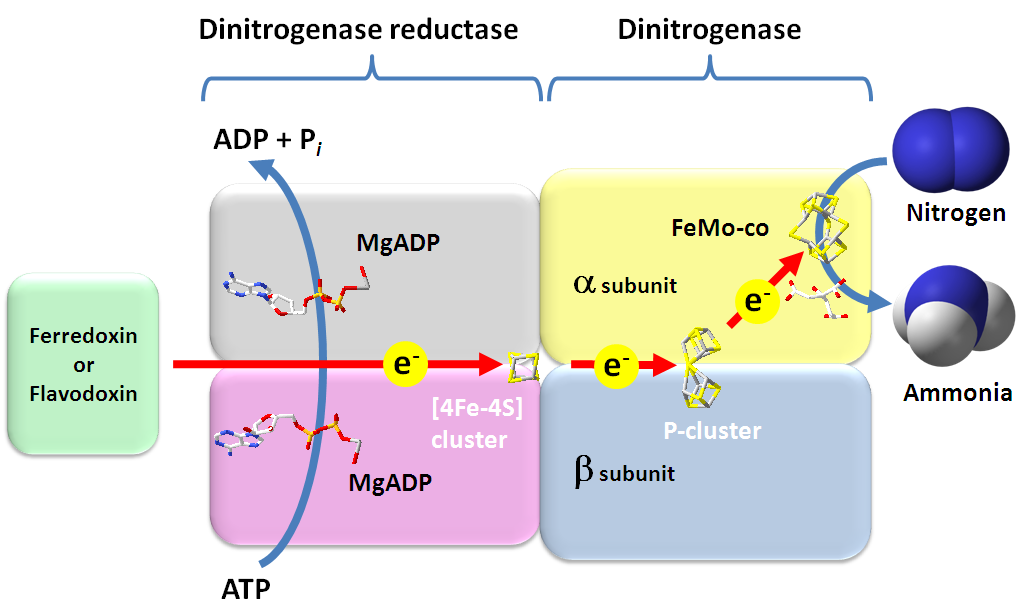
질소 고정 효소는 크게 두 가지 단백질 복합체로 구성된다. 활성 중심을 가진 질소 고정 효소 이량체(Dinitrogenase, Mo-Fe 단백질, component I)와 질소 고정 효소 이량체를 환원하는 질소 고정 효소 환원 효소(Dinitrogenase reductase, Fe 단백질, component II)가 그것이다.[62] 기능 단위는 질소 고정 효소 이량체 및 질소 고정 효소 환원 효소 이량체의 헤테로 사량체를 이루지만, 생체 내에서는 헤테로 사량체 2개가 결합하여 헤테로 팔량체 구조로 기능한다.
4. 1. 질소 고정 효소 이량체 (Dinitrogenase)
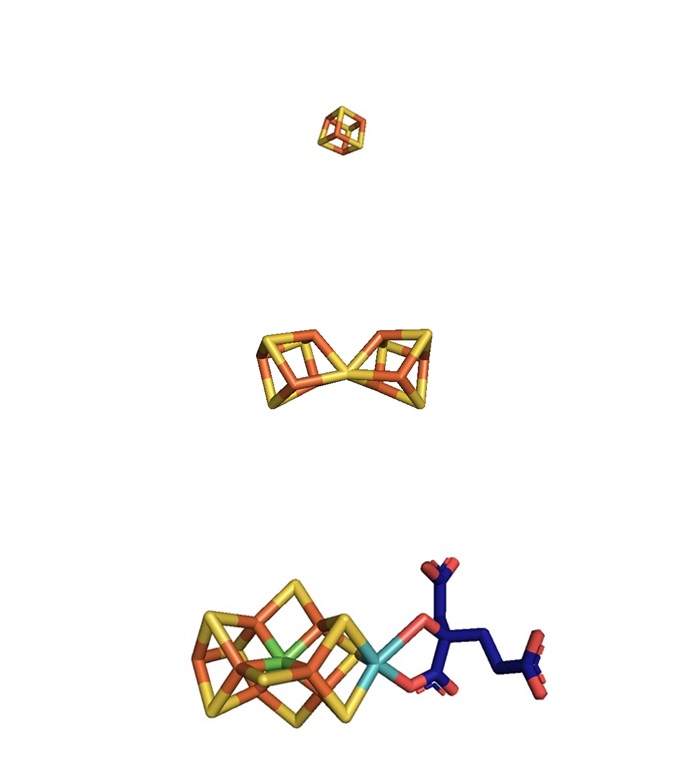
MoFe 단백질은 두 개의 α 서브유닛과 두 개의 β 서브유닛으로 구성된 이종사량체(α₂β₂)이다.[2] 각 서브유닛의 경계면에는 P-클러스터라고 불리는 두 개의 철-황 클러스터가 있고, α 서브유닛 내에는 두 개의 FeMo 보조 인자가 있다.- P-클러스터의 코어(Fe8S7)는 중심 황 원자에 의해 연결된 두 개의 [Fe4S3] 큐브 형태를 취한다. 각 P-클러스터는 6개의 시스테인 잔기에 의해 MoFe 단백질에 연결되어 있다.
- 각 FeMo 보조 인자(Fe7MoS9C)는 두 개의 비동일 클러스터([Fe4S3] 및 [MoFe3S3])로 구성되며, 이들은 3개의 황화 이온에 의해 연결된다. 각 FeMo 보조 인자는 하나의 시스테인 잔기와 하나의 히스티딘 잔기에 의해 단백질의 α 서브유닛에 공유 결합되어 있다.
Fe 단백질에서 나온 전자는 P-클러스터를 거쳐 MoFe 단백질로 들어가고, P-클러스터는 전자를 FeMo 보조 인자로 전달한다. 각 FeMo 보조 인자는 질소 고정 부위로 작용하며, N2는 보조 인자의 중심 캐비티에 결합한다.
질소고정효소 이량체의 유전자는 ''nifD'' 및 ''nifK''이며, 각각 α 및 β 서브유닛을 암호화한다. αβ 구조가 기능 단위이지만, 생체 내에서는 α₂β₂ 구조를 가지며, 분자량은 220 - 240 kDa 정도이다. αβ 구조 내에는 활성 중심인 철-몰리브덴 보조 인자(FeMo-co) 및 전자 전달을 담당하는 P-cluster가 하나씩 배위하고 있다. FeMo-co는 [Mo-3Fe-3S] 및 [4Fe-3S] 클러스터가 3개의 황 리간드에 의해 결합하여 [Mo-7Fe-6S] 클러스터 구조를 가지고 있다. 또한 몰리브덴은 호모구연산의 C2 카르보닐기와 히드록시기와 결합하고, 또한 α 서브유닛의 시스테인과 히스티딘에 결합하여 안정된 구조를 이룬다. 한편, P-cluster는 2개의 [4Fe-3S] 클러스터가 하나의 황 리간드에 의해 결합하여 [8Fe-7S] 클러스터 구조를 이룬다. 각 클러스터의 양쪽 끝은 α 및 β 서브유닛의 시스테인에 결합되어 배위되어 있다. 따라서 P-cluster는 αβ 서브유닛 사이에 배치되어 있다.
4. 2. 질소 고정 효소 환원 효소 (Dinitrogenase reductase)
Fe 단백질, 질소고정효소 환원효소 또는 NifH는 동일한 서브유닛의 이량체이며, 하나의 [Fe4S4] 클러스터를 포함하고 있고, 질량은 약 60-64kDa이다.[2] Fe 단백질의 기능은 전자를 환원제(예: 페레독신 또는 플라보독신)에서 질소고정효소 단백질로 전달하는 것이다. 페레독신 또는 플라보독신은 다음 여섯 가지 메커니즘 중 하나에 의해 환원될 수 있다.[3]| 번호 | 환원 메커니즘 |
|---|---|
| 1 | 피루브산:페레독신 산화환원효소에 의해 |
| 2 | 양방향 수소화 효소에 의해 |
| 3 | 광합성 반응 중심에서 |
| 4 | 전자 전달계의 전자 흐름을 양성자 구동력의 소산에 연결함으로써 |
| 5 | 전자 분기에 의해 |
| 6 | 페레독신:NADPH 산화환원효소에 의해 |
전자의 전달에는 ATP의 결합 및 가수분해로부터 오는 화학 에너지의 투입이 필요하다. ATP의 가수분해는 또한 질소고정효소 복합체 내에서 입체 구조 변화를 일으켜, Fe 단백질과 MoFe 단백질을 더 가깝게 하여 전자 전달을 용이하게 한다.[4]
질소 고정 효소 환원 효소의 유전자는 ''nifH''이다. 기능 단위는 호모 이량체이며, 분자량은 120 kDa이다. 니트로게나제 환원 효소 내에는 1개의 [4Fe-4S] 클러스터 및 2개의 Mg-ATP 결합 부위를 가지고 있다. [4Fe-4S] 클러스터는 호모 이량체 각각의 시스테인에 의해 배위되며, P-클러스터와 마찬가지로 서브 유닛 사이에 배치되어 있다. 한편, Mg-ATP 결합 부위에 대해서는, 호모 이량체의 서브 유닛 각각에 존재한다.
5. 반응 메커니즘
질소 고정 효소의 반응 메커니즘은 복잡하며, 여러 단계의 전자 전달과 양성자 이동을 포함한다. 1960년에 Carnahan 등은 ''C. pasteurianum'' 무세포 표본으로 질소 고정 반응에 성공했다.[70][71] 이후 연구를 통해 질소 고정 효소가 두 가지 구성 요소, 즉 질소 고정 효소 이량체와 질소 고정 효소 환원 효소에 의해 기능한다는 것이 밝혀졌다.[72]
질소 고정 효소는 아래의 5가지 성분이 있을 때 질소 고정 반응을 수행한다.[73][74][75]
| 성분 | 설명 |
|---|---|
| 전자 공여체 | 페레독신, 플라보독신 등이 있다. |
| 질소 고정 효소 환원 효소 | 4Fe-4S 클러스터를 포함한다. |
| ATP 및 2가 금속 이온 | 마그네슘, 칼슘 등이 사용된다. |
| 질소 고정 효소 이량체 | P-Cluster, FeMo-co를 포함한다. |
| 전자 수용체 | 질소가 사용된다. |
이 성분들은 순서대로 전자를 전달한다. 질소 고정 반응의 순서는 다음과 같다.
# 질소 고정 효소 환원 효소에 ATP와 마그네슘이 결합하여 복합체를 형성하고, 표준 산화 환원 전위가 -400 mV 부근까지 낮아진다.
# 전자 공여체에서 질소 고정 효소 환원 효소-MgATP 복합체로 전자가 전달되어 복합체가 환원된다.
# 복합체의 ATP가 가수분해되어 더 낮은 전위의 전자가 되고, 결합된 ATP는 ADP가 된다.
# 질소 고정 효소 환원 효소-MgADP 복합체의 4Fe-4S 클러스터를 통해 질소 고정 효소 이량체의 P-cluster로 전자가 전달된다.
# 질소 고정 효소 이량체의 P-cluster에서 FeMo-co로 전자가 전달된다.
# FeMo-co가 질소를 2전자 환원하여 N2H2을 생성한다.
# FeMo-co가 N2H2를 추가로 2전자 환원하여 N2H4을 생성한다.
# FeMo-co가 N2H4를 추가로 2전자 환원하여 2개의 암모니아를 생성한다.
# 질소 환원과 동시에 양성자도 환원되어 수소가 발생한다.
Lowe-Thorneley(LT) 모델은 이러한 실험에서 개발되었으며, 반응에 필요한 8개의 상관된 양성자 및 전자 이동을 설명한다.[9][16][17] 각 중간 단계는 En (n = 0–8)으로 표시되며, 이동된 당량 수를 나타낸다. 질소 환원은 균형 화학 반응에서 예측된 6당량과 달리 8당량의 양성자와 전자를 필요로 한다.[18]
5. 1. 일반적인 메커니즘
분자 수소와 질소로부터 암모니아를 형성하는 것은 전체적으로 음의 반응 엔탈피를 가지지만, 활성화 에너지는 매우 높다.[1] 질소 고정 효소는 촉매 역할을 하여 이 에너지 장벽을 낮춰 반응이 실온에서 일어날 수 있도록 한다.일반적인 질소 고정 효소는 두 가지 구성 요소로 이루어져 있다.
# 높은 환원력을 가지고 있으며 전자를 공급하는 역할을 하는 동종 이량체 Fe-only 단백질인 환원 효소.
# N2를 NH3로 환원하기 위해 제공된 전자를 사용하는 이종 사량체 MoFe 단백질인 질소 고정 효소.
질소 고정 효소는 질소 고정을 촉매하는 효소로, 질소(N2)를 암모니아(NH3)로 환원시킨다.[9] 질소 고정 효소에는 몰리브덴(Mo) 질소 고정 효소, 바나듐(V) 질소 고정 효소, 철-전용(Fe) 질소 고정 효소의 세 가지 유형이 있다.[10] 이 중 몰리브덴 질소 고정 효소는 가장 광범위하게 연구되었으며 가장 잘 특징지어진 질소 고정 효소이다.[10] 바나듐 질소 고정 효소와 철-전용 질소 고정 효소는 모두 Azotobacter의 일부 종에서 대체 질소 고정 효소로 발견될 수 있다.[11][13]
몰리브덴 질소 고정 효소에서 질소 고정의 균형 반응은 다음과 같다.
:N2 + 8 H+ + 8 e− + 16 MgATP → 2 NH3 + H2 + 16 MgADP + 16 Pi[9]
모든 질소 고정 효소는 구성 요소 I (다이질소네이스)과 구성 요소 II (다이질소네이스 환원 효소)로 구성된 2성분 시스템이다. 구성 요소 I은 몰리브덴 질소 고정 효소에서는 MoFe 단백질이고, 바나듐 질소 고정 효소에서는 VFe 단백질이며, 철-전용 질소 고정 효소에서는 Fe 단백질이다.[9] 구성 요소 II는 Fe-S 클러스터를 포함하는 Fe 단백질로, 구성 요소 I에 전자를 전달한다.[13] 구성 요소 I에는 P-클러스터와 FeMo-코팩터 (FeMo-co)의 2개의 금속 클러스터가 포함되어 있으며, Mo는 바나듐 질소 고정 효소와 철-전용 질소 고정 효소에서 각각 V 또는 Fe로 대체된다.[9][15] 촉매 작용 동안 2당량의 MgATP가 가수분해되어 Fe-S 클러스터에 대한 전위를 감소시키고 P-클러스터의 환원, 마지막으로 N2가 NH3로 환원되는 FeMo-co로 구동하는 데 도움이 된다.
질소 고정 반응에서 가장 특징적인 것은, 질소 분자의 강력한 삼중 결합을 해리하여 무기 질소 화합물로 변환하는 점에 있다.
1960년 Carnahan 등은 ''C. pasteurianum'' 무세포 표본으로 질소 고정 반응에 성공했다.[70][71] 이후, 몰리브덴 함유 질소 고정 효소의 정제를 거쳐, 질소 고정 효소가 두 개의 Component (질소 고정 효소 이량체 및 질소 고정 효소 환원 효소)에 의해 기능하는 것이 밝혀졌다.[72]
질소 고정 효소는 아래의 5가지 성분의 존재 하에 질소 고정 반응을 수행한다.[73][74][75]
# 전자 공여체 (페레독신, 플라보독신)
# 질소 고정 효소 환원 효소 ([4Fe-4S] 클러스터)
# ATP 및 2가 금속 이온 (마그네슘, 칼슘 등)
# 질소 고정 효소 이량체 (P-Cluster, FeMo-co)
# 전자 수용체 (질소)
위의 순서대로 전자 전달이 이루어지며, 5가지 성분의 질소 고정 반응 순서는 다음과 같다.
# 질소 고정 효소 환원 효소에 ATP 및 마그네슘이 결합하여 복합체를 이룬다. 이때 질소 고정 효소 환원 효소의 표준 산화 환원 전위는 -400 mV 부근까지 저하된다.
# 전자 공여체로부터 질소 고정 효소 환원 효소-MgATP 복합체로 전자 전달이 일어나고, 이 복합체가 환원된다.
# 질소 고정 효소 환원 효소-MgATP 복합체의 ATP가 가수 분해되어 더 낮은 전위의 전자가 된다. 결합하고 있는 ATP는 ADP가 된다.
# 질소 고정 효소 환원 효소-MgADP 복합체의 [4Fe-4S] 클러스터를 통해, 질소 고정 효소 이량체의 P-cluster로 전자 전달이 일어난다.
# 질소 고정 효소 이량체의 P-cluster로부터 FeMo-co로 전자 전달이 일어난다.
# FeMo-co가 질소를 2전자 환원하면 N2H2이 생성된다.
# FeMo-co가 N2H2를 추가로 2전자 환원하면 N2H4이 생성된다.
# FeMo-co가 N2H4를 추가로 2전자 환원하면 2개의 암모니아가 생성된다.
# 질소 환원을 수행하는 동안, 동시에 양성자도 환원되어 수소가 발생한다.
5. 2. Lowe-Thorneley 동역학 모델
질소는 구성 요소 II에서 양성자와 전자 당량을 순차적으로 첨가한 후 구성 요소 I의 FeMo-co에서 두 분자의 암모니아로 환원된다.[9] 1970년대와 80년대에 로우(Lowe)와 손리(Thorneley) 등이 수행한 정상 상태, 급랭, 멈춤 흐름 운동 측정은 이 과정에 대한 운동론적 근거를 제공했다.[16][17] 이러한 실험을 통해 개발된 로우-손리(Lowe-Thorneley, LT) 운동 모델은 반응에 필요한 8개의 상관된 양성자 및 전자 이동을 보여준다.[9][16][17] 각 중간 단계는 En으로 표시되며, 여기서 n = 0–8로, 이동된 당량 수를 나타낸다. N2의 생산적인 첨가 전에 4개의 당량 이동이 필요하지만, E3과 N2의 반응 또한 가능하다.[16] 특히, 질소 환원은 균형 화학 반응에서 예측된 6당량과 달리 8당량의 양성자와 전자를 필요로 하는 것으로 나타났다.[18]5. 3. 중간체 E₀부터 E₄까지
질소고정효소의 촉매 반응에서 나타나는 중간체 E₀부터 E₄까지의 특징은 다음과 같다.| 중간체 | 설명 |
|---|---|
| E₀ | 촉매 작용이 시작되기 전 효소의 휴지 상태이다. EPR 특성 분석에 따르면 스핀 3/2를 갖는다.[19] |
| E₁ | 1개의 전자가 환원된 중간체로, N₂ 하에서 턴오버 동안 포획되었다. 뫼스바우어 분광법은 FeMo-co가 1보다 큰 정수 스핀을 갖는다는 것을 보여준다.[20] |
| E₂ | 금속 클러스터가 휴지 산화 상태에 있고 2개의 추가 전자가 브리지 수소화물에 저장되며, 추가적인 양성자가 황 원자에 결합되어 있다고 제안된다. 변이된 효소에서 이 중간체를 분리한 결과, FeMo-co가 고스핀이며 스핀 3/2를 갖는다는 것이 밝혀졌다.[21] |
| E₃ | 1개의 브리지 수소화물과 1개의 수소화물을 가진 단일 환원된 FeMo-co로 제안된다.[9] |
| E₄ | 전이의 로마 신에서 이름을 따온 야누스 중간체는 정확히 절반의 전자-양성자 전달 후에 위치하며, E₀로 되돌아가거나 질소 결합을 진행하여 촉매 사이클을 완료할 수 있다. 이 중간체는 2개의 브리지 수소화물과 2개의 황 결합된 양성자를 가진 휴지 산화 상태의 FeMo-co를 포함하는 것으로 제안된다.[9] |
위의 중간체는 금속 클러스터가 원래의 산화 상태와 단일 환원 상태 사이에서 순환하며, 추가 전자가 수소화물에 저장됨을 시사한다. 각 단계에서 수소화물이 형성되고 금속 클러스터가 실제로 원래의 산화 상태와 단일 산화 상태 사이에서 순환한다는 대안적인 제안도 있다.[9]
5. 4. N₂ 고정을 위한 말단 및 교번 경로
야누스 E4 복합체 이전의 질소 고정 메커니즘은 일반적으로 합의되었지만, 메커니즘 후반부의 정확한 경로에 대해서는 "말단 경로"와 "교번 경로"라는 두 가지 가설이 존재한다.[9][24][25]- 말단 경로: 말단 질소가 먼저 수소화되어 암모니아를 방출하고, 그 후 금속에 직접 결합된 질소가 수소화된다.
- 교번 경로: 수소가 말단 질소에 추가된 다음, 금속에 직접 결합된 질소에 추가된다. 이 과정은 암모니아가 방출될 때까지 반복된다.[9][24][25]
각 경로는 고유한 중간 생성물 세트를 선호한다. 따라서 어떤 경로가 정확한지 확인하기 위해 일반적으로 해당 중간 생성물을 분리하는 데 초점을 맞추었다. 예를 들어, 말단 경로의 니트리도[26]와 교번 경로의 다이아젠 및 히드라진 등이 있다.[9]
질소 고정효소 자체에서 중간 생성물을 분리하려는 시도는 현재까지 성공하지 못했지만, 모델 복합체를 사용하여 사용된 금속 중심에 따라 양쪽 경로를 모두 지지하는 중간 생성물을 분리할 수 있었다.[9] Mo을 사용한 연구는 일반적으로 말단 경로를, Fe를 사용한 연구는 일반적으로 교번 경로를 지지한다.[9][24][25][27][28]
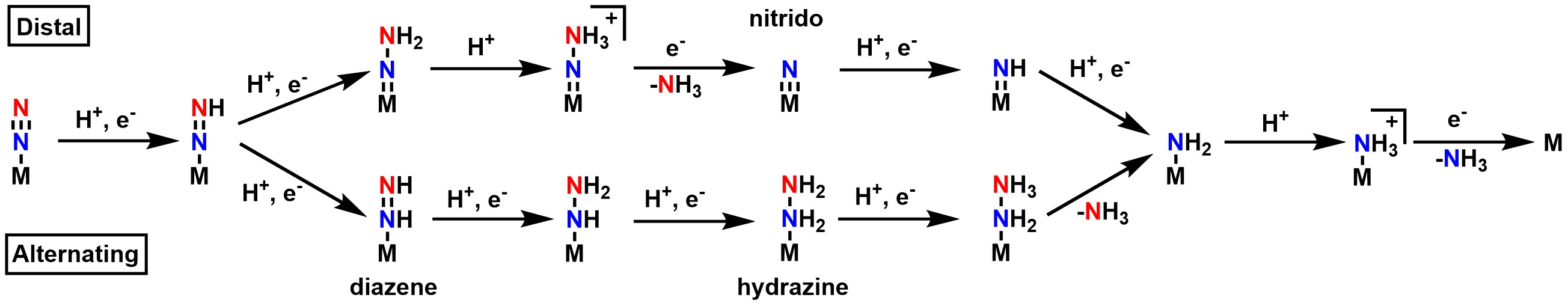
말단 경로에 대한 구체적인 지지는 Schrock과 Chatt의 연구에서 비롯되었는데, 이들은 모델 복합체에서 금속 중심으로 Mo를 사용하여 니트리도 복합체를 성공적으로 분리했다.[26][29] 교번 경로에 대한 지지는 다음 연구들에서 비롯되었다.
- 철 단독 모델 클러스터가 N2를 촉매적으로 환원하는 것으로 나타났다.[27][28]
- 작은 텅스텐 클러스터도 질소 고정을 위해 교번 경로를 따르는 것으로 나타났다.[30]
- 바나듐 질소 고정효소는 교번 메커니즘에 특정한 중간 생성물인 히드라진을 방출한다.[9][31]
하지만, 네이티브 효소 자체에서 특성화된 중간 생성물이 없기 때문에 어떤 경로도 결정적으로 증명되지 않았다. 또한, 계산 연구는 반응 부위가 MoFe 보조 인자에서 Mo (말단) 또는 Fe (교번)에 있다고 가정하는지에 따라 양쪽 경로를 모두 지지하는 것으로 나타났다.[9][24][25]
5. 5. MgATP 결합 메커니즘
MgATP의 말단 인산염 그룹의 가수분해는 Fe 단백질에서 MoFe 단백질로 전자를 전달하는 데 필요한 에너지를 제공한다.[32] MgATP 인산염 그룹과 Fe 단백질의 아미노산 잔기 사이의 결합 상호 작용은 비교적 잘 이해되고 있지만, MgATP가 결합된 Fe 단백질 결정 구조가 없기 때문에 (1996년 기준) 분자의 나머지 부분과의 상호 작용은 더 알기 어렵다.[33]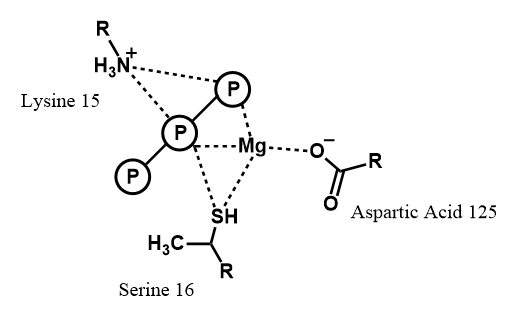
세 개의 단백질 잔기가 인산염과 유의미한 상호 작용을 하는 것으로 나타났다.[16]
- 잔기 15 (라이신): MgATP가 없을 때 잔기 125인 아스파르트산 사이에 염다리가 존재한다.[33] 결합 시 이 염다리는 끊어진다.
- 부위 지향적 돌연변이 유발 결과, 라이신이 글루타민으로 대체되면 단백질의 MgATP에 대한 친화력이 크게 감소한다.[34]
- 라이신이 아르기닌으로 대체되면 염다리가 너무 강해져 MgATP가 결합할 수 없다.[35]
- 잔기 125 (아스파르트산): 글루탐산으로 돌연변이되었을 때 변경된 반응성이 관찰되어 해당 잔기의 필요성이 나타났다.[36]
- 잔기 16 (세린): MgATP에 결합하는 것으로 나타났으며, 부위 지향적 돌연변이 유발로 증명되었다.[36] 세린은 인산염 가수분해 후 Mg2+ 이온에 계속 배위되어 현재 ADP 분자의 다른 인산염과의 연관성을 촉진한다는 모델이 제시되었다.[37]
MgATP 결합은 Fe 단백질 내에서 상당한 입체 형태 변화를 유도한다.[16] 부위 지향적 돌연변이 유발을 통해 MgATP는 결합하지만 입체 형태 변화를 유도하지 않는 돌연변이 단백질을 생성했다.[38] 돌연변이체와 야생형 단백질의 X선 산란 기술 데이터를 비교한 결과, MgATP 결합 시 전체 단백질이 수축하며 반경이 약 감소한다는 결론이 나왔다.[38]
6. 관련 유전자 및 기능
니트로게나아제 이량체의 유전자는 ''nifD'' 및 ''nifK''이며, 각각 α 및 β 서브유닛을 암호화한다.[62] αβ 구조가 기능 단위이지만, 생체 내에서는 α2β2 구조를 가지며, 분자량은 220 - 240 kDa 정도이다. αβ 구조 내에는 활성 중심인 철-몰리브덴 보조 인자(FeMo-co) 및 전자 전달을 담당하는 P-cluster가 하나씩 배위하고 있다.
니트로게나아제 환원 효소의 유전자는 ''nifH''이다.[62] 기능 단위는 호모 이량체이며, 분자량은 120 kDa이다. 니트로게나아제 환원 효소 내에는 1개의 [4Fe-4S] 클러스터 및 2개의 Mg-ATP 결합 부위를 가지고 있다.
P 클러스터나 FeMo-co와 같은 복잡한 금속 클러스터는 자발적으로 구축되지 않으며, 다양한 단백질이 구축에 관여한다. 질소 고정 효소 구조 유전자 발현 후, 단백질 내에 클러스터가 배위되는 발현 후 프로세싱을 거쳐 활성을 발휘하는데, 이 일련의 현상을 성숙화(maturation)라고 한다. 또한, 질소 고정 효소는 발현에 있어서 다양한 조절을 받으며, 이에 관련된 유전자도 다수 존재한다. ''A. vinelandii''나 ''K. pneumoniae''의 질소 고정 효소 유전자 기능 분석을 통해, 질소 고정 효소와 관련된 유전자 전체의 모습이 밝혀지고 있다.[77][78][79]
지금까지 밝혀진 질소 고정 효소 관련 유전자군(''nif'' 유전자)의 명칭 및 기능은 다음과 같다.
| 유전자명 | 기능 |
|---|---|
| nifH | 질소 고정 효소 환원 효소 |
| nifD | 질소 고정 효소 이량체 α 서브유닛 |
| nifK | 질소 고정 효소 이량체 β 서브유닛 |
| nifT | 기능 불명 |
| nifY/nafY | 질소 고정 효소 이량체의 샤페론. FeMo-co의 삽입에 관여. |
| nifE | FeMo-co 구축 |
| nifN | FeMo-co 구축 |
| nifX | FeMo-co 구축 |
| nifU | 철-황 클러스터 골격 |
| nifS | 철-황 클러스터의 불안정한 황 운반 |
| nifV | 호모구연산 합성 효소 |
| nifW | FeMo-co 안정화 |
| nifZ | 기능 불명 |
| nifM | 질소 고정 효소 환원 효소의 성숙화 |
| nifF | 플라보독신 |
| nifL | 음성 조절 인자 |
| nifA | 양성 조절 인자 |
| nifB | FeMo-co 구축 |
| fdnN | 페레독신 |
| nifQ | FeMo-co 구축 |
| nifJ | 피루브산: 플라보독신 (페레독신) 옥시도리덕타제 |
바나듐 함유 및 철형 질소 고정 효소도, 각각 ''vnf'' 유전자군(Vanadium Nitrogen Fixation) 및 ''anf'' 유전자군(Alternative Nitrogen Fixation)을 각각 가지고 있으며, 유사한 기전으로 발현에 관여하는 것으로 생각된다.[80] 몇몇 'nif' 유전자는 바나듐 함유 및 철형 질소 고정 효소에서 공유된다.[81]
7. 발현 조절
질소고정효소 계는 다량의 ATP를 요구하기 때문에, 산화적 인산화 또는 광인산화가 일어나는 조건에서만 질소 고정 반응이 나타난다. 게다가 질소고정효소 활성은 효소 발현량의 조절 및 ADP의 길항 억제에 의해 이루어진다.[82] 질소고정효소는 생산물인 암모니아의 존재에 의해 발현량이 감소한다. 암모니아 자체는 질소고정효소 반응의 저해 물질이 되지 않는다. ADP의 길항 억제에 관하여, 리보실화된 ADP가 질소고정효소 환원 효소의 강력한 억제제가 된다는 것이 밝혀졌다.[82] ADP의 리보실화는 질소고정효소 환원 효소 ADP 리보실 전이 효소(DRAT)가 관여하고 있으며, 이 효소는 암조건(광인산화가 일어나지 않는 조건)이나 암모늄염의 첨가에 의해 유도된다. 리보실화 ADP에 의해 억제된 질소고정효소 환원 효소는 질소고정효소 환원 효소 활성화 글리코히드로라제(DRAG)에 의해 부활되어 재활성화된다. DRAT 및 DRAG는 모두 정제되어 성상 분석이 이루어지고 있다.[83]
8. 산소 내성 기작
질소고정효소는 산소의 산화적 특성으로 인해 이산소에 의해 비가역적으로 억제되며, 이는 Fe-S 보조 인자를 분해적으로 산화시킨다.[39] 따라서 질소 고정 박테리아는 질소고정효소를 ''생체 내''에서 산소로부터 보호하기 위한 메커니즘이 필요하다. 이러한 문제에도 불구하고, 많은 종들은 호흡을 위한 최종 전자 수용체로 산소를 사용한다.
Azotobacteraceae와 같은 일부 질소 고정 박테리아가 호기성 조건에서 산소에 불안정한 질소고정효소를 사용할 수 있는 능력은 높은 대사율에 기인하며, 이는 세포막에서 산소 환원을 가능하게 한다. 하지만 이러한 메커니즘의 효율성은 70μM 이상의 산소 농도(주변 농도는 230μM O2)뿐만 아니라 추가적인 영양분 제한 시에도 의문이 제기되었다.[40]
근류균은 산소에 높은 친화성을 가진 레그헤모글로빈을 근류 주변에 배치하여 니트로게나아제 계열에서 산소를 제거한다. 레그헤모글로빈에 포획된 산소는 니트로게나아제 계열에 닿지 않고 식물의 뿌리를 통해 흡수되어 체내에서 산화적 인산화에 사용된다.[53] 콩과 식물의 질소 고정 결절에서 발견되는 분자인 레그헤모글로빈은 헴 보조기를 통해 이산소에 결합할 수 있으며, 질소고정효소의 활성 부위에서 O2를 완충하는 데 중요한 역할을 하는 동시에 효율적인 호흡을 가능하게 한다.[41]
시아노박테리아는 광화학계 I과 II를 동시에 가지고 있으며, 산소 발생형 광합성을 수행한다. 따라서, 니트로게나아제 계열과는 매우 상성이 좋지 않다. 그러나 ''Anabaena'' 속과 같은 섬유상 시아노박테리아는 산소를 발생하는 광화학계 II를 세포에서 제거한 헤테로시스트 (이질 세포)에서 니트로게나아제를 발현하여 질소 고정 반응을 수행한다.[61] 그러나, 섬유상 형태를 취하지 않는 단세포 시아노박테리아 (''Trichodesmium'' 속 등)에서도 니트로게나아제 계열 및 질소 고정 반응이 확인되었다. 이러한 시아노박테리아는 낮에 광합성을 수행하여 ATP를 축적한 후, 밤에 질소 고정 반응을 수행하는 방법을 사용한다.[53] 다만, 광합성과 질소 고정을 동시에 수행하는 시아노박테리아도 발견되었으며, 그 기작에 대해서는 아직 수수께끼에 싸여 있다.[85]
''A. vinelandii''와 같은 호기성 세균은 자체의 높은 산소 호흡 활성을 통해 세포 주변의 산소를 최대한 제거하고, 니트로게나아제의 입체 구조 차이로 산소의 영향을 회피한다.[53][84]
9. 분포
질소고정효소는 세균, 고세균 등 다양한 원핵생물에 널리 분포하며, 게놈 분석과 미생물 생태학적 접근 방식을 통해서도 그 분포 범위가 확대되고 있다.[60] 질소 고정 연구가 특히 진전된 미생물군에 관해서는 혐기성 세균, 시아노박테리아, 그리고 근류균이 주로 언급된다. 또한, 그 생활 양식에 따라 공생 질소 고정 생물과 비공생 질소 고정 생물로 분류된다.[61]
'''비공생 질소 고정 생물'''
| 종류 | 예시 |
|---|---|
| 절대 혐기성 세균 | Clostridium, Desulfovibrio, Desulfotomaculum |
| 통성 혐기성 세균 | Klebisiella, Bacillus |
| 호기성 세균 | 아조토박터, Azomonas, Beijerinckia |
| 광합성 세균 | Chromatium, Rhodospirillum, Rhodobacter |
| 시아노박테리아 | Anabaena, Nostoc, Gloeocapsa |
'''공생 질소 고정 세균'''
한편 진핵생물에서는 질소 고정 효소계를 포함한 질소 고정계가 발견되지 않았다.[62]
10. 다른 단백질과의 유사성
질소 고정 효소의 세 소단위체는 프로토클로로필라이드를 엽록소로 전환하는 프로토클로로필라이드 환원효소의 광 비의존성 버전의 세 소단위체와 상당한 서열 유사성을 나타낸다. 이 단백질은 겉씨식물, 조류, 광합성 세균에 존재하지만, 진화 과정에서 속씨식물에서는 소실되었다.[47]
별도로, 질소 고정 효소의 두 소단위체(NifD와 NifH)는 질소를 고정하지 않는 메탄 생성균 (예: ''Methanocaldococcus jannaschii'')에서 상동체(homologue)를 가진다.[48] 이 "4군" ''nif'' 유전자의 기능에 대해서는 거의 알려진 바가 없지만,[49] 많은 메탄 생성균에서 발견된다. ''M. jannaschii''에서 이들은 서로 상호 작용하는 것으로 알려져 있으며, 구성적으로 발현된다.[48]
11. 질소 고정 효소 활성 측정
많은 효소 활성 측정법과 마찬가지로, 질소고정효소 활성은 기질(N2)이 생성물(NH3)로 전환되는 속도를 측정하여 추정할 수 있다. NH3는 세포 내 다른 반응에도 관여하므로, 첨가된 기질의 회계 또는 "질량 균형"을 제공하기 위해 기질에 15N을 표지하는 것이 종종 바람직하다. 보다 흔한 검정법인 아세틸렌 환원 검정법(ARA)은 효소가 아세틸렌 가스를 에틸렌 가스로 환원시키는 능력을 이용하여 질소고정효소의 활성을 추정한다. 이러한 가스는 기체 크로마토그래피를 사용하여 쉽게 정량화할 수 있다.[50] 이 방법은 처음에는 ''클로스트리디움 파스퇴리아눔(Clostridium pasteurianum)'' 세포 추출물에서 질소고정효소 활성을 측정하기 위해 실험실에서 사용되었지만, 다른 기술을 적용하기 어려운 현장 연구를 포함하여 광범위한 시험 시스템에 적용되었다. 예를 들어, ARA는 벼 뿌리와 관련된 박테리아가 식물에 의해 조절되는 것으로 보이는 질소고정효소 활성의 계절적 및 일주기 리듬을 겪는다는 것을 증명하는 데 성공적으로 사용되었다.[51]
불행히도, 질소고정효소 검정법에서 얻은 데이터를 실제 환원된 N2의 몰수로 변환하는 것은(특히 ARA의 경우) 항상 간단하지 않으며, 다양한 이유로 실제 속도를 과소평가하거나 과대평가할 수 있다. 예를 들어, H2는 질소고정효소에 대해 N2와 경쟁하지만 아세틸렌과는 경쟁하지 않아(ARA에 의한 질소고정효소의 과대평가로 이어진다). 병이나 챔버 기반 검정법은 미생물 시스템에 담김 또는 취급을 통한 미세 환경 교란의 결과로 부정적인 영향을 미쳐 질소고정효소의 과소평가를 초래할 수 있다. 이러한 약점에도 불구하고, 이러한 검정법은 질소고정효소 활성의 상대적 속도 또는 시간적 패턴을 평가하는 데 매우 유용하다.
아세틸렌 환원 반응은 질소 고정 효소의 간이 측정법으로 유효하며, 생성된 에틸렌을 기체 크로마토그래피로 분석함으로써 질소 고정 효소 활성을 검출할 수 있다.
참조
[1]
논문
Haber Process for Ammonia Synthesis
[2]
논문
Mechanism of Molybdenum Nitrogenase
[3]
논문
Mechanisms for Generating Low Potential Electrons across the Metabolic Diversity of Nitrogen-Fixing Bacteria
https://journals.asm[...]
[4]
논문
Molybdenum nitrogenases: a crystallographic and mechanistic view
2002
[5]
논문
Molybdenum L-Edge XAS Spectra of MoFe Nitrogenase
[6]
서적
Catalysts for Nitrogen Fixation: Nitrogenases, Relevant Chemical Models and Commercial Processes
Springer Netherlands
[7]
서적
Catalysts for Nitrogen Fixation: Nitrogenases, Relevant Chemical Models and Commercial Processes
Springer Netherlands
[8]
논문
Reconstruction and minimal gene requirements for the alternative iron-only nitrogenase in Escherichia coli
2014-09
[9]
논문
Mechanism of nitrogen fixation by nitrogenase: the next stage
2014-04
[10]
논문
Exploring new frontiers of nitrogenase structure and mechanism
2006-04
[11]
논문
Biosynthesis of the iron-molybdenum cofactor of nitrogenase
2008
[12]
논문
Nitrogen-fixing bacteria associated with leguminous and non-leguminous plants
2008-12
[13]
서적
Catalysts for Nitrogen Fixation
Springer Netherlands
2004-01
[14]
논문
The structure of vanadium nitrogenase reveals an unusual bridging ligand
2017-07-10
[15]
논문
Structural insights into the iron nitrogenase complex
https://www.nature.c[...]
2023-12-07
[16]
논문
Mechanism of Molybdenum Nitrogenase
1996-11
[17]
논문
Duplication and extension of the Thorneley and Lowe kinetic model for Klebsiella pneumoniae nitrogenase catalysis using a MATHEMATICA software platform
2001-07
[18]
논문
A nitrogen pressure of 50 atmospheres does not prevent evolution of hydrogen by nitrogenase
1984-06
[19]
논문
Breaking the N2 triple bond: insights into the nitrogenase mechanism
2006-05
[20]
논문
Mössbauer Study of the MoFe Protein of Nitrogenase from Azotobacter vinelandii Using Selective 57Fe Enrichment of the M-Centers
2000-05
[21]
논문
Connecting nitrogenase intermediates with the kinetic scheme for N2 reduction by a relaxation protocol and identification of the N2 binding state
2007-01
[22]
논문
Trapping H- bound to the nitrogenase FeMo-cofactor active site during H2 evolution: characterization by ENDOR spectroscopy
2005-05
[23]
논문
57Fe ENDOR spectroscopy and 'electron inventory' analysis of the nitrogenase E4 intermediate suggest the metal-ion core of FeMo-cofactor cycles through only one redox couple
2011-11
[24]
논문
The Yandulov/Schrock cycle and the nitrogenase reaction: pathways of nitrogen fixation studied by density functional theory
2005-12
[25]
논문
Catalysis by Enzymes: The Biological Ammonia Synthesis
2008
[26]
논문
Catalytic reduction of dinitrogen to ammonia at a single molybdenum center
2005-12
[27]
논문
N₂reduction and hydrogenation to ammonia by a molecular iron-potassium complex
2011-11
[28]
논문
Catalytic conversion of nitrogen to ammonia by an iron model complex
2013-09
[29]
논문
Recent advances in chemistry of nitrogen-fixation
1978
[30]
논문
Reduction of N2 by supported tungsten clusters gives a model of the process by nitrogenase
2012-05-14
[31]
논문
Hydrazine is a product of dinitrogen reduction by the vanadium-nitrogenase from Azotobacter chroococcum
1991-07
[32]
논문
Nitrogenase and nitrogenase reductase associate and dissociate with each catalytic cycle
1978-06
[33]
논문
Crystallographic structure of the nitrogenase iron protein from Azotobacter vinelandii
1992-09
[34]
논문
Mapping the site(s) of MgATP and MgADP interaction with the nitrogenase of Azotobacter vinelandii. Lysine 15 of the iron protein plays a major role in MgATP interaction
http://www.jbc.org/c[...]
1992-04
[35]
논문
Evidence for a central role of lysine 15 of Azotobacter vinelandii nitrogenase iron protein in nucleotide binding and protein conformational changes
1995-06
[36]
논문
Nucleotide-iron-sulfur cluster signal transduction in the nitrogenase iron-protein: the role of Asp125
1992-11
[37]
논문
Nuclear Magnetic Resonance Spectra of Adenosine Di- and Triphosphate
[38]
논문
MgATP-induced conformational changes in the iron protein from Azotobacter vinelandii, as studied by small-angle x-ray scattering
http://www.jbc.org/c[...]
1994-02
[39]
논문
Substrate interactions with nitrogenase: Fe versus Mo
2004-02
[40]
논문
Respiratory protection of nitrogenase in Azotobacter species: is a widely held hypothesis unequivocally supported by experimental evidence?
2000-10
[41]
논문
Symbiotic Leghemoglobins Are Crucial for Nitrogen Fixation in Legume Root Nodules but Not for General Plant Growth and Development
https://doi.org/10.1[...]
2005-03-29
[42]
논문
Interactions among substrates and inhibitors of nitrogenase
1975-08
[43]
논문
Nonenzymatic simulation of nitrogenase reactions and the mechanism of biological nitrogen fixation
1975-08
[44]
논문
Carbonyl sulfide and carbon dioxide as new substrates, and carbon disulfide as a new inhibitor, of nitrogenase
1995-04
[45]
논문
Reduction of thiocyanate, cyanate, and carbon disulfide by nitrogenase: kinetic characterization and EPR spectroscopic analysis
1997-07
[46]
논문
Inhibition of nitrogenase-catalyzed NH3 formation by H2
1983-10
[47]
논문
Chloroplast-encoded chlB is required for light-independent protochlorophyllide reductase activity in Chlamydomonas reinhardtii
1993-12
[48]
논문
Expression and association of group IV nitrogenase NifD and NifH homologs in the non-nitrogen-fixing archaeon Methanocaldococcus jannaschii
2007-10
[49]
논문
The natural history of nitrogen fixation
2004-03
[50]
논문
Acetylene reduction by nitrogen-fixing preparations from Clostridium pasteurianum
1966-10
[51]
논문
Diurnal and seasonal variations in nitrogenase activity (C2H2 reduction) of rice roots.
[52]
서적
코ーン・スタンプ生化学 第5版
1991
[53]
논문
Nitrogenases
1991
[54]
논문
1975
[55]
논문
1989
[56]
논문
1984
[57]
논문
1964
[58]
논문
1983
[59]
논문
Transposon mutagenesis in purple sulfur photosynthetic bacteria: identification of ''hyp''F, encoding a protein capable of processing [NiFe] hydrogenases in alpha, beta, and gamma subdivisions of the proteobacteria
2001
[60]
간행물
Phylogenetic classification of nitrogen-fixing organisms
Chapman and Hall, New York, N.Y.
1992
[61]
서적
植物生理学入門
培風館
1997
[62]
논문
Maturation of Nitrogenase: a Biochemical Puzzle
2005
[63]
논문
Evidence for an alternative nitrogen fixation system in ''Azotobacter vinelandii''
1980
[64]
논문
Nitrogen fixation by ''Azotobacter vinelandii'' strains having deletions in structural genes for nitrogenase
1986
[65]
논문
Purification and characterization of the alternative nitrogenase from the photosynthetic bacterium ''Rhodospirillum rubrum''
1996
[66]
논문
Demonstration of a molybdenum- and vanadium-independent nitrogenase in a nifHDKdeletion mutant of ''Rhodobacter capsulatus''
1991
[67]
논문
Characterization of genes for an alternative nitrogenase in the cyanobacterium ''Anabaena variabilis''
1993
[68]
논문
Nucleotide sequence of a 24,206-base-pair DNA fragment carrying the entire nitrogen fixation gene cluster of ''Klebsiella pneumoniae''
1988
[69]
논문
N2 fixation by ''Streptomyces thermoautotrophicus'' involves a molybdenum-dinitrogenase and a manganese-superoxide oxidoreductase that couple N2 reduction to the oxidation of superoxide produced from O2 by a molybdenum-CO dehydrogenase
1997
[70]
논문
1960
[71]
논문
Biochim. Biophys. Acta 44, 520-535
1960
[72]
서적
Non-Heme Iron Proteins: Role in Energy Conversion
Antioch Press
1965
[73]
논문
J. Biol. Chem. 243,940-944
1968
[74]
논문
Proc. Natl. Acad. Sci. U. S. A. 69, 3142-3145
1972
[75]
논문
Biochim. Biophys. Acta 416, 1-52
1975
[76]
논문
Exploring new frontiers of nitrogenase structure and mechanism
2006
[77]
논문
Formation and insertion of the nitrogenase iron-molybdenum cofactor
2004
[78]
논문
Iron-molybdenum cofactor synthesis in ''Azotobacter vinelandii'' Nif- mutants
1987
[79]
논문
J. Bacteriol. 136, 267-279
1978
[80]
간행물
Biosynthesis of the iron-molybdenum and iron-vanadium cofactors of the nif- and vnf-encoded nitrogenases
Horizon Scientific Press
2000
[81]
논문
The nifU, nifS and nifV gene products are required for activity of all three nitrogenases of ''Azotobacter vinelandii''
1992
[82]
논문
Science 194,424-426
1976
[83]
논문
Curr. Top. Cell. Regul. 30,23-56
1989
[84]
서적
The Fundamentals of Nitrogen Fixation
Cambridge University Press
1982
[85]
논문
N2 fixation by non-heterocystous cyanobacteria
1997
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com