치환 반응
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
치환 반응은 분자 내 원자 또는 작용기가 다른 원자 또는 작용기로 대체되는 화학 반응의 한 종류이다. 치환 반응은 반응 메커니즘에 따라 친핵성 치환 반응(SN1, SN2), 친전자성 치환 반응(SEAr), 자유 라디칼 치환 반응(F.R.S.), 친핵성 아실 치환 반응(N.A.S.) 등으로 분류된다. 친핵성 치환 반응은 친핵체가 이탈기를 대체하는 반응으로, SN1과 SN2 두 가지 메커니즘으로 진행된다. 친전자성 치환 반응은 벤젠 고리에서 일어나는 반응이며, 자유 라디칼 치환 반응은 알케인에서, 친핵성 아실 치환 반응은 카복실산 등에서 일어난다. 또한, 유기 금속 치환 반응과 무기 및 유기 금속 화학에서의 치환 반응도 존재한다. 치환 화합물은 수소 원자가 다른 원자나 작용기로 대체된 화합물을 의미한다.
더 읽어볼만한 페이지
- 치환 반응 - 탈카복실화
탈카복실화는 유기화학 및 생화학에서 카복실산으로부터 이산화 탄소가 제거되는 반응으로, 유기화학에서는 수소 원자로 치환되며, 생화학에서는 아민 생합성 등 다양한 생체 반응에 관여한다. - 치환 반응 - 친전자성 방향족 치환
친전자성 방향족 치환은 방향족 고리의 수소 원자가 친전자체로 치환되는 유기 반응으로, 아레니움 이온 중간체를 거쳐 진행되며, 벤젠 고리의 치환기는 반응 속도와 치환 위치에 영향을 미쳐 다양한 화학 제품 생산에 활용된다. - 유기 반응 - 열분해
열분해는 고온에서 물질을 분해하는 과정으로, 다양한 산업과 에너지 분야에 활용되지만 안전 및 환경 문제도 고려해야 하며, 관련 분석 및 연구가 활발히 진행되고 있다. - 유기 반응 - 메틸화
메틸화는 메틸기를 분자에 첨가하는 과정으로, 생물학에서 유전자 발현 조절 등 생명현상에 관여하고 유기화학에서 유기 합성에 활용되며, 다양한 생물종에 존재하는 중요한 생리적 과정이다. - 화학 반응 - 촉매
촉매는 화학 반응에서 자신은 소모되지 않으면서 반응 속도를 변화시키는 물질로, 활성화 에너지를 낮추는 새로운 반응 경로를 제공하여 반응 속도를 증가시키며, 균일계, 불균일계, 생체 촉매 등 다양한 종류가 있고 여러 산업 분야에서 활용된다. - 화학 반응 - 축합 반응
축합 반응은 두 작용기가 결합하며 작은 분자를 생성하고 제거되어 새로운 작용기를 형성하는 화학 반응으로, 중축합이나 탈수 축합으로 응용되며 에스터화, 아미드화, 알돌 축합 반응 등이 대표적이다.
| 치환 반응 | |
|---|---|
| 개요 | |
| 정의 | 화합물 내의 작용기가 다른 작용기로 대체되는 화학 반응 |
| 유형 | 친핵성 치환 반응 친전자성 치환 반응 라디칼 치환 반응 |
| 친핵성 치환 반응 | |
| 설명 | 친핵체에 의한 치환 반응 |
| 반응 메커니즘 | SN1 반응 SN2 반응 SNi 반응 |
| 친전자성 치환 반응 | |
| 설명 | 친전자체에 의한 치환 반응 |
| 유형 | 친전자성 방향족 치환 반응 친전자성 지방족 치환 반응 |
| 라디칼 치환 반응 | |
| 설명 | 라디칼에 의한 치환 반응 |
| 예시 | 할로젠화 알케인 |
| 무기화학에서의 치환 반응 | |
| 설명 | 리간드가 다른 리간드로 치환되는 반응 |
| 관련 반응 | 가수분해 중화 반응 불균등화 반응 |
| 기타 정보 | |
| 관련 개념 | 첨가 반응, 제거 반응 |
2. 치환 반응의 종류
치환 반응은 반응 메커니즘과 반응 조건에 따라 다양하게 분류된다.
- 친핵성 치환 반응: 이탈기를 가진 화합물에서 일어난다.
- SN1 반응 (단분자 친핵성 치환 반응): 이탈기가 먼저 떨어져 나가 카보 양이온 중간체를 형성한 후, 친핵체가 결합하는 2단계 반응이다.
- SN2 반응 (이분자 친핵성 치환 반응): 친핵체의 공격과 이탈기의 이탈이 동시에 일어나는 1단계 반응이다.
- 친전자성 방향족 치환 반응: 벤젠 링과 같은 방향족 화합물에서 주로 일어나며, 친전자체가 벤젠 고리를 공격하여 수소 원자를 치환한다.
- 자유 라디컬 치환 반응: 알케인과 같이 반응성이 낮은 화합물에서 주로 일어나며, 라디칼이 반응에 참여한다. 훈스디커 반응이 대표적인 예이다.
- 친핵성 아실 치환 반응: 카복실산, 에스터 및 그 유사체에서 일어나는 반응으로, 친핵체가 아실기를 공격하여 치환 반응이 일어난다.
이 외에도 유기금속 화합물을 이용한 커플링 반응과 같이 금속 촉매 하에 진행되는 치환 반응도 존재한다.[3] 배위 착물에서의 리간드 치환 반응은 연관 치환과 해리 치환으로 나뉜다.
2. 1. 친핵성 치환 반응 (Nucleophilic Substitution)
유기 화학(및 무기 화학)에서 친핵성 치환 반응은 친핵체가 원자 또는 원자단의 양전하 또는 부분적인 양전하와 결합하거나 공격하는 기본적인 반응 종류이다. 친핵체는 약한 친핵체를 대체하며, 약한 친핵체는 이탈기가 된다. 남은 양전하 또는 부분적인 양전하를 띠는 원자는 전자체가 된다. 친전자체와 이탈기가 속한 전체 분자는 일반적으로 반응물이라고 한다.[1]반응의 가장 일반적인 형태는 다음과 같다.
:
여기서 R-LG는 반응물을 나타낸다. 친핵체(Nuc:)의 전자쌍 (''':''')이 반응물을 공격하여 새로운 공유 결합 R-Nuc를 형성한다. 이탈기(LG)는 전자쌍을 가지고 떨어져 나가면서 이전의 전하 상태가 회복된다. 이 경우 주요 생성물은 R-Nuc이다. 이러한 반응에서 친핵체는 일반적으로 전기적으로 중성이거나 음전하를 띠는 반면, 반응물은 일반적으로 중성이거나 양전하를 띤다.
친핵성 치환 반응의 한 예는 염기성 조건에서 알킬 브로마이드(R-Br)의 가수분해이며, 여기서 ''공격''하는 친핵체는 염기 (OH-)이고 이탈기는 Br-이다.
:
친핵성 치환 반응은 유기 화학에서 흔히 발생하며, 포화된 지방족 화합물 탄소 또는 (덜 흔하게) 방향족 또는 기타 불포화 탄소 중심에서 일어나는 반응으로 광범위하게 분류될 수 있다.[1]
친핵성 치환 반응은 SN1 반응과 SN2 반응 두 가지 메커니즘으로 진행될 수 있다. 두 반응은 속도 법칙에 따라 이름이 붙여졌으며, SN1은 1차 속도 법칙을, SN2는 2차 속도 법칙을 갖는다.[2] SN1 반응은 이탈기가 떨어져 나가 카보 양이온이 형성되고, 친핵성 시약이 카보 양이온에 부착되어 공유 결합을 형성하는 2단계로 진행된다. 반면 SN2 반응은 시약의 공격과 이탈기의 방출이 동시에 일어나는 한 단계로 진행된다.
다른 유형의 친핵성 치환에는 친핵성 아실 치환 및 친핵성 방향족 치환이 있다. 방향족 치환은 고리에서 연결된 이중 결합 시스템을 가진 화합물에서 발생한다. 자세한 내용은 방향족 화합물을 참조하라.
2. 1. 1. SN1 반응
친핵성 치환 반응의 메커니즘 중 하나인 단분자 친핵성 치환 반응(SN1)은 2단계로 진행된다.[2]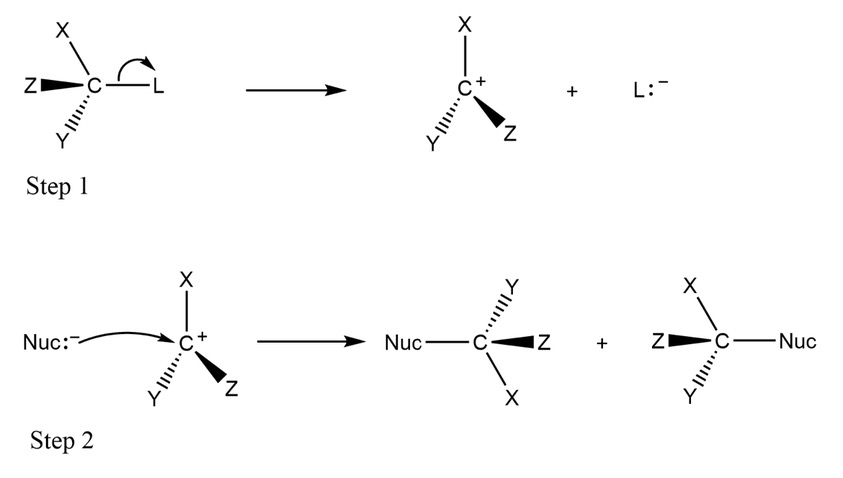
첫 번째 단계에서는 이탈기가 떨어져 나가 카보 양이온(C+)을 형성한다. 두 번째 단계에서 친핵성 시약(Nuc:)이 카보 양이온에 부착되어 공유 시그마 결합을 형성한다. 기질이 키랄 탄소를 가지고 있다면, 이 메커니즘은 입체화학의 반전 또는 유지를 유발할 수 있다. 일반적으로 두 가지 모두 선호도 없이 발생하며, 그 결과는 라세미화이다.[2]
카보 양이온(C+)의 안정성은 다른 몇 개의 탄소 원자가 결합되어 있는지에 달려 있다. 그 결과 SN1 반응은 일반적으로 적어도 두 개의 탄소가 결합된 원자에서 발생한다.[2]
2. 1. 2. SN2 반응
친핵성 치환 반응의 한 종류인 SN2 반응(Bimolecular nucleophilic substitution)은 이탈기를 가진 화합물에서 일어난다.[1] SN2 반응은 속도 법칙에 따라 2차 속도 법칙을 따른다.[2]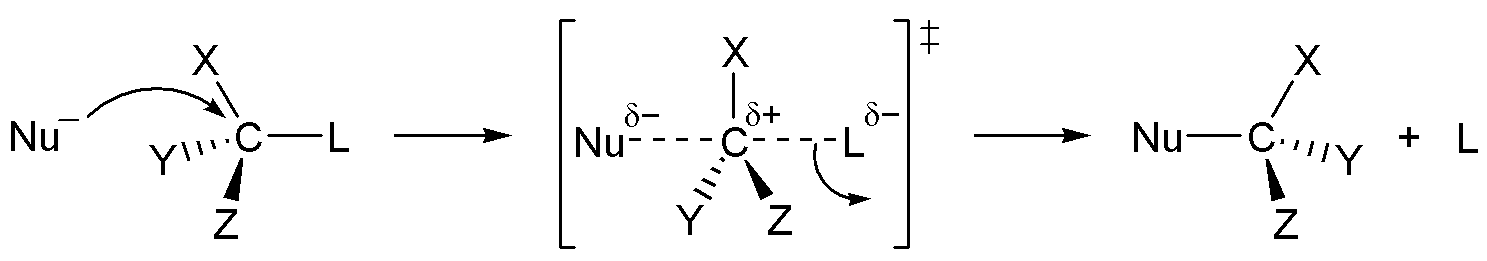
SN2 메커니즘은 한 단계로 진행된다. 시약의 공격과 이탈기의 방출이 동시에 일어난다. 이 메커니즘은 항상 배치의 반전을 유발한다. 친핵성 공격을 받는 기질이 키랄인 경우, 반응은 그 입체 화학의 반전으로 이어지며, 이를 왈덴 반전이라고 한다.
SN2 공격은 공격의 뒷면 경로가 기질의 치환체에 의해 입체 장애를 받지 않는 경우에 발생할 수 있다. 따라서 이 메커니즘은 일반적으로 방해받지 않는 1차 탄소 중심에서 발생한다. 이탈기 근처의 기질에 입체적 혼잡이 있는 경우, 예를 들어 3차 탄소 중심에서 치환 반응은 SN2 대신 SN1 반응을 포함한다.[2]
2. 1. 3. 친핵성 아실 치환 반응
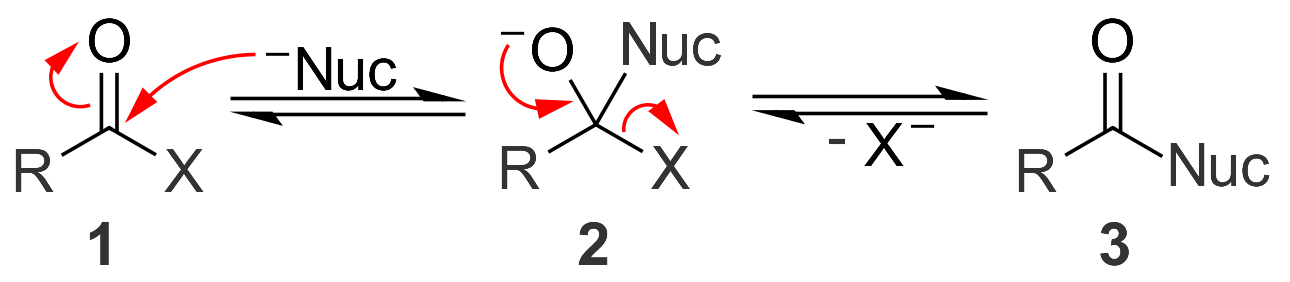
친핵성 아실 치환은 친핵체가 아실기를 공격할 때 발생한다. 친핵체는 탄소를 공격하여 이중 결합을 단일 결합으로 끊는다. 그러면 이중 결합이 다시 형성되어 이탈기를 방출한다. 아실 치환은 친핵체가 하나의 산소와 이중 결합하고 다른 산소(N 또는 S 또는 할로겐)와 단일 결합한 탄소에서 발생한다.[1]
2. 2. 친전자성 치환 반응 (Electrophilic Substitution)
친전자체는 친전자성 치환 반응에 관여한다. 특히 친전자성 방향족 치환 반응에서 두드러진다.[1]벤젠 링의 전자 공명 구조는 친전자체 E+에 의해 공격받는다. 공명 결합이 끊어지고 카보 양이온 공명 구조가 생성된다. 마지막으로 양성자가 방출되고 새로운 방향족 화합물이 형성된다.[1]
 |
| 1: 자유 벤젠 + 친전자체; 2a: 벤젠이 친전자체를 공격; |
|---|
아렌과 같은 다른 불포화 화합물에 대한 친전자성 반응은 친전자성 부가 반응을 일으킨다.[1]
2. 2. 1. 친전자성 방향족 치환 반응 (SEAr)
친전자체는 특히 친전자성 방향족 치환 반응에 관여한다.벤젠 링의 전자 공명 구조는 친전자체 E+에 의해 공격받는다. 공명 결합이 끊어지고 카보 양이온 공명 구조가 생성된다. 마지막으로 양성자가 방출되고 새로운 방향족 화합물이 형성된다.
| 1: 자유 벤젠 + 친전자체 |
|---|
| 2a: 벤젠이 친전자체를 공격 |
| 2b: 벤젠-친전자체 중간체의 공명 |
| 3: 치환된 반응 생성물 |
아렌과 같은 다른 불포화 화합물에 대한 친전자성 반응은 일반적으로 치환 반응이 아닌 친전자성 부가 반응을 일으킨다.
2. 3. 자유 라디칼 치환 반응 (Free Radical Substitution)
자유 라디칼 치환 반응(F.R.S., Free radical substitution)은 알케인에서 일어나는 반응이다. 라디칼을 포함하는 반응이며, 훈스디커 반응이 그 예시이다.[1]2. 4. 유기 금속 치환 반응
커플링 반응은 금속 촉매 반응의 한 종류로, 유기금속 화합물 RM과 유기 할라이드 R′X가 반응하여 새로운 탄소-탄소 결합을 형성하며 R-R′ 유형의 화합물을 생성하는 반응을 포함한다. 예시로는 Heck 반응, Ullmann 반응, Wurtz-Fittig 반응 등이 있다.[3]2. 5. 무기 및 유기 금속 화학에서의 치환 반응
치환 반응은 유기 화학에서 주로 논의되지만, 일반적이며 광범위한 화합물에 적용된다. 배위 착물의 리간드는 치환되기 쉬우며, 연관 치환과 해리 치환 메커니즘이 모두 관찰된다.2. 5. 1. 배위 화합물의 리간드 치환 반응
연관 치환은 유기금속화학과 배위 착물에서 주로 나타나며, SN2 반응과 유사하다. 반대로 해리 치환은 SN1 반응과 유사하다.연관 메커니즘은 16전자 정사각형 평면 분자 구조 금속 착물, 예를 들어 바스카 착물과 테트라클로로백금산 칼륨 등에서 흔히 발견된다. 이 반응의 속도식은 Eigen–Wilkins 메커니즘에 의해 결정된다.
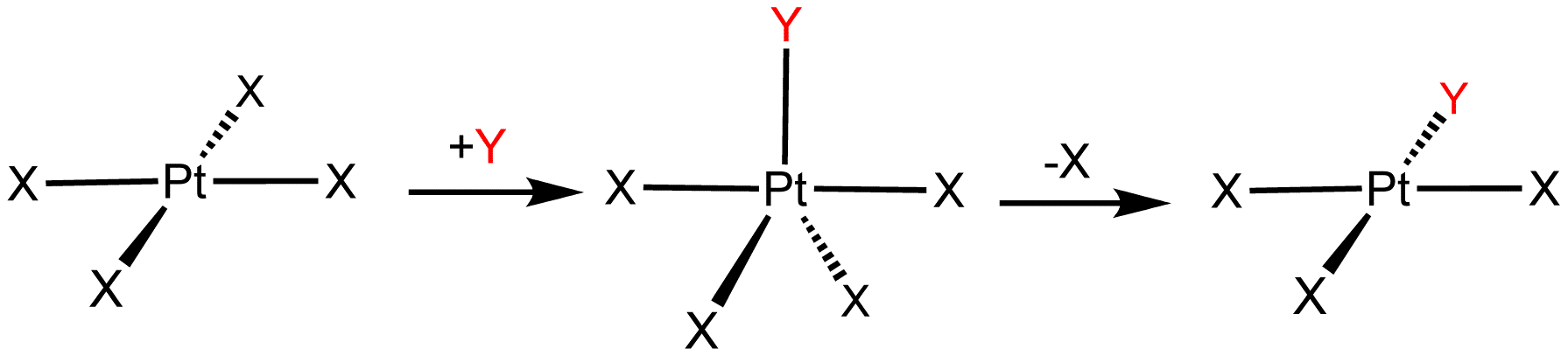
해리 치환은 유기 화학의 SN1 반응과 유사하며, 시스 효과 (''시스'' 위치에 있는 CO 리간드의 활성화)로 설명할 수 있다. 해리 치환을 겪는 착물은 배위 불포화 상태이며, 팔면체 분자 구조를 갖는 경우가 많다. 활성화 엔트로피는 대개 양수 값을 가지는데, 이는 속도 결정 단계에서 반응계의 무질서도가 증가함을 의미한다. 해리 경로는 금속의 배위권에서 리간드가 방출되는 속도 결정 단계를 거친다. 치환하는 친핵체의 농도는 반응 속도에 영향을 주지 않으며, 배위수가 감소된 중간체가 생성될 수 있다. 반응은 k1, k−1, k2 (각 중간 반응 단계의 속도 상수)로 나타낼 수 있다.
:
일반적으로 속도 결정 단계는 착물에서 L이 떨어져 나가는 과정이며, L'은 반응 속도에 영향을 미치지 않는다. 따라서 속도 방정식은 다음과 같이 간단하게 표현된다.
:
2. 5. 2. 연관 치환 (Associative Substitution)
연관 치환은 유기금속화학과 배위 착물에 적용되는 개념으로, SN2 반응과 유사하다.연관 메커니즘은 16전자 정사각형 평면 분자 구조 금속 착물, 예를 들어 바스카 착물과 테트라클로로백금산 칼륨 등의 화학 반응에서 흔히 발견된다. 이 반응의 속도식은 Eigen–Wilkins 메커니즘에 의해 결정된다.
2. 5. 3. 해리 치환 (Dissociative Substitution)
해리 치환은 유기 화학의 SN1 반응과 유사하다. 이 경로는 시스 효과 또는 ''시스'' 위치에서 CO 리간드의 활성화에 의해 잘 설명될 수 있다. 해리 치환을 겪는 착물은 종종 배위 불포화이며, 종종 팔면체 분자 구조를 갖는다. 활성화 엔트로피는 이러한 반응에 대해 특징적으로 양수인데, 이는 속도 결정 단계에서 반응 시스템의 무질서가 증가한다는 것을 나타낸다. 해리 경로는 치환을 겪는 금속의 배위권에서 리간드의 방출을 포함하는 속도 결정 단계로 특징지어진다. 치환하는 친핵체의 농도는 이 속도에 영향을 미치지 않으며, 감소된 배위수를 갖는 중간체가 감지될 수 있다. 반응은 k1, k−1 및 k2로 설명될 수 있으며, 이는 해당 중간 반응 단계의 속도 상수이다.:
일반적으로 속도 결정 단계는 착물에서 L의 해리이며, [L']은 반응 속도에 영향을 미치지 않으므로, 간단한 속도 방정식이 나온다.
:
3. 치환 화합물
'''치환 화합물'''은 하나 이상의 수소 원자가 알킬기, 하이드록시기, 또는 할로젠과 같은 다른 원자나 작용기로 대체된 화합물이다. 더 자세한 내용은 치환 화합물 페이지에서 확인할 수 있다.
참조
[1]
문서
REDIRECT
[2]
서적
Organic Chemistry
Pearson Education Inc.
[3]
서적
Organometallics: A Concise Introduction
Wiley-VCH
[4]
서적
Mechanisms of Inorganic Reactions
John Wiley and Son
[5]
서적
Kinetics and Mechanism of Reactions of Transition Metal Complexes
https://archive.org/[...]
VCH
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com