중추관용
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
중추관용은 면역 세포가 자기 항원을 외부 항원으로 오인하지 않도록 하여 자가면역 반응을 예방하는 데 필수적인 과정이다. 림프구 수용체의 무작위적인 생성 과정에서 자기 항원에 반응하는 수용체가 생성될 수 있는데, 중추관용은 이러한 자기 반응성 림프구를 제거하거나 불활성화하여 자가면역 질환을 막는다. 중추관용은 B 세포는 골수에서, T 세포는 흉선에서 획득하며, B 세포는 세포자멸사, 수용체 편집, 무반응 유도를 통해, T 세포는 양성 선택과 음성 선택 과정을 거쳐 자기 반응성을 제거한다. 중추관용의 유전적 결함은 자가면역 질환을 유발할 수 있으며, 1945년 레이 오웬의 연구를 시작으로 버넷과 메더워가 면역 관용 기전을 밝혀 1960년 노벨 생리의학상을 수상했다.
더 읽어볼만한 페이지
- 면역계 - 알레르기
알레르기는 면역 체계가 무해한 물질에 과도하게 반응하여 아토피 피부염, 비염, 천식, 두드러기 등 다양한 증상을 일으키는 질환으로, Gell과 Coombs 분류법에 따라 여러 유형으로 나뉘며, 심각한 경우 아나필락시스를 유발할 수 있고, 유전적, 환경적 요인이 복합적으로 작용하여 발생하며, 알레르겐 회피, 약물, 면역요법 등으로 치료한다. - 면역계 - 면역억제
면역억제는 면역계의 활동을 감소시키는 현상으로, 의도적으로는 장기 이식 거부 반응 방지나 자가면역 질환 치료를 위해 면역억제제를 사용하고, 비의도적으로는 질병으로 인해 발생하며 면역결핍질환을 유발할 수 있다. - 면역학 - 체취
체취는 인간의 피부상재균이 분비물을 대사하여 발생하는 냄새로, 유전자, 건강 상태 등에 따라 달라지며, 데오드란트 등으로 관리하거나 심한 경우 의학적 치료가 필요하다. - 면역학 - 면역계
면역계는 물리적 장벽, 선천 면역, 후천 면역으로 구성되어 감염으로부터 생물체를 보호하는 다층적인 방어 시스템이며, 기능 이상 시 자가면역 질환, 과민 반응, 면역 결핍 등 다양한 질병을 유발할 수 있다.
2. 중추관용의 기능
중추관용은 성숙한 B 세포와 T 세포가 자기 항원을 외부 항원으로 오인하지 않도록 하여 면역 세포가 정상적으로 기능하는 데 필수적이다.[39][2][28] 림프구 수용체(T세포 수용체(TCR), B세포 수용체(BCR))는 무작위적인 체세포 재배열(V(D)J 재조합)을 통해 다양성을 확보하는데,[38][1][27] 이 과정에서 자기 항원에 반응하는 수용체가 생성될 수 있다.[39][2] 접합 다양성은 재조합 과정에서 BCR과 TCR의 다양성을 더욱 증가시킨다.[38][1]
관용의 최종 결과는 자가 항원에 반응하지 않지만 무작위로 배열된 수용체에 따라 외래의 비자기 항원을 인식할 수 있는 림프구 집단이다.[39] 림프구는 골수(B세포의 경우)와 흉선(T세포의 경우)에 존재하는 항원에 대해서만 관용을 획득할 수 있다.
무작위적인 TCR, BCR 생성은 높은 돌연변이율 덕분에 미생물에 대한 중요한 방어 수단이 된다.[38][27] 또한, 다양한 수용체를 가진 개체가 많을수록 새로운 항원에 대처할 가능성이 높아지므로 종의 생존에 매우 중요하다.[38][1][27]
하지만 체세포 재조합은 자기 반응성을 유발할 수 있다. 예를 들어 체세포 재조합에 필요한 효소인 RAG1/2가 결핍되면 환자의 혈액 세포에 대해 항체가 생성되는 면역 혈구감소증이 발병할 수 있다.[41][4][30] 중추관용은 이러한 자기 반응성 림프구를 제거하거나 억제(불활성화)하여 자가면역 반응을 예방한다.[39][28] 만약 중추관용이 없다면 면역계가 자기 자신을 공격하게 되어 자가면역 질환을 유발할 수 있다.[39][40][3][28][29]
3. 중추관용의 기전
중추 관용의 결과는 자가 항원에 대한 면역 반응을 일으키지 않는 림프구 집단이다. 이러한 세포는 TCR 또는 BCR 특이성을 사용하여 외래 항원을 인식하여 해당 항원에 대한 면역 반응에서 특정한 역할을 수행한다.[2][6]
이러한 방식으로 중추 관용의 메커니즘은 숙주를 위험에 빠뜨릴 수 있는 방식으로 자가 항원을 인식하는 림프구가 말초로 방출되지 않도록 보장한다.
관용 기전에도 불구하고 T 세포는 어느 정도 자가 반응성을 가지고 있다는 점에 주목해야 한다. 일반적인 T 세포의 TCR은 주요 조직 적합성 복합체(MHC) 분자(CD8+ T 세포의 경우 MHC 클래스 I 또는 CD4+ T 세포의 경우 MHC 클래스 II)의 일부를 인식하여 항원 제시 세포와 적절한 상호 작용을 생성할 수 있어야 한다. 또한, 조절 T 세포(Treg 세포)의 TCR은 자가 항원에 직접적으로 반응하며 (자가 반응성은 그다지 강하지 않지만) 이러한 자가 반응성을 사용하여 면역계가 활성화되지 않아야 할 때 면역 반응을 억제하여 면역 반응을 조절한다.[6][7][21] 중요한 점은 림프구는 골수(B 세포의 경우)와 흉선(T 세포의 경우)에 존재하는 항원에 대해서만 관용을 발달시킬 수 있다는 것이다.[8]
관용의 최종 결과는 자기 항원에 반응하지 않지만, 무작위로 배치된 수용체를 기반으로 외부의 비자기 항원을 인식할 수 있는 림프구 집단의 형성이다[28]。 중요한 것은 림프구는 골수(B 세포)와 흉선(T 세포)에 존재하는 항원에 대해서만 관용을 획득할 수 있다는 것이다.
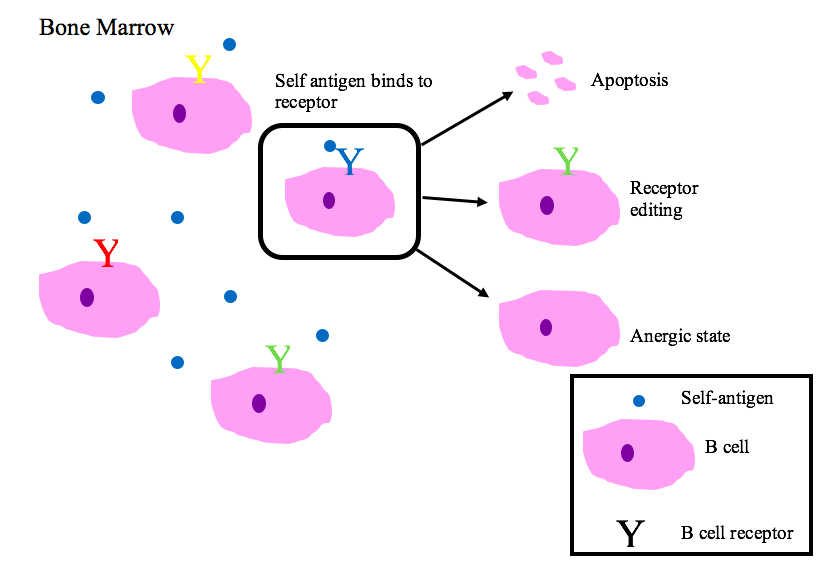
3. 1. B 세포 관용
골수에서 미성숙 B 세포는 자기 항원에 결합하면 음성 선택을 받는다.[39][2][28] 제대로 기능하는 B 세포 수용체(BCR)는 비자기 항원 또는 병원체 연관 분자 패턴(PAMP)을 인식한다.[38][1][27]
자가 반응성 BCR의 주요 결과는 다음과 같다.[38][39][1][2][27][28]
# 세포자멸사(클론 결실)
# 수용체 편집: 자가 반응성 B 세포는 유전자를 재배열하여 특이성을 변화시키고 자가 반응하지 않는 새로운 BCR을 발달시킨다. 이 과정은 B 세포가 세포사멸 신호를 받거나 무반응 상태가 되기 전에 BCR을 다시 편집할 기회를 준다.
# 무반응 유도(항원에 대한 반응이 일어나지 않는 상태)
3. 2. T 세포 관용
T세포 중추관용은 가슴샘에서 발생한다.[38] T세포는 양성 선택과 음성 선택을 거친다.[39] T세포 수용체는 결합된 비자기 펩타이드와 함께 자기 주조직 적합성 복합체(MHC) 분자를 인식하는 능력이 있어야 한다.[38]
T 세포 전구 세포(흉선 세포라고도 함)는 골수에서 생성된 후 흉선으로 이동하여 발달을 계속한다.[1][9] 이 발달 과정에서 흉선 세포는 V(D)J 재조합을 수행하며, 발달 중인 일부 T 세포 클론은 완전히 기능하지 않는(펩타이드-MHC 복합체에 결합할 수 없는) TCR을 생성하고, 일부는 자기 반응성을 띠어 자가 면역을 촉진할 수 있는 TCR을 생성한다.[10][2]
먼저, "'''양성 선택'''" 과정에서 흉선 세포의 TCR이 제대로 작동하는지 테스트하고, 기능하지 않는 TCR을 가진 흉선 세포는 세포자멸사에 의해 제거된다.[6][7] 이 메커니즘은 흉선에서 항원 제시 세포의 펩타이드-MHC 복합체와 TCR이 '''상호 작용하는''' 흉선 세포만 생존하도록 선택하기 때문에 이러한 이름이 붙었다. 펩타이드-MHC 복합체에 결합하는 T세포의 친화력이 확인되며, MHC 클래스 I 또는 MHC 클래스 II 복합체에 결합할 수 없으면 생존 신호를 받지 못하므로 세포 사멸을 통해 T세포가 죽게 된다. 펩타이드-MHC 복합체에 대해 충분한 친화성을 갖는 T세포 수용체가 생존을 위해 선택된다. T세포가 MHC I이나 II에 결합하는지 여부에 따라 각각 CD8+ 또는 CD4+ T세포로 분화한다. 양성 선택은 표면 MHC I와 MHC II 분자를 발현하고 있는 가슴샘 상피 세포의 도움으로 가슴샘 겉질에서 발생한다.[39]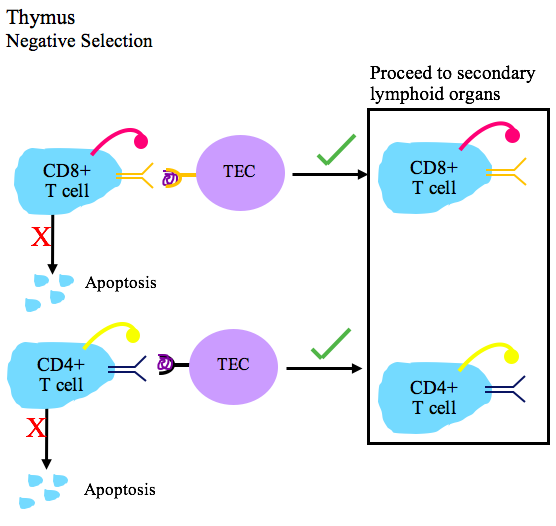
양성 선택의 후기 단계에서 "'''MHC 제한성'''"(또는 계통 결정)이라는 또 다른 과정이 일어난다.
그 후, 양성 선택된 흉선 세포는 "'''음성 선택'''"을 거쳐 흉선 세포의 자기 반응성을 테스트한다. 자기 반응성이 강한 세포(따라서 숙주 세포를 공격할 가능성이 높은 세포)는 세포자멸사에 의해 제거된다. 음성 선택 동안에는 T세포의 자가 반응성(자기 조직에 대한 친화성)이 테스트된다. T세포가 펩타이드에 결합하면 세포자멸사(클론 결실 과정) 신호를 받는다. 가슴샘 상피 세포는 T세포에 대한 자가 항원을 발현하여 자가 친화도를 테스트한다. 전사 조절자 AIRE는 가슴샘 상피 세포에서 자가 조직 항원의 발현에 중요한 역할을 한다. 음성 선택은 겉질-속질 접합부와 가슴샘 속질에서 발생한다.[39] 자가 결합하지 않지만 항원/MHC 복합체를 인식하고 CD4+ 또는 CD8+인 T세포는 성숙한 미접촉 T세포로서 이차 림프 기관으로 이동한다.
조절 T세포는 가슴샘에서 성숙하는 또 다른 유형의 T세포이다. 조절 T세포의 선택은 가슴샘 속질에서 발생하며 FOXP3의 전사를 동반한다. 조절 T세포는 활성화되지 않아야 할 때 면역계를 억제하여 자가 면역을 조절하는 데 중요하다.[42]
4. 중추관용의 결함으로 인한 유전 질환
중추관용의 유전적 결함은 자가면역질환을 유발할 수 있다. 자가면역 다발성 내분비병증 증후군 제1형은 AIRE 유전자의 돌연변이로 인해 발생한다. 이로 인해 흉선에서 말초 항원의 발현이 부족해져 인슐린과 같은 주요 말초 단백질에 대한 음성 선택이 결핍되어, 여러 자가 면역 증상이 나타난다.[43][44][22][23][33][34]
5. 중추관용의 역사
1945년, 레이 오웬(Ray Owen)은 이란성 쌍둥이 소에서 한쪽 소에게 다른 소의 혈액을 주입하여도 항체가 생성되지 않는 현상을 발견했다.[45][24][35] 오웬의 발견은 이후 하세크(Hasek)와 빌링햄(Billingham)의 실험을 통해 확인되었다.[45][24][35] 이 결과는 버넷의 클론 선택설로 설명되었다.[46][25][36] 버넷과 메더워는 면역 관용 기전을 설명한 공로로 1960년 노벨 생리학·의학상을 수상했다.[46][47][25][26][36][37]
6. 한국에서의 자가면역질환
참조
[1]
서적
Kuby immunology
W.H. Freeman
2013
[2]
논문
Immunological tolerance and autoimmunity
2006
[3]
서적
Immunobiology 5: The Immune System in Health and Disease
https://archive.org/[...]
Garland
2001
[4]
논문
Autoimmunity due to RAG deficiency and estimated disease incidence in RAG1/2 mutations
2014-03
[5]
서적
Immunobiology 5: The Immune System in Health and Disease
Garland Science
2001
[6]
논문
Central CD4+ T cell tolerance: deletion versus regulatory T cell differentiation
https://epub.ub.uni-[...]
2019-01
[7]
논문
A unified theory of central tolerance in the thymus
2006-05
[8]
논문
Tolerance is established in polyclonal CD4(+) T cells by distinct mechanisms, according to self-peptide expression patterns
2016-02
[9]
논문
Formation of the Intrathymic Dendritic Cell Pool Requires CCL21-Mediated Recruitment of CCR7+ Progenitors to the Thymus
2018-07
[10]
논문
Negative selection--clearing out the bad apples from the T-cell repertoire
2003-05
[11]
논문
Regulatory T cells prevent catastrophic autoimmunity throughout the lifespan of mice
2007-02
[12]
논문
The thymus and central tolerance
2001-05
[13]
논문
Signal integration and crosstalk during thymocyte migration and emigration
2011
[14]
논문
The long road to the thymus: the generation, mobilization, and circulation of T-cell progenitors in mouse and man
http://link.springer[...]
2008
[15]
논문
CCR7 and CCR9 together recruit hematopoietic progenitors to the adult thymus
https://ashpublicati[...]
2010-03-11
[16]
논문
Hematopoietic progenitor migration to the adult thymus
2011
[17]
논문
An Overview of the Intrathymic Intricacies of T Cell Development
https://journals.aai[...]
2014-05-01
[18]
논문
Single-cell insights into the hematopoietic generation of T-lymphocyte precursors in mouse and human
2021
[19]
논문
Regulation of γδ T Cell Effector Diversification in the Thymus
2020
[20]
논문
Determining γδ versus αß T cell development
https://pubmed.ncbi.[...]
2010
[21]
논문
Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells
2006-05
[22]
논문
Projection of an immunological self shadow within the thymus by the aire protein
2002-11
[23]
논문
Aire regulates negative selection of organ-specific T cells
2003-04
[24]
논문
Historical overview of immunological tolerance
2012-04
[25]
논문
Immunological tolerance 50 years after the Burnet Nobel Prize
2011-01
[26]
논문
The curious case of the 1960 Nobel Prize to Burnet and Medawar
2016-03
[27]
서적
Kuby immunology
W.H. Freeman
2013
[28]
논문
Immunological tolerance and autoimmunity
2006
[29]
서적
Immunobiology 5: The Immune System in Health and Disease
https://archive.org/[...]
Garland
2011
[30]
논문
Autoimmunity due to RAG deficiency and estimated disease incidence in RAG1/2 mutations
2014-03
[31]
논문
The thymus and central tolerance
2001-05
[32]
논문
Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells
2006-05
[33]
논문
Projection of an immunological self shadow within the thymus by the aire protein
2002-11
[34]
논문
Aire regulates negative selection of organ-specific T cells
2003-04
[35]
논문
Historical overview of immunological tolerance
2012-04
[36]
논문
Immunological tolerance 50 years after the Burnet Nobel Prize
2011-01
[37]
논문
The curious case of the 1960 Nobel Prize to Burnet and Medawar
2016-03
[38]
서적
Kuby immunology
https://archive.org/[...]
W.H. Freeman
2013
[39]
저널
Immunological tolerance and autoimmunity
2006
[40]
서적
Immunobiology 5: The Immune System in Health and Disease
https://archive.org/[...]
Garland
2011
[41]
저널
Autoimmunity due to RAG deficiency and estimated disease incidence in RAG1/2 mutations
2014-03
[42]
저널
Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells
2006-05
[43]
저널
Projection of an immunological self shadow within the thymus by the aire protein
2002-11
[44]
저널
Aire regulates negative selection of organ-specific T cells
2003-04
[45]
저널
Historical overview of immunological tolerance
2012-04
[46]
저널
Immunological tolerance 50 years after the Burnet Nobel Prize
2011-01
[47]
저널
The curious case of the 1960 Nobel Prize to Burnet and Medawar
2016-03
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
