탄산 구리(II)
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
탄산 구리(II)는 화학식 CuCO3를 갖는 구리의 탄산염이다. 건조한 조건에서는 안정하지만, 이산화 탄소 분압이 낮아지면 산화 구리(II)와 이산화 탄소로 분해된다. 탄산 구리(II)는 일반적으로 구리(II) 황산염과 탄산 나트륨 용액을 혼합하여 합성하려 하지만, 일반적인 조건에서는 염기성 탄산염이 생성된다. 탄산 구리(II)는 특수한 조건, 예를 들어 고압의 이산화 탄소 분위기에서 합성될 수 있으며, 단사정계 구조를 갖는다. 결정 구조에서 구리는 왜곡된 사각뿔 분자 구조의 배위 환경을 가지며, 각 탄산염 이온은 5개의 구리 중심과 결합한다.
더 읽어볼만한 페이지
- 탄산염 - 탄산 마그네슘
탄산 마그네슘은 MgCO₃의 화학식을 가지는 무기 화합물로, 무색 또는 백색의 고체이며, 물과 에탄올에 녹지 않고 산과 반응하여 이산화탄소를 방출하며, 내화 벽돌, 소화제, 화장품 등 다양한 산업 분야에서 사용되는 무독성 물질이다. - 탄산염 - 탄산 칼슘
탄산 칼슘은 무색 결정 또는 백색 분말 형태의 탄산염으로, 산과 반응하여 이산화 탄소를 방출하고 가열 시 분해되며, 자연에서 다양한 결정형으로 발견되어 여러 산업 분야와 농업에 널리 사용된다. - 구리(II) 화합물 - 녹청
녹청은 구리나 구리 합금 표면에 자연적으로 생기는 청록색 막으로, 아세트산구리를 주성분으로 하는 다양한 구리 염 혼합물이며, 안료나 구리 부식 방지 피막으로 사용되고, 과거 독성 오해와 달리 실제 독성은 미미하다. - 구리(II) 화합물 - BSCCO
비스무트계 고온 초전도체(BSCCO)는 비스무트, 스트론튬, 칼슘, 구리, 산소로 구성된 물질로, 다양한 조성비를 가지며 110 K 이상의 높은 임계온도를 나타내는 상을 형성하고, 초전도선 제작에 사용되는 등 여러 분야에서 응용 가능성을 보인다.
2. 합성
구리(II) 황산염()과 탄산 나트륨의 용액을 상온 조건에서 혼합하면 이온이 수산화물 음이온 에 대한 친화력이 크기 때문에 염기성 탄산염과 가 생성된다.[1] 대기압에서 염기성 탄산염의 열분해는 탄산염이 아닌 산화 구리(II)를 생성한다.
1960년, C. W. F. T. Pistorius는 염기성 탄산 구리를 이산화 탄소 (450 atm)와 물(50 atm) 분위기에서 180 °C로 36시간 동안 가열하여 합성을 시도하였다. 생성물의 대부분은 잘 결정화된 공작석 ()2였지만, 능면체 물질의 소량의 수율도 얻었으며, 이는 라고 주장되었다.[5] 그러나 이 합성은 재현되지 않은 것으로 보인다.
1973년 하트무트 에르하르트(Hartmut Ehrhardt) 외에는 500 °C 및 2 GPa (20,000 atm)에서 은 옥살산염 의 분해로 생성된 이산화 탄소 분위기에서 염기성 탄산 구리를 가열하여 회색 분말 형태의 구리(II) 탄산염을 얻었다. 이 화합물은 단사정계 구조를 갖는 것으로 확인되었다.[3]
2. 1. 일반적인 합성 시도
구리(II) 황산염()과 탄산 나트륨의 용액을 상온 조건에서 혼합하면 이온이 수산화물 음이온 에 대한 친화력이 크기 때문에 염기성 탄산염과 가 생성된다.[1] 대기압에서 염기성 탄산염의 열분해는 탄산염이 아닌 산화 구리(II)를 생성한다.1960년, C. W. F. T. Pistorius는 염기성 탄산 구리를 이산화 탄소 (450 atm)와 물(50 atm) 분위기에서 180 °C로 36시간 동안 가열하여 합성을 시도하였다. 생성물의 대부분은 잘 결정화된 공작석 ()2였지만, 능면체 물질의 소량의 수율도 얻었으며, 이는 라고 주장되었다.[5] 그러나 이 합성은 재현되지 않은 것으로 보인다.
1973년 하트무트 에르하르트(Hartmut Ehrhardt) 외에는 500 °C 및 2 GPa (20,000 atm)에서 은 옥살산염 의 분해로 생성된 이산화 탄소 분위기에서 염기성 탄산 구리를 가열하여 회색 분말 형태의 구리(II) 탄산염을 얻었다. 이 화합물은 단사정계 구조를 갖는 것으로 확인되었다.[3]
2. 2. 특수 조건에서의 합성
구리(II) 황산염(CuSO4)과 탄산 나트륨의 용액을 상온 조건에서 혼합하면 Cu2+ 이온이 수산화물 음이온(HO−)에 대한 친화력이 크기 때문에 염기성 탄산염과 CO2가 생성된다.[1] 대기압에서 염기성 탄산염의 열분해는 탄산염이 아닌 산화 구리(II)를 생성한다.1960년, C. W. F. T. Pistorius는 염기성 탄산 구리를 이산화 탄소(450 atm)와 물(50 atm) 분위기에서 180 °C로 36시간 동안 가열하여 탄산 구리(II)를 합성했다고 주장했다. 생성물의 대부분은 잘 결정화된 공작석(Cu2CO3(OH)2)이었지만, 능면체 물질의 소량의 수율도 얻었으며, 이는 CuCO3라고 주장되었다.[5] 그러나 이 합성은 재현되지 않은 것으로 보인다.
1973년 하트무트 에르하르트는 500 °C 및 2 GPa(20,000 atm)에서 은 옥살산염(Ag2C2O4)의 분해로 생성된 이산화 탄소 분위기에서 염기성 탄산 구리를 가열하여 회색 분말 형태의 진정한 구리(II) 탄산염을 얻었다. 이 화합물은 단사정계 구조를 갖는 것으로 확인되었다.[3]
3. 화학적 및 물리적 성질
건조한 탄산 구리(II) (CuCO3영어)의 안정성은 이산화 탄소의 부분 압력(pCO2)에 크게 좌우된다. 건조한 공기 중에서는 수개월 동안 안정하지만, pCO2가 0.11 atm 미만이면 산화 구리(II) (CuO)와 이산화 탄소 (CO2)로 천천히 분해된다.[7]
25 °C의 물 또는 습한 공기 중에서 CuCO3영어는 pCO2가 4.57기압 이상이고 pH가 약 4~8 사이일 때만 안정하다.[8] 그 부분 압력 이하에서는 물과 반응하여 염기성 탄산염(청동광, Cu3(CO3)2(OH)2)을 형성한다.[7]
:3 CuCO3영어 + H2O → Cu3(CO3)2(OH)2 + CO2
고도로 염기성인 용액에서는 복합 음이온 Cu(CO3)22-가 대신 형성된다.[7]
탄산 구리(II)의 용해도곱은 Reiterer 등에 의해 25 °C에서 pKso = 11.45 ± 0.10으로 측정되었다.[7][6]
3. 1. 안정성
건조한 탄산 구리(II)(CuCO3)의 안정성은 이산화 탄소의 부분 압력(pCO2)에 크게 좌우된다. 건조한 공기 중에서는 수개월 동안 안정하지만, pCO2가 0.11 atm 미만이면 산화 구리(II)(CuO)와 이산화 탄소(CO2)로 천천히 분해된다.[7]25 °C의 물 또는 습한 공기 중에서 CuCO3는 pCO2가 4.57기압 이상이고 pH가 약 4~8 사이일 때만 안정하다.[8] 그 부분 압력 이하에서는 물과 반응하여 염기성 탄산염(청동광, Cu3(CO3)2(OH)2)을 형성한다.[7]
:3 CuCO3 + H2O → Cu3(CO3)2(OH)2 + CO2
고도로 염기성인 용액에서는 복합 음이온 Cu(CO3)22-가 대신 형성된다.[7]
탄산 구리(II)의 용해도곱은 25 °C에서 pKso = 11.45 ± 0.10으로 측정되었다.[7][6]
3. 2. 용해도
건조한 탄산 구리(II) (CuCO3)의 안정성은 이산화 탄소의 부분 압력(pCO2)에 크게 좌우된다. 건조한 공기 중에서는 수개월 동안 안정적이지만, pCO2가 0.11 atm 미만이면 산화 구리(II) (CuO)와 이산화 탄소(CO2)로 천천히 분해된다.[7]25 °C의 물 또는 습한 공기 중에서 CuCO3는 pCO2가 4.57기압 이상이고 pH가 약 4~8 사이일 때만 안정하다.[8] 그 부분 압력 이하에서는 물과 반응하여 염기성 탄산염(청동광, Cu3(CO3)2(OH)2)을 형성한다.[7]
:3 CuCO3 + H2O → Cu3(CO3)2(OH)2 + CO2
고도로 염기성인 용액에서는 복합 음이온 Cu(CO3)22-가 대신 형성된다.[7]
탄산 구리(II)의 용해도곱은 Reiterer 등에 의해 25 °C에서 pKso = 11.45 ± 0.10으로 측정되었다.[7][6]
4. 구조
CuCO3의 결정 구조에서 구리는 왜곡된 사각뿔 분자 구조의 배위 환경을 가지며, 배위수는 5이다.[4] 각 탄산염 이온은 5개의 구리 중심과 결합한다.[4]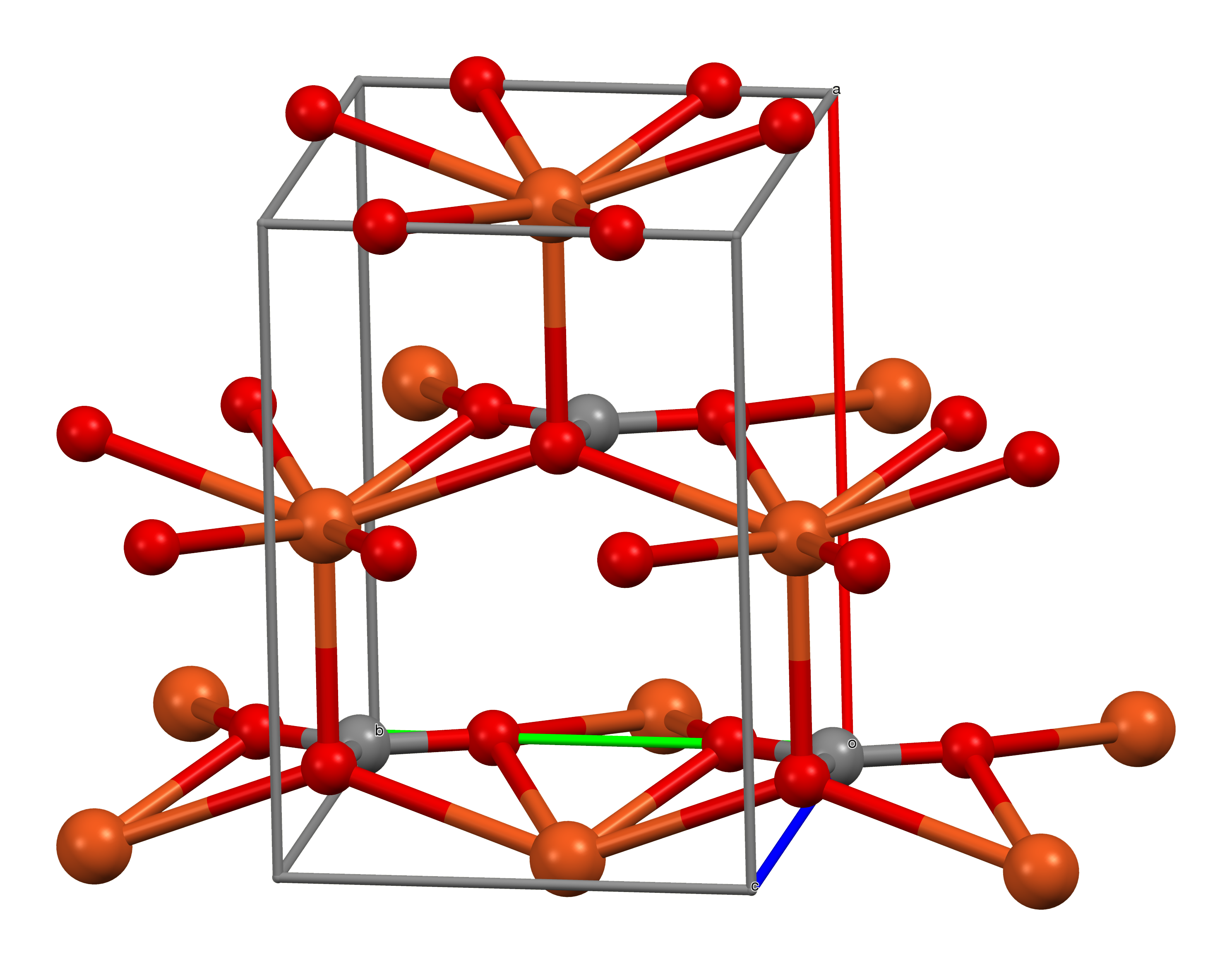


4. 1. 단위 세포
4. 2. 구리의 배위 환경
탄산 구리(II)의 결정 구조에서 구리는 왜곡된 사각뿔 분자 구조의 배위 환경을 가지며, 배위수는 5이다.[4] 각 탄산염 이온은 5개의 구리 중심과 결합한다.[4]
4. 3. 탄산염의 배위 환경
CuCO3의 결정 구조에서 구리는 왜곡된 사각뿔 분자 구조의 배위 환경을 가지며, 배위수는 5이다.[4] 각 탄산염 이온은 5개의 구리 중심과 결합한다.[4]참조
[1]
서적
Principles of Corrosion Engineering and Corrosion Control
Butterworth-Heinemann
2006
[2]
간행물
Solubility Products of M(II) Carbonates
http://www.nagra.ch/[...]
1999
[3]
논문
"Hochdrucksynthese von Kupfer(II)-Carbonat"
1973
[4]
논문
"Darstellung, Struktur und Eigenschaften von Kupfer(II)-Carbonat"
1974
[5]
논문
"Synthesis at High Pressure and Lattice Constants of Normal Cupric Carbonate"
1960
[6]
학위논문
"Löslichkeitskonstanten und Freie Bildungsenthalpien neutraler Übergangsmetallcarbonate"
1980
[7]
논문
"Semimicro Determination of Solubility Constants: Copper(II) Carbonate and Iron(II) Carbonate"
1981
[8]
기타
"Copper Content in Synthetic Copper Carbonate."
1999
[9]
사전
炭酸銅
岩波書店
[10]
학술지
Synthesis at high pressure and lattice constants of normal cupric carbonate
[11]
학술지
Darstellung, Struktur und Eigenschaften von Kupfer(II)-Carbonat
[12]
논문
"Darstellung, Struktur und Eigenschaften von Kupfer(II)-Carbonat"
1974
[13]
간행물
Solubility Products of M(II) Carbonates
http://www.nagra.ch/[...]
1999
[14]
논문
"Semimicro Determination of Solubility Constants: Copper(II) Carbonate and Iron(II) Carbonate"
1981
[15]
학위논문
"Löslichkeitskonstanten und Freie Bildungsenthalpien neutraler Übergangsmetallcarbonate"
1980
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
