트라이오스 인산 이성질화효소
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
트라이오스 인산 이성질화효소(TPI)는 다이하이드록시아세톤 인산과 글리세르알데하이드 3-인산을 상호 전환하는 반응을 촉매하는 효소이다. 이 효소는 해당과정에서 중요한 역할을 하며, 엔올 중간생성물을 통해 반응이 진행된다. Glu165 잔기와 His95 잔기가 촉매 작용에 관여하며, 확산 제한 효소로 작용한다. TPI는 황산염, 인산염, 비산염 이온에 의해 저해되며, 전이상태 유사체와 기질 유사체 또한 저해제로 작용한다. TPI는 αβ-배럴 구조를 가지며, 활성 부위는 배럴 중앙에 위치한다. 이 효소의 루프 구조는 중간생성물을 안정화시키고, 메틸글리옥살 생성을 방지하는 역할을 한다.
더 읽어볼만한 페이지
- EC 5.3.1 - 포도당 6-인산 이성질화효소
포도당 6-인산 이성질화효소는 포도당 6-인산과 과당 6-인산의 가역적 이성질화를 촉매하는 효소로서 해당과정, 포도당신생합성, 오탄당 인산 경로에 관여하며, 세포 내외에서 신경세포 영향, 암 전이 촉진, 그리고 일부 균류에서 만노스 6-인산 이성질화효소 활성을 나타내고, 임상적으로 GPI 결핍은 용혈성 빈혈을 유발하며 혈청 GPI 수치는 암 예후 바이오마커로 활용된다. - EC 5.3.1 - 리보스 5-인산 이성질화효소
리보스 5-인산 이성질화효소는 리보스 5-인산을 리불로스 5-인산으로 전환하는 효소로, RpiA와 RpiB 두 가지 형태로 존재하며, 오탄당 인산 경로와 캘빈 회로에서 DNA와 RNA 합성에 필요한 리보스 5-인산의 항상성 유지, 간세포암종 발생, 말라리아 기생충 생존 및 증식, 그리고 리보스 5-인산 이성질화효소 결핍증과 관련된다. - 해당 - 유비퀴논
유비퀴논(CoQ10)은 미토콘드리아 전자 전달계의 주요 구성 요소인 지용성 유기 화합물로, 세포 호흡과 에너지 생산에 필수적이며 항산화 작용을 통해 세포를 보호하고 면역 반응에도 관여한다. - 해당 - 글루코스
글루코스는 6개의 탄소 원자를 가진 단당류로, D-글루코스 이성질체는 덱스트로스라고도 불리며 생물체의 에너지원, 식물의 광합성 생산물, 그리고 다양한 탄수화물의 구성 성분으로서 중요한 역할을 한다.
2. 반응 메커니즘
삼탄당 인산 이성질화효소(triosephosphate isomerase영어, TPI)의 반응 메커니즘은 "엔올"(엔다이올) 중간생성물 형성을 포함한다.[2] 각 기저 상태와 전이 상태의 상대적인 자유 에너지는 실험적으로 결정되었다.[2]
삼탄당 인산 이성질화효소의 구조는 다이하이드록시아세톤 인산과 글리세르알데하이드 3-인산 사이의 전환을 촉진한다. 삼탄당 인산 이성질화효소의 친핵체 Glu165 잔기는 기질을 탈양성자화시키고,[4][16][28] 친전자체 His95 잔기는 양성자를 공여하여 엔다이올 중간생성물을 형성한다.[5][6][17][18][29][30] 탈양성자화되면 엔다이올 중간생성물은 붕괴되고, 양성자화된 Glu165로부터 양성자를 추출하여 글리세르알데하이드 3-인산 생성물을 형성한다. 역반응의 촉매 작용은 유사하게 진행되어, 동일한 엔다이올을 형성하지만, C2의 산소로부터 엔올의 붕괴가 일어난다.[7][19][31]
삼탄당 인산 이성질화효소는 확산이 제한적인 효소이다. 열역학적인 측면에서 다이하이드록시아세톤 인산의 생성은 글리세르알데하이드 3-인산의 생성보다 20:1로 선호된다.[8][20][32] 그러나 해당과정에서 글리세르알데하이드 3-인산은 후속 단계에의 반응에 의해 계속해서 소모되기 때문에 이러한 소모는 새로운 글리세르알데하이드 3-인산의 생성 반응을 유발한다. 삼탄당 인산 이성질화효소는 효소의 활성 부위에 결합하는 황산염, 인산염 및 비산염 이온에 의해 저해된다.[9][21][33] 다른 저해제로는 전이상태 유사체인 2-포스포글리콜산 및 기질 유사체인 글리세롤- 1-인산이 있다.[10][22][34]
2. 1. 촉매 작용
트라이오스 인산 이성질화효소(TPI)의 촉매 작용은 중간생성물인 엔다이올 형성을 포함한다.[2][14] 효소의 활성 부위에 있는 친핵성 Glu165 잔기는 기질을 탈양성자화시키고,[4][16][28] 친전자성 His95 잔기는 양성자를 공여하여 엔다이올 중간생성물을 형성한다.[5][6][17][18][29][30] 탈양성자화된 엔다이올 중간생성물은 붕괴되며, 양성자화된 Glu165 잔기로부터 양성자를 받아 글리세르알데하이드 3-인산(GAP)을 생성한다.[7][19][31] 역반응도 동일한 엔다이올 중간생성물을 통해 유사하게 진행되지만, C2의 산소로부터 엔올의 붕괴가 일어난다.[7][19][31]
트라이오스 인산 이성질화효소는 확산이 제한적인 효소이다. 열역학적인 측면에서 다이하이드록시아세톤 인산(DHAP)의 생성은 글리세르알데하이드 3-인산(GAP)의 생성보다 20:1로 선호되지만,[8][20][32] 해당과정에서 글리세르알데하이드 3-인산은 후속 단계 반응에 의해 계속해서 소모되기 때문에 이러한 소모는 새로운 글리세르알데하이드 3-인산의 생성 반응을 유발한다. 트라이오스 인산 이성질화효소는 황산염, 인산염 및 비산염 이온에 의해 저해되며, 이들은 효소의 활성 부위에 결합한다.[9][21][33] 다른 저해제로는 전이상태 유사체인 2-포스포글리콜산 및 기질 유사체인 글리세롤- 1-인산이 있다.[10][22][34]
2. 2. 확산 제한 및 저해
트라이오스 인산 이성질화효소(TPI)는 확산 제한 효소이다.[20] 열역학적으로는 다이하이드록시아세톤 인산(DHAP) 형성이 글리세르알데하이드 3-인산(GAP) 형성보다 20배 더 유리하다.[20] 그러나 해당과정에서 대사의 다음 단계로 GAP가 소모되면서 반응이 진행된다. 트라이오스 인산 이성질화효소는 활성 부위에 결합하는 황산, 인산, 비소산 이온에 의해 저해된다.[21] 그 외에 전이 상태 유사체인 2-포스포글리콜산과 기질 유사체인 글리세롤-1-인산도 저해제로 작용한다.[22]3. 구조
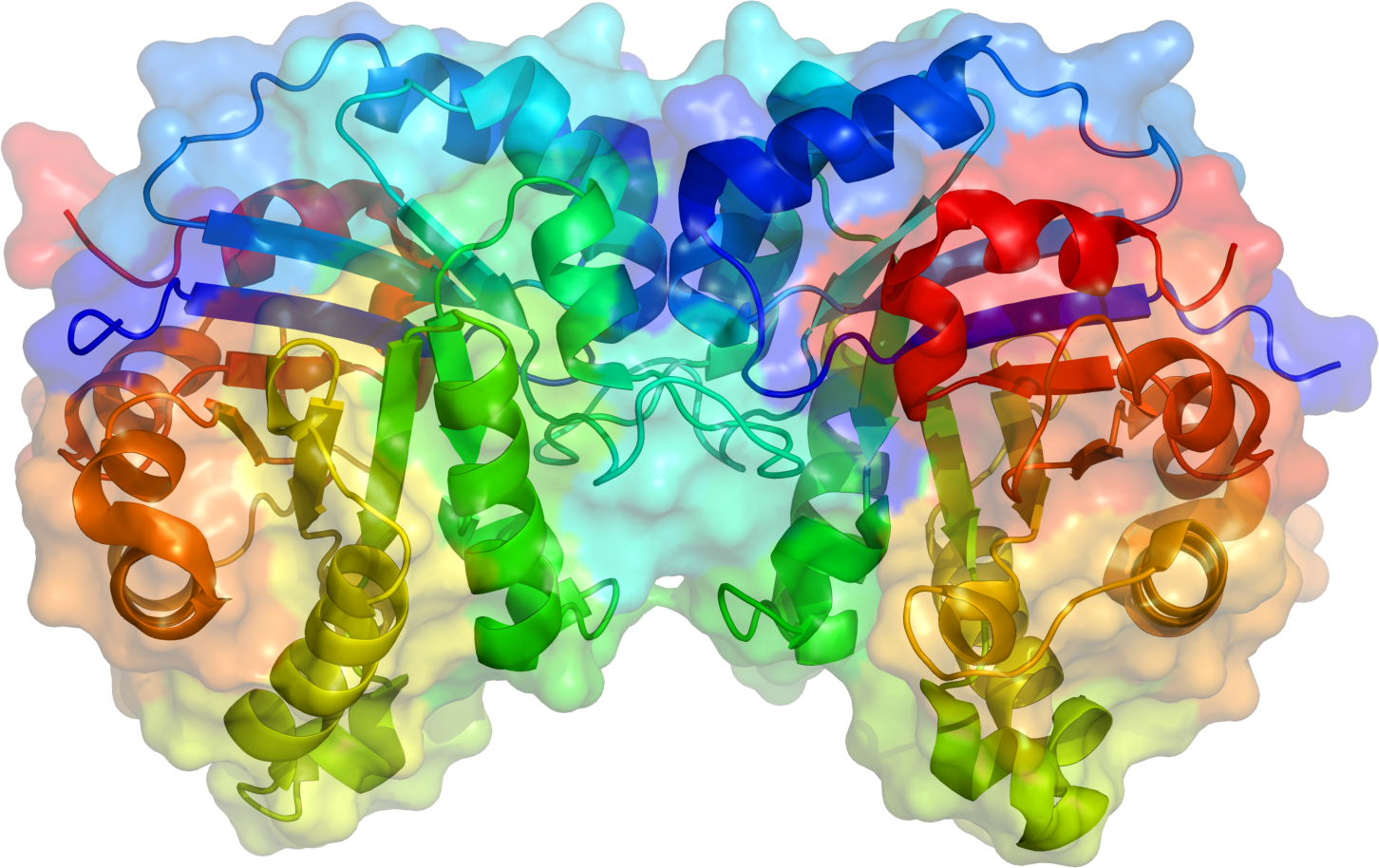
삼탄당 인산 이성질화효소는 동일한 소단위체의 이량체이며, 각각의 소단위체는 약 250개의 아미노산 잔기들로 구성된다. 소단위체의 3차원 구조는 외부에 8개의 α-나선과 β-시트를 포함하고 있다. 이러한 구조적 모티프를 αβ-배럴 또는 TIM 배럴이라고 하며, 가장 일반적으로 관찰되는 단백질 접힘이다. 이 효소의 활성 부위는 배럴의 중앙에 위치한다. 글루탐산 잔기와 히스티딘 잔기가 촉매 매커니즘에 관여한다. 활성 부위 잔기들 주변의 서열은 알려진 모든 삼탄당 인산 이성질화효소에서 보존되어 있다.
삼탄당 인산 이성질화효소의 구조는 효소의 기능과 밀접하게 관련되어 있다. 정확하게 배치된 글루탐산 및 히스티딘 잔기가 엔올을 형성하는 것 외에도, 삼탄당 인산 이성질화효소의 10개 또는 11개의 아미노산 사슬은 중간생성물을 안정화시키는 루프로서 작용한다. 166번째 잔기부터 176번째 잔기에 의해 형성된 루프는 닫히고, 기질의 인산기와 수소 결합을 형성한다. 이 작용은 반응 경로 상의 엔올 중간생성물 및 다른 전이 상태들을 안정화시킨다.[31]
반응을 동역학적으로 실현가능하게 만드는 것 외에도, 삼탄당 인산 이성질화효소 루프는 반응성 엔올 중간생성물을 격리시켜 메틸글리옥살 및 무기 인산으로의 분해를 방지한다. 효소와 기질의 인산기 사이의 수소 결합은 그러한 분해를 입체전자적으로 불리하게 만든다.[31] 메틸글리옥살은 독소이며, 형성된 경우 글리옥살레이스 시스템을 통해 제거된다.[35] 고에너지 인산 결합의 분해 및 해당과정의 나머지 기질들의 소모는 메틸글리옥살의 형성을 비효율적으로 만든다.
연구에 따르면 활성 부위에 가까운 리신(12번 위치)도 효소의 기능에 중요하다. 생리적 pH에서 양성자화된 리신은 인산기의 음전하를 중화시키는 데 도움이 될 수 있다. 이 리신 잔기가 중성 아미노산으로 치환되는 돌연변이가 일어나면 삼탄당 인산 이성질화효소는 모든 기능을 상실하지만, 양전하를 띠는 다른 아미노산으로 치환된 돌연변이체는 일부 기능을 유지한다.[36]
3. 1. TIM 배럴 구조
트라이오스 인산 이성질화효소(TIM)는 동일한 소단위체의 이량체이며, 각각의 소단위체는 약 250개의 아미노산 잔기들로 구성된다. 각 소단위체의 3차원 구조는 8개의 α-나선이 바깥쪽에, 8개의 평행한 β-시트가 안쪽에 있는 형태를 갖는다. 이러한 구조적 모티프를 αβ-배럴 또는 TIM 배럴이라고 하며, 가장 일반적인 단백질 접힘 중 하나이다.[31][7][19] 그림에서 각 소단위체의 리본 뼈대는 N-말단에서 C-말단까지 파란색에서 빨간색으로 표시되어 있다.이 효소의 활성 부위는 배럴의 중앙에 있으며, 글루탐산 및 히스티딘 잔기가 촉매 메커니즘에 관여한다. 활성 부위 잔기들 주변의 서열은 모든 트라이오스 인산 이성질화효소에서 보존된다.[31][7][19] 166번째 잔기부터 176번째 잔기에 의해 형성된 10~11개의 아미노산 사슬은 중간생성물을 안정화시키는 루프 역할을 하며, 닫혀서 기질의 인산기와 수소 결합을 형성하여 반응 경로 상의 엔올 중간생성물 및 다른 전이 상태들을 안정화시킨다.[31][7] 또한, 이 루프는 반응성 엔올 중간생성물을 격리시켜 메틸글리옥살 및 무기 인산으로 분해되는 것을 방지한다.[31][7][19] 활성 부위 근처의 리신(12번 위치)은 인산기의 음전하를 중화하여 효소 기능에 중요한 역할을 한다.[36][12][24]
3. 2. 루프 구조와 기능
트라이오스 인산 이성질화효소(triosephosphate isomerase영어, TPI)의 구조는 효소의 기능과 밀접하게 관련되어 있다. 166번 잔기부터 176번 잔기까지 형성되는 루프는 기질의 인산기와 수소 결합을 형성한다. 이 작용은 반응 경로 상의 엔올 중간생성물 및 다른 전이 상태들을 안정화시킨다.[31][7][19]
이 루프는 반응성 엔올 중간생성물을 격리하여 메틸글리옥살 및 무기 인산으로 분해되는 것을 방지한다. 효소와 기질의 인산기 사이의 수소 결합은 그러한 분해를 입체전자적으로 불리하게 만든다.[31][7][19] 메틸글리옥살은 독소이며, 형성된 경우 글리옥살라아제 시스템을 통해 제거된다.[35][11][23]
활성 부위 근처의 리신(Lys12) 잔기는 인산기의 음전하를 중화하여 효소 기능에 중요한 역할을 한다.[36][12][24]
4. 임상적 의의
5. 보존
참조
[1]
논문
Triosephosphate isomerase deficiency: facts and doubts
2006-12
[2]
논문
Free-energy profile of the reaction catalyzed by triosephosphate isomerase
1976-12
[3]
논문
Proton diffusion in the active site of triosephosphate isomerase
1990-05
[4]
논문
On the three-dimensional structure and catalytic mechanism of triose phosphate isomerase
1981-06
[5]
논문
Triosephosphate isomerase: removal of a putatively electrophilic histidine residue results in a subtle change in catalytic mechanism
1988-08
[6]
논문
Electrophilic catalysis in triosephosphate isomerase: the role of histidine-95
1991-03
[7]
논문
Enzyme catalysis: not different, just better
1991-03
[8]
논문
Proton transfer in the mechanism of triosephosphate isomerase
1998-11
[9]
논문
Kinetic properties of triose-phosphate isomerase from Trypanosoma brucei brucei. A comparison with the rabbit muscle and yeast enzymes
1987-10
[10]
논문
Crystallographic analysis of the complex between triosephosphate isomerase and 2-phosphoglycolate at 2.5-A resolution: implications for catalysis
1990-07
[11]
논문
Brief history of glyoxalase I and what we have learned about metal ion-dependent, enzyme-catalyzed isomerizations
2001-03
[12]
논문
Triosephosphate isomerase requires a positively charged active site: the role of lysine-12
1994-03
[13]
논문
Triosephosphate isomerase deficiency: facts and doubts
[14]
논문
Free-Energy Profile for the Reaction Catalyzed by Triosephosphate Isomerase
[15]
논문
Proton diffusion in the active site of triosephosphate isomerase
[16]
논문
On the three-dimensional structure and catalytic mechanism of triose phosphate isomerase.
[17]
논문
Triose Phosphate Isomerase: Removal of a Putatively Electrophilic Histidine Residue Results in a Subtle Change in Catalytic Mechanism.
[18]
논문
Electrophilic Catalysis in Triosephosphate Isomerase: the Role of Histidine-95.
[19]
논문
Enzyme catalysis: not different, just better
[20]
논문
Proton Transfer in the Mechanism of Triosephosphate Isomerase.
[21]
논문
Kinetic properties of triose-phosphate isomerase from Trypanosama brucei brucei
[22]
논문
Crystallographic Analysis of the Complex between Triosephosphate Isomerase and 2-Phosphoglycolate at 2.5-A Resolution: Implications for Catalysis
[23]
논문
Brief History of Glyoxalase I and What We Have Learned about Metal Ion-Dependent, Enzyme-Catalyzed Isomerizations.
[24]
논문
Triosephosphate Isomerase Requires a Positively Charged Active Site: The Role of Lysine-12.
[25]
논문
Triosephosphate isomerase deficiency: facts and doubts
2006-12
[26]
논문
Free-energy profile of the reaction catalyzed by triosephosphate isomerase
1976-12
[27]
논문
Proton diffusion in the active site of triosephosphate isomerase
1990-05
[28]
논문
On the three-dimensional structure and catalytic mechanism of triose phosphate isomerase
1981-06
[29]
논문
Triosephosphate isomerase: removal of a putatively electrophilic histidine residue results in a subtle change in catalytic mechanism
1988-08
[30]
논문
Electrophilic catalysis in triosephosphate isomerase: the role of histidine-95
1991-03
[31]
논문
Enzyme catalysis: not different, just better
1991-03
[32]
논문
Proton transfer in the mechanism of triosephosphate isomerase
1998-11
[33]
논문
Kinetic properties of triose-phosphate isomerase from Trypanosoma brucei brucei. A comparison with the rabbit muscle and yeast enzymes
1987-10
[34]
논문
Crystallographic analysis of the complex between triosephosphate isomerase and 2-phosphoglycolate at 2.5-A resolution: implications for catalysis
1990-07
[35]
논문
Brief history of glyoxalase I and what we have learned about metal ion-dependent, enzyme-catalyzed isomerizations
2001-03
[36]
저널
Triosephosphate isomerase requires a positively charged active site: the role of lysine-12
1994-03
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

