바이러스 침입
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
바이러스 침입은 바이러스가 숙주 세포에 부착하여 세포 내로 침투하는 과정을 설명한다. 바이러스는 세포 표면의 수용체 단백질에 부착하여 세포 감염을 시작하며, 막 융합, 세포내이입, 유전체 주입 등의 메커니즘을 통해 세포 내로 침투한다. 침투 후 바이러스는 숙주 세포의 기능을 억제하고, 바이러스 복제를 위한 준비를 하며, 세포를 제어하여 세포 독성을 유발하기도 한다.
더 읽어볼만한 페이지
- 바이러스학 - 코로나19 백신
코로나19 백신은 코로나19 감염을 예방하기 위해 개발되었으며, 다양한 기술 플랫폼을 기반으로 전 세계적으로 사용되었으나, 백신 접근성 불평등, 허위 정보, 법적 책임 문제 등 논란과 변이 바이러스 출현으로 인한 효과 감소, 부작용 등의 문제도 존재한다. - 바이러스학 - 백신
백신은 약화된 병원체나 일부를 활용하여 인체의 면역계를 활성화, 특정 질병에 대한 항체 생성을 유도하는 의약품으로 감염병 예방에 효과적이지만, 부작용 발생 가능성과 효과의 다양성, 백신 거부와 오해로 인한 접종률 저하 및 감염병 확산의 위험이 존재하며, 지속적인 연구개발을 통해 안전성과 효능이 향상되고 새로운 기술을 이용한 백신들이 개발되고 있다.
2. 바이러스의 세포 부착
바이러스가 숙주 세포에 침투하기 위한 첫 단계는 세포 표면에 부착하는 것이다. 바이러스는 세포 표면에 있는 특정한 수용체 단백질에 결합하여 부착하며, 바이러스의 종류에 따라 부착 과정과 이후 침투 방식에 차이가 있다.
인간면역결핍 바이러스(HIV)와 단순포진바이러스는 외피를 가진 바이러스의 예시이며, 박테리오파지는 외피가 없는 바이러스의 대표적인 예이다.[31]
2. 1. 부착 과정
바이러스는 세포 표면에 있는 특정한 수용체 단백질에 결합하여 부착한다. 바이러스 외피나 캡시드에 있는 단백질이 세포막의 수용체와 상호작용한다.[31] 이 과정은 열역학적 확산에 의해 무작위로 일어나며, 바이러스와 세포가 충분히 가까워져야 한다.[31]인간면역결핍 바이러스(HIV)와 단순포진바이러스는 외피 바이러스의 예시이며, 박테리오파지는 외피가 없는 바이러스의 대표적인 예이다.[31]
2. 2. 부착 인자
바이러스가 숙주 세포에 침투하려면 먼저 세포 표면에 부착해야 한다. 이 부착 과정은 바이러스의 캡시드나 바이러스 외피에 있는 특정 단백질이 표적 세포의 세포막에 있는 수용체 단백질과 결합함으로써 이루어진다. 바이러스 종류에 따라 다양한 부착 인자가 존재하며, 숙주 세포의 종류에 따라 발현되는 수용체의 종류가 다르기 때문에, 바이러스가 감염시킬 수 있는 세포의 종류가 결정된다. 이를 세포 친화성이라고 한다.[2]HIV나 단순 헤르페스 바이러스와 같은 외피 바이러스는 숙주 세포 표면의 부착 인자에 결합하여 세포에 침투한다. 바이러스 외피의 수용체는 세포막의 상보적인 수용체와 결합하여 두 막을 서로 가깝게 유지하고, 표면 단백질 간의 추가적인 상호 작용을 촉진한다. 이러한 부착은 세포 감염의 첫 번째 필수 조건이며, 이 조건이 충족되면 세포는 감수성을 갖게 된다.[2]
박테리오파지와 같이 외피가 없는 바이러스도 숙주 세포 표면의 수용체에 부착하여 침투한다. 예를 들어, 전형적인 박테리오파지는 긴 꼬리를 이용하여 박테리아 표면의 수용체에 부착한다.[2]
3. 바이러스의 세포 침투 메커니즘
바이러스는 세포막을 통과하기 위해 다양한 방법을 사용한다. 부유 상태의 바이러스는 열역학적 확산을 통해 움직이며, 세포나 바이러스가 특별한 전하를 띠지 않기 때문에 거의 충돌할 때까지 움직여야 한다. 충돌하면 바이러스 외피나 캡시드에 있는 수용체를 통해 세포막의 수용체 단백질과 상호작용하여 부착(흡착)한다. 이렇게 부착되면 두 막 사이 거리가 가까워져 표면에 있는 다른 단백질들이 상호작용한다.
세포막을 뚫는 과정은 크게 세 가지로 나뉜다.
- '''막 융합''': 세포막에 구멍이 뚫려 바이러스 외피와 연결된다.
- '''세포내이입''': 세포가 음식물을 대하듯 바이러스 입자를 받아들인다.
- '''유전체 주입''': 캡시드나 유전체가 세포의 세포질로 주사된다.
녹색 형광 단백질을 사용해 실시간으로 바이러스 감염을 관찰할 수 있는데, 침투로부터 복제까지는 수초에서 수시간이 걸린다.[32][33]
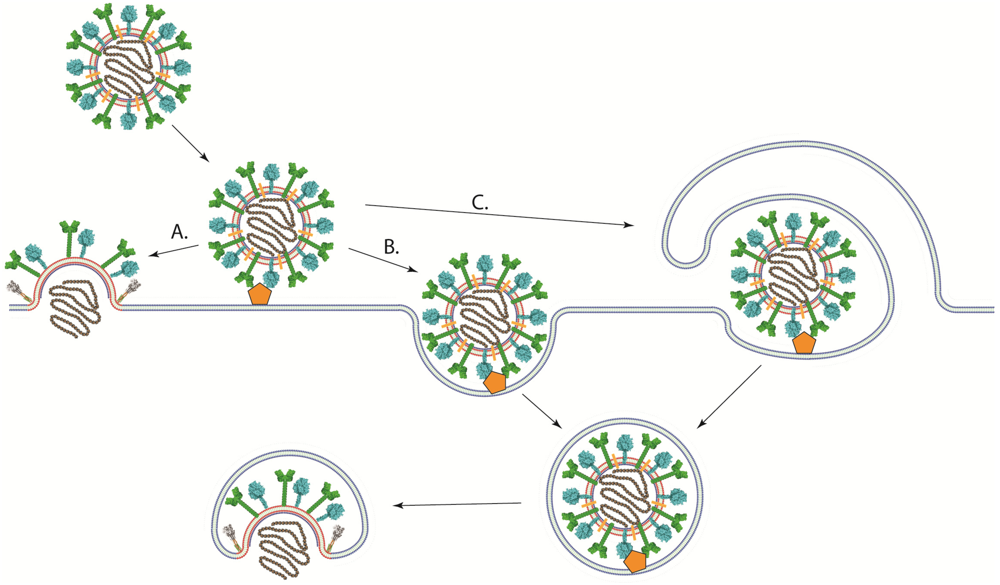
각각의 침투 방식에 대한 자세한 설명은 하위 문단을 참고할 수 있다.
3. 1. 막 융합
막 융합은 바이러스가 세포 내로 침투하는 가장 흔한 방법 중 하나이다. 이 방식은 바이러스 외피를 가진 바이러스에서 주로 나타나며, 바이러스 외피의 수용체가 세포막의 수용체와 결합하면서 시작된다. 이 결합은 세포 내 신호전달경로를 활성화시켜 세포막에 구멍을 뚫고, 바이러스 외피와 세포막이 융합되도록 한다. 본질적으로 바이러스 외피가 세포막에 녹아들어 하나가 되면서 바이러스 내부 물질이 세포 안으로 방출되는 것이다.
이러한 방식으로 세포에 침입하는 대표적인 바이러스로는 인간면역결핍 바이러스(HIV), 단순포진바이러스(HSV), 카포시육종 헤르페스바이러스(KSHV) 등이 있다.[34][35][36][37][38]
SARS-CoV-2와 같은 코로나바이러스도 막 융합을 통해 세포 내로 침투한다. 이 바이러스는 스파이크 단백질을 이용하여 세포 표면의 안지오텐신 전환 효소 2(ACE2) 수용체와 결합한다. 이 결합을 통해 막 융합이 일어나고 바이러스가 세포 내로 들어갈 수 있게 된다.[10] 이러한 이유로, SARS-CoV-2 감염 예방을 위한 백신은 스파이크 단백질을 표적으로 하여 바이러스와 숙주 세포 막의 융합을 막는 것을 기반으로 한다.[11][12] 또한, 융합 메커니즘은 항바이러스제 개발의 잠재적 표적으로 연구되고 있다.[13]
3. 2. 세포내이입 (Endocytosis)
세포가 외부 물질을 받아들이는 세포내이입(엔도사이토시스) 과정을 통해 바이러스가 세포 안으로 들어간다. 이는 세포가 바이러스를 영양소나 음식물로 착각하게 하여 이루어진다. 바이러스는 세포에 의해 소포 형태로 둘러싸여 세포 안으로 들어간 후, 소포를 파괴하고 세포질로 방출된다.[40] 폴리오바이러스, C형 간염 바이러스,[39] 구제역바이러스[40] 등이 이 방식을 사용한다.
외피를 가진 바이러스 중에도 세포내이입을 이용하는 경우가 있다. 엔도솜의 낮은 pH와 단백질분해효소는 바이러스가 캡시드를 분해하고 유전 물질 방출을 돕는다. 게다가 막 융합과는 달리 세포막에 바이러스 외피의 구성요소가 남아있지 않기 때문에 면역체계에 쉽게 감지되지 않는다는 이점이 있다.[41]
3. 3. 유전체 주입 (Viral penetration)
바이러스가 자신의 유전체(게놈)만을 세포 안으로 주입하고, 나머지 부분은 세포 외부에 남겨두는 방식이다. 주로 박테리오파지가 이 방식을 사용하며, 꼬리를 이용하여 세포막을 뚫고 DNA를 주입한다.[42] 박테리오파지 T2의 경우 세포에 부착한 후 긴 꼬리를 통해 세포막을 뚫어 캡시드에 있는 DNA를 세포 내로 주사한다.[17]이 방식은 오직 유전체만으로 복제가 가능한 바이러스에서 행해지는데, 대부분의 양성 단일가닥 RNA 바이러스가 이에 해당된다. 이 바이러스의 경우 침입하자마자 다른 과정 없이 바로 번역이 가능하기 때문이다.[42]
4. 세포 침투 이후 과정
바이러스는 침입 가능한 세포를 민감하다고(susceptible) 한다. 바이러스 입자가 세포 안으로 들어간 후에는 단백질, 유전체 등 바이러스의 내용물을 풀어 바이러스 복제를 위한 준비를 한다.[43][44]
녹색 형광 단백질(green fluorescent protein|녹색 형광 단백질영어)을 사용하면 바이러스의 침입과 감염을 실시간으로 볼 수 있다. 바이러스가 세포 내로 침입한 후 바로 복제가 이루어지는 것은 아니고, 수 초에서 수 시간 정도 걸린다.[19][20]
4. 1. 세포 기능 억제
바이러스는 침입 후 여러 단백질을 활성화하여 세포를 장악한다. 이 과정에서 세포의 방어 기능을 담당하는 단백질의 전사와 번역을 억제한다. 이는 세포 독성을 띄며, 감염된 세포가 죽는 원인이 된다.[43][44]바이러스가 세포를 완전히 제어하기 위해 단백질 형성을 활성화하면, 세포 고유 방어 억제, 세포 신호 전달 억제, 숙주 세포의 전사 및 번역 억제 등의 작용이 일어난다. 이러한 세포 독성 효과는 바이러스에 감염된 세포의 죽음과 쇠퇴로 이어진다.
4. 2. 바이러스 복제 준비
바이러스 입자가 세포 안으로 들어오면 단백질, 유전체 등 바이러스의 내용물을 풀어놓고, 바이러스 복제를 위한 준비를 한다.[43][44] 바이러스가 세포 내에 침투하면, 가능하다면 숙주 세포를 완전히 제어하기 위해 단백질 형성을 활성화한다. 제어 메커니즘에는 고유 세포 방어 억제, 세포 신호 전달 억제, 숙주 세포의 전사 및 번역 억제가 포함된다.5. 한국의 바이러스 연구
(이전 답변에서 원본 소스가 없어 내용을 구성할 수 없다고 말씀드렸습니다. 따라서 수정할 결과물도 없습니다. 원본 소스가 제공되면 지침에 따라 위키텍스트를 작성하고, 필요한 경우 수정까지 완료하여 제공하겠습니다.)
참조
[1]
논문
Herpes simplex virus type 1 mediates fusion through a hemifusion intermediate by sequential activity of glycoproteins D, H, L, and B
2007-02-20
[2]
웹사이트
Virus entry into host cell ~ ViralZone page
https://viralzone.ex[...]
2021-02-05
[3]
논문
Visualizing infection of individual influenza viruses
[4]
논문
Visualization of Targeted Transduction by Engineered Lentiviral Vectors
2008-05-15
[5]
논문
KSHV Entry and Trafficking in Target Cells-Hijacking of Cell Signal Pathways, Actin and Membrane Dynamics
2016-11-14
[6]
논문
ESCRT-I Protein Tsg101 Plays a Role in the Post-macropinocytic Trafficking and Infection of Endothelial Cells by Kaposi's Sarcoma-Associated Herpesvirus
2016-10
[7]
논문
ESCRT-0 Component Hrs Promotes Macropinocytosis of Kaposi's Sarcoma-Associated Herpesvirus in Human Dermal Microvascular Endothelial Cells
2016-04
[8]
논문
Protective Immunity Based on the Conserved Hemagglutinin Stalk Domain and Its Prospects for Universal Influenza Vaccine Development
2014
[9]
논문
The multipartite system that mediates entry of herpes simplex virus into the cell
http://dx.doi.org/10[...]
2007
[10]
논문
Design of Potent Membrane Fusion Inhibitors against SARS-CoV-2, an Emerging Coronavirus with High Fusogenic Activity
[11]
논문
Inhibition of SARS-CoV-2 (previously 2019-nCoV) infection by a highly potent pan-coronavirus fusion inhibitor targeting its spike protein that harbors a high capacity to mediate membrane fusion
2020-03-30
[12]
논문
Inhibition of Coronavirus Entry In Vitro and Ex Vivo by a Lipid-Conjugated Peptide Derived from the SARS-CoV-2 Spike Glycoprotein HRC Domain
2020-10-20
[13]
논문
Coronavirus membrane fusion mechanism offers a potential target for antiviral development
2020-06
[14]
논문
Hepatitis C virus entry into host cells.
2007-10-04
[15]
서적
Introduction to Modern Virology
Blackwell Publishing
2007
[16]
서적
Fields Virology
Lippincott Williams & Williams
2013
[17]
논문
Mechanism of plasmid delivery by hydrodynamic tail vein injection. I. Hepatocyte uptake of various molecules
http://dx.doi.org/10[...]
2006-07
[18]
논문
Herpes simplex virus type 1 mediates fusion through a hemifusion intermediate by sequential activity of glycoproteins D, H, L, and B
2007-02-20
[19]
논문
Visualizing infection of individual influenza viruses
[20]
논문
Visualization of Targeted Transduction by Engineered Lentiviral Vectors
2008-05-15
[21]
논문
KSHV Entry and Trafficking in Target Cells-Hijacking of Cell Signal Pathways, Actin and Membrane Dynamics
2016-11-14
[22]
논문
ESCRT-I Protein Tsg101 Plays a Role in the Post-macropinocytic Trafficking and Infection of Endothelial Cells by Kaposi's Sarcoma-Associated Herpesvirus
2016-10
[23]
논문
ESCRT-0 Component Hrs Promotes Macropinocytosis of Kaposi's Sarcoma-Associated Herpesvirus in Human Dermal Microvascular Endothelial Cells
2016-04
[24]
논문
Protective Immunity Based on the Conserved Hemagglutinin Stalk Domain and Its Prospects for Universal Influenza Vaccine Development
2014
[25]
논문
The multipartite system that mediates entry of herpes simplex virus into the cell.
2007
[26]
논문
Hepatitis C virus entry into host cells.
2007-10-04
[27]
서적
Introduction to Modern Virology
Blackwell Publishing
2007
[28]
서적
Fields Virology
Lippincott Williams & Williams
2013
[29]
논문
Mechanism of plasmid delivery by hydrodynamic tail vein injection. I. Hepatocyte uptake of various molecules.
2006-07
[30]
저널
Herpes simplex virus type 1 mediates fusion through a hemifusion intermediate by sequential activity of glycoproteins D, H, L, and B
2007-02-20
[31]
저널
Virus entry: molecular mechanisms and biomedical applications
https://www.nature.c[...]
2004-02
[32]
저널
Visualizing infection of individual influenza viruses
[33]
저널
Visualization of Targeted Transduction by Engineered Lentiviral Vectors
2008-05-15
[34]
저널
KSHV Entry and Trafficking in Target Cells-Hijacking of Cell Signal Pathways, Actin and Membrane Dynamics
2016-11-14
[35]
저널
ESCRT-I Protein Tsg101 Plays a Role in the Post-macropinocytic Trafficking and Infection of Endothelial Cells by Kaposi's Sarcoma-Associated Herpesvirus
2016-10
[36]
저널
ESCRT-0 Component Hrs Promotes Macropinocytosis of Kaposi's Sarcoma-Associated Herpesvirus in Human Dermal Microvascular Endothelial Cells
2016-04
[37]
저널
Protective Immunity Based on the Conserved Hemagglutinin Stalk Domain and Its Prospects for Universal Influenza Vaccine Development
2014
[38]
간행물
The multipartite system that mediates entry of herpes simplex virus into the cell.
2007-09
[39]
간행물
Hepatitis C virus entry into host cells.
2007-10-04
[40]
서적
Introduction to Modern Virology
Blackwell Publishing
2007
[41]
서적
Fields Virology
Lippincott Williams & Williams
2013
[42]
간행물
Mechanism of plasmid delivery by hydrodynamic tail vein injection. I. Hepatocyte uptake of various molecules.
2006-07
[43]
저널
Cellular Control in Virus Infection
https://www.nature.c[...]
1955-03
[44]
저널
Viruses and apoptosis
https://www.ncbi.nlm[...]
2001-04
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
