오염화 인
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
오염화 인(PCl₅)은 화학식 PCl₅를 갖는 인과 염소의 화합물이다. 기체 상태와 용융 상태에서 삼각 쌍뿔 구조를 가지며, 고체 상태에서는 이온 화합물인 사염화인 육염화인산염으로 존재한다. 오염화 인은 삼염화 인을 염소화하여 제조되며, 유기 화합물 및 무기 화합물의 염소화 반응에 널리 사용된다. 물과 격렬하게 반응하며, 피부 부식성 및 흡입 시 치명적일 수 있어 독물로 분류된다. 1808년 험프리 데이비에 의해 처음으로 제조되었다.
더 읽어볼만한 페이지
- 인(V) 화합물 - 인산
인산은 화학식 H₃PO₄를 가지며, 인광석을 이용한 습식 또는 건식 공정으로 생산되어 비료, 식품 첨가물, 세제, 의약품, 금속 처리 등 다양한 산업 분야에 사용되는 인 화합물이다. - 인(V) 화합물 - 피로인산
피로인산은 화학식 H₄P₂O₇을 갖는 무기산으로, 피로인산나트륨 이온 교환 등으로 제조되고 DNA 합성 부산물로 생성되며 가수분해 시 방출되는 에너지는 세포 내 과정에 사용된다. - 염화물 - 염산
염산은 염화수소 수용액으로, 자비르 이븐 하이얀에 의해 처음 발견되어 르블랑 공정을 통해 대량 생산되었으며, 현재는 유기 화합물 생산의 부산물로 얻어져 산업 전반에 사용되지만 강한 부식성으로 취급에 주의해야 하는 강산성 무기산이다. - 염화물 - 클로로포름
클로로포름은 화학식 CHCl3을 갖는 무색의 휘발성 액체 유기 화합물로, 마취 효과가 있어 과거에 마취제로 사용되었으나 독성 문제로 현재는 냉매 생산, 유기 용매 등으로 사용되며, 발암 가능성과 유독 물질 생성 위험으로 취급에 주의가 필요하고 사용을 줄이는 추세이다.
2. 구조
오염화 인(PCl5)은 VSEPR 이론에 따라 환경에 따라 다른 구조를 갖는다. 기체 및 용융 상태에서는 삼각 쌍뿔 분자 구조(''D''3h 분자 대칭)를 띤 중성 분자이며, 이황화 탄소(CS2)나 사염화 탄소(CCl4) 같은 비극성 용매에서도 이 구조가 유지된다.[5]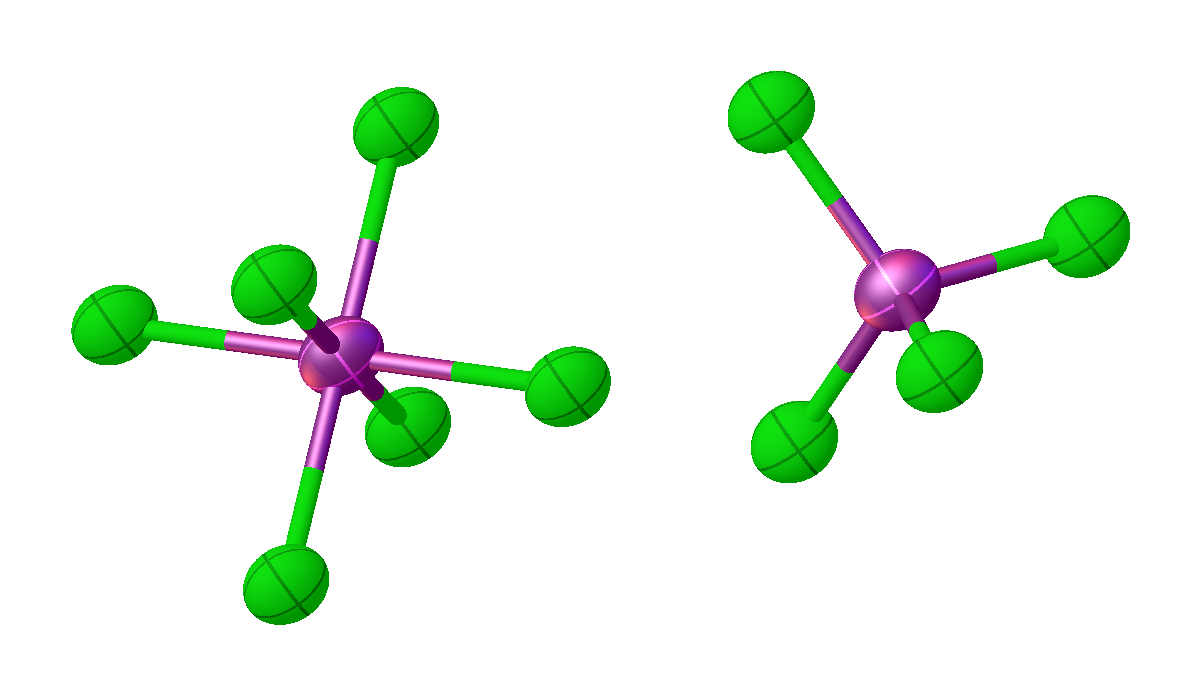
극성 용매에서는 자체 이온화를 거친다.[8] 희석 용액에서는 다음 평형에 따라 해리된다.
:PCl5
고농도에서는 다음 평형이 더 우세하다.
:2 PCl5
PCl₄]⁺] 양이온과
2. 1. 관련 오염화물
오염화 비소(AsCl5)와 오염화 안티몬(SbCl5)도 삼각 쌍뿔 구조를 갖는다. 관련 결합 거리는 As-Cleq 211pm, As-Clax 221pm, Sb-Cleq 227pm, Sb-Clax 233.3pm이다.[9] 저온에서 SbCl5는 오염화 니오브(niobium pentachloride)와 구조적으로 관련된 이합체인 이팔면체 Sb2Cl10으로 전환된다.3. 제조
삼염화 인(PCl3)과 염소(Cl2)를 반응시켜 제조한다. 반응식은 다음과 같다.[10][6][26]
:PCl3 + Cl2 ⇌ PCl5 (ΔH = -124 kJ/mol)
이 반응은 상업적으로 연간 약 10000ton의 PCl5를 생산하는 데 사용된다.[6][26] PCl5는 PCl3 및 Cl2와 평형을 이루며, 180°C에서 약 40%가 해리된다.[6][26] 이 평형 때문에 PCl5 시료에는 종종 염소가 포함되어 녹색을 띤다.
4. 반응
오염화 인은 물과의 반응, 루이스 산으로서의 반응, 유기 및 무기 화합물의 염소화 등 다양한 반응을 보인다.
- 가수 분해: 물과 반응하여 염화 수소를 방출하고 인 산화물을 생성한다. 첫 생성물은 인산 옥시염화물이며[24], 뜨거운 물에서는 오르토인산이 된다.[24]
- 루이스 산: 루이스 산으로 작용하여 자동 이온화, 염소화, 가수분해 등을 일으킨다. PCl5(피리딘)은 대표적인 부가물이다.[11]
- 유기 화합물 염소화: 카복실산을 아실 클로라이드로[12][13], 알코올을 알킬 클로라이드로 전환한다. 디메틸포름아미드(DMF)와 반응하여 빌스마이어 시약을 생성, 벤즈알데히드 유도체 제조 등에 쓰인다.[14] C=O 그룹을 CCl2 그룹으로 바꿀 수 있다.[15] (예: 벤조페논 → 디페닐디클로로메탄[16]) 친전자성을 띠어 스티렌과 반응, 가수분해 후 포스폰산 유도체를 생성한다.[17]
- 무기 화합물 염소화: 오산화 인과 반응하여 인산 옥시염화물(POCl3)을 생성하고[18], 이산화 질소(NO2)를 염소화하여 불안정한 염화 질소(NO2Cl)를 만든다. 육플루오린화 인산 리튬(LiPF6) (리튬 이온 전지 전해질 염)의 전구체이다.[19]
4. 1. 가수 분해
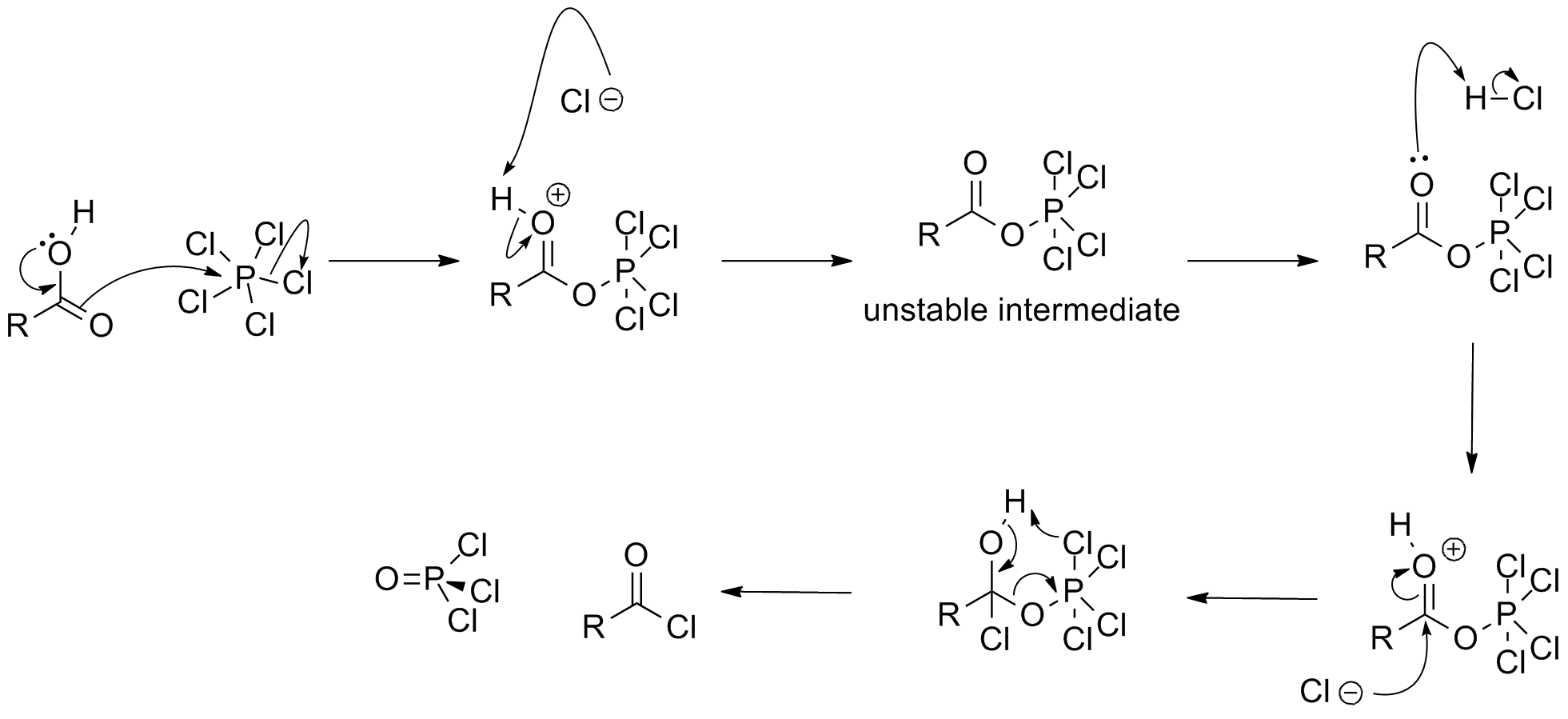
오염화 인의 가장 특징적인 반응은 물과의 화학 반응이다. 물과 접촉하면 염화 수소를 방출하고 인 산화물을 생성한다. 첫 번째 가수 분해 생성물은 인산 옥시염화물이다.[24]
:PCl5 + H2O → POCl3 + 2 HCl
뜨거운 물에서는 가수 분해가 완전히 진행되어 오르토인산이 생성된다.[24]
:PCl5 + 4 H2O → H3PO4 + 5 HCl
4. 2. 루이스 산성
오염화 인은 루이스 산이다. 이러한 성질은 자동 이온화, 염소화, 가수분해를 포함한 여러 반응의 기초가 된다. 잘 연구된 부가물은 PCl5(피리딘)이다.[11]4. 3. 유기 화합물의 염소화
합성 화학에서 주로 중요하게 사용되는 염소화 반응에는 산화 염소화와 치환 염소화 두 종류가 있다. 산화 염소화는 시약으로부터 기질로 Cl|Cl영어를 전달하는 것을 뜻한다. 치환 염소화는 O 또는 OH 그룹을 염화물(Cl)로 치환하는 반응이다. 오염화 인(PCl5)은 두 과정 모두에 사용될 수 있다.
PCl5는 카복실산을 아실 클로라이드로 변환한다.[12][13]
PCl5는 또한 알코올을 알킬 클로라이드로 변환한다. 염화 티오닐은 생성된 이산화황이 POCl3보다 유기 생성물로부터 더 쉽게 분리되기 때문에 실험실에서 더 일반적으로 사용된다.
PCl5는 디메틸포름아미드(DMF)와 같은 3차 아미드와 반응하여 빌스마이어 시약 [(CH3)2N=CClH]Cl을 생성한다. DMF와 POCl3의 반응에서도 관련 염이 생성된다. 이러한 시약은 벤즈알데히드 유도체를 제조하고 C−OH 그룹을 C−Cl 그룹으로 변환하는 데 유용하다.[14]
PCl5는 특히 C=O 그룹을 CCl2 그룹으로 변환하는 데 유용하다.[15] 예를 들어, 벤조페논은 오염화 인과 반응하여 디페닐디클로로메탄을 생성한다:[16]
:(C6H5)2CO + PCl5 → (C6H5)2CCl2 + POCl3
PCl5는 친전자성을 띠는데, 이는 PCl5가 스티렌과 반응 후 가수분해하면 포스폰산 유도체가 생성된다는 점에서 잘 드러난다.[17]
4. 4. 무기 화합물의 염소화
오산화 인과 오염화 인(PCl5)의 반응으로 인산 옥시염화물(POCl3)이 생성된다.[18]:6 PCl5 + P4O10 → 10 POCl3
오염화 인은 이산화 질소(NO2)를 염소화하여 불안정한 염화 질소(NO2Cl)를 생성한다.
:PCl5 + 2 NO2 → PCl3 + 2 NO2Cl
:2 NO2Cl → 2 NO2 + Cl2
오염화 인은 육플루오린화 인산 리튬(LiPF6)의 전구체이다. 육플루오린화 인산 리튬은 리튬 이온 전지의 전해질에 일반적으로 사용되는 염이다.[19]
:PCl5 + 6 LiF → LiPF6 + 5 LiCl
5. 안전성
오염화 인(PCl5)은 물과 격렬하게 반응하여 위험하다. 피부에 닿으면 부식성이 있으며, 흡입하면 치명적일 수 있다.[1] 또한 염화 수소나 염소의 발생원이 된다. 대한민국에서는 독물 및 극물 단속법에 의해 독물로 지정되어 있다.[2]
6. 역사
오염화 인은 1808년 영국의 화학자 험프리 데이비에 의해 처음으로 제조되었다.[20] 데이비의 오염화 인 분석은 정확하지 않았으며,[21] 최초의 정확한 분석은 1816년 프랑스 화학자 피에르 루이 듈롱에 의해 이루어졌다.[22]
참조
[1]
간행물
2014-05-15
[2]
웹사이트
Phosphorus pentachloride
http://www.sigmaaldr[...]
[3]
간행물
[4]
간행물
Phosphorus pentachloride
[5]
서적
Phosphorus: An outline of its chemistry, biochemistry, and uses
Elsevier Science
[6]
서적
Inorganic Chemistry
Academic Press
[7]
논문
Crystal and Molecular structure of a metastable modification of phosphorus pentachloride
[8]
논문
Nature of Phosphorus(V) Chloride in Ionizing and Nonionizing Solvents
[9]
논문
Solid State Structures of AsCl5 and SbCl5
[10]
서적
Inorganic Syntheses
1939
[11]
논문
Neutral Six-Coordinate Phosphorus
[12]
간행물
p-Nitrobenzoyl chloride
[13]
서적
Organic chemistry
https://archive.org/[...]
Oxford University Press
[14]
간행물
Encyclopedia of Reagents for Organic Synthesis
J. Wiley & Sons
2004
[15]
간행물
Dichloromethyl methyl ether
[16]
논문
A Mild Synthesis of Vinyl Halides and gem-Dihalides Using Triphenyl Phosphite−Halogen-Based Reagents
[17]
간행물
Styrylphosphonic dichloride
[18]
서적
Advanced Inorganic Chemistry
Wiley-Interscience
[19]
논문
New lithium salts in electrolytes for lithium-ion batteries (Review)
2017-08-04
[20]
논문
The Bakerian Lecture. An account of some new analytical researches on the nature of certain bodies, particularly the alkalies, phosphorus, sulphur, carbonaceous matter, and the acids hitherto undecomposed; with some general observations on chemical theory
https://babel.hathit[...]
1809
[21]
논문
Researches on the oxymuriatic acid [i.e., chlorine], its nature and combinations; and on the elements of the muriatic acid [i.e., hydrogen chloride]. With some experiments on sulphur and phosphorus, made in the laboratory of the Royal Institution
https://babel.hathit[...]
1810
[22]
논문
Extrait d'un mémoire sur les combinaisons du phosphore avec l'oxigène
https://babel.hathit[...]
1816
[23]
간행물
Phosphorus(V) Chloride
J. Wiley & Sons
2004
[24]
논문
Nature of Phosphorus(V) Chloride in Ionizing and Nonionizing Solvents
1973
[25]
서적
Phosphorus: An Outline of its Chemistry, Biochemistry, and Technology
Elsevier
1995
[26]
서적
Inorganic Chemistry
Academic Press
2001
[27]
간행물
p-Nitrobenzoyl chloride
http://www.orgsyn.or[...]
1941
[28]
간행물
Dichloromethyl Methyl Ether
http://www.orgsyn.or[...]
1973
[29]
간행물
Styrylphosphonic dichloride
http://www.orgsyn.or[...]
1973
[30]
간행물
2014-05-15
[31]
웹사이트
Phosphorus pentachloride
http://www.sigmaaldr[...]
[32]
간행물
[33]
간행물
Phosphorus pentachloride
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
