염산
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
염산은 800년경 연금술사 자비르 이븐 하이얀에 의해 처음 발견된 강산이다. 염산은 염화수소를 물에 녹여 제조하며, 철강 산세척, 유기 화합물 생산, pH 조절, 이온 교환 수지 재생 등 다양한 산업 분야에 사용된다. 염산은 부식성이 강하여 취급 시 주의가 필요하며, 특정 물질과 혼합 시 유독한 염소 기체를 발생시킬 수 있다.
더 읽어볼만한 페이지
- ATC 코드가 들어있는 - 리포산
리포산은 이황화 결합과 카르복실산을 가진 화합물로, 효소의 보조인자 및 항산화제로 작용하며, 당뇨병성 신경병증 치료에 사용된다. - ATC 코드가 들어있는 - 아세타졸아마이드
아세타졸아마이드는 탄산탈수효소 억제제로, 녹내장, 부종, 간질 등의 치료에 사용되며 이뇨 작용을 통해 안압, 혈압, 두개내압을 감소시키지만, 대사성 산증, 전해질 이상 등의 부작용과 약물 상호작용에 주의해야 한다. - 위 (해부학) - 위산 (소화계)
위산은 위에서 분비되는 강한 산성 물질로 살균 작용, 펩신 활성화 등의 소화 작용을 하며, 자율 신경계와 호르몬에 의해 조절되고, 과다 또는 과소 분비 시 질환을 유발할 수 있으며, 양성자 펌프 억제제 등으로 조절 가능하다. - 위 (해부학) - 벽세포
벽세포는 위벽에 존재하며 위산과 내인자를 분비하고, 세포내세관 네트워크와 풍부한 미토콘드리아를 통해 효율적인 위산 분비를 수행하며, 기능 이상은 임상적 문제와 관련될 수 있다. - 용액 - 요소수
요소수는 디젤 엔진의 질소산화물을 줄이는 선택적 촉매 환원 시스템에 사용되는 표준 물질로, 보통 32.5% 요소 수용액 형태로 사용되며, 배기가스에 분사되어 질소산화물을 질소와 물로 환원시키는 역할을 한다. - 용액 - 용매
용매는 다른 물질을 용해시켜 용액을 만드는 물질로, 물이 가장 흔하지만 알코올, 아세톤 등 유기 용매도 사용되며, 용액의 안정성과 화학 반응 속도에 영향을 주고, 극성/무극성, 프로톤성/비프로톤성 등으로 분류되며, 산업적으로 널리 쓰이지만 가연성 및 독성으로 안전한 취급이 중요하다.
2. 역사
800년경 연금술사 자비르 이븐 하이얀(Jabir ibn Hayyan, Geber)이 소금과 황산을 반응시켜 처음 발견했다.[86][87][88][89][90] 자비르 이븐 하이얀는 염산 외에도 다른 많은 물질들을 발견하고, 20권이 넘는 자신의 책에 기록하였다. 그 중에서도 염산과 질산을 혼합한 왕수는 금까지도 녹일 수 있어서 현자의 돌을 찾으려 하던 연금술사들이 많은 관심을 보였다.[90]
10세기 초, 알라지지(アル・ラーズィー)는 염화암모늄(塩化アンモン石)과 황산염을 혼합하여 증류하는 실험을 실시했다. 이 실험으로 염화수소 기체가 생성되었지만, 알라지지는 대부분의 실험에서 이 기체를 무시했다.[51]
11세기부터 12세기 무렵, 이 실험을 바탕으로 기술된 ''De aluminibus et salibus'' (『명반(ミョウバン)과 염(塩)에 관하여』)에서는 다양한 금속염(염 (화학))의 가열에 대해 기술되어 있으며, 수은(水銀)과 염을 가열하면 염화수은(II)(昇汞)이 생성된다는 사실이 기록되어 있었다.[52] 이 반응에서는 실제로 염산이 생성되지만, 곧바로 수은과 반응하여 염화수은(II)이 생성된다.
13세기 무렵, 라틴 연금술사들은 앞선 문헌에 기록된 염화수은(II)의 염소화 특성에 매료되어 여러 가지 실험을 반복했다. 그 결과, 황산염·명반·염을 가열한 후 금속을 제거하면 강한 무기산을 직접 증류할 수 있다는 것을 발견했다.[53]
이 무기산의 발견으로 14세기 무렵, 금을 용해할 수 있는 왕수가 발명되었다. 현재는 왕수가 질산과 염산을 1:3의 비율로 혼합하여 만드는 것이 널리 알려져 있지만, 당시에는 염화암모늄과 질산을 가열하여 만들었으며, 염산의 단독 분리는 이루어지지 않았다.[54]
염산 단독의 제조는 16세기 후반 장바티스타 델라 포르타(ジャンバッティスタ・デッラ・ポルタ), 안드레아스 리바비우스(アンドレアス・リバヴィウス), 장 베갱(ジャン・ベガン) 등의 저술에 의해 처음으로 보고되었다.[55]
2. 1. 고대 ~ 중세
염산은 800년경 연금술사 자비르 이븐 하이얀(Jabir ibn Hayyan, Geber)이 소금과 황산을 반응시켜 처음 발견했다.[86][87][88][89][90] 자비르 이븐 하이얀는 염산 이외에도 다른 많은 물질들을 발견하고, 20권이 넘는 자신의 책에 기록하였다. 10세기 초, 페르시아의 의사이자 연금술사였던 아부 바크르 알라지(라틴어: 라제스)는 염화암모늄과 황산을 함께 증류하는 실험을 통해 염화수소 기체를 생성했다.[9] 하지만 알라지는 대부분의 실험에서 기체 생성물을 무시하고 잔류물에서 일어날 수 있는 색 변화에 집중했던 것으로 보인다.[12]11세기 또는 12세기 아랍어 텍스트인 De aluminibus et salibusla("명반과 염에 관하여")는 라틴어로 번역되어 게라르두스 크레모넨시스에 의해 전해졌다.[14] 이 책에는 수은과 염을 가열하면 염화수은(II)이 생성된다는 내용이 기록되어 있다.[15] 이 과정에서 염산이 생성되기 시작하지만, 곧 수은과 반응하여 염화수은(II)을 생성하였다. 13세기 라틴 연금술사들은 ''De aluminibus et salibus''에 기록된 염화수은(II)의 염소화 특성에 주목했고, 금속을 황산염, 명반, 염을 가열하는 과정에서 제거하면 강한 무기산을 직접 증류할 수 있다는 것을 발견하였다.[15]
무기산의 발견으로 인해 중요한 발명품 중 하나인 왕수는 질산과 염산을 1:3 비율로 혼합하여 금을 용해할 수 있는 혼합물이다. 이는 가짜 게베르(pseudo-Geber)의 저서 『진리의 발견(De inventione veritatis)』(1300년경 이후)에 처음 기술되었는데, 여기서 왕수는 질산에 염화암모늄을 첨가하여 제조되었다.[16] 자비르 이븐 하이얀이 발견한 왕수는 금까지도 녹일 수 있어서 현자의 돌을 찾으려 하던 연금술사들이 많은 관심을 보였다.[86][87][88][89][90] 염산의 분리가 일어난 것은 약 300년 후였다.[17]
2. 2. 근대 ~ 현대
16세기 후반, 장바티스타 델라 포르타, 안드레아스 리바비우스, 장 베갱 등의 저술을 통해 염산 단독 제조법이 처음으로 보고되었다.[18][55] 이탈리아 화학자 라디슬라오 레티는 그들의 연구 결과를 다음과 같이 요약했다.18세기 유럽의 산업혁명 시기에는 알칼리성 물질에 대한 수요가 증가했다. 프랑스 이수던 출신의 니콜라 르블랑이 개발한 새로운 산업 공정(르블랑 공정)을 통해 탄산나트륨(소다회)을 저렴하게 대량 생산할 수 있게 되었다. 이 르블랑 공정에서는 염산을 부산물로 배출하면서 황산, 석회석, 석탄을 사용하여 일반적인 소금을 소다회로 전환한다. 영국의 1863년 알칼리법 및 다른 국가의 유사한 법률이 제정되기 전까지는 과잉 염산이 대기 중으로 배출되는 경우가 많았다. 초기 예외는 보닝턴 화학 공장으로, 1830년부터 염산을 포집하기 시작하여 생산된 염산을 염화암모늄(염안) 제조에 사용했다.[21] 법률이 제정된 후에는 소다회 생산업체들이 폐가스를 물에 흡수하여 염산을 산업 규모로 생산해야 했다.[22][23][56][57][58]
20세기에 들어서는 염산 부산물이 없는 솔베이 공정이 르블랑 공정을 사실상 대체했다. 이미 염산이 수많은 용도에서 중요한 화학 물질로 자리 잡았기 때문에, 상업적 이익을 위해 다른 생산 방법들이 개발되었고, 그중 일부는 오늘날에도 여전히 사용되고 있다. 2000년 이후로는 주로 산업용 유기 화합물 생산에서 부산물로 생성되는 염화수소를 흡수하여 염산을 제조한다.[22][23][24][57][58][59]
2. 3. 한국에서의 역사
염산은 800년경 연금술사 자비르 이븐 하이얀(Jabir ibn Hayyan, Geber)이 소금과 황산을 반응시키는 과정에서 처음 발견되었다.[86][87] 자비르 이븐 하이얀는 염산 이외에도 다른 많은 물질들을 발견하고, 20권이 넘는 자신의 책에 기록하였다.[88][89] 그 중에서도 염산과 질산을 혼합한 왕수는 금까지도 녹일 수 있어서 현자의 돌을 찾으려 하던 연금술사들이 많은 관심을 보였다.[90]3. 화학적 성질


염화 수소 기체는 수소 원자와 염소 원자 사이에 공유 결합을 가진 분자 화합물이다. 수용액에서는 완전히 해리되어 염화 이온과 수화된 수소 이온(히드로늄 이온)을 형성한다.[25] 고농도 염산에 대한 적외선, 라만, X선 및 중성자 회절 연구를 종합한 결과, 히드로늄 이온이 다른 물 분자와 수소 결합된 복합체를 형성한다는 것을 보여주었다.[26] (이 문제에 대한 자세한 내용은 히드로늄을 참조하십시오.)
수용액에서 염산의 p''K''a 값은 이론적으로 −5.9로 추정된다.[3] 물에 녹인 염화수소 용액은 강산으로 작용하며, HCl 분자의 농도는 사실상 0이다.
염산은 히드로늄 이온과 염화물 이온의 염이다. 그 이온은 H3O+ Cl-로 표기되지만, 실제로는 양이온이 다른 물 분자와 결합하는 경우가 흔하다.[60] 농염산의 적외선 분광법, 라만 분광법, X선, 그리고 중성자 회절을 결합한 연구에 의하면, 이러한 용액 내 H+(aq)의 주된 형태는 H5O2+이며, 여러 방식으로 염화물 이온과 함께 인접한 물 분자에 수소 결합하고 있음이 밝혀졌다.[61] (이 문제에 대한 더 자세한 논의는 히드로늄 이온을 참조)
3. 1. 강산으로서의 성질
염화 수소는 일양성자산으로, 수용액에서 수소 이온을 내놓고 거의 완전히 이온화하여 H3O+과 Cl-을 생성한다.[91][92]:
염산은 강산으로, 물에 거의 완전히 용해되기 때문이다.[91][92] 일양성자산의 산 해리 상수(Ka)는 물에 산이 해리되는 정도를 나타내는데, 염산과 같은 강산은 이온화 상수가 높다.[93] 염화수소의 p*K*a는 -5.9인 것으로 추정된다.[46] 염화나트륨 같은 염화물염을 HCl 수용액에 첨가해도 pH에 미치는 영향은 미미하며, 이는 Cl-이 매우 약한 짝염기이고 HCl이 완전히 해리됨을 보여준다.[62] HCl의 희석 용액은 수화된 H+와 Cl-로의 완전 해리를 가정하여 예측된 pH 값과 가까운 값을 나타낸다.[62]
고농도 염산에 대한 적외선, 라만, X선 및 중성자 회절 연구를 종합한 결과, 히드로늄 이온이 다른 물 분자와 수소 결합된 복합체를 형성한다는 것을 보여주었다.[26]
3. 2. 염화 반응
유기 화합물을 염화시키는 데에 주로 많이 이용되고 산출된다. 예로 클로로벤젠의 생성을 들 수 있다. 이때는 염화 수소가 생성된다.:
위의 예처럼 수소가 염소로 치환되는 경우에는 이미 있던 수소 원자가 염소와 결합해 염화 수소를 이루는 경우가 많다.
3. 3. 금속과의 반응
염산은 아연(Zn)과 같은 금속을 부식시키는 데 쓰인다.[20] 아연(Zn)이 염산과 반응하면 염화아연(ZnCl₂)과 수소 기체(H₂)가 생성된다.[20]:
이는 이온화 경향에 따라 일어나는 화학 반응이므로, 수소보다 이온화 경향이 낮은 금, 은 등은 염산에 부식되지 않는다.[20] 17세기 화학자 다니엘 젠너트와 로버트 보일은 금속을 빠르게 용해시키는 무기산의 성질을 이용하여 물질의 복합적 본성을 보여주는 실험을 했다.[20]
4. 물리적 성질
수소 이온 농도 지수, 점성, 비열, 증기압, 끓는점, 녹는점 같은 염산의 물리적 성질은 염화 수소의 농도나 몰 농도에 따라 달라진다.[91][92][95] 염산은 HCl과 H2O의 이성분 화합물이며, 염화 수소 농도 20.2%에서 108.6°C의 불변 끓음 혼합물을 형성한다.[95]
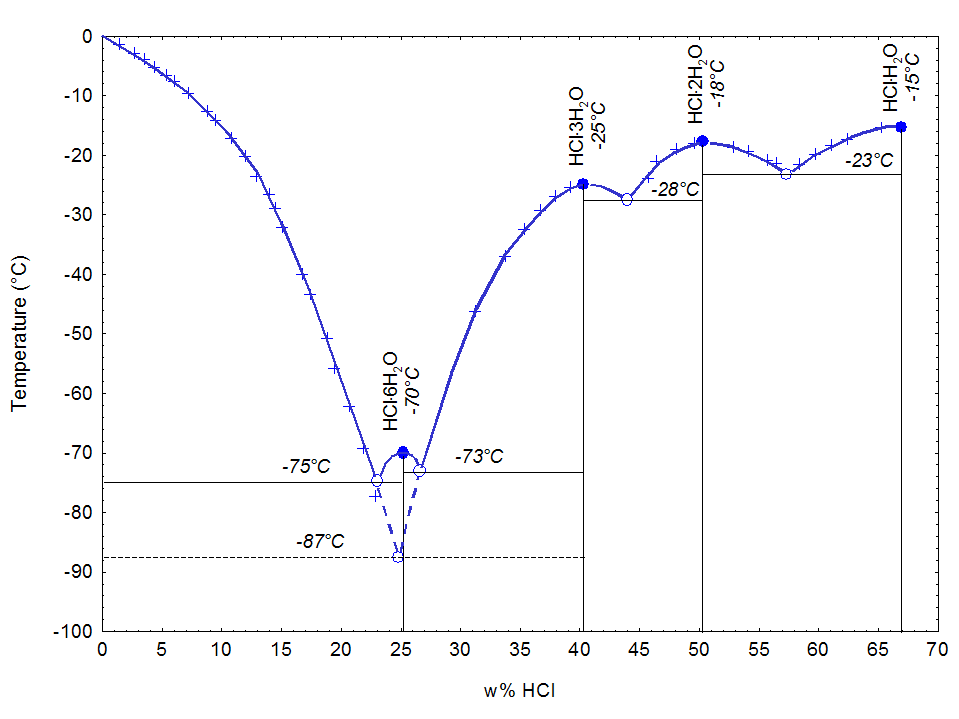
염산에는 [H3O]Cl (68% HCl), [H5O2]Cl (51% HCl), [H7O3]Cl (41% HCl), [H3O]Cl·5H2O (25% HCl) 그리고 얼음 (0% HCl)의 결정 형태 사이에 네 가지 일정 결정화 공융점이 있다. 얼음과 [H7O3]Cl 결정화 사이에는 24.8%의 준안정 공융점도 있다.[65] 이들은 모두 히드로늄염이다.
5. 제법
염산은 일반적으로 염화수소를 물에 녹여 산업적으로 제조된다. 염화수소는 여러 가지 방법으로 생성될 수 있으므로, 염산의 전구체는 여러 가지가 존재한다. 대규모 염산 생산은 거의 항상 다른 화학 물질의 산업 규모 생산과 통합되어 있다. 예를 들어 염소알칼리 공정은 수산화물, 수소 및 염소를 생산하는데, 이 중 염소는 HCl을 생산하는 데 사용될 수 있다.[30][31]
염화수소는 염소와 수소를 결합하여 생성된다.
:Cl2 + H2 → 2 HCl
이 반응은 발열 반응이므로, 설비를 HCl 로 또는 HCl 버너라고 한다. 생성된 염화수소 가스는 흡수되어 탈이온수에 흡수되고, 화학적으로 순수한 염산이 생성된다. 이 반응은 식품 산업 등에서 사용되는 매우 순수한 제품을 제공할 수 있다.
염산은 산업적으로 염화수소를 물에 녹여 제조하는 경우가 많다. 염화수소는 여러 가지 방법으로 생성될 수 있으므로, 염산의 전구체는 여러 가지가 존재한다. 염산의 대규모 생산은 대부분 수산화물, 수소, 염소를 생산하는 염소알칼리 공정과 같은 산업 규모의 다른 화학 물질 생산과 통합되어 있다. 이때 발생하는 수소와 염소를 이용하여 HCl을 생성할 수 있다.[66][67]
염화 나트륨(NaCl)과 황산(H₂SO₄)을 반응시켜 염화 수소를 얻는 방법이다. 주로 생산 규모가 작은 실험실 등에서 많이 이용된다.[96]
: 2NaCl + H2SO4 → Na2SO4 + 2HCl
위 반응은 상온에서 일어나고, 더 많은 염화 수소를 얻기 위해서는 습기가 없는 상태에서 온도를 200°C까지 올려야 한다.[96]
: NaCl + NaHSO4 → HCl + Na2SO4
공업적으로 염산은 염화수소를 물에 녹여 제조한다. 염화수소는 여러 가지 방법으로 생성될 수 있는데, 전기분해에서 발생한 수소와 염소를 직접 반응시켜 얻기도 한다.[66][67]
:H2 + Cl2 → 2HCl
이 반응은 발열 반응이므로, 설비를 HCl 로 또는 HCl 버너라고 한다. 생성된 염화수소 가스는 흡수되어 탈이온수에 흡수되고, 화학적으로 순수한 염산을 생성한다. 이 반응은 식품 산업 등에서 사용되는 매우 순수한 제품을 제공할 수 있다.[30][31]
염소와 플루오린이 들어있는 유기 화합물(예: 폴리테트라플루오로에틸렌, 염화 플루오린화 탄소, 클로로아세트산, 폴리염화 비닐 등)을 이용한 제법은 염산 제조에서 가장 큰 비중을 차지한다. 이 방법에서는 염산은 생성한 곳에서 사용되는 경우가 많다. 이때는 수소나 플루오린이 염소로 치환된다.
:R-H + Cl2 → R-Cl + HCl
:R-Cl + HF → R-F + HCl
염산의 대규모 생산은 대부분 수산화물, 수소, 염소를 생산하는 염소알칼리 공정과 같은 산업 규모의 다른 화학 물질 생산과 통합되어 있다. 이때 발생하는 수소와 염소를 이용하여 HCl을 생성할 수 있다.[66][67]
염산은 최대 38% HCl(고농축 등급) 용액으로 생산된다. 화학적으로는 40%를 약간 넘는 고농도로 만드는 것이 가능하지만, 증발률이 매우 높기 때문에 보관 및 취급에는 가압이나 냉각과 같은 특별한 예방 조치가 필요하다. 따라서 대량 생산을 위한 공업용 등급은 30%~35%이며, 수송 효율과 증발에 의한 제품 손실의 균형을 맞추도록 최적화되어 있다. 미국에서는 20%~32% 용액이 염산으로 판매된다. 미국 가정용 용액은 주로 세척에는 일반적으로 10%~12%의 것을 사용하므로 사용 전에 희석하는 것이 강력히 권장된다. 염산이 가정용 세척제인 ''Spirits of Salt''로 판매되는 영국에서는 효력이 미국의 공업용 등급과 같다.[57] 이탈리아 등 다른 국가에서는 가정용 또는 공업용 세척제인 염산이 ''Acido Muriatico''로 판매되며, 그 농도는 5%~32% 범위이다.
전 세계 주요 생산업체로는 HCl 가스 환산으로 연간 200만 톤(2 Mt/년)을 생산하는 다우(Dow Chemical)이 있으며, 또한 , 도소(東ソー), 악조노벨(AkzoNobel), 그리고 가 각각 0.5~1.5 Mt/년 생산하고 있다. 비교하면, HCl로 표시되는 세계 총 생산량은 20 Mt/년으로 추정되며, 그 내역은 직접 합성에서 3 Mt/년, 나머지는 유기 합성 및 유사한 합성에서의 부산물이다.[57] 참고로, 2016년도 일본 국내 생산량은 합성 696,835톤, 부생 929,311톤, 소비량은 533,600톤이다.[68]
5. 1. 만하임 공정
염화 나트륨(NaCl)과 황산(H₂SO₄)을 반응시켜 염화 수소를 얻는 방법이다. 주로 생산 규모가 작은 실험실 등에서 많이 이용된다.[96]:
위 반응은 상온에서 일어나고, 더 많은 염화 수소를 얻기 위해서는 습기가 없는 상태에서 온도를 200°C까지 올려야 한다.[96]
:
5. 2. 공업적 제법
공업적으로 염산은 염화수소를 물에 녹여 제조한다. 염화수소는 여러 가지 방법으로 생성될 수 있는데, 전기분해에서 발생한 수소와 염소를 직접 반응시켜 얻기도 한다.[66][67]:
이 반응은 발열 반응이므로, 설비를 HCl 로 또는 HCl 버너라고 한다. 생성된 염화수소 가스는 흡수되어 탈이온수에 흡수되고, 화학적으로 순수한 염산을 생성한다. 이 반응은 식품 산업 등에서 사용되는 매우 순수한 제품을 제공할 수 있다.[30][31]
염소와 플루오린이 들어있는 유기 화합물(예: 폴리테트라플루오로에틸렌, 염화 플루오린화 탄소, 클로로아세트산, 폴리염화 비닐 등)을 이용한 제법은 염산 제조에서 가장 큰 비중을 차지한다. 이 방법에서는 염산은 생성한 곳에서 사용되는 경우가 많다. 이때는 수소나 플루오린이 염소로 치환된다.
:
염산의 대규모 생산은 대부분 수산화물, 수소, 염소를 생산하는 염소알칼리 공정과 같은 산업 규모의 다른 화학 물질 생산과 통합되어 있다. 이때 발생하는 수소와 염소를 이용하여 HCl을 생성할 수 있다.[66][67]
염산은 최대 38% HCl(고농축 등급) 용액으로 생산된다. 화학적으로는 40%를 약간 넘는 고농도로 만드는 것이 가능하지만, 증발률이 매우 높기 때문에 보관 및 취급에는 가압이나 냉각과 같은 특별한 예방 조치가 필요하다. 따라서 대량 생산을 위한 공업용 등급은 30%~35%이며, 수송 효율과 증발에 의한 제품 손실의 균형을 맞추도록 최적화되어 있다. 미국에서는 20%~32% 용액이 염산으로 판매된다. 미국 가정용 용액은 주로 세척에는 일반적으로 10%~12%의 것을 사용하므로 사용 전에 희석하는 것이 강력히 권장된다. 염산이 가정용 세척제인 ''Spirits of Salt''로 판매되는 영국에서는 효력이 미국의 공업용 등급과 같다.[57] 이탈리아 등 다른 국가에서는 가정용 또는 공업용 세척제인 염산이 ''Acido Muriatico''로 판매되며, 그 농도는 5%~32% 범위이다.
전 세계 주요 생산업체로는 HCl 가스 환산으로 연간 200만 톤(2 Mt/년)을 생산하는 다우(Dow Chemical)이 있으며, 또한 , 도소(東ソー), 악조노벨(AkzoNobel), 그리고 가 각각 0.5~1.5 Mt/년 생산하고 있다. 비교하면, HCl로 표시되는 세계 총 생산량은 20 Mt/년으로 추정되며, 그 내역은 직접 합성에서 3 Mt/년, 나머지는 유기 합성 및 유사한 합성에서의 부산물이다.[57] 참고로, 2016년도 일본 국내 생산량은 합성 696,835톤, 부생 929,311톤, 소비량은 533,600톤이다.[68]
6. 용도
염산은 강한 무기산으로 산업용 공정에 사용된다. 인체에는 위산의 형태로 존재한다.
염산은 금속 정련과 같은 많은 산업 공정에 사용되는 강한 무기산이다. 용도에 따라 필요한 제품의 품질이 결정되는 경우가 많다.[22] 염산이 아닌 염화수소(hydrogen chloride)는 염화비닐 및 디클로로에탄과 같은 산업 유기 화학에서 더 널리 사용된다.[32]
염산은 금속의 정제 등 많은 산업 공정에 사용되는 강한 무기산이다. 많은 경우, 용도에 따라 요구되는 제품의 품질이 결정된다.[57] 염산이 아닌 염화수소는, 예를 들어 클로로에틸렌(클로로에텐) 및 디클로로에탄용 유기화학 공업에서 더 널리 사용되고 있다.[69]
6. 1. 산업 분야
염산은 금속 정련 등 다양한 산업 공정에 사용되는 강한 무기산이다.[22] 용도에 따라 필요한 제품의 품질이 결정되는 경우가 많다.[22][57]염산의 가장 중요한 용도 중 하나는 철강의 산세척으로, 압출, 압연, 도금 등 후속 공정 전에 철이나 강에서 녹이나 산화철 찌꺼기를 제거하는 데 사용된다.[22][24][57][59] 일반적으로 18% 농도의 염산이 탄소강 표면에 녹을 제거하는 데 사용된다.[88][97]
:
여기서 나온 산화철로 몇 가지 공정을 거치면 다시 염화 수소로 쓸 수 있는데, 가장 많이 이용되는 방법은 다음과 같다.[88]
:
철강 산세척 산업은 염산 재생 공정을 개발하여 폐산세척액에서 HCl을 회수할 수 있게 했다. 폐산의 회수를 통해 폐쇄된 산 루프가 구축된다.[24][59] 재생 공정의 부산물인 산화철(III)은 다양한 2차 산업에서 사용된다.[22][57]
염산은 염화 바이닐, 다이클로로에테인, 폴리염화 비닐 등의 유기 화합물 생산에도 쓰인다.[97] 염화수소는 염화비닐 및 디클로로에탄과 같은 산업 유기 화학에서 더 널리 사용된다.[32][69] 폴리카보네이트, 활성탄, 아스코르빈산(비타민 C)을 비롯한 유기 화합물뿐 아니라 약 역시 염산을 이용하여 생산한다.[97]
:(옥시 염소화로 생성된 다이클로로에테인)
:나무 + HCl + 열 → 활성 탄소 (탄소의 활성화)
염산은 수소 이온 농도 지수가 낮아 염기성 용액을 중화 반응하는 데 사용된다.[97]
:
식품, 제약, 식수 등 순도가 요구되는 산업에서는 고품질 염산을 사용하여 공정수의 pH를 조절하고, 순도 요구가 덜 까다로운 산업에서는 기술 등급 염산으로 폐수를 중화하고 수영장의 pH를 조절한다.[24][59]
고품질 염산은 이온 교환 수지의 재생에도 사용된다. 양이온 교환은 수용액에서 Na+ 및 Ca2+와 같은 이온을 제거하여 탈염수를 생산하는 데 널리 사용된다. 산은 수지에서 양이온을 씻어내는 데 사용된다.[22][57] Na+는 H+로, Ca2+는 2H+로 치환된다. 이온 교환체와 탈염수는 모든 화학 산업, 식수 생산 및 많은 식품 산업에서 사용된다.[22][57]
6. 2. 기타 용도
염산은 금속 정련과 같은 많은 산업 공정에 사용되는 강한 무기산이다.[22] 가죽 가공, 가정용 세척[34] 및 건축[24] 등 다양한 소규모 용도로 사용된다. 원유 생산은 염산을 암석층에 주입하여 암석의 일부를 용해하고 큰 기공 구조를 생성함으로써 자극할 수 있다. 유정 산처리는 북해 유전 생산 산업에서 일반적인 공정이다.염산은 탄산칼슘을 용해하는 데 사용되어 왔는데, 주전자의 물때를 제거하거나 벽돌의 모르타르를 제거하는 데 사용된다. 벽돌에 사용될 경우 모르타르와의 반응은 산이 모두 전환되어 염화칼슘, 이산화탄소 및 물을 생성할 때까지 계속된다.[71][59]
염산을 포함하는 많은 화학 반응은 식품, 식품 재료 및 식품 첨가물 생산에 적용된다. 대표적인 제품으로는 아스파탐, 과당, 구연산, 라이신, 식품 향상제로 사용되는 가수분해 식물성 단백질 및 젤라틴 생산이 있다. 필요에 따라 식품 등급(특급 순도) 염산을 최종 제품에 적용할 수 있다.[24][59]
7. 위험성 및 안전
고농도의 염산은 다량의 증기가 발생하며 이는 눈, 피부, 창자 등의 생체 조직에 손상을 입힐 수 있다. 또 염산을 과망가니즈산 칼륨이나 차아염소산나트륨 등에 섞으면 유독한 염소 기체가 생성된다.[98]
:
:
염산은 강산이기 때문에 생체 조직 및 많은 물질에 대해 부식성이 있지만, 고무에는 부식성이 없다. 일반적으로 농축용액을 취급할 때는 고무 보호 장갑 및 관련 보호구를 사용한다.[69][32] 증기 또는 안개는 호흡기 위험을 초래하며, 염산을 특히 포집하도록 설계된 카트리지가 장착된 방진마스크를 사용하여 부분적으로 완화할 수 있다. 공기 중의 산은 눈에 자극을 주며, 보호 안경이나 마스크를 사용해야 할 수 있다.
염산 자체가 폭발하지는 않으나 염산에서 생성된 수소는 폭발할 수 있다. 이온화 경향이 큰 알칼리 금속이나 알칼리 토금속과 염산이 반응하면 금속이 부식해서 다음과 같은 반응이 일어난다.
:
이온화 경향이 큰 칼륨, 칼슘, 나트륨 등의 금속과 반응하면 수소기체가 많이 발생하고 온도가 높은 상황에는 폭발할 수도 있다.
염산은 헤로인, 코카인 및 메스암페타민 생산에 사용되기 때문에, 1988년의 에 따라 II표 전구체로 지정되어 있다.[77][41][42]
8. 환경
염산은 여러 산업 공정에서 사용되지만, 환경 오염을 유발할 수 있다. 국가 오염 물질 목록에 따르면 염산은 주의해야 할 물질 중 하나이다.
참조
[1]
뉴스
spirits of salt
http://www.thefreedi[...]
2012-05-29
[2]
서적
Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013
Royal Society of Chemistry
2014
[3]
논문
Acidity of Strong Acids in Water and Dimethyl Sulfoxide
2016-05-01
[4]
웹사이트
Hydrochloric acid
https://www.chemsrc.[...]
[5]
Sigma-Aldrich
2022-03-16
[6]
웹사이트
Hydrochloric Acid
http://www.bayermate[...]
2010-09-16
[7]
웹사이트
Muriatic Acid
http://www.ppg.com/c[...]
PPG Industries
2010-09-10
[8]
간행물
Mémoire sur l'iode
https://books.google[...]
1814
[9]
서적
[10]
논문
Chemistry in Iraq and Persia in the Tenth Century A.D.
http://www.southasia[...]
[11]
서적
The Alchemy of Al-Razi: A Translation of the "Book of Secrets"
CreateSpace Independent Publishing Platform
2015
[12]
서적
The Origins of Chemistry
Oldbourne
[13]
서적
[14]
서적
[15]
서적
[16]
논문
Vitriol in the History of Chemistry
http://www.chemicke-[...]
[17]
서적
[18]
서적
[19]
논문
How Old Is Hydrochloric Acid?
https://www.jstor.or[...]
[20]
서적
Atoms and Alchemy: Chymistry and the Experimental Origins of the Scientific Revolution
University of Chicago Press
[21]
논문
Bonnington Chemical Works (1822-1878): Pioneer Coal Tar Company
2019
[22]
서적
Chemicals Economics Handbook
SRI International
[23]
서적
A History of the International Chemical Industry
University of Pennsylvania Press
[24]
서적
[25]
서적
General chemistry: principles and modern applications
Prentice Hall
2002
[26]
논문
Structure of Concentrated HCl Solutions
1998-01-01
[27]
서적
Gmelins Handbuch der Anorganischen Chemie
Chemie Berlin
[28]
서적
Gmelins Handbuch der Anorganischen Chemie
Chemie Weinheim
[29]
서적
Aspen Properties
Aspen Technology
[30]
서적
CRC Handbook of Chemistry and Physics
CRC Press
[31]
서적
Perry's Chemical Engineers' Handbook
McGraw-Hill Book Company
[32]
서적
Hydrochloric Acid
[33]
서적
Vogel's Quantitative Chemical Analysis
Prentice Hall
[34]
뉴스
Household plc: really filthy bathroom
https://www.telegrap[...]
2010-03-31
[35]
서적
Human Biology and Health
https://archive.org/[...]
Prentice Hall
[36]
웹사이트
Digestive Aids: Hydrochloric acid
http://www.healthy.n[...]
2000-12-06
[37]
서적
Textbook of Medical Physiology
W.B. Saunders Company
[38]
웹사이트
Control and Physiologic Effects of Secretin
http://www.vivo.colo[...]
Colorado State University
2003-03-18
[39]
논문
The cell biology of osteoclast function
https://journals.bio[...]
2000-02-01
[40]
웹사이트
Regulation (EC) No 1272/2008 of the European Parliament and of Council of 16 December 2008 on classification, labelling and packaging of substances and mixtures, amending and repealing Directives 67/548/EEC and 1999/45/EC, and amending Regulation (EC) No 1907/2006
https://eur-lex.euro[...]
EUR-lex
2008-12-16
[41]
간행물
List of precursors and chemicals frequently used in the illicit manufacture of narcotic drugs and psychotropic substances under international control
http://www.incb.org/[...]
International Narcotics Control Board
2007-01-01
[42]
보고서
Chemicals Required for the Illicit Manufacture of Drugs
https://www.unodc.or[...]
UNDOC
1998-01-01
[43]
웹사이트
Hydrochloric Acid
http://www.bayermate[...]
[44]
웹사이트
spirits of salt
http://www.thefreedi[...]
[45]
서적
Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013
The 왕립화学会
2014-01-01
[46]
논문
Acidity of Strong Acids in Water and Dimethyl Sulfoxide
2016-05-01
[47]
웹사이트
Hydrochloric acid
https://www.chemsrc.[...]
[48]
웹사이트
Hydrochloric acid
Sigma-Aldrich
[49]
웹사이트
塩酸の名称についての疑問
http://www.page.sann[...]
2004-12-26
[50]
서적
Mémoire sur l'iode
https://books.google[...]
1814-01-01
[51]
서적
The Origins of Chemistry
Oldbourne
[52]
서적
[53]
서적
[54]
논문
Vitriol in the History of Chemistry
http://www.chemicke-[...]
[55]
서적
[56]
논문
Bonnington Chemical Works (1822-1878): Pioneer Coal Tar Company
2019-01-01
[57]
서적
Chemicals Economics Handbook
SRIインターナショナル
[58]
서적
A History of the International Chemical Industry
University of Pennsylvania Press
[59]
서적
Greenwood&Earnshaw
[60]
서적
General chemistry: principles and modern applications
Prentice Hall
2002-01-01
[61]
논문
Structure of Concentrated HCl Solutions
1998-01-01
[62]
논문
pH Paradoxes: Demonstrating That It Is Not True That pH ≡ −log[H+]
2006-05-01
[63]
서적
Gmelins Handbuch der Anorganischen Chemie
Chemie Berlin
[64]
서적
Gmelins Handbuch der Anorganischen Chemie
Chemie Weinheim
[65]
서적
Aspen Properties
Aspen Technology
[66]
서적
CRC Handbook of Chemistry and Physics
CRC Press
[67]
서적
Perry's Chemical Engineers' Handbook
McGraw-Hill Book Company
[68]
웹사이트
経済産業省生産動態統計年報 化学工業統計編
https://www.meti.go.[...]
[69]
서적
Hydrochloric Acid
[70]
서적
Vogel's Quantitative Chemical Analysis
Prentice Hall
[71]
뉴스
Household plc: really filthy bathroom
https://www.telegrap[...]
2010-03-31
[72]
서적
Human Biology and Health
https://archive.org/[...]
Prentice Hall
[73]
웹사이트
Digestive Aids: Hydrochloric acid
http://www.healthy.n[...]
2000-12-06
[74]
서적
Textbook of Medical Physiology
W.B.サンダース社
[75]
웹사이트
Control and Physiologic Effects of Secretin
http://www.vivo.colo[...]
Colorado State University
2003-03-18
[76]
웹사이트
Regulation (EC) No 1272/2008 of the European Parliament and of Council of 16 December 2008 on classification, labelling and packaging of substances and mixtures, amending and repealing Directives 67/548/EEC and 1999/45/EC, and amending Regulation (EC) No 1907/2006
https://eur-lex.euro[...]
EUR-lex
2008-12-16
[77]
간행물
List of precursors and chemicals frequently used in the illicit manufacture of narcotic drugs and psychotropic substances under international control
http://www.incb.org/[...]
国際麻薬統制委員会
2007-01
[78]
웹인용
Hydrochloric Acid
http://www.bayermate[...]
[79]
웹인용
spirits of salt
http://www.thefreedi[...]
[80]
서적
Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013
Royal Society of Chemistry
2014
[81]
논문
Acidity of Strong Acids in Water and Dimethyl Sulfoxide
2016-05-06
[82]
웹인용
Hydrochloric acid
https://www.chemsrc.[...]
[83]
Sigma-Aldrich
[84]
논문
The Wilkins Lecture. Sir Humphry Davy, Bt., P.R.S. 1778-1829
[85]
서적
[86]
서적
http://books.google.[...]
[87]
논문
http://www.chemicke-[...]
[88]
서적
[89]
논문
http://molinterv.asp[...]
[90]
서적
[91]
서적
https://archive.org/[...]
[92]
서적
https://archive.org/[...]
[93]
웹인용
http://www.chembuddy[...]
[94]
서적
[95]
서적
[96]
서적
http://books.google.[...]
[97]
서적
[98]
기타
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com