녹농균
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
녹농균(Pseudomonas aeruginosa)은 그리스어에서 유래된 이름으로, 다양한 환경에서 발견되는 그람 음성 세균이다. 이 세균은 녹색 색소인 피오시아닌과 피오베르딘을 생성하여 배양 시 청록색을 띠며, 상처 감염 시 녹색 고름을 생성하는 특징이 있다. 녹농균은 토양, 물 등 자연 환경에 널리 존재하며, 사람과 동물의 소화관에도 소량 존재한다. 면역력이 저하된 환자에게 기회 감염을 일으키며, 폐렴, 요로 감염, 피부 및 연조직 감염, 패혈증 등을 유발할 수 있다. 녹농균은 항생제에 대한 내성이 강하여 치료가 어렵고, 다제내성 녹농균 감염증이 의료 문제로 대두되고 있다. 진단은 세균 배양 검사 및 색소 생성 확인을 통해 이루어지며, 치료에는 항균제를 사용한다.
더 읽어볼만한 페이지
- 1872년 기재된 세균 - 탄저균
탄저균은 바실러스속의 그람 양성 포자 형성 간균으로, 탄저병을 일으키는 병원체이며, 생물학적 무기로 사용될 수 있을 만큼 강력한 포자를 형성하고 캡슐과 외독소를 통해 숙주를 공격하며, 백신과 항생제로 예방 및 치료가 가능하다. - 1872년 기재된 세균 - 고초균
고초균은 극한 환경에서 내생포자를 형성하는 호기성 그람 양성균으로, 유전자 조작이 용이하여 모델 생물로 사용되며, 낫토 제조, 효소 생산, 살균제 등 다양한 분야에 활용되고 안전성이 평가되어 식품 및 우주 비행 연구에도 사용된다. - 슈도모나스목 - 모락셀라
모락셀라는 점막에 공생하는 세균 속으로, 일부 종은 호흡기 감염이나 안검결막염, 소 전염성 각막결막염과 같은 질병을 유발할 수 있다. - 슈도모나스목 - 슈도모나스 푸티다
슈도모나스 푸티다는 산소가 있는 환경에 서식하며 유기 용매 분해 능력을 활용해 환경 오염 물질 정화, 식물 병원균 방제, 유기 화합물 합성, 그리고 일부 균주는 카페인 분해에 기여할 수 있는 세균이다.
| 녹농균 - [생물]에 관한 문서 | |
|---|---|
| 기본 정보 | |
 | |
| 학명 | Pseudomonas aeruginosa |
| 명명자 | (Schröter 1872) Migula 1900 |
| 이명 | Bacterium aeruginosum Schroeter 1872 Bacterium aeruginosum Cohn 1872 Micrococcus pyocyaneus Zopf 1884 Bacillus aeruginosus (Schroeter 1872) Trevisan 1885 Bacillus pyocyaneus (Zopf 1884) Flügge 1886 Pseudomonas pyocyanea (Zopf 1884) Migula 1895 Bacterium pyocyaneum (Zopf 1884) Lehmann and Neumann 1896 Pseudomonas polycolor Clara 1930 Pseudomonas vendrelli nomen nudum 1938 |
| 분류 | |
| 도메인 | 세균 |
| 문 | 프로테오박테리아 |
| 강 | 감마프로테오박테리아 |
| 목 | 슈도모나스목 |
| 과 | 슈도모나스과 |
| 속 | 슈도모나스 |
| 특징 | |
| 설명 | 녹농균은 의료 시설 환경에서 발견되는 슈도모나스속의 기회 감염균임. |
2. 명칭
''Pseudomonas''라는 단어는 그리스어 ''pseudēs''(ψευδής, 거짓)와 monasla, 그리스어: μονάς, 단일 단위)에서 유래되어 "가짜 단위"를 의미한다. 어간 단어 ''mon''은 미생물학 초기에 미생물과 세균을 지칭하는 데 사용되었다.[7]
슈도모나스속에 속하는, 0.7 x 2 μm 정도 크기의 그람 음성막대 세균이다. 아포는 형성하지 않으며, 균체의 한쪽 끝에 1개의 편모(드물게 2~3개)를 가지고 활발하게 운동한다.[79] 또한 균체의 한쪽 끝에는 섬모를 가지고 있다.
종명 ''aeruginosa''는 라틴어로 녹청 ("구리 녹")을 의미하며, 이 종의 실험실 배양에서 나타나는 청록색을 나타낸다.[7] 이 청록색 색소는 ''P. aeruginosa''의 두 가지 이차 대사 산물인 피오시아닌 (파란색)과 피오베르딘 (녹색)의 조합으로, 배양체의 청록색 특성을 부여한다.
피오시아닌과 피오베르딘이라는 이름은 그리스어에서 유래되었으며, ''pyo-''는 "고름"을 의미하고,[9] ''cyanin''은 "파란색"을 의미하며,[10] ''verdine''은 "녹색"을 의미한다. 따라서 "피오시아닌 세균"이라는 용어는 ''P. aeruginosa'' 감염의 특징인 "파란 고름"을 특별히 지칭한다.
녹농균이라는 명칭은, 본 균이 상처에 감염(창상 감염)되었을 때, 종종 녹색 농이 보이는 것에서 유래되었다. 학명인 ''Pseudomonas aeruginosa''의 종명인 ''aeruginosa''도 "녹청으로 가득 찬"을 의미하는 그리스어에서 유래되었으며, 본 균이 만드는 녹색 색소(피오시아닌)에 기인한 명칭이다.
3. 생물학적 특징
절대 호기성 생물이며, 일반적으로 산소가 없는 환경에서는 생존할 수 없다. 이는 주로 호흡에 의해서만 에너지를 생산하고 발효를 하지 않기 때문이다. 다른 병원성 세균에 비해 발육에 특별한 영양을 필요로 하지 않기 때문에 (영양 요구성이 낮음), 증식하기 쉬운 세균이다. 미량의 유기물로도 증식이 가능하며, 장기간 보존하고 있는 증류수 용기에도 혼입된 약간의 유기물을 영양원으로 녹농균이 증식하는 경우가 있다. 인공적으로 배양하는 경우에도, 암모늄염을 포함하는 무기염배지에 탄소원이 되는 한 종류의 유기물이 있으면 배양이 가능하다. 최적 발육 온도는 37℃ 전후이며, 42℃ 정도의 고온에서도 증식이 가능하지만, 저온(4℃ 이하)에서는 증식하지 않는다. 유기물을 분해하여 아민의 일종인 트리메틸아민을 생산하기 때문에 특유의 냄새(썩은 생선 냄새)가 난다.
NAC 배지를 통해 선택분리된다.
''P. aeruginosa''는 부분적 또는 완전한 산소 고갈 상태에서 증식하는 데 잘 적응되어 있어 통성 혐기성 세균이다. 이 미생물은 질산염 또는 아질산염을 전자 수용체로 사용하여 혐기성 성장을 할 수 있다. 산소, 질산염, 아질산염이 없을 때는 아르기닌과 피루브산을 기질 수준 인산화를 통해 발효시킬 수 있다.[24] 또한, ''P. aeruginosa''가 생성하는 페나진은 생물막 깊숙한 곳에서 세포의 생존을 돕는 전자 셔틀 역할을 할 수 있다.[25]
토양, 담수, 해수 등 자연 환경의 모든 곳에 서식하는 환경 상재 미생물의 일종으로, 습윤한 환경을 특히 좋아한다. 또한 사람과 동물의 소화관 내부에도 소수 존재하며 장내 세균의 일종으로, 건강한 성인의 약 15%, 병원 내에서는 30~60%가 이 균을 보유하고 있다고 한다.
녹농균은 열에 대한 저항성은 다른 세균과 동등한 수준으로 비교적 약한 편에 속하지만(55℃ 1시간 처리로 사멸), 소독약이나 항생 물질 등에 대해서는 광범위하고 강한 저항성을 가지고 있다.(약제 내성 절에 상세 설명). 이 때문에 장기간 방치된 손 세정용 소독액 등에서도 분리될 수 있으며, 원내 감염 등과의 관련성으로 인해 특히 의료 분야에서 주목받고 있다.
''P. aeruginosa''의 동정은 개별 분리주가 종종 운동성을 보이지 않는다는 사실로 인해 복잡해질 수 있다. 집락 형태 자체도 여러 가지 변종을 나타낸다. 주요 두 가지 유형은 크고 매끄럽고 평평한 가장자리와 융기된 중심부를 가지며, 작고 거칠고 볼록하다.[82] 세 번째 유형인 점액성도 발견될 수 있다. 큰 집락은 일반적으로 임상 환경에서 발견될 수 있는 반면, 작은 집락은 자연에서 발견된다.[82] 그러나 세 번째 유형은 생물학적 환경에 존재하며 호흡기 및 비뇨기에서 발견되었다.[82] 또한, 유전자 lasR의 돌연변이는 집락 형태를 급격하게 변화시키고 일반적으로 젤라틴 가수 분해 또는 용혈 실패로 이어진다.
특정 조건에서 ''P. aeruginosa''는 다양한 색소를 분비할 수 있는데, 여기에는 피오시아닌(파란색), 피오베르딘(노란색 및 형광), 피오루빈 (빨간색) 및 피오멜라닌 (갈색)이 포함된다. 이를 사용하여 유기체를 식별할 수 있다.[83]
''P. aeruginosa''의 임상적 식별에는 피오시아닌과 형광물질의 생성, 그리고 42 °C에서 생장 능력을 확인하는 것이 포함될 수 있다. ''P. aeruginosa''는 경유 및 제트 연료에서 생장할 수 있으며, 여기서 탄화수소를 사용하는 미생물로 알려져 미생물 부식을 일으킨다.[84] 이는 때때로 외관 때문에 부적절하게 "조류"라고 불리는 어두운 젤리 모양의 매트를 생성한다.
다음 표는 ''Pseudomonas aeruginosa''의 형태학적, 생리학적 및 생화학적 특성을 보여준다.검사 유형 검사 특징 집락 특징 크기 큼 유형 매끄러움 색상 모양 평평함 형태학적 특징 모양 막대 생리학적 특징 운동성 + 6.5% NaCl에서의 성장 - 생화학적 특징 그람 염색 - 산화 효소 + 카탈라아제 + 산화적-발효 운동성 + 메틸 레드 - 보게스-프로스카우어 - 인돌 - H2S 생성 - 요소 분해 효소 - 질산염 환원 효소 + β-갈락토시다아제 페닐알라닌 디아미나아제 - DNA 분해 효소 - 리파아제 + 라이신 탈카복실라아제 - 색소 + (푸르스름한 녹색 색소) 용혈 베타/가변적 가수 분해 젤라틴 + 카제인 이용 글리세롤 + 갈락토스 - D-글루코스 + D-과당 + D-만노스 - 만니톨 + 시트르산염 + 말토스 - 수크로스 - 락토스 -
참고: + = 양성, - = 음성
3. 1. 게놈
녹농균(''Pseudomonas aeruginosa'')의 게놈은 비교적 큰 환형 염색체(5.5–6.8 Mb)로 구성되어 있으며, 5,500개에서 6,000개의 개방형 읽기 틀(open reading frame)을 포함하고, 때로는 균주에 따라 다양한 크기의 플라스미드를 포함한다.[11] 서로 다른 389개의 ''P. aeruginosa'' 균주 게놈을 비교한 결과, 17.5%만이 공유되었으며, 이 게놈 부분은 ''P. aeruginosa'' 핵심 게놈이다.[12]
비교 게놈 연구(2020년)는 ''Pseudomonas'' 속에 속하는 494개의 완전한 게놈을 분석했으며, 그중 189개는 ''P. aeruginosa'' 균주였다.[13] 이 연구는 단백질 수가 5500개에서 7352개(평균: 6192개) 사이였고, GC 함량은 65.6%에서 66.9%(평균: 66.1%) 사이임을 관찰했다.[13] 이 비교 분석을 통해 1811개의 aeruginosa-core 단백질이 추가로 확인되었으며, 이는 프로테옴의 30% 이상을 차지한다. ''P. aeruginosa''는 매우 잘 정의된 단일 계통 종이지만, 계통 발생학적으로나 ANIm 값 측면에서 단백질 함량 측면에서 놀랍도록 다양하며, 여러 분석에 따라 매우 역동적인 부속 프로테옴을 보여준다.[13][14][15][16] 평균적으로 산업 균주가 가장 큰 게놈을 가지고, 그 다음이 환경 균주, 그리고 임상 분리주 순이다.[13][17]
| 균주: | VRFPA04 | C3719 | PAO1 | PA14 | PACS2 |
|---|---|---|---|---|---|
| 염색체 크기 (bp) | 6,818,030 | 6,222,097 | 6,264,404 | 6,537,648 | 6,492,423 |
| ORF | 5,939 | 5,578 | 5,571 | 5,905 | 5,676 |
동일한 비교 연구(494개의 ''Pseudomonas'' 균주, 그중 189개가 ''P. aeruginosa'')는 1811개의 ''P. aeruginosa'' 핵심 단백질 중 41개가 이 종에만 존재하고 속의 다른 구성원에는 존재하지 않으며, 41개 중 26개는 가상으로 주석 처리되었다는 것을 확인했다. 또한, 다른 19개의 상동 단백질 그룹은 최소 188/189개의 ''P. aeruginosa'' 균주에 존재하며 속의 다른 모든 균주에는 존재하지 않는다.
3. 2. 집단 구조
녹농균의 집단은 유전자형에 따라 PAO1, PA14, 그리고 더 분화된 PA7을 모델 균주로 하여 세 가지 주요 계통으로 분류할 수 있다.[18]녹농균은 일반적으로 기회 감염 병원체로 여겨지지만, 몇몇 광범위하게 퍼진 클론들은 특히 낭성 섬유증 환자에서 더 전문화된 병원체가 된 것으로 보인다. 여기에는 주로 영국에서 발견되는 리버풀 유행 균주(LES)[19], 덴마크의 DK2[20], 그리고 호주의 AUST-02(이전에는 AES-2 및 P2로 알려짐)가 포함된다.[21] 또한 말의 생식기를 자주 감염시키는 클론도 있다.[22][23]
3. 3. 대사
녹농균(''P. aeruginosa'')은 통성 혐기성 세균으로 부분적 또는 완전한 산소 고갈 상태에서 증식하는 데 잘 적응되어 있다.[24] 이 미생물은 질산염 또는 아질산염을 전자 수용체로 사용하여 혐기성 성장을 할 수 있다. 산소, 질산염, 아질산염이 없을 때는 아르기닌과 피루브산을 기질 수준 인산화를 통해 발효시킬 수 있다.[24] 또한, 녹농균(''P. aeruginosa'')이 생성하는 페나진은 생물막 깊숙한 곳에서 세포의 생존을 돕는 전자 셔틀 역할을 할 수 있다.[25] 미호기성 또는 혐기성 환경에 대한 적응은 ''P. aeruginosa''의 특정 생활 방식, 예를 들어 낭성 섬유증 및 원발성 섬모 운동 이상증 환자의 폐 감염에서 필수적인데, 이곳에서는 두꺼운 폐 점액 층과 세균이 생성한 알긴산이 점액성 세균 세포를 둘러싸 산소 확산을 제한할 수 있다.[26][27][28][29][30][31]3. 4. 세포 간 협력
녹농균(''P. aeruginosa'')은 철을 영양소 공급원으로 사용한다.[32] 철은 환경에서 흔히 발견되지 않아 접근하기 쉽지 않고, 과도하게 높은 수준의 철은 녹농균에게 독성이 있을 수 있다.[32] 이러한 문제를 극복하고 철의 적절한 섭취를 조절하기 위해, 녹농균은 철을 결합하고 수송하는 분비 분자인 시데로포어를 사용한다.[33] 철-시데로포어 복합체는 특이성이 없어, 시데로포어를 생성한 박테리아가 반드시 철 섭취의 직접적인 이점을 얻는 것은 아니다.[34] 세포 집단의 모든 구성원이 철-시데로포어 복합체에 접근할 가능성이 동등하다. 시데로포어를 효율적으로 생성할 수 있는 세포 집단의 구성원을 협력자, 거의 또는 전혀 생성하지 않는 구성원은 속임수라고 한다.[34] 협력자와 속임수를 함께 배양하면 협력자의 적합성이 감소하고 속임수의 적합성은 증가하며, 철 제한이 증가함에 따라 적합성의 변화 정도가 커진다.[34][35] 적합성이 증가하면 속임수가 협력자를 능가할 수 있으며, 이는 충분한 시데로포어 생산 부족으로 인해 그룹의 전체적인 적합성 감소로 이어진다. 협력자와 속임수의 혼합은 녹농균의 독성을 줄일 수 있다.[34]4. 물질 생산
'''왼쪽 그림''': 세균 밀도가 낮은 상태에서는 오토인듀서(파랑)의 농도도 낮아 물질 생산이 거의 일어나지 않는다.
'''오른쪽 그림''': 세균 밀도가 높아지면 오토인듀서의 농도가 상승하여 퀼럼 센싱 특유의 물질(빨강)이 생산된다.]]
''녹농균''(P. aeruginosa)은 다른 종과의 영양분 경쟁 또는 집락 형성을 위해 유전자 발현을 조절하는 능력을 가진 기회주의적 병원체이다. 유전자 발현의 조절은 세포 간의 통신 또는 외부 환경으로 방출되는 자동유도물질이라고 하는 작은 분자를 통한 쿼럼 감지(QS)를 통해 발생할 수 있다. 이러한 신호는 특정 개체군의 세포 밀도와 상관된 특정 농도에 도달하면 해당 조절 인자를 활성화하여 유전자 발현을 변경하고 행동을 조절한다. ''녹농균''은 각각 고유한 신호 분자를 생성하는 5개의 상호 연결된 QS 시스템– las, rhl, pqs, iqs 및 pch–을 사용한다.[61] las 및 rhl 시스템은 수많은 QS 제어 유전자의 활성을 담당하고, pqs 시스템은 퀴놀론 신호 전달에 관여하며, iqs 시스템은 세포 간 통신에서 중요한 역할을 한다.[62] ''녹농균''의 QS는 계층적 방식으로 구성된다. 신호 전달 계층의 최상위에는 las 시스템이 있는데, las 조절 인자가 rhl과 같은 다른 여러 조절 인자의 전사를 활성화하여 QS 조절 시스템을 시작하기 때문이다. 따라서 las 시스템은 las에서 rhl regulons까지의 계층적 QS 캐스케이드를 정의한다.[63] 이러한 분자의 감지는 ''녹농균''이 낭포성 섬유증 환자의 폐 내에서 바이오필름으로 성장하고 있음을 나타낸다.[64] 그러나 QS, 특히 las 시스템이 ''녹농균''의 병원성에 미치는 영향은 불분명하다. 연구에 따르면 lasR 결핍 돌연변이는 낭포성 섬유증 환자에서 더 심각한 결과와 관련이 있으며, 손상된 QS 활동에도 불구하고 만성적으로 감염된 낭포성 섬유증 환자의 최대 63%에서 발견된다.[66]
QS는 색소 피오시아닌을 포함하여 여러 독성 인자의 발현을 계층적으로 제어하는 것으로 알려져 있다. 그러나 las 시스템이 유전자 발현 조절을 시작하지만, 그 부재가 독성 인자의 손실로 이어지지는 않는다. 최근에, rhl 시스템이 엘라스타제 및 스타필로라이제 활성을 담당하는 단백질 분해 효소와 같은 las 특정 인자를 지연된 방식으로 부분적으로 제어한다는 것이 입증되었다. 따라서 las는 QS 제어 유전자의 직접적이고 간접적인 조절 인자이다.[62] 세균이 주변 변화에 빠르게 적응할 수 있게 하는 또 다른 형태의 유전자 조절은 환경 신호를 통해서이다. 최근 연구에 따르면 혐기성 생물은 QS의 주요 조절 회로에 상당한 영향을 미칠 수 있다. QS와 혐기성 사이의 이러한 중요한 연결은 이 유기체의 독성 인자 생산에 상당한 영향을 미친다.[104] 마늘은 실험적으로 ''녹농균''의 쿼럼 감지를 차단한다.[67]
4. 1. 색소 생성
녹농균은 피오시아닌(청록색), 피오베르딘(황록색, 형광), 피오루빈(적색), 피오멜라닌(흑갈색) 등 다양한 색소를 생성한다.[123] 이 중 피오시아닌과 피오베르딘 두 가지가 특히 연구가 많이 진행되었다. 일부 색소를 생성하지 않는 변이주도 존재한다.thumb이기 때문에 배지 표면 근처에서만 증식하여(바이오필름 형성, 흰 부분), 거기에서 아래로 생성된 피오시아닌이 확산된다. 오른쪽은 녹농균 배양 전의 배지.]]
thumb
피오시아닌은 클로로포름에 용해되는 녹색 색소로, 균체 외로 분비되어 녹농균을 배양한 배지나 감염된 상처 등을 녹색으로 착색시킨다.[124][125] 녹농균 발견의 계기가 된 붕대의 녹변과 학명 및 일본어 명칭은 이 피오시아닌에 의한 녹색에서 유래한다. 피오시아닌은 포유류 세포의 미토콘드리아에 의한 호흡 기능 및 기도 점막의 섬모 운동을 저해하는 독성을 가지고 있어 녹농균의 병원성의 일부를 담당한다.[126][127]
페나진은 ''P. aeruginosa''가 생성하는 산화 환원 활성 색소이며, 정족수 감지, 독성, 철 획득에 관여한다.[46] ''P. aeruginosa''는 페나진-1-카복사미드(PCA), 1-하이드록시페나진, 5-메틸페나진-1-카복실산 베타인, 피오시아닌, 에루기노신 A와 같은 여러 색소를 생합성 경로를 통해 생성한다.[47][48][49]
피오베르딘은 플루오레신(fluorescin)이라고도 불리며, 분자 내에 디히드록시퀴놀린 구조를 가지고 철이온과 강하게 결합한다. 철 이온 농도가 낮은 환경에서 잘 생성되며, 균체에서 주변으로 분비된 피오베르딘은 증식에 필요한 철 이온을 유지하고 이를 균체에 효율적으로 공급하는 시데로포어의 역할을 한다.
4. 2. 무코이드와 생물막
녹농균은 점액질의 세포외다당류 피막을 만들어 미생물막 형태로 감염을 일으킨다.[126] 바이오필름은 물질 표면에 강하게 부착되어 기계적 제거에 강하고, 약제 침투가 어려워 화학적 자극에도 저항성을 보인다.[126] 또한, 다른 미생물에 의한 포식이나 백혈구 등에 의한 탐식 등 생물학적 제거로부터 보호받기 쉽다.[126]thumb 사진'''.
균체 표면에 분비된 무코이드가 부착되어 있으며, 일부 균(오른쪽 부분)은 그 안에 묻혀 균 전체의 형태를 판별하기 어려워지고 있다.]]
녹농균의 생물막 매트릭스는 핵산, 아미노산, 탄수화물 및 다양한 이온으로 구성되어 면역 체계 및 일부 독성 화합물로부터 녹농균을 보호한다.[69] 매트릭스는 PSL, PEL 및 알지네이트라는 최대 세 가지 유형의 당 중합체로 구성되며, 어떤 엑소폴리사카라이드가 생성되는지는 균주에 따라 다르다.[70][71]
녹농균의 일부는 '''무코이드'''라고 불리는 점성 물질을 생성하여 균체 외로 분비하는데, 이를 '''무코이드형 녹농균'''이라고 한다. 무코이드의 주성분은 알긴산이라고 불리는 점성이 높은 무코다당류이다. 무코이드형 녹농균은 바이오필름을 형성하여 그 안에서 효율적으로 증식하고 생존한다.
생물막은 기회 감염을 유발할 수 있으며, 전통적인 항생제 치료로 효과적으로 치료하기 어렵다.[104] 생물막은 항생제뿐만 아니라 숙주 면역계 구성요소를 포함한 불리한 환경 요인으로부터 박테리아를 보호한다.[104]
의학적 관점에서 무코이드나 바이오필름의 생성은 병원성 및 감염 위험 증가로 이어진다. 감염 환자로부터 분리되는 병원성 녹농균의 대부분은 무코이드형이며, 감염된 점막 표면 등에서 바이오필름을 형성한다. 이는 백혈구에 의한 탐식이나 항체, 보체 등 숙주의 면역 기구에 의한 제거를 어렵게 하고, 항생 물질의 침투성 저하로 인해 치료를 더욱 어렵게 만든다.
유전 질환인 낭성 섬유증(CF) 환자의 경우, 녹농균에 의한 바이오필름 형성은 만성 감염의 주요 원인 중 하나이다. 이 바이오필름은 기도 내 점액에 형성되어 녹농균의 서식지가 된다. CF 환자의 바이오필름에 서식하는 녹농균은 혐기성 호흡을 하게 되는데, 이는 알긴산 대량 생산에 유리하여 기도 내 점막 비대를 유발하고, 혐기성 세균의 증식을 촉진한다.
4. 3. 외독소 및 분비 효소
녹농균은 다양한 독력인자를 통해 숙주세포에 감염을 일으킨다. 대표적인 독력인자인 엘라스타제는 LasA (세린 단백질분해효소)와 LasB (아연 금속단백분해효소)로 구성되며, 인체의 폐 조직과 인대를 구성하는 엘라스틴을 분해하여 조직을 손상시킨다.[126] 또한 인지질분해효소 C(PLC)를 분비하여 세포막의 인산기를 유리, 세포막을 분해한다.[126] alginate라는 다당류로 점액질 캡슐을 만들어 항생제나 숙주의 면역 세포 공격으로부터 자신을 보호하여 만성 감염을 유발하기도 한다.피오시아닌 색소는 독성을 가진 물질로, 주변 미생물을 죽이고 영역을 독점하며, 포유류 감염 시 폐 세포를 죽이고 낭성 섬유증을 일으킨다.[126] 피오시아닌은 세포막을 자유롭게 통과하여 전자전달계, 막 전달계, 세포 성장 관련 세포 회로에 영향을 주어 방해한다.[126] 피오시아닌은 화농증에서 보이는 녹색 농의 원인이며, 심내막염, 폐렴, 수막염 등 여러 질환을 유발한다.[127]
녹농균은 병원성 인자인 외독소 A를 통해 숙주 세포 내에서 ADP 리보실화로 진핵 세포 신장 인자 2를 비활성화한다. 이는 디프테리아 독소와 유사한 작용이다. 신장 인자 2가 없으면 진핵 세포는 단백질 합성이 불가능해져 괴사한다. 세포 내 내용물이 방출되면 면역계가 정상 작동하는 환자에게서 면역 반응을 유발한다.
또한 ''녹농균''은 ExoU라는 엑소효소를 통해 진핵 세포의 세포막을 분해하여 세포 용해를 유발한다. 최근에는 철 획득 세포외 운반체인 피오베르딘이 미토콘드리아에서 철을 제거하여 손상을 입히는 독소로 기능한다는 사실이 밝혀졌다.[43][44] 피오베르딘은 환경으로 분비되어 숙주나 포식자가 쉽게 감지하게 하며, 결과적으로 숙주/포식자가 박테리아로 이동하게 한다.[45]
녹농균은 외독소, 용혈소, 분비 효소 등 다양한 단백질을 균체 밖으로 분비하며, 이는 녹농균의 병원성과 밀접하게 관련되어 있다. 엑소톡신 A는 임상 분리 녹농균의 90%가 생산하며, 디프테리아균의 디프테리아 독소와 같은 생리 활성을 가진다. 엑소톡신 A는 펩타이드 신장 인자인 EF2를 ADP-리보실화하여 동물 세포의 단백질 합성을 불가역적으로 저해하고 세포를 죽음에 이르게 한다. EF2 외 다른 분자를 표적으로 ADP-리보실화하는 엑소엔자임 S도 분비한다.
녹농균은 강한 세포 독성을 가진 헤몰리신(단백질성 용혈독)과 용혈 살균 작용을 하는 람노리피드, 두 종류의 용혈소를 분비한다. 혈액 한천 배지에서는 β용혈성을 나타낸다. 분비 효소로는 알칼리 펩티다제, 엘라스타제, 콜라게나제, 리파아제 등을 생산한다. 이들은 감염 부위 조직을 파괴하고 세균 침입과 증식을 용이하게 하며, 출혈이나 괴사를 일으키는 병원인자로 작용한다.
5. 병원성
녹농균은 주로 면역 결핍 환자에게서 기회 감염, 원내 감염 병원체로 작용하며, 기도, 요로 감염, 화상, 상처를 감염시키며, 다른 혈액 감염도 유발한다.[37]
| 감염 | 세부 사항 및 일반적인 관련성 | 고위험군 |
|---|---|---|
| 폐렴 | 광범위한 기관지 폐렴 | 낭성 섬유증, 비 CF 기관지 확장증 환자 |
| 패혈성 쇼크 | 자주색-검은색 피부 병변 괴저성 농창과 연관됨 | 호중구 감소증 환자 |
| 요로 감염 | 요로 카테터 삽입 | |
| 위장관 감염 | 괴사성 장염 | 미숙아 및 호중구 감소증 암 환자 |
| 피부 및 연조직 감염 | 출혈 및 괴사 | 화상 또는 상처 감염 환자 |
화상 부위 감염 및 외이 감염(외이염)의 가장 흔한 원인이며, 의료 기기(예: 카테터)의 가장 흔한 집락화 균이다. ''Pseudomonas''는 오염된 장비가 제대로 세척되지 않거나 의료 종사자의 손을 통해 전파될 수 있다.[38] 드물게 ''Pseudomonas''는 지역사회 획득 폐렴을 유발할 수 있으며,[39] 여러 연구에서 가장 흔하게 분리되는 원인균 중 하나인 인공호흡기 관련 폐렴도 유발할 수 있다.[40] 피오시아닌은 이 박테리아의 독성 인자이며, ''C. elegans''에서 산화 스트레스를 통해 사망을 유발하는 것으로 알려져 있다. 그러나 살리실산은 피오시아닌 생성을 억제할 수 있다.[41] 병원 내 감염의 10%는 ''Pseudomonas''에 의해 발생한다. 낭성 섬유증 환자는 또한 돌연변이로 인한 세포막을 통한 염화 이온 이동의 기능적 손실로 인해 폐의 ''P. aeruginosa'' 감염에 취약하다.[42] ''P. aeruginosa''는 또한 적절하고 주기적인 수질 관리가 이루어지지 않아 발생하는 "뜨거운 욕조 발진" (피부염)의 흔한 원인이 될 수 있다. 이러한 박테리아는 뜨거운 욕조와 수영장과 같은 습한 환경에서 번식하므로 피부 발진이나 수영자 귀(swimmer's ear)를 유발할 수 있다.[38] ''Pseudomonas''는 또한 방사형 각막 절개술 수술 환자에서 수술 후 감염의 흔한 원인이다. 이 균은 또한 피부 병변 괴저성 농창과 관련이 있다. ''P. aeruginosa''는 발의 관통 상처와 관련된 골수염과 자주 연관되며, 이는 테니스화의 폼 패드를 통해 ''P. aeruginosa''에 직접 접종되어 발생한다고 믿어지며, 당뇨병 환자에게서 더 높은 위험이 있다.
녹농균은 엘라스테이스, 인지질분해효소 C, alginate, 피오시아닌 등의 다양한 독력인자를 통해 숙주세포를 감염시킨다.[126] 엘라스테이스는 폐 조직과 인대의 엘라스틴을 분해하여 조직을 손상시키고, 인지질분해효소 C는 세포막의 인산기를 유리하여 세포막을 분해한다.[126] Alginate는 점액질 캡슐을 만들어 항생제나 숙주 면역세포의 공격으로부터 세균을 보호하여 만성 감염을 유발한다. 피오시아닌은 주변 미생물과 포유류 폐 세포를 죽이고 낭성 섬유증을 일으키며, 세포 내 침투 후 전자전달계, 막 전달계, 세포 성장 관련 회로를 방해한다.[126] 피오시아닌은 화농증의 녹색농을 유발하며, 심내막염, 폐렴, 수막염 등 다양한 질환의 원인이 된다.[127]
녹농균은 건강한 사람에게 감염되어도 증상이 나타나는 경우가 거의 없는 독성이 낮은 세균이지만, 면역력이 저하된 사람에게 '''뮤코이드형 녹농균'''이 기회 감염하면 '''녹농균 감염증'''을 일으킨다. 원내 감염에 의해 발생하는 경우도 많다. 발병한 경우, 녹농균이 가진 약제 내성 때문에 약물 치료가 어려운 경우도 많다. β-락탐계, 아미노글리코사이드계, 뉴퀴놀론계의 3계통의 항균제에 각각 유효한 것이 있지만, 이들 계통 모두에 대해 내성을 획득한 '''다제내성 녹농균 감염증'''도 나타나고 있어 의료상의 문제가 되고 있다.
5. 1. 녹농균 감염증
녹농균은 엘라스테이스, 인지질분해효소 C, alginate, 피오시아닌 등의 다양한 독력인자를 통해 숙주세포를 감염시킨다.[126] 엘라스테이스는 폐 조직과 인대의 엘라스틴을 분해하여 조직을 손상시키고, 인지질분해효소 C는 세포막의 인산기를 유리하여 세포막을 분해한다.[126] Alginate는 점액질 캡슐을 만들어 항생제나 숙주 면역세포의 공격으로부터 세균을 보호하여 만성 감염을 유발한다. 피오시아닌은 주변 미생물과 포유류 폐 세포를 죽이고 낭성 섬유증을 일으키며, 세포 내 침투 후 전자전달계, 막 전달계, 세포 성장 관련 회로를 방해한다.[126] 피오시아닌은 화농증의 녹색농을 유발하며, 심내막염, 폐렴, 수막염 등 다양한 질환의 원인이 된다.[127]녹농균 감염증은 면역 억제제 사용, 후천성 면역 결핍 증후군(AIDS), 장기간 입원, 수술 등으로 면역력이 저하된 "감염 취약 숙주"에게 발병하는 기회 감염이다.
의료용 카테터, 기관 삽관, 외과적 수술 등으로 요도, 기도, 창상을 통해 감염되거나, 욕창, 화상, 외상 등으로 피부 방어 기전이 손실된 부위에서 감염된다. 콘택트 렌즈 착탈 시 손상으로 눈에 감염을 일으키기도 한다. 국소 감염으로는 각막염, 외이염("수영자의 귀"), 피부 발진, 폐렴 등이 있다. 전신 감염으로는 패혈증, 속발성 폐렴, 심내막염, 중추 신경 감염 등이 있으며, 녹농균 패혈증은 치사율이 매우 높다.
5. 2. 원내 감염
의료기관에서는 녹농균이 존재하기 쉬운 환경에서 감염되기 쉬운 숙주에게 감염 원인이 될 수 있는 의료 행위를 실시한다는 조건이 갖춰져 있기 때문에 녹농균에 의한 원내 감염이 종종 문제가 된다. 녹농균은 병원 등의 의료기관과 같이 감염되기 쉬운 숙주가 모이는 환경에서 기회 감염을 일으킨다. 또한, 의료기관에서는 다양한 소독약, 항생 물질 등의 약제가 사용되어 약제 내성이 강한 녹농균이 선택적으로 살아남기 쉬우며, 새로운 내성을 획득한 항생제 내성균도 생기기 쉬운 환경이다. 외과적 처치나 삽관 등의 의료 행위는 녹농균 감염의 직접적인 계기가 될 수 있다. 각 의료기관에서 녹농균을 포함한 병원체 발생 상황을 모니터링하고 원내 감염 예방을 위한 노력을 기울이고 있지만, 환경 중의 상재균이기도 한 녹농균의 완전한 제거는 어렵다. 환자에게 주는 문병품도 녹농균의 감염원이 될 수 있는데, 화훼 상품의 용토나 식물 자체에 녹농균이 부착, 서식하고 있는 경우가 많아, 병원에서는 화훼 반입을 금지하기도 한다.5. 3. 식물 및 무척추동물에 대한 병원성
녹농균(''P. aeruginosa'')은 애기장대([51])와 상추에서[57][52] 연부병을 유발한다.[57] 또한, 예쁜꼬마선충([53][54]), 초파리([55]), 큰벌집나방([56])을 포함한 무척추 동물에도 병원성을 나타낸다. 식물과 동물의 감염에 대한 독성 인자의 연관성은 동일하다.[57][58] 곤충과 식물 모두에서, 녹농균(''P. aeruginosa'')의 독성은 정족수 감지(QS)에 크게 의존한다.[59] 정족수 감지는 다시 아실-호모세린-락톤 신타제와 lasI와 같은 유전자에 매우 의존적이다.[60]5. 4. 쿼럼 센싱
녹농균(''P. aeruginosa'')은 다른 종과의 영양분 경쟁 또는 집락 형성을 위해 유전자 발현을 조절하는 기회주의적 병원체이다. 유전자 발현의 조절은 세포 간의 통신 또는 외부 환경으로 방출되는 자동유도물질이라고 하는 작은 분자를 통한 쿼럼 센싱(QS)을 통해 발생할 수 있다.[61] 이러한 신호는 특정 개체군의 세포 밀도와 상관된 특정 농도에 도달하면 해당 조절 인자를 활성화하여 유전자 발현을 변경하고 행동을 조절한다. 녹농균은 las, rhl, pqs, iqs, pch의 5가지 상호 연결된 쿼럼 센싱 시스템을 사용한다.[61] las 및 rhl 시스템은 수많은 QS 제어 유전자의 활성을 담당하고, pqs 시스템은 퀴놀론 신호 전달에 관여하며, iqs 시스템은 세포 간 통신에서 중요한 역할을 한다.[62] 신호 전달 계층의 최상위에는 las 시스템이 있는데, las 조절 인자가 rhl과 같은 다른 여러 조절 인자의 전사를 활성화하여 QS 조절 시스템을 시작하기 때문이다. 따라서 las 시스템은 las에서 rhl regulons까지의 계층적 QS 캐스케이드를 정의한다.[63]쿼럼 센싱은 색소 피오시아닌을 포함하여 여러 독성 인자의 발현을 계층적으로 제어하는 것으로 알려져 있다.[62] 그러나 las 시스템이 유전자 발현 조절을 시작하지만, 그 부재가 독성 인자의 손실로 이어지지는 않는다. rhl 시스템은 엘라스타제 및 스타필로라이제 활성을 담당하는 단백질 분해 효소와 같은 las 특정 인자를 지연된 방식으로 부분적으로 제어한다. 따라서 las는 QS 제어 유전자의 직접적이고 간접적인 조절 인자이다.[62] 세균이 주변 변화에 빠르게 적응할 수 있게 하는 또 다른 형태의 유전자 조절은 환경 신호를 통해서이다. 최근 연구에 따르면 혐기성 생물은 QS의 주요 조절 회로에 상당한 영향을 미칠 수 있다. QS와 혐기성 사이의 이러한 중요한 연결은 이 유기체의 독성 인자 생산에 상당한 영향을 미친다.[104] 마늘은 실험적으로 녹농균의 쿼럼 센싱을 차단한다.[67]
6. 약제 내성
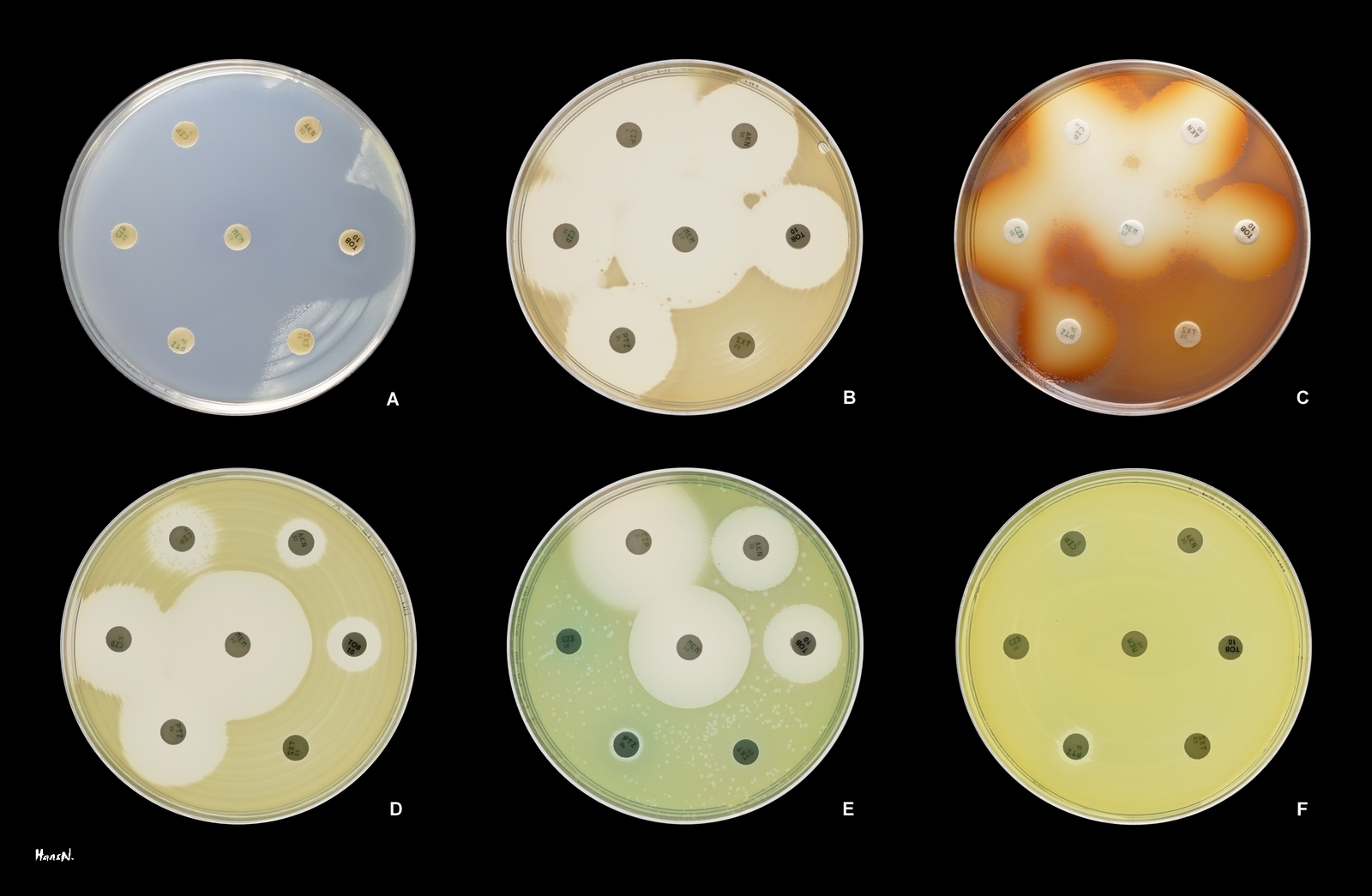
녹농균(''P. aeruginosa'')은 낮은 항생제 감수성을 보이는 것이 특징이며, 이는 염색체에 암호화된 항생제 내성 유전자와 다약제 유출 펌프의 복합적인 작용 때문이다.[104] 이러한 유전자에는 페니실린, 세팔로스포린,[87] 카바페넴[88]을 분해하는 ''AmpC''형 β-락타마제 효소,[89][90][91] 페니실린과 세팔로스포린을 분해하는 PER-1형 광범위 스펙트럼 β-락타마제 효소, 카바페넴을 분해하는 IMP형 카바페네마제,[92][93] 뉴델리 메탈로-β-락타마제 1,[94][95][96] 옥사 실리나제 (OCA) β-락타마제,[97] 겐타마이신 및 토브라마이신 등 아미노글리코사이드 항생제 구조를 변경하는 아미노글리코사이드 N6'-아세틸트랜스퍼라제,[98] DNA 자이레이스와 토포아이소머라제 IV를 퀴놀론(플루오로퀴놀론) 항생제로부터 보호하는 Qnr 단백질[99] 등이 있다. 균주에 따라 항생제 내성에 관여하는 특정 유전자와 효소는 다를 수 있다.[100][101]
녹농균은 세균 세포 외피의 낮은 투과성으로 인해 원래부터 내성을 갖는다.[103] 여기에 더해, 염색체 암호화 유전자의 돌연변이나 항생제 내성 결정 인자의 수평 유전자 전달을 통해 획득 내성을 발달시킨다.[104] 항생제 내성 기전에는 항생제 분해/비활성화 효소 생성, 항생제 배출 외부 막 단백질, 항생제 표적 변경 돌연변이 등이 있다.[104] 광범위 스펙트럼 β-락타마제, AmpC 세팔로스포리나제, 카바페네마제, 메탈로-b-락타마제, OXA형 카바페네마제, 아미노글리코사이드 변형 효소 등이 보고되었다.[104] ''P. aeruginosa''는 아미노글리코사이드 결합을 막기 위해 16S rRNA 메틸화를 하거나, DNA 또는 토포아이소머라제를 수정하여 퀴놀론 작용을 차단한다.[104] 다약제 유출 펌프 시스템도 가지고 있으며, RND 계열이 가장 중요하다.[105] 항생제 내성과 관련된 중요한 점은 내성 균주의 독성 능력이 감소한다는 것이다.[106]
DNA 자이레이스 돌연변이는 ''P. aeruginosa''의 항생제 내성과 관련이 있으며, 다른 돌연변이와 결합하면 높은 내성을 유발한다.[107] cyclic-di-GMP 신호 전달 관련 유전자도 내성에 기여한다.[107] 작은 RNA인 Sr0161과 ErsA는 카바페넴 항생제를 주위질로 흡수시키는 주요 포린 OprD를 암호화하는 mRNA와 상호 작용하여 메로페넴에 대한 세균 내성을 높인다.[108] 또 다른 sRNA인 Sr006은 지질 A의 탈아실화를 담당하는 효소인 PagL 발현을 조절하여 폴리믹신 B 내성에 기여한다.[108]
다제내성 녹농균(MDRP)은 광범위 β-락탐계, 아미노글리코사이드계, 뉴퀴놀론계 항생제에 모두 내성을 나타내는 균주를 말한다.[104] 2000년대 이후에는 이미페넴(β-락탐의 카바페넴계), 아미카신(아미노글리코사이드), 시프로플록사신(뉴퀴놀론계) 등에 대한 내성을 기준으로 판단하는 경향이 있다. 다제내성 녹농균 감염증은 전 세계적으로 감시 대상이며, 한국에서는 감염증법에 따라 5류 감염증으로 지정되어 관리하고 있다. 콜리스틴은 MDRP 감염증에 효과가 있는 약제 중 하나이다.
6. 1. 다제내성 녹농균 감염증
녹농균(''P. aeruginosa'')의 가장 우려스러운 특징 중 하나는 낮은 항생제 감수성이다. 이는 염색체에 암호화된 항생제 내성 유전자와 다약제 유출 펌프의 협력적인 작용에 기인한다.[104] 이러한 유전자에는 페니실린, 세팔로스포린,[87] 카바페넴[88]을 분해하는 ''AmpC''형 β-락타마제 효소,[89][90][91] 페니실린과 세팔로스포린을 분해하는 PER-1형 광범위 스펙트럼 β-락타마제 효소, 카바페넴을 분해하는 IMP형 카바페네마제,[92][93] 뉴델리 메탈로-β-락타마제 1,[94][95][96] 옥사 실리나제 (OCA) β-락타마제,[97] 겐타마이신 및 토브라마이신과 같은 아미노글리코사이드 항생제의 구조를 변경하는 아미노글리코사이드 N6'-아세틸트랜스퍼라제,[98] DNA 자이레이스와 토포아이소머라제 IV를 퀴놀론 (플루오로퀴놀론) 항생제로부터 보호하는 Qnr 단백질[99] 등이 있다. 항생제 내성에 관여하는 특정 유전자와 효소는 균주에 따라 다를 수 있다.[100][101]녹농균은 세균 세포 외피의 낮은 투과성으로 인해 고유한 내성을 갖는다.[103] 또한, 염색체에 암호화된 유전자의 돌연변이나 항생제 내성 결정 인자의 수평 유전자 전달을 통해 획득 내성을 발달시킨다.[104] 항생제 내성 기전에는 항생제 분해 또는 비활성화 효소 생성, 항생제 배출 외부 막 단백질, 항생제 표적 변경 돌연변이 등이 있다.[104] 광범위 스펙트럼 β-락타마제, AmpC 세팔로스포리나제, 카바페네마제, 메탈로-b-락타마제, OXA형 카바페네마제, 아미노글리코사이드 변형 효소 등이 보고되었다.[104] ''P. aeruginosa''는 아미노글리코사이드 결합을 방지하기 위한 16S rRNA 메틸화, DNA 또는 토포아이소머라제를 수정하여 퀴놀론 작용을 방어한다.[104] 또한 다약제 유출 펌프 시스템을 가지고 있으며, RND 계열이 가장 중요하다.[105] 항생제 내성과 관련된 중요한 요인은 내성 균주의 독성 능력 감소이다.[106]
DNA 자이레이스의 돌연변이는 일반적으로 ''P. aeruginosa''의 항생제 내성과 관련이 있으며, 다른 돌연변이와 결합할 때 높은 내성을 부여한다.[107] cyclic-di-GMP 신호 전달에 관여하는 유전자도 내성에 기여할 수 있다.[107] 작은 RNA인 Sr0161과 ErsA는 카바페넴 항생제를 주위질로 흡수하는 데 책임이 있는 주요 포린 OprD를 암호화하는 mRNA와 상호 작용하여 메로페넴에 대한 세균 내성을 증가시킨다.[108] 또 다른 sRNA인 Sr006은 지질 A의 탈아실화를 담당하는 효소인 PagL의 발현을 조절하여 폴리믹신 B 내성에 도움이 될 수 있다.[108]
다제내성 녹농균(MDRP)은 광범위 β-락탐계, 아미노글리코사이드계, 뉴퀴놀론계 항생제에 동시에 내성을 나타내는 균주를 의미한다.[104] 2000년대 이후에는 이미페넴(β-락탐의 카바페넴계), 아미카신(아미노글리코사이드), 시프로플록사신(뉴퀴놀론계) 등에 대한 내성을 지표로 삼는 경향이 있다. 다제내성 녹농균 감염증은 전 세계적으로 감시되고 있으며, 한국에서는 감염증법에 의해 5류 감염증으로 지정되어 있다. 콜리스틴은 MDRP 감염증에 유효한 약제 중 하나이다.
7. 진단
녹농균(P. aeruginosa) 감염 진단은 감염 부위에 따라 적절한 검체를 채취하여 세균학적 검사를 실시하는 방식으로 이루어진다. 그람 염색을 통해 그람 음성 막대균 및 백혈구를 관찰할 수 있다.[77][78] 녹농균은 배양 검사에서 특징적인 "포도 향" 또는 "갓 구운 토르티야" 냄새가 나는 집락을 생성하며, 맥콘키 한천에서는 유당을 발효하지 않아 투명한 집락으로 분리되고, 산화 효소 양성 반응을 보인다.[77][78]
확진을 위해 세트리미드 한천에서 푸른 녹색 색소인 피오시아닌 생성 여부와 42℃에서 생장 가능 여부를 확인한다.[77][78] TSI 사면 배지는 대변 검체에서 비발효성 ''Pseudomonas'' 종을 장내 병원균과 구별하는 데 사용되기도 한다.
녹농균은 피오시아닌(파란색), 피오베르딘(노란색 및 형광), 피오루빈(빨간색), 피오멜라닌(갈색) 등 다양한 색소를 분비할 수 있어 이를 통해 균을 식별하기도 한다.[83] 또한, 경유 및 제트 연료에서 생장하여 미생물 부식을 일으키기도 한다.[84]
녹농균(P. aeruginosa)은 그람 음성, 호기성 (때로는 통성 혐기성) 막대 모양의 세균이며, 편모를 이용해 운동성을 갖는다.[79]
형태학적, 생리학적 및 생화학적 특성은 아래 표와 같다.
| 검사 유형 | 검사 | 특징 |
|---|---|---|
| 집락 특징 | 크기 | 큼 |
| 유형 | 매끄러움 | |
| 색상 | ||
| 모양 | 평평함 | |
| 형태학적 특징 | 모양 | 막대 |
| 생리학적 특징 | 운동성 | + |
| 6.5% NaCl에서의 성장 | - | |
| 생화학적 특징 | 그람 염색 | - |
| 산화 효소 | + | |
| 카탈라아제 | + | |
| 산화적-발효 | ||
| 운동성 | + | |
| 메틸 레드 | - | |
| 보게스-프로스카우어 | - | |
| 인돌 | - | |
| H2S 생성 | - | |
| 요소 분해 효소 | - | |
| 질산염 환원 효소 | + | |
| β-갈락토시다아제 | ||
| 페닐알라닌 디아미나아제 | - | |
| DNA 분해 효소 | - | |
| 리파아제 | + | |
| 라이신 탈카복실라아제 | - | |
| 색소 | + (푸르스름한 녹색 색소) | |
| 용혈 | 베타/가변적 | |
| 가수 분해 | 젤라틴 | + |
| 카제인 | ||
| 이용 | 글리세롤 | + |
| 갈락토스 | - | |
| D-글루코스 | + | |
| D-과당 | + | |
| D-만노스 | - | |
| 만니톨 | + | |
| 시트르산염 | + | |
| 말토스 | - | |
| 수크로스 | - | |
| 락토스 | - |
8. 치료
녹농균 감염증 치료에는 항균제를 이용한 화학 요법이 사용된다.[86] 아미노글리코사이드, 페니실린, 세펨계, 카바페넴, 뉴퀴놀론계 항생제 등이 사용될 수 있다.[86]
많은 ''P. aeruginosa'' 균주는 광범위한 항생제에 내성을 나타내며, 치료 실패 후 추가적인 내성을 보일 수 있다. 일반적으로 경험적인 항생제를 선택하기보다는 실험실 감수성에 따라 치료를 진행하는 것이 가능해야 한다. 경험적으로 항생제를 투여하는 경우, 배양 검사를 수행하고, 배양 검사 결과가 나오면 사용된 항생제의 선택을 재검토해야 한다.
카바페넴, 폴리믹신, 티게사이클린이 선택 약물로 간주되었으나, 이러한 약물에 대한 내성 또한 보고되었다. 일정 수준의 내성이 있는 경우에도 항균 작용을 강화하기 위해 설박탐과 같은 β-락타마제 억제제를 항생제와 함께 사용하는 것이 권장되었다. 다제내성 ''P. aeruginosa''의 치료에는 병용 요법이 가장 효과적인 방법으로 밝혀졌다.
''P. aeruginosa''에 활성을 보일 수 있는 항생제는 다음과 같다.
- 아미노글리코사이드 (젠타마이신, 아미카신, 토브라마이신, 단, 카나마이신은 아님)
- 퀴놀론 (시프로플록사신, 레보플록사신, 단, 목시플록사신은 아님)
- 세팔로스포린 (세프타지딤, 세페핌, 세포페라존, 세피롬, 세프토비프롤, 단, 세푸록심, 세포탁심, 세프트리악손은 아님)
- 항녹농균 페니실린: 카르복시페니실린 (카르베니실린 및 티카르실린), 그리고 우레이도페니실린 (메즐로실린, 아즐로실린, 그리고 피페라실린). ''P. aeruginosa''는 다른 모든 페니실린에 본질적으로 내성을 가지고 있다.
- 카바페넴 (메로페넴, 이미페넴, 도리페넴, 단, 에르타페넴은 아님)
- 폴리믹신 (폴리믹신 B 및 콜리스틴)[85]
- 모노박탐 (아즈트레오남)
플루오로퀴놀론은 ''P. aeruginosa''에 광범위하게 효과적인 몇 안 되는 항생제 계열 중 하나이므로, 일부 병원에서는 내성 균주의 발생을 피하기 위해 사용을 엄격히 제한하고 있다. 감염이 표면적이고 제한적인 드문 경우(예: 귀 감염 또는 손톱 감염)에는 국소 젠타마이신 또는 콜리스틴을 사용할 수 있다.
녹농균 상처 감염의 경우, 0.5%에서 5% 농도의 아세트산은 상처에서 세균을 제거하는 데 효과적일 수 있다. 멸균된 거즈에 아세트산을 적셔 생리 식염수로 세척한 후 상처에 덮고, 드레싱은 하루에 한 번 한다. 녹농균은 치료 10~14일 후에 대개 90%의 경우에서 제거된다.[86]
녹농균 감염증의 치료는 녹농균에 대한 항균성을 가진 약제에 의한 화학요법이 이루어진다. 제1 선택이 되는 아미노글리코사이드계의 겐타마이신, 토브라마이신 및 아미카신 외에도 페니실린계의 티카실린 및 피페라실린, 제3세대 세펨인 세프타지딤, 또한 완전 합성 β-락탐인 카바페넴계의 이미페넴·실라스타틴 합제, 메로페넴, 도리페넴, 뉴퀴놀론계의 시프로플록사신도 사용되는 경우가 있다.[86]
그러나 녹농균이 감염 부위에서 생물막을 형성한 경우에는 그 내부로의 약제 침투성이 낮아져 완전한 제거가 어려워지는 경우도 많다. 또한 녹농균은 비교적 새로운 약제 내성을 얻기 쉬우므로, 상기 치료약에 대한 내성균, 특히 다제내성 녹농균의 출현이 문제가 된다.
9. 예방
프로바이오틱스 예방 요법은 중환자실 환경에서 녹농균의 집락 형성을 예방하고 녹농균 감염 발병을 지연시킬 수 있다.[110] 녹농균에 대한 면역 예방 요법이 연구되고 있다.[111]
녹농균에 감염될 위험은 수영장, 온탕 및 기타 고인 물을 피하고, 습기에 자주 노출되는 장비(예: 콘택트렌즈 장비 및 용액)를 정기적으로 소독하거나 교체하며, 손을 자주 씻음으로써 줄일 수 있다. 이는 다른 많은 병원체로부터도 보호해 준다.[112] 그러나 녹농균이 환경에서 매우 흔하다는 점을 감안할 때, 아무리 위생 관리를 잘하더라도 녹농균으로부터 완전히 보호할 수는 없다.[112]
10. 실험적 치료법
파지 치료는 항생제와 병용 가능하고, 금기 사항이 없으며 부작용이 최소화되어 효과적인 치료법으로 연구되어 왔다. 파지는 섭취, 투여 등에 적합한 멸균 액체 형태로 생산된다. 2009년 8월, ''녹농균(P. aeruginosa)''에 의해 발생한 귀 감염에 대한 파지 치료가 ''임상 이비인후과학 저널(Clinical Otolaryngology)''에 보고되었다. 이 주제에 대한 연구는 계속 진행 중이다.
11. 역학
녹농균(Pseudomonas aeruginosa)은 슈도모나스 속에 속하는 유일한 병원성 균종이다.[127] 환경 분야에서는 탄화수소를 분해하는 능력이 있어 해상 기름 유출 사고 시 타르볼 제거를 위한 미생물제 용도로도 사용된다.[128]
녹농균은 호기성 세균이지만 질산염이 존재하면 산소 없이도 성장할 수 있다. 균 집락은 점액질의 세포외다당류 피막을 형성하여 주로 미생물막 형태로 감염을 일으킨다.[126] NAC 배지를 통해 선택적으로 분리할 수 있다.
2019년 현재 동아프리카 공동체는 ''P. aeruginosa''를 검역 대상으로 지정하고 있다. 이는 케냐에서 발견된 Phaseolus vulgaris 병원성 ''P. aeruginosa'' 균주 때문이다. 동아프리카 공동체의 해충 위험 분석은 카야 & 다르지(Kaaya & Darji)가 1989년 케냐에서 처음 발견한 이후, CABI 작물 보호 편람 목록을 기반으로 작성되었다.
12. 역사
녹농균은 1872년에 슈뢰터(Schroeter)에 의해 발견, 명명된 후, 1882년에 카를 게사르(Carle Gessard)에 의해 녹색으로 착색된 붕대에서 처음 분리, 배양되었다. 이후 녹농균 및 녹농균 감염증에 대한 기초적인 연구가 진행되어, 약제 내성 및 물질 생산의 메커니즘이 해명되었다.
1929년, 알렉산더 플레밍에 의한 페니실린의 발견 이후, 많은 항생물질이 발견, 개발되었다. 처음에는 그람 양성균에만 유효했던 항생물질 중에서, 그람 음성균에도 유효한 것이 서서히 발견되었지만, 녹농균에 대해 효과를 보이는 약제는 거의 발견되지 않았다. 1960년대 이후가 되어서 겐타마이신 등 녹농균에 유효한 항생물질이 몇 가지 발견되었다. 또한 신약 개발이 계속되었던 페니실린계 항생물질 중에서, 처음으로 녹농균에 대한 효과를 얻은 카르베니실린이 개발되어, 이러한 약제가 녹농균 치료약으로 실용화되었다. 그러나 1970년대까지, 당시 사용되었던 여러 항생물질에 대한 다제내성 녹농균의 존재가 알려지게 되었다.
2000년에는 녹농균 PAO1주의 전체 게놈 해독이 완료되었다.
참조
[1]
웹사이트
UK Standards for Microbiology Investigations: Identification of Pseudomonas species and other Non- Glucose Fermenters
https://assets.publi[...]
Public Health England
2015-04-13
[2]
간행물
Microbe Profile: ''Pseudomonas aeruginosa'': opportunistic pathogen and lab rat
2020-01
[3]
간행물
Pseudomonas aeruginosa in the healthcare facility setting
https://journals.lww[...]
2021-07
[4]
서적
"''Pseudomonas aeruginosa'': Infections and Treatment"
Informa Health Care
[5]
간행물
Growth Profile and Hydrocarbonoclastic Potential of Microorganisms Isolated from Tarballs in the Bight of Bonny, Nigeria
[6]
간행물
Pseudomonas aeruginosa biofilms in cystic fibrosis
2010-11
[7]
간행물
The Pseudomonas story
2010-06
[8]
서적
Composition of Scientific Words
Smithsonian Institutional Press
[9]
서적
WestBow Press
https://books.google[...]
Greek Words
2014
[10]
간행물
Colour Me Blue: The History and the Biotechnological Potential of Pyocyanin
2021
[11]
간행물
Pseudomonas aeruginosa Genomic Structure and Diversity
[12]
간행물
Pseudomonas predators: understanding and exploiting phage-host interactions
https://lirias.kuleu[...]
2017-09
[13]
간행물
Comparative Analysis of the Core Proteomes among the Pseudomonas Major Evolutionary Groups Reveals Species-Specific Adaptations for Pseudomonas aeruginosa and Pseudomonas chlororaphis
2020-07-24
[14]
간행물
Characterization of the core and accessory genomes of Pseudomonas aeruginosa using bioinformatic tools Spine and AGEnt
2014-08
[15]
간행물
Comparative genomics of clinical strains of Pseudomonas aeruginosa strains isolated from different geographic sites
2018-10
[16]
간행물
The Pseudomonas aeruginosa Pan-Genome Provides New Insights on Its Population Structure, Horizontal Gene Transfer, and Pathogenicity
2019-01
[17]
간행물
Not all Pseudomonas aeruginosa are equal: strains from industrial sources possess uniquely large multireplicon genomes
2019-07
[18]
간행물
Complete genome sequence of the multiresistant taxonomic outlier Pseudomonas aeruginosa PA7
2010-01
[19]
간행물
Newly introduced genomic prophage islands are critical determinants of in vivo competitiveness in the Liverpool Epidemic Strain of Pseudomonas aeruginosa
2009-01
[20]
간행물
Genome analysis of a transmissible lineage of pseudomonas aeruginosa reveals pathoadaptive mutations and distinct evolutionary paths of hypermutators
2013
[21]
간행물
Whole genome sequencing reveals the emergence of a Pseudomonas aeruginosa shared strain sub-lineage among patients treated within a single cystic fibrosis centre
2018-08
[22]
간행물
Pseudomonas aeruginosa exhibits frequent recombination, but only a limited association between genotype and ecological setting
2012-09-06
[23]
간행물
Clonal complex Pseudomonas aeruginosa in horses
2011-05
[24]
간행물
Anaerobic physiology of Pseudomonas aeruginosa in the cystic fibrosis lung
2010-12
[25]
간행물
Bacterial community morphogenesis is intimately linked to the intracellular redox state
2013-04
[26]
서적
Microbiology: An Introduction
Pearson Education
2016
[27]
간행물
Anaerobic production of alginate by Pseudomonas aeruginosa: alginate restricts diffusion of oxygen
1996-12
[28]
간행물
Effects of reduced mucus oxygen concentration in airway Pseudomonas infections of cystic fibrosis patients
2002-02
[29]
간행물
Regulation of expression of the cyanide-insensitive terminal oxidase in Pseudomonas aeruginosa
2003-05
[30]
서적
Oxygen, cyanide and energy generation in the cystic fibrosis pathogen Pseudomonas aeruginosa
[31]
서적
Oxford Desk Reference: Acute Medicine
https://books.google[...]
Oxford University Press
2016
[32]
간행물
Siderophore-mediated cooperation and virulence in Pseudomonas aeruginosa
2007-11
[33]
간행물
Iron Depletion Enhances Production of Antimicrobials by Pseudomonas aeruginosa
2015-07
[34]
간행물
Cooperation and virulence in acute Pseudomonas aeruginosa infections
2006-07
[35]
간행물
Cooperation and competition in pathogenic bacteria
2004-08
[36]
논문
Nonhomologous end-joining in bacteria: a microbial perspective
Annual Reviews (publisher)
[37]
웹사이트
Pseudomonas aeruginosa
http://textbookofbac[...]
2004-06-04
[38]
웹사이트
"''Pseudomonas aeruginosa'' in Healthcare Settings"
https://www.cdc.gov/[...]
Centers for Disease Control and Prevention
2014-05-07
[39]
논문
Prognosis and outcomes of patients with community-acquired pneumonia. A meta-analysis
1996-01
[40]
논문
Survey of bloodstream infections due to gram-negative bacilli: frequency of occurrence and antimicrobial susceptibility of isolates collected in the United States, Canada, and Latin America for the SENTRY Antimicrobial Surveillance Program, 1997
1999-09
[41]
논문
Down regulation of virulence factors of Pseudomonas aeruginosa by salicylic acid attenuates its virulence on Arabidopsis thaliana and Caenorhabditis elegans
2005-09
[42]
논문
Novel understandings of host cell mechanisms involved in chronic lung infection: Pseudomonas aeruginosa in the cystic fibrotic lung
2019-03
[43]
논문
Mitophagy confers resistance to siderophore-mediated killing by Pseudomonas aeruginosa
2015-02
[44]
논문
Pseudomonas aeruginosa disrupts Caenorhabditis elegans iron homeostasis, causing a hypoxic response and death
2013-04
[45]
논문
Bacterivorous nematodes decipher microbial iron siderophores as prey cue in predator-prey interactions
2024-01
[46]
논문
The phenazine pyocyanin is a terminal signalling factor in the quorum sensing network of Pseudomonas aeruginosa
2006-09
[47]
논문
Cyclic voltammetric, fluorescence and biological analysis of purified aeruginosin A, a secreted red pigment of Pseudomonas aeruginosa PAO1
2013-08
[48]
논문
Functional analysis of genes for biosynthesis of pyocyanin and phenazine-1-carboxamide from Pseudomonas aeruginosa PAO1
2001-11
[49]
논문
Raloxifene attenuates Pseudomonas aeruginosa pyocyanin production and virulence
2012-09
[50]
간행물
Research could lead to new non-antibiotic drugs to counter hospital infections
https://www.scienced[...]
University of Chicago Medical Center
2009-04-14
[51]
논문
Pseudomonas aeruginosa-plant root interactions. Pathogenicity, biofilm formation, and root exudation
2004-01
[52]
논문
Use of model plant hosts to identify Pseudomonas aeruginosa virulence factors
1997-11
[53]
논문
Molecular mechanisms of bacterial virulence elucidated using a Pseudomonas aeruginosa-Caenorhabditis elegans pathogenesis model
1999-01
[54]
논문
Salicylic acid regulates flowering time and links defence responses and reproductive development
2004-01
[55]
논문
Drosophila as a model host for Pseudomonas aeruginosa infection
2001-02
[56]
논문
Use of the Galleria mellonella caterpillar as a model host to study the role of the type III secretion system in Pseudomonas aeruginosa pathogenesis
2003-05
[57]
논문
Common virulence factors for bacterial pathogenicity in plants and animals
1995-06
[58]
논문
Plants and animals share functionally common bacterial virulence factors
2000-08
[59]
논문
Contribution of quorum sensing to the virulence of Pseudomonas aeruginosa in burn wound infections
1999-11
[60]
논문
Bacterial Quorum Sensing During Infection
Annual Reviews (publisher)
2020-09
[61]
논문
A characterization of DNA release in Pseudomonas aeruginosa cultures and biofilms
2006-02
[62]
논문
Revisiting the quorum-sensing hierarchy in Pseudomonas aeruginosa: the transcriptional regulator RhlR regulates LasR-specific factors
2009-03
[63]
논문
The hierarchy quorum sensing network in Pseudomonas aeruginosa
2015-01
[64]
논문
The role of quorum sensing in chronic cystic fibrosis Pseudomonas aeruginosa infections
2009-01
[65]
논문
Pseudomonas aeruginosa lasR mutants are associated with cystic fibrosis lung disease progression
2009-01
[66]
논문
LasR Variant Cystic Fibrosis Isolates Reveal an Adaptable Quorum-Sensing Hierarchy in Pseudomonas aeruginosa
2016-10
[67]
논문
Garlic blocks quorum sensing and promotes rapid clearing of pulmonary Pseudomonas aeruginosa infections
2005-12
[68]
논문
A Surface-Induced Asymmetric Program Promotes Tissue Colonization by Pseudomonas aeruginosa
2019-01
[69]
서적
Pseudomonas aeruginosa - Biofilm Formation, Infections and Treatments
https://www.intechop[...]
IntechOpen
2021-06-09
[70]
논문
"''Pseudomonas aeruginosa'' Biofilms"
2020-11
[71]
논문
Role of exopolysaccharides in Pseudomonas aeruginosa biofilm formation and architecture
2011-08
[72]
논문
Pel is a cationic exopolysaccharide that cross-links extracellular DNA in the Pseudomonas aeruginosa biofilm matrix
2015-09
[73]
논문
Dispersed cells represent a distinct stage in the transition from bacterial biofilm to planktonic lifestyles
2014-07
[74]
논문
In vitro and in vivo generation and characterization of Pseudomonas aeruginosa biofilm-dispersed cells via c-di-GMP manipulation
2015-08
[75]
논문
Distinct bacterial population dynamics and disease dissemination after biofilm dispersal and disassembly
2023-08
[76]
논문
A genetic basis for Pseudomonas aeruginosa biofilm antibiotic resistance
https://scholarworks[...]
2022-12-21
[77]
웹사이트
What Is a Pseudomonas Infection?
https://www.medicine[...]
2020-12-08
[78]
웹사이트
Pseudomonas aeruginosa in Healthcare Settings
https://www.cdc.gov/[...]
U.S. Department of Health & Human Services
2020-12-08
[79]
서적
Sherris Medical Microbiology
McGraw Hill
[80]
서적
Baron's Medical Microbiology
University of Texas Medical Branch
[81]
논문
Phylogenetic affiliation of the pseudomonads based on 16S rRNA sequence
2000-07
[82]
서적
Bergey's manual of systematic bacteriology
https://link.springe[...]
Springer
2022-04-21
[83]
논문
Two simple media for the demonstration of pyocyanin and fluorescin
1954-08
[84]
논문
Characterization of the F-76 diesel and Jet-A aviation fuel hydrocarbon degradation profiles of Pseudomonas aeruginosa and Marinobacter hydrocarbonoclasticus
2014-09
[85]
논문
Colistin is effective in treatment of infections caused by multidrug-resistant Pseudomonas aeruginosa in cancer patients
2007-06
[86]
논문
Acetic acid treatment of pseudomonal wound infections--a review
2013-12
[87]
논문
Impact of Peptidoglycan Recycling Blockade and Expression of Horizontally Acquired β-Lactamases on Pseudomonas aeruginosa Virulence
2022-02
[88]
논문
Detection of AmpC-β-lactamases producing isolates among carbapenem resistant P. aeruginosa isolated from burn patient
2014-10
[89]
논문
"[Investigation of the frequency of PER-1 type beta-lactamase and antimicrobial resistance rates in nosocomial isolates of Pseudomonas aeruginosa]"
2012-01
[90]
논문
OXA β-lactamases
2014-04
[91]
논문
Antibiotic resistance and extended spectrum beta-lactamases: Types, epidemiology and treatment
2015-01
[92]
논문
Clinical and bacteriological characteristics of IMP-type metallo-beta-lactamase-producing Pseudomonas aeruginosa
2003-07
[93]
논문
Nosocomial outbreak caused by multidrug-resistant Pseudomonas aeruginosa producing IMP-13 metallo-beta-lactamase
2005-08
[94]
논문
Genetic Diversity, Distribution, and Genomic Characterization of Antibiotic Resistance and Virulence of Clinical ''Pseudomonas aeruginosa'' Strains in Kenya
2022
[95]
논문
Structure, Genetics and Worldwide Spread of New Delhi Metallo-β-lactamase (NDM): a threat to public health
2017-04
[96]
논문
Worldwide dissemination of the NDM-type carbapenemases in Gram-negative bacteria
2014
[97]
논문
On functional and structural heterogeneity of VIM-type metallo-beta-lactamases
2003-02
[98]
논문
Characterization of the aac(6')-Ib gene encoding an aminoglycoside 6'-N-acetyltransferase in Pseudomonas aeruginosa BM2656
1993-07
[99]
논문
"[Investigation of plasmid-mediated quinolone resistance in Pseudomonas aeruginosa strains isolated from cystic fibrosis patients]"
2011-10
[100]
논문
Metabolomic studies of Pseudomonas aeruginosa
2019-11
[101]
논문
"''Pseudomonas aeruginosa'': An Audacious Pathogen with an Adaptable Arsenal of Virulence Factors"
2021-03
[102]
논문
Friend or Foe: Whole-Genome Sequence of Pseudomonas aeruginosa TG523, Isolated from the Gut of a Healthy Nile Tilapia (Oreochromis niloticus)
2023-01
[103]
논문
Efflux-mediated multiresistance in Gram-negative bacteria
2004-01
[104]
서적
Pseudomonas: Genomics and Molecular Biology
http://www.horizonpr[...]
Caister Academic Press
2007-09-24
[105]
논문
Effect of efflux pump inhibition on Pseudomonas aeruginosa transcriptome and virulence
2017-09
[106]
논문
Molecular mechanisms related to colistin resistance in Enterobacteriaceae
2019
[107]
논문
Genomics of adaptation during experimental evolution of the opportunistic pathogen Pseudomonas aeruginosa
2012-09
[108]
논문
Probing the sRNA regulatory landscape of P. aeruginosa: post-transcriptional control of determinants of pathogenicity and antibiotic susceptibility
2017-12
[109]
논문
Release of the lipopolysaccharide deacylase PagL from latency compensates for a lack of lipopolysaccharide aminoarabinose modification-dependent resistance to the antimicrobial peptide polymyxin B in Salmonella enterica
2007-07
[110]
논문
Oral probiotic and prevention of Pseudomonas aeruginosa infections: a randomized, double-blind, placebo-controlled pilot study in intensive care unit patients
[111]
논문
Vaccines and immunotherapy against Pseudomonas aeruginosa
2008-02
[112]
웹사이트
"Pseudomonas Aeruginosa'' Fact Sheet"
http://www.childrens[...]
2014-11-15
[113]
논문
Bacteriophage therapy
2001-03
[114]
논문
A controlled clinical trial of a therapeutic bacteriophage preparation in chronic otitis due to antibiotic-resistant Pseudomonas aeruginosa; a preliminary report of efficacy
2009-08
[115]
논문
A synthetic biology approach to assemble and reboot clinically relevant Pseudomonas aeruginosa tailed phages
2024-01-31
[116]
논문
Convergent evolution of hyperswarming leads to impaired biofilm formation in pathogenic bacteria
2013-08
[117]
뉴스
Watching Bacteria Evolve, With Predictable Results
https://www.nytimes.[...]
2016-02-02
[118]
논문
Review on the current status of polymer degradation: a microbial approach
2017-03-23
[119]
논문
An updated genome-scale metabolic network reconstruction of Pseudomonas aeruginosa PA14 to characterize mucin-driven shifts in bacterial metabolism
2021-10
[120]
논문
Genome-scale model of Pseudomonas aeruginosa metabolism unveils virulence and drug potentiation
2023-02
[121]
보고서
Pest Risk Analysis (PRA) for Grain and Seed of Beans, Phaseolus vulgaris L. within East African Countries (Kenya, Burundi, Rwanda, Tanzania and Uganda): A Qualitative, Pathway-Initiated Risk Analysis)
http://repository.ea[...]
2021-10-19
[122]
웹사이트
Infection toll for recalled eyedrops climbs to 81, including 4 deaths, CDC says
https://www.npr.org/[...]
[123]
웹사이트
助川化学株式会社「緑膿菌」
http://www.sukegawa.[...]
[124]
웹사이트
アズワン「シュードモナス寒天培地ピオシアニン(ベクトン・ディッキンソン)」
https://axel.as-1.co[...]
[125]
웹사이트
金沢医科大学 臨床感染症学・感染症科「質問箱」
http://www.kanazawa-[...]
[126]
웹인용
"[네이버 지식백과] 녹농균 [Pseudomonas aeruginosa] (미생물학백과)"
https://terms.naver.[...]
[127]
웹인용
Pseudomonas aeruginosa
https://terms.naver.[...]
2022-02-09
[128]
웹인용
녹농균
https://terms.naver.[...]
2022-02-09
관련 사건 타임라인
( 최근 20개의 뉴스만 표기 됩니다. )
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com