모계 영향 유전
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
모계 영향 유전은 유전학에서 유기체의 표현형이 어머니의 유전자형에 의해 결정되는 현상을 의미한다. 이는 어머니가 난모세포에 mRNA나 단백질을 공급하기 때문에 발생하며, 초기 배아의 전사적 비활성 상태에서 중요하다. 모계 영향은 초파리의 초기 배아 발생, 조류의 알을 통한 호르몬 전달, 식물의 종자 특성에 영향을 미치며, 환경적 요인에 의한 표현형 변화, 부계 효과 유전자, 그리고 적응적 모계 영향으로도 나타난다. 적응적 모계 영향은 어미가 자손의 적합성을 높이는 방향으로 표현형 변화를 유도하며, 모계 식단과 환경은 후성유전적 변화에 영향을 미쳐 비만, 심혈관 질환, 당뇨병 등과 같은 질병 위험을 증가시킬 수 있다. 이러한 연구 결과는 한국 사회에서 비전염성 질환 예방, 산모와 아동 건강 증진, 농업 및 양식업 분야에 시사하는 바가 크다.
더 읽어볼만한 페이지
- 유전학 - 우생학
우생학은 인간의 유전적 특질 개선을 목표로 19세기 후반 골턴에 의해 체계화되었으며, 긍정적·부정적 방식으로 전개되었으나, 나치 독일의 인종정책과 결부되어 비판받으며 쇠퇴하였지만, 현대 사회에서도 유전자 선별과 관련된 논쟁이 지속되고 있다. - 유전학 - 행동유전학
행동유전학은 행동에 영향을 주는 유전적 요인과 환경적 요인을 연구하는 학문으로, 프랜시스 골턴의 연구에서 시작되었으나 우생학 논란을 겪었으며, 가족 연구, 쌍둥이 연구 등을 통해 발전해 왔지만 사회적 논쟁과 방법론적 한계에 대한 비판도 존재한다. - 생물학 - 균근
균근은 식물 뿌리와 균류 사이의 공생체로, 식물에게 물과 영양분을 공급하고 식물은 광합성 산물을 제공하며, 농업, 산림 복원 등 다양한 분야에서 활용될 수 있다. - 생물학 - 생명
생명은 환경 속에서 자기 유지, 증진, 강화를 하는 특징으로 정의되나 논쟁적이며, 항상성 유지, 세포 구조, 물질대사, 성장, 적응, 자극 반응, 생식 능력을 포함하고, 자기 복제와 진화로 유지되는 열린 열역학계로 설명되며, 기원은 약 40억 년 전으로 추정되고, 진화와 멸종이 공존하며, 바이러스, 외계 생명체, 인공 생명 연구가 진행 중이다.
| 모계 영향 유전 | |
|---|---|
| 일반 정보 | |
| 한국어 명칭 | 모계 효과 |
| 영어 명칭 | Maternal effect |
| 설명 | 어머니의 유전자형이 자손의 표현형에 영향을 미치는 현상 |
| 관련 현상 | 유전체 각인 후성 유전 |
| 상세 내용 | |
| 정의 | 자손의 표현형이 자손 자신의 유전자형이 아닌 모체의 유전자형에 의해 결정되는 현상 |
| 예시 | 달팽이 껍데기의 방향, 닭의 깃털 모양 |
| 유전적 메커니즘 | 난자 형성 과정에서 모체 유전자형에 따라 결정되는 mRNA 또는 단백질이 자손의 초기 발달에 영향을 미침 |
| 중요성 | 초기 발생 과정, 종 분화, 진화적 적응에 중요한 역할 |
| 추가 정보 | |
| 오해 | 모계 영향은 세포질 유전과는 다름 (세포질 유전은 세포 소기관의 유전 물질에 의해 발생) |
| 연구 분야 | 발생 생물학, 유전학, 진화 생물학 |
2. 유전학에서의 모계 영향
유전학에서 모계 영향은 유기체의 표현형이 어머니의 유전자형에 의해 결정될 때 발생하는 현상을 말한다.[1] 예를 들어, 어떤 돌연변이가 모계 영향 열성이라면, 해당 돌연변이에 대해 동형 접합성을 갖는 암컷은 겉보기에는 정상으로 보일 수 있다. 하지만 그 암컷의 자손은 해당 돌연변이에 대해 이형 접합성이더라도 돌연변이 표현형을 나타내게 된다.
| 모계 영향 유전 예시 | |||
|---|---|---|---|
 |  |  |  |
| 모든 자손은 야생형 표현형을 나타낸다 | 모든 자손은 돌연변이 표현형을 나타낸다 | ||
모계 영향은 주로 어머니가 난모세포에 특정 mRNA나 단백질을 미리 공급하기 때문에 나타난다. 따라서 어머니의 유전체가 이들 분자의 기능을 결정하게 된다. 많은 유기체에서 초기 배아는 스스로 유전 정보를 전사하는 능력이 없기 때문에, 어머니로부터 mRNA를 공급받는 것은 초기 발생 과정에 매우 중요하다.[2] 모계 영향 돌연변이는 일반적인 유전 양상과 다르므로, 이를 찾아내기 위해서는 특별한 유전자 스크리닝 기법이 필요하다. 일반적으로 접합자 단계에서 표현형을 확인하는 기존 스크리닝과 달리, 모계 영향 돌연변이를 찾기 위해서는 한 세대 더 나아간 자손 세대의 표현형을 검사해야 한다. 이는 자손의 표현형이 그 어머니의 유전자형에 의해 결정되기 때문이다.[3][4]
2. 1. 초파리 초기 배아 발생
Drosophila melanogaster 난모세포는 간호 세포라고 불리는 세포 집단과 밀접하게 연관되어 난소 챔버에서 발달한다. 난모세포와 간호 세포는 모두 단일 생식 세포 줄기 세포에서 유래하지만, 이들 세포 분열에서 세포질 분열이 불완전하여 간호 세포와 난모세포의 세포질은 고리 운하로 알려진 구조물에 의해 연결된다.[5] 난모세포만이 감수 분열을 거쳐 다음 세대에 DNA를 기여한다.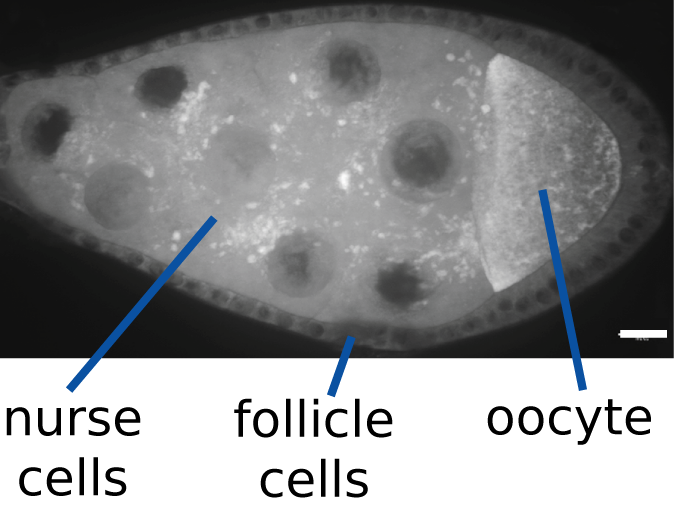
축 결정을 포함하여 초기 배아 발생 단계에 영향을 미치는 많은 모계 효과 Drosophila 돌연변이가 발견되었으며, 여기에는 bicoid, dorsal, gurken 및 oskar가 포함된다.[6][7][8] 예를 들어, 동형 접합 bicoid 어미에서 나온 배아는 머리와 가슴 구조를 생성하지 못한다.
bicoid 돌연변이에서 파괴된 유전자가 확인되자, bicoid mRNA가 간호 세포에서 전사된 후 난모세포로 재위치된다는 것이 밝혀졌다.[9] 다른 모계 효과 돌연변이는 유사하게 간호 세포에서 생성되어 난모세포에서 작용하는 산물이나, 이러한 재위치에 필요한 수송 기계의 일부에 영향을 미친다.[10] 이러한 유전자는 (모체) 간호 세포에서 발현되고 난모세포 또는 수정된 배아에서는 발현되지 않으므로, 모체의 유전자형이 기능 여부를 결정한다.
모계 효과 유전자는[11] 난자 형성 동안 어머니에 의해 발현되어 (수정 전에 발현) 난자의 전후 및 등배 복부 극성을 발달시킨다. 난자의 앞쪽 끝은 머리가 되고, 뒤쪽 끝은 꼬리가 된다. 등쪽 면은 위쪽에 있고, 복쪽 면은 아래쪽에 있다. 모계 효과 유전자의 산물인 모성 mRNA는 간호 세포와 난포 세포에 의해 생성되어 난자 세포(난모세포)에 축적된다. 발생 과정이 시작될 때 mRNA 기울기는 전후 및 등배 복부 축을 따라 난모세포에서 형성된다.
약 30개의 모성 유전자가 패턴 형성에 관여하는 것으로 확인되었다.[11] 특히, 네 개의 모계 효과 유전자의 산물은 전후 축 형성에 중요하다. 두 개의 모계 효과 유전자, bicoid와 hunchback의 산물은 앞쪽 구조의 형성을 조절하는 반면, 다른 한 쌍인 nanos와 caudal은 배아의 뒤쪽 부분 형성을 조절하는 단백질을 지정한다. bicoid, hunchback, caudal, nanos의 네 유전자 모두의 전사체는 간호 세포와 난포 세포에서 합성되어 난모세포로 수송된다.
2. 2. 조류에서의 모계 영향
새의 경우, 어미는 알을 통해 호르몬을 전달하여 새끼의 성장과 행동에 영향을 미칠 수 있다. 집 비둘기를 대상으로 한 실험에서는, 더 많은 난황 안드로겐을 함유한 알에서 부화한 병아리가 사회적으로 더 우위를 차지하는 경향을 보였다. 미국 쇠물닭과 같은 다른 조류에서도 비슷한 난황 안드로겐 수치의 변화가 관찰되었으나, 이것이 구체적으로 어떤 방식으로 영향을 미치는지에 대한 메커니즘은 아직 명확히 밝혀지지 않았다.[12]2. 3. 식물에서의 모계 영향
어머니 식물이 자라는 환경, 예를 들어 받는 빛의 양, 온도, 토양의 수분 상태, 영양분 공급 등은 같은 유전자형을 가진 식물이라도 종자의 품질에 차이를 만들 수 있다. 결과적으로 어미 식물의 환경 조건은 만들어지는 종자의 크기, 발아율, 생존력 등 여러 특성에 중요한 영향을 미치게 된다.[17]3. 환경적 모계 영향
어머니 식물이 접하는 빛, 온도, 토양 수분 및 영양분과 같은 환경적 단서는 동일한 유전자형 내에서도 종자 품질에 변화를 일으킬 수 있다. 따라서 어미 식물은 종자 크기, 발아율, 생존력과 같은 종자 특성에 큰 영향을 미친다.[17]
어미의 환경 또는 상태는 새끼의 유전자형과 무관하게 새끼의 표현형에 영향을 미칠 수 있다.
4. 부계 효과 유전자
(내용 없음 - 주어진 원본 소스에는 '부계 효과 유전자'에 대한 정보가 포함되어 있지 않아 해당 섹션 내용을 작성할 수 없음)
5. 적응적 모계 영향
어미의 환경이나 상태는 새끼의 유전자형과 관계없이 새끼의 표현형에 영향을 미칠 수 있다. 이 중 적응적 모계 영향(adaptive maternal effecteng)은 어미가 특정 환경 신호를 감지하고, 그 결과 자손의 적합도를 높이는 방향으로 표현형 변화를 유도하는 현상을 말한다.[21][23] 이는 어미가 자손의 생존이나 번식에 불리할 수 있는 환경 요인을 미리 감지하고, 자손이 해당 환경에 더 잘 대비할 수 있도록 '준비'시키는 방식으로 작동한다.[24]
적응적 모계 영향의 중요한 특징 중 하나는 표현형 가소성과 밀접하게 연관되어 있다는 점이다. 표현형 가소성은 유기체가 환경 변화에 대응하여 표현형을 조절하는 능력을 의미하며, 적응적 모계 영향은 이러한 가소성을 통해 발현되는 경우가 많다. (자세한 내용은 #표현형 가소성 참조) 또한, 적응적 모계 영향은 환경 특이성을 가진다. 즉, 특정 환경 신호에 대한 반응으로 나타나는 적응적인 변화이다.[24]
일반적인 모계 영향과 적응적 모계 영향을 구분하는 것이 중요할 때가 있다. 예를 들어, 특정 먹이(밤나무 잎)를 먹고 자란 독나방 어미가 낳은 자손이 더 빨리 성장하는 것은 모계 영향에 해당하지만,[25] 이것이 특정 환경 조건에 대한 적응적 반응(예: 자손의 식성 변화 유도)으로 나타난 것이 아니라면 '적응적' 모계 영향이라고 보기는 어렵다.[25] 핵심적인 차이는 적응적 모계 영향이 특정 환경 신호에 대한 반응이며, 그 결과가 자손의 적합도 증가로 이어진다는 점이다.
적응적 모계 영향은 자손이 다양한 환경에 직면할 가능성이 있고, 어미가 자손이 처할 환경을 어느 정도 예측할 수 있으며, 어미의 영향이 실제로 자손의 표현형을 변화시켜 적합도를 높일 수 있을 때 진화적으로 유리해진다.[25] 어미가 감지하는 환경 신호에는 포식자의 존재, 서식지의 질적 변화, 높은 개체군 밀도, 먹이의 양이나 질 변화 등이 포함될 수 있다.[26][27][28] 이러한 신호에 대한 어미의 반응은 자손이 특정 환경에 더 잘 적응하도록 돕는 중요한 메커니즘이 된다.
5. 1. 표현형 가소성
적응적 모계 영향은 어미가 자손의 생존에 불리할 수 있는 환경 신호를 감지하고, 이에 대응하여 자손이 미래 환경에 더 잘 대비할 수 있도록 표현형 변화를 유도하는 것을 의미한다.[21][23] 이러한 적응적 모계 영향의 핵심적인 특징 중 하나는 바로 표현형 가소성이다. 표현형 가소성이란 하나의 유전자형이 다양한 환경 조건에 반응하여 여러 다른 표현형을 나타낼 수 있는 능력을 말한다.[24] 즉, 유기체는 표현형 가소성을 통해 변화하는 환경에 맞춰 자신의 특성을 조절함으로써 적합도를 높일 수 있다. 이는 유기체와 집단이 단기적인 환경 변화에 적응하는 데 매우 중요한 메커니즘이다.[29][30]모계 영향이 적응적인지 여부는 환경 특이성에 달려있다. 예를 들어, 어미가 특정 환경(예: 포식자 위협, 먹이 부족)을 감지하고 그 결과 자손이 해당 환경에 더 잘 생존할 수 있는 방향으로 표현형(행동, 형태, 생리 등)이 변한다면 이는 적응적 모계 영향이며, 표현형 가소성의 결과로 볼 수 있다.[24][25] 이러한 적응적 모계 영향은 자손이 다양한 환경에 직면할 가능성이 있고, 어미가 자손이 처할 환경을 어느 정도 예측할 수 있으며, 어미의 영향이 실제로 자손의 표현형을 변화시켜 적합도를 높일 수 있을 때 진화적으로 유리해진다.[25]
적응적 모계 영향으로 인한 표현형 가소성의 예시는 다양하다.
- 북미 적색다람쥐(Northern American red squirrels)의 경우, 어미가 높은 인구 밀도(낮은 먹이 가용성을 의미)를 감지하면 평균보다 몸집이 크고 성장 속도가 빠른 새끼를 낳는다. 이 새끼들은 첫 겨울 동안 생존율이 더 높아 결과적으로 적합도가 증가한다.[26]
- 씨앗 딱정벌레의 일종인 Stator limbatusla는 어떤 숙주 식물에서 번식하느냐에 따라 알의 크기를 다르게 낳는 가소성을 보인다. 흔한 숙주 식물인 Cercidium floridumla에서는 큰 알을 낳는 것이 유리하고, Acacia greggiila에서는 작은 알을 낳는 것이 유리하다. 실험 결과, 특정 숙주 식물에 적응한 어미가 낳은 알이 다른 숙주 식물에 놓였을 때보다 생존율이 높았는데, 이는 알 크기 생산의 가소성뿐만 아니라 어미 환경이 자손 생존에 직접적인 영향을 미침을 보여준다.[27]
- 많은 곤충에서 환경 신호에 따른 표현형 가소성이 관찰된다:[31]
- 급격한 온도 하강이나 일조량 감소는 자손이 휴면 상태에 들어가도록 유도하여 추위에 대한 저항력을 높이고 에너지를 보존하게 한다.
- 영양분이 부족한 환경에 알을 낳아야 할 경우, 어미는 더 큰 알을 낳아 자손에게 더 많은 초기 자원을 제공한다.[27]
- 서식지 환경이 열악하거나 개체수가 과밀할 경우, 날개가 있는 자손을 낳아 더 나은 환경으로 이동할 수 있도록 한다.
이처럼 표현형 가소성은 적응적 모계 영향을 통해 유기체가 변화하는 환경에 효과적으로 대응하고 생존 가능성을 높이는 중요한 전략이다.
6. 모계 식단 및 환경이 후성유전적 영향에 미치는 영향
모계의 식단이나 노출되는 환경 요인은 자손의 건강과 특정 질병에 대한 감수성에 후성유전적 메커니즘을 통해 영향을 미칠 수 있다. 이러한 영향은 유전자 서열 자체를 바꾸는 것이 아니라, 어떤 유전자가 언제, 얼마나 발현될지를 조절하는 방식으로 나타난다.
모계 식단이 유발하는 후성유전적 변화에 대한 이해는 과학 연구뿐만 아니라 일반 대중에게도 중요한 의미를 지닌다. 특히 암, 비만, 심장 질환과 같은 비전염성 질환이 전 세계적으로 증가하는 상황에서, 이러한 질병의 원인을 이해하는 데 중요한 단서를 제공한다. 일부 질병은 모계의 식단이나 환경 노출로 인한 후성유전적 변화와 깊은 관련이 있는 것으로 밝혀지고 있다. 만약 질병과 관련된 특정 후성유전적 표지를 식별할 수 있다면, 질병의 조기 진단 가능성을 높이고, 나아가 이러한 후성유전적 영향을 되돌리거나 조절하는 새로운 치료법 개발 연구로 이어질 수 있다. 이는 특정 유전자나 유전체 변화를 표적으로 하는 약물 개발 등 제약 산업과의 연계를 통해 구체화될 수 있다.
사회적으로는 임신 중 특정 식단이나 환경 요인 노출의 잠재적 위험성에 대한 인식을 높여, 예방적인 노력을 기울이도록 유도할 수 있다. 이는 장기적으로 다음 세대의 건강 문제를 줄이고 사회 전체의 건강 수준 향상에 기여할 잠재력을 가진다.
이러한 모계의 영향은 인간에게만 국한되지 않고 다른 생물 종에게도 관찰된다. 예를 들어, 기후 변화와 같은 환경 변화는 생태계 내 종 구성과 먹이 자원의 가용성에 영향을 미치고, 이는 다시 번식기 암컷의 식단과 그 자손의 후성유전적 특성에 연쇄적인 영향을 줄 수 있다. 따라서 후성유전학적 메커니즘에 대한 이해는 변화하는 환경 속에서 생태계 변화를 예측하고, 생태학적, 경제적, 문화적으로 중요한 종들을 보존하는 데 도움을 줄 수 있다.
나아가 농업 및 양식업 분야에서도 모계의 식단이나 환경 조건을 조절하여 가축이나 양식 어류의 건강과 생산성을 향상시키는 지속 가능한 사육 방식을 개발하는 데 활용될 수 있다. 이는 생산 비용 절감과 소비자에게 더 건강한 식품을 제공하는 데 기여할 수 있다.
한편, 어머니가 환경 신호에 반응하여 자손의 표현형을 조절함으로써 자손의 생존 적합성을 높이는 적응적 모계 영향 역시 후성유전적 조절의 중요한 측면이다.[21] 이는 환경 변화에 대한 생물학적 적응 전략으로서 표현형 가소성의 중요성을 보여준다.
6. 1. 임신 중 고혈당증과 비만 및 심장 질환
임신 중 고혈당증은 태어나는 아기의 렙틴 유전자에 후성 유전적 변화를 일으켜, 나중에 비만이나 심장 질환에 걸릴 위험을 높일 수 있다고 여겨진다. 렙틴은 지방세포에서 분비되어 식욕을 억제하는 역할을 하기 때문에 "포만 호르몬"이라고도 불린다. 동물 실험과 인간 관찰 연구에 따르면, 태어나기 직전과 직후의 기간(주산기) 동안 렙틴 수치가 급증하는 것이 장기적으로 비만 위험을 높이는 데 중요한 역할을 할 수 있다. 주산기는 보통 임신 22주부터 시작하여 출생 후 1주일까지의 기간을 말한다.어머니의 혈당 수치와 아기의 렙틴 유전자 주변 DNA 메틸화 상태 사이의 관계를 조사한 연구가 있다. DNA 메틸화는 유전자의 작동을 조절하는 후성 유전적 기전 중 하나이다. 연구 결과, 어머니의 혈당 수치가 높을수록 아기의 렙틴 호르몬 생산을 조절하는 LEP 유전자의 메틸화 정도는 낮아지는 반비례 관계가 나타났다. 즉, 어머니의 혈당이 높으면 아기의 LEP 유전자 메틸화가 덜 되어, 결과적으로 LEP 유전자가 더 자주 전사되고 혈중 렙틴 농도가 높아지게 된다.[33]
주산기 동안 이렇게 혈중 렙틴 농도가 높은 상태는 성인이 되었을 때 비만과 관련이 있는 것으로 나타났다. 이는 임신 기간 동안 높은 렙틴 수치가 아이의 몸에서 "정상"으로 인식되도록 설정되었기 때문일 수 있다. 비만은 심장 질환의 주요 원인 중 하나이므로, 임신 중 고혈당으로 인한 렙틴 수치의 변화는 비만뿐만 아니라 심장 질환의 위험 증가와도 관련이 있다고 볼 수 있다.
6. 2. 임신 중 고지방 식단과 대사 증후군
임신 중 고지방 식단은 자궁 내 환경에 영향을 미쳐 자손의 대사 증후군 발병 위험을 높일 수 있는 것으로 여겨진다.[35] 대사 증후군은 비만과 인슐린 저항성을 포함하는 복합적인 상태로, 종종 제2형 당뇨병, 고혈압, 죽상 동맥 경화증과 같은 질환으로 이어질 수 있다.[35]생쥐를 이용한 동물 모델 연구에 따르면, 임신 중 고지방 식단은 자손의 아디포넥틴 및 렙틴 유전자에 후성 유전적 변형을 일으켜 유전자 발현을 변화시키고, 결과적으로 대사 증후군 발병에 기여할 수 있다.[35] 아디포넥틴은 포도당 대사와 지방산 분해 조절에 관여하는 호르몬으로, 정확한 작용 기전은 아직 완전히 알려지지 않았지만, 사람과 생쥐 모델 모두에서 근육 및 간 조직의 인슐린 감수성을 높이고 항염증 효과를 나타내는 것으로 밝혀졌다.[34] 또한 생쥐에서는 지방산의 운반 및 산화 속도를 증가시켜 지방산 대사를 촉진하는 역할도 한다.[34]
연구 결과, 임신 중 고지방 식단을 섭취한 어미 생쥐의 자손에서는 아디포넥틴 유전자의 프로모터 부위에 메틸화가 증가하고 아세틸화가 감소하는 변화가 관찰되었다.[35] 이러한 후성 유전적 변화는 일반적으로 유전자의 전사를 억제하기 때문에, 아디포넥틴의 생성을 감소시킬 가능성이 높다.[35] 동시에 식욕 억제와 에너지 소비 조절에 관여하는 렙틴 유전자의 프로모터에서도 메틸화가 증가하여 렙틴 생성 역시 감소하는 것으로 나타났다.[35]
결과적으로, 포도당 흡수와 지방 분해를 돕는 아디포넥틴과 포만감을 느끼게 하는 렙틴의 분비가 모두 감소하면서, 자손 생쥐는 일생 동안 지방량 증가, 포도당 불내성, 고트리글리세라이드혈증, 비정상적인 호르몬 수치, 고혈압 등의 대사 이상 증상을 나타냈다.[35]
하지만 이러한 후성 유전적 영향이 영구적이지 않을 수 있다. 해당 연구에서는 고지방 식단의 영향을 받은 생쥐의 후손에게 3세대 동안 정상적인 식단을 제공하자 대사 증후군 관련 증상들이 사라지는 것이 관찰되었다.[35] 이는 후성 유전적 표지가 다음 세대로 전달되더라도 환경 요인(이 경우 식단)의 변화에 따라 다시 변형되거나 제거될 수 있음을 시사한다.[35]
현재까지 자궁 내 고지방 식단이 사람에게 미치는 구체적인 영향에 대한 연구는 생쥐 모델에 비해 부족한 실정이다.[35] 그러나 사람에서도 낮은 아디포넥틴 수치는 비만, 인슐린 저항성, 제2형 당뇨병, 관상 동맥 질환 등과 관련이 있다는 사실이 밝혀져 있다.[34] 따라서 생쥐 모델 연구에서 관찰된 메커니즘이 사람의 대사 증후군 발병에도 유사하게 작용할 가능성이 제기되고 있다.[34] 이러한 연구 결과는 임신 중 산모의 식단이 자녀의 장기적인 대사 건강에 영향을 미칠 수 있는 가능성을 시사한다.
6. 3. 임신 중 고지방 식단과 만성 염증
임신 중 고지방 식단은 자궁 내 환경에 영향을 미쳐 태아에게 대사 증후군과 유사한 상태를 유발할 수 있는 것으로 여겨진다. 대사 증후군은 비만과 인슐린 저항성을 포함하는 여러 증상이 함께 나타나는 상태로, 제2형 당뇨병, 고혈압, 죽상 동맥 경화증과 같은 심각한 질환으로 이어질 위험이 높다.생쥐를 이용한 동물 모델 연구에 따르면, 임신 중 어미 쥐에게 고지방 식단을 제공했을 때 태어난 새끼 쥐에게서 후성 유전적 변화가 관찰되었다. 구체적으로 포도당 대사와 지방산 분해를 조절하는 아디포넥틴 유전자와 식욕 억제 및 포만감 신호에 관여하는 렙틴 유전자의 발현 방식에 변화가 생겼다. 고지방 식단은 아디포넥틴 유전자 프로모터(유전자 발현 조절 부위)의 메틸화를 증가시키고 아세틸화를 감소시켰으며, 렙틴 유전자 프로모터의 메틸화도 증가시켰다.[35] 이러한 후성 유전적 변화는 일반적으로 유전자 발현을 억제하는 효과가 있어, 결과적으로 아디포넥틴과 렙틴 호르몬의 생성이 감소하게 된다.[34][35]
아디포넥틴은 인슐린 감수성을 높이고 항염증 작용을 하는 중요한 호르몬으로 알려져 있다.[34] 따라서 아디포넥틴과 렙틴의 감소는 새끼 쥐의 일생에 걸쳐 지방량 증가, 포도당 불내성(혈당 조절 능력 저하), 고트리글리세라이드혈증(혈중 중성지방 증가), 비정상적인 호르몬 수치, 고혈압과 같은 대사 이상을 유발했다.[35] 이는 아디포넥틴의 항염증 기능 저하가 만성적인 염증 상태 및 관련 질환 발생 위험 증가와 연관될 수 있음을 시사한다. 흥미롭게도 이러한 후성 유전적 영향은 다음 세대로 전달될 수 있지만, 정상적인 식단을 섭취한 지 세 세대가 지나면 그 효과가 사라지는 것으로 나타났다. 이는 후성 유전적 표지가 환경 요인(여기서는 식단)에 의해 변화될 수 있으며, 시간이 지남에 따라 되돌릴 수도 있음을 보여준다.[35]
인간의 경우, 임신 중 고지방 식단이 태아에게 미치는 구체적인 후성 유전적 영향에 대한 연구는 아직 부족하다. 그러나 아디포넥틴 수치 감소가 비만, 인슐린 저항성, 제2형 당뇨병, 관상 동맥 질환과 관련이 있다는 점은 여러 연구를 통해 밝혀졌다.[34] 따라서 생쥐 모델에서 관찰된 것과 유사한 메커니즘이 인간의 대사 증후군 발생에도 기여할 수 있을 것으로 추정된다.[34] 이러한 연구 결과는 임신 중 산모의 식단 관리가 태아의 장기적인 건강에 미치는 중요성을 강조한다.
6. 4. 임신 중 영양 결핍과 심혈관 질환
임신 중 고혈당증은 태어날 아기의 렙틴 유전자에 후성유전학적 변화를 일으켜, 장기적으로 비만 및 심장 질환의 위험을 높일 수 있는 것으로 보인다. 렙틴은 지방 세포에서 분비되어 식욕을 억제하는 역할을 하므로 "포만 호르몬"이라고도 불린다. 동물 실험 및 인간 관찰 연구 결과, 임신 후기부터 출생 후 1주까지의 주산기 동안 렙틴 수치가 급증하는 것이 장기적인 비만 위험과 관련이 있음이 시사되었다. 연구에 따르면, 임신부의 혈당 수치가 높을수록 태아의 렙틴 유전자(LEP) 주변 DNA 메틸화 정도는 낮아지는 반비례 관계가 나타났다. 낮은 메틸화 상태는 LEP 유전자의 발현을 증가시켜 혈중 렙틴 농도를 높인다.[33] 주산기의 높은 렙틴 농도는 성인기 비만과 연관되는데, 이는 임신 중에 더 높은 렙틴 수치가 '정상'으로 설정되기 때문일 수 있다. 비만은 심장 질환의 주요 원인이므로, 이러한 렙틴 수치의 변화는 비만뿐 아니라 심장 질환의 위험 증가와도 관련된다.또한, 임신 중 고지방 식단은 자궁 내 환경에서 대사 증후군을 유발할 수 있는 요인으로 지목된다. 대사 증후군은 비만, 인슐린 저항성, 고혈압, 죽상 동맥 경화증 등 여러 건강 문제를 포함하며, 제2형 당뇨병 발병 위험을 높인다. 생쥐를 이용한 연구에서는 임신 중 고지방 식단이 아디포넥틴과 렙틴 유전자의 발현을 조절하는 후성유전학적 변화를 일으켜 대사 증후군 발생에 기여함을 보여주었다. 아디포넥틴은 포도당 대사와 지방산 분해를 조절하며, 인슐린 감수성을 높이고 항염증 효과를 나타낸다. 임신한 생쥐에게 고지방 식단을 제공했을 때, 자손의 아디포넥틴 유전자 프로모터 부위의 메틸화는 증가하고 아세틸화는 감소하여 유전자 발현이 억제되었다. 동시에 렙틴 유전자 프로모터의 메틸화도 증가하여 렙틴 생성 역시 감소했다.[34] 이러한 변화는 포도당 흡수와 지방 분해를 돕는 아디포넥틴과 포만감을 느끼게 하는 렙틴의 부족으로 이어져, 결과적으로 지방량 증가, 포도당 불내성, 고중성지방혈증, 비정상적인 호르몬 수치, 고혈압 등을 유발했다. 다만, 이러한 후성유전학적 영향은 정상 식단을 섭취한 지 3세대 후에는 사라지는 것으로 나타나, 식단 조절을 통해 다음 세대에서 영향을 줄일 수 있음을 시사한다.[35] 인간의 경우, 자궁 내 고지방 식단의 직접적인 영향에 대한 연구는 아직 부족하지만, 아디포넥틴 수치 감소가 비만, 인슐린 저항성, 제2형 당뇨병 및 관상 동맥 질환과 관련이 있다는 점을 고려할 때, 생쥐 모델에서 관찰된 것과 유사한 메커니즘이 인간의 대사 증후군 및 관련 심혈관 질환 발생에도 영향을 미칠 수 있다고 추정된다.[34]
6. 5. 임신 중 영양 제한과 제2형 당뇨병
2015년 에드워드 아처(Edward Archer)는 모체 영양 대사의 비유전적 진화를 통한 누적된 모체 영향이 전 세계적인 비만 및 제2형 당뇨병 증가의 원인일 수 있다고 주장했다.[13][14][15][16] 그는 모체 대사 조절 능력 감소가 태아의 췌장 베타 세포, 지방 세포, 근육 세포 발달을 변화시켜, 영양 에너지 획득 및 저장 과정에서 지방 세포가 지속적으로 우위를 점하게 만든다고 보았다.임신 중 고지방 식단은 자궁 내에서 대사 증후군을 유발할 수 있는 요인으로 지목된다. 대사 증후군은 비만과 인슐린 저항성을 포함하는 여러 증상이 복합적으로 나타나는 상태로, 제2형 당뇨병뿐만 아니라 고혈압, 죽상 동맥 경화증과도 관련이 깊다. 생쥐 모델 연구에 따르면, 임신 중 고지방 식단은 아디포넥틴 및 렙틴 유전자에 후생 유전적 변형을 일으켜 유전자 발현을 변화시키며, 이는 대사 증후군 발병에 기여한다. 아디포넥틴은 포도당 대사 및 지방산 분해를 조절하는 데 관여하며, 특히 근육 및 간 조직에서 인슐린 감수성을 높이고 항염증 효과를 나타내는 것으로 알려져 있다.[34] 임신 중 고지방 식단은 아디포넥틴 유전자 프로모터의 메틸화를 증가시키고 아세틸화를 감소시켜 유전자 발현을 억제할 수 있다. 또한 렙틴 프로모터의 메틸화 증가로 렙틴 생성도 감소시킨다. 결과적으로 포도당 흡수와 지방 분해를 돕는 아디포넥틴과 포만감을 유발하는 렙틴이 모두 줄어들어, 자손에서 지방량 증가, 포도당 불내성, 고중성지방혈증, 비정상적인 호르몬 수치, 고혈압 등이 나타날 수 있다. 다만, 이러한 영향은 정상 식단을 섭취한 후 3세대가 지나면 사라지는 것으로 나타나, 후생 유전적 표지가 비교적 짧은 시간 안에 변경될 수 있음을 시사한다.[35]
인간의 경우, 자궁 내 고지방 식단의 직접적인 영향에 대한 연구는 상대적으로 적지만, 아디포넥틴 수치 감소가 비만, 인슐린 저항성, 제2형 당뇨병, 관상 동맥 질환과 관련이 있다는 점은 잘 알려져 있다. 따라서 생쥐 모델에서 관찰된 메커니즘이 인간의 대사 증후군 및 제2형 당뇨병 발병에도 유사하게 기여할 가능성이 제기된다.[34]
6. 6. 임신 중 고단백 식단과 혈압 및 지방 증가
임신 중 고지방 식단은 자궁 내에서 대사 증후군을 유발할 수 있는 것으로 여겨진다. 대사 증후군은 비만과 인슐린 저항성을 포함하는 여러 증상이 복합적으로 나타나는 상태이며, 제2형 당뇨병, 고혈압, 죽상 동맥 경화증과 관련이 깊다.[34]생쥐 모델을 이용한 연구에 따르면, 임신 중 고지방 식단은 아디포넥틴과 렙틴 유전자에 후성유전학적 변형을 일으켜 유전자 발현을 변화시키고, 이는 대사 증후군 발병에 기여할 수 있다. 아디포넥틴은 포도당 대사와 지방산 분해를 조절하는 호르몬으로, 인슐린 감수성을 높이고 항염증 효과를 나타낸다. 또한 생쥐 실험에서는 지방산 운반 및 산화 속도를 증가시켜 지방산 대사를 촉진하는 것으로 확인되었다.[34] 임신 중 고지방 식단은 아디포넥틴 유전자 프로모터 부위의 메틸화를 증가시키고 아세틸화를 감소시켜 유전자 발현을 억제할 가능성이 있다. 동시에 렙틴 유전자 프로모터의 메틸화도 증가시켜 '포만 호르몬'으로 알려진 렙틴의 생산을 감소시킨다.[35]
결과적으로, 포도당 흡수와 지방 분해를 돕는 아디포넥틴과 포만감을 느끼게 하는 렙틴의 분비가 모두 감소하게 된다. 이러한 호르몬 변화는 자손에게서 평생에 걸쳐 지방량 증가, 포도당 불내성, 고중성지방혈증, 비정상적인 호르몬 수치, 그리고 고혈압을 유발하는 원인이 될 수 있다. 다만, 이러한 후성유전학적 영향은 정상 식단을 섭취한 지 3세대 후에는 사라지는 것으로 나타나, 후성유전학적 표지가 한 세대 안에서도 변할 수 있으며 시간이 지남에 따라 완전히 제거될 수도 있음을 시사한다.[35]
인간의 경우, 자궁 내 고지방 식단이 미치는 구체적인 영향에 대한 연구는 아직 제한적이다. 그러나 인간에서도 아디포넥틴 수치가 낮으면 비만, 인슐린 저항성, 제2형 당뇨병, 관상동맥질환과 관련이 있다는 사실이 밝혀져 있어, 생쥐 모델에서 관찰된 것과 유사한 기전이 인간의 대사 증후군 발병에도 기여할 수 있을 것으로 추정된다.[34]
6. 7. 신생아 에스트로겐 노출과 전립선암
(내용 없음 - 주어진 원본 소스에 해당 섹션 제목과 관련된 내용이 없습니다.)6. 8. 보충제를 통한 후성유전적 변화 역전 가능성
자궁 안이나 태어난 직후 비스페놀 A(BPA)에 노출되면 후성유전적 변화가 일어날 수 있다. BPA는 폴리카보네이트 플라스틱 제조에 사용되는 화학 물질로, 높은 체중, 유방암, 전립선암, 생식 기능 변화 등과 관련이 있는 것으로 알려져 있다.쥐를 이용한 실험에서, 어미 쥐가 BPA를 섭취했을 때 새끼 쥐는 아구티 유전자 상류에 위치한 레트로트랜스포존 프로모터 영역의 메틸화 상태가 낮아지는 경향을 보였다. 아구티 유전자는 털 색깔을 결정하는 데 관여하는데, 이 유전자의 메틸화가 낮아지면 쥐는 황색 털을 가질 가능성이 커진다.
하지만 이러한 BPA에 의한 후성유전적 변화는 특정 영양소 보충을 통해 되돌릴 수 있는 가능성이 제시되었다. BPA를 섭취한 어미 쥐에게 엽산이나 식물성 에스트로겐과 같은 메틸기를 제공하는 영양소를 함께 보충해주었더니, 아구티 유전자의 낮은 메틸화 현상이 사라지는 것이 관찰되었다. 이는 식단 조절이나 영양 보충을 통해 환경 요인에 의한 후성유전적 변화를 되돌릴 수 있다는 점을 시사한다.[41]
7. 모계 식단의 영향과 생태학
모계 영향은 인간뿐만 아니라 동물계의 다양한 분류군에서도 관찰되며, 개체군 전체와 여러 세대에 걸쳐 영향을 미쳐 더 큰 규모의 생태학적 변화를 가져올 수 있다. 모계 식단으로 인한 후성유전적 변화는 자손이 태어날 환경을 예측하고 이에 적응할 수 있도록 표현형적 가소성을 부여한다. 어미의 식단을 통해 전달되는 후성유전적 정보는 자손이 앞으로 마주할 환경에 더 잘 적응하도록 돕는 중요한 기전이며, 다양한 생태학적 신호와 후성유전적 기전을 통해 미래 세대에게 적응적 이점을 제공한다.
또한, 모계 식단의 영향은 지구 기후 변화와 같은 환경 변화 예측에도 중요한 단서를 제공한다. 후성유전적 메커니즘을 이해하면, 변화하는 환경 조건이 생태학적, 경제적, 문화적으로 중요한 종들의 군집 구조에 미칠 영향을 더 정확하게 예측할 수 있다. 많은 생태계에서 종 구성 변화는 영양소 가용성 변화를 유발하며, 이는 번식기 암컷의 먹이 선택에 영향을 미친다.
모계 식단 영향에 대한 지식은 농업 및 양식업 분야의 지속 가능한 발전을 위해서도 활용될 수 있다. 사육자들은 과학적 데이터를 바탕으로 더 효율적이고 환경친화적인 사육 방식을 개발하여 생산 비용을 절감하고 소비자에게도 혜택을 줄 수 있다.
생태학 분야에서 모계 식단 영향의 다양한 사례가 보고되고 있지만, 이러한 표현형 변화의 기저에 있는 구체적인 후성유전적 메커니즘 연구는 아직 부족하다. 앞으로 생태학자, 후성유전학자, 유전체학 연구자들이 협력하여 환경 요인, 후성유전적 변화, 그리고 표현형 다양성 사이의 관계를 통합적으로 이해하려는 노력이 필요하다.
7. 1. 부모의 식단이 자손의 면역력에 미치는 영향
쌀도둑나방(''Plodia interpunctella'')은 식품 저장 구역에서 흔히 발견되는 나방으로, 부모 세대의 식단이 자손의 특성에 영향을 미치는 현상(모계 및 부계 식단 영향 모두)을 보여준다.[42] 부모 나방의 식단은 자손에게 후성유전적 변화를 유발할 수 있는데, 이는 멜라닌 생성에 관여하는 효소인 페놀산화효소의 생산량에 영향을 미친다. 페놀산화효소는 여러 무척추동물 종에서 특정 병원체에 대한 저항 능력과 관련이 있는 것으로 알려져 있다.[42]한 연구에서는 번식 기간 동안 부모 나방을 영양분이 풍부한 환경과 부족한 환경으로 나누어 사육했다. 그 결과, 영양분이 부족한 환경에서 자란 부모에게서 태어난 자손은 영양분이 풍부한 환경에서 번식한 부모의 자손보다 페놀산화효소를 더 적게 생산했으며, 이는 면역 체계가 상대적으로 약화되었음을 시사한다.[42] 이러한 현상은 자손이 발달 과정에서 '영양 기회가 부족할 것'이라는 신호를 미리 받아 적응하는 과정으로 해석될 수 있다. 즉, 나방은 이 신호를 바탕으로 한정된 에너지를 면역 체계 유지보다는 생존율을 높이고 다음 세대를 생산하기 위한 성장과 번식에 우선적으로 배분하는 전략을 취하는 것이다.[42] 이러한 효과를 설명하는 한 가지 가설은 한쪽 부모로부터 물려받은 유전자만이 발현되는 유전자 각인 현상이지만, 이를 명확히 밝히기 위해서는 추가적인 연구가 필요하다.[42]
부모 세대의 식단에 의해 매개되는 이러한 후성유전적 효과는 야생 생물 개체군 전체에도 영향을 미칠 수 있다. 개체군 구성원들의 면역력이 전반적으로 변화하면, 병원체의 유입과 같은 환경 변화에 해당 개체군이 더욱 취약해질 수 있다. 결과적으로, 이러한 세대 간 후성유전적 효과는 후성유전적으로 변화를 겪은 자손이 부모 세대와 다른 환경 조건에 처했을 때 개체군의 안정성을 떨어뜨려 개체군 역학에 영향을 줄 수 있다.[42]
7. 2. 모계 식단이 자손의 성장 속도에 미치는 영향
구강 부화 시클리드의 일종인 ''Simochromis pleurospilus''는 어미가 섭취하는 먹이의 양에 따라 자손의 성장 속도가 달라지는 후성 유전적 영향을 받는다. 먹이가 풍부한 환경의 어미는 작지만 많은 수의 알을 낳는 반면, 먹이가 부족한 환경의 어미는 크지만 적은 수의 알을 낳는다. 알의 크기는 부화하는 유충의 크기와 관련이 있어, 작은 알에서는 작은 유충이 태어난다. 시클리드의 경우, 작은 유충은 큰 알에서 태어난 유충보다 더 빠르게 성장하는데, 이는 성장 호르몬 수용체(GHR) 유전자의 발현이 증가하기 때문이다. GHR 유전자 발현이 늘어나면 성장 호르몬(GH)과 결합할 수 있는 수용체가 많아져 작은 물고기의 성장 속도가 빨라진다. 몸집이 큰 물고기는 포식자에게 잡아먹힐 확률이 낮으므로, 생애 초기에 빠르게 성장하는 것이 생존에 유리하다. GHR 유전자 발현을 조절하는 정확한 메커니즘은 아직 밝혀지지 않았으나, 어미가 알에 저장하는 난황 속 호르몬이나 난황 자체의 양이 DNA 메틸화나 히스톤 변형 같은 후성 유전적 조절을 통해 유전자 발현 수준에 영향을 미칠 가능성이 있다.[43]생태학적으로 이는 어미가 주변 환경을 활용하여 의식적인 노력 없이도 자손의 생존 가능성을 최대화하는 전략으로 볼 수 있다. 자원이 풍부하면 어미는 많은 자손을 낳고, 이 자손들은 빠르게 성장하여 포식 위험을 줄인다. 반면 자원이 부족하면 어미는 적은 수의 자손을 낳지만, 이 자손들은 태어날 때부터 큰 몸집을 가져 성체까지 생존할 확률을 높인다. 또한, 구강 부화 시클리드는 자손을 입에 물고 키우는 부모 보살핌을 제공하는데, 빠르게 성장하는 자손은 더 빨리 독립하여 부모가 양육에 들이는 에너지를 줄여주는 효과도 있다.
이와 유사한 현상은 성게의 일종인 ''Strongylocentrotus droebachiensis''에서도 관찰된다. 영양 상태가 좋은 어미 성게는 작지만 많은 알을 낳고, 이 알에서 태어난 유충(플라눌라)은 영양 상태가 나쁜 어미의 큰 알에서 태어난 유충보다 더 빠르게 성장한다. 성게 유충 역시 유충 단계를 빨리 끝내고 어린 성게로 변태하는 것이 포식 위험을 줄이는 데 유리하다. 성게 유충은 어미의 영양 상태와 유충 시기의 영양 상태에 따라 두 가지 다른 모습(표현형)으로 발달할 수 있다. 영양 공급이 충분하여 빠르게 성장하는 유충은 에너지를 주로 어린 성게 형태로 발달하는 데 사용한다. 반면, 영양 공급이 부족하여 느리게 성장하는 유충은 생존율을 높이기 위해 포식자로부터 자신을 보호할 가시 같은 부속물을 키우는 데 더 많은 에너지를 투자한다. 이러한 표현형 변화를 일으키는 후성 유전 메커니즘은 아직 명확히 밝혀지지 않았지만, 특정 영양 수준이 발달 과정에 영향을 미치는 후성 유전적 변화를 유발하여 최종적인 유충의 모습을 결정하는 것으로 추정된다.[44]
8. 한국 사회에의 시사점
모계의 식단이 자녀의 후성유전적 특성에 영향을 미친다는 사실은 단순히 과학 연구의 영역을 넘어 사회 전체에 중요한 의미를 가진다. 특히 한국 사회가 당면한 건강 문제와 관련하여 주목할 필요가 있다.
최근 서구화된 식습관과 생활 방식의 변화로 비만, 당뇨병, 심장병 등 만성 비전염성 질환의 유병률이 증가하고 있다. 이러한 질병 중 일부는 태아기 또는 초기 발달 과정에서 어머니의 영양 상태나 식단에 의한 후성유전적 변화와 관련이 있을 수 있다. 모계 영향을 통해 특정 질병 발생 위험을 높이는 유전체 표지가 확인된다면, 질병의 조기 예측 및 예방 전략 수립에 기여할 수 있다. 나아가 후성유전적 변화를 되돌리거나 조절하는 치료법 개발의 가능성도 열릴 수 있다.
이러한 연구 결과는 임신을 계획하거나 임신 중인 여성에게 건강한 식단과 생활 습관의 중요성을 다시 한번 강조한다. 산모의 건강과 영양 관리는 단순히 임신 기간 동안의 건강 유지를 넘어, 태어날 자녀의 장기적인 건강에까지 영향을 미치는 중요한 요소이다. 따라서 임신 중 영양 관리의 중요성에 대한 사회적 인식을 높이고, 모든 산모가 적절한 건강 관리와 영양 지원을 받을 수 있도록 사회적 관심과 정책적 지원이 필요하다. 이는 저출산·고령화 시대에 미래 세대의 건강을 확보하고 건강 불평등을 완화하는 데 중요한 역할을 할 수 있다.
모계 영향 유전에 대한 올바른 지식을 대중에게 알리는 것은 개개인이 건강한 선택을 하도록 돕고, 잠재적인 건강 위험을 줄이는 데 기여할 수 있다. 이는 궁극적으로 국민 전체의 건강 수준을 향상시키는 긍정적인 효과로 이어질 수 있을 것이다.
참조
[1]
서적
An Introduction to genetic analysis
https://www.ncbi.nlm[...]
W. H. Freeman
[2]
논문
The maternal-zygotic transition: death and birth of RNAs
2007-04
[3]
논문
The art and design of genetic screens: ''Caenorhabditis elegans''
2002-05
[4]
논문
The art and design of genetic screens: ''Drosophila melanogaster''
2002-03
[5]
논문
''Drosophila'' oogenesis
2008-12
[6]
논문
A dorso-ventral shift of embryonic primordia in a new maternal-effect mutant of ''Drosophila''
1980-01
[7]
논문
Germline autonomy of maternal-effect mutations altering the embryonic body pattern of ''Drosophila''
1986-02
[8]
논문
Determination of anteroposterior polarity in ''Drosophila''
1987-12
[9]
논문
The role of localization of ''bicoid'' RNA in organizing the anterior pattern of the ''Drosophila'' embryo
1988-06
[10]
논문
Seeing is believing: the Bicoid morphogen gradient matures
2004-01
[11]
서적
Life Sciences : Fundamentals and practice.
Pathfinder Academy
2013
[12]
논문
Beyond maternal effects in birds: responses of the embryo to the environment
2011-07
[13]
논문
The childhood obesity epidemic as a result of nongenetic evolution: the maternal resources hypothesis
http://www.mayoclini[...]
2015-01
[14]
논문
In reply—Maternal, paternal, and societal efforts are needed to "cure" childhood obesity
http://www.mayoclini[...]
2015-04
[15]
논문
In reply--Epigenetics and Childhood Obesity
http://www.mayoclini[...]
2015-05
[16]
논문
The mother of all problems
2015-02-28
[17]
논문
Effects of Maternal Environment on Seed Germination and Seedling Vigor of Petunia x Hybrida under Different Abiotic Stresses
2021-03
[18]
논문
Genetic characterization of ms (3) K81, a paternal effect gene of Drosophila melanogaster
http://www.genetics.[...]
1995-05
[19]
서적
Paternal effects in Drosophila: implications for mechanisms of early development
https://archive.org/[...]
[20]
논문
The paternal effect gene ms(3)sneaky is required for sperm activation and the initiation of embryogenesis in Drosophila melanogaster
1998-05
[21]
논문
Intergenerational fitness effects of the early life environment in a wild rodent
http://urn.fi/urn:nb[...]
2019-09
[22]
논문
Maternal effects in quail and zebra finches: Behavior and hormones
2013-09
[23]
논문
Contribution of maternal effects to dietary selection in Mediterranean fruit flies
2019-02
[24]
논문
Maternal effects provide phenotypic adaptation to local environmental conditions
2005-04
[25]
논문
Maternal effects in the soft scale insect Saissetia coffeae (Hemiptera: Coccidae)
[26]
논문
Density triggers maternal hormones that increase adaptive offspring growth in a wild mammal
2013-06
[27]
논문
Egg Size Plasticity in a Seed Beetle: An Adaptive Maternal Effect
[28]
논문
Phenotypic lability and the evolution of predator-induced plasticity in tadpoles
2002-02
[29]
논문
The evolutionary ecology of individual phenotypic plasticity in wild populations
[30]
논문
Phenotypic plasticity and experimental evolution
[31]
논문
The adaptive significance of maternal effects
[32]
논문
Lifestyle, pregnancy and epigenetic effects
[33]
논문
Mendelian randomization supports causality between maternal hyperglycemia and epigenetic regulation of leptin gene in newborns
[34]
논문
Adiponectin: more than just another fat cell hormone?
[35]
논문
The Effects of High-Fat Diet Exposure In Utero on the Obesogenic and Diabetogenic Traits Through Epigenetic Changes in Adiponectin and Leptin Gene Expression for Multiple Generations in Female Mice
[36]
논문
Pathophysiological basis for compromised health beyond generations: role of maternal high-fat diet and low-grade chronic inflammation
[37]
논문
Persistent epigenetic differences associated with prenatal exposure to famine in humans
[38]
논문
Maternal undernutrition and cardiometabolic disease: a Latin American perspective
[39]
논문
An unbalanced maternal diet in pregnancy associates with offspring epigenetic changes in genes controlling glucocorticoid action and foetal growth
[40]
논문
Developmental exposure to estrogen alters differentiation and epigenetic programming in a human fetal prostate xenograft model
[41]
논문
Maternal nutrient supplementation counteracts bisphenol A-induced DNA hypomethylation in early development
[42]
논문
Age-specific maternal effects interact with larval food supply to modulate life history in Coleomegilla maculata
[43]
논문
Parental diet has strong transgenerational effects on offspring immunity
[44]
논문
Effects of Maternal and Larval Nutrition on Growth and Form of Planktotrophic Larvae
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com