사이토크롬 c
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
사이토크롬 c는 미토콘드리아 내막의 전자 전달계 구성 요소로, 복합체 III에서 복합체 IV로 전자를 전달하여 ATP 합성을 촉진한다. 또한, 다양한 산화 환원 반응을 촉매하며 과산화 효소 활성을 보인다. 세포자멸사 조절자로서, 미토콘드리아에서 방출되어 카스파제를 활성화하여 세포 자살을 유도하기도 한다. 구조적으로는 헴 c를 포함하며, 종 전체에서 매우 보존된 단백질로 분자 계통학 연구에 활용된다. 항산화 효소로 작용하여 슈퍼옥사이드와 과산화 수소를 제거하기도 하며, 저준위 레이저 치료와 과산화물 검출, 촉매 활성 연구 등 다양한 분야에 응용된다.
더 읽어볼만한 페이지
- 세포예정사 - 오토파지
오토파지는 세포 내 구성 성분을 분해 및 재활용하여 항상성을 유지하고, 영양 결핍 시 에너지와 물질을 공급하는 과정으로, 거대 자가포식, 미세 자가포식, 샤페론 매개 자가포식의 세 유형으로 나뉘며, 오스미 요시노리의 노벨상 수상 이후 질병 치료 표적으로 연구가 활발하다. - 세포예정사 - Fas 리간드
Fas 리간드(FasL)는 세포자멸사를 유도하는 Fas 수용체(FasR, CD95) 및 FasL-FasR 상호작용을 억제하는 미끼 수용체 3(DcR3)과 상호작용하는 II형 막관통 단백질로, 면역계 조절, 세포독성 T 세포 활성, 면역 특권 유지, 종양 면역 회피 등 다양한 생리적 기능에 관여한다. - 인간 7번 염색체상 유전자 - 소닉 헤지호그
소닉 헤지호그는 척추동물 발생 시 중추신경계, 뇌, 척수, 사지 형성에 관여하는 형태발생소이며, 유전자 변이는 질병을 유발하고 유모 세포 재생과 진피 지방 생성 조절과 같은 재생 기능도 가지고 있다. - 인간 7번 염색체상 유전자 - 렙틴
렙틴은 지방 세포에서 생성되어 식욕과 에너지 소비를 조절하며, 렙틴 결핍은 비만을 유발하고 렙틴 저항성은 비만 관련 질병의 원인으로 여겨진다. - 세포 호흡 - 유비퀴논
유비퀴논(CoQ10)은 미토콘드리아 전자 전달계의 주요 구성 요소인 지용성 유기 화합물로, 세포 호흡과 에너지 생산에 필수적이며 항산화 작용을 통해 세포를 보호하고 면역 반응에도 관여한다. - 세포 호흡 - 광합성
광합성은 생물이 빛에너지를 이용하여 이산화탄소와 물로부터 유기물을 합성하고 산소를 방출하는 과정으로, 엽록체 내 틸라코이드 막에서 일어나는 명반응과 스트로마에서 일어나는 암반응으로 구성되며, 환경에 따라 탄소 농축 메커니즘을 통해 효율을 높이기도 하고, 지구 대기의 산소를 생성하는 주요 원천이다.
| 사이토크롬 c - [화학 물질]에 관한 문서 | |
|---|---|
| 일반 정보 | |
| CAS 등록번호 | 9007-43-6 |
| KEGG | C00524 |
| KEGG1 | C00125 |
| KEGG1 주석 | (산화형, 페리시토크롬 c) |
| KEGG2 | C00126 |
| KEGG2 주석 | (환원형, 페로시토크롬 c) |
| 관련 정보 | |
| 효소 | 철-시토크롬c 환원효소 시토크롬c 산화효소 시토크롬c 과산화효소 |
| 식별 | |
| 영어 명칭 | cytochrome c, cyt c |
2. 전자전달계에서의 기능
사이토크롬 c는 미토콘드리아 내막(크리스타)의 전자 전달계의 필수적인 구성 요소이다. 사이토크롬 c의 헴기는 복합체 III로부터 전자를 받아 복합체 IV로 전자를 전달한다.[38]
샤오둥 왕은 1996년에 사이토크롬 c가 세포자멸사 과정에서 중간 역할을 한다는 것을 발견했다.[17] 사이토크롬 c는 세포자멸사를 유도하는 자극(산소 결핍, 칼슘 농축 등)에 반응하여 미토콘드리아 내막에서 방출된다.[18]
사이토크롬 c는 수산화 반응 및 방향족 산화와 같은 여러 산화 환원 반응을 촉매할 수 있으며, 2,2-아지노-''비스''(3-에틸벤즈티아졸린-6-설폰산) (ABTS), 2-케토-4-티오메틸 부티르산 및 4-아미노안티피린과 같은 다양한 전자 공여체의 산화를 통해 과산화 효소 활성을 보인다.
세균 사이토크롬 ''c''는 아질산염 환원 효소로 기능한다.[16]
3. 세포자멸사 (아포토시스)
사이토크롬 c는 미토콘드리아 내막의 카디오리핀에 결합하여 존재한다. 초기에는 정전기적 인력으로 결합하지만, 최종적으로는 카디오리핀의 소수성 꼬리가 사이토크롬 c의 소수성 부분에 삽입되는 소수성 상호작용을 통해 결합한다.
세포자멸사 초기 단계에서 미토콘드리아의 활성산소(ROS) 생성이 촉진되고, 카디오리핀은 카디오리핀-사이토크롬 c 복합체의 과산화효소 기능에 의해 산화된다. 이후 혈색소 단백질은 미토콘드리아 내막에서 분리되어 외막의 구멍을 통해 세포질로 방출된다.[18]
칼슘 수치의 지속적인 증가는 미토콘드리아로부터 사이토크롬 c 방출에 선행한다. 소량의 사이토크롬 c 방출은 소포체(ER)의 IP3 수용체(IP3R)와 상호작용하여 ER 칼슘 방출을 유발한다. 칼슘 증가는 대량의 사이토크롬 c 방출을 유발하며, 이는 양성 피드백 루프를 통해 ER 칼슘 방출을 유지한다.[19] 이로 인해 ER 칼슘 방출은 세포 독성 수준에 도달할 수 있다.
세포질로 방출된 사이토크롬 c는 시스테인 프로테아제인 카스파제 9를 활성화한다. 카스파제 9는 카스파제 3과 카스파제 7을 활성화하여 세포를 파괴한다.
3. 1. 세포자멸사 억제
세포는 Bcl-xL을 사용하여 사이토크롬 c의 방출을 차단함으로써 세포자멸사로부터 스스로를 보호할 수 있다.[20] 세포가 세포자멸사를 제어할 수 있는 또 다른 방법은 Tyr48의 인산화인데, 이는 사이토크롬 c를 항세포자멸사 스위치로 바꾼다.[21]
4. 구조

사이토크롬 c는 c형 사이토크롬 계열의 I족에 속하며, 헴을 결합하는 특징적인 CXXCH(시스테인-임의-임의-시스테인-히스티딘) 아미노산 서열을 갖는다.[10] 이 서열은 N-말단 방향의 펩타이드 사슬에 위치하며 헴 철의 5번째 리간드인 히스티딘을 포함한다. 6번째 리간드는 C-말단 방향에서 발견되는 메티오닌 잔기로 제공된다. 단백질 골격은 N-말단에서 C-말단으로 α1-α5로 번호가 매겨진 5개의 α-나선으로 접혀있다. 미토콘드리아 사이토크롬 c를 언급할 때 나선 α3, α4 및 α5는 각각 50s, 60s 및 70s 나선이라고 한다.[11]
1991년, R. P. 앰블러는 사이토크롬 c에 다음과 같은 4개의 클래스가 있다고 보았다.
| 클래스 | 설명 |
|---|---|
| 클래스 I | 미토콘드리아와 진정세균이 가지는 저스핀 가용성 사이토크롬 c이다. 헴 결합 부위는 N 말단 측의 히스티딘 잔기에 있으며, 리간드는 C 말단 측의 메티오닌 잔기에 의해 공급된다. |
| 클래스 II | 고스핀 사이토크롬 c이다. 헴 결합 부위가 N 말단 측의 히스티딘 잔기에 있다. |
| 클래스 III | 낮은 산화 환원 전위를 가진 사이토크롬 군이다. 이것의 헴 c기는 구조적으로나 기능적으로 동일한 것이 아니며, 0mV에서 -400mV까지의 서로 다른 산화 환원 전위를 나타낸다. |
| 클래스 IV | 원래 헴 c나 다른 보결 분자단을 가진 복합체 단백질을 지칭하기 위해 만들어진 클래스이다. |
4. 1. 헴 c (Heme c)

대부분의 헴 단백질은 철 이온 배위 결합과 3차 구조적 상호작용을 통해 보결 분자단에 부착되지만, 사이토크롬 c의 헴 그룹은 단백질의 두 시스테인 측쇄와 티오에테르 결합을 형성한다.[12] 사이토크롬 c가 다양한 기능을 가질 수 있게 하는 헴 c의 주요 특성 중 하나는 자연 상태에서 다양한 환원 전위를 갖는 능력이다. 이 특성은 전자 전달 반응의 속도론과 열역학을 결정한다.[13]
4. 2. 쌍극자 모멘트 (Dipole moment)
쌍극자 모멘트는 단백질이 적절한 방향으로 정렬되고 다른 분자와 결합하는 능력을 향상시키는 데 중요한 역할을 한다.[14][15] 사이토크롬 c의 쌍극자 모멘트는 효소 "뒷면"에 있는 음전하를 띤 아미노산 측쇄 클러스터에서 발생한다.[15] 결합된 헴 그룹의 수와 서열의 변화에도 불구하고, 척추동물 사이토크롬 c의 쌍극자 모멘트는 놀랍도록 보존되어 있다. 예를 들어, 척추동물 사이토크롬 c는 모두 약 320 debye의 쌍극자 모멘트를 가지는 반면, 식물과 곤충의 사이토크롬 c는 약 340 debye의 쌍극자 모멘트를 갖는다.[15]5. 종 분포
사이토크롬 c는 진핵생물 종 전체에서 매우 보존된 단백질로, 식물, 동물, 균류 및 많은 단세포 생물에서 발견된다. 작은 크기(분자량 약 12,000 달톤)[3]와 분류학 연구에 유용하게 사용된다.[4] 사이토크롬 c는 진화 생물학에 대한 통찰력을 제공하기 위해 연구되어 왔다.
사이토크롬 c는 약 100개의 아미노산 사슬로 구성된 1차 구조를 가지고 있으며, 많은 고등 생물은 104개의 아미노산 사슬을 가지고 있다.[5] 30개 이상의 종에서 104개의 아미노산 중 34개가 보존되었다.[7] 사람의 사이토크롬 c 서열은 침팬지(가장 가까운 친척)와 동일하지만 말과는 다르다.[6] 닭과 칠면조의 사이토크롬 c 아미노산 서열은 완전히 동일하지만, 이들과 오리 사이에는 1개의 아미노산 잔기 차이가 있다. 인간과 침팬지의 사이토크롬 c는 완전히 동일하지만, 붉은털원숭이와는 1개의 아미노산 잔기 차이가 있다[42]。 인간과 침팬지에서는 66번째 아미노산 잔기가 이소류신이지만, 붉은털원숭이에서는 트레오닌이다[41]。 돼지, 소, 양의 사이토크롬 c는 모두 동일하다.
6. 항산화 효소로서의 기능
최근 연구에 따르면 사이토크롬 c는 전자 전달 연쇄 및 세포 세포자멸사에서의 역할 외에도 미토콘드리아에서 항산화 효소로 작용할 수 있으며, 슈퍼옥사이드(O₂⁻)와 과산화 수소(H₂O₂)를 미토콘드리아에서 제거함으로써 이러한 역할을 수행한다.[22] 따라서 사이토크롬 c는 세포 호흡을 위해 미토콘드리아에 필요할 뿐만 아니라, O₂⁻ 및 H₂O₂의 생성을 제한하기 위해서도 미토콘드리아 내에서 필요하다.[22]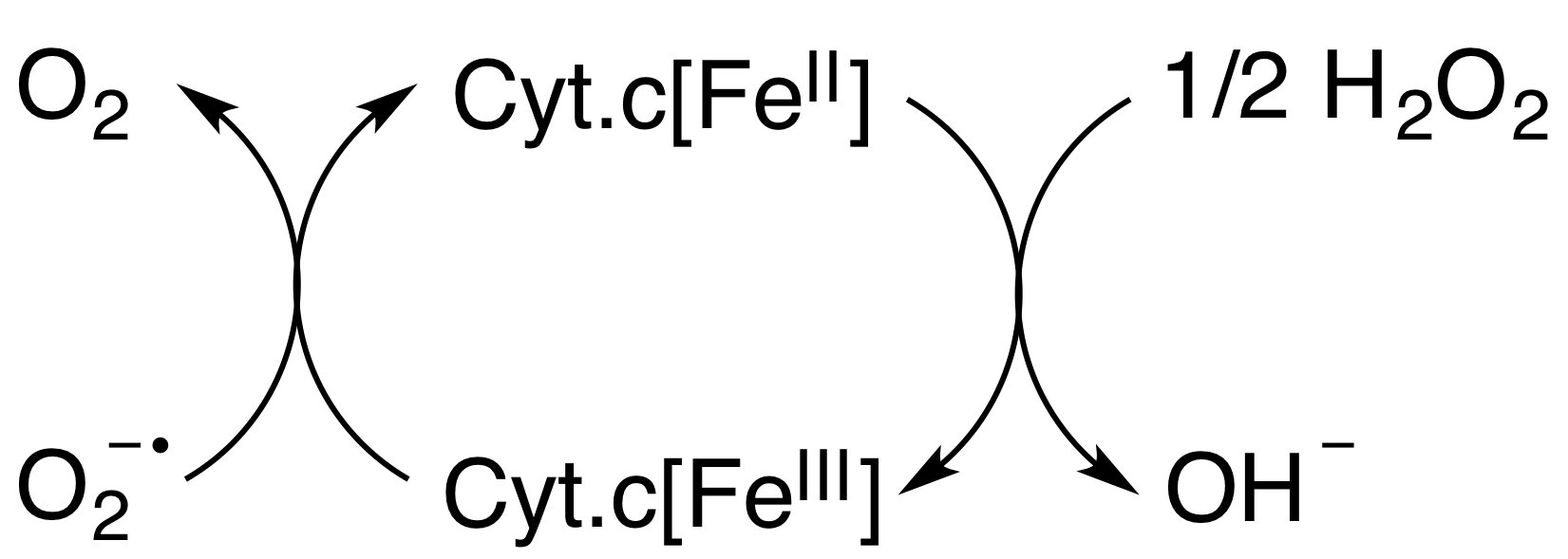
7. 미토콘드리아 외부 위치
사이토크롬 c는 정상적인 생리 조건에서는 미토콘드리아 내막 공간에만 국한되어 있는 것으로 널리 알려져 있다.[23] 사이토크롬 c가 미토콘드리아에서 세포질로 방출되어 카스파제 단백질 분해 효소군을 활성화시키는 것이 세포자멸사의 시작을 유발하는 주요 원인으로 여겨진다.[24]
그러나 쥐 조직 절편을 이용한 사이토크롬 c 특이적 항체를 이용한 상세한 면역 전자 현미경 연구 결과, 정상적인 세포 조건 하에서도 사이토크롬 c가 미토콘드리아 외부에 존재한다는 강력한 증거가 제시되었다.[27] 췌장의 샘세포와 뇌하수체 전엽에서 사이토크롬 c는 각각 과립 효소 과립과 성장 호르몬 과립에서 강하고 특이적으로 검출되었다. 췌장에서는 사이토크롬 c가 응축 소포와 샘세포의 내강에서도 발견되었다. 사이토크롬 c의 미토콘드리아 외부 국재화는 정제된 사이토크롬 c로 1차 항체를 흡착시키면 완전히 사라지는 것으로 보아 특이적임이 확인되었다.[27]
사이토크롬 c 외에도 미토콘드리아 DNA에 의해 암호화된 단백질을 포함하여 다수의 다른 단백질에서도 미토콘드리아 외부 국재화가 관찰되었다.[28][29][30] 이는 아직 밝혀지지 않은, 미토콘드리아에서 다른 세포 목적지로의 단백질 이동을 위한 특이적인 기전이 존재할 가능성을 제기한다.[30][31]
8. 응용
사이토크롬 c는 생물학적 시스템에서 과산화물 생성을 감지하는 데 사용되어 왔다. 초과산화물이 생성되면 산화된 사이토크롬 c3+의 수가 증가하고 환원된 사이토크롬 c2+의 수는 감소한다.[32] 그러나 초과산화물은 종종 일산화 질소와 함께 생성되는데, 일산화 질소가 존재하면 사이토크롬 c3+의 환원이 억제된다.[33] 이는 일산화 질소와 초과산화물의 반응을 통해 생성되는 중간체인 과산화질산에 의해 사이토크롬 c2+가 사이토크롬 c3+로 산화되기 때문이다. 과산화 질산염 또는 H2O2 및 이산화 질소 NO2의 미토콘드리아 내 존재는 사이토크롬 c의 티로신 잔기를 질산화하여 전자 전달 연쇄에서 전자 전달체로서의 사이토크롬 c의 기능을 방해하기 때문에 치명적일 수 있다.[34]
사이토크롬 c는 과산화 효소 유사 활성을 가진 효소로도 널리 연구되어 왔다. 사이토크롬 c는 과산화 효소 유사 활성을 시험하기 위해 전하를 띤 고분자에 접합되기도 한다.[35][36] 또한, 단백질 기반 케이지 구조 내 효소 캡슐화의 자연적인 예에서 영감을 얻어, 사이토크롬 c를 키메라 자가 조립 방식을 사용하여 영양 결핍 세포(Dps) 단백질 케이지에서 9 nm 크기의 작은 자가 조립 DNA 결합 단백질에 캡슐화하는 연구도 진행되었다. 이 연구에서는 단백질 케이지 내 효소를 캡슐화할 때 용액 내 효소와 다른 고유한 촉매 활성 거동이 관찰되었는데, 이는 대량의 환경과는 다른 Dps 나노케이지 내부 공동이 제공하는 국소 미세 환경에 기인한 것이다.[37]
사이토크롬 c는 수산화 반응이나 방향족 화합물의 산화 반응 등 몇몇 반응의 촉매 기능을 가지며, 과산화효소 활성을 나타내 2,2-azino-''bis''(3-ethylbenzthiazoline-6-sulphonic acid (ABTS)와 2-keto-4-thiomethyl butyric acid, 4-aminoantipyrine와 같은 전자 전달체를 산화시킨다.
사이토크롬 c는 근적외선을 조사하여 조직을 관통시켜 세포 재생을 촉진하는 치료법인 저준위 레이저 치료(Low-Level laser therapy; LLLT)에서 기능적인 역할을 담당하고 있는 것으로 여겨진다. 이 파장의 빛은 사이토크롬 c의 활성을 높여 대사를 활성화하고, 조직 재생을 위한 에너지를 효율적으로 생성하도록 돕는다.[44]
8. 1. 과산화물 검출
사이토크롬 c는 생물학적 시스템에서 과산화물 생성을 감지하는 데 사용되어 왔다. 초과산화물이 생성되면 산화된 사이토크롬 c3+의 수가 증가하고 환원된 사이토크롬 c2+의 수는 감소한다.[32] 그러나 초과산화물은 종종 일산화 질소와 함께 생성된다. 일산화 질소가 존재하면 사이토크롬 c3+의 환원이 억제된다.[33] 이는 일산화 질소와 초과산화물의 반응을 통해 생성되는 중간체인 과산화질산에 의해 사이토크롬 c2+가 사이토크롬 c3+로 산화되는 결과를 초래한다. 과산화 질산염 또는 H2O2 및 이산화 질소 NO2의 미토콘드리아 내 존재는 치명적일 수 있는데, 그 이유는 이들이 사이토크롬 c의 티로신 잔기를 질산화하여 전자 전달 연쇄에서 전자 전달체로서의 사이토크롬 c의 기능을 방해하기 때문이다.[34]8. 2. 촉매 활성 연구
사이토크롬 c는 과산화 효소 유사 활성을 가진 효소로도 널리 연구되어 왔다. 사이토크롬 c는 과산화 효소 유사 활성을 시험하기 위해 전하를 띤 고분자에 접합되었다.[35][36] 단백질 기반 케이지 구조 내 효소 캡슐화의 자연적인 예(예: 카르복시솜, 페리틴 및 캡슐린)에서 영감을 얻어, 사이토크롬 c는 키메라 자가 조립 방식을 사용하여 영양 결핍 세포(Dps) 단백질 케이지에서 9 nm 크기의 작은 자가 조립 DNA 결합 단백질에 캡슐화되었다. 저자는 단백질 케이지 내 효소를 캡슐화할 때 용액 내 효소와 다른 고유한 촉매 활성 거동을 관찰했다. 이는 대량의 환경과는 다른 Dps 나노케이지 내부 공동이 제공하는 국소 미세 환경에 기인한 것이다.[37]사이토크롬 c는 수산화 반응이나 방향족 화합물의 산화 반응 등 몇몇 반응의 촉매 기능을 가지며 과산화효소 활성을 나타내 2,2-azino-''bis''(3-ethylbenzthiazoline-6-sulphonic acid (ABTS)와 2-keto-4-thiomethyl butyric acid, 4-aminoantipyrine와 같은 전자 전달체를 산화시킨다.
8. 3. 저준위 레이저 치료 (LLLT)
사이토크롬 c는 저준위 레이저 치료(Low-Level laser therapy; LLLT)에서 기능적인 역할을 담당하고 있는 것으로 여겨진다. 저준위 레이저 치료는 적색광이나 근적외선을 조사하여 조직을 관통시켜 세포 재생을 촉진하는 치료법이다. 이 파장의 빛은 사이토크롬 c의 활성을 높이는 작용을 하며, 이를 통해 대사가 활성화되어 조직 재생을 위한 에너지를 효율적으로 생성할 수 있다고 생각된다[44]9. 상호작용
참조
[1]
웹사이트
Entrez Gene: cytochrome c
https://www.ncbi.nlm[...]
[2]
논문
Cytochrome c release upon Fas receptor activation depends on translocation of full-length bid and the induction of the mitochondrial permeability transition
2002-03
[3]
웹사이트
Cytochrome c – Homo sapiens (Human)
https://www.uniprot.[...]
UniProt Consortium
[4]
논문
Primary structure and evolution of cytochrome c
1963-10
[5]
웹사이트
Amino acid sequences in cytochrome c proteins from different species
http://www.indiana.e[...]
[6]
서적
Genes, culture, and human evolution: a synthesis
https://books.google[...]
Blackwell
[7]
서적
Biochemistry
https://archive.org/[...]
W.H. Freeman and Company
1975
[8]
논문
Microgravity protein crystallization
[9]
논문
Sequence variability in bacterial cytochromes c
1991-05
[10]
논문
Cytochrome c assembly
2013-03
[11]
논문
Metalloproteins Containing Cytochrome, Iron–Sulfur, or Copper Redox Centers
2014-04-23
[12]
논문
Role of heme in structural organization of cytochrome c probed by semisynthesis
1999-11
[13]
논문
Effect of cytochrome c on the generation and elimination of O{{sub|2}}{{sup|–}} and H{{sub|2}}O{{sub|2}} in mitochondria
2003-01
[14]
논문
The asymmetric distribution of charges on the surface of horse cytochrome c. Functional implications
1982-04
[15]
논문
The dipole moment of cytochrome c
1991-07
[16]
서적
The Metal-Driven Biogeochemistry of Gaseous Compounds in the Environment
Springer
[17]
논문
Induction of apoptotic program in cell-free extracts: requirement for dATP and cytochrome c
1996-07
[18]
논문
Cardiolipin oxidation sets cytochrome c free
2005-09
[19]
논문
Cytochrome c binds to inositol (1,4,5) trisphosphate receptors, amplifying calcium-dependent apoptosis
2003-12
[20]
논문
Role for Bcl-xL as an inhibitor of cytosolic cytochrome C accumulation in DNA damage-induced apoptosis
1997-06
[21]
논문
Tyrosine phosphorylation turns alkaline transition into a biologically relevant process and makes human cytochrome c behave as an anti-apoptotic switch
2011-12
[22]
논문
The chemistry and biochemistry of heme c: functional bases for covalent attachment
2008-12
[23]
논문
Protein import into mitochondria
[24]
논문
The mitochondrial death/life regulator in apoptosis and necrosis
[25]
논문
An aptamer-based bio-barcode assay with isothermal recombinase polymerase amplification for cytochrome-c detection and anti-cancer drug screening
2013-10
[26]
논문
A new quantitative assay for cytochrome c release in apoptotic cells
2003-07
[27]
논문
Cytochrome-C localises in secretory granules in pancreas and anterior pituitary
[28]
서적
The Biology of Extracellular Molecular Chaperones
[29]
논문
Localisation of mitochondrial DNA encoded cytochrome c oxidase subunits I and II in rat pancreatic zymogen granules and pituitary growth hormone granules
2005-11
[30]
서적
Mitochondrial proteins at unexpected cellular locations: export of proteins from mitochondria from an evolutionary perspective
[31]
논문
Mitochondrial-matrix proteins at unexpected locations: are they exported?
1999-05
[32]
논문
Superoxide dismutase. An enzymic function for erythrocuprein (hemocuprein)
1969-11
[33]
논문
Kinetics of cytochrome c2+ oxidation by peroxynitrite: implications for superoxide measurements in nitric oxide-producing biological systems
1995-06
[34]
논문
The kinetics of the reaction of nitrogen dioxide with iron(II)- and iron(III) cytochrome c
2014-04
[35]
논문
Increasing enzyme cascade throughput by pH-engineering the microenvironment of individual enzymes.
2017-03
[36]
논문
Cytochrome c-poly(acrylic acid) conjugates with improved peroxidase turnover number
2019-04
[37]
논문
Cytochrome C with peroxidase-like activity encapsulated inside the small DPS protein nanocage
2021-03
[38]
웹사이트
Entrez Gene: cytochrome c
http://www.ncbi.nlm.[...]
2010-04-18
[39]
논문
Cytochrome c release upon Fas receptor activation depends on translocation of full-length bid and the induction of the mitochondrial permeability transition
[40]
논문
Induction of apoptotic program in cell-free extracts: requirement for dATP and cytochrome c
[41]
문서
Amino acid sequences in cytochrome c proteins from different species
http://www.indiana.e[...]
adapted from Strahler, Arthur; Science and Earth History, 1997. page 348.
[42]
서적
Genes, Culture, and Human Evolution: A Synthesis
https://books.google[...]
Blackwell Publishing
2007
[43]
논문
Sequence variability in bacterial cytochromes c
[44]
논문
Cellular effects of low power laser therapy can be mediated by nitric oxide.
[45]
논문
Spectroscopic analysis of the interaction between cytochrome c and cytochrome c oxidase
[46]
논문
Evaluation of methods for the determination of mitochondrial respiratory chain enzyme activities in human skeletal muscle samples
[47]
논문
Cytochrome c/cytochrome c oxidase interaction. Direct structural evidence for conformational changes during enzyme turnover
[48]
논문
Cytochrome c binding affects the conformation of cytochrome a in cytochrome c oxidase
[49]
웹사이트
KEGG Homo sapiens (human): 54205
https://www.genome.j[...]
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com