히스티딘
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
히스티딘은 이미다졸 곁사슬을 가진 필수 아미노산으로, 염기 또는 약한 산으로 작용한다. 이미다졸 고리의 호변 이성질체와 산-염기 특성은 효소의 촉매 반응, 특히 촉매 삼잔기, 히스티딘 양성자 셔틀, 헤모글로빈의 산소 및 일산화 탄소 결합에 중요한 역할을 한다. 히스티딘은 금속 이온과 착물을 형성하여 금속단백질의 리간드로 작용하며, 생합성은 여러 단계의 효소 반응을 거쳐 이루어진다. 히스티딘은 히스타민, 3-메틸히스티딘, 카르노신, 에르고싸이오네인과 같은 다른 생물학적 활성 아민으로 전환될 수 있다. 19세 이상 성인의 경우 체중 1kg당 14mg이 권장되며, 보충제는 다양한 질환에 대한 치료제로 연구되고 있다.
히스티딘의 이미다졸 곁사슬은 양성자(H+)의 부착 및 해리가 가능하여 염기 또는 매우 약한 산으로 작용한다.
2. 이미다졸 곁사슬의 특성
히스티딘에서 이미다졸 곁사슬의 짝산(양성자화된 형태)은 약 6.0의 p''K''a를 갖는다. 따라서 pH 6 미만에서 이미다졸 고리는 대부분 양성자화(헨더슨-하셀바흐 방정식에 의해 설명됨)된다. 생성된 이미다졸륨 고리는 2개의 NH 결합을 갖고 양전하를 띤다. 양전하는 두 질소 사이에 균등하게 분포되어 있으며, 두 개의 똑같이 중요한 공명 구조로 나타낼 수 있다. 때로는 일반적인 기호인 His 대신에 이러한 양성자화된 형태에 대해 기호 '''Hip'''이 사용된다.[42][40][41] pH 6 이상에서는 두 개의 양성자 중 하나가 소실된다. 이미다졸 고리의 나머지 양성자는 질소에 존재하여 N1-H 또는 N3-H 호변 이성질체로 알려진 것을 생성할 수 있다. 위의 그림에 표시된 N3-H 호변 이성질체는 아미노기 및 카복실기를 포함하는 아미노산 골격으로부터 멀리 떨어진 3번 질소에서 양성자화되는 반면, N1-H 호변 이성질체는 골격에서 가까운 질소에서 양성자화된다. 이러한 중성 호변 이성질체는 양성자화되는 질소(각각 Nδ 및 Nε)에 따라 '''Hid''' 및 '''Hie''' 기호로 표시되기도 한다.[42][40][41] 히스티딘의 이미다졸/이미다졸륨 고리는 모든 pH 범위에서 방향족성이다.[43]
center
이미다졸 곁사슬의 산-염기 특성은 많은 효소들에서 촉매 메커니즘과 관련이 있다.[44] 촉매 삼잔기에서 히스티딘의 염기성 질소는 세린, 트레오닌 또는 시스테인으로부터 양성자를 추출하여 친핵체로 활성화된다. 히스티딘 양성자 셔틀에서 히스티딘은 양성자를 빠르게 왕복시키는 데 사용된다. 염기성 질소로 양성자를 추출하여 양전하를 띤 중간생성물을 만든 다음, 완충제인 또 다른 분자를 사용하여 산성 질소로부터 양성자를 추출함으로써 이를 수행할 수 있다. 탄산무수화효소에서 히스티딘 양성자 셔틀은 효소의 활성 형태를 신속하게 재생하기 위해 아연 결합 물 분자로부터 양성자를 빠르게 왕복시키는 데 사용된다. 헤모글로빈의 나선 E와 F에서 히스티딘은 일산화 탄소(CO) 뿐만 아니라 산소 분자(O2)의 결합에 영향을 미친다. 이러한 상호작용은 O2에 대한 Fe(II)의 친화력을 항상시키지만, CO의 결합을 불안정하게 하며, 이는 자유 헴에서 20,000배 더 강한 것과 비교하여 헤모글로빈에서 200배만 더 강하게 결합하도록 한다.
이미다졸 곁사슬의 호변 이성질체 및 산-염기 특성은 15N NMR 분광법으로 특성화되었다. 두 개의 15N의 화학적 이동은 유사하다(시그마 스케일의 질산에 대해 약 200 ppm, 여기서 증가된 차폐는 화학적 이동 증가에 해당함). NMR 스펙트럼 측정은 N1-H의 화학적 이동이 약간 떨어지는 반면, N3-H의 화학적 이동은 상당히 떨어지는 것으로(약 190 ppm 대 145 ppm) 나타났다. 이 변화는 N1-H 호변 이성질체가 선호됨을 나타내며, 이는 아마도 인접한 암모늄에 대한 수소 결합 때문일 수 있다. N3에서의 차폐는 질소의 고립 전자쌍과 방향족 고리의 여기된 π* 상태 사이의 대칭 허용 상호작용을 포함하는 2차 상자성 효과로 인해 실질적으로 감소된다. pH > 9에서 N1 및 N3의 화학적 이동은 약 185 ppm 및 170 ppm이다.[45]
2. 1. 호변 이성질체
히스티딘의 이미다졸 곁사슬은 N1-H 및 N3-H 호변 이성질체를 형성할 수 있다.[42][40][41] N3-H 호변 이성질체는 아미노산 골격에서 멀리 떨어진 3번 질소에서 양성자화되는 반면, N1-H 호변 이성질체는 골격에 가까운 질소에서 양성자화된다.[42][40][41] 이러한 호변 이성질체는 질소(각각 Nδ 및 Nε)에 따라 Hid 및 Hie 기호로 표시되기도 한다.[42][40][41]
center
NMR 분광법으로 분석한 결과, N1-H 호변 이성질체가 더 선호되는 경향을 보이는데, 이는 암모늄과의 수소 결합 때문으로 추정된다.[45] 이미다졸 고리의 양성자는 질소 원자에 결합 및 분리될 수 있으며, 염기 또는 매우 약한 산으로 작용한다. 두 호변 이성질체는 평형 상태에 있으며, 질소 원자는 수소 원자를 운반하는 역할을 할 수 있다.
2. 2. 산-염기 특성
히스티딘에서 이미다졸 곁사슬의 짝산(양성자화된 형태)은 약 6.0의 p''K''a를 갖는다. 따라서 pH 6 미만에서 이미다졸 고리는 대부분 양성자화된다.[42][40][41] 생성된 이미다졸륨 고리는 2개의 NH 결합을 갖고 양전하를 띤다. 양전하는 두 질소 사이에 균등하게 분포되어 있으며, 두 개의 똑같이 중요한 공명 구조로 나타낼 수 있다. pH 6 이상에서는 두 개의 양성자 중 하나가 소실된다. 이미다졸 고리의 나머지 양성자는 질소에 존재하여 N1-H 또는 N3-H 호변 이성질체로 알려진 것을 생성할 수 있다. 히스티딘의 이미다졸/이미다졸륨 고리는 모든 pH 범위에서 방향족성이다.[43]
이미다졸 곁사슬의 산-염기 특성은 많은 효소들에서 촉매 메커니즘과 관련이 있다.[44] 촉매 삼잔기에서 히스티딘의 염기성 질소는 세린, 트레오닌 또는 시스테인으로부터 양성자를 추출하여 친핵체로 활성화된다. 히스티딘 양성자 셔틀에서 히스티딘은 양성자를 빠르게 왕복시키는 데 사용된다. 염기성 질소로 양성자를 추출하여 양전하를 띤 중간생성물을 만든 다음, 완충제인 또 다른 분자를 사용하여 산성 질소로부터 양성자를 추출함으로써 이를 수행할 수 있다. 탄산무수화효소에서 히스티딘 양성자 셔틀은 효소의 활성 형태를 신속하게 재생하기 위해 아연 결합 물 분자로부터 양성자를 빠르게 왕복시키는 데 사용된다. 헤모글로빈의 나선 E와 F에서 히스티딘은 일산화 탄소(CO) 뿐만 아니라 산소 분자(O2)의 결합에 영향을 미친다. 이러한 상호작용은 O2에 대한 Fe(II)의 친화력을 항상시키지만, CO의 결합을 불안정하게 하며, 이는 자유 헴에서 20,000배 더 강한 것과 비교하여 헤모글로빈에서 200배만 더 강하게 결합하도록 한다.
이미다졸 곁사슬의 호변 이성질체 및 산-염기 특성은 15N NMR 분광법으로 특성화되었다. pH > 9에서 N1 및 N3의 화학적 이동은 약 185 ppm 및 170 ppm이다.[45]
질소 원자에 결합된 양성자(H+)의 부착과 분리를 일으켜, 염기 또는 매우 약한 산으로 작용한다. 또한, 이중 결합의 위치와 수소 원자가 이동한 互変異성체가 평형 상태에 있다. 어느 구조의 경우든, 수소 원자를 갖지 않는 쪽의 질소 원자가 수소 원자와 쉽게 반응하고, 동시에 다른 쪽 질소 원자 위에 있는 수소 원자를 방출한다. 결과적으로, 수소 원자를 운반하는 운반체로서 기능할 수 있다.
2. 3. 리간드
히스티딘은 많은 금속 이온들과 착물을 형성할 수 있다.[46] 히스티딘 잔기의 이미다졸 곁사슬은 일반적으로 금속단백질에서 리간드로 작용한다. 한 가지 예는 미오글로빈과 헤모글로빈의 Fe에 부착된 축 염기이다. 미토콘드리아의 전자전달계의 전자 운반체인 석신산 탈수소효소의 히스티딘 결합 헴기에서 커다란 반투명 구는 철 이온의 위치를 나타낸다.
많은 락케이스에서 발견되는 삼구리 부위는 각각의 구리 중심이 히스티딘의 이미다졸 곁사슬에 결합되어 있다.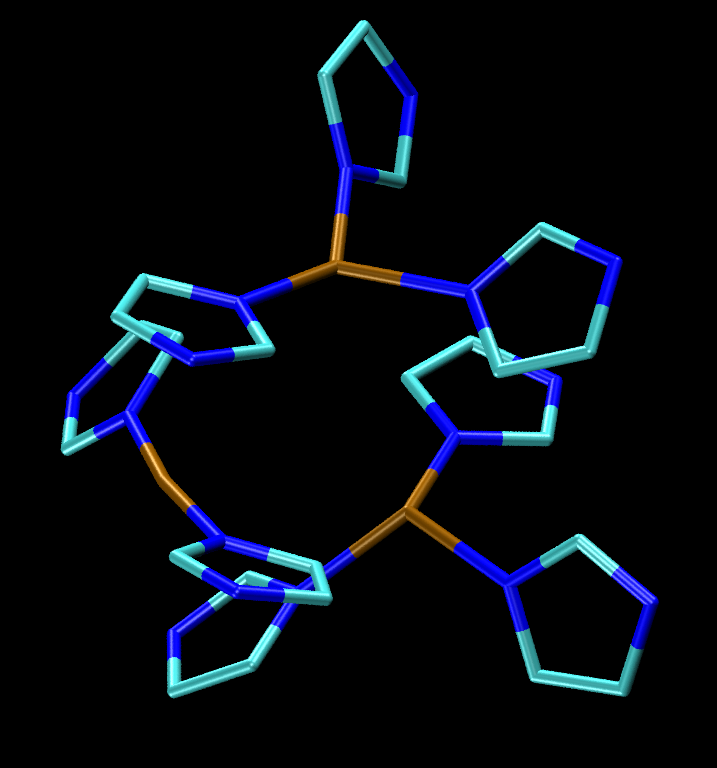
3. 물질대사
3. 1. 생합성
히스티딘은 사람에서 신생합성되지 않는 필수 아미노산이다.[48] 사람과 다른 동물들은 히스티딘이나 히스티딘 함유 단백질을 섭취해야 한다. 히스티딘의 생합성은 대장균과 같은 원핵생물에서 널리 연구되어 왔다.[14]
대장균에서 히스티딘 생합성은 8가지 유전자 산물(His1, 2, 3, 4, 5, 6, 7, 8)에 의해 촉매되는 10단계 반응으로 구성된다.[49] 이 과정은 단일 유전자 산물이 하나 이상의 반응을 촉매할 수 있기 때문에 가능하다. 예를 들어 히스티딘 생합성 경로에서 His4 유전자의 산물인 히스티딘올 탈수소효소는 대사 경로에서 4가지 다른 단계들을 촉매한다.[49]
히스티딘 생합성은 오탄당 인산 경로에서 리보스-인산 다이포스포키네이스에 의해 리보스 5-인산으로부터 만들어지는 포스포리보실 피로인산(PRPP)으로부터 시작된다.[15] 첫 번째 반응은 ATP 포스포리보실기전이효소(His1)에 의한 포스포리보실 피로인산(PRPP)과 아데노신 삼인산(ATP)의 축합 반응이다.[49] 그런 다음 His4 유전자의 산물은 축합 반응의 산물인 포스포리보실-ATP를 가수분해하여 포스포리보실-AMP(PRAMP)를 생성하며, 이는 비가역적인 단계이다. His4는 이어서 포스포리보실폼이미노AICAR-인산의 형성을 촉매하고, 이것은 His6 유전자의 산물에 의해 포스포리불로실폼이미노-AICAR-P로 전환된다.[50] His7 유전자의 산물은 포스포리불로실폼이미노-AICAR-P를 분해하여 D-에리트로-이미다졸-글리세롤-인산을 형성한다. 이후 His3 유전자의 산물은 이미다졸 아세톨-인산을 형성하면서 물을 방출한다. His5 유전자의 산물은 L-히스티딘올-인산을 만들고, 이것은 His2 유전자의 산물이 히스티딘올을 만드는 것에 의해 가수분해된다. His4 유전자의 산물인 히스티딘올 탈수소효소는 L-히스티딘올의 산화를 촉매하여 아미노 알데하이드인 L-히스티딘알을 형성한다. 마지막 단계에서 L-히스티딘알은 L-히스티딘으로 전환된다.[50][51]
히스티딘 생합성 경로는 균류인 붉은빵곰팡이(''Neurospora crassa'')에서 연구되었으며, 다중효소 복합체를 암호화하는 유전자(His-3)가 대장균의 His4 유전자와 유사한 것으로 밝혀졌다.[52] 붉은빵곰팡이 히스티딘 돌연변이체에 대한 유전적 연구에서는 다중효소 복합체의 개별 활성이 His-3 유전자 지도의 별개의 연속 섹션에서 발생함을 나타냈으며, 이는 다중효소 복합체의 다양한 활성이 서로 별도로 암호화된다는 것을 시사한다.[36] 그러나 세 가지 활성이 동시에 결여된 돌연변이체도 발견되었는데, 이는 일부 돌연변이가 복합체 전체의 기능 상실을 초래한다는 것을 암시한다.
동물과 미생물과 마찬가지로 식물도 생장과 발생에 히스티딘이 필요하다.[44] 미생물과 식물은 히스티딘을 합성할 수 있다는 점에서 유사하다.[53] 미생물과 식물은 둘 다 생화학적 대사 중간생성물인 포스포리보실 피로인산으로부터 히스티딘을 합성한다. 일반적으로 히스티딘 생합성은 미생물과 식물에서 매우 유사하다.[54]
히스티딘 생합성 경로는 에너지를 필요로 하며, ATP는 대사 경로의 첫 번째 효소인 ATP 포스포리보실기전이효소(His1)를 활성화시킨다. ATP 포스포리보실기전이효소는 음성 피드백 조절을 받으며, 최종 생성물인 히스티딘이 경로의 첫 번째 효소인 ATP 포스포리보실기전이효소를 억제한다.[55]
3. 2. 분해
히스티딘은 프롤린, 아르기닌과 같은 다른 아미노산과 함께 아미노기가 제거되는 과정인 탈아미노화에 참여한다.[56][22] 원핵생물에서 히스티딘은 먼저 히스티데이스에 의해 유로칸산으로 전환된다. 그런 다음 유로카네이스는 유로칸산을 이미다졸-4-온-5-프로피온산으로 전환한다. 이미다졸론프로피오네이스는 이미다졸-4-온-5-프로피온산으로부터 폼이미노글루탐산(FIGLU)을 형성하는 반응을 촉매한다.[57][23] 폼이미노기는 테트라하이드로폴산으로 전이되고, 나머지 5개의 탄소는 글루탐산을 형성한다.[56][22] 전반적으로 이들 반응은 글루탐산과 암모니아를 생성한다.[58][24] 그런 다음 글루탐산은 글루탐산 탈수소효소에 의해 탈아미노화되거나 아미노기 전이 반응에 의해 α-케토글루타르산을 형성할 수 있다.[56][22]
3. 3. 다른 생물학적 활성 아민으로의 전환
아미노산인 히스티딘은 염증 반응에 필요한 체내에서 생성되는 아민인 히스타민의 전구체이다.[59][25] 히스티딘 탈카복실화효소에 의해 히스티딘은 히스타민으로 전환된다.
히스티딘 암모니아 분해효소는 히스티딘을 암모니아와 유로칸산으로 전환시킨다. 이 효소의 결핍은 희귀 대사 장애인 히스티딘혈증에서 발견되며, 주요 진단 소견으로 유로칸산뇨증을 발생시킨다.[59] 히스티딘은 특정 메틸기전이효소에 의해 골격근 손상에 대한 바이오마커 역할을 하는 3-메틸히스티딘으로 전환될 수 있다.[60][26] 히스티딘은 또한 골격근에서 발견되는 다이펩타이드인 카르노신 생합성의 전구체이다.[61][27] 방선균 및 붉은빵곰팡이와 같은 자낭균류에서 히스티딘은 항산화제인 에르고싸이오네인으로 전환될 수 있다.[62][28]
4. 합성법
프룩토스, 포르말린 및 암모니아로부터 히드록시메틸이미다졸을 생성하고, 이것의 염화물에 아세트아미드말론산 에스터를 축합시켜 히스티딘을 만든다.
5. 필요 요건 및 안전성
미국 의학 연구소의 식품 영양 위원회(FNB)는 2002년에 필수 아미노산에 대한 권장 식이 허용량(RDA)을 제정했다. 19세 이상의 성인의 경우 매일 체중 1 kg 당 14 mg의 히스티딘이 필요하다.[63][29] 히스티딘 보충제는 신경계 질환, 아토피성 피부염, 대사 증후군, 당뇨병, 요독성 빈혈, 궤양, 염증성 장질환, 악성 종양, 그리고 고강도 운동 중 근육 기능 향상 등 다양한 질환에 대한 치료제로 연구되고 있다.[64][30] 사람의 경우 하루 4.5g까지의 투여량에서는 부작용이 보고되지 않았으나,[35] 하루 24~64g에서는 일부 부작용이 보고되었다.[35]
히스티딘은 청어류에 많이 함유되어 있는 경향이 있으며, 청어류가 죽은 후 시간이 지나면 어육에 포함된 효소에 의해 히스타민으로 변화하기 때문에 스콤브로이드식중독(히스타민식중독)의 원인이 될 수 있다.
6. 추가 정보 (선택 사항)
미국 의학 연구소의 식품 영양 위원회(FNB)는 2002년에 필수 아미노산에 대한 권장 식이 허용량(RDA)을 제정했다. 19세 이상의 성인의 경우 매일 체중 1 kg 당 14 mg의 히스티딘이 필요하다.[63][29] 히스티딘의 보충은 신경 장애, 아토피성 피부염, 대사 증후군, 당뇨병, 요독성 빈혈, 궤양, 염증성 장질환, 악성 종양 및 격렬한 운동 중 근육 손상을 비롯한 다양한 질환에 사용하기 위해 연구되고 있다.[64][30]
참조
[1]
웹사이트
(제목 없음)
http://prowl.rockefe[...]
2015-03-01
[2]
웹사이트
Nomenclature and Symbolism for Amino Acids and Peptides
http://www.chem.qmul[...]
IUPAC-IUB Joint Commission on Biochemical Nomenclature
2018-03-05
[3]
논문
Evidence that histidine is an essential amino acid in normal and chronically uremic man
[4]
논문
On the Separation of Histidine and Arginine
http://www.jbc.org/c[...]
1928-08-01
[5]
웹사이트
HISTIDINE
http://ambermd.org/Q[...]
2022-05-12
[6]
논문
Computational Assignment of the Histidine Protonation State in (6-4) Photolyase Enzyme and Its Effect on the Protonation Step
2016-08-05
[7]
논문
Effects of histidine protonation and rotameric states on virtual screening of M. tuberculosis RmlC
2013-03-01
[8]
논문
Five-membered heterocycles. Part III. Aromaticity of 1,3-imidazole in 5+n hetero-bicyclic molecules
[9]
논문
What kind of interactions we may get moving from zwitter to "dritter" ions: C–O⋯Re(O4) and Re–O⋯Re(O4) anion⋯anion interactions make structural difference between L-histidinium perrhenate and pertechnetate
https://pubs.rsc.org[...]
2023-12-01
[10]
논문
Histidine Biosynthesis
[11]
서적
ABCs of FT-NMR
University Science Books
[12]
서적
Applications of Chimeric Genes and Hybrid Proteins Part A: Gene Expression and Protein Purification
2000-01-01
[13]
논문
African Viper Poly-His Tag Peptide Fragment Efficiently Binds Metal Ions and Is Folded into an α-Helical Structure
https://pubmed.ncbi.[...]
2015-08-17
[14]
웹사이트
Roche biochemical pathways map
http://web.expasy.or[...]
[15]
논문
Histidine biosynthetic pathway and genes: structure, regulation, and evolution.
1996-03-01
[16]
논문
Histidine biosynthesis, its regulation and biotechnological application in Corynebacterium glutamicum
2014-01-01
[17]
논문
L-Histidinal, a biosynthetic precursor of histidine
1955-11-01
[18]
논문
Organization of the histidine-3 region of Neurospora.
[19]
웹사이트
How come plants can make essential amino acids but people can't?
https://www.thetech.[...]
2011-02-08
[20]
논문
Histidine biosynthesis in plants
2006-03-01
[21]
논문
Modification of histidine biosynthesis pathway genes and the impact on production of L-histidine in Corynebacterium glutamicum
2013-05-01
[22]
서적
Board review series (BRS)-- Biochemistry, Molecular Biology, and Genetics (fifth edition)
[23]
논문
The degradation of l-histidine, imidazolyl-l-lactate and imidazolylpropionate by Pseudomonas testosteroni
1973-03-01
[24]
논문
Deamination of histidine to form urocanic acid in liver
1953-04-01
[25]
논문
Human surrogate models of histaminergic and non-histaminergic itch
http://vbn.aau.dk/fi[...]
2015-09-01
[26]
웹사이트
3-Methylhistidine
http://www.hmdb.ca/m[...]
Human Metabolome Database
2017-12-25
[27]
논문
Muscle carnosine metabolism and beta-alanine supplementation in relation to exercise and training
https://biblio.ugent[...]
2010-03-01
[28]
논문
Novelthiols Ofprokaryotes
[29]
서적
Dietary Reference Intakes for Energy, Carbohydrates, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids
The National Academies Press
[30]
논문
Histidine in Health and Disease: Metabolism, Physiological Importance, and Use as a Supplement
2020-03-22
[31]
웹사이트
(제목 없음)
http://prowl.rockefe[...]
2015-03-01
[32]
논문
On the Separation of Histidine and Arginine
http://www.jbc.org/c[...]
1928-08-01
[33]
논문
Evidence that histidine is an essential amino acid in normal and chronically uremic man.
http://www.jci.org/a[...]
1975-05-01
[34]
간행물
対象外物質 評価書ヒスチジン
https://www.fsc.go.j[...]
食品安全委員会
[35]
논문
The Nature of Human Hazards Associated with Excessive Intake of Amino Acids
[36]
웹사이트
http://prowl.rockefe[...]
[37]
웹인용
Nomenclature and Symbolism for Amino Acids and Peptides
http://www.chem.qmul[...]
IUPAC-IUB Joint Commission on Biochemical Nomenclature
2018-03-05
[38]
저널
Evidence that histidine is an essential amino acid in normal and chronically uremic man
[39]
저널
On the Separation of Histidine and Arginine
http://www.jbc.org/c[...]
1928-08-01
[40]
웹인용
HISTIDINE
http://ambermd.org/Q[...]
2022-05-12
[41]
저널
Computational Assignment of the Histidine Protonation State in (6-4) Photolyase Enzyme and Its Effect on the Protonation Step
2016-08-05
[42]
저널
Effects of histidine protonation and rotameric states on virtual screening of M. tuberculosis RmlC
2013-03-01
[43]
저널
Five-membered heterocycles. Part III. Aromaticity of 1,3-imidazole in 5+n hetero-bicyclic molecules
[44]
저널
Histidine Biosynthesis
[45]
서적
ABCs of FT-NMR
https://archive.org/[...]
University Science Books
[46]
서적
Purification of proteins using polyhistidine affinity tags
2000
[47]
저널
African Viper Poly-His Tag Peptide Fragment Efficiently Binds Metal Ions and Is Folded into an α-Helical Structure
https://pubmed.ncbi.[...]
2015-08-17
[48]
웹사이트
Roche biochemical pathways map
http://web.expasy.or[...]
[49]
저널
Histidine biosynthetic pathway and genes: structure, regulation, and evolution.
1996-03-01
[50]
저널
Histidine biosynthesis, its regulation and biotechnological application in Corynebacterium glutamicum
2014-01-01
[51]
저널
L-Histidinal, a biosynthetic precursor of histidine
1955-11-01
[52]
저널
Organization of the histidine-3 region of Neurospora
[53]
웹인용
Understanding Genetics
http://genetics.thet[...]
2016-05-19
[54]
저널
Histidine biosynthesis in plants
2006-03-01
[55]
저널
Modification of histidine biosynthesis pathway genes and the impact on production of L-histidine in Corynebacterium glutamicum
2013-05-01
[56]
서적
Board review series (BRS)-- Biochemistry, Molecular Biology, and Genetics (fifth edition)
[57]
저널
The degradation of l-histidine, imidazolyl-l-lactate and imidazolylpropionate by Pseudomonas testosteroni
1973-03-01
[58]
저널
Deamination of histidine to form urocanic acid in liver
1953-04-01
[59]
저널
Human surrogate models of histaminergic and non-histaminergic itch
http://vbn.aau.dk/fi[...]
2015-09-01
[60]
웹인용
3-Methylhistidine
http://www.hmdb.ca/m[...]
Human Metabolome Database
2017-12-25
[61]
저널
Muscle carnosine metabolism and beta-alanine supplementation in relation to exercise and training
https://biblio.ugent[...]
2010-03-01
[62]
저널
Novelthiols Ofprokaryotes
[63]
서적
Dietary Reference Intakes for Energy, Carbohydrates, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids
The National Academies Press
[64]
저널
Histidine in Health and Disease: Metabolism, Physiological Importance, and Use as a Supplement
2020-03-22
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

