트롬빈
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
트롬빈은 혈액 응고에 중요한 역할을 하는 효소로, 피브리노겐을 피브린으로 전환하여 혈액 응고를 촉진한다. 프로트롬빈의 전구물질이며, 혈액 응고 경로에서 다른 응고 인자들을 활성화하고, 혈소판 활성화를 유도하며, 혈전 조절 인자와 상호 작용하여 단백질 C를 활성화하는 등 다양한 기능을 수행한다. 트롬빈은 생화학 연구 도구, 수술 시 지혈 보조제, 그리고 식품 생산에서 고기 결합제로 사용되기도 한다.
더 읽어볼만한 페이지
- 응고계통 - 지혈
지혈은 혈관 수축, 혈소판 마개 형성, 혈액 응고 과정을 통해 출혈을 막는 신체의 고유한 반응이며, 다양한 방법으로 이루어지고 응급 처치에 사용되며, 관련 질환과 약물, 유전적 요인이 지혈에 영향을 미친다. - 응고계통 - 혈소판
혈소판은 골수 내 거핵세포에서 생성되는 핵 없는 혈구의 일종으로, 혈액 응고 인자를 통해 혈관 손상 시 혈전을 형성하여 일차 지혈 작용을 수행하고 혈관 내피 세포 유지, 염증 반응, 면역 반응, 감염 방어 등 다양한 생체 반응에 관여하며 평균 수명은 8~12일이다. - EC 3.4.21 - 단백분해효소 K
단백분해효소 K는 칼슘 이온에 의해 활성화되어 소수성 아미노산을 선호하는 단백질 분해 효소로, 넓은 pH 범위에서 안정적이며 핵산 정제 시 뉴클레아제 비활성화에 효과적이고 분자생물학 연구에 다양하게 활용된다. - EC 3.4.21 - 아크로신
아크로신은 정자의 첨체 내에 있는 단백질 분해 효소로서, 첨체 반응 중 활성화되어 난자를 둘러싼 투명대 용해를 돕고, 정자 운동성과의 관련성, 피임제 개발 가능성, HIV 감염 억제 효과 등으로 질병 및 약리학적 중요성을 가진다. - 표재성 막 단백질 - 알파-시누클레인
알파-시누클레인은 신경 조직에서 발견되는 시누클레인 단백질로, 시냅스 소포 조절, 도파민 조절 등 다양한 기능을 수행하지만 응집되어 레비 소체를 형성하면 파킨슨병과 같은 시누클레인병증을 유발하며, 장-뇌 축을 통해 파킨슨병 발병에 영향을 미치고 유전자 돌연변이는 가족성 파킨슨병의 원인이 될 수 있다. - 표재성 막 단백질 - 신경독
신경독은 신경계에 손상을 일으키는 다양한 종류의 물질로, 중금속, 유기용매, 살충제, 생물 유래 독소 등이 있으며, 이들은 다양한 작용 메커니즘을 통해 신경계에 손상을 유발하여 신경퇴행성 질환, 인지 기능 저하, 정신 질환, 발달 장애 등 다양한 건강 문제를 야기하므로 예방과 치료를 위한 노력이 필요하고 신경과학 연구에도 활용된다.
| 트롬빈 | |
|---|---|
| 효소 정보 | |
 | |
| EC 번호 | 3.4.21.5 |
| 유전자 | 사람: F2 생쥐: F2 |
| 식별 | |
| 기호 | F2 |
| 외부 데이터베이스 | 위키데이터: Q422139 팜: PF00089 PROSITE: PDOC00006 PROSITE: PDOC00008 |
| 유전자 정보 | |
| 염색체 | 11q11-q12 |
| 발견 및 연구 | |
| 발견 연도 | 1893년 |
| 발견자 | 폴 모라비츠 |
| 기타 정보 | |
| 기능 | 혈액 응고 |
2. 역사
알렉산더 슈미트는 1872년에 피브리노겐을 피브린으로 전환하는 효소가 존재한다는 가설을 제시했다.[3]
트롬빈은 혈액 응고 과정에서 다양한 역할을 하는 효소이다. 프로트롬빈이라는 전구물질(활성화되기 전 단계의 물질)에서 생성되며, 이 과정은 프로트롬빈 분해효소, 칼슘 이온, 혈소판이 관여한다.[9]
프로트롬빈은 1894년 페켈하링에 의해 발견되었다.[4][5][6]
3. 생리학
트롬빈은 피브리노겐을 피브린으로 전환하고, XI인자, VIII인자, V인자, XIII인자를 활성화시킨다. XIIIa인자는 피브린 사이의 공유 결합을 촉진하여 혈병(피떡)을 안정화시킨다.[10][11] 또한 혈소판 막에 있는 프로테아제 활성화 수용체를 활성화시켜 혈소판 활성화와 응집을 돕는다.
트롬빈은 트롬보모듈린과 결합하여 단백질 C를 활성화시켜 응고 반응을 억제한다. 트롬보모듈린에 트롬빈이 결합하면 단백질 C의 활성화가 크게 증가한다.[36][37] 활성화된 단백질 C는 인자 Va와 VIIIa를 비활성화시키며, 안티트롬빈에 의해서도 트롬빈이 비활성화된다.
3. 1. 합성
트롬빈은 활성화된 인자 X(Xa)에 의해 프로트롬빈의 두 부위가 효소적으로 절단되어 생성된다. 프로트롬비나제 복합체는 활성화된 인자 V(Va)가 인자 Xa의 활성과 결합하여 크게 향상된다. 프로트롬빈은 간에서 생성되며, 분자의 N 말단에 있는 10-12개의 글루탐산을 감마-카르복시글루탐산(Gla)으로 전환하는 비타민 K 의존적 반응에서 공동 번역적으로 변형된다.[7] 칼슘이 존재하면 Gla 잔기는 프로트롬빈이 인지질 이중층에 결합하는 것을 촉진한다. 비타민 K 결핍 또는 항응고제 와파린 투여는 감마-카르복시글루탐산 잔기의 생성을 억제하여 응고 캐스케이드의 활성화를 늦춘다.
성인의 정상적인 혈중 트롬빈 활성은 1.1 units/mL 정도이다. 트롬빈 활성은 출생 후 1일에는 0.5 units/mL 정도, 6개월에는 0.9 units/mL 정도로 출생에서 성인 수준에 도달할 때까지 점차 상승한다.[35]
3. 2. 작용 기전
트롬빈은 혈액 응고 과정에서 다양한 역할을 수행하는 효소이다. 프로트롬빈이라는 전구물질(활성화되기 전 단계의 물질)에서 생성되며, 이 과정은 프로트롬빈 분해효소와 칼슘 이온, 혈소판이 관여한다.[9]
트롬빈은 피브리노겐을 피브린으로 전환하는 데 핵심적인 역할을 한다. 피브리노겐의 Aα 사슬과 Bβ 사슬에서 피브리노펩티드 A와 피브리노펩티드 B를 잘라내어 피브린 단량체를 형성한다.[9] 이 피브린 단량체들이 모여 혈액 응고 덩어리(혈병)를 형성한다.
또한, 트롬빈은 다음 혈액 응고 인자들을 활성화시킨다.
XIIIa인자는 피브린 사이의 공유 결합을 촉진하여 혈병을 안정화시키는 트랜스글루타미네이스이다.[10][11]
트롬빈은 트롬보모듈린과 단백질-단백질 상호작용을 통해 결합한다.[10][11]
그 외에도 트롬빈은 혈소판 막에 있는 프로테아제 활성화 수용체를 활성화시켜 혈소판 활성화와 응집을 돕는다.
3. 3. 음성 피드백 조절
트롬빈은 혈전 조절 인자에 결합하여 단백질 C를 활성화시키는데, 이는 응고 연쇄 반응의 억제제이다. 트롬보모듈린에 트롬빈이 결합하면 단백질 C의 활성화가 크게 증가하는데, 트롬보모듈린은 내피 세포에서 발현되는 통합 막 단백질이다.[36][37] 활성화된 단백질 C는 인자 Va와 VIIIa를 비활성화시킨다. 활성화된 단백질 C가 단백질 S에 결합하면 활성이 약간 증가한다. 트롬빈은 세린 프로테아제 억제제인 안티트롬빈에 의해서도 비활성화된다.
4. 구조
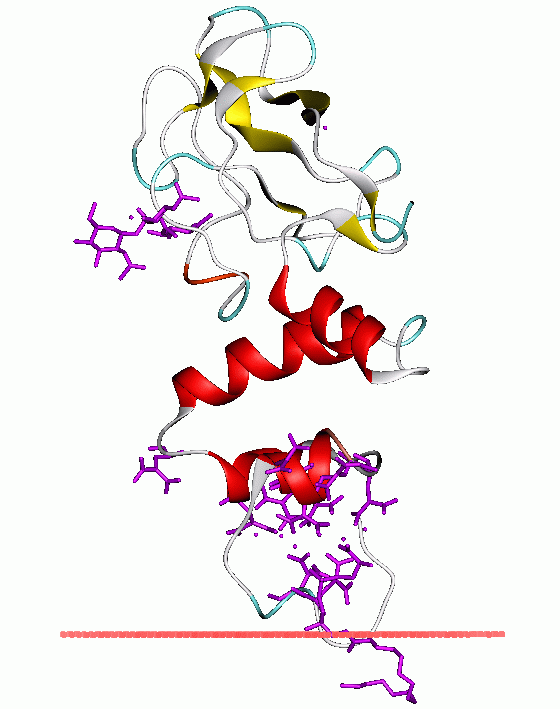
프로트롬빈의 분자량은 약 72,000Da이다. 프로트롬빈은 N 말단의 Gla 도메인, 두 개의 크링글 도메인(Kringle domain), C 말단의 트립신 유사 세린 프로테아제 도메인 등 4개의 도메인으로 구성된다. 인자 Xa는 보조 인자로 인자 V와 결합하여 프로트롬빈을 Gla 도메인과 두 개의 크링글 도메인(이들을 통틀어 단편 1.2라고 함) 및 세린 프로테아제 도메인으로 구성된 트롬빈으로 절단한다.[39] 트롬빈의 분자량은 약 36,000Da이며, 구조적으로 프로테아제의 PA 클랜에 속한다.
모든 세린 프로테아제와 마찬가지로, 프로트롬빈은 단백질 내부의 펩타이드 결합 분해를 통해 활성형 트롬빈으로 변환되며, 새로운 N 말단으로 이소류신의 아미노기가 노출된다. 세린 프로테아제의 활성화에 대한 역사적인 모델에서는 이 새롭게 형성된 N 말단이 β 배럴 구조에 삽입되어 촉매 잔기의 올바른 컨포메이션 형성을 촉진한다고 생각했다.[40] 활성형 트롬빈의 결정 구조와는 달리, Hydrogen–deuterium exchange|수소-중수소 교환영어 질량 분석 연구에 따르면 아포형 트롬빈에서는 N 말단이 β 배럴에 삽입되지 않았다. 트롬보모듈린의 활성형 단편 결합이 알로스테릭 작용을 통해 N 말단 영역을 삽입하여 트롬빈의 활성형 컨포메이션을 촉진하는 것으로 보인다.[41]
5. 유전자
프로트롬빈 G20210A 돌연변이는 선천적이며, 제2인자 돌연변이라고도 불린다. 이 유전자는 이형 접합체(1쌍) 또는 드물게 동형 접합체(2쌍)로 유전될 수 있으며 성별이나 혈액형과는 관련이 없다. 동형 접합 돌연변이는 이형 접합 돌연변이보다 혈전증의 위험을 증가시키지만, 상대적인 위험 증가는 명확하게 밝혀지지 않았다. 경구 피임약과 같은 다른 잠재적 혈전증 위험 요인은 추가적인 영향을 미칠 수 있다.[18] 이전에 보고된 염증성 장 질환(크론병 또는 궤양성 대장염 등)과 프로트롬빈 G20210A 또는 제V인자 라이덴 돌연변이 사이의 관계는 연구 결과에 따라 상반된 결과가 나타나고 있다.[44]
트롬빈(프로트롬빈) 유전자는 11번 염색체(11p11-q12)에 위치한다.[28]
6. 질환에서의 역할
프로트롬빈은 혈액 응고에 중요한 역할을 하는 단백질로, 트롬빈의 전구물질이다. 프로트롬빈과 관련된 다양한 희귀 질환들이 존재한다. 예를 들어 저프로트롬빈혈증이 있다. 자가면역 질환에서 항프로트롬빈 항체는 루푸스 항응고제(항인지질 증후군이라고도 함) 형성에 관여할 수 있다. 고프로트롬빈혈증은 G20210A 돌연변이에 의해 발생할 수 있다.[16][17][18]
트롬빈은 혈관 수축을 일으키고 세포 분열을 촉진하는 물질로, 지주막하 출혈 후 혈관 연축의 주요 원인으로 알려져 있다. 뇌 동맥류가 파열되어 나온 혈액이 응고되면서 트롬빈을 방출하는데, 이는 혈관의 급격하고 지속적인 수축을 유발하여 뇌 허혈 및 뇌경색(뇌졸중)을 일으킬 수 있다.
트롬빈은 염증을 유발하는 성질이 있어 죽상동맥경화증의 발생 및 진행에도 영향을 미친다. 트롬빈은 특정 세포막 수용체(PAR-1, PAR-3, PAR-4)를 통해 작용하여 염증, 백혈구 유입, 산화 스트레스 증가, 혈관 평활근 세포의 이동 및 증식, 세포 자멸사, 혈관 신생 등 죽상경화를 촉진하는 작용을 한다.
트롬빈은 혈전 생성에 핵심적인 역할을 하며, 트롬빈의 존재는 혈전의 존재를 나타낸다. 2013년에는 쥐에서 트롬빈을 감지하는 시스템이 개발되었다. 이 시스템은 펩타이드로 코팅된 산화철에 특정 물질을 결합한 것으로, 트롬빈과 결합하면 이 물질이 방출되어 소변에서 검출된다. 아직 사람을 대상으로 한 실험은 진행되지 않았다.
7. 임상적 응용
트롬빈은 프로트롬빈 복합체 농축액, 신선 동결 혈장 같은 응고 인자 제제의 주요 성분으로, 프로트롬빈 결핍을 치료하는 데 사용된다. 와파린으로 인한 출혈 등에 쓰인다.[23]
항응고제는 대부분 프로트롬빈을 조작하여 작용한다. 와파린 등은 프로트롬빈을 포함한 응고 인자의 비타민 K 의존적 카복실화를 억제하고, 헤파린은 안티트롬빈의 트롬빈 친화력을 높인다. 직접 트롬빈 억제제는 트롬빈을 직접 억제한다.[24]
재조합 트롬빈은 수용액 형태 분말로 만들어져 수술 중 지혈에 국소적으로 사용된다. 하지만 대량 또는 동맥 출혈에는 효과가 없다.[25]
트롬빈은 피브리노겐과 결합, Fibrimex라는 고기 결합제로 판매된다. Fibrimex는 돼지나 소 혈액 추출 단백질로 만들어지며, 여러 고기를 결합해 혼합육을 만드는 데 쓰인다.[26] 그러나 스웨덴 소비자 연합은 재구성된 고기와 실제 고기 구분이 어려워 소비자 기만 위험이 있다고 경고한다.[26]
7. 1. 연구 도구
트롬빈은 단백질 분해 특이성이 높아 생화학 연구 도구로 유용하게 사용된다. 트롬빈 분해 부위(Leu-Val-Pro-Arg-Gly-Ser)는 재조합 융합 단백질 구조의 링커 영역에 주로 포함된다. 융합 단백질 정제 후, 트롬빈을 사용하여 분해 부위의 아르기닌과 글리신 잔기 사이를 선택적으로 절단하면, 관심 있는 단백질에서 정제 태그를 매우 특이적으로 제거할 수 있다.7. 2. 의학 및 수술
프로트롬빈 복합체 농축액과 신선 동결 혈장은 프로트롬빈이 풍부한 응고 인자 제제로, 프로트롬빈 결핍(보통 약물로 인한)을 교정하는 데 사용될 수 있다. 적응증으로는 와파린으로 인한 난치성 출혈이 있다.[23]프로트롬빈 조작은 대부분의 항응고제 작용 기전의 핵심이다. 와파린 및 관련 약물은 프로트롬빈을 포함한 여러 응고 인자의 비타민 K 의존적 카르복실화를 억제한다. 헤파린은 안티트롬빈의 트롬빈(및 인자 Xa)에 대한 친화력을 증가시킨다. 직접 트롬빈 억제제는 활성 부위에 결합하여 트롬빈을 직접 억제한다.[24]
재조합 트롬빈은 수용액으로 재구성하기 위한 분말로 제공된다. 수술 중 국소적으로 사용하여 지혈을 돕는 데 사용할 수 있다. 모세혈관과 작은 세정맥에서 발생하는 경미한 출혈을 제어하는 데 유용하지만, 대량 또는 격렬한 동맥 출혈에는 효과가 없고 사용이 권장되지 않는다.[25]
7. 3. 식품 생산
트롬빈은 피브리노겐과 결합하여 고기 결합제로 사용하기 위해 Fibrimex라는 브랜드 이름으로 판매된다. Fibrimex의 두 단백질은 돼지 또는 소의 혈액에서 유래한다.[26] 제조업체에 따르면, 쇠고기와 생선을 완벽하게 결합하는 등 새로운 종류의 혼합 육류를 생산하는 데 사용할 수 있다. 또한 제조업체는 이 제품을 사용하여 통근육을 결합하고, 모양을 만들고, 분할하여 품질 저하 없이 생산 비용을 절감할 수 있다고 밝히고 있다.[27]스웨덴 소비자 연합의 사무총장인 얀 베르토프트(Jan Bertoft)는 "이 재구성된 고기를 실제 고기와 구별할 방법이 없으므로 소비자 기만의 위험이 있다"고 말했다.[26]
참조
[1]
논문
Human genes encoding prothrombin and ceruloplasmin map to 11p11-q12 and 3q21-24, respectively
1987-05-01
[2]
논문
Nucleotide sequence of the gene for human prothrombin
1987-09-01
[3]
논문
Neue Untersuchungen ueber die Fasserstoffesgerinnung
[4]
서적
Williams Hematology
McGraw-Hill
2015-01-01
[5]
서적
Hemorrhagic Diseases
Lea and Febiger
1957-01-01
[6]
논문
Die Chemie der Blutgerinnung
1905-01-01
[7]
논문
Chemical and functional aspects of posttranslational modification of proteins
2009-10-01
[8]
논문
Development of the human coagulation system in the full-term infant
1987-07-01
[9]
논문
Determinants of fibrin formation, structure, and function
2012-09-01
[10]
논문
TAFI, or plasma procarboxypeptidase B, couples the coagulation and fibrinolytic cascades through the thrombin-thrombomodulin complex
1996-07-01
[11]
논문
Macromolecular specificity determinants on thrombin for fibrinogen and thrombomodulin
1989-07-01
[12]
논문
Structural basis of membrane binding by Gla domains of vitamin K-dependent proteins
2003-09-01
[13]
논문
An overview of the structure and function of thrombin
2006-04-01
[14]
논문
Structural basis of the activation and action of trypsin
1978-03-01
[15]
논문
Thrombomodulin Binding Selects the Catalytically Active Form of Thrombin
2015-11-01
[16]
논문
Prothrombin Frankfurt: a dysfunctional prothrombin characterized by substitution of Glu-466 by Ala
1995-02-01
[17]
논문
Cardiology patient pages. Prothrombin 20210 mutation (factor II mutation)
2004-07-01
[18]
논문
Mutations in clotting factors and inflammatory bowel disease
2007-02-01
[19]
논문
Is thrombin a key player in the 'coagulation-atherogenesis' maze?
2009-06-01
[20]
논문
Early atherosclerosis exhibits an enhanced procoagulant state
2010-08-01
[21]
논문
The hemostatic system as a modulator of atherosclerosis
2011-05-01
[22]
뉴스
Nanomedicine: Particle physiology
https://www.economis[...]
2013-11-05
[23]
논문
A phase 3, randomized, double-blind comparative study of the efficacy and safety of topical recombinant human thrombin and bovine thrombin in surgical hemostasis
2007-08-01
[24]
논문
A phase 3b, open-label, single-group immunogenicity and safety study of topical recombinant thrombin in surgical hemostasis
2009-07-01
[25]
논문
Recombinant thrombin: safety and immunogenicity in burn wound excision and grafting
[26]
웹사이트
Sverige röstade ja till köttklister
http://www.dn.se/nyh[...]
Dagens Nyheter
2010-02-09
[27]
웹사이트
Welcome to Fibrimex
https://www.sonac.bi[...]
Sonac
[28]
논문
Human genes encoding prothrombin and ceruloplasmin map to 11p11-q12 and 3q21-24, respectively
1987-05-01
[29]
논문
Nucleotide sequence of the gene for human prothrombin
1987-09-01
[30]
논문
Neue Untersuchungen ueber die Fasserstoffesgerinnung
[31]
서적
Williams Hematology
McGraw-Hill
2015-01-01
[32]
서적
Hemorrhagic Diseases
Lea and Febiger
1957-01-01
[33]
논문
Die Chemie der Blutgerinnung
1905-01-01
[34]
논문
Chemical and functional aspects of posttranslational modification of proteins
2009-10-01
[35]
논문
Development of the human coagulation system in the full-term infant
1987-07-01
[36]
논문
TAFI, or plasma procarboxypeptidase B, couples the coagulation and fibrinolytic cascades through the thrombin-thrombomodulin complex
1996-07
[37]
논문
Macromolecular specificity determinants on thrombin for fibrinogen and thrombomodulin
1989-07
[38]
논문
Structural basis of membrane binding by Gla domains of vitamin K-dependent proteins
2003-09
[39]
논문
An overview of the structure and function of thrombin
2006-04
[40]
논문
Structural basis of the activation and action of trypsin
1978-03-01
[41]
논문
Thrombomodulin Binding Selects the Catalytically Active Form of Thrombin
2015-11
[42]
논문
Prothrombin Frankfurt: a dysfunctional prothrombin characterized by substitution of Glu-466 by Ala
1995-02
[43]
논문
Cardiology patient pages. Prothrombin 20210 mutation (factor II mutation)
2004-07
[44]
논문
Mutations in clotting factors and inflammatory bowel disease
2007-02
[45]
논문
Is thrombin a key player in the 'coagulation-atherogenesis' maze?
2009-06
[46]
논문
Early atherosclerosis exhibits an enhanced procoagulant state
2010-08
[47]
논문
The hemostatic system as a modulator of atherosclerosis
2011-05
[48]
웹사이트
Nanomedicine: Particle physiology
https://www.economis[...]
The Economist
2013-12-15
[49]
논문
A phase 3, randomized, double-blind comparative study of the efficacy and safety of topical recombinant human thrombin and bovine thrombin in surgical hemostasis
2007-08
[50]
논문
A phase 3b, open-label, single-group immunogenicity and safety study of topical recombinant thrombin in surgical hemostasis
2009-07
[51]
논문
Recombinant thrombin: safety and immunogenicity in burn wound excision and grafting
2009
[52]
웹사이트
Sverige röstade ja till köttklister
http://www.dn.se/nyh[...]
Dagens Nyheter
2010-10-17
[53]
웹사이트
Welcome to Fibrimex
https://www.sonac.bi[...]
Sonac
2019-02-28
[54]
백과사전
두산백과
https://terms.naver.[...]
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com