세르핀
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
세르핀은 다양한 생물체에서 발견되는 단백질 슈퍼패밀리로, 주로 프로테아제 억제제 역할을 한다. 세린 프로테아제와 시스테인 프로테아제를 포함한 다양한 프로테아제를 억제하며, 혈액 응고, 염증, 면역 반응, 세포 사멸 등 다양한 생물학적 과정에 관여한다. 세르핀은 독특한 구조 변화를 통해 프로테아제를 비가역적으로 억제하며, 알로스테릭 조절을 받거나 잠복 상태로 전환될 수 있다. 세르핀 유전자 변이는 다양한 질병, 특히 알파-1 항트립신 결핍증과 같은 세르핀병을 유발하며, 관련 질환 치료를 위한 연구가 진행 중이다. 세르핀은 진화적으로 보존되어 세균, 고세균, 바이러스에서도 발견되며, 바이러스는 숙주의 면역 반응을 회피하기 위해 세르핀을 사용하기도 한다.
더 읽어볼만한 페이지
- 단백질 슈퍼패밀리 - 글로빈
글로빈은 글로빈 슈퍼패밀리에 속하는 단백질로, 8개의 α 나선으로 구성된 '글로빈 폴드'라는 3차원 구조를 가지며, 헤모글로빈, 미오글로빈 등 다양한 종류가 존재하고 산소 운반, 저장, 센서 기능 등을 수행하며, 공통 조상으로부터 진화하여 M/F, S, T 세 가지 주요 계열로 나뉜다. - 단백질 슈퍼패밀리 - 미오신
미오신은 액틴 필라멘트를 따라 움직이며 힘을 생성하는 단백질 분자로, 근육 수축, 세포 운동, 소포 수송 등 다양한 생체 내 기능에 관여하며, 근육형, 비근육형, 프로세시브형, 논프로세시브형으로 분류된다.
| 세르핀 | |
|---|---|
| 개요 | |
| 유형 | 단백질 슈퍼패밀리 |
| 기능 | 구조적으로 유사하며 다양한 기능을 수행 |
| 설명 | 세린 프로테아제 저해제 |
| 식별자 | |
| 심볼 | Serpin, SERPIN |
| Pfam | PF00079 |
| InterPro | IPR000215 |
| SMART | 해당 없음 |
| Prosite | PDOC00256 |
| SCOP | 1hle |
| TCDB | 해당 없음 |
| OPM family | 해당 없음 |
| OPM protein | 해당 없음 |
| CDD | cd00172 |
| PDB | A:1-378 B:349-379 A:1-415 A:1-415 A:1-385 A:1-385 B:1-385 B:77-433 L:76-461 I:76-461 L:76-461 I:76-461 L:76-461 L:76-461 L:76-461 L:76-461 L:76-461 L:76-461 A:78-461 I:76-461 I:76-461p I:76-461 L:76-461 I:76-461 A:76-461 I:76-461 A:1-375 B:1-375 B:1-375 A:1-375 A:1-300 A:1-55 A:1-305 I:18-392 :18-369 :45-415 B:383-415 A:43-382 A:49-376 A:43-415 A:43-415 B:378-415 A:44-382 A:43-415 A:43-415 :44-415 A:43-382 B:383-415 :47-415 A:43-415 A:50-383 A:43-420 B:390-420 A:47-383 A:48-383 B:42-417 F:376-406 B:374-406 B:374-406 A:119-496 A:119-496 A:25-402 A:25-402 D:25-402 D:25-402 A:25-402 A:25-402 B:26-402 A:25-402 A:25-402 A:138-498 D:101-361 A:49-415 |
| 이미지 | |
 | |
2. 역사
세르핀 초기 연구는 알파1-안티트립신 결핍증과 항트롬빈 결핍과 같은 인간 질병에 초점을 맞추었다. 알파1-안티트립신 결핍증은 폐기종을 일으키는 흔한 유전자 질환 중 하나이며,[217][220][16][221] 항트롬빈 결핍은 혈전증을 유발한다.[222][223]
1980년대에 세르핀 단백질의 3차 구조가 처음으로 밝혀졌고, 이어서 긴장형 구조가 밝혀졌다.[225][226] 세르핀의 구조 분석은 억제 작용이 독특한 구조 변화를 동반한다는 것을 보여주었고, 이후 연구는 구조 생물학에 집중되었다.[227][226]
2. 1. 세르핀 슈퍼패밀리의 발견
혈장 내 단백질 분해 효소 억제 활성은 1800년대 후반에 처음 보고되었지만,[10] 항트롬빈과 알파 1-안티트립신이 분리된 것은 1950년대였다.[11] 1979년에는 이들의 밀접한 계통 발생학적 상동성이 인식되었다.[12][13] 이들이 새로운 단백질 계열에 속한다는 것은 비억제성 난백 단백질 오발부민과의 추가 정렬을 통해 명백해졌고, 처음에는 '알파1-안티트립신-안티트롬빈 III-오발부민 슈퍼패밀리 세린 단백질 분해 효소 억제제'[14]라고 불렸지만, 이후 세르핀(Serpins)으로 간결하게 이름이 변경되었다.[15]세르핀이라는 이름은 일반적인 세르핀의 효과인 세린 프로테아제 억제제 ('''ser'''ine '''p'''rotease '''in'''hibitors)를 기반으로 만들어졌다.[224]
2000년대에는 진화적 관계를 기반으로 세르핀 슈퍼패밀리의 구성원을 분류하기 위한 체계적인 명명법이 도입되었다.[34] 따라서 세르핀은 단백질 분해 효소 억제제의 가장 크고 다양한 슈퍼패밀리이다.[35]
2. 2. 구조생물학적 연구의 발전
혈장 내 단백질 분해 효소 억제 활성은 1800년대 후반에 처음 보고되었지만,[10] 안티트롬빈과 알파 1-안티트립신이 분리된 것은 1950년대였다.[11] 1979년에는 이들의 밀접한 계통 발생학적 상동성이 인식되었다.[12][13] 이들이 새로운 단백질 계열에 속한다는 것은 비억제성 난백 단백질 오발부민과의 추가 정렬을 통해 명백해졌고, 처음에는 '알파1-안티트립신-안티트롬빈 III-오발부민 슈퍼패밀리 세린 단백질 분해 효소 억제제'[14]라고 불렸지만, 이후 세르핀(Serpins)으로 간결하게 이름이 변경되었다.[15]새로운 계열의 초기 특성은 혈장 내 고농도로 존재하는 세르핀인 알파1-안티트립신을 중심으로 이루어졌으며, 이는 흔한 유전 질환으로 폐기종[16] 및 간 경변증[17]에 대한 소인을 유발하는 것으로 나타났다. 유전적 결핍을 담당하는 S 및 Z 돌연변이의 확인[18][19]과 1982년 알파1-안티트립신과 안티트롬빈의 후속 서열 정렬을 통해 두 단백질의 활성 부위가 밀접하게 상동성을 보인다는 것을 인식하게 되었으며,[20][21] 이는 조직 엘라스타제의 억제제로서의 메티오닌[22]과 트롬빈의 억제제로서의 아르기닌을 중심으로 이루어졌다.[23][24]
세르핀의 억제 특이성을 결정하는 활성 중심 잔기의 중요한 역할은 알파1-안티트립신의 활성 중심 메티오닌이 안티트롬빈과 같이 아르기닌으로 자연 돌연변이를 일으켜 심각한 출혈 질환을 유발한다는 사실을 통해 명확하게 확인되었다.[25] 세르핀은 모양의 변화를 겪는 고유한 능력을 가지고 있다는 점에서 다른 단백질 분해 효소 억제제 계열과 달랐다. 이러한 구조 변화의 특성은 1984년 세르핀의 첫 번째 결정 구조, 즉 절단 후 알파1-안티트립신의 구조가 결정되면서 밝혀졌다.[26]
이후 네이티브(비절단) 오발부민의 구조가 밝혀지면서[27] 세르핀의 억제 메커니즘이 놀라운 구조적 변화를 포함하며, 반응 부위를 포함하는 노출된 펩타이드 루프의 이동과 세르핀 분자를 특징짓는 주요 베타-병풍 시트의 중간 가닥으로의 통합을 포함한다는 것을 나타냈다.[28][29] 이 루프 이동이 억제 메커니즘에서 필수적인 역할을 한다는 초기 증거는 안티트롬빈에서 이동의 힌지를 형성하는 아미노산 잔기에 사소한 이상만 있어도 혈전성 질환이 발생한다는 사실에서 비롯되었다.[28][30]
이러한 루프 이동에 의한 표적 단백질 분해 효소의 연결된 변위의 최종 확인은 2000년 알파1-안티트립신과 트립신의 억제 후 복합체의 구조에 의해 제공되었으며,[5] 변위가 어떻게 부착된 단백질 분해 효소의 변형 및 비활성화를 초래하는지 보여주었다. 후속 구조 연구를 통해 조직 수준에서 보이는 바와 같이, 인간 혈장의 기능적으로 다양한 세르핀과 함께 억제 활성의 미묘한 조절을 허용하는 구조적 메커니즘의 추가적인 이점이 밝혀졌다.[155][31]
2. 3. 광범위한 분포와 명명법
혈장 내 단백질 분해 효소 억제 활성은 1800년대 후반에 처음 보고되었지만,[10] 항트롬빈과 알파 1-안티트립신이 분리된 것은 1950년대였다.[11] 1979년에는 이들의 밀접한 계통 발생학적 상동성이 인식되었다.[12][13] 이들이 새로운 단백질 계열에 속한다는 것은 비억제성 난백 단백질 오발부민과의 추가 정렬을 통해 명백해졌고, 처음에는 '알파1-안티트립신-안티트롬빈 III-오발부민 슈퍼패밀리 세린 단백질 분해 효소 억제제'[14]라고 불렸지만, 이후 세르핀(Serpins)으로 간결하게 이름이 변경되었다.[15]세르핀의 억제 특이성을 결정하는 활성 중심 잔기의 중요한 역할은 알파1-안티트립신의 활성 중심 메티오닌이 안티트롬빈과 같이 아르기닌으로 자연 돌연변이를 일으켜 심각한 출혈 질환을 유발한다는 사실을 통해 명확하게 확인되었다.[25]
현재 1000개 이상의 세르핀이 확인되었으며, 여기에는 36개의 인간 단백질뿐만 아니라 동물, 식물, 균류, 세균, 고균 등 모든 생물계와 일부 바이러스의 분자가 포함된다.[94][91][32] 2000년대에는 진화적 관계를 기반으로 세르핀 슈퍼패밀리의 구성원을 분류하기 위한 체계적인 명명법이 도입되었다.[34] 따라서 세르핀은 단백질 분해 효소 억제제의 가장 크고 다양한 슈퍼패밀리이다.[35]
3. 활성
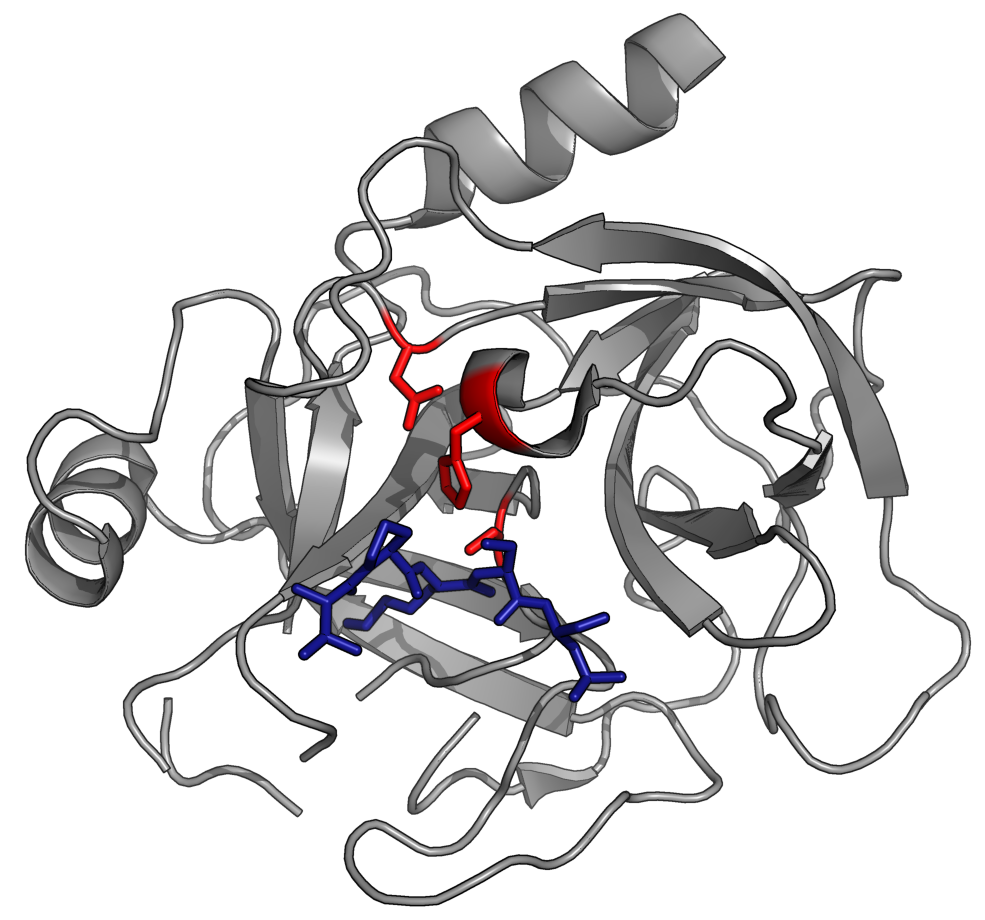
대부분의 세르핀은 프로테아제 억제제로 작용하여, 세포 외부에서 키모트립신과 유사한 세린 프로테아제를 표적으로 삼는다. 이러한 프로테아제는 활성 부위의 촉매 삼합체에 친핵체인 세린 잔기를 가지고 있다. 예를 들어, 트롬빈, 트립신, 사람 호중구 엘라스타제 등이 이에 해당한다.[36] 세르핀은 프로테아제의 촉매 메커니즘 중간체를 가두어 비가역적 억제를 일으키는 자살 억제제로 기능한다.[5]
일부 세르핀은 시스테인 프로테아제와 같이 다른 종류의 프로테아제를 억제하기도 하는데, 이를 "교차 종류 억제제"라고 부른다. 이 효소들은 활성 부위에 세린 대신 친핵성 시스테인 잔기를 사용한다는 점에서 세린 프로테아제와 차이가 있다.[37] 그러나 효소의 화학적 작용은 유사하며, 세르핀에 의한 억제 메커니즘은 두 종류의 프로테아제 모두에서 동일하게 작용한다.[38] 교차 종류 억제 세르핀의 예로는 세르핀 B4(편평 세포 암종 항원 1(SCCA-1))와 조류 세르핀 골수 및 적혈구 핵 종결 단계 특정 단백질(MENT)이 있으며, 이들은 모두 파파인 유사 시스테인 프로테아제를 억제한다.[39][40][41]
3. 1. 프로테아제 억제
대부분의 세르핀은 세포 외 키모트립신 유사 세린 프로테아제를 표적으로 하는 프로테아제 억제제이다. 이러한 프로테아제는 활성 부위의 촉매 삼합체에 친핵체 세린 잔기를 가지고 있다. 예로는 트롬빈, 트립신, 사람 호중구 엘라스타제 등이 있다.[36] 세르핀은 프로테아제의 촉매 메커니즘의 중간체를 가두어 비가역적 억제, 자살 억제제 역할을 한다.[5]
일부 세르핀은 다른 프로테아제 종류, 일반적으로 시스테인 프로테아제를 억제하며 "교차 종류 억제제"라고 불린다. 이러한 효소는 활성 부위에 세린 대신 친핵성 시스테인 잔기를 사용한다는 점에서 세린 프로테아제와 다르다.[37] 그럼에도 불구하고, 효소 화학은 유사하며 세르핀에 의한 억제 메커니즘은 두 종류의 프로테아제 모두에서 동일하다.[38] 교차 종류 억제 세르핀의 예로는 편평 세포 암종 항원 1(SCCA-1)인 세르핀 B4와 조류 세르핀 골수 및 적혈구 핵 종결 단계 특정 단백질(MENT)이 있으며, 둘 다 파파인 유사 시스테인 프로테아제를 억제한다.[39][40][41]
인간 세르핀의 약 3분의 2는 혈액 내 프로테아제의 활성을 조절하기 위해 혈류에서 프로테아제를 억제하는 세포 외 역할을 수행한다. 예를 들어, 세포 외 세르핀은 혈액 응고 (항트롬빈), 염증 및 면역 반응 (항트립신, 안티키모트립신 및 C1-억제제) 및 조직 리모델링 (PAI-1)에 중요한 단백질 분해 연쇄 반응을 조절한다.[95] 신호 전달 연쇄 반응 프로테아제를 억제하여 발생 생물학에도 영향을 미칠 수 있다.[42][43]
세포 내 억제 세르핀의 프로테아제 표적은 이러한 분자들이 중복된 역할을 수행하는 것으로 보이기 때문에 식별하기 어렵다. 또한 많은 인간 세르핀은 쥐와 같은 모델 유기체에서 정확한 기능적 등가물을 가지고 있지 않다. 그럼에도 불구하고, 세포 내 세르핀의 중요한 기능은 세포 내부에서 프로테아제의 부적절한 활성에 대한 보호일 수 있다.[44] 예를 들어, 가장 잘 특징지어진 인간 세포 내 세르핀 중 하나는 세르핀 B9로, 세포 독성 과립 프로테아제 그랜자임 B를 억제한다. 그렇게 함으로써, 세르핀 B9은 그랜자임 B의 부주의한 방출과 세포사멸 경로의 조기 또는 원치 않는 활성화를 방지할 수 있다.[45]
일부 바이러스는 세르핀을 사용하여 숙주 내 프로테아제 기능을 방해한다. 우두 바이러스 세르핀 CrmA (사이토카인 반응 조절자 A)는 감염된 숙주 세포의 염증 및 세포사멸 반응을 피하기 위해 사용된다. CrmA는 IL-1 및 IL-18의 시스테인 프로테아제 카스파제-1에 의한 처리를 억제함으로써 숙주의 염증 반응을 억제하여 감염성을 증가시킨다.[46] 진핵생물에서 식물 세르핀은 메타카스파제[47] 및 파파인 유사 시스테인 프로테아제를 모두 억제한다.[48]
3. 2. 교차 클래스 억제
일부 세르핀은 다른 프로테아제 종류, 일반적으로 시스테인 프로테아제를 억제하며, "교차 종류 억제제"라고 불린다. 이러한 효소는 활성 부위에 세린 대신 친핵성 시스테인 잔기를 사용한다는 점에서 세린 프로테아제와 다르다.[37] 그럼에도 불구하고, 효소 화학은 유사하며 세르핀에 의한 억제 메커니즘은 두 종류의 프로테아제 모두에서 동일하다.[38] 교차 종류 억제 세르핀의 예로는 편평 세포 암종 항원 1(SCCA-1)인 세르핀 B4와 조류 세르핀 골수 및 적혈구 핵 종결 단계 특정 단백질(MENT)이 있으며, 둘 다 파파인 유사 시스테인 프로테아제를 억제한다.[39][40][41]4. 생물학적 기능 및 위치
인간 세르핀은 크게 세포 외 기능과 세포 내 기능으로 나눌 수 있다.
세포 외에서는 주로 혈류 내 프로테아제의 활성을 억제하는 역할을 한다. 혈액 응고(항트롬빈), 염증 및 면역 반응(안티키모트립신, C1-억제제), 조직 리모델링((PAI-1))과 같이 생명 유지에 필수적인 단백질 분해 연쇄 반응을 조절한다.[95] 또한 신호 전달 연쇄 반응 프로테아제를 억제하여 발생 생물학에도 영향을 미친다.[42][43]
세포 내 세르핀은 세포 내부에서 프로테아제의 부적절한 활성을 막는 역할을 한다.[44] 예를 들어 세르핀 B9는 세포 독성 과립 프로테아제 그랜자임 B를 억제하여 세포사멸 경로의 조기 활성화를 방지한다.[45]
일부 바이러스는 세르핀을 이용하여 숙주의 프로테아제 기능을 방해하기도 한다. 우두 바이러스 세르핀 CrmA는 숙주의 염증 반응을 억제하여 바이러스의 감염성을 높인다.[46]
4. 1. 세포 외 기능
인간 세르핀의 약 3분의 2는 혈류에서 프로테아제의 활성을 억제하는 세포 외 역할을 수행한다. 예를 들어, 세포 외 세르핀은 혈액 응고 (항트롬빈), 염증 및 면역 반응 (안티키모트립신 및 C1-억제제)과 조직 리모델링((PAI-1))에 중요한 단백질 분해 연쇄 반응을 조절한다.[95] 또한 신호 전달 연쇄 반응 프로테아제를 억제하여 발생 생물학에도 영향을 미칠 수 있다.[42][43]4. 2. 세포 내 기능
인간 세르핀의 약 3분의 2는 혈류에서 프로테아제를 억제하는 세포 외 역할을 수행하여 혈액 내 프로테아제의 활성을 조절한다. 예를 들어, 세포 외 세르핀은 혈액 응고 (항트롬빈), 염증 및 면역 반응 (항트립신, 안티키모트립신 및 C1-억제제) 및 조직 리모델링 (PAI-1)에 중요한 단백질 분해 연쇄 반응을 조절한다.[95] 신호 전달 연쇄 반응 프로테아제를 억제하여 발생 생물학에도 영향을 미칠 수 있다.[42][43]세포 내 억제 세르핀의 프로테아제 표적은 이러한 분자들이 중복된 역할을 수행하는 것으로 보이기 때문에 식별하기 어렵다. 또한 많은 인간 세르핀은 쥐와 같은 모델 유기체에서 정확한 기능적 등가물을 가지고 있지 않다. 그럼에도 불구하고, 세포 내 세르핀의 중요한 기능은 세포 내부에서 프로테아제의 부적절한 활성에 대한 보호일 수 있다.[44] 예를 들어, 가장 잘 특징지어진 인간 세포 내 세르핀 중 하나는 세르핀 B9로, 세포 독성 과립 프로테아제 그랜자임 B를 억제한다. 그렇게 함으로써, 세르핀 B9은 그랜자임 B의 부주의한 방출과 세포사멸 경로의 조기 또는 원치 않는 활성화를 방지할 수 있다.[45]
일부 바이러스는 세르핀을 사용하여 숙주 내 프로테아제 기능을 방해한다. 우두 바이러스 세르핀 CrmA (사이토카인 반응 조절자 A)는 감염된 숙주 세포의 염증 및 세포사멸 반응을 피하기 위해 사용된다. CrmA는 IL-1 및 IL-18의 시스테인 프로테아제 caspase-1에 의한 처리를 억제함으로써 숙주의 염증 반응을 억제하여 감염성을 증가시킨다.[46] 진핵생물에서 식물 세르핀은 메타카스파제[47] 및 파파인 유사 시스테인 프로테아제를 모두 억제한다.[48]
4. 3. 비억제성 기능
갑상선 호르몬 결합 글로불린과 트란스코르틴은 각각 호르몬 티록신과 코르티솔을 운반한다.[49][66] 억제 기능을 하지 않는 세르핀인 오발부민은 달걀 흰자에서 가장 풍부한 단백질이다. 정확한 기능은 알려져 있지 않지만, 이는 태아 발달을 위한 저장 단백질로 여겨진다.[50] 열 충격 세르핀 47은 샤페론이며, 콜라겐의 적절한 접힘에 필수적이다. 이는 소포체에서 처리되는 동안 콜라겐의 삼중 나선을 안정화시키는 작용을 한다.[51]일부 세르핀은 단백질 분해 효소 억제제이면서 추가적인 역할을 수행한다. 예를 들어, 핵 시스테인 단백질 분해 효소 억제제인 MENT는 조류에서 조류의 적혈구에서 염색질 리모델링 분자로도 작용한다.[40][52]
4. 4. 바이러스 세르핀
일부 바이러스는 세르핀을 사용하여 숙주 내 프로테아제 기능을 방해한다. 우두 바이러스 세르핀 CrmA (사이토카인 반응 조절자 A)는 감염된 숙주 세포의 염증 및 세포사멸 반응을 피하기 위해 사용된다. CrmA는 IL-1 및 IL-18의 시스테인 프로테아제 카스페이즈-1에 의한 처리를 억제함으로써 숙주의 염증 반응을 억제하여 감염성을 증가시킨다.[46] 진핵생물에서 식물 세르핀은 메타카스파제[47] 및 파파인 유사 시스테인 프로테아제를 모두 억제한다.[48]5. 구조
세르핀은 다단계 작용 메커니즘을 가지고 있으며, 이를 이해하기 위해서는 여러 가지 다른 형태의 구조를 파악해야 한다. 따라서 구조 생물학은 세르핀의 기능과 생물학을 이해하는 데 중요한 역할을 해왔다.[7]
5. 1. 공통 구조
모든 세르핀은 다양한 기능에도 불구하고 공통적인 구조를 공유한다. 일반적으로 3개의 β-시트 (A, B, C로 명명)와 8개 또는 9개의 α-나선 (hA–hI로 명명)을 가지고 있다.[26][27] 세르핀 기능에 가장 중요한 영역은 A-시트와 반응 중심 루프(RCL)이다. A-시트는 '셔터'라고 불리는 그 사이의 영역과 '브리치'라고 불리는 상부 영역이 있는 평행한 방향으로 있는 두 개의 β-가닥을 포함한다. RCL은 억제 분자에서 표적 프로테아제와 초기 상호 작용을 형성한다. RCL이 완전히 노출되거나 A-시트에 부분적으로 삽입된 구조가 해결되었으며, 세르핀은 이 두 상태 사이의 동적 평형 상태에 있는 것으로 생각된다.[7] RCL은 또한 구조의 나머지 부분과 일시적인 상호 작용만 하기 때문에 유연성이 매우 높고 용매에 노출되어 있다.[7]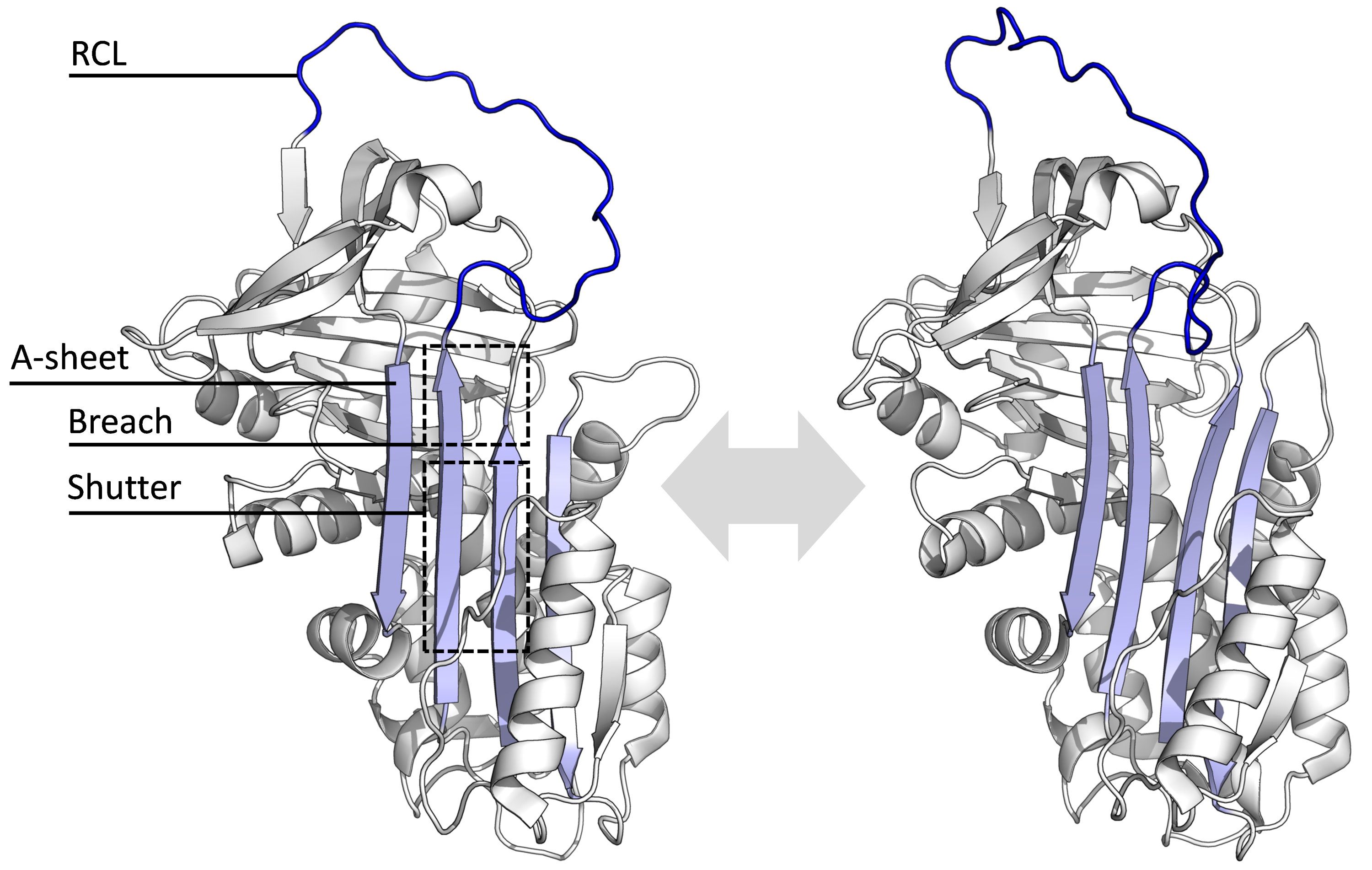
결정된 세르핀 구조는 여러 가지 다른 형태를 포괄하며, 이는 다단계 작용 메커니즘을 이해하는 데 필요했다. 따라서 구조 생물학은 세르핀 기능과 생물학을 이해하는 데 중요한 역할을 해왔다.[7]
5. 2. 핵심 영역
모든 세르핀은 다양한 기능에도 불구하고 공통적인 구조 (또는 접힘)를 공유한다. 일반적으로 3개의 β-시트 (A, B, C로 명명)와 8개 또는 9개의 α-나선 (hA–hI로 명명)을 가지고 있다.[26][27] 세르핀 기능에 가장 중요한 영역은 A-시트와 반응 중심 루프(RCL)이다. A-시트는 '셔터'라고 불리는 그 사이의 영역과 '브리치'라고 불리는 상부 영역이 있는 평행한 방향으로 있는 두 개의 β-가닥을 포함한다. RCL은 억제 분자에서 표적 프로테아제와 초기 상호 작용을 형성한다. RCL이 완전히 노출되거나 A-시트에 부분적으로 삽입된 구조가 해결되었으며, 세르핀은 이 두 상태 사이의 동적 평형 상태에 있는 것으로 생각된다.[7] RCL은 또한 구조의 나머지 부분과 일시적인 상호 작용만 하기 때문에 유연성이 매우 높고 용매에 노출되어 있다.[7]결정된 세르핀 구조는 여러 가지 다른 형태를 포괄하며, 이는 다단계 작용 메커니즘을 이해하는 데 필요했다. 따라서 구조 생물학은 세르핀 기능과 생물학을 이해하는 데 중요한 역할을 해왔다.[7]
5. 3. 동적 평형
모든 세르핀은 다양한 기능에도 불구하고 공통적인 구조를 공유하며, 일반적으로 3개의 β-시트 (A, B, C)와 8개 또는 9개의 α-나선 (hA–hI)을 가진다.[26][27] 세르핀 기능에 가장 중요한 A-시트는 '셔터'와 '브리치'라고 불리는 상부 영역이 있는 평행한 방향으로 있는 두 개의 β-가닥을 포함한다. 반응 중심 루프(RCL)는 억제 분자에서 표적 프로테아제와 초기 상호 작용을 형성하며, 완전히 노출되거나 A-시트에 부분적으로 삽입된 구조가 해결되었으며, 세르핀은 이 두 상태 사이의 동적 평형 상태에 있는 것으로 생각된다.[7] RCL은 또한 구조의 나머지 부분과 일시적인 상호 작용만 하기 때문에 유연성이 매우 높고 용매에 노출되어 있다.[7]
6. 입체 구조 변화와 억제 기전
세르핀은 프로테아제 억제제와 달리, '자물쇠와 열쇠' 방식의 경쟁적 메커니즘으로 표적 프로테아제를 억제하지 않는다. 대신, 세르핀은 프로테아제의 구조를 파괴하고 촉매 작용을 완료하지 못하게 하는 특이한 입체 구조 변화를 사용한다.
세린 프로테아제와 시스테인 프로테아제는 2단계 과정을 통해 펩타이드 결합 분해를 촉매한다. 먼저 활성 부위 촉매 삼합체의 촉매 잔기가 기질의 펩타이드 결합에 친핵체 공격을 수행하여, 새로운 N-말단을 방출하고 효소와 기질 사이에 공유 에스터 결합을 형성한다.[6] 이 공유 복합체를 아실-효소 중간체라고 한다. 표준 기질의 경우, 에스터 결합은 가수분해되고 새로운 C-말단이 방출되어 촉매 작용이 완료된다.
그러나 세르핀이 프로테아제에 의해 절단되면 아실-효소 중간체가 가수분해되기 전에 S to R 전환이 빠르게 일어난다.[6] 이 전환 속도가 가수분해보다 훨씬 빠르기 때문에 억제가 효과적이다. RCL이 프로테아제에 공유 결합된 상태에서 S to R 전환은 프로테아제를 세르핀 아래로 당기고 촉매 삼합체를 왜곡시킨다. 왜곡된 프로테아제는 아실 효소 중간체를 매우 느리게 가수분해하여, 프로테아제는 며칠에서 몇 주 동안 결합된 상태로 남는다.[5] 세르핀은 한 번에 하나의 프로테아제만 영구적으로 비활성화시키므로, 비가역적 억제 및 자살 억제제로 분류된다.[6]
6. 1. S-R 전이
세르핀 억제제는 대부분의 작은 프로테아제 억제제와 달리, '자물쇠와 열쇠' 방식의 경쟁적 메커니즘으로 작동하지 않는다. 대신 세르핀은 프로테아제의 구조를 파괴하고 촉매 작용을 방해하는 독특한 입체 구조 변화를 이용한다. 이 변화는 RCL이 단백질의 반대쪽 끝으로 이동하여 β-시트 A에 삽입되면서 추가적인 역평행 β-가닥을 형성하는 것을 포함한다. 이는 세르핀을 스트레스 상태(S)에서 에너지가 감소된 이완 상태(R)로 전환시킨다(S to R 전환).[6][7][55]세린 프로테아제와 시스테인 프로테아제는 2단계 과정을 통해 펩타이드 결합 분해를 촉매한다.
# 활성 부위 촉매 삼합체의 촉매 잔기가 기질의 펩타이드 결합에 친핵체 공격을 한다.
# 새로운 N-말단이 방출되고 효소와 기질 사이에 공유 에스터 결합이 형성된다.[6] 이 효소-기질 복합체를 아실-효소 중간체라고 한다.
표준 기질의 경우, 에스터 결합은 가수분해되고 새로운 C-말단이 방출되어 촉매 작용이 완료된다. 그러나 세르핀이 프로테아제에 의해 절단되면 아실-효소 중간체가 가수분해되기 전에 S to R 전환이 빠르게 일어난다.[6] 억제 효율성은 입체 구조 변화의 운동 속도가 프로테아제에 의한 가수분해보다 수십 배 더 빠르다는 사실에 기인한다.
RCL이 프로테아제에 에스터 결합을 통해 공유 결합된 상태이므로, S to R 전환은 프로테아제를 세르핀의 위에서 아래로 끌어당기고 촉매 삼합체를 왜곡시킨다. 왜곡된 프로테아제는 아실 효소 중간체를 매우 느리게 가수분해하며, 프로테아제는 며칠에서 몇 주 동안 공유 결합 상태로 유지된다.[5] 세르핀은 각 세르핀 단백질이 단일 프로테아제를 영구적으로 비활성화하고 한 번만 기능하므로 비가역적 억제 및 자살 억제제로 분류된다.[6]
6. 2. 아실-효소 중간체 포획
세르핀 억제제는 대부분의 작은 프로테아제 억제제와 달리, '자물쇠와 열쇠' 방식의 경쟁적 메커니즘으로 표적 프로테아제를 억제하지 않는다. 대신 세르핀은 프로테아제의 구조를 파괴하고 촉매 작용을 완료하지 못하게 하는 특이한 입체 구조 변화를 사용한다. 이 변화는 RCL이 단백질의 반대쪽 끝으로 이동하여 β-시트 A에 삽입되어 추가적인 역평행 β-가닥을 형성하는 것을 포함한다. 이는 세르핀을 스트레스 상태에서 에너지 감소된 이완 상태(S to R 전환)로 변환시킨다.[6][7][55]세린 프로테아제와 시스테인 프로테아제는 2단계 과정을 통해 펩타이드 결합 분해를 촉매한다.
# 활성 부위 촉매 삼합체의 촉매 잔기가 기질의 펩타이드 결합에 친핵체 공격을 수행한다. 이는 새로운 N-말단을 방출하고 효소와 기질 사이에 공유 에스터 결합을 형성한다.[6] 효소와 기질 사이의 이 공유 복합체를 아실-효소 중간체라고 한다.
# 표준 기질의 경우, 에스터 결합은 가수분해되고 새로운 C-말단이 방출되어 촉매 작용이 완료된다.
그러나 세르핀이 프로테아제에 의해 절단되면 아실-효소 중간체가 가수분해되기 전에 S to R 전환이 빠르게 일어난다.[6] 억제 효율성은 입체 구조 변화의 운동 속도가 프로테아제에 의한 가수분해보다 수십 배 더 빠르다는 사실에 달려 있다.
RCL이 에스터 결합을 통해 프로테아제에 여전히 공유 결합되어 있기 때문에, S to R 전환은 프로테아제를 세르핀의 위에서 아래로 끌어당기고 촉매 삼합체를 왜곡시킨다. 왜곡된 프로테아제는 아실 효소 중간체를 극도로 느리게 가수분해할 수 있으며, 따라서 프로테아제는 며칠에서 몇 주 동안 공유 결합 상태로 유지된다.[5] 세르핀은 각 세르핀 단백질이 단일 프로테아제를 영구적으로 비활성화하고 한 번만 기능할 수 있기 때문에 비가역적 억제 및 자살 억제제로 분류된다.[6]
6. 3. 비가역적 억제
세르핀 억제제는 대부분의 작은 프로테아제 억제제와 달리, '자물쇠와 열쇠' 방식의 경쟁적 억제가 아닌, 독특한 입체 구조 변화를 이용한다. 이 변화는 프로테아제의 구조를 파괴하여 촉매 작용을 완료하지 못하게 한다. RCL(반응 중심 고리)이 단백질 반대편 끝으로 이동하여 β-시트 A에 삽입, 추가적인 역평행 β-가닥을 형성한다. 이는 세르핀을 스트레스 상태(S)에서 이완 상태(R)로 전환시킨다(S to R 전환).[6][7][55]세린 프로테아제와 시스테인 프로테아제는 2단계 과정을 통해 펩타이드 결합을 분해한다. 먼저, 활성 부위 촉매 삼합체의 잔기가 기질 펩타이드 결합에 친핵체 공격을 한다. 이는 새로운 N-말단을 방출하고 효소와 기질 사이에 공유 에스터 결합을 형성한다.[6] 이 복합체를 아실-효소 중간체라 한다. 일반 기질은 에스터 결합이 가수분해되어 새로운 C-말단이 방출되고 촉매 작용이 완료된다. 그러나 세르핀이 프로테아제에 의해 절단되면, 아실-효소 중간체가 가수분해되기 전에 S to R 전환이 빠르게 일어난다.[6] 이 전환 속도가 가수분해보다 훨씬 빠르기 때문에 억제가 효과적이다.
RCL이 프로테아제에 공유 결합된 상태에서 S to R 전환은 프로테아제를 세르핀 아래로 당기고 촉매 삼합체를 왜곡시킨다. 왜곡된 프로테아제는 아실 효소 중간체를 매우 느리게 가수분해하여, 프로테아제는 며칠에서 몇 주 동안 결합된 상태로 남는다.[5] 세르핀은 한 번에 하나의 프로테아제만 영구적으로 비활성화시키므로, 비가역적 억제 및 자살 억제제로 분류된다.[6]
7. 알로스테릭 활성화
세르핀의 입체 구조 변화는 정적인 "열쇠와 자물쇠"형 (경쟁적 억제형) 프로테아제 억제제가 가지지 못하는 중요한 이점을 제공한다.[354] 억제형 세르핀의 기능은 특정 보조 인자와의 알로스테릭 상호 작용에 의해 제어될 수 있다. 항트롬빈, 헤파린 보조 인자 II, MENT, 그리고 마우스 항키모트립신의 X선 결정 구조를 통해, 이들 세르핀은 RCL의 처음 두 아미노산이 A 시트의 정점에 포함되는 입체 구조를 가진다는 것이 밝혀졌다. RCL이 부분적으로 본체에 포함된 입체 구조는, 보조 인자와 결합하면 포함된 부위를 노출시켜 프로테아제와 반응하기 쉬운 입체 구조로 재구성되기 때문에 기능적으로 중요하다.[253][254]
7. 1. 보조 인자에 의한 조절
세르핀의 입체 구조 이동성은 고정된 자물쇠-열쇠 프로테아제 억제제보다 중요한 이점을 제공한다.[155] 특히, 억제성 세르핀의 기능은 특정 보조 인자와의 알로스테릭 상호 작용에 의해 조절될 수 있다. 항트롬빈, 헤파린 보조 인자 II, MENT 및 마우스 안티키모트립신의 X선 결정 구조는 이들 세르핀이 RCL의 처음 두 아미노산이 A β-시트의 상단에 삽입되는 형태를 취한다는 것을 보여준다. 부분적으로 삽입된 구조는 보조 인자가 특정 부분적으로 삽입된 세르핀을 완전히 배출된 형태로 구조적으로 전환할 수 있기 때문에 중요하다.[56][57] 이러한 구조적 재배열은 세르핀을 더욱 효과적인 억제제로 만든다.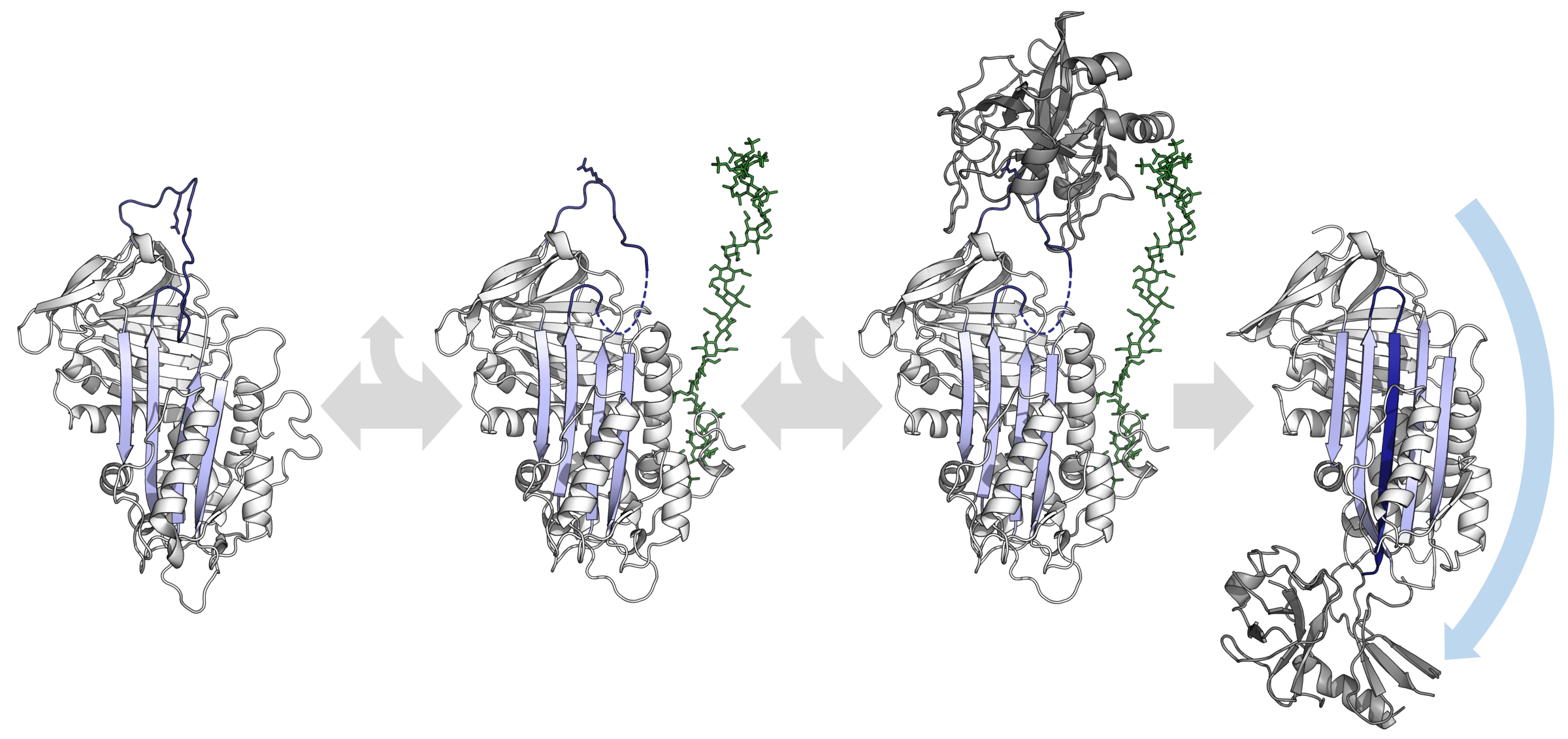
이 상황의 전형적인 예는 혈장 내에서 부분적으로 삽입된 비교적 비활성 상태로 순환하는 항트롬빈이다. 주요 특이성을 결정하는 잔기(P1 아르기닌)는 세르핀의 몸체를 향하고 프로테아제에 사용할 수 없다. 긴 사슬 헤파린 내에서 고친화성 오당류 서열에 결합하면 항트롬빈은 구조적 변화, RCL 배출, P1 아르기닌 노출을 겪는다. 따라서 헤파린 오당류 결합 형태의 항트롬빈은 트롬빈 및 인자 Xa의 더욱 효과적인 억제제이다.[58][59] 또한, 이 두 가지 응고 프로테아제는 모두 헤파린에 대한 결합 부위(엑소사이트)를 포함한다. 따라서 헤파린은 또한 프로테아제와 세르핀 모두의 결합 템플릿 역할을 하여 두 당사자 간의 상호 작용을 더욱 극적으로 가속화한다. 초기 상호 작용 후 최종 세르핀 복합체가 형성되고 헤파린 부분이 방출된다. 이 상호 작용은 생리학적으로 중요하다. 예를 들어, 혈관벽 손상 후 헤파린이 노출되고 항트롬빈이 활성화되어 응고 반응을 제어한다. 이러한 상호 작용의 분자적 기초에 대한 이해를 통해 폰다파리눅스의 개발이 가능해졌으며, 이는 항응고 약물로 사용되는 헤파린 오당류의 합성 형태이다.[60][61]
7. 2. 폰다파리눅스 개발
이러한 상호 작용의 분자적 기초에 대한 이해를 통해 항응고제로 사용되는 합성 헤파린 펜타사카라이드인 폰다파리눅스가 개발되었다.[60][61][258][259]
8. 잠재형 입체 구조
일부 세르핀은 프로테아제에 의한 절단 없이 자연스럽게 S-R 전이(S에서 R로의 전이)를 일으켜 잠재형(潛在形)이라고 불리는 입체 구조를 취한다. 잠재형 세르핀은 프로테아제와 상호작용할 수 없으므로 더 이상 프로테아제 억제제로 작용하지 않는다. 잠재형으로의 입체 구조 변화는 세르핀 절단에 의해 일어나는 S-R 전이와는 다르다. RCL이 손상되지 않았기 때문에 RCL이 완전히 통합되려면 C 시트의 첫 번째 가닥이 벗겨져야 한다.[62]
잠재형 전이 조절은 PAI-1과 같은 일부 세르핀의 제어 기구로 작용한다. PAI-1은 억제 S형 구조로 생성되지만, 비트로넥틴과 결합하지 않으면 잠재형으로 변화하여 자동 비활성화된다.[62] 항트롬빈은 헤파린에 의한 알로스테릭 활성화 외에 추가적인 조절 기구로서 잠재형으로 전환될 수 있다.[63] 써모아나에로박터속 세균의 세르핀인 tengpin|텡핀영어 N 말단은 텡핀 활성형 구조 유지에 필요하며, N 말단 영역 상호 작용이 차단되면 잠재형 구조로 변화한다.[64][65]
8. 1. 자발적 S-R 전이
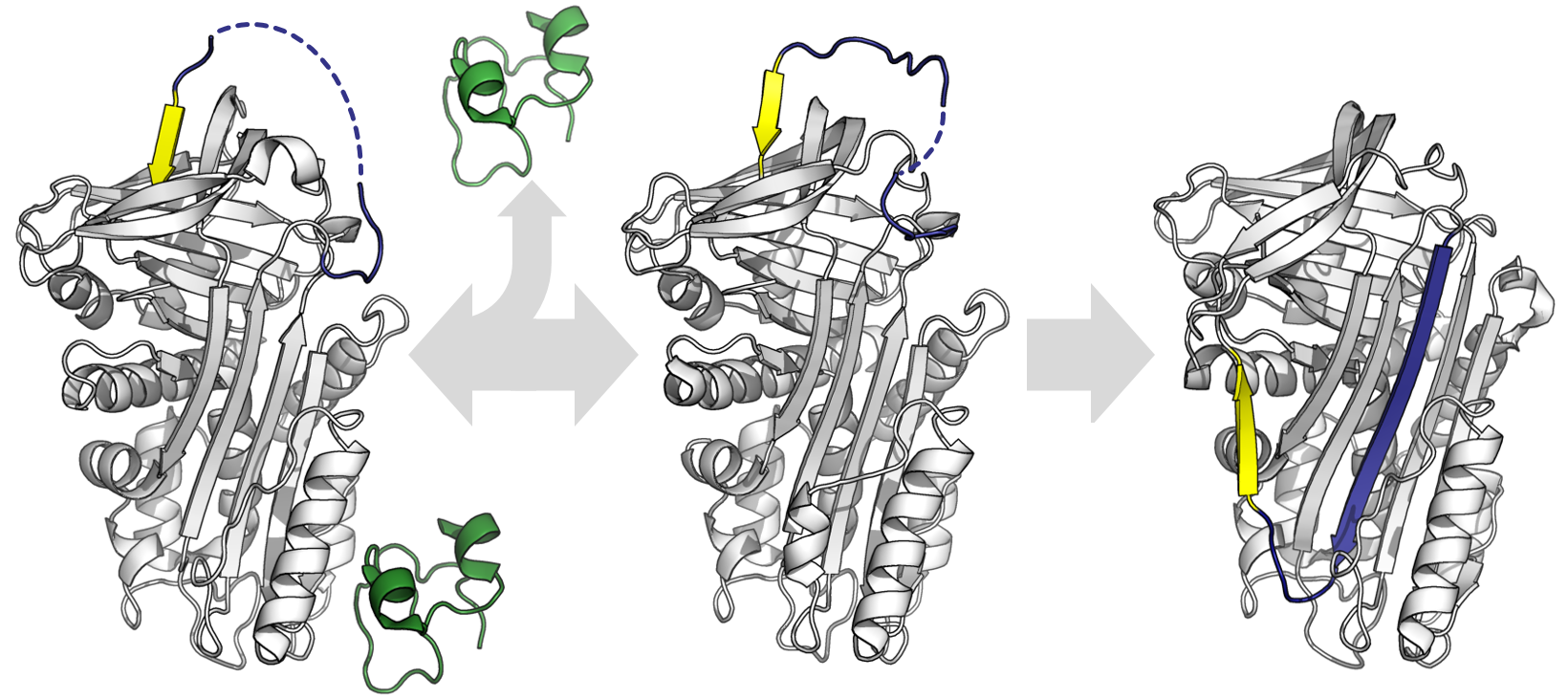
특정 세르핀은 프로테아제에 의해 절단되지 않고 자발적으로 S에서 R로의 전이를 겪어 잠복 상태라는 컨포메이션을 형성한다. 잠복 세르핀은 프로테아제와 상호 작용할 수 없으므로 더 이상 프로테아제 억제제가 아니다. 잠복 상태로의 컨포메이션 변화는 절단된 세르핀의 S에서 R로의 전이와 정확히 같지는 않다. RCL이 여전히 손상되지 않았으므로, 완전한 RCL 삽입을 허용하려면 C 시트의 첫 번째 가닥이 벗겨져야 한다.[62]
잠복 전이의 조절은 일부 세르핀, 예를 들어 PAI-1에서 제어 메커니즘 역할을 할 수 있다. PAI-1은 억제 S 컨포메이션으로 생성되지만, 공통 인자 비트로넥틴에 결합되지 않으면 잠복 상태로 변화하여 "자동 비활성화"된다.[62] 마찬가지로, 항트롬빈은 헤파린에 의한 알로스테릭 활성화에 대한 추가적인 조절 메커니즘으로 자발적으로 잠복 상태로 전환될 수 있다.[63] 마지막으로, ''Thermoanaerobacter tengcongensis''의 세르핀인 tengpin|텡핀영어의 N-말단은 분자를 고유의 억제 상태로 고정하는 데 필요하다. N-말단 부위에서 발생하는 상호 작용의 파괴는 이 세르핀의 자발적인 컨포메이션 변화를 잠복 컨포메이션으로 유도한다.[64][65]
8. 2. PAI-1의 조절 기전
일부 세르핀은 프로테아제에 의해 절단되지 않고 자발적으로 S에서 R로의 전이를 겪어 잠복 상태라는 컨포메이션을 형성한다. 잠복 세르핀은 프로테아제와 상호 작용할 수 없으므로 더 이상 프로테아제 억제제가 아니다. 잠복 상태로의 컨포메이션 변화는 절단된 세르핀의 S에서 R로의 전이와 정확히 같지는 않다. RCL이 여전히 손상되지 않았으므로, 완전한 RCL 삽입을 허용하려면 C 시트의 첫 번째 가닥이 벗겨져야 한다.[62]잠복 전이의 조절은 일부 세르핀, 예를 들어 PAI-1에서 제어 메커니즘 역할을 할 수 있다. PAI-1은 억제 S 컨포메이션으로 생성되지만, 공통 인자 비트로넥틴에 결합되지 않으면 잠복 상태로 변화하여 "자동 비활성화"된다.[62] 마찬가지로, 항트롬빈은 헤파린에 의한 알로스테릭 활성화에 대한 추가적인 조절 메커니즘으로 자발적으로 잠복 상태로 전환될 수 있다.[63] 마지막으로, ''Thermoanaerobacter tengcongensis''의 세르핀인 tengpin영어 (텡핀)의 N-말단은 분자를 고유의 억제 상태로 고정하는 데 필요하다. N-말단 부위에서 발생하는 상호 작용의 파괴는 이 세르핀의 자발적인 컨포메이션 변화를 잠복 컨포메이션으로 유도한다.[64][65]
9. 비억제성 기능에서의 입체 구조 변화
일부 세르핀에서 S에서 R로의 전환은 세포 신호 전달 현상을 활성화할 수 있다. 이러한 경우, 표적 프로테아제와 복합체를 형성한 세르핀은 수용체에 의해 인식된다. 이 결합은 수용체에 의한 하위 신호 전달로 이어진다.[68] 따라서 S에서 R로의 전환은 프로테아제 활동의 존재를 세포에 알리는 데 사용된다.[68] 이는 세르핀이 신호 전달 연쇄 반응에 관여하는 프로테아제를 억제함으로써 신호 전달에 영향을 미치는 일반적인 메커니즘과는 다르다.[42][43][238][239][266]
9. 1. 리간드 방출
일부 비억제성 세르핀은 입체 구조 변화를 그 기능의 일부로 사용한다. 예를 들어, 티록신 결합 글로불린의 기본(S) 형태는 티록신에 대한 친화력이 높지만, 절단된 (R) 형태는 친화력이 낮다. 마찬가지로, 트란스코르틴은 기본(S) 상태일 때 절단된 (R) 상태보다 코르티솔에 대한 친화력이 더 높다. 따라서 이러한 세르핀에서 RCL 절단 및 S에서 R로의 전환은 프로테아제 억제보다는 리간드 방출을 허용하기 위해 사용된다.[49][66][67][245][264][265]9. 2. 신호 전달
세르핀은 억제 기능 외에도 광범위한 역할을 수행한다. 갑상선 호르몬 결합 글로불린과 트란스코르틴은 각각 호르몬 티록신과 코르티솔을 운반한다.[49][66] 억제 기능을 하지 않는 세르핀인 오발부민은 달걀 흰자에서 가장 풍부한 단백질이다. 정확한 기능은 알려져 있지 않지만, 이는 태아 발달을 위한 저장 단백질로 여겨진다.[50] 열 충격 세르핀 47은 샤페론이며, 콜라겐의 적절한 접힘에 필수적이다. 이는 소포체에서 처리되는 동안 콜라겐의 삼중 나선을 안정화시키는 작용을 한다.[51]일부 세르핀은 단백질 분해 효소 억제제이면서 추가적인 역할을 수행한다. 예를 들어, 핵 시스테인 단백질 분해 효소 억제제인 MENT는 조류의 적혈구에서 염색질 리모델링 분자로도 작용한다.[40][52]
특정 비억제성 세르핀은 세르핀의 컨포메이션 변화를 그 기능의 일부로 사용하기도 한다. 예를 들어, 티록신 결합 글로불린의 기본 (S) 형태는 티록신에 대한 친화력이 높지만, 절단된 (R) 형태는 친화력이 낮다. 마찬가지로, 트란스코르틴은 기본 (S) 상태일 때 절단된 (R) 상태보다 코르티솔에 대한 친화력이 더 높다. 따라서 이러한 세르핀에서, RCL 절단 및 S에서 R로의 전환은 프로테아제 억제보다는 리간드 방출을 허용하기 위해 사용된다.[49][66][67]
일부 세르핀에서 S에서 R로의 전환은 세포 신호 전달 현상을 활성화할 수 있다. 이러한 경우, 표적 프로테아제와 복합체를 형성한 세르핀은 수용체에 의해 인식된다. 이 결합은 수용체에 의한 하위 신호 전달로 이어진다.[68] 따라서 S에서 R로의 전환은 프로테아제 활동의 존재를 세포에 알리는 데 사용된다.[68] 이는 세르핀이 신호 전달 연쇄 반응에 관여하는 프로테아제를 억제함으로써 신호 전달에 영향을 미치는 일반적인 메커니즘과는 다르다.[42][43]
10. 분해
세르핀이 표적 단백질 분해 효소를 억제하면 영구적인 복합체를 형성하지만, 이 복합체는 제거되어야 한다. 세포 외 세르핀의 경우, 최종 산물인 세르핀-효소 복합체는 순환계에서 신속하게 제거된다. 포유류에서 이러한 제거는 저밀도 지질단백질 수용체 관련 단백질(LRP)을 통해 이루어진다.[266][267] 초파리의 세르핀 네크로틱(Necrotic)은 라이소좀 내에서 분해된다.[268]
10. 1. 세르핀-효소 복합체 제거
세르핀이 표적 단백질 분해 효소를 억제하면 영구적인 복합체를 형성하며, 이는 제거되어야 한다. 세포 외 세르핀의 경우, 최종 세르핀-효소 복합체는 순환계에서 빠르게 제거된다. 포유류에서 이러한 현상이 발생하는 한 가지 메커니즘은 저밀도 지단백질 수용체 관련 단백질(LRP)을 통해 이루어지며, 이 단백질은 안티트롬빈, PA1-1, 그리고 뉴로세르핀에 의해 만들어진 억제 복합체에 결합하여 세포내이입을 유발한다.[68][69] 유사하게, ''초파리'' 괴사 세르핀은 리소좀에서 분해되며, 이는 리포포린 수용체-1(포유류의 LDL 수용체 패밀리와 상동성)에 의해 세포 내로 수송된 후 일어난다.[70]11. 질환 및 세르핀병
세르핀은 광범위한 생리 기능에 관여하기 때문에, 이를 암호화하는 유전자에 변이가 생기면 다양한 질환을 유발할 수 있다. 세르핀의 활성, 특이성, 응집 특성을 변화시키는 변이는 모두 세르핀의 기능에 영향을 미친다. 대부분의 세르핀 관련 질병은 세르핀 중합체의 응집으로 발생하지만, 다른 유형의 질병 관련 변이도 존재한다.[7][71] 알파-1 항트립신 결핍증은 가장 흔한 유전 질환 중 하나이다.[9][72]
드물게 세르핀의 RCL(반응 중심 루프)에서 단일 아미노산 변화가 일어나면 표적 프로테아제를 잘못 지정하여 특이성이 변경될 수 있다. 예를 들어, 안티트립신-피츠버그 변이(M358R)는 α1-안티트립신이 트롬빈을 억제하게 만들어 출혈 장애를 유발한다.[25]
11. 1. 세르핀 유전자 변이
세르핀은 광범위한 생리학적 기능에 관여하며, 따라서 이를 암호화하는 유전자에 돌연변이가 생기면 다양한 질병을 유발할 수 있다. 세르핀의 활성, 특이성 또는 응집 특성을 변화시키는 돌연변이는 모두 세르핀의 기능에 영향을 미친다. 대부분의 세르핀 관련 질병은 세르핀 중합체의 응집체 형성으로 인해 발생하지만, 다른 여러 유형의 질병 관련 돌연변이도 발생한다.[7][71] 알파-1 항트립신 결핍증은 가장 흔한 유전 질환 중 하나이다.[9][72]11. 2. 세르핀병(Serpinopathy)
세르핀은 광범위한 생리 기능에 관여하기 때문에, 이를 암호화하는 유전자의 돌연변이는 다양한 질병을 유발할 수 있다. 세르핀의 활성, 특이성 또는 응집 특성을 변화시키는 돌연변이는 모두 세르핀의 기능에 영향을 미친다. 대부분의 세르핀 관련 질병은 세르핀 중합체의 응집체 형성으로 인해 발생하지만, 다른 여러 유형의 질병 관련 돌연변이도 발생한다.[7][71] 알파-1 항트립신 결핍증은 가장 흔한 유전 질환 중 하나이다.[9][72]대부분의 세르핀 질환은 단백질 응집에 의한 것이며, "세르핀병"이라고 불린다.[277][272] 본질적으로 불안정한 구조 때문에 세르핀은 폴딩 이상을 촉진하는 질환 유발 변이에 취약하다.[272] 잘 연구된 세르핀병에는 가족성 폐기종이나 때로는 간경변을 일으키는 α1-안티트립신 결핍증, 안티트롬빈 결핍증 관련 가족성 혈전증, C1 억제제 결핍증에 의한 1형 및 2형 유전성 혈관부종, 그리고 뉴로세르핀의 봉입체 형성을 동반하는 가족성 뇌증(FENIB; 뉴로세르핀의 다량체 형성에 기인하는 희귀한 치매) 등이 포함된다.[217][277][275][276]
세르핀 단량체의 응집은 비활성 이완형 입체 구조(RCL이 A 시트에 들어간 상태)를 취한다. 그러므로 다량체는 온도에 대해 매우 안정적이며, 프로테아제를 억제할 수 없다. 따라서 세르핀병은 두 가지 주요 원리에 의해 다른 단백질병(프로테오패티, 예: 프리온병)과 유사한 병리를 보인다.[217][277] 먼저, 활성화된 세르핀의 결실은 프로테아제의 폭주와 조직 파괴를 일으킨다. 다음으로, 초안정 다량체 자신도 세르핀을 대사하는 소포체를 방해하여, 결과적으로 세포 사멸과 조직 손상을 일으킨다. 안티트립신 결핍증에서는 안티트립신의 다량체가 간세포의 세포 사멸을 일으켜 간의 파괴와 간경변의 원인이 된다. 세포 내에서 세르핀 다량체는 소포체에서 분해되어 서서히 제거된다.[278] 그러나 세르핀 다량체가 세포 사멸을 일으키는 상세한 기전은 아직 완전히 이해되지 않았다.[217]
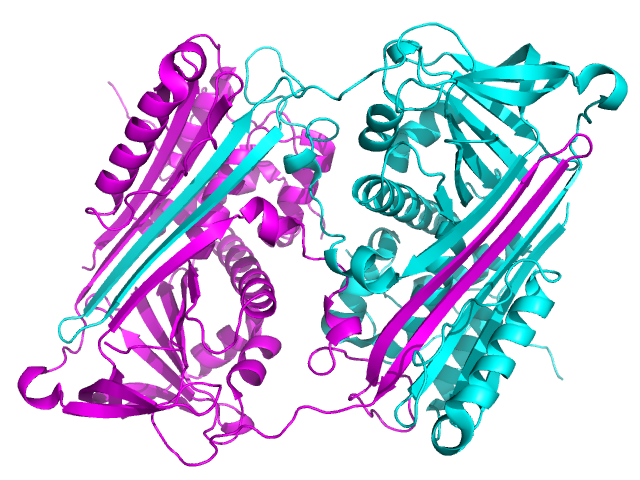
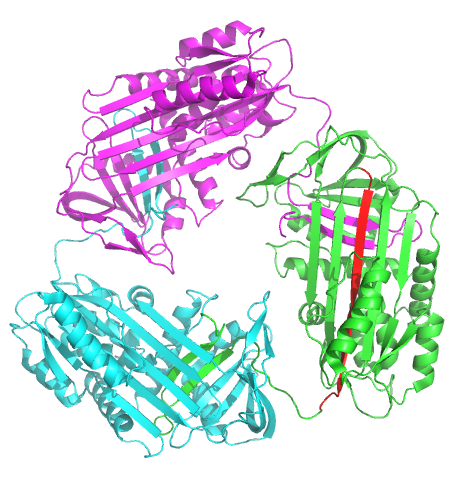
세르핀 다량체는 생리적으로 도메인 교환 현상에 의해 생긴다고 생각된다. 이 현상에서는 세르핀 분자의 일부분이 다른 세르핀 분자에 들어간다.[279] 도메인 교환은 변이나 환경 인자가 세르핀이 천연 상태의 구조로 폴딩되는 과정의 최종 단계를 방해하고, 고에너지 중간체의 폴딩 이상을 일으킴으로써 발생한다.[280] 지금까지 이량체와 삼량체 모두에 대해 도메인 교환 구조가 밝혀졌다. 먼저, (안티트롬빈의) 이량체에서는 RCL과 A 시트의 일부가 다른 세르핀 분자에 포함된다.[279] 한편, (안티트립신의) 도메인 교환형 삼량체는 이량체와는 전혀 다르게, B 시트의 교환에 의해 다량체가 형성되며, 각 분자 중의 RCL은 자신의 A 시트에 들어간다.[281] 또한, 세르핀이 RCL을 다른 A 시트에 삽입함으로써 도메인 교환 구조를 형성할 가능성(A 시트 다량체화)도 제안되었다.[275][282] 이상과 같은 도메인 교환에 의해 생기는 이량체 구조나 삼량체 구조는 질환 관련 다량체 응집 덩어리를 만든다고 생각되지만, 정확한 원리는 아직 밝혀지지 않았다.[279][280][281][283]
11. 3. 비활성 또는 결손
스트레스를 받은 세르핀 폴드는 고에너지 상태이기 때문에, 돌연변이는 억제 역할을 제대로 수행하기 전에 저에너지 컨포메이션(예: 이완 또는 잠재)으로 잘못 변경될 수 있다.[8]A-시트에 RCL 삽입 속도나 정도에 영향을 미치는 돌연변이는 프로테아제와 결합하기 전에 세르핀이 S에서 R로의 컨포메이션 변화를 겪게 할 수 있다. 세르핀은 이 컨포메이션 변화를 한 번만 수행할 수 있으므로, 결과적으로 오작동된 세르핀은 비활성화되어 표적 프로테아제를 제대로 제어할 수 없게 된다.[8][73] 마찬가지로, 단량체 잠재 상태로의 부적절한 전이를 촉진하는 돌연변이는 활성 억제 세르핀의 양을 감소시켜 질병을 유발한다. 예를 들어, 질병과 관련된 안티트롬빈 변이체인 ''wibble''과 ''wobble''은[74] 모두 잠재 상태의 형성을 촉진한다.
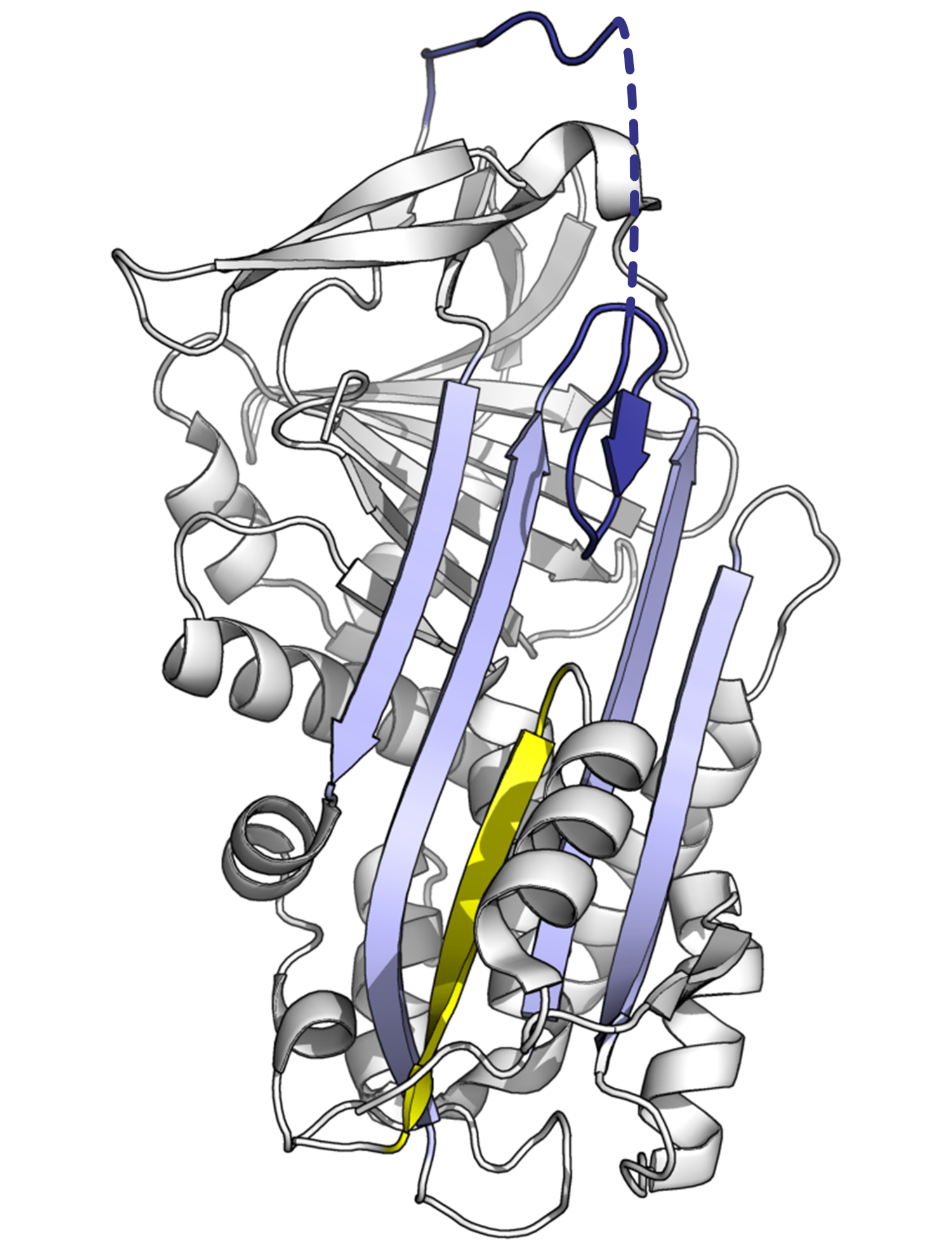
질병과 관련된 안티키모트립신(L55P) 돌연변이의 구조는 또 다른 비활성 "δ-컨포메이션"을 보여주었다. δ-컨포메이션에서 RCL의 4개 잔기가 β-시트 A 상단에 삽입된다. 시트의 하단 절반은 α-나선 중 하나(F-나선)가 부분적으로 β-가닥 컨포메이션으로 전환되어 β-시트 수소 결합을 완성한 결과로 채워진다.[75] 다른 세르핀이 이 컨포머를 채택할 수 있는지, 이 컨포메이션이 기능적 역할을 하는지는 불분명하지만, δ-컨포메이션은 티록신 방출 동안 티록신 결합 글로불린에 의해 채택될 수 있다고 추측된다.[66] 세르핀과 관련된 비억제 단백질도 돌연변이가 발생하면 질병을 유발할 수 있다. 예를 들어, SERPINF1의 돌연변이는 인간에게 골형성 부전증 VI형을 유발한다.[168]
필요한 세르핀이 없는 경우, 일반적으로 조절하는 프로테아제가 과활성화되어 병리가 발생한다.[8] 결과적으로 세르핀의 단순한 결핍(예: null 돌연변이)은 질병을 유발할 수 있다.[76] 특히 넉아웃 마우스에서 유전자 녹아웃은 세르핀 부재의 영향을 통해 세르핀의 정상적인 기능을 결정하기 위해 실험적으로 사용된다.[96]
11. 4. 특이성 변화
드물게, 세르핀의 RCL에서 단일 아미노산 변화가 일어나면 표적 프로테아제를 잘못 지정하여 특이성이 변경될 수 있다. 예를 들어, 안티트립신-피츠버그 변이(M358R)는 α1-안티트립신 세르핀이 트롬빈을 억제하게 하여 출혈 장애를 유발한다.[25] 이와 유사하게, 항트립신-피츠버그 변이(M358R)는 α1 항트립신의 표적을 트립신에서 트롬빈으로 변경하여 출혈성 질환의 원인이 된다.[274]11. 5. 다량체화 및 응집
세르핀 유전자 변이는 세르핀의 활성, 특이성, 응집 특성 등에 영향을 미쳐 다양한 질환을 유발한다.대부분의 세르핀 질환은 단백질 응집으로 인해 발생하는 "세르피노병증"이다.[78][75] 세르핀은 불안정한 구조 탓에 질병 유발 돌연변이에 취약하여 잘못 접힌 중합체를 형성하기 쉽다.[75] 대표적인 세르피노병증으로는 알파 1-안티트립신 결핍증(가족성 폐기종, 간경변 유발), 항트롬빈 결핍증 관련 가족성 혈전증, C1-억제제 결핍 관련 유전성 혈관부종(제1형 및 제2형), 뉴로세르핀 응집체 관련 가족성 뇌병증(FENIB, 희귀 치매) 등이 있다.[9][78][77]
세르핀 응집체 내 각 단량체는 비활성 이완 상태(RCL이 A-시트에 삽입)로 존재한다. 이 중합체는 온도에 매우 안정적이며 프로테아제 억제능이 없다. 세르피노병증은 활성 세르핀 부족에 따른 프로테아제 활성화 및 조직 파괴, 그리고 중합체의 소포체 차단으로 인한 세포 사멸 및 조직 손상이라는 두 가지 기전을 통해 병을 일으킨다.[9][78] 알파 1-안티트립신 결핍증의 경우, 안티트립신 중합체가 간세포 사멸을 유발하여 간 손상 및 간경변을 일으키기도 한다. 세포 내 세르핀 중합체는 소포체 분해를 통해 서서히 제거되나,[79] 세포 사멸 유발 기전은 아직 완전히 밝혀지지 않았다.[9]
생리적 세르핀 중합체는 한 세르핀 단백질의 일부가 다른 세르핀 단백질에 삽입되는 단백질 도메인 교환을 통해 형성되는 것으로 추정된다.[80] 도메인 교환은 돌연변이나 환경 요인에 의해 세르핀의 정상적인 접힘 과정이 방해받아 고에너지 중간체가 잘못 접힐 때 발생한다.[81] 단백질 이량체(안티트롬빈, RCL과 A-시트 일부가 다른 분자의 A-시트에 통합) 및 단백질 삼량체(안티트립신, B-시트 교환, 각 분자의 RCL은 자체 A-시트에 삽입) 도메인 교환 구조가 밝혀졌다.[80][82] 한 세르핀의 RCL이 다른 세르핀의 A-시트에 삽입되는 도메인 교환(A-시트 중합) 가설도 제기되었다.[77][83] 이러한 도메인 교환 이량체 및 삼량체는 질병 유발 중합체 응집체의 구성 요소로 추정되나, 정확한 기전은 불분명하다.[80][81][82][84]
11. 5. 1. 치료 전략
대부분의 세르핀 질환은 단백질 응집으로 인해 발생하며, 이를 "세르피노병증"이라고 부른다.[78][75] 세르핀은 불안정한 구조 때문에 잘못 접힌 중합체를 형성하는 돌연변이에 취약하다.[75] 대표적인 세르피노병증으로는 가족성 폐기종과 간경변을 유발하는 알파 1-안티트립신 결핍증, 항트롬빈 결핍증과 관련된 가족성 혈전증, C1-억제제 결핍과 관련된 유전성 혈관부종, 뉴로세르핀 응집체와 관련된 가족성 뇌병증(FENIB) 등이 있다.[9][78][77]세르핀 응집체의 각 단량체는 비활성 상태로 존재하며, 중합체는 온도에 매우 안정적이고 프로테아제를 억제할 수 없다. 세르피노병증은 활성 세르핀 부족으로 인한 프로테아제 활성화와 조직 파괴, 그리고 중합체가 세포의 소포체를 막아 세포 사멸과 조직 손상을 유발하는 두 가지 방식으로 병을 일으킨다.[9][78] 안티트립신 결핍의 경우, 안티트립신 중합체는 간세포의 죽음을 유발하여 간 손상 및 간경변을 일으키기도 한다. 세르핀 중합체는 소포체에서 분해를 통해 서서히 제거되지만,[79] 세포 사멸을 유발하는 자세한 기전은 아직 완전히 밝혀지지 않았다.[9]
생리적 세르핀 중합체는 단백질 도메인 교환, 즉 한 세르핀 단백질의 일부가 다른 세르핀 단백질에 삽입되는 방식으로 형성된다.[80] 도메인 교환은 돌연변이나 환경 요인이 세르핀이 정상 형태로 접히는 마지막 단계를 방해하여 고에너지 중간체가 잘못 접힐 때 발생한다.[81] 단백질 이량체 및 단백질 삼량체 도메인 교환 구조가 밝혀졌는데, 이량체(안티트롬빈)에서는 RCL과 A-시트의 일부가 다른 세르핀 분자의 A-시트에 통합되고,[80] 도메인 교환 삼량체(안티트립신)는 B-시트를 교환하여 형성된다(각 분자의 RCL은 자체 A-시트에 삽입됨).[82] 세르핀이 한 단백질의 RCL을 다른 단백질의 A-시트에 삽입하여 도메인 교환을 형성할 수 있다는 가설도 있다(A-시트 중합).[77][83] 이러한 도메인 교환 이량체 및 삼량체는 질병을 유발하는 중합체 응집체의 구성 요소로 생각되지만, 정확한 기전은 아직 불분명하다.[80][81][82][84]
가장 흔한 세르핀병증인 항트립신 결핍증을 치료하기 위해 여러 치료법이 사용되거나 연구 중이다.[9] 항트립신 보충 요법은 심각한 항트립신 결핍증 관련 폐기종에 대해 승인되었으며,[85] 헌혈자의 혈장에서 정제한 항트립신을 정맥 내로 투여한다(처음에는 Prolastin으로 시판).[9][86] 심각한 항트립신 결핍증 관련 질환 치료에는 폐 및 간 장기 이식이 효과적이다.[9][87] 동물 모델에서는 유도 만능 줄기 세포의 유전자 타겟팅을 통해 항트립신 중합 결함을 교정하고 포유류 간이 활성 항트립신을 분비하는 능력을 회복시키는 데 성공했다.[88] 또한 시험관 내에서 항트립신 중합을 차단하는 저분자 물질도 개발되었다.[89][90]
세르핀은 광범위한 생리 기능에 관여하기 때문에, 세르핀 유전자 변이는 다양한 질환의 원인이 된다. 세르핀의 활성, 특이성, 응집 특성을 변화시키는 변이는 세르핀의 기능에 영향을 미친다. 가장 흔한 세르핀 관련 질환은 세르핀 응집으로 발생하지만, 이 외에도 질환과 관련된 몇 가지 변이가 있다.[227][269] 알파-1 항트립신 결핍증은 특히 흔한 유전성 질환이다.[217][221] 항트립신 결핍증의 치료를 위해 여러 치료 전략이 실용화되거나 연구되고 있다.[217] 항트립신 증강 요법은 중증 항트립신 결핍증 관련 폐기종에 적용된다.[284] 처음 Prolastin으로 시판된 이 치료제는 항트립신을 기증자의 혈장에서 정제한 것으로, 정맥 주사로 사용된다.[217][285] 중증 항트립신 관련 질환에는 폐와 간 이식이 효과적이다.[217][286] 동물 실험에서는 iPS 세포에 대한 유전자 치료법이 항트립신 다량체 형성에 의한 결핍을 개선하고, 간의 활성 항트립신 생산 능력을 회복하는 데 성공했다.[287] 시험관 내에서 항트립신 다량체 형성을 차단하는 저분자 개발도 진행되고 있다.[288][289]
12. 진화
세르핀은 단백질 분해 효소 억제제 중 가장 널리 분포하고 큰 슈퍼패밀리이다.[229][230] 처음에는 진핵생물에만 있는 것으로 알려졌으나, 이후 세균, 고세균, 일부 바이러스에서도 발견되었다.[293][290][291] 원핵생물 세르핀 유전자가 조상으로부터 물려받은 것인지, 아니면 진핵생물로부터 수평적 이동으로 획득된 것인지는 불분명하다.
대부분의 세포 내 세르핀은 식물성과 동물성에 관계없이 계통학적으로 단일 클레이드에 속한다. 따라서 세포 내 세르핀과 세포 외 세르핀은 식물과 동물이 분기하기 이전에 분화했을 가능성이 있다.[292] 다만, 콜라겐의 올바른 접힘에 필수적인 샤페론인 세포 내 열 충격 단백질 HSP47은 예외로, 시스-골지체와 소포체 사이를 순환한다.[247]
단백질 분해 효소 억제는 세르핀의 오래된 기능이며, 비억제형 세르핀은 진화 과정에서 신기능 획득을 통해 나타난 것으로 보인다. S-R 입체 구조 전이는 결합형 세르핀이 표적에 대한 친화성을 조절하는 데 사용된다.[264]
12. 1. 가장 크고 다양한 슈퍼패밀리
세르핀은 가장 널리 분포하고 가장 큰 단백질 분해 효소 억제제 슈퍼패밀리이다.[34][35] 처음에는 진핵생물에만 국한된 것으로 여겨졌지만, 이후 세균, 고세균 및 일부 바이러스에서도 발견되었다.[94][91][92] 원핵생물 유전자가 조상 원핵생물 세르핀의 후손인지, 아니면 진핵생물로부터의 수평적 유전자 전달의 산물인지는 아직 불분명하다. 대부분의 세포 내 세르핀은 식물에서 유래했든 동물에서 유래했든 단일 계통 발생 분류군에 속하며, 이는 세포 내 및 세포 외 세르핀이 식물과 동물 이전에 분화되었을 수 있음을 나타낸다.[93] 예외는 콜라겐의 적절한 폴딩에 필수적인 샤페론이며, 시스-골지와 소포체 사이를 순환하는 세포 내 열충격 세르핀 HSP47이 있다.[51]단백질 분해 효소 억제는 조상 기능으로 여겨지며, 비억제성 구성원은 구조의 진화적 신 기능화의 결과이다. S에서 R로의 형태 변화는 일부 결합 세르핀에 의해 표적에 대한 친화성을 조절하기 위해 적용되었다.[66]
12. 2. 광범위한 분포
세르핀은 가장 널리 분포하고 가장 큰 단백질 분해 효소 억제제 슈퍼패밀리이다.[34][35] 처음에는 진핵생물에만 국한된 것으로 여겨졌지만, 이후 세균, 고세균 및 일부 바이러스에서도 발견되었다.[94][91][92] 원핵생물 유전자가 조상 원핵생물 세르핀의 후손인지, 아니면 진핵생물로부터의 수평적 유전자 전달의 산물인지는 아직 불분명하다. 대부분의 세포 내 세르핀은 식물에서 유래했든 동물에서 유래했든 단일 계통 발생 분류군에 속하며, 이는 세포 내 및 세포 외 세르핀이 식물과 동물 이전에 분화되었을 수 있음을 나타낸다.[93] 예외는 콜라겐의 적절한 폴딩에 필수적인 샤페론이며, 시스-골지와 소포체 사이를 순환하는 세포 내 열충격 세르핀 HSP47이 있다.[51]12. 3. 세포 내 및 세포 외 세르핀의 분화
세르핀은 가장 널리 분포하고 가장 큰 단백질 분해 효소 억제제 슈퍼패밀리이다.[34][35] 처음에는 진핵생물에만 국한된 것으로 여겨졌지만, 이후 세균, 고세균 및 일부 바이러스에서도 발견되었다.[94][91][92] 원핵생물 유전자가 조상 원핵생물 세르핀의 후손인지, 아니면 진핵생물로부터의 수평적 유전자 전달의 산물인지는 아직 불분명하다. 대부분의 세포 내 세르핀은 식물에서 유래했든 동물에서 유래했든 단일 계통 발생 분류군에 속하며, 이는 세포 내 및 세포 외 세르핀이 식물과 동물 이전에 분화되었을 수 있음을 나타낸다.[93] 예외는 콜라겐의 적절한 폴딩에 필수적인 샤페론이며, 시스-골지와 소포체 사이를 순환하는 세포 내 열충격 세르핀 HSP47이 있다.[51]12. 4. 신기능 획득
단백질 분해 효소 억제는 세르핀의 오래된 기능으로 여겨지며, 비억제성 세르핀은 구조의 진화적 신기능 획득의 결과이다.[66][264] S에서 R로의 형태 변화는 일부 결합 세르핀이 표적에 대한 친화성을 조절하기 위해 사용된다.[66][264]13. 분포
세르핀은 다양한 생물종에 걸쳐 광범위하게 분포한다.
- 동물:
- 곤충: 초파리 유전자에는 29개의 세르핀 유전자가 있으며, 이들은 염색체 위치에 따라 명명된다. Serpin-27A는 배쪽-등쪽 패턴 형성과 곤충 면역 반응을 조절한다.[43][189][190] 밀웜의 SPN93 단백질은 톨 단백질 분해 연쇄반응을 조절한다.[191]
- 선충: 예쁜꼬마선충은 9개의 세르핀 유전자를 가지며, 이 중 SRP-6는 스트레스 유발 칼파인 관련 리소좀 파괴를 방지한다.[193]
- 포유류: 인간 게놈은 16개의 세르핀 클레이드를 포함하며, 29개의 억제성 단백질과 7개의 비억제성 단백질이 있다.[95][96] 인간 세르핀은 생화학 연구, 인간 유전 질환 및 녹아웃 마우스 모델을 통해 기능이 밝혀졌다.[96]
- 식물: 식물 세르핀은 보리 단백질 Z와 같이 곡물에 풍부하며, 곤충이나 미생물의 프로테아제로부터 식물을 보호하는 역할을 할 수 있다.[196][197] 애기장대 세르핀 AtSerpin1은 프로그램된 세포 사멸 조절에 관여한다.[48][201]
- 진균: 파이로마이세스 종 E2 균주에서 발견된 셀핀은 억제 작용을 할 것으로 예측되며, 식물 단백질 분해 효소로부터 셀룰로솜을 보호할 수 있다.[32]
- 원핵생물: 세르핀 유전자는 원핵생물에 산발적으로 분포하며, 단백질 분해 효소를 억제할 수 있다.[203][204]
- 바이러스: 폭스바이러스가 발현하는 세르핀은 숙주의 면역 방어를 회피하는 데 사용된다.[206]
13. 1. 동물
초파리 유전자에는 29개의 세르핀을 암호화하는 유전자가 있다. 이 중 14개는 세르핀 클레이드 Q에, 3개는 세르핀 클레이드 K에 속하며, 나머지 12개는 특정 클레이드에 속하지 않는 고아 세르핀으로 분류된다.[186] ''초파리'' 세르핀에는 클레이드 분류 시스템을 적용하기 어려워, ''초파리'' 염색체에서 세르핀 유전자의 위치를 기반으로 하는 명명법이 사용된다. ''초파리'' 세르핀 중 13개는 독립된 유전자 형태로 존재하며(Serpin-27A 포함), 나머지 16개는 염색체 위치 28D (2개), 42D (5개), 43A (4개), 77B (3개), 88E (2개)에 위치한 5개의 유전자 클러스터로 구성되어 있다.[186][187][188]''초파리'' 세르핀 연구에 따르면, Serpin-27A는 Easter 프로테아제를 억제하여 배쪽-등쪽 패턴 형성을 조절한다. Easter는 Spätzle(케모카인형 리간드)를 절단하며, 이는 톨 매개 신호 전달을 유발한다. 톨 신호 전달은 배아 패턴 형성뿐만 아니라 곤충의 선천 면역 반응에도 중요하다. 따라서 serpin-27A는 곤충 면역 반응 조절에도 관여한다.[43][189][190] 밀웜(큰 딱정벌레)에는 두 개의 세르핀 도메인으로 구성된 단백질(SPN93)이 톨 단백질 분해 연쇄반응을 조절한다.[191]
선충 ''예쁜꼬마선충''의 게놈은 9개의 세르핀을 포함하며, 모두 신호 서열이 없어 세포 내에 존재할 가능성이 높다.[192] 이 중 5개만 단백질 분해 효소 억제제 역할을 하는 것으로 보인다.[192] SRP-6는 스트레스 유발 칼파인 관련 리소좀 파괴를 방지하고, 리소좀 파열 후 방출되는 리소좀 시스테인 단백질 분해 효소를 억제한다. SRP-6가 없는 선충은 스트레스에 민감하며, 특히 물에 넣으면 죽는다(저삼투압 스트레스 치사 표현형). 따라서 리소좀이 세포 운명을 결정하는 데 중요한 역할을 한다는 것이 제안되었다.[193]
13. 1. 1. 포유류
인간 게놈은 16개의 세르핀 클레이드(serpinA부터 serpinP까지)를 포함하며, 여기에는 29개의 억제성 단백질과 7개의 비억제성 단백질이 포함된다.[95][96] 2001년부터 약 500개의 세르핀에 대한 계통 발생 분석을 기반으로 인간 세르핀 명명 시스템이 만들어졌으며, 단백질은 serpinXY로 명명되었다. (X는 단백질의 클레이드, Y는 해당 클레이드 내의 단백질 번호)[34][94][96] 인간 세르핀의 기능은 생화학 연구, 인간 유전 질환 및 녹아웃 마우스 모델을 통해 밝혀졌다.[96]| 유전자 이름 | 일반 이름 | 위치 | 기능/활성 | 결핍 효과 | 인간 질병 | 염색체 위치 | 단백질 구조 |
|---|---|---|---|---|---|---|---|
| SERPINA1 | α1-안티트립신 | 세포 외 | 인간 호중구 엘라스타제의 억제제.[97] 절단된 SERPINA1의 C-말단 단편은 HIV-1 감염을 억제할 수 있다.[98] | 결핍은 폐기종을 유발하고, 중합화는 간경변을 유발한다(serpinopathy).[9][99] | 14q32.1 | --, --, -- | |
| SERPINA2 | 안티트립신 관련 단백질 | 세포 외 | 가능한 유사 유전자.[100] | 14q32.1 | |||
| SERPINA3 | α1-안티키모트립신 | 세포 외 | 카텝신 G의 억제제.[101] 간세포에서 염색질 응축에 대한 추가 역할.[102] | 조절 장애는 알츠하이머병을 유발한다(serpinopathy).[103] | 14q32.1 | --, -- | |
| SERPINA4 | 칼리스테틴 | 세포 외 | 칼리크레인의 억제제, 혈관 기능의 조절제.[104][105] | 고혈압 쥐에서 고갈은 신장 및 심혈관 손상을 악화시킨다.[106] | 14q32.1 | ||
| SERPINA5 | 단백질 C 억제제 | 세포 외 | 활성 단백질 C의 억제제.[107] 박테리아의 식세포 작용을 방지하는 세포 내 역할.[108] | 수컷 쥐에서 녹아웃은 불임을 유발한다.[109] 축적은 다발성 경화증의 만성 활성 반점에서 발생한다.[110] | 14q32.1 | --, -- | |
| SERPINA6 | 트란스코르틴 | 세포 외 | 비억제성. 코르티솔 결합.[49] | 결핍은 만성 피로와 관련이 있다.[111] | 14q32.1 | --, --, -- | |
| SERPINA7 | 티록신 결합 글로불린 | 세포 외 | 비억제성. 티록신 결합.[66] | 결핍은 갑상선 기능 저하증을 유발한다.[112][113] | Xq22.2 | --, --, -- | |
| SERPINA8 | 안지오텐시노겐 | 세포 외 | 비억제성, 레닌에 의한 절단은 안지오텐신 I의 방출을 유발한다.[114] | 쥐에서 녹아웃은 저혈압을 유발한다.[115] | 변이는 고혈압과 관련이 있다.[116][117][118] | 1q42-q43 | --, --, --, --, --, --, -- |
| SERPINA9 | 센터린 / GCET1 | 세포 외 | 억제성, 나이브 B 세포 유지.[119][120] | 대부분의 B 세포 림프종에서 강력하게 발현된다.[121][122] | 14q32.1 | ||
| SERPINA10 | 단백질 Z 관련 프로테아제 억제제 | 세포 외 | 단백질 Z에 결합하여 인자 Xa 및 인자 XIa를 비활성화한다.[123] | 14q32.1 | --, -- | ||
| SERPINA11 | – | 아마도 세포 외 | 알려지지 않음 | 14q32.13 | |||
| SERPINA12 | 바스핀 | 세포 외 | 칼리크레인-7의 억제제. 인슐린 감작 아디포사이토카인.[124] | 높은 혈장 수치는 제2형 당뇨병과 관련이 있다.[125] | 14q32.1 | -- | |
| SERPINA13 | – | 아마도 세포 외 | 알려지지 않음 | 14q32 | |||
| SERPINB1 | 단핵구 호중구 엘라스타제 억제제 | 세포 내 | 호중구 엘라스타제의 억제제.[126] | 쥐에서 녹아웃은 호중구 생존 결함 및 면역 결핍을 유발한다.[127] | 6p25 | -- | |
| SERPINB2 | 플라스미노겐 활성제 억제제-2 | 세포 내/세포 외 | 세포 외 uPA의 억제제. 세포 내 기능은 불분명하지만 바이러스 감염으로부터 보호할 수 있다.[128] | 쥐에서 결핍은 선충 감염에 대한 면역 반응을 감소시킨다.[129] 쥐에서 녹아웃은 뚜렷한 표현형을 유발하지 않는다.[130] | 18q21.3 | -- | |
| SERPINB3 | 편평 상피 세포 암종 항원-1 (SCCA-1) | 세포 내 | 파파인 유사 시스테인 프로테아제[39] 및 카텝신 K, L 및 S의 억제제.[131][132] | Serpinb3a (인간 SERPINB3 및 SERPINB4의 마우스 상동체)의 쥐에서 녹아웃은 천식의 마우스 모델에서 점액 생성이 감소한다.[134] | 18q21.3 | -- | |
| SERPINB4 | 편평 상피 세포 암종 항원-2 (SCCA-2) | 세포 내 | 키모트립신 유사 세린 프로테아제, 카텝신 G 및 키마제의 억제제.[132][133] | Serpinb3a (인간 SERPINB3 및 SERPINB4의 마우스 상동체)의 쥐에서 녹아웃은 천식의 마우스 모델에서 점액 생성이 감소한다.[134] | 18q21.3 | ||
| SERPINB5 | 마스핀 | 세포 내 | 비억제성, 기능 불분명[135][136][137] (maspin 참조) | 쥐에서 녹아웃은 원래 치명적인 것으로 보고되었지만[138], 이후 뚜렷한 표현형이 없는 것으로 나타났다.[137] 발현은 인접한 종양 억제 유전자(포스파타제 PHLPP1)의 발현을 반영하는 예후 지표일 수 있다.[137] | 18q21.3 | -- | |
| SERPINB6 | PI-6 | 세포 내 | 카텝신 G의 억제제.[139] | 쥐에서 녹아웃은 청력 손실[140] 및 경미한 호중구 감소증을 유발한다.[141] | 결핍은 청력 손실과 관련이 있다.[142] | 6p25 | |
| SERPINB7 | 메긴 | 세포 내 | 거핵세포 성숙에 관여한다.[143] | 쥐에서 과발현은 신장 질환을 유발한다.[144] 쥐에서 녹아웃은 조직학적 이상을 유발하지 않는다.[144] | 돌연변이는 나가시마형 손발바닥 각화증과 관련이 있다.[145] | 18q21.3 | |
| SERPINB8 | PI-8 | 세포 내 | 가능한 퓨린 억제제.[146] | 18q21.3 | |||
| SERPINB9 | PI-9 | 세포 내 | 세포 독성 과립 프로테아제 그란자임 B의 억제제.[147] | 쥐에서 녹아웃은 면역 기능 장애를 유발한다.[148][149] | 6p25 | ||
| SERPINB10 | 보마핀 | 세포 내 | 알려지지 않음[150] | 쥐에서 녹아웃은 뚜렷한 표현형을 유발하지 않음(C57/BL6; 연구실 균주 [https://www.ncbi.nlm.nih.gov/entrez/viewer.fcgi?db=nuccore&id=47125085 BC069938]). | 18q21.3 | ||
| SERPINB11 | 세포 내 | 알려지지 않음[151] | 마우스 Serpinb11은 활성 억제제인 반면 인간 정위체는 비활성이다.[151] 조랑말의 결핍은 발굽 벽 분리 질환과 관련이 있다.[152] | 18q21.3 | |||
| SERPINB12 | 유코핀 | 세포 내 | 알려지지 않음[153] | 18q21.3 | |||
| SERPINB13 | 후르핀/헤드핀 | 세포 내 | 파파인 유사 시스테인 프로테아제의 억제제.[154] | 18q21.3 | |||
| SERPINC1 | 안티트롬빈 | 세포 외 | 응고의 억제제, 특히 인자 X, 인자 IX 및 트롬빈.[155] | 쥐에서 녹아웃은 치명적이다.[156] | 결핍은 혈전증 및 기타 응고 장애를 유발한다(serpinopathy).[157][158] | 1q23-q21 | --, --, --, --, --, -- |
| SERPIND1 | 헤파린 보조 인자 II | 세포 외 | 트롬빈의 억제제.[159] | 쥐에서 녹아웃은 치명적이다.[160] | 22q11 | --, -- | |
| SERPINE1 | 플라스미노겐 활성제 억제제 1 | 세포 외 | 트롬빈, uPA 및 TPa의 억제제.[161] | 7q21.3-q22 | --, -- | ||
| SERPINE2 | 신경교 유래 넥신 / 프로테아제 넥신 I | 세포 외 | uPA 및 tPA의 억제제.[162] | 비정상적인 발현은 남성 불임을 유발한다.[163] 쥐에서 녹아웃은 간질을 유발한다.[164] | 2q33-q35 | -- | |
| SERPINF1 | 색소 상피 유래 인자 | 세포 외 | 비억제성, 강력한 항혈관 생성 분자.[165] PEDF는 글리코사미노글리칸 히알루론산에 결합하는 것으로 보고되었다.[166] | 쥐에서 녹아웃은 췌장 및 전립선의 혈관 및 질량에 영향을 미친다.[165] 성인 실질주위 신경 줄기 세포의 노치 의존성 갱신을 촉진한다.[167] 인간의 돌연변이는 골형성 부전증 제VI형을 유발한다.[168] | 17p13.3 | -- | |
| SERPINF2 | α2-항플라스민 | 세포 외 | 플라스민의 억제제, 피브린 용해의 억제제.[169] | 쥐에서 녹아웃은 피브린 용해가 증가하지만 출혈 장애는 없다.[170] | 결핍은 드문 출혈 장애를 유발한다.[171][172] | 17pter-p12 | -- |
| SERPING1 | 보체 1-억제제 | 세포 외 | C1 에스테라제의 억제제.[173] | 여러 다형성은 황반 변성[174] 및 유전성 혈관 부종과 관련이 있다.[175] | 11q11-q13.1 | -- | |
| SERPINH1 | 47kDa 열충격 단백질 (HSP47) | 세포 내 | 비억제성, 콜라겐 폴딩의 분자 샤페론.[51] | 쥐에서 녹아웃은 치명적이다.[176] | 인간의 돌연변이는 심각한 골형성 부전증을 유발한다.[177][178] | 11p15 | -- |
| SERPINI1 | 신경세르핀 | 세포 외 | tPA, uPA 및 플라스민의 억제제.[179] | 돌연변이는 FENIB 치매(serpinopathy)를 유발한다.[180][181] | 3q26 | --, --, --, -- | |
| SERPINI2 | 판크핀 | 세포 외 | 알려지지 않음[182] | 쥐에서 결핍은 소포체 세포 손실을 통해 췌장 기능 부전을 유발한다.[183] | 3q26 |
많은 포유류 세르핀이 확인되었으며, 이들은 인간 세르핀 대응물과 명확한 상동성을 공유하지 않는 경우가 있다. 예를 들어 다수의 설치류 세르핀(특히 일부 쥐과 세포 내 세르핀)과 자궁 세르핀이 있다. 자궁 세르핀은 SERPINA14 유전자에 의해 암호화되는 세르핀 A 계열에 속하며, 라우라시아수목류 계열의 제한된 포유류 그룹에서 프로게스테론 또는 에스트로겐의 영향으로 자궁내막에서 생성된다.[184] 이들은 단백질 분해 효소 억제제가 아닐 가능성이 높으며, 임신 중 모체의 면역 반응을 착상에 대해 억제하거나 태반 통과 수송에 관여할 수 있다.[185]
13. 1. 2. 곤충
노란 초파리의 게놈은 29개의 세르핀 유전자를 가지고 있다. 아미노산 서열 분석 결과 14개의 세르핀이 클레이드 Q에, 3개가 클레이드 K에 분류되었으며, 나머지 12개는 고립되어 특정 클레이드에 분류되지 않았다.[186] 클레이드 분류 체계를 초파리의 세르핀에 사용하는 것은 어려우며, 대신 초파리의 염색체상의 위치에 기반한 전문적인 명명 체계가 적용된다. 초파리 세르핀 유전자 중 13개는 게놈상에 고립되어 존재한다(Serpin-27A 포함). 반면 나머지 16개는 5개의 클러스터를 형성하며, 각각 염색체 28D(2개), 42D(5개), 43A(4개), 77B(3개), 88E(2개) 위에 위치한다.[186][187][188]초파리 세르핀 연구를 통해 Serpin-27A가 Easter 프로테아제(단백질 분해 캐스케이드의 최종 단계를 담당)를 억제하여 배복축 형성을 제어한다는 것이 밝혀졌다. Easter 프로테아제는 Spätzle(케모카인형 리간드)을 절단하는 기능을 가지며, Spätzle의 절단은 toll 의존성 신호 전달로 이어진다. 패턴 형성에 있어서의 중심적인 역할과 함께 toll 신호 전달계는 곤충의 선천 면역 반응에서도 중요하다. 따라서 serpin-A27은 곤충의 면역 반응을 제어하는 기능도 갖는다.[43][189][190] Tenebrio molitor(큰 딱정벌레)에서는 어떤 단백질(SPN93)이 세르핀 전체를 도메인으로 하는 구조를 이중으로 가지며, toll의 단백질 분해 캐스케이드를 조절하고 있다.[191]
13. 1. 3. 선충
선충 ''C. elegans''(예쁜꼬마선충)의 게놈은 9개의 세르핀을 포함하고 있으며, 이들은 모두 신호 서열이 없어 세포 내부에 존재할 가능성이 높다.[192][390] 그러나 이 세르핀 중 5개만 단백질 분해 효소 억제제 역할을 하는 것으로 보인다.[192][390] 그 중 SRP-6는 보호 기능을 수행하며 스트레스 유발 칼파인 관련 리소좀 파괴를 방지한다. 또한 SRP-6는 리소좀 파열 후 방출되는 리소좀 시스테인 단백질 분해 효소를 억제한다. 따라서 SRP-6가 없는 선충은 스트레스에 민감하다. 특히 SRP-6 녹아웃 선충은 물에 넣으면 죽는다(저삼투압 스트레스 치사 표현형 또는 Osl). 따라서 리소좀이 세포 운명을 결정하는 데 일반적이고 제어 가능한 역할을 한다는 것이 제안되었다.[193][391]13. 2. 식물
식물 세르핀은 이 슈퍼패밀리의 최초 구성원 중 하나로 확인되었다.[194] 세르핀 보리 단백질 Z는 보리 곡물에 매우 풍부하며 맥주의 주요 단백질 성분 중 하나이다. 모델 식물인 ''애기장대''의 게놈에는 18개의 세르핀 유사 유전자가 포함되어 있지만, 이 중 8개만이 전체 길이의 세르핀 서열이다.식물 세르핀은 포유류 키모트립신 유사 세린 프로테아제에 대한 강력한 ''시험관 내'' 억제제이며, 가장 잘 연구된 예는 보리 세르핀 Zx(BSZx)로, 트립신과 키모트립신뿐만 아니라 여러 혈액 응고 인자를 억제할 수 있다.[195] 그러나 키모트립신 유사 세린 프로테아제의 근연종은 식물에 존재하지 않는다. 밀 곡물과 호밀의 여러 세르핀의 RCL에는 배유의 프롤라민 저장 단백질에 존재하는 것과 유사한 poly-Q 반복 서열이 포함되어 있다.[196][197] 따라서 식물 세르핀은 곡물 저장 단백질을 소화할 수 있는 곤충이나 미생물로부터의 프로테아제를 억제하는 기능을 할 수 있다는 주장이 제기되었다. 이 가설을 뒷받침하기 위해 특정 식물 세르핀이 호박(CmPS-1)[198]과 오이 식물의 사부 수액에서 확인되었다.[199][200] CmPS-1 발현의 상향 조절과 진딧물 생존 사이의 역상관 관계가 관찰되었지만, ''시험관 내'' 먹이 실험 결과 재조합 CmPS-1이 곤충 생존에 영향을 미치지 않는 것으로 나타났다.[198]
식물 세르핀에 대한 대체 역할과 프로테아제 표적이 제안되었다. ''애기장대'' 세르핀인 AtSerpin1(At1g47710)은 '건조 반응-21'(RD21) 파파인 유사 시스테인 프로테아제를 표적으로 하여 프로그램된 세포 사멸에 대한 설정점 조절을 매개한다.[48][201] AtSerpin1은 또한 ''시험관 내''에서 메타카스파제 유사 프로테아제를 억제한다.[47] 다른 두 개의 ''애기장대'' 세르핀인 AtSRP2(At2g14540) 및 AtSRP3(At1g64030)는 DNA 손상에 대한 반응에 관여하는 것으로 보인다.[202]
13. 3. 진균
현재까지 진균 세르핀은 하나가 특징적으로 밝혀졌는데, 그것은 ''파이로마이세스''(Piromyces) 종 E2 균주에서 발견된 셀핀|celpin영어이다. ''파이로마이세스''(Piromyces)는 반추동물의 내장에서 발견되는 혐기성 진균의 속으로, 식물 재료를 소화하는 데 중요하다. 셀핀|celpin영어은 억제 작용을 할 것으로 예측되며, 세르핀 도메인 외에 두 개의 N-말단 도커린 도메인을 포함하고 있다. 도커린은 일반적으로 곰팡이 셀룰로솜에 위치하는 단백질에서 발견되며, 셀룰로솜은 셀룰로오스를 분해하는 거대한 세포외 다중 단백질 복합체이다.[32] 따라서 셀핀|celpin영어이 식물 단백질 분해 효소로부터 셀룰로솜을 보호할 수 있다는 주장이 제기되었다. 특정 박테리아 세르핀도 유사하게 셀룰로솜에 위치한다.[205]13. 4. 원핵생물
세르핀 유전자는 원핵생물에 산발적으로 분포한다. 이 분자들 중 일부에 대한 ''시험관 내'' 연구 결과, 단백질 분해 효소를 억제할 수 있으며, ''생체 내''에서도 억제제 역할을 하는 것으로 추정된다.[203][204] 여러 원핵생물 세르핀은 극호성 생물에서 발견된다. 따라서, 포유류 세르핀과 대조적으로, 이 분자들은 열 변성에 대한 저항성이 높다.[203][204] 대부분의 세균 세르핀의 정확한 역할은 여전히 불분명하지만, ''Clostridium thermocellum'' 세르핀은 세포질소체에 국한되어 있다. 세포질소체 관련 세르핀의 역할은 세포질소체에 대한 원치 않는 단백질 분해 효소 활성을 방지하는 것일 수 있다는 추측이 있다.[205]13. 5. 바이러스
세르핀은 바이러스가 숙주의 면역 방어를 회피하기 위해 발현한다.[206] 특히 우두바이러스 (백시니아) 및 토끼두창 (믹소마)을 포함한 폭스바이러스가 발현하는 세르핀은 면역 및 염증 질환, 이식 치료에 대한 새로운 치료법으로서의 잠재력 때문에 관심의 대상이 된다.[207][208] Serp1은 TLR 매개 선천 면역 반응을 억제하며 쥐에서 무기한 심장 동종이식 생존을 가능하게 한다.[207][209] Crma와 Serp2는 모두 교차 억제제이며 세린 (그랜자임 B; 약하지만) 및 시스테인 프로테아제 (caspase 1 및 caspase 8)를 표적으로 한다.[210][211]포유류의 대응물과 비교하여, 바이러스 세르핀은 이차 구조 요소의 상당한 결실을 포함한다. 구체적으로, crmA는 D-나선과 A- 및 E-나선의 상당 부분을 결여한다.[212]
참조
[1]
논문
A Comprehensive Phylogenetic Analysis of the Serpin Superfamily
2021-06
[2]
서적
Proteinase Inhibitors
Elsevier Science Publishers BV
[3]
논문
Serpins flex their muscle: I. Putting the clamps on proteolysis in diverse biological systems
2010-08
[4]
논문
Serpins flex their muscle: II. Structural insights into target peptidase recognition, polymerization, and transport functions
2010-08
[5]
논문
Structure of a serpin-protease complex shows inhibition by deformation
2000-10
[6]
논문
Serpin structure, mechanism, and function
2002-12
[7]
논문
Molecular gymnastics: serpin structure, folding and misfolding
2006-12
[8]
논문
What do dysfunctional serpins tell us about molecular mobility and disease?
1995-02
[9]
논문
The discovery of α1-antitrypsin and its role in health and disease
2011-08
[10]
논문
Untersuchungen uber die enzyme, Vergleichende Studie
https://ia800708.us.[...]
1894-12
[11]
논문
Zur Kenntnis der alpha-globulin des menschlichen normal serums
1955-08
[12]
서적
The Physiological Inhibitors of Coagulation and Fibrinolysis
Elsevier
[13]
논문
Carboxy terminal fragment of human alpha-1-antitrypsin from hydroxylamine cleavage: homology with antithrombin III
1979-12
[14]
논문
A surprising new protein superfamily containing ovalbumin, antithrombin-III, and alpha 1-proteinase inhibitor
1980-07
[15]
논문
Structure and variation of human alpha 1-antitrypsin
1982-07
[16]
논문
The electrophoretic α1-globulin pattern of serum in α1-antitrypsin deficiency. 1963
2013-03
[17]
논문
Cirrhosis associated with alpha-1-antitrypsin deficiency: a previously unrecognized inherited disorder
https://pubmed.ncbi.[...]
1969-06
[18]
논문
Alpha-1-antitrypsin: molecular abnormality of S variant
1976-01
[19]
논문
Amino acid substitution Glu leads to Lys alpha1-antitrypsin PiZ
1976-06
[20]
논문
Structure and variation of human alpha 1-antitrypsin
1982-07
[21]
논문
Active site of alpha 1-antitrypsin: homologous site in antithrombin-III
1980-03
[22]
논문
Structural evidence for methionine at the reactive site of human alpha-1-proteinase inhibitor
1978-10
[23]
논문
The thrombin cleavage site in bovine antithrombin
1979-10
[24]
논문
Inherited antithrombin deficiency causing thrombophilia
1965-06
[25]
논문
Mutation of antitrypsin to antithrombin. alpha 1-antitrypsin Pittsburgh (358 Met leads to Arg), a fatal bleeding disorder
1983-09
[26]
논문
Human alpha 1-proteinase inhibitor. Crystal structure analysis of two crystal modifications, molecular model and preliminary analysis of the implications for function
1984-08
[27]
논문
Crystal structure of ovalbumin as a model for the reactive centre of serpins
1990-09
[28]
논문
Mobile reactive centre of serpins and the control of thrombosis
1991-10
[29]
논문
Structural basis of latency in plasminogen activator inhibitor-1
1992-01
[30]
논문
Antithrombin-III-Hamilton, Ala 382 to Thr: an antithrombin-III variant that acts as a substrate but not an inhibitor of alpha-thrombin and factor Xa
1991-05
[31]
논문
How serpins transport hormones and regulate their release
https://www.reposito[...]
2017-02
[32]
논문
A serpin in the cellulosome of the anaerobic fungus Piromyces sp. strain E2
https://zenodo.org/r[...]
2008-08
[33]
논문
Implications of the three-dimensional structure of alpha 1-antitrypsin for structure and function of serpins
1989-11
[34]
논문
The serpins are an expanding superfamily of structurally similar but functionally diverse proteins. Evolution, mechanism of inhibition, novel functions, and a revised nomenclature
2001-09
[35]
논문
Evolutionary families of peptidase inhibitors
2004-03
[36]
논문
Families and clans of serine peptidases
1995-04
[37]
논문
Evolutionary lines of cysteine peptidases
2001-05
[38]
논문
Evidence that serpin architecture intrinsically supports papain-like cysteine protease inhibition: engineering alpha(1)-antitrypsin to inhibit cathepsin proteases
2002-04
[39]
논문
The reactive site loop of the serpin SCCA1 is essential for cysteine proteinase inhibition
1998-11
[40]
논문
X-ray crystal structure of MENT: evidence for functional loop-sheet polymers in chromatin condensation
2006-07
[41]
논문
DNA accelerates the inhibition of human cathepsin V by serpins
2007-12
[42]
논문
The serpin PN1 is a feedback regulator of FGF signaling in germ layer and primary axis formation
2015-03
[43]
논문
Spatial regulation of developmental signaling by a serpin
2003-12
[44]
논문
Regulation of pro-apoptotic leucocyte granule serine proteinases by intracellular serpins
1999-02
[45]
논문
Selective regulation of apoptosis: the cytotoxic lymphocyte serpin proteinase inhibitor 9 protects against granzyme B-mediated apoptosis without perturbing the Fas cell death pathway
1998-11
[46]
논문
Viral inhibition of inflammation: cowpox virus encodes an inhibitor of the interleukin-1 beta converting enzyme
1992-05
[47]
논문
Serpin1 of Arabidopsis thaliana is a suicide inhibitor for metacaspase 9
2006-12
[48]
논문
Arabidopsis AtSerpin1, crystal structure and in vivo interaction with its target protease RESPONSIVE TO DESICCATION-21 (RD21)
2010-04
[49]
논문
Corticosteroid-binding globulin, a structural basis for steroid transport and proteinase-triggered release
2007-10
[50]
논문
Structure and properties of ovalbumin
2001-05
[51]
논문
Interactions of heat shock protein 47 with collagen and the stress response: an unconventional chaperone model?
2010-11
[52]
논문
MENT, a heterochromatin protein that mediates higher order chromatin folding, is a new serpin family member
1999-02
[53]
논문
Inhibitory conformation of the reactive loop of alpha 1-antitrypsin
1996-08
[54]
논문
The murine orthologue of human antichymotrypsin: a structural paradigm for clade A3 serpins
2005-12
[55]
논문
Conformational changes in serpins: I. The native and cleaved conformations of alpha(1)-antitrypsin
2000-02
[56]
논문
The anticoagulant activation of antithrombin by heparin
1997-12
[57]
논문
Conformational changes in serpins: II. The mechanism of activation of antithrombin by heparin
2000-09
[58]
논문
Structure of the antithrombin-thrombin-heparin ternary complex reveals the antithrombotic mechanism of heparin
2004-09
[59]
논문
Antithrombin-S195A factor Xa-heparin structure reveals the allosteric mechanism of antithrombin activation
2006-05
[60]
논문
Fondaparinux: a synthetic heparin pentasaccharide as a new antithrombotic agent
2002-03
[61]
논문
A synthetic antithrombin III binding pentasaccharide is now a drug! What comes next?
2004-06
[62]
논문
Stability of plasminogen activator inhibitor 1 (PAI-1)
1989-09
[63]
논문
Latent antithrombin and its detection, formation and turnover in the circulation
2004-12
[64]
논문
The N terminus of the serpin, tengpin, functions to trap the metastable native state
2007-07
[65]
논문
A structural basis for loop C-sheet polymerization in serpins
2008-03
[66]
논문
Structural mechanism for the carriage and release of thyroxine in the blood
2006-09
[67]
논문
Hormone binding globulins undergo serpin conformational change in inflammation
1988-11
[68]
논문
Endocytic receptor LRP together with tPA and PAI-1 coordinates Mac-1-dependent macrophage migration
2006-05
[69]
논문
Specificity of binding of the low density lipoprotein receptor-related protein to different conformational states of the clade E serpins plasminogen activator inhibitor-1 and proteinase nexin-1
2009-07
[70]
논문
Uptake of the necrotic serpin in Drosophila melanogaster via the lipophorin receptor-1
2009-06
[71]
논문
Mechanisms of serpin dysfunction in disease
2006-12
[72]
논문
Worldwide racial and ethnic distribution of alpha1-antitrypsin deficiency: summary of an analysis of published genetic epidemiologic surveys
2002-11
[73]
논문
Effects of mutations in the hinge region of serpins
1993-08
[74]
논문
Antithrombins Wibble and Wobble (T85M/K): archetypal conformational diseases with in vivo latent-transition, thrombosis, and heparin activation
1998-10
[75]
논문
Inactive conformation of the serpin alpha(1)-antichymotrypsin indicates two-stage insertion of the reactive loop: implications for inhibitory function and conformational disease
2000-01
[76]
논문
Human plasminogen activator inhibitor-1 (PAI-1) deficiency: characterization of a large kindred with a null mutation in the PAI-1 gene
1997-07
[77]
논문
The mechanism of Z alpha 1-antitrypsin accumulation in the liver
1992-06
[78]
논문
Conformational disease
1997-07
[79]
논문
Endoplasmic reticulum-associated degradation (ERAD) and autophagy cooperate to degrade polymerogenic mutant serpins
2009-08
[80]
논문
Crystal structure of a stable dimer reveals the molecular basis of serpin polymerization
2008-10
[81]
논문
The structural diversity in α1-antitrypsin misfolding
2011-09
[82]
논문
Molecular basis of α1-antitrypsin deficiency revealed by the structure of a domain-swapped trimer
2011-09
[83]
논문
Importance of the release of strand 1C to the polymerization mechanism of inhibitory serpins
1997-01
[84]
논문
A novel monoclonal antibody to characterize pathogenic polymers in liver disease associated with alpha1-antitrypsin deficiency
2010-09
[85]
논문
alpha1-Antitrypsin deficiency . 6: new and emerging treatments for alpha1-antitrypsin deficiency
2004-10
[86]
논문
Expanding the clinical indications for α(1)-antitrypsin therapy
2012-09
[87]
논문
Hereditary alpha-1-antitrypsin deficiency and its clinical consequences
2008-06
[88]
논문
Targeted gene correction of α1-antitrypsin deficiency in induced pluripotent stem cells
2011-10
[89]
논문
Small molecules block the polymerization of Z alpha1-antitrypsin and increase the clearance of intracellular aggregates
2007-11
[90]
논문
Automated high-content live animal drug screening using C. elegans expressing the aggregation prone serpin α1-antitrypsin Z
2010-11
[91]
논문
Serpins in prokaryotes
2002-11
[92]
논문
Aeropin from the extremophile Pyrobaculum aerophilum bypasses the serpin misfolding trap
2007-09
[93]
논문
Serpin protease inhibitors in plant biology
2012-05
[94]
논문
Phylogeny of the serpin superfamily: implications of patterns of amino acid conservation for structure and function
2000-12
[95]
논문
An overview of the serpin superfamily
2006
[96]
논문
Update of the human and mouse SERPIN gene superfamily
2013-10
[97]
논문
Alpha1-antitrypsin deficiency
2005
[98]
논문
Discovery and optimization of a natural HIV-1 entry inhibitor targeting the gp41 fusion peptide
2007-04
[99]
논문
The molecular and cellular pathology of α₁-antitrypsin deficiency
2014-02
[100]
논문
Sequence diversity at the proximal 14q32.1 SERPIN subcluster: evidence for natural selection favoring the pseudogenization of SERPINA2
2007-02
[101]
논문
Alpha 1-antichymotrypsin
1996-09
[102]
논문
Nuclear α1-antichymotrypsin promotes chromatin condensation and inhibits proliferation of human hepatocellular carcinoma cells
2013-04
[103]
논문
Multi-functional capability of proteins: alpha1-antichymotrypsin and the correlation with Alzheimer's disease
2002-04
[104]
논문
Kallistatin is a potent new vasodilator
1997-07
[105]
논문
Kallistatin is a new inhibitor of angiogenesis and tumor growth
2002-11
[106]
논문
Depletion of endogenous kallistatin exacerbates renal and cardiovascular oxidative stress, inflammation, and organ remodeling
2012-10
[107]
논문
Protein C inhibitor, a serpin with functions in- and outside vascular biology
2007-03
[108]
논문
Phosphatidylethanolamine critically supports internalization of cell-penetrating protein C inhibitor
2007-11
[109]
논문
Disruption of the protein C inhibitor gene results in impaired spermatogenesis and male infertility
2000-12
[110]
논문
Proteomic analysis of active multiple sclerosis lesions reveals therapeutic targets
2008-02
[111]
논문
Corticosteroid-binding globulin gene polymorphisms: clinical implications and links to idiopathic chronic fatigue disorders
2007-08
[112]
논문
Variations in thyroid hormone transport proteins and their clinical implications
[113]
논문
Clinical review: Central hypothyroidism: pathogenic, diagnostic, and therapeutic challenges
2012-09
[114]
논문
The intracellular renin-angiotensin system: a new paradigm
2007-07
[115]
논문
Angiotensinogen-deficient mice with hypotension
1994-12
[116]
논문
Angiotensinogen variants and human hypertension
[117]
논문
Angiotensinogen gene polymorphism, plasma angiotensinogen, and risk of hypertension and ischemic heart disease: a meta-analysis
2003-07
[118]
논문
Genetic basis of hypertension: revisiting angiotensinogen
2006-07
[119]
논문
Identification of centerin: a novel human germinal center B cell-restricted serpin
2000-10
[120]
논문
Molecular characterization of centerin, a germinal centre cell serpin
2007-08
[121]
논문
Expression of the serpin centerin defines a germinal center phenotype in B-cell lymphomas
2008-07
[122]
논문
An emerging role for Serine Protease Inhibitors in T lymphocyte immunity and beyond
2013-04
[123]
논문
Characterization of the protein Z-dependent protease inhibitor
2000-11
[124]
논문
Visceral adipose tissue-derived serine protease inhibitor: a unique insulin-sensitizing adipocytokine in obesity
2005-07
[125]
논문
Higher vaspin levels in subjects with obesity and type 2 diabetes mellitus: a meta-analysis
2014-10
[126]
논문
Sequence and molecular characterization of human monocyte/neutrophil elastase inhibitor
1992-06
[127]
논문
The neutrophil serine protease inhibitor serpinb1 preserves lung defense functions in Pseudomonas aeruginosa infection
2007-08
[128]
논문
The serine proteinase inhibitor (serpin) plasminogen activation inhibitor type 2 protects against viral cytopathic effects by constitutive interferon alpha/beta priming
1998-06
[129]
논문
SerpinB2 is critical to Th2 immunity against enteric nematode infection
2013-06
[130]
논문
The plasminogen activator inhibitor-2 gene is not required for normal murine development or survival
1999-01
[131]
논문
Squamous cell carcinoma antigen is a potent inhibitor of cysteine proteinase cathepsin L
1995-02
[132]
논문
SERPINB3 (serpin peptidase inhibitor, clade B (ovalbumin), member 3)
2015-03
[133]
논문
Squamous cell carcinoma antigen 2 is a novel serpin that inhibits the chymotrypsin-like proteinases cathepsin G and mast cell chymase
1997-01
[134]
논문
A nonredundant role for mouse Serpinb3a in the induction of mucus production in asthma
2011-01
[135]
논문
Maspin (SERPINB5) is an obligate intracellular serpin
2010-04
[136]
논문
Maspin, a serpin with tumor-suppressing activity in human mammary epithelial cells
1994-01
[137]
논문
Maspin is not required for embryonic development or tumour suppression
[138]
논문
Maspin plays an essential role in early embryonic development
2004-04
[139]
논문
The intracellular serpin proteinase inhibitor 6 is expressed in monocytes and granulocytes and is a potent inhibitor of the azurophilic granule protease, cathepsin G
1999-03
[140]
논문
Absence of SERPINB6A causes sensorineural hearing loss with multiple histopathologies in the mouse inner ear
2013-07
[141]
논문
Targeted disruption of SPI3/Serpinb6 does not result in developmental or growth defects, leukocyte dysfunction, or susceptibility to stroke
2004-05
[142]
논문
A truncating mutation in SERPINB6 is associated with autosomal-recessive nonsyndromic sensorineural hearing loss
2010-05
[143]
논문
Overexpression of the serpin megsin induces progressive mesangial cell proliferation and expansion
2002-03
[144]
논문
Megsin gene: its genomic analysis, pathobiological functions, and therapeutic perspectives
2007-05
[145]
논문
Nagashima-type palmoplantar keratosis: a common Asian type caused by SERPINB7 protease inhibitor deficiency
2014-08
[146]
논문
Inhibition of soluble recombinant furin by human proteinase inhibitor 8
1998-01
[147]
논문
A cytosolic granzyme B inhibitor related to the viral apoptotic regulator cytokine response modifier A is present in cytotoxic lymphocytes
1996-11
[148]
논문
Serine protease inhibitor 6 protects cytotoxic T cells from self-inflicted injury by ensuring the integrity of cytotoxic granules
2006-04
[149]
논문
Serpinb9 (Spi6)-deficient mice are impaired in dendritic cell-mediated antigen cross-presentation
2012-10
[150]
논문
Expression of bomapin, a novel human serpin, in normal/malignant hematopoiesis and in the monocytic cell lines THP-1 and AML-193
1998-02
[151]
논문
SERPINB11 is a new noninhibitory intracellular serpin. Common single nucleotide polymorphisms in the scaffold impair conformational change
2007-08
[152]
논문
SERPINB11 frameshift variant associated with novel hoof specific phenotype in Connemara ponies
2015-04
[153]
논문
SERPINB12 is a novel member of the human ov-serpin family that is widely expressed and inhibits trypsin-like serine proteinases
2001-12
[154]
논문
Hurpin is a selective inhibitor of lysosomal cathepsin L and protects keratinocytes from ultraviolet-induced apoptosis
2003-06
[155]
논문
Shape-shifting serpins--advantages of a mobile mechanism
2006-08
[156]
논문
Complete antithrombin deficiency in mice results in embryonic lethality
2000-10
[157]
논문
Inherited antithrombin deficiency: a review
2008-11
[158]
논문
Serpin structure, function and dysfunction
2011-07
[159]
논문
Antithrombotic activity of dermatan sulfate in heparin cofactor II-deficient mice
2004-12
[160]
논문
Strain-dependent embryonic lethality and exaggerated vascular remodeling in heparin cofactor II-deficient mice
2007-06
[161]
논문
Structure-function relationships of plasminogen activator inhibitor-1 and its potential as a therapeutic agent
2007-09
[162]
논문
Mice lacking protease nexin-1 show delayed structural and functional recovery after sciatic nerve crush
2007-04
[163]
논문
Male fertility defects in mice lacking the serine protease inhibitor protease nexin-1
2001-03
[164]
논문
Endogenous serine protease inhibitor modulates epileptic activity and hippocampal long-term potentiation
1997-06
[165]
논문
Pigment epithelium-derived factor regulates the vasculature and mass of the prostate and pancreas
2003-06
[166]
논문
Pigment epithelium-derived factor binds to hyaluronan. Mapping of a hyaluronan binding site
2008-11
[167]
논문
Vascular niche factor PEDF modulates Notch-dependent stemness in the adult subependymal zone
2009-12
[168]
논문
Mutations in SERPINF1 cause osteogenesis imperfecta type VI
2011-12
[169]
논문
On the mechanism of the reaction between human alpha 2-antiplasmin and plasmin
1979-09
[170]
논문
Alpha2-antiplasmin gene deficiency in mice is associated with enhanced fibrinolytic potential without overt bleeding
1999-04
[171]
논문
Alpha2-antiplasmin and its deficiency: fibrinolysis out of balance
2008-11
[172]
논문
Congenital alpha(2)-plasmin inhibitor deficiencies: a review
2001-07
[173]
논문
C1 inhibitor serpin domain structure reveals the likely mechanism of heparin potentiation and conformational disease
2007-07
[174]
논문
Complement analysis in the 21st century
2007-09
[175]
논문
The autoimmune side of hereditary angioedema: insights on the pathogenesis
2015-08
[176]
논문
Embryonic lethality of molecular chaperone hsp47 knockout mice is associated with defects in collagen biosynthesis
2000-09
[177]
논문
Osteogenesis imperfecta due to mutations in non-collagenous genes: lessons in the biology of bone formation
2014-08
[178]
논문
Recessively inherited forms of osteogenesis imperfecta
2012-01-01
[179]
논문
The axonally secreted serine proteinase inhibitor, neuroserpin, inhibits plasminogen activators and plasmin but not thrombin
1998-01
[180]
논문
Familial conformational diseases and dementias
2002-07
[181]
논문
Protein misfolding and the serpinopathies
2007-03-01
[182]
논문
Isolation and characterization of a novel human pancreas-specific gene, pancpin, that is down-regulated in pancreatic cancer cells
1998-07
[183]
논문
Acinar cell apoptosis in Serpini2-deficient mice models pancreatic insufficiency
2005-09
[184]
논문
The molecular phylogeny of uterine serpins and its relationship to evolution of placentation
2010-02
[185]
논문
Evolution and function of the uterine serpins (SERPINA14)
2010-10
[186]
논문
Tip of another iceberg: Drosophila serpins
2005-12
[187]
논문
A serpin that regulates immune melanization in the respiratory system of Drosophila
2008-10
[188]
논문
Drosophila Serpin-28D regulates hemolymph phenoloxidase activity and adult pigmentation
2008-11
[189]
논문
Dorsoventral patterning: a serpin pinned down at last
2004-01
[190]
논문
A serpin regulates dorsal-ventral axis formation in the Drosophila embryo
2003-12
[191]
논문
93-kDa twin-domain serine protease inhibitor (Serpin) has a regulatory function on the beetle Toll proteolytic signaling cascade
2011-10
[192]
논문
SRP-2 is a cross-class inhibitor that participates in postembryonic development of the nematode Caenorhabditis elegans: initial characterization of the clade L serpins
2004-04
[193]
논문
An intracellular serpin regulates necrosis by inhibiting the induction and sequelae of lysosomal injury
2007-09
[194]
논문
Sequence homology between barley endosperm protein Z and protease inhibitors of the alpha-1-antitrypsin family
1985
[195]
논문
Inhibition of coagulation factors by recombinant barley serpin BSZx
1996-09
[196]
논문
Inhibitory serpins from rye grain with glutamine as P1 and P2 residues in the reactive center
2001-01
[197]
논문
Inhibitory serpins from wheat grain with reactive centers resembling glutamine-rich repeats of prolamin storage proteins. Cloning and characterization of five major molecular forms
2000-10
[198]
논문
Characterization of cucurbita maxima phloem serpin-1 (CmPS-1). A developmentally regulated elastase inhibitor
2000-11
[199]
논문
Cucurbit phloem serpins are graft-transmissible and appear to be resistant to turnover in the sieve element-companion cell complex
2005-12
[200]
논문
Serpins in plants and green algae
2008-02
[201]
논문
Set-point control of RD21 protease activity by AtSerpin1 controls cell death in Arabidopsis
2013-05
[202]
논문
Serpin genes AtSRP2 and AtSRP3 are required for normal growth sensitivity to a DNA alkylating agent in Arabidopsis
2009-05
[203]
논문
The 1.5 A crystal structure of a prokaryote serpin: controlling conformational change in a heated environment
2003-04
[204]
논문
The high resolution crystal structure of a native thermostable serpin reveals the complex mechanism underpinning the stressed to relaxed transition
2005-03
[205]
논문
The functional repertoire of prokaryote cellulosomes includes the serpin superfamily of serine proteinase inhibitors
2006-06
[206]
논문
Poxvirus immune modulators: functional insights from animal models
2002-09
[207]
논문
Serpins, the vasculature, and viral therapeutics
2006-01
[208]
논문
Induction of indefinite cardiac allograft survival correlates with toll-like receptor 2 and 4 downregulation after serine protease inhibitor-1 (Serp-1) treatment
2007-11
[209]
논문
Serp-1, a viral anti-inflammatory serpin, regulates cellular serine proteinase and serpin responses to vascular injury
2003-05
[210]
논문
Myxoma virus Serp2 is a weak inhibitor of granzyme B and interleukin-1beta-converting enzyme in vitro and unlike CrmA cannot block apoptosis in cowpox virus-infected cells
1999-08
[211]
논문
Viral anti-inflammatory reagents: the potential for treatment of arthritic and vasculitic disorders
2006-12
[212]
논문
Crystal structure of the apoptotic suppressor CrmA in its cleaved form
2000-07
[213]
논문
Serpins flex their muscle: I. Putting the clamps on proteolysis in diverse biological systems
2010-08
[214]
논문
Serpins flex their muscle: II. Structural insights into target peptidase recognition, polymerization, and transport functions
2010-08
[215]
논문
Serpin structure, mechanism, and function
2002-12
[216]
논문
What do dysfunctional serpins tell us about molecular mobility and disease?
1995-02
[217]
논문
The discovery of α1-antitrypsin and its role in health and disease
2011-08
[218]
논문
Untersuchungen uber die enzyme, Vergleichende Studie
1984
[219]
논문
Zur Kenntnis der alpha-globulin des menschlichen normal serums
1955
[220]
논문
The electrophoretic α1-globulin pattern of serum in α1-antitrypsin deficiency. 1963
[221]
논문
Worldwide Racial and Ethnic Distribution of α-Antitrypsin Deficiency
2002-11-01
[222]
논문
Inherited antithrombin deficiency causing thrombophilia
1965-06
[223]
논문
Inherited antithrombin deficiency: a review
2008-11
[224]
논문
A surprising new protein superfamily containing ovalbumin, antithrombin-III, and alpha 1-proteinase inhibitor
1980-07
[225]
논문
Human alpha 1-proteinase inhibitor. Crystal structure analysis of two crystal modifications, molecular model and preliminary analysis of the implications for function
1984-08
[226]
논문
Crystal structure of ovalbumin as a model for the reactive centre of serpins
1990-09
[227]
논문
Molecular gymnastics: serpin structure, folding and misfolding
2006-12
[228]
논문
A serpin in the cellulosome of the anaerobic fungus Piromyces sp. strain E2
2008-08
[229]
논문
The serpins are an expanding superfamily of structurally similar but functionally diverse proteins. Evolution, mechanism of inhibition, novel functions, and a revised nomenclature
2001-09
[230]
논문
Evolutionary families of peptidase inhibitors
2004-03
[231]
논문
Families and clans of serine peptidases
1995-04
[232]
논문
Structure of a serpin-protease complex shows inhibition by deformation
2000-10
[233]
논문
Evolutionary lines of cysteine peptidases
2001-05
[234]
논문
Evidence that serpin architecture intrinsically supports papain-like cysteine protease inhibition: engineering alpha(1)-antitrypsin to inhibit cathepsin proteases
2002-04
[235]
논문
The reactive site loop of the serpin SCCA1 is essential for cysteine proteinase inhibition
1998-11
[236]
논문
X-ray crystal structure of MENT: evidence for functional loop-sheet polymers in chromatin condensation
2006-07
[237]
논문
DNA accelerates the inhibition of human cathepsin V by serpins
2007-12
[238]
논문
The serpin PN1 is a feedback regulator of FGF signaling in germ layer and primary axis formation
2015-03
[239]
논문
Spatial regulation of developmental signaling by a serpin
2003-12
[240]
논문
Regulation of pro-apoptotic leucocyte granule serine proteinases by intracellular serpins
1999-02
[241]
논문
Selective regulation of apoptosis: the cytotoxic lymphocyte serpin proteinase inhibitor 9 protects against granzyme B-mediated apoptosis without perturbing the Fas cell death pathway
1998-11
[242]
논문
Viral inhibition of inflammation: cowpox virus encodes an inhibitor of the interleukin-1 beta converting enzyme
1992-05
[243]
논문
Serpin1 of Arabidopsis thaliana is a suicide inhibitor for metacaspase 9
2006-12
[244]
논문
Arabidopsis AtSerpin1, crystal structure and in vivo interaction with its target protease responsive to desiccation (RD21)
2010-04
[245]
논문
Corticosteroid-binding globulin, a structural basis for steroid transport and proteinase-triggered release
2007-10
[246]
논문
Structure and properties of ovalbumin
2001-05
[247]
논문
Interactions of heat shock protein 47 with collagen and the stress response: an unconventional chaperone model?
2010-11
[248]
논문
MENT, a heterochromatin protein that mediates higher order chromatin folding, is a new serpin family member
1999-02
[249]
논문
Inhibitory conformation of the reactive loop of alpha 1-antitrypsin
1996-08
[250]
논문
The murine orthologue of human antichymotrypsin: a structural paradigm for clade A3 serpins
2005-12
[251]
논문
Conformational changes in serpins: I. The native and cleaved conformations of alpha(1)-antitrypsin
2000-02
[252]
논문
セリンプロテアーゼとそのインヒビター--活性化,触媒機構ならびにその制御機構 (第1土曜特集 プロテアーゼとそのインヒビター--最新の知見) -- (おもなプロテアーゼとそのインヒビター--活性化ならびにその制御機構)
[253]
논문
The anticoagulant activation of antithrombin by heparin
1997-12
[254]
논문
Conformational changes in serpins: II. The mechanism of activation of antithrombin by heparin
2000-09
[255]
논문
Structure of the antithrombin-thrombin-heparin ternary complex reveals the antithrombotic mechanism of heparin
2004-09
[256]
논문
Antithrombin-S195A factor Xa-heparin structure reveals the allosteric mechanism of antithrombin activation
2006-05
[257]
논문
アンチトロンビンのプロテアーゼ阻害機構とヘパリンの作用機構 立体構造で見る動的構造変化
[258]
논문
Fondaparinux: a synthetic heparin pentasaccharide as a new antithrombotic agent
2002-03
[259]
논문
A synthetic antithrombin III binding pentasaccharide is now a drug! What comes next?
2004-06
[260]
논문
Stability of plasminogen activator inhibitor 1 (PAI-1)
1989-09
[261]
논문
Latent antithrombin and its detection, formation and turnover in the circulation
2004-12
[262]
논문
The N terminus of the serpin, tengpin, functions to trap the metastable native state
2007-07
[263]
논문
A structural basis for loop C-sheet polymerization in serpins
2008-03
[264]
논문
Structural mechanism for the carriage and release of thyroxine in the blood
2006-09
[265]
논문
Hormone binding globulins undergo serpin conformational change in inflammation
1988-11
[266]
논문
Endocytic receptor LRP together with tPA and PAI-1 coordinates Mac-1-dependent macrophage migration
2006-05
[267]
논문
Specificity of binding of the low density lipoprotein receptor-related protein to different conformational states of the clade E serpins plasminogen activator inhibitor-1 and proteinase nexin-1
2009-07
[268]
논문
Uptake of the necrotic serpin in Drosophila melanogaster via the lipophorin receptor-1
2009-06
[269]
논문
Mechanisms of serpin dysfunction in disease
2006-01-01
[270]
논문
Effects of mutations in the hinge region of serpins
1993-08
[271]
논문
Antithrombins Wibble and Wobble (T85M/K): archetypal conformational diseases with in vivo latent-transition, thrombosis, and heparin activation
1998-10
[272]
논문
Inactive conformation of the serpin alpha(1)-antichymotrypsin indicates two-stage insertion of the reactive loop: implications for inhibitory function and conformational disease
2000-01
[273]
논문
Human plasminogen activator inhibitor-1 (PAI-1) deficiency: characterization of a large kindred with a null mutation in the PAI-1 gene
1997-07
[274]
논문
Mutation of antitrypsin to antithrombin. alpha 1-antitrypsin Pittsburgh (358 Met leads to Arg), a fatal bleeding disorder
1983-09
[275]
논문
The mechanism of Z alpha 1-antitrypsin accumulation in the liver
1992-06
[276]
논문
セルピノパシー : セルピンのポリマー化により発症するコンフォメーション病 : ニューロセルピン封入体形成による若年性痴呆症
[277]
논문
Conformational disease
1997-07
[278]
논문
Endoplasmic reticulum-associated degradation (ERAD) and autophagy cooperate to degrade polymerogenic mutant serpins
2009-08
[279]
논문
Crystal structure of a stable dimer reveals the molecular basis of serpin polymerization
2008-10
[280]
논문
The structural diversity in α1-antitrypsin misfolding
2011-10
[281]
논문
Molecular basis of α1-antitrypsin deficiency revealed by the structure of a domain-swapped trimer
2011-10
[282]
논문
Importance of the release of strand 1C to the polymerization mechanism of inhibitory serpins
1997-01
[283]
논문
A novel monoclonal antibody to characterize pathogenic polymers in liver disease associated with alpha1-antitrypsin deficiency
2010-09
[284]
논문
alpha1-Antitrypsin deficiency . 6: new and emerging treatments for alpha1-antitrypsin deficiency
2004-10
[285]
논문
Expanding the clinical indications for α(1)-antitrypsin therapy
http://www.molmed.or[...]
[286]
논문
Hereditary alpha-1-antitrypsin deficiency and its clinical consequences
[287]
논문
Targeted gene correction of α1-antitrypsin deficiency in induced pluripotent stem cells
2011-10
[288]
논문
Small molecules block the polymerization of Z alpha1-antitrypsin and increase the clearance of intracellular aggregates
2007-11
[289]
논문
Automated high-content live animal drug screening using C. elegans expressing the aggregation prone serpin α1-antitrypsin Z
[290]
논문
Serpins in prokaryotes
2002-11
[291]
논문
Aeropin from the extremophile Pyrobaculum aerophilum bypasses the serpin misfolding trap
2007-09
[292]
논문
Serpin protease inhibitors in plant biology
2012-05
[293]
논문
Phylogeny of the serpin superfamily: implications of patterns of amino acid conservation for structure and function
2000-12
[294]
논문
An overview of the serpin superfamily
[295]
논문
Update of the human and mouse SERPIN gene superfamily
2013-10-30
[296]
논문
Alpha1-antitrypsin deficiency
[297]
논문
Discovery and optimization of a natural HIV-1 entry inhibitor targeting the gp41 fusion peptide
2007-04
[298]
논문
The molecular and cellular pathology of α₁-antitrypsin deficiency
2014-02
[299]
논문
Sequence diversity at the proximal 14q32.1 SERPIN subcluster: evidence for natural selection favoring the pseudogenization of SERPINA2
2007-02
[300]
논문
Alpha 1-antichymotrypsin
1996-09
[301]
논문
Nuclear α1-antichymotrypsin promotes chromatin condensation and inhibits proliferation of human hepatocellular carcinoma cells
2013-04
[302]
논문
Multi-functional capability of proteins: alpha1-antichymotrypsin and the correlation with Alzheimer's disease
2002-04
[303]
논문
Kallistatin is a potent new vasodilator
1997-07
[304]
논문
Kallistatin is a new inhibitor of angiogenesis and tumor growth
2002-11
[305]
논문
Depletion of endogenous kallistatin exacerbates renal and cardiovascular oxidative stress, inflammation, and organ remodeling
2012-10
[306]
논문
Protein C inhibitor, a serpin with functions in- and outside vascular biology
2007-03
[307]
논문
Phosphatidylethanolamine critically supports internalization of cell-penetrating protein C inhibitor
2007-11
[308]
논문
Disruption of the protein C inhibitor gene results in impaired spermatogenesis and male infertility
2000-12
[309]
논문
Proteomic analysis of active multiple sclerosis lesions reveals therapeutic targets
2008-02
[310]
논문
Corticosteroid-binding globulin gene polymorphisms: clinical implications and links to idiopathic chronic fatigue disorders
2007-08
[311]
논문
Variations in thyroid hormone transport proteins and their clinical implications
[312]
논문
Clinical review: Central hypothyroidism: pathogenic, diagnostic, and therapeutic challenges
2012-09
[313]
논문
The intracellular renin-angiotensin system: a new paradigm
2007-07
[314]
논문
Angiotensinogen-deficient mice with hypotension
1994-12
[315]
논문
Angiotensinogen variants and human hypertension
[316]
논문
Angiotensinogen gene polymorphism, plasma angiotensinogen, and risk of hypertension and ischemic heart disease: a meta-analysis
2003-07
[317]
논문
Genetic basis of hypertension: revisiting angiotensinogen
2006-07
[318]
논문
Identification of centerin: a novel human germinal center B cell-restricted serpin
2000-10
[319]
논문
Molecular characterization of centerin, a germinal centre cell serpin
2007-08
[320]
논문
Expression of the serpin centerin defines a germinal center phenotype in B-cell lymphomas
2008-07
[321]
논문
An emerging role for Serine Protease Inhibitors in T lymphocyte immunity and beyond
2013-04
[322]
논문
Characterization of the protein Z-dependent protease inhibitor
2000-11
[323]
논문
Visceral adipose tissue-derived serine protease inhibitor: a unique insulin-sensitizing adipocytokine in obesity
2005-07
[324]
논문
Higher vaspin levels in subjects with obesity and type 2 diabetes mellitus: a meta-analysis
2014-10
[325]
논문
Sequence and molecular characterization of human monocyte/neutrophil elastase inhibitor
1992-06
[326]
논문
The neutrophil serine protease inhibitor serpinb1 preserves lung defense functions in Pseudomonas aeruginosa infection
2007-08
[327]
논문
The serine proteinase inhibitor (serpin) plasminogen activation inhibitor type 2 protects against viral cytopathic effects by constitutive interferon alpha/beta priming
1998-06
[328]
논문
SerpinB2 is critical to Th2 immunity against enteric nematode infection
2013-06
[329]
논문
The plasminogen activator inhibitor-2 gene is not required for normal murine development or survival
1999-01
[330]
논문
Squamous cell carcinoma antigen is a potent inhibitor of cysteine proteinase cathepsin L
1995-02
[331]
논문
SERPINB3 (serpin peptidase inhibitor, clade B (ovalbumin), member 3)
2015-03
[332]
논문
Squamous cell carcinoma antigen 2 is a novel serpin that inhibits the chymotrypsin-like proteinases cathepsin G and mast cell chymase
1997-01
[333]
논문
A nonredundant role for mouse Serpinb3a in the induction of mucus production in asthma
2011-01
[334]
논문
Maspin (SERPINB5) is an obligate intracellular serpin
2010-04
[335]
논문
Maspin, a serpin with tumor-suppressing activity in human mammary epithelial cells
1994-01
[336]
논문
Maspin is not required for embryonic development or tumour suppression
null
[337]
논문
Maspin plays an essential role in early embryonic development
2004-04
[338]
논문
The intracellular serpin proteinase inhibitor 6 is expressed in monocytes and granulocytes and is a potent inhibitor of the azurophilic granule protease, cathepsin G
1999-03
[339]
논문
Absence of SERPINB6A causes sensorineural hearing loss with multiple histopathologies in the mouse inner ear
2013-07
[340]
논문
Targeted disruption of SPI3/Serpinb6 does not result in developmental or growth defects, leukocyte dysfunction, or susceptibility to stroke
2004-05
[341]
서적
Genetics of Nonsyndromic Recessively Inherited Moderate to Severe and Progressive Deafness in Humans
http://cdn.intechope[...]
InTech
[342]
논문
Overexpression of the serpin megsin induces progressive mesangial cell proliferation and expansion
2002-03
[343]
논문
Megsin gene: its genomic analysis, pathobiological functions, and therapeutic perspectives
2007-05
[344]
논문
Nagashima-type palmoplantar keratosis: a common Asian type caused by SERPINB7 protease inhibitor deficiency
2014-08
[345]
논문
Inhibition of soluble recombinant furin by human proteinase inhibitor 8
1998-01
[346]
논문
A cytosolic granzyme B inhibitor related to the viral apoptotic regulator cytokine response modifier A is present in cytotoxic lymphocytes
1996-11
[347]
논문
Serine protease inhibitor 6 protects cytotoxic T cells from self-inflicted injury by ensuring the integrity of cytotoxic granules
2006-04
[348]
논문
Serpinb9 (Spi6)-deficient mice are impaired in dendritic cell-mediated antigen cross-presentation
2012-10
[349]
논문
Expression of bomapin, a novel human serpin, in normal/malignant hematopoiesis and in the monocytic cell lines THP-1 and AML-193
http://bloodjournal.[...]
1998-02
[350]
논문
SERPINB11 is a new noninhibitory intracellular serpin. Common single nucleotide polymorphisms in the scaffold impair conformational change
2007-08
[351]
논문
SERPINB11 frameshift variant associated with novel hoof specific phenotype in Connemara ponies
2015-04-01
[352]
논문
SERPINB12 is a novel member of the human ov-serpin family that is widely expressed and inhibits trypsin-like serine proteinases
2001-12-01
[353]
논문
Hurpin is a selective inhibitor of lysosomal cathepsin L and protects keratinocytes from ultraviolet-induced apoptosis
2003-06-01
[354]
논문
Shape-shifting serpins--advantages of a mobile mechanism
2006-08-01
[355]
논문
Complete antithrombin deficiency in mice results in embryonic lethality
2000-10-01
[356]
논문
Serpin structure, function and dysfunction
2011-07-01
[357]
논문
Antithrombotic activity of dermatan sulfate in heparin cofactor II-deficient mice
2004-12-01
[358]
논문
Strain-dependent embryonic lethality and exaggerated vascular remodeling in heparin cofactor II-deficient mice
2007-06-01
[359]
논문
Structure-function relationships of plasminogen activator inhibitor-1 and its potential as a therapeutic agent
2007-09-01
[360]
논문
Mice lacking protease nexin-1 show delayed structural and functional recovery after sciatic nerve crush
2007-04-01
[361]
논문
Male fertility defects in mice lacking the serine protease inhibitor protease nexin-1
2001-03-01
[362]
논문
Endogenous serine protease inhibitor modulates epileptic activity and hippocampal long-term potentiation
1997-06-01
[363]
논문
Pigment epithelium-derived factor regulates the vasculature and mass of the prostate and pancreas
2003-06-01
[364]
논문
Pigment epithelium-derived factor binds to hyaluronan. Mapping of a hyaluronan binding site
2008-11-01
[365]
논문
Vascular niche factor PEDF modulates Notch-dependent stemness in the adult subependymal zone
2009-12-01
[366]
논문
Mutations in SERPINF1 cause osteogenesis imperfecta type VI
2011-12-01
[367]
논문
On the mechanism of the reaction between human alpha 2-antiplasmin and plasmin
1979-09-01
[368]
논문
Alpha2-antiplasmin gene deficiency in mice is associated with enhanced fibrinolytic potential without overt bleeding
1999-04-01
[369]
논문
Alpha2-antiplasmin and its deficiency: fibrinolysis out of balance
2008-11-01
[370]
논문
Congenital α2-plasmin inhibitor deficiencies: a review
2001-07-01
[371]
논문
C1 inhibitor serpin domain structure reveals the likely mechanism of heparin potentiation and conformational disease
2007-07-01
[372]
논문
Complement analysis in the 21st century
2007-09-01
[373]
논문
The autoimmune side of hereditary angioedema: insights on the pathogenesis
2015-08-01
[374]
논문
Embryonic lethality of molecular chaperone hsp47 knockout mice is associated with defects in collagen biosynthesis
2000-09-01
[375]
논문
Osteogenesis imperfecta due to mutations in non-collagenous genes: lessons in the biology of bone formation
2014-08-01
[376]
논문
Recessively inherited forms of osteogenesis imperfecta
2012-01-01
[377]
논문
The axonally secreted serine proteinase inhibitor, neuroserpin, inhibits plasminogen activators and plasmin but not thrombin
1998-01-01
[378]
논문
Familial conformational diseases and dementias
2002-07-01
[379]
논문
Protein misfolding and the serpinopathies
2007-03-01
[380]
논문
Isolation and characterization of a novel human pancreas-specific gene, pancpin, that is down-regulated in pancreatic cancer cells
1998-07-01
[381]
논문
Acinar cell apoptosis in Serpini2-deficient mice models pancreatic insufficiency
2005-09-01
[382]
논문
The molecular phylogeny of uterine serpins and its relationship to evolution of placentation
2010-02-01
[383]
논문
Evolution and function of the uterine serpins (SERPINA14)
2010-10-01
[384]
논문
Tip of another iceberg: Drosophila serpins
2005-12-01
[385]
논문
A serpin that regulates immune melanization in the respiratory system of Drosophila
2008-10-01
[386]
논문
Drosophila Serpin-28D regulates hemolymph phenoloxidase activity and adult pigmentation
2008-11
[387]
논문
Dorsoventral patterning: a serpin pinned down at last
2004-01
[388]
논문
A serpin regulates dorsal-ventral axis formation in the Drosophila embryo
2003-12
[389]
논문
93-kDa twin-domain serine protease inhibitor (Serpin) has a regulatory function on the beetle Toll proteolytic signaling cascade
2011-10
[390]
논문
SRP-2 is a cross-class inhibitor that participates in postembryonic development of the nematode Caenorhabditis elegans: initial characterization of the clade L serpins
2004-04
[391]
논문
An intracellular serpin regulates necrosis by inhibiting the induction and sequelae of lysosomal injury
2007-09
[392]
논문
Inhibition of coagulation factors by recombinant barley serpin BSZx
1996-09
[393]
논문
Inhibitory serpins from rye grain with glutamine as P1 and P2 residues in the reactive center
2001-01
[394]
논문
Inhibitory serpins from wheat grain with reactive centers resembling glutamine-rich repeats of prolamin storage proteins. Cloning and characterization of five major molecular forms
2000-10
[395]
논문
Characterization of cucurbita maxima phloem serpin-1 (CmPS-1). A developmentally regulated elastase inhibitor
2000-11
[396]
논문
Cucurbit phloem serpins are graft-transmissible and appear to be resistant to turnover in the sieve element-companion cell complex
2005-12
[397]
논문
Serpins in plants and green algae
2008-02
[398]
논문
Set-point control of RD21 protease activity by AtSerpin1 controls cell death in Arabidopsis
2013-05
[399]
논문
Serpin genes AtSRP2 and AtSRP3 are required for normal growth sensitivity to a DNA alkylating agent in Arabidopsis
[400]
논문
The 1.5 A crystal structure of a prokaryote serpin: controlling conformational change in a heated environment
2003-04
[401]
논문
The high resolution crystal structure of a native thermostable serpin reveals the complex mechanism underpinning the stressed to relaxed transition
2005-03
[402]
논문
The functional repertoire of prokaryote cellulosomes includes the serpin superfamily of serine proteinase inhibitors
2006-06
[403]
논문
Poxvirus immune modulators: functional insights from animal models
2002-09
[404]
논문
Serpins, the vasculature, and viral therapeutics
[405]
논문
Induction of indefinite cardiac allograft survival correlates with toll-like receptor 2 and 4 downregulation after serine protease inhibitor-1 (Serp-1) treatment
2007-11
[406]
논문
Serp-1, a viral anti-inflammatory serpin, regulates cellular serine proteinase and serpin responses to vascular injury
2003-05
[407]
논문
Myxoma virus Serp2 is a weak inhibitor of granzyme B and interleukin-1beta-converting enzyme in vitro and unlike CrmA cannot block apoptosis in cowpox virus-infected cells
1999-08
[408]
논문
Viral anti-inflammatory reagents: the potential for treatment of arthritic and vasculitic disorders
2006-12
[409]
논문
Crystal structure of the apoptotic suppressor CrmA in its cleaved form
2000-07
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com