유비퀴틴
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
유비퀴틴은 모든 진핵생물 세포에 존재하는 작은 단백질로, 수명이 다하거나 손상된 단백질을 식별하여 분해하는 역할을 한다. 유비퀴틴은 유비퀴틴 활성화 효소(E1), 유비퀴틴 결합 효소(E2), 유비퀴틴 리가아제(E3)의 효소에 의해 표적 단백질에 부착되는 유비퀴틴화 과정을 통해 다양한 세포 과정에 관여한다. 유비퀴틴화는 단백질 분해, DNA 복구, 신호 전달 등 다양한 기능을 수행하며, 단일 유비퀴틴 분자(단일유비퀴틴화) 또는 유비퀴틴 사슬(다중유비퀴틴화)을 형성한다. 유비퀴틴 경로는 알츠하이머병, 파킨슨병, 암과 같은 다양한 질병과 관련이 있으며, 유비퀴틴 유사 단백질(UBL)과 탈유비퀴틴화 효소(DUBs)를 포함하는 복잡한 시스템을 통해 조절된다.
더 읽어볼만한 페이지
- 번역 후 변형 - 단백질 카보닐화
- 번역 후 변형 - 메틸화
메틸화는 메틸기를 분자에 첨가하는 과정으로, 생물학에서 유전자 발현 조절 등 생명현상에 관여하고 유기화학에서 유기 합성에 활용되며, 다양한 생물종에 존재하는 중요한 생리적 과정이다. - 단백질 구조 - 메틸화
메틸화는 메틸기를 분자에 첨가하는 과정으로, 생물학에서 유전자 발현 조절 등 생명현상에 관여하고 유기화학에서 유기 합성에 활용되며, 다양한 생물종에 존재하는 중요한 생리적 과정이다. - 단백질 구조 - 녹색 형광 단백질
녹색 형광 단백질(GFP)은 해파리에서 발견된 단백질로, 특정 파장의 빛을 흡수하여 녹색 형광을 방출하며, 자체 발색단 형성 능력과 유전자 조작을 통한 개량형 개발로 생물학 연구에서 리포터 유전자로 널리 사용되지만, 실험 결과 해석 시 주의가 필요하고 대체 기술 또한 개발 중이다.
| 유비퀴틴 | |
|---|---|
| 개요 | |
 | |
| 심볼 | 유비퀴틴 |
| 명칭 | 유비퀴틴 |
| 발견 | 유비퀴틴 의존적 단백질 분해 발견 |
| 발견자 | Wilkinson KD |
| 발견 연도 | 2005년 |
| 노벨상 수상 연도 | 2004년 |
| 관련 노벨상 | 2004년 노벨 화학상 |
| 관련 수상자 | 아론 치에하노버 아브람 허슈코 어윈 로즈 |
| 식별 정보 | |
| Pfam | PF00240 |
| InterPro | IPR000626 |
| SMART | 해당 없음 |
| Prosite | PDOC00271 |
| SCOP | 1aar |
| TCDB | 해당 없음 |
| OPM 패밀리 | 해당 없음 |
| OPM 단백질 | 해당 없음 |
| PDB | 1D3Z |
| 분류 | |
| 종류 | 가수분해효소 |
| 특징 | |
| 기능 | 다른 단백질의 분해에 관여 |
| 상세 정보 | |
| 설명 | 대부분의 진핵 조직에서 발견되는 조절 단백질 |
2. 식별자
유비퀴틴은 단백질의 수명이 다했거나(반감기 경과) 손상되어 불안정한 경우 이를 표지하는 식별자 역할을 수행한다. 이렇게 표지된 단백질은 단백질 분해 공장인 프로테아좀(proteasome)으로 보내져 아미노산 수준으로 분해되고 안정화된다.
유비퀴틴-프로테아솜계(ubiquitin-proteasome system, UPS)는 세포질 내에서 불필요하거나 손상된 단백질을 식별하고 분해하는 핵심적인 시스템이다.[135] 이 시스템은 단백질의 반감기가 지나 폐기가 필요하거나, 구조적 오류 또는 손상으로 인해 불안정한 단백질을 표지하는 역할을 한다. 표지된 단백질은 프로테아좀(proteasome)이라는 단백질 분해 복합체에 의해 아미노산 수준으로 분해되어 세포 내 단백질 항상성을 유지한다. 유비퀴틴-프로테아솜계는 세포의 성장과 분화, DNA 복제와 복구, 세포 자멸사(apoptosis), 그리고 스트레스 및 면역 반응과 같은 다양한 필수 세포 과정에 깊이 관여한다.[135]
유비퀴틴은 1975년에 처음 발견되었으며, 모든 진핵생물 세포에 존재하는 작은(8.6 kDa) 단백질이다.[4] 유비퀴틴이 단백질 분해 과정에서 어떤 역할을 하는지는 1980년대 초 테크니온의 아론 시차노버, 아브람 허쉬코, 어윈 로즈에 의해 밝혀졌고, 이들은 이 공로로 2004년 노벨 화학상을 수상했다.[2]
초기 연구에서 유비퀴틴(당시 APF-1으로 불림)은 ATP와 Mg2+ 이온이 있을 때 특정 단백질(라이소자임 등)에 달라붙는다는 것이 확인되었다.[5] 여러 개의 유비퀴틴 분자가 기질 단백질의 특정 라이신 잔기에 이소펩타이드 결합이라는 특수한 방식으로 연결된다. 구체적으로는 유비퀴틴의 가장 끝부분에 있는 글리신 아미노산(Gly76)의 카르복실기가 기질 단백질의 라이신에 결합한다. 이렇게 유비퀴틴 표지가 붙은 단백질은 프로테아좀에 의해 빠르게 분해된다.[5]
이러한 유비퀴틴의 식별자 기능은 세포 내 단백질 품질 관리 시스템에서 중요한 역할을 한다. 새로 만들어지는 단백질 중 일부는 제대로 접힘 구조를 형성하지 못하는데(미스폴딩 단백질), Hsp90과 같은 분자 샤페론 단백질이 먼저 이를 수리하려고 시도한다. 만약 손상이 심해 수리가 불가능하면, 이 단백질은 소포체에서 세포질로 옮겨져 유비퀴틴 표지가 붙게 된다. 이 과정을 유비퀴틴화라고 하며, 이후 프로테아좀에 의해 분해된다. 이러한 전체 과정을 소포체 관련 분해(ERAD, Endoplasmic Reticulum-associated degradation)라고 부른다.
3. 유비퀴틴-프로테아솜계
이 시스템의 핵심 과정은 유비퀴틴화(ubiquitylation 또는 ubiquitination)이다. 이는 번역 후 변형의 일종으로, 작은 단백질인 유비퀴틴(ubiquitin)이 표적 단백질에 결합하는 과정이다. 가장 일반적인 유비퀴틴화는 유비퀴틴의 C-말단 글리신(Gly76) 잔기의 카복실산기와 표적 단백질의 라이신 잔기의 엡실론-아민기(ε-NH3+) 사이에 아이소펩타이드 결합이 형성되는 방식으로 일어난다.[8] 유비퀴틴 분자 하나가 붙는 것을 모노유비퀴틴화, 여러 개가 사슬 형태로 붙는 것을 폴리유비퀴틴화라고 한다.[45] 폴리유비퀴틴 사슬이 형성된 단백질은 주로 프로테아좀에 의해 분해된다.
유비퀴틴화 과정은 세 가지 주요 효소, 즉 E1(유비퀴틴 활성화 효소), E2(유비퀴틴 결합 효소), E3(유비퀴틴 리가아제)에 의해 단계적으로 진행된다.
# '''활성화 (Activation)''': E1 효소는 ATP를 사용하여 유비퀴틴을 활성화시킨다. 이 과정에서 유비퀴틴의 C-말단과 E1 효소의 활성 부위 시스테인 잔기 사이에 티오에스터 결합이 형성된다.[8][46] 인간에게는 UBA1과 UBA6 두 종류의 E1 효소 유전자가 있다.[47]
# '''접합 (Conjugation)''': 활성화된 유비퀴틴은 E1 효소에서 E2 효소의 활성 부위 시스테인 잔기로 전달된다. E2 효소는 다양한 종류가 존재하며(인간의 경우 약 35종), 특정 E3 효소와 협력하여 표적 단백질에 유비퀴틴을 전달하는 역할을 한다.[48]
# '''결찰 (Ligation)''': E3 효소는 특정 표적 단백질을 인식하고, E2 효소로부터 유비퀴틴을 받아 표적 단백질의 라이신 잔기에 최종적으로 결합시키는 역할을 한다. E3 효소는 수백 종류가 존재하며, 유비퀴틴화의 특이성을 결정하는 중요한 요소이다. E3 효소는 크게 HECT 도메인과 RING 도메인(또는 U-box 도메인)을 가진 두 가지 유형으로 나뉜다.[49] 후기 분열 촉진 복합체(APC)와 SCF 복합체는 잘 알려진 다중 단백질 서브유닛 E3 리가아제의 예이다.[50]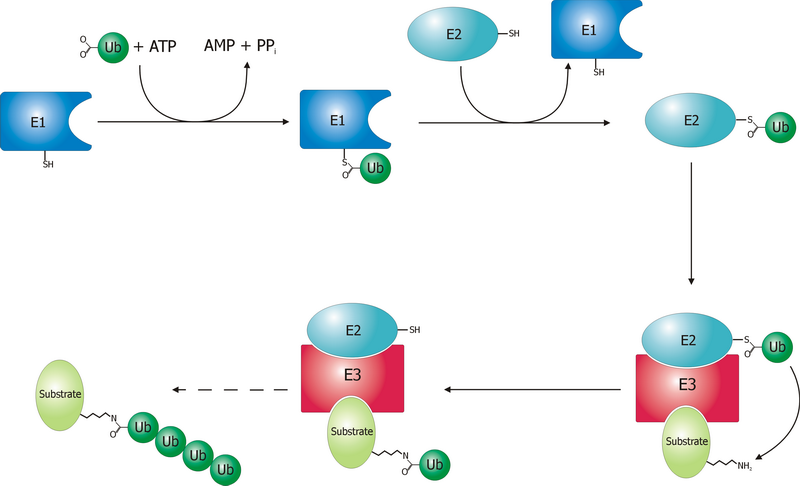
이러한 E1-E2-E3 효소 캐스케이드는 계층적 구조를 이루어 유비퀴틴화 과정을 정교하게 조절한다.[51] 경우에 따라 E4 효소(유비퀴틴 사슬 신장 인자)가 이미 형성된 유비퀴틴 사슬을 더욱 길게 만드는 데 관여하기도 한다.[53]
유비퀴틴-프로테아솜계는 단백질 분해 외에도 다양한 세포 기능을 조절한다.
유비퀴틴화의 조절은 E3 리가아제가 표적 단백질의 특정 아미노산 서열인 데그론(degron)을 인식하는 과정에서 이루어진다. 이때 인산화, 수산화 등 다른 번역 후 변형이 데그론 인식에 영향을 미치기도 한다. 또한, 탈유비퀴틴화 효소(deubiquitinating enzyme, DUB)는 표적 단백질에 결합된 유비퀴틴을 제거하여 유비퀴틴화를 되돌리거나 유비퀴틴을 재활용하는 역할을 한다.
4. 역사
유비퀴틴은 1975년에 처음으로 발견되었으며, 당시에는 '어디에나 존재하는 면역 조혈 폴리펩타이드'라고 불렸다.[4] 이는 모든 진핵생물 세포에서 발현되는 8.6 kDa 크기의 단백질로 확인되었다.
유비퀴틴의 기본적인 기능과 유비퀴틴화 경로의 구성 요소는 1980년대 초 테크니온의 아론 시차노버, 아브람 허쉬코, 어윈 로즈에 의해 밝혀졌다.[2] 이 연구는 처음에는 세포 추출물 내 ATP에 의존하는 단백질 분해 시스템을 규명하는 과정에서 시작되었다. 연구팀은 이 과정에서 ATP 의존성 단백질 분해 인자 1(APF-1)이라는 열에 안정한 폴리펩타이드를 발견했다. APF-1은 ATP와 Mg2+가 있을 때 모델 단백질 기질인 라이소자임에 공유 결합하는 것으로 나타났다.[5] 여러 개의 APF-1 분자가 하나의 기질 분자에 이소펩타이드 결합을 통해 연결되며, 이렇게 형성된 접합체는 빠르게 분해되면서 자유 APF-1을 방출하는 것이 확인되었다. 이후 APF-1은 이전에 발견된 유비퀴틴과 동일한 물질임이 확인되었다. 또한 유비퀴틴의 C-말단 글리신 잔기(Gly76)의 카르복실기가 기질의 라이신 잔기에 결합하는 부위임이 밝혀졌다.
이러한 '유비퀴틴-매개 단백질 분해의 발견'에 대한 공로로 아론 시차노버, 아브람 허쉬코, 어윈 로즈는 2004년 노벨 화학상을 공동 수상하였다.[2]
5. 단백질
유비퀴틴은 모든 진핵생물 세포에 존재하는 작은 단백질이다. 다양한 표적 단백질에 결합하여 세포 내에서 수많은 기능을 수행하며, 다양한 방식으로 변형될 수 있다. 유비퀴틴 단백질 자체는 76개의 아미노산으로 구성되어 있으며 약 8.6 kDa의 분자량을 가진다. 주요 구조적 특징으로는 C-말단 꼬리와 N-말단 메티오닌 (M1), 그리고 내부의 7개 라이신 잔기(K6, K11, K27, K29, K33, K48, K63)가 있다. 이러한 잔기들은 다양한 형태의 유비퀴틴 사슬을 형성하는 연결 지점으로 사용된다. 유비퀴틴은 진핵생물 진화 과정에서 매우 잘 보존되어 있으며, 사람과 효모의 유비퀴틴은 96%의 서열 상동성을 보인다.[6]
| 아미노산 개수 | 76 |
|---|---|
| 분자량 | 8564.8448 Da |
| 등전점 (pI) | 6.79 |
| 유전자 이름 | RPS27A, UBA52, UBB, UBC |
| 서열 (한 글자 약어) | MQIFVKTLTGKTITLEVEPSDTIENVKAKIQDKEGIPPD QQRLIFAGKQLEDGRTLSDYNIQKESTLHLVLRLRGG |
유비퀴틴이 다른 단백질(기질 단백질)에 결합하는 과정을 유비퀴틴화라고 한다. 유비퀴틴화는 표적 단백질의 분해(프로테아좀 및 리소좀 경로), 세포 내 위치 조절, 활성화 및 비활성화, 단백질-단백질 상호작용 조절 등 다양한 세포 과정에 영향을 미친다.[57][58][59] 유비퀴틴화는 단일 유비퀴틴 분자가 부착되는 단일 유비퀴틴화와 여러 유비퀴틴 분자가 사슬 형태로 연결되는 다중 유비퀴틴화(폴리유비퀴틴화)로 나눌 수 있다.[60]
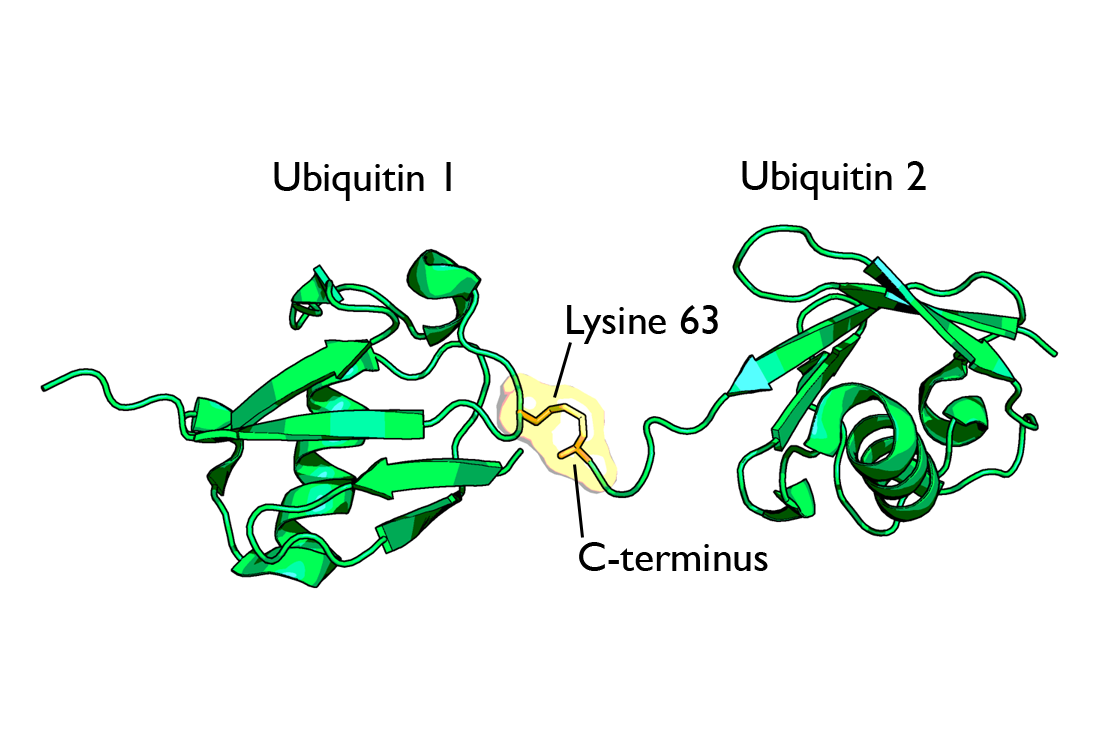
폴리유비퀴틴 사슬은 첫 번째 유비퀴틴 분자가 기질 단백질에 부착된 후, 추가적인 유비퀴틴 분자들이 앞선 유비퀴틴 분자에 순차적으로 연결되어 형성된다.[60] 이 연결은 주로 유비퀴틴 분자 내 7개의 라이신 잔기(K6, K11, K27, K29, K33, K48, K63) 중 하나와 다른 유비퀴틴 분자의 C-말단 글리신 잔기 사이의 펩타이드 결합을 통해 이루어진다.[75] 또한, N-말단의 메티오닌(M1) 잔기를 통해 선형 사슬이 형성되기도 한다. 어떤 잔기를 통해 연결되는지에 따라 폴리유비퀴틴 사슬의 구조와 기능이 달라진다.[10][62][60][61][63]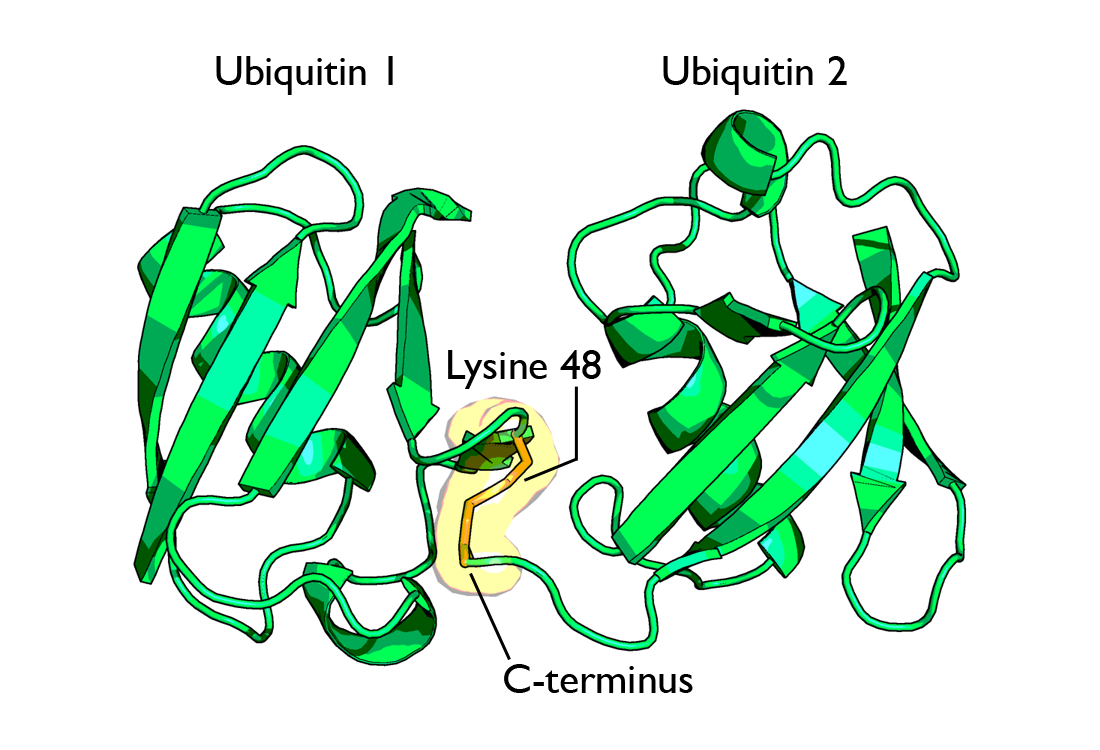
- '''K48 연결 폴리유비퀴틴 사슬''': 가장 먼저 발견되고 연구된 유형으로, 주로 단백질 분해 신호로 작용한다. 수명이 다하거나 손상된 단백질에 K48 연결 사슬(최소 4개의 유비퀴틴 분자)이 부착되면, 프로테아좀이라는 세포 내 단백질 분해 공장에서 인식되어 분해된다.[64] 유비퀴틴 분자 자체는 분해 직전에 분리되어 재활용된다.[65] 프로테아좀의 S5a/Rpn10 소단위체에 있는 유비퀴틴-상호작용 모티프(UIM)가 이 사슬을 인식한다.[57]
- '''K63 연결 폴리유비퀴틴 사슬''': K48과 달리 단백질 분해와는 직접적인 관련이 적다. 대신 세포내이입, 염증 반응 조절, 번역, DNA 복구와 같은 다양한 세포 신호 전달 경로에서 중요한 역할을 한다.[66] 세포 내 ESCRT-0 복합체 등이 K63 사슬에 결합하여 특정 기능을 수행하도록 돕는다.[67][68]
- '''M1 연결 (선형) 폴리유비퀴틴 사슬''': 유비퀴틴의 N-말단 메티오닌(M1)과 다른 유비퀴틴의 C-말단 글리신이 직접 연결되어 형성되는 직선 형태의 사슬이다. NF-κB 신호 전달 경로 활성화에 필수적인 역할을 하는 것으로 알려져 있으며, 이는 면역 및 염증 반응 조절에 중요하다.[70] 선형 유비퀴틴 사슬 어셈블리 복합체(LUBAC)가 M1 연결 사슬을 만드는 주요 효소이다.[62][71]
- '''기타 비정형 및 혼합/분지형 사슬''': K6, K11, K27, K29, K33 등을 통해 연결되는 비정형 사슬들도 존재하며, 일부(K6, K11, K27, K29 등)는 단백질 분해를 유도할 수 있다는 증거가 있다.[72][76] 또한 여러 종류의 연결 방식이 섞인 혼합 사슬이나 나뭇가지처럼 뻗어 나가는 분지형 사슬도 형성될 수 있으나,[73] 이들의 정확한 기능은 아직 활발히 연구 중이다.[61][75]
'''유비퀴틴 결합 도메인'''(UBD)은 유비퀴틴 분자에 비공유적으로 결합하는 단백질 내 특정 영역(모듈)이다. 다양한 단백질들이 UBD를 가지고 있으며, 이를 통해 유비퀴틴 또는 유비퀴틴 사슬을 인식하고 결합하여 신호를 전달하거나 특정 세포 과정을 조절한다. UBD의 종류와 결합 방식에 따라 유비퀴틴 신호의 해석과 그에 따른 세포 반응이 달라진다.[89][90]
5. 1. 유전자
유비퀴틴은 포유류에서 4개의 다른 유전자에 의해 암호화된다. UBA52와 RPS27A 유전자는 각각 리보솜 단백질 L40 및 S27a에 융합된 유비퀴틴의 단일 사본을 암호화한다. UBB와 UBC 유전자는 폴리유비퀴틴 전구 단백질을 암호화한다.[7]6. 유비퀴틴화
유비퀴틴화(Ubiquitylation 또는 Ubiquitination)는 단백질이 만들어진 후 일어나는 번역 후 변형의 한 종류로, 작은 단백질인 유비퀴틴이 특정 기질 단백질에 공유 결합으로 부착되는 과정이다.[8] 이 과정은 세포 내에서 매우 중요한 역할을 수행하는데, 특히 수명이 다하거나 손상된 단백질, 또는 잘못 접힌 단백질을 식별하여 분해하도록 표지하는 기능을 한다. 이렇게 표지된 단백질은 주로 프로테아좀이라는 세포 내 단백질 분해 공장으로 보내져 제거된다. 유비퀴틴-프로테아좀 시스템은 세포의 성장과 분화, DNA 복제 및 복구, 세포 사멸, 스트레스 반응 및 면역 반응 조절 등 생명 유지에 필수적인 다양한 세포 활동에 깊이 관여한다.[135]
유비퀴틴화는 일반적으로 유비퀴틴 분자의 C-말단 글리신(Gly76) 잔기의 카복실기(-COOH)와 기질 단백질에 있는 라이신(Lys) 잔기의 엡실론-아민기(-NH₂) 사이에 아이소펩타이드 결합을 형성하면서 일어난다.[8] 하지만 라이신 외에도 다른 부위에 유비퀴틴이 결합할 수도 있다. 예를 들어, 단백질의 N-말단 아민기,[12][13][14][15][16][17][18][19][20][21][22][23][24][25][26][27][28][29][30][31][32][62] 시스테인 잔기의 티올기(-SH),[28][29][33][34][35][36][37][38][39][40] 트레오닌이나 세린 잔기의 하이드록실기(-OH) 등에도 유비퀴틴이 결합할 수 있으며, 이를 비정규 유비퀴틴화(non-canonical ubiquitylation)라고 한다.[11][28][29][33][39][40][41][42][43][44] 유비퀴틴화의 결과, 기질 단백질에는 유비퀴틴 분자 하나만 부착되거나(단일유비퀴틴화), 여러 개의 유비퀴틴 분자가 사슬 형태로 연결되어 부착될 수 있다(다중유비퀴틴화).[45] 다중유비퀴틴화의 경우, 유비퀴틴 사슬이 어떤 방식으로 연결되는지에 따라 그 기능이 달라진다.
유비퀴틴화 과정은 세 가지 종류의 효소, 즉 유비퀴틴 활성화 효소(E1), 유비퀴틴 결합 효소(E2), 유비퀴틴 리가아제(E3)가 순차적으로 작용하는 효소 연쇄 반응(enzymatic cascade)을 통해 일어난다.
# '''활성화 (Activation)''': E1 효소가 ATP를 사용하여 유비퀴틴 분자를 활성화시킨다. 이 과정에서 유비퀴틴의 C-말단 카복실기와 E1 효소의 특정 시스테인 잔기 사이에 티오에스터 결합이라는 고에너지 결합이 형성된다.[8][46]
# '''접합 (Conjugation)''': E2 효소가 E1 효소로부터 활성화된 유비퀴틴을 전달받아 자신의 활성 부위 시스테인 잔기에 일시적으로 결합시킨다.[48]
# '''결찰 (Ligation)''': E3 효소가 특정 기질 단백질을 인식하고 E2 효소와 결합한다. 그 후 E3 효소는 E2 효소에 붙어 있는 유비퀴틴을 기질 단백질의 특정 부위(주로 라이신 잔기)로 옮겨 아이소펩타이드 결합 형성을 촉매한다. E3 효소는 어떤 단백질을 유비퀴틴화할지 결정하는 핵심적인 역할을 하며, 세포 내에 수백 종류가 존재하여 다양한 기질 단백질에 대한 특이성을 부여한다.[49]
이러한 E1-E2-E3 효소 시스템은 계층 구조를 이루어 소수의 E1이 다수의 E2를, 다시 다수의 E2가 수백 개의 E3와 작용함으로써 매우 정교하고 효율적인 조절을 가능하게 한다.[51] 때로는 E4 효소라고 불리는 유비퀴틴 사슬 연장 인자가 이미 형성된 유비퀴틴 사슬을 더 길게 만드는 데 관여하기도 한다.[53]
유비퀴틴화 시스템의 기본적인 기능과 구성 요소는 1980년대 초 테크니온의 아론 시차노버, 아브람 허쉬코, 어윈 로즈에 의해 ATP 의존적인 단백질 분해 시스템으로 처음 규명되었으며, 이들은 이 공로로 2004년 노벨 화학상을 수상했다.[2] 초기 연구에서는 세포 추출물에서 ATP 의존적으로 단백질 분해를 일으키는 인자 1(APF-1)을 발견했는데, 이것이 바로 유비퀴틴이었으며, 여러 개의 APF-1(유비퀴틴) 분자가 기질 단백질에 결합하면 해당 단백질이 빠르게 분해된다는 사실을 밝혀냈다.[5]
6. 1. 유형
유비퀴틴화는 표적 단백질에 유비퀴틴이 부착되는 방식에 따라 크게 두 가지 유형으로 나눌 수 있다. 하나는 표적 단백질의 특정 부위에 유비퀴틴 분자 하나가 결합하는 단일유비퀴틴화(monoubiquitylation)이고, 다른 하나는 여러 개의 유비퀴틴 분자가 사슬 형태로 연결되어 표적 단백질이나 이미 결합된 유비퀴틴에 부착되는 다중유비퀴틴화(polyubiquitylation)이다.[45][60] 이러한 유비퀴틴화 유형의 차이는 단백질의 운명이나 기능 조절에 서로 다른 영향을 미친다. 각 유형의 구체적인 과정과 기능은 해당 하위 문단에서 자세히 다룬다.6. 1. 1. 단일유비퀴틴화
유비퀴틴화는 기질 단백질에 유비퀴틴 분자를 부착하는 방식에 따라 여러 유형으로 나뉜다. 유비퀴틴 분자 하나만 붙이는 것을 단일유비퀴틴화(Monoubiquitylation)라고 하며, 여러 유비퀴틴 분자를 사슬처럼 연결하는 것을 폴리유비퀴틴화(Polyubiquitylation)라고 한다.[60]단일유비퀴틴화는 하나의 기질 단백질에 있는 특정 아미노산 잔기에 유비퀴틴 분자 하나를 공유 결합으로 연결하는 과정이다. 만약 하나의 단백질 내 여러 다른 잔기에 각각 유비퀴틴 분자를 하나씩 붙인다면, 이를 다중 단일유비퀴틴화(Multiple monoubiquitylation)라고 부른다. 단백질에 단일유비퀴틴화가 일어났을 때 나타나는 생물학적 효과는, 같은 단백질에 여러 유비퀴틴이 사슬 형태로 붙는 폴리유비퀴틴화가 일어났을 때와는 다를 수 있다. 일반적으로 단일유비퀴틴화는 이후 폴리유비퀴틴 사슬이 형성되기 위해 먼저 필요한 단계로 여겨진다.[60]
단일유비퀴틴화는 단백질 분해 신호 외에도 다양한 세포 내 과정 조절에 중요한 역할을 한다. 예를 들어, 세포막을 통한 물질의 이동을 조절하는 막 수송, 세포가 외부 물질을 안으로 받아들이는 세포내이입(endocytosis), 그리고 바이러스가 숙주 세포에서 증식한 뒤 밖으로 나가는 과정인 바이러스 출아(viral budding) 등에 영향을 미친다.[66][61]
6. 1. 2. 다중유비퀴틴화
다중유비퀴틴화(Polyubiquitylation)는 기질 단백질의 단일 라이신 잔기에 여러 개의 유비퀴틴 분자가 사슬 형태로 연결되는 현상이다.[60] 먼저 단일 유비퀴틴 분자가 기질 단백질에 부착된 후, 추가적인 유비퀴틴 분자들이 이 첫 번째 유비퀴틴에 순차적으로 결합하여 사슬을 형성한다.[60] 이 사슬은 한 유비퀴틴 분자의 C-말단 글리신 잔기와 이전 유비퀴틴 분자의 특정 라이신 잔기 사이에 아이소펩타이드 결합이 형성되면서 만들어진다. 유비퀴틴 분자 내에는 K6, K11, K27, K29, K33, K48, K63의 7개 라이신 잔기와 N-말단 메티오닌(M1)이 존재하며, 이들이 사슬 형성을 위한 연결 지점으로 사용될 수 있다.[75] 어떤 연결 지점을 사용하느냐에 따라 형성되는 유비퀴틴 사슬의 종류와 기능이 달라진다.
주요 다중유비퀴틴 사슬의 종류와 기능은 다음과 같다.
- '''K48 연결 사슬''': 유비퀴틴의 48번째 라이신(K48)을 통해 연결된 사슬이다. 가장 먼저 발견되었고 가장 많이 연구된 유형으로,[75] 주로 단백질 분해 신호로 작용하여 표적 단백질을 프로테아좀으로 보내 파괴되도록 유도한다. 프로테아좀(특히 26S 프로테아좀)이 단백질을 인식하고 분해하기 위해서는 일반적으로 최소 4개 이상의 유비퀴틴 분자로 구성된 K48 사슬이 표적 단백질에 부착되어야 한다.[64] 이 사슬은 프로테아좀의 특정 서브유닛(S5a/Rpn10)에 존재하는 유비퀴틴-상호작용 모티프(UIM)에 의해 인식된다.[57] 단백질이 분해되기 직전에 유비퀴틴 분자들은 사슬에서 분리되어 재활용된다.[65]
- '''K63 연결 사슬''': 유비퀴틴의 63번째 라이신(K63)을 통해 연결된 사슬이다. K48 사슬과는 달리 단백질 분해 신호로 작용하지 않는다. 대신 세포내이입, 염증 반응 조절, 단백질 번역, DNA 복구 등 다양한 세포 신호 전달 과정에 관여한다.[66] 세포 내에서 K63 사슬은 ESCRT-0 복합체(UIM을 포함하는 Hrs, STAM1 단백질 등으로 구성)에 의해 특이적으로 결합하며, 이를 통해 프로테아좀에 의한 분해를 피할 수 있다.[67][68]
- '''M1 연결 (선형) 사슬''': 유비퀴틴 분자들이 머리-꼬리 방식으로 연결된, 즉 한 유비퀴틴의 C-말단 글리신이 다음 유비퀴틴의 N-말단 메티오닌(M1)에 직접 펩타이드 결합을 형성하여 만들어진 직선 형태의 사슬이다. 처음에는 단백질 분해와 관련이 있을 것으로 생각되었으나,[69] 현재는 NF-κB 신호 전달 경로를 활성화하는 데 필수적인 역할을 하는 것으로 밝혀졌다.[70] 이 선형 사슬의 생성은 선형 유비퀴틴 사슬 어셈블리 복합체(LUBAC)라는 특정 E3 유비퀴틴 리가아제에 의해서만 이루어지는 것으로 알려져 있다.[62][71]
이 외에도 K6, K11, K27, K29, K33 등 다른 라이신 잔기를 통해 연결되는 비정형(atypical) 사슬들이 존재한다. 이들의 기능은 K48이나 K63 사슬에 비해 아직 명확하게 밝혀지지 않았지만,[61] K6, K11, K27, K29 연결 사슬 등 일부 비정형 사슬도 특정 상황에서는 프로테아좀에 의한 단백질 분해를 유도할 수 있다는 연구 결과가 있다.[72][76] 또한, 여러 종류의 연결 방식이 혼합되어 있는 혼합 사슬(mixed linkage chain)이나 하나의 유비퀴틴 분자에 두 개 이상의 다른 유비퀴틴 분자가 서로 다른 라이신 잔기를 통해 연결된 분지형 사슬(branched chain)도 형성될 수 있다.[73] 이러한 복잡한 사슬들의 구체적인 생물학적 기능은 아직 연구 중이다.[75]
다양한 연결 방식으로 생성된 유비퀴틴 사슬들은 서로 다른 3차원 구조(컨포메이션)를 가지며, 이는 각각의 사슬이 특정 기능을 수행하도록 하는 중요한 요인이 된다. 예를 들어, K29, K33,[74] K63, M1 연결 사슬은 비교적 길게 늘어선 '열린 구조'(open conformation)를 형성하는 반면, K6, K11, K48 연결 사슬은 서로 밀집된 '닫힌 구조'(closed conformation)를 형성한다. 이러한 구조적 차이 때문에 세포 내의 특정 단백질들(주로 유비퀴틴 결합 도메인(UBD)을 가진 단백질들)은 특정 연결 방식의 유비퀴틴 사슬만을 선택적으로 인식하고 결합하여 신호를 전달하거나 특정 세포 과정을 매개할 수 있다.[75][66][76]
7. 기능
유비퀴틴은 세포 내에서 다양한 기능을 수행하는 작은 단백질이다. 가장 잘 알려진 기능은 더 이상 필요 없거나 손상된 단백질을 표지하여 분해하도록 유도하는 역할이다. 이렇게 표지된 단백질은 세포 내 단백질 분해 공장인 프로테아좀으로 보내져 아미노산 단위로 분해된다. 이러한 과정을 통해 세포는 단백질의 품질을 관리하고 항상성을 유지한다.
유비퀴틴과 프로테아좀이 함께 작동하는 시스템을 '''유비퀴틴-프로테아솜 시스템'''(Ubiquitin-Proteasome System, UPS)이라고 부른다. 이 시스템은 단순히 불필요한 단백질을 제거하는 것 외에도 세포의 성장과 분화, DNA 복제 및 복구, 세포자멸사, 스트레스 반응, 면역 반응 등 생명 유지에 필수적인 광범위한 세포 과정 조절에 깊이 관여한다.[135]
유비퀴틴이 표적 단백질에 부착되는 방식, 즉 유비퀴틴화(ubiquitination)는 매우 다양하며, 이 방식에 따라 표적 단백질의 운명이 달라진다. 하나의 유비퀴틴 분자가 붙는 단일 유비퀴틴화(monoubiquitination)와 여러 개의 유비퀴틴 분자가 사슬처럼 연결되어 붙는 다중 유비퀴틴화(polyubiquitination)가 있으며, 다중 유비퀴틴화의 경우 어떤 라이신 잔기를 통해 사슬이 연결되는지에 따라 기능이 달라진다.[60] 예를 들어, 특정 방식으로 연결된 유비퀴틴 사슬은 단백질 분해 신호로 작용하는 반면, 다른 방식의 연결은 단백질 분해 외에도 신호 전달, DNA 복구, 단백질의 세포 내 위치 변경, 유전자 발현 조절 등 다양한 세포 내 사건을 조절하는 신호로 기능한다.[57][58][59][66] 따라서 유비퀴틴화는 세포 내에서 일어나는 수많은 과정을 정교하게 조절하는 핵심적인 번역 후 변형 메커니즘이다.
7. 1. 주요 기능
유비퀴틴화는 단백질의 분해(프로테아좀 및 리소좀 경유), 단백질의 세포 내 위치 조절, 단백질 활성화 및 비활성화, 그리고 단백질-단백질 상호작용 조절을 통해 다양한 세포 과정에 영향을 미친다.[57][58][59] 이러한 효과는 표적 단백질에 유비퀴틴이 어떻게 부착되는지에 따라 달라지는데, 단일 유비퀴틴 분자가 부착되는 경우(단일 유비퀴틴화)와 여러 유비퀴틴 분자가 사슬 형태로 부착되는 경우(다중 유비퀴틴화) 기능이 다르다.[60]
다중 유비퀴틴화는 유비퀴틴 사슬이 표적 단백질의 특정 라이신 잔기에 형성되는 것을 의미한다. 유비퀴틴 자체에는 K6, K11, K27, K29, K33, K48, K63의 7개 라이신 잔기와 N-말단 메티오닌(M1)이 있어 다양한 형태의 사슬을 만들 수 있다.[75] 유비퀴틴 사슬의 연결 방식은 표적 단백질의 운명을 결정하는 중요한 신호로 작용한다.
- '''K48 연결 사슬''': 가장 먼저 발견되고 가장 잘 연구된 형태로, 주로 단백질을 프로테아좀으로 보내 분해시키는 표지 역할을 한다.[64] 세포 내에서 잘못 접힘(미스폴딩)되었거나 수명이 다해 더 이상 필요 없어진 단백질을 제거하는 단백질 품질 관리 시스템의 핵심 요소이다. 예를 들어, 소포체에서 잘못 만들어진 단백질은 세포질로 나와 Hsp90과 같은 분자 샤페론과 C-terminus of Hsc-70-interacting protein (CHIP) 같은 유비퀴틴 리가아제에 의해 유비퀴틴화된 후 프로테아좀에서 분해되는데, 이를 '''소포체 관련 분해'''(ERAD, Endoplasmic Reticulum-associated degradation)라고 한다.[135] 이러한 기전을 표적으로 하는 항암제 보르테조미브가 개발되기도 했다. 일반적으로 최소 4개 이상의 유비퀴틴 분자가 K48 방식으로 연결되어야 프로테아좀(26S 프로테아좀)이 이를 인식하고 분해할 수 있다.[64] 분해 직전에 유비퀴틴 분자들은 단백질에서 분리되어 재활용된다.[65]
- '''K63 연결 사슬''': K48 연결과 달리 단백질 분해보다는 주로 비분해성 신호 전달 경로 조절에 관여한다. 세포내이입, 염증 반응 조절, 단백질 번역, DNA 복구와 같은 다양한 세포 과정에서 중요한 역할을 수행한다.[66] K63 연결 사슬은 ESCRT-0 복합체에 의해 인식되어 결합하는데, 이는 프로테아좀에 의한 분해를 막는 기전 중 하나이다.[67][68]
- '''M1 연결 (선형) 사슬''': 유비퀴틴의 N-말단 메티오닌(M1)과 다음 유비퀴틴의 C-말단 글리신이 직접 연결되어 형성되는 선형 사슬이다. 처음에는 단백질 분해와 관련 있을 것으로 추정되었으나,[69] 현재는 NF-κB 신호 전달 경로 활성화에 필수적인 역할을 하는 것으로 밝혀졌다.[70] 선형 유비퀴틴 사슬 어셈블리 복합체(LUBAC)가 M1 연결 사슬을 만드는 유일하게 알려진 E3 유비퀴틴 리가아제이다.[62][71]
- '''기타 비정형 사슬 및 분지형 사슬''': K6, K11, K27, K29, K33 등 다른 라이신 잔기를 이용한 연결이나, 여러 종류의 연결이 혼합된 분지형 유비퀴틴 사슬도 존재한다.[73] 이들의 정확한 기능은 아직 완전히 밝혀지지 않았지만, 연구를 통해 K6, K11, K27, K29 연결 사슬 등 일부 비정형 사슬도 특정 조건에서 단백질 분해를 유도할 수 있다는 증거가 제시되고 있다.[72][76]
이 외에도 유비퀴틴-프로테아좀 시스템은 다음과 같은 중요한 세포 과정에 필수적이다.
- '''항원 제시''': 세포 내부에서 유래한 단백질(예: 바이러스 단백질, 종양 단백질)을 분해하여 짧은 펩타이드 조각으로 만들고, 이를 MHC 클래스 I 분자에 결합시켜 세포 표면에 제시하는 과정에 관여한다. 이는 CD8 양성 T 세포가 감염된 세포나 암세포를 인식하고 제거하는 면역 반응의 핵심 단계이다. 세포질 내 단백질은 유비퀴틴-프로테아좀 시스템에 의해 분해된 후, TAP 수송체를 통해 소포체로 들어가 MHC 클래스 I 분자와 결합한다.
- '''세포 주기 조절''': 세포 분열 주기를 조절하는 핵심 단백질인 사이클린과 CDK 복합체의 활성을 제어하는 데 중요한 역할을 한다. 특정 시점에 특정 사이클린을 유비퀴틴화하여 프로테아좀에서 분해함으로써 세포 주기가 다음 단계로 정확하게 진행되도록 조절한다.
종합적으로 유비퀴틴화 시스템은 다음과 같이 매우 광범위한 세포 과정에서 핵심적인 기능을 수행한다:[77]
- 항원 제시
- 세포자멸사 (Apoptosis)
- 세포 소기관의 생성 (Biogenesis)
- 세포 주기와 분열 조절
- DNA 전사 및 DNA 복구
- 세포 분화 및 발생
- 면역 반응 및 염증
- 신경 및 근육 퇴행 (Neurodegeneration and muscular degeneration)
- 만능성 유지[78]
- 신경 네트워크의 형태 형성 (Morphogenesis of neural networks)
- 세포 표면 수용체, 이온 채널 및 분비 경로 조절
- 스트레스 및 세포 외부 조절 인자에 대한 반응
- 리보솜 생합성
- 바이러스 감염 대응
7. 2. 막 단백질
다중 단일유비퀴틴화는 막단백질, 예를 들어 수용체 같은 단백질을 생체막에서 제거(내재화)하는 표지로 작용할 수 있다. 이 과정은 세포 내에서 다양한 신호 전달 역할을 수행한다.[66][60][64][79] 세포 표면의 막 단백질이 유비퀴틴으로 표지되면, 해당 단백질의 세포 내 위치가 바뀌며 종종 리소좀으로 보내져 분해된다.[66][60][64][79] 이는 일종의 음성 피드백 조절 방식으로, 리간드가 수용체에 결합하여 자극하면 해당 수용체의 유비퀴틴화와 내재화 속도가 빨라지는 방식으로 작동한다.[66][60][64][79]단일 유비퀴틴화 자체도 막 수송, 세포 내 섭취와 같은 막 관련 과정에 영향을 준다.[66][61] 또한, 라이신 63번 잔기를 통해 연결된 다중유비퀴틴 사슬 역시 일부 막 단백질의 이동 및 수송에 관여한다.[66][60][64][79]
7. 3. 유전체 유지
증식 세포 핵 항원 (PCNA)은 DNA 합성에 관여하는 단백질이다. 정상적인 생리 조건에서 PCNA는 SUMO화된다 (유비퀴틴화와 유사한 번역 후 변형). DNA가 자외선이나 화학 물질에 의해 손상되면 라이신 잔기에 부착된 SUMO 분자가 유비퀴틴으로 대체된다. 모노유비퀴틴화된 PCNA는 손상된 DNA로 DNA 합성을 수행할 수 있는 중합효소를 모집하지만, 이는 오류 발생 가능성이 높으며, 돌연변이된 DNA의 합성을 초래할 수 있다. PCNA의 라이신 63 결합 폴리유비퀴틴화는 템플릿 스위칭 경로로 알려진 오류 발생률이 낮은 돌연변이 우회를 수행할 수 있게 한다.[59][80][81]히스톤 H2AX의 유비퀴틴화는 DNA 이중 가닥 절단의 DNA 손상 인식에 관여한다. 라이신 63 결합 폴리유비퀴틴 사슬은 E2/E3 연결효소 쌍인 Ubc13-Mms2/RNF168에 의해 H2AX 히스톤에 형성된다.[82][83] 이 K63 사슬은 UIM을 포함하는 RAP80을 모집하는 것으로 보이며, RAP80은 BRCA1의 국소화를 돕는다. 이 경로는 결국 상동 재조합 복구에 필요한 단백질을 모집할 것이다.[84]
7. 4. 전사 조절
히스톤은 유비퀴틴화될 수 있으며, 일반적으로 단일 유비퀴틴화 형태를 띠지만, 폴리유비퀴틴화된 형태도 나타난다.[85][86] 히스톤 유비퀴틴화는 염색질 구조를 변경하고 전사에 관여하는 효소의 접근을 조절한다.[85][86] 히스톤에 붙은 유비퀴틴은 전사를 활성화하거나 억제하는 단백질의 결합 부위로 작용하며, 단백질의 추가적인 번역 후 변형을 유도할 수도 있다.[85][86] 이러한 효과들은 유전자 전사를 조절할 수 있다.[85][86]8. 탈유비퀴틴화
탈유비퀴틴화 효소 (deubiquitinases; DUBs)는 기질 단백질에서 유비퀴틴을 제거함으로써 유비퀴틴화의 역할에 반대한다. 이들은 두 단백질 사이의 아미드 결합을 절단하는 시스테인 프로테아제이다. 효소당 소수의 기질만을 가지며 유비퀴틴을 부착하는 E3 연결 효소와 마찬가지로 매우 특이적이다. 이들은 이소펩티드 결합 (유비퀴틴과 라이신 사이) 및 펩타이드 결합 (유비퀴틴과 N-말단 사이)을 모두 절단할 수 있다.
DUB는 기질 단백질에서 유비퀴틴을 제거하는 것 외에도 세포 내에서 많은 다른 역할을 한다. 유비퀴틴은 사슬 (폴리유비퀴틴)로 연결된 여러 사본으로 발현되거나 리보솜 소단위에 부착된다. DUB는 이러한 단백질을 절단하여 활성 유비퀴틴을 생성한다. 또한 유비퀴틴화 과정에서 작은 친핵성 분자에 결합된 유비퀴틴을 재활용하며, 프로테아좀에서 단백질이 분해되기 직전에 유비퀴틴을 기질에서 제거하여 재사용할 수 있도록 한다. 모노유비퀴틴은 단백질에서 이전에 제거된 자유 폴리유비퀴틴 사슬에서 유비퀴틴을 절단하는 DUB에 의해 형성된다.[87][88]
9. 유비퀴틴 결합 도메인
유비퀴틴 결합 도메인 (UBD)은 유비퀴틴에 비공유적으로 결합하는 모듈형 단백질 도메인으로, 다양한 세포 내 현상을 조절하는 역할을 한다. 여러 UBD의 상세한 분자 구조가 밝혀졌으며, 이들의 결합 특이성은 작용 방식과 조절 메커니즘을 결정하여 세포 내 단백질과 과정을 조절하는 데 중요하다.[89][90]
| 도메인 | 프로테옴 내 단백질 수 | 길이 (아미노산) | 유비퀴틴 결합 친화도 |
|---|---|---|---|
| CUE | S. cerevisiae: 7 H. sapiens: 21 | 42–43 | ~2–160 μM |
| GATII | S. cerevisiae: 2 H. sapiens: 14 | 135 | ~180 μM |
| GLUE | S. cerevisiae: ? H. sapiens: ? | ~135 | ~460 μM |
| NZF | S. cerevisiae: 1 H. sapiens: 25 | ~35 | ~100–400 μM |
| PAZ | S. cerevisiae: 5 H. sapiens: 16 | ~58 | 알려지지 않음 |
| UBA | S. cerevisiae: 10 H. sapiens: 98 | 45–55 | ~0.03–500 μM |
| UEV | S. cerevisiae: 2 H. sapiens: ? | ~145 | ~100–500 μM |
| UIM | S. cerevisiae: 8 H. sapiens: 71 | ~20 | ~100–400 μM |
| VHS | S. cerevisiae: 4 H. sapiens: 28 | 150 | 알려지지 않음 |
10. 질병과의 관련성
유비퀴틴 경로는 여러 종류의 질병 및 장애가 발생하는 과정에 깊이 관여하는 것으로 알려져 있다.[91] 이 시스템의 기능 이상은 신경 퇴행성 질환, 감염 및 면역 관련 질환, 다양한 유전 질환, 그리고 암과 같은 광범위한 질병의 원인이 될 수 있다. 구체적으로 단백질 처리 과정에 문제가 생겨 비정상적인 단백질이 쌓이면 신경 퇴행성 질환으로 이어질 수 있으며,[91][92] 면역 신호 전달 조절에 이상이 생기면 감염에 취약해지거나 자가면역 질환이 발생하기도 한다. 또한, 세포의 성장과 분열을 조절하는 과정에 문제가 생기면 암이 발생할 수 있다.[99][114] 유비퀴틴 경로와 관련된 특정 유전자의 결함은 안젤만 증후군이나 폰 히펠-린다우 증후군 같은 유전 질환을 유발하기도 한다.[91]
10. 1. 병인
유비퀴틴 경로는 다음과 같은 광범위한 질병 및 장애의 발병 기전에 관여하는 것으로 알려져 있다.[91]단백질의 번역 후 변형은 진핵생물 세포 신호 전달에서 흔히 사용되는 방식이다.[99] 단백질에 유비퀴틴을 붙이는 유비퀴틴화는 세포 주기 진행, 세포 증식, 발달에 중요한 과정이다. 유비퀴틴화는 주로 26S 프로테아좀을 통한 단백질 분해 신호로 작용하지만, 세포내이입,[100] 효소 활성화,[101] DNA 복구[102] 등 다른 기본적인 세포 과정에도 기여한다.[99] 또한 유비퀴틴화는 사이클린의 세포 내 양을 정밀하게 조절하므로, 이 조절에 문제가 생기면 심각한 결과를 초래할 수 있다. 유비퀴틴/프로테아좀 경로가 암 발생 과정에 중요하다는 사실은 프로테아좀 억제제가 높은 항암 효과를 보인다는 점에서 처음 확인되었다.[103][104][105] 여러 연구를 통해 유비퀴틴화 과정의 문제나 변화가 인간 암종과 자주 연관되어 나타난다는 사실이 밝혀졌다.[106][107][108][109][110][111][112][113] 악성 종양은 종양 억제 유전자의 기능 상실 돌연변이, 유비퀴틴화 활성 증가, 또는 관련 단백질의 돌연변이로 인한 유비퀴틴화 약화 등 다양한 원인으로 발생할 수 있다.[114]
10. 2. 신경 퇴행
유비퀴틴은 단백질 항상성 기능 장애와 관련된 신경 퇴행성 질환, 예를 들어 알츠하이머병, 운동신경 질환,[92] 헌팅턴병 및 파킨슨병과 관련이 있다.[91] 유비퀼린-1의 서로 다른 이소형을 암호화하는 전사 변이체는 알츠하이머병 및 파킨슨병과 관련된 병변에서 발견된다.[93] 뇌에서 유비퀼린의 수치가 높을수록 알츠하이머병 발병에 핵심 역할을 하는 아밀로이드 전구체 단백질 (APP)의 변형이 감소하는 것으로 나타났다.[94] 반대로, 뇌에서 유비퀼린-1 수치가 낮을수록 APP 변형이 증가하는 것과 관련이 있다.[94] 유비퀴틴 B의 프레임 시프트 돌연변이는 C-말단 글리신이 없는 절단된 펩타이드를 생성할 수 있다. UBB+1로 알려진 이 비정상적인 펩타이드는 알츠하이머병 및 기타 타우병증에서 선택적으로 축적되는 것으로 나타났다.면역조직화학은 유비퀴틴에 대한 항체를 사용하여 세포 내부의 비정상적인 유비퀴틴 축적을 식별할 수 있으며, 이는 질병 과정을 나타낸다. 이러한 단백질 축적은 봉입체(세포 내 비정상 물질의 현미경적 집합)라고 한다.
10. 3. 감염 및 면역
유비퀴틴과 유비퀴틴 유사 분자는 면역 반응의 여러 단계에서 중요한 조절 역할을 한다. 정상 상태에서는 면역 반응을 억제하고, 감염 시에는 활성화하며, 감염원이 제거되면 다시 약화시키는 등 면역 신호 전달 경로의 거의 모든 단계를 조절한다. 이러한 조절 기능에 문제가 생기면, 병원체에 대한 면역 반응이 제대로 일어나지 않아 만성 질환이나 심각한 경우 사망에 이를 수 있다. 반대로 면역계가 과도하게 활성화되면 자가면역 질환처럼 자신의 장기와 조직을 공격하는 문제가 발생할 수 있다.한편, 바이러스는 증식하기 위해 숙주 세포의 여러 기능, 특히 면역계의 작동을 방해하거나 자신에게 유리하도록 바꿔야 한다. 질병을 일으키는 많은 바이러스는 정보적으로 제한된 게놈을 가지고 있다. 세포 내에서 매우 다양한 역할을 하는 유비퀴틴 시스템을 조작하는 것은 이러한 바이러스가 자신의 복제를 돕기 위해 숙주 세포의 중요한 기능을 차단, 전복 또는 재지정하는 효율적인 방법이 된다.[95]
레티노산 유도 유전자 I (RIG-I) 단백질은 인간 세포에서 바이러스 RNA와 같은 외부 침입 물질을 감지하는 주요 면역 시스템 센서 중 하나이다.[96] RIG-I 유사 수용체 (RLR) 면역 신호 전달 경로는 면역 조절에서 유비퀴틴의 역할 측면에서 가장 광범위하게 연구된 경로 중 하나이다.[97]
10. 4. 유전 질환
유비퀴틴 경로의 이상은 여러 유전 질환의 발병 기전에 관여하는 것으로 알려져 있다.[91]- 안젤만 증후군: 유비퀴틴 연결효소(E3)인 E6-AP를 암호화하는 유전자 ''UBE3A''의 손상으로 인해 발생한다.
- 폰 히펠-린다우 증후군: 유비퀴틴 E3 연결효소 중 하나인 VHL 종양 억제 인자(또는 ''VHL'' 유전자)의 손상과 관련이 있다.
- 판코니 빈혈: 이 질병의 원인이 될 수 있는 13개 유전자 중 8개는 거대한 유비퀴틴 연결효소(E3) 복합체를 형성하는 단백질을 암호화한다.
- 3-M 증후군: 컬린7 E3 유비퀴틴 연결효소의 돌연변이와 관련된 상염색체 열성 성장 지연 질환이다.[98]
10. 5. 암
단백질의 번역 후 변형 중 하나인 유비퀴틴화는 진핵생물의 세포 신호전달에서 중요한 역할을 한다.[99] 특히 세포 주기 진행, 세포 증식, 발달 과정에 필수적이다. 유비퀴틴화는 주로 26S 프로테아좀에 의한 단백질 분해 신호로 알려져 있지만, 세포내이입,[100] 효소 활성화,[101] DNA 복구[102] 등 다양한 세포 과정 조절에도 관여한다.[99] 세포 주기를 조절하는 사이클린 단백질의 양을 정밀하게 조절하는 데 유비퀴틴화가 핵심적인 역할을 하므로, 이 과정에 문제가 생기면 심각한 결과를 초래할 수 있다.유비퀴틴-프로테아좀 경로가 암 발생 과정에 중요하다는 사실은 프로테아좀 억제제가 높은 항암 효과를 보인다는 점에서 처음 확인되었다.[103][104][105] 여러 연구를 통해 유비퀴틴화 과정의 결함이나 변형이 다양한 종류의 인간 암과 밀접하게 연관되어 있다는 사실이 밝혀졌다.[106][107][108][109][110][111][112][113] 악성 종양은 종양 억제 유전자 자체의 기능 상실 돌연변이로 인해 발생하기도 하지만, 유비퀴틴화 과정의 비정상적인 활성 증가나 관련 단백질의 돌연변이로 인한 유비퀴틴화 기능 약화 등 다양한 방식으로 유발될 수 있다.[114]
- 폰 히펠-린다우(VHL) 유전자: E3 유비퀴틴 리가아제 복합체의 일부를 암호화한다. 정상 산소 농도에서는 VHL 복합체가 저산소 유도 인자(HIF)라는 단백질 계열의 분해를 유도한다. HIF는 혈관 내피 성장 인자(VEGF) 등을 활성화시켜 혈관 형성을 촉진하는데, VHL 유전자에 돌연변이가 생기면 HIF가 분해되지 않아 과도한 혈관이 생성되는 병변이나 신장암 등이 발생할 수 있다.[106][114]
- BRCA1 유전자: DNA 손상 반응에 관여하는 단백질을 암호화하는 종양 억제 유전자이다. 이 단백질은 E3 유비퀴틴 리가아제 활성을 가진 RING 핑거 도메인을 포함하고 있으며, BARD1, BAP1 등 다른 분자와 결합하여 유비퀴틴화 기능을 수행한다. BRCA1 유전자의 돌연변이는 유비퀴틴화 기능에 영향을 미쳐 다양한 종류의 암, 특히 유방암 및 난소암 발생과 관련이 있다.[110][114]
- 사이클린 E/Fbw7: 세포 주기 조절에 중요한 사이클린 E는 CDK2와 결합 후 인산화되면, SCF 관련 F-box 단백질 Fbw7에 의해 인식되어 유비퀴틴화되고 분해된다. Fbw7 유전자에 돌연변이가 생기면 사이클린 E가 분해되지 않고 축적되어 세포 주기가 비정상적으로 진행될 수 있다. 실제로 인간 종양의 30% 이상에서 Fbw7 돌연변이가 발견되며, 이는 Fbw7이 종양 억제 유전자임을 시사한다.[113]
- 인간 유두종 바이러스(HPV): 암을 유발하는 유형의 HPV는 세포의 유비퀴틴-프로테아좀 경로를 이용해 증식한다. HPV의 E6 단백질은 세포의 E3 유비퀴틴 리가아제인 E6-AP에 결합하여, 대표적인 종양 억제 유전자인 p53을 표적으로 삼도록 유도한다.[108] 결과적으로 p53이 유비퀴틸화되어 프로테아좀 매개 분해를 겪게 된다. 한편, HPV의 E7 단백질은 또 다른 종양 억제 유전자인 Rb에 결합하여 분해를 매개한다.[114] p53과 Rb의 손실은 세포가 통제 없이 증식하게 만들어 자궁경부암 등을 유발할 수 있다.
- MDM2 유전자: p53 활성 감소를 담당하는 RING 타입 E3 유비퀴틴 리가아제를 암호화하는 유전자이다. MDM2는 p53을 유비퀴틴화 및 프로테아좀 분해 대상으로 하여 정상 세포 상태에 적절한 수준을 유지한다. 여러 종류의 종양에서 ''MDM2'' 유전자가 비정상적으로 많이 복제되는 유전자 증폭이 자주 발생한다. MDM2의 과발현은 p53 활성의 손실을 유발하여 세포가 무제한의 복제 잠재력을 갖도록 한다.[109][114]
- SKP2 유전자: ''SKP2'' 유전자 역시 증폭의 표적이 되는 유전자이다. SKP2는 유비퀴틴화 및 분해를 위한 기질 인식을 담당하는 F-box 단백질이다. SKP2는 p27Kip-1을 표적으로 하며, 이는 사이클린 의존성 키나아제 (CDK)의 억제제이다. SKP2가 과발현되면 p27Kip-1 단백질의 낮은 수준이 다양한 암에서 자주 발견되며, 이는 SKP2의 과발현을 통한 유비퀴틴 매개 단백질 분해의 과활성화 때문이다.[111][114]
- Efp (TRIM25): 에스트로겐 유도 RING 핑거 단백질로, 과발현 시 에스트로겐 비의존적 유방암의 주요 원인으로 밝혀진 E3 유비퀴틴 리가아제이다.[105][115] Efp의 기질은 세포 주기를 음성적으로 조절하는 14-3-3 단백질이다.
- 샘종성 폴립증(APC) 유전자/베타-카테닌: APC 유전자는 전형적인 종양 억제 유전자로, 대장암 발생과 밀접한 관련이 있다. APC 유전자 산물은 베타-카테닌을 N-말단에서 유비퀴틴화를 통해 분해하도록 하여 세포 수준을 조절한다. 대부분의 대장암 사례는 APC 유전자의 돌연변이와 함께 발견된다. 그러나 APC 유전자가 돌연변이되지 않은 경우, 베타-카테닌의 N-말단에서 돌연변이가 발견되어 유비퀴틴화가 일어나지 않아 활성이 증가한다.[107][114]
- 상피세포 성장 인자 수용체(EGFR)/CBL: 교모세포종과 같은 가장 공격적인 암에서, EGFR의 세포외 도메인 일부의 결실과 관련된 돌연변이가 발견된다. 이러한 결실은 CBL E3 리가제가 유비퀴틴-리소좀 경로를 통해 수용체를 재활용하고 분해하는 데 결합할 수 없게 한다. 따라서 EGFR은 세포막에서 구성적으로 활성화되어 세포 증식 및 이동에 관여하는 하위 이펙터를 활성화시킨다.[112]
유비퀴틴화와 인산화 간의 상호 작용은 지속적인 연구 관심사이다. 인산화는 종종 유비퀴틴화가 분해로 이어지는 표지 역할을 하기 때문이다.[99] 또한 유비퀴틴화는 단백질의 키나아제 활성을 켜거나 끄는 역할을 할 수도 있다.[116] 인산화의 중요한 역할은 Cbl 단백질에서 자기 억제의 활성화 및 제거에서 크게 강조된다.[117] Cbl은 RING 핑거 도메인을 가진 E3 유비퀴틴 리가아제로, 티로신 키나아제 결합 (TKB) 도메인과 상호 작용하여 RING 도메인이 E2 유비퀴틴 접합 효소와 상호 작용하는 것을 방지한다. 이 분자 내 상호 작용은 자기 억제 조절이며, Y363의 인산화는 자기 억제를 완화하고 E2에 대한 결합을 향상시킨다.[117] 리가아제/종양 억제 기능의 손실과 양성 신호 전달/발암 기능의 유지를 통해 Cbl 단백질이 기능 장애를 일으키는 돌연변이는 암 발생의 원인이 되는 것으로 나타났다.[118][119]
유비퀴틴 경로의 이상이 암 발생에 중요한 역할을 하므로, 이 경로를 표적으로 하는 항암 치료제 개발이 활발히 연구되고 있다. 예를 들어 보르테조밉은 E3 리가제에 의한 특정 기질 인식을 차단하는 방식으로 작용한다. 특정 E3 리가제의 활성 및 질병과 관련된 단백질-단백질 상호작용을 선택적으로 억제하는 특정 분자를 찾는 것은 중요하고 확장되는 연구 분야 중 하나이다. 또한, 유비퀴틴화는 다양한 구성요소와 중간 형태를 가진 다단계 과정이므로, 작은 분자 억제제를 설계할 때 구성 요소 간의 복잡한 상호작용을 고려해야 한다.[105]
11. 유비퀴틴 유사 단백질
유비퀴틴 외에도 여러 종류의 유비퀴틴 유사 단백질 (Ubiquitin-like proteins, UBLs)이 존재하며, 이들은 유비퀴틴과 유사하면서도 독자적인 방식으로 세포 내 표적 단백질을 변형시킨다. 유비퀴틴은 가장 잘 알려진 번역 후 변형 인자이지만, UBL 역시 다양한 세포 과정 조절에 중요한 역할을 한다.[77]
알려진 주요 UBL에는 다음과 같은 것들이 있다.
- 작은 유비퀴틴 유사 변형자 (SUMO)
- 유비퀴틴 교차 반응 단백질 (UCRP, ISG15로도 알려짐)
- 유비퀴틴 관련 변형자-1 (URM1)
- 신경 전구 세포에서 발현되는 발달적으로 하향 조절된 단백질-8 (NEDD8, 효모 ''S. cerevisiae''에서는 Rub1이라고도 함)
- 사람 백혈구 항원 F 관련 (FAT10)
- 자가 소화 관련 단백질 ATG8 및 ATG12
- FUB1 (FAU 유전자에 의해 암호화된 유비퀴틴 유사 단백질)
- MUB (막 결합 UBL)[121]
- 유비퀴틴 폴드 변형자-1 (UFM1)
- 유비퀴틴 유사 단백질-5 (UBL5, 효모 ''S. pombe''의 Hub1과 상동성을 가짐)[122][123]
이러한 UBL 단백질들은 아미노산 서열상으로는 유비퀴틴과 유사성이 낮지만 (예: SUMO는 18%의 서열 동일성만 공유), 3차원 구조적으로는 매우 유사하다. 이들은 유비퀴틴과 마찬가지로 "유비퀴틴 폴드"라고 불리는 특징적인 구조를 가진다. 일부 UBL(FAT10, UCRP 등)은 두 개의 유비퀴틴 폴드를 포함하기도 한다. 이러한 콤팩트한 구형 베타-그래스프 폴드는 유비퀴틴, UBL뿐만 아니라 유비퀴틴 유사 도메인을 포함하는 다른 단백질에서도 발견된다. 예를 들어, 효모의 방추체 극 복제 단백질인 Dsk2나 NER 단백질인 Rad23은 모두 N-말단 유비퀴틴 도메인을 포함한다.
UBL은 각각 고유한 기능을 가지고 있으며 다양한 생물학적 과정에 영향을 미친다. 또한, 유비퀴틴화 경로와 UBL 접합 경로는 서로 상호작용하며 조절될 수 있다. 어떤 단백질은 여러 종류의 UBL에 의해 변형될 수 있으며, 때로는 동일한 라이신 잔기에 다른 종류의 UBL이 붙기도 한다. 예를 들어, SUMO 변형(SUMOylation)은 종종 유비퀴틴화와 반대되는 효과를 나타내어 표적 단백질을 분해로부터 보호하고 안정화시키는 역할을 한다. 일반적으로 UBL이 결합된 단백질은 프로테아좀에 의한 분해 대상으로 인식되지 않으며, 대신 다양한 조절 기능을 수행하게 된다. UBL의 부착은 표적 단백질의 구조를 변화시키거나, 다른 분자와의 결합 친화도에 영향을 주거나, 단백질의 세포 내 위치를 바꾸거나, 단백질의 안정성을 조절할 수 있다.[77]
UBL의 작용 메커니즘은 유비퀴틴과 유사하다. UBL 역시 단백질로 합성된 후 C-말단 부분이 잘려나가 불변의 LRGG 서열을 노출시키는 과정을 거친다. 이후 유비퀴틴처럼 E1 (활성화 효소), E2 (결합 효소), E3 (리가아제) 효소 시스템을 통해 표적 단백질에 결합한다. 각 UBL은 자신만의 특이적인 E1, E2, E3 효소 세트를 가지고 있다. 표적 단백질에 결합된 UBL은 특정 UBL 분해효소(isopeptidase)에 의해 다시 분리될 수 있으며, 이는 탈유비퀴틴화 효소와 유사한 방식으로 작용한다.[77]
일부 종에서는 수정 후 정자에서 유래한 미토콘드리아를 제거하는 과정에서 유비퀴틴 관련 메커니즘이 관여하는 것으로 알려져 있다.[124]
12. 원핵생물 유비퀴틴 유사 단백질
원핵생물 유비퀴틴 유사 단백질(Pup)은 수렴 진화를 통해 유비퀴틴과 유사한 기능을 가지도록 진화한 단백질로, 그람 양성 세균의 방선균(Actinomycetota) 문에서 처음 발견되었다. Pup는 유비퀴틴처럼 특정 단백질을 분해 대상으로 표지하는 역할을 수행한다. 하지만 유비퀴틴화(ubiquitination)와 퓨필화(pupylation)의 효소적 과정은 서로 다르며, 두 단백질 계열은 진화적으로 같은 조상에서 유래하지 않은 상동성이 없는 관계이다. 유비퀴틴화가 3단계 반응을 거치는 것과 달리, 퓨필화는 2단계 반응만 필요하며 단 두 종류의 효소만 관여한다.
2017년에는 Pup의 상동체로 추정되는 단백질이 그람 음성 세균 5개 문, 7개의 후보 세균 문, 그리고 하나의 고세균 문에서도 발견되었다는 보고가 있었다.[130] 이 상동체들은 그람 양성 세균의 Pup와 서열상 상당한 차이를 보이며, 세균 유비퀴틴(UBact)이라는 이름이 제안되었다. 그러나 UBact가 Pup와는 별개의 진화적 기원을 가진다는 계통 발생학적 증거나 실험적 증거는 아직 부족하다.[130]
그람 양성 세균과 그람 음성 세균 모두에서 Pup/UBact-프로테아좀 시스템이 발견된다는 점은 두 가지 가능성을 시사한다. 첫째는 이 시스템이 약 30억 년 전, 세균이 그람 양성균과 음성균 계통으로 나뉘기 전에 이미 존재했을 가능성이다.[131] 둘째는 아직 알려지지 않은 제3의 생물체로부터 수평 유전자 전달을 통해 각 세균 계통이 이 시스템을 획득했을 가능성이다. 두 번째 가능성을 뒷받침하는 근거로, 배양되지 않은 혐기성 메탄 영양 고세균(ANME-1)의 게놈에서 두 개의 ''UBact'' 유전자 위치(CBH38808.1 및 CBH39258.1)가 발견되기도 했다.
13. 유비퀴틴화 예측
E3-기질 상호작용의 조절 실패는 여러 인간 질환의 주요 원인이 되기 때문에, E3 유비퀴틴 리가아제 기질을 식별하는 것은 매우 중요하다. 2008년에는 이러한 기질을 발견하기 위해 '전반적인 단백질 안정성(GPS) 프로파일링' 방법이 개발되었다.[120] 이 고처리량 시스템은 수천 개의 잠재적 기질을 분석하여 E3 리가아제 기질 목록에 많은 새로운 기질을 추가하는 데 기여했다.
단백질 내 유비퀴틴화 부위를 예측하기 위한 여러 컴퓨터 프로그램들이 개발되었다. 주요 예측 프로그램은 다음과 같다.
참조
[1]
논문
The discovery of ubiquitin-dependent proteolysis
2005-10
[2]
웹사이트
The Nobel Prize in Chemistry 2004
http://nobelprize.or[...]
Nobelprize.org
2010-10-16
[3]
웹사이트
The Nobel Prize in Chemistry 2004: Popular Information
https://www.nobelpri[...]
Nobelprize.org
2013-12-14
[4]
논문
Isolation of a polypeptide that has lymphocyte-differentiating properties and is probably represented universally in living cells
1975-01
[5]
논문
A heat-stable polypeptide component of an ATP-dependent proteolytic system from reticulocytes. 1978
2012-08
[6]
논문
Molecular evolution of ubiquitin genes.
1987-11
[7]
논문
Regulatory mechanisms involved in the control of ubiquitin homeostasis
2010-06
[8]
논문
Mechanisms underlying ubiquitylation
[9]
논문
Direct identification of a G protein ubiquitylation site by mass spectrometry
2002-04
[10]
논문
A proteomics approach to understanding protein ubiquitylation
2003-08
[11]
논문
Non-canonical ubiquitylation: mechanisms and consequences
2013-08
[12]
논문
A novel site for ubiquitylation: the N-terminal residue, and not internal lysines of MyoD, is essential for conjugation and degradation of the protein
1998-10
[13]
논문
Proteasome-mediated degradation of p21 via N-terminal ubiquitinylation
2003-10
[14]
논문
The ubiquitin-conjugating enzyme (E2) Ube2w ubiquitinates the N terminus of substrates
2013-06
[15]
논문
The N-terminal domain of MyoD is necessary and sufficient for its nuclear localization-dependent degradation by the ubiquitin system
2008-10
[16]
논문
N-Terminal ubiquitylation of extracellular signal-regulated kinase 3 and p21 directs their degradation by the proteasome
2004-07
[17]
논문
N-terminal polyubiquitylation and degradation of the Arf tumor suppressor
2004-08
[18]
논문
The tumor suppressor protein p16(INK4a) and the human papillomavirus oncoprotein-58 E7 are naturally occurring lysine-less proteins that are degraded by the ubiquitin system. Direct evidence for ubiquitylation at the N-terminal residue
2004-10
[19]
논문
Lysine-independent turnover of cyclin G1 can be stabilized by B'alpha subunits of protein phosphatase 2A
2009-02
[20]
논문
Degradation of the E7 human papillomavirus oncoprotein by the ubiquitin-proteasome system: targeting via ubiquitylation of the N-terminal residue
2000-11
[21]
논문
Degradation of the epstein-barr virus latent membrane protein 1 (LMP1) by the ubiquitin-proteasome pathway. Targeting via ubiquitylation of the N-terminal residue
2000-08
[22]
논문
Lysine-independent ubiquitylation of Epstein-Barr virus LMP2A
2002-08
[23]
논문
HSP70 protects BCL2L12 and BCL2L12A from N-terminal ubiquitylation-mediated proteasomal degradation
2009-05
[24]
논문
N-terminal hemagglutinin tag renders lysine-deficient APOBEC3G resistant to HIV-1 Vif-induced degradation by reduced polyubiquitylation
2011-05
[25]
논문
Ubiquitin-Proteasome-mediated degradation of Id1 is modulated by MyoD
2004-07
[26]
논문
Ubiquitin proteasome-dependent degradation of the transcriptional coactivator PGC-1{alpha} via the N-terminal pathway
2010-12
[27]
논문
Degradation of the Id2 developmental regulator: targeting via N-terminal ubiquitylation
2004-02
[28]
논문
Ubiquitylation on canonical and non-canonical sites targets the transcription factor neurogenin for ubiquitin-mediated proteolysis
2009-06
[29]
논문
Non-canonical ubiquitylation of the proneural protein Ngn2 occurs in both Xenopus embryos and mammalian cells
2010-10
[30]
논문
Ube2W conjugates ubiquitin to α-amino groups of protein N-termini
2013-07
[31]
논문
Intrinsic disorder drives N-terminal ubiquitylation by Ube2w
2015-01
[32]
논문
A proteolytic pathway that recognizes ubiquitin as a degradation signal
1995-07
[33]
논문
Ubiquitination of serine, threonine, or lysine residues on the cytoplasmic tail can induce ERAD of MHC-I by viral E3 ligase mK3
2007-05
[34]
논문
Ubiquitination on nonlysine residues by a viral E3 ubiquitin ligase
2005-07
[35]
논문
The specificities of Kaposi's sarcoma-associated herpesvirus-encoded E3 ubiquitin ligases are determined by the positions of lysine or cysteine residues within the intracytoplasmic domains of their targets
2008-04
[36]
논문
A conserved cysteine is essential for Pex4p-dependent ubiquitination of the peroxisomal import receptor Pex5p
2007-08
[37]
논문
Ubiquitination of mammalian Pex5p, the peroxisomal import receptor
2007-10
[38]
논문
A conserved cysteine residue of Pichia pastoris Pex20p is essential for its recycling from the peroxisome to the cytosol
2007-03
[39]
논문
Apoptosis induction by Bid requires unconventional ubiquitination and degradation of its N-terminal fragment
2007-12
[40]
논문
Complex regulation controls Neurogenin3 proteolysis
2012-12
[41]
논문
Multilayered mechanism of CD4 downregulation by HIV-1 Vpu involving distinct ER retention and ERAD targeting steps
2010-04
[42]
논문
Serine-threonine ubiquitination mediates downregulation of BST-2/tetherin and relief of restricted virion release by HIV-1 Vpu
2011-01
[43]
논문
Serine residues in the cytosolic tail of the T-cell antigen receptor alpha-chain mediate ubiquitination and endoplasmic reticulum-associated degradation of the unassembled protein
2010-07
[44]
논문
Ubiquitylation of an ERAD substrate occurs on multiple types of amino acids
2010-12
[45]
논문
Ubiquitin ligases and beyond
2012-03
[46]
논문
Ubiquitin-like protein activation by E1 enzymes: the apex for downstream signalling pathways
2009-05
[47]
논문
Activating the ubiquitin family: UBA6 challenges the field
http://nbn-resolving[...]
2008-05
[48]
논문
The family of ubiquitin-conjugating enzymes (E2s): deciding between life and death of proteins
2010-04
[49]
논문
HECT and RING finger families of E3 ubiquitin ligases at a glance
2012-02
[50]
논문
Control of cell growth by the SCF and APC/C ubiquitin ligases
2009-12
[51]
논문
Ubiquitin: structures, functions, mechanisms
2004-11
[52]
논문
Modification of proteins by ubiquitin and ubiquitin-like proteins
2006
[53]
논문
A novel ubiquitination factor, E4, is involved in multiubiquitin chain assembly
1999-03
[54]
논문
Human mdm2 mediates multiple mono-ubiquitination of p53 by a mechanism requiring enzyme isomerization
2001-08
[55]
논문
Polyubiquitination of p53 by a ubiquitin ligase activity of p300
2003-04
[56]
논문
CBP and p300 are cytoplasmic E4 polyubiquitin ligases for p53
2009-09
[57]
논문
The ubiquitin-proteasome proteolytic pathway: destruction for the sake of construction
2002-04
[58]
논문
Proteasome-independent functions of ubiquitin in endocytosis and signaling
2007-01
[59]
논문
Non-traditional functions of ubiquitin and ubiquitin-binding proteins
2003-09
[60]
논문
The emerging complexity of protein ubiquitination
2009-10
[61]
논문
Atypical ubiquitin chains: new molecular signals. 'Protein Modifications: Beyond the Usual Suspects' review series
2008-06
[62]
논문
A ubiquitin ligase complex assembles linear polyubiquitin chains
2006-10
[63]
논문
Characterization of polyubiquitin chain structure by middle-down mass spectrometry
2008-05
[64]
논문
Protein regulation by monoubiquitin
2001-03
[65]
논문
Protein degradation by the ubiquitin-proteasome pathway in normal and disease states
2006-07
[66]
논문
Regulation of receptors and transporters by ubiquitination: new insights into surprisingly similar mechanisms
2007-06
[67]
논문
Why do cellular proteins linked to K63-polyubiquitin chains not associate with proteasomes?
2013-02
[68]
논문
STAM and Hrs are subunits of a multivalent ubiquitin-binding complex on early endosomes
2003-04
[69]
논문
Mutual regulation of conventional protein kinase C and a ubiquitin ligase complex
https://linkinghub.e[...]
2006-12
[70]
논문
Involvement of linear polyubiquitylation of NEMO in NF-κB activation
http://www.nature.co[...]
2009-02
[71]
논문
Linear ubiquitination prevents inflammation and regulates immune signalling
http://www.nature.co[...]
2011-03
[72]
논문
Non-canonical ubiquitin-based signals for proteasomal degradation
2012-02
[73]
논문
Certain pairs of ubiquitin-conjugating enzymes (E2s) and ubiquitin-protein ligases (E3s) synthesize nondegradable forked ubiquitin chains containing all possible isopeptide linkages
2007-06
[74]
논문
Assembly and specific recognition of k29- and k33-linked polyubiquitin
2015-04
[75]
논문
The ubiquitin code
[76]
논문
Distinct consequences of posttranslational modification by linear versus K63-linked polyubiquitin chains
2010-04
[77]
웹사이트
Ubiquitin Proteasome Pathway Overview
http://www.bostonbio[...]
2008-04-30
[78]
논문
The Ubiquitin Proteasome System Is a Key Regulator of Pluripotent Stem Cell Survival and Motor Neuron Differentiation
2019-06
[79]
논문
Deubiquitinase function of A20 maintains and repairs endothelial barrier after lung vascular injury
2018-05
[80]
논문
The Role of PCNA Posttranslational Modifications in Translesion Synthesis
2010-08
[81]
논문
Regulation of DNA damage responses by ubiquitin and SUMO
2013-03
[82]
논문
Molecular insights into the function of RING finger (RNF)-containing proteins hRNF8 and hRNF168 in Ubc13/Mms2-dependent ubiquitylation
2012-07
[83]
논문
DNA damage-dependent acetylation and ubiquitination of H2AX enhances chromatin dynamics
2007-10
[84]
논문
Ubiquitin-binding protein RAP80 mediates BRCA1-dependent DNA damage response
2007-05
[85]
논문
Ubiquitin-binding domains and their role in the DNA damage response
2009-04
[86]
논문
Roles of ubiquitin signaling in transcription regulation
2012-02
[87]
논문
Regulation and cellular roles of ubiquitin-specific deubiquitinating enzymes
[88]
논문
A genomic and functional inventory of deubiquitinating enzymes
2005-12
[89]
논문
Ubiquitin-binding domains
2005-08
[90]
논문
Ubiquitin-binding proteins: decoders of ubiquitin-mediated cellular functions
2012-01-01
[91]
논문
Ubiquitination in disease pathogenesis and treatment
https://www.nature.c[...]
2014-11
[92]
논문
Proteome Homeostasis Dysfunction: A Unifying Principle in ALS Pathogenesis
https://pubmed.ncbi.[...]
2020-05
[93]
웹사이트
UBQLN1 ubiquilin 1 [ Homo sapiens ]
https://www.ncbi.nlm[...]
National Center for Biotechnology Information
2012-05-09
[94]
논문
Ubiquilin-1 is a molecular chaperone for the amyloid precursor protein
2011-10
[95]
논문
Ubiquitin in the activation and attenuation of innate antiviral immunity
2016-01
[96]
논문
Pattern recognition receptors and inflammation
2010-03
[97]
논문
Regulation of RIG-I Activation by K63-Linked Polyubiquitination
2018
[98]
논문
Identification of mutations in CUL7 in 3-M syndrome
2005-10
[99]
논문
When ubiquitination meets phosphorylation: a systems biology perspective of EGFR/MAPK signalling
2013-07
[100]
논문
Endocytosis and intracellular trafficking of ErbBs
2008-10
[101]
논문
Switches, excitable responses and oscillations in the Ring1B/Bmi1 ubiquitination system
2011-12
[102]
논문
Histone H2A ubiquitination in transcriptional regulation and DNA damage repair
2009-01
[103]
논문
Proteasome inhibitors as potential novel anticancer agents
1999-08
[104]
논문
Clinical Cancer Research 2000: New Agents and Therapies
[105]
논문
Cell cycle regulatory E3 ubiquitin ligases as anticancer targets
2002-12
[106]
논문
Contrasting effects on HIF-1alpha regulation by disease-causing pVHL mutations correlate with patterns of tumourigenesis in von Hippel–Lindau disease
[107]
논문
Mutational analysis of the APC/beta-catenin/Tcf pathway in colorectal cancer
1998-03
[108]
논문
The HPV-16 E6 and E6-AP complex functions as a ubiquitin-protein ligase in the ubiquitination of p53
1993-11
[109]
논문
The MDM2 gene amplification database
1998-08
[110]
논문
The RING heterodimer BRCA1-BARD1 is a ubiquitin ligase inactivated by a breast cancer-derived mutation
2001-05
[111]
논문
Skp2 gene copy number aberrations are common in non-small cell lung carcinoma, and its overexpression in tumors with ras mutation is a poor prognostic marker
[112]
논문
Epidermal growth factor receptor signaling intensity determines intracellular protein interactions, ubiquitination, and internalization
2003-05
[113]
논문
DNA copy number losses in human neoplasms
1999-09
[114]
논문
The ubiquitin-proteasome pathway and its role in cancer
2005-07
[115]
논문
Therapeutic anti-cancer targets upstream of the proteasome
2003-05
[116]
논문
Ubiquitylation of MEKK1 inhibits its phosphorylation of MKK1 and MKK4 and activation of the ERK1/2 and JNK pathways
2003-01
[117]
논문
Autoinhibition and phosphorylation-induced activation mechanisms of human cancer and autoimmune disease-related E3 protein Cbl-b
2011-12
[118]
논문
Germline CBL mutations cause developmental abnormalities and predispose to juvenile myelomonocytic leukemia
2010-09
[119]
논문
Cbl and human myeloid neoplasms: the Cbl oncogene comes of age
2010-06
[120]
논문
Identification of SCF ubiquitin ligase substrates by global protein stability profiling
[121]
논문
MUBs, a family of ubiquitin-fold proteins that are plasma membrane-anchored by prenylation
2006-09
[122]
논문
Ubiquitin and ubiquitin-like proteins as multifunctional signals
2005-08
[123]
논문
Functional roles of ubiquitin-like domain (ULD) and ubiquitin-binding domain (UBD) containing proteins
2009-04
[124]
논문
Ubiquitinated sperm mitochondria, selective proteolysis, and the regulation of mitochondrial inheritance in mammalian embryos
2000-08
[125]
논문
Solution structure of ThiS and implications for the evolutionary roots of ubiquitin
2001-01
[126]
논문
Mechanism of ubiquitin activation revealed by the structure of a bacterial MoeB-MoaD complex
2001-11
[127]
논문
Origin and function of ubiquitin-like proteins
2009-03
[128]
서적
Regulated Proteolysis in Microorganisms
2013
[129]
논문
Rpn11-mediated ubiquitin processing in an ancestral archaeal ubiquitination system
2018-07
[130]
논문
Identification of UBact, a ubiquitin-like protein, along with other homologous components of a conjugation system and the proteasome in different gram-negative bacteria
2017-02
[131]
논문
The Timetree of Prokaryotes: New Insights into Their Evolution and Speciation
2017-02
[132]
논문
Computational identification of ubiquitylation sites from protein sequences
2008-07
[133]
논문
Identification, analysis, and prediction of protein ubiquitination sites
2010-02
[134]
논문
Prediction of ubiquitination sites by using the composition of k-spaced amino acid pairs
[135]
문서
유비퀴틴,유비퀴틴프로테아솜계 등
우리말샘
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

