이온화 에너지
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
이온화 에너지는 원자나 분자에서 전자를 떼어내는 데 필요한 에너지이다. n차 이온화 에너지를 통해 원자 족을 파악할 수 있으며, 광전자 분광학을 이용하여 측정한다. 일반적으로 (N+1)번째 이온화 에너지가 N번째보다 크며, 비활성 기체 배열을 지날 때 큰 변화를 보인다. 주기율표에서 왼쪽에서 오른쪽으로, 또는 위에서 아래로 갈수록 이온화 에너지는 주기적인 경향을 보이지만, 예외도 존재한다. 분자의 경우, 이온화는 분자 구조 변화를 동반하며 단열 및 수직 이온화 에너지가 정의된다. 이온화 에너지 외에도 전자 결합 에너지, 일함수 등이 있으며, 양자역학적 계산 방법을 통해 이온화 에너지를 계산할 수 있다.
더 읽어볼만한 페이지
- 이온 - 이온 빔
이온 빔은 전하를 띤 입자들의 좁은 흐름으로, 전류 밀도와 에너지로 측정되며, 격자형 또는 격자 없는 이온 소스를 통해 생성되어 다양한 과학 및 기술 분야에서 활용된다. - 이온 - 이온원
이온원은 원자나 분자를 이온화하여 이온 빔이나 플라즈마를 만드는 장치로, 전자, 광자, 레이저 등 다양한 방법으로 이온화를 유도하며 질량 분석법, 입자 가속기 등 여러 분야에 응용된다. - 양자화학 - 태양광 발전
태양광 발전은 태양빛을 직류 전기로 변환 후 교류 전기로 변환하여 사용하는 기술로, 다양한 종류의 태양전지 개발과 활용이 증가하고 있으나 초기 투자비용, 간헐성, 환경적 영향 등의 과제를 안고 있다. - 양자화학 - 양공
양공은 반도체 내에서 전자가 빠져나간 자리를 의미하며, 마치 양의 전하를 띠는 입자처럼 행동하여 전기 전도에 기여하고, P형 반도체의 특성을 나타낸다. - 화학적 성질 - 에너지 준위
에너지 준위는 양자 역학적 계에서 입자가 가질 수 있는 특정 에너지 값으로, 원자 내 전자의 양자화된 에너지 상태를 나타내며 분자에서는 전자, 진동, 회전 에너지 준위가 존재하고, 에너지 준위 간 전이는 광자의 흡수 또는 방출을 수반한다. - 화학적 성질 - 양쪽성
양쪽성은 산과 염기 모두로 작용할 수 있는 성질을 나타내며, 브뢴스테드-로우리 이론에 따라 양성자를 주고받을 수 있는 물, 아미노산 등이 대표적이며, 용액의 pH에 따라 산 또는 염기로 작용하는 산화아연 등도 존재한다.
| 이온화 에너지 | |
|---|---|
| 이온화 에너지 | |
| 정의 | 기체 상태의 원자 또는 이온에서 전자 1개를 떼어내어 기체 상태의 양이온으로 만드는 데 필요한 최소한의 에너지이다. |
| 설명 | 원자에서 전자를 떼어내는 데 필요한 에너지로, 중성 원자에서 전자를 제거할 때, 전자는 핵에 의해 가장 강하게 결합되어 있으므로, 가장 높은 에너지를 필요로 한다. 이 전자가 제거되면, 다음 전자를 제거하는 것은 더 쉬워진다. 연속적인 이온화 에너지들은 점점 증가하는 값을 가진다. |
| 로마자 표기 | I-onhwa enerji |
| 단위 | 킬로줄/몰 (kJ/mol), 전자볼트 (eV) |
| 기호 | 'Eᵢ', 'IE', 또는 'IP' |
| 1차 이온화 에너지 | 가장 바깥쪽 궤도의 전자를 떼어낼 때 필요한 에너지. |
| 2차 이온화 에너지 | 첫 번째 전자를 떼어낸 후 두 번째 전자를 떼어낼 때 필요한 에너지. |
| 3차 이온화 에너지 | 두 번째 전자를 떼어낸 후 세 번째 전자를 떼어낼 때 필요한 에너지. |
| 원소 이온화 에너지 경향 | 같은 주기에서는 원자 번호가 증가할수록 이온화 에너지는 대체로 증가한다. 같은 족에서는 원자 번호가 증가할수록 이온화 에너지는 대체로 감소한다. |
| 요약 | 원자나 이온에서 전자 1개를 떼어낼 때 필요한 에너지이며, 주기율표에서 원자 크기 및 유효 핵전하와 관련되어 변화한다. |
| 기타 | 이온화 에너지는 화학 반응의 활성화 에너지와 관련이 있다. |
2. n차 이온화 에너지
'''n차 이온화 에너지'''는 하나의 원자나 분자에서 n-1개의 전자를 떼어낸 후 n번째 전자를 떼어내는 데 드는 에너지이다.
n차 이온화 에너지의 변화 패턴을 조사하여 원자가 몇 족에 속하는지 파악할 수 있다. 주양자수가 줄어들 때(즉, 전자 껍질의 개수가 줄어드는 지점) 이온화 에너지가 그 전까지의 증가율에 비해 아주 큰 폭으로 증가하는 현상을 이용한다. n차 이온화 에너지는 (n = (그 단계의 껍질에 들어 있는 총 전자 수) + 1)의 지점에서 급격히 커진다고 볼 수 있다.
일반적으로 특정 원소의 (''N''+1)번째 이온화 에너지는 ''N''번째 이온화 에너지보다 크다. 다음 이온화 에너지가 같은 전자껍질에서 전자를 제거하는 경우, 이온화 에너지의 증가는 주로 전자가 제거되는 이온의 순전하 증가 때문이다. 더 높은 전하를 띤 이온에서 제거된 전자는 더 큰 정전기적 인력을 경험하므로, 이러한 전자를 제거하는 데는 더 많은 에너지가 필요하다. 또한, 다음 이온화 에너지가 더 낮은 전자껍질에서 전자를 제거하는 경우, 원자핵과 전자 사이의 거리가 크게 감소하여 정전기력과 전자를 제거하기 위해 극복해야 하는 거리 모두 증가한다. 이 두 가지 요인 모두 이온화 에너지를 더욱 증가시킨다.
세 번째 주기 원소에 대한 몇 가지 이온화 에너지 값은 다음 표와 같다.
| 원소 | 첫 번째 | 두 번째 | 세 번째 | 네 번째 | 다섯 번째 | 여섯 번째 | 일곱 번째 |
|---|---|---|---|---|---|---|---|
| Na | 496 | 4,560 | |||||
| Mg | 738 | 1,450 | 7,730 | ||||
| Al | 577 | 1,816 | 2,881 | 11,600 | |||
| Si | 786 | 1,577 | 3,228 | 4,354 | 16,100 | ||
| P | 1,060 | 1,890 | 2,905 | 4,950 | 6,270 | 21,200 | |
| S | 1,000 | 2,295 | 3,375 | 4,565 | 6,950 | 8,490 | 27,107 |
| Cl | 1,256 | 2,260 | 3,850 | 5,160 | 6,560 | 9,360 | 11,000 |
| Ar | 1,520 | 2,665 | 3,945 | 5,770 | 7,230 | 8,780 | 12,000 |
비활성 기체 배열을 지날 때 연속적인 몰 이온화 에너지에서 큰 변화가 발생한다. 예를 들어, 위 표에서 볼 수 있듯이 Mg의 첫 번째와 두 번째 몰 이온화 에너지는 세 번째 이온화 에너지보다 훨씬 작다. 세 번째 이온화 에너지는 Mg2+의 네온 배열에서 2p 전자를 제거하는 데 필요하기 때문이다. 이 2p 전자는 이전에 제거된 3s 전자보다 원자핵에 훨씬 가깝다.
이온화 에너지는 주기율표 내에서 주기적 경향을 보인다. 주기 내에서 왼쪽에서 오른쪽으로 이동하거나 족 내에서 위쪽으로 이동하면 첫 번째 이온화 에너지는 일반적으로 증가한다.[9] 위 표의 Al과 S과 같은 예외도 있다. 주기를 가로질러 원자핵의 핵전하가 증가함에 따라 전자와 양성자 사이의 정전기적 인력이 증가하여 원자 반지름이 감소하고 전자 구름이 원자핵에 더 가까워진다.[10] 특히 가장 바깥쪽 전자가 더 높은 유효 핵전하에 의해 더 단단히 결합되기 때문이다.
주어진 족 내에서 아래로 이동하면 전자는 원자핵에서 더 멀리 떨어져 있는 더 높은 주양자수를 가진 더 높은 에너지 껍질에 위치하며, 따라서 더 느슨하게 결합되어 이온화 에너지가 감소한다. 유효 핵전하는 느리게만 증가하므로 그 영향이 주양자수의 증가보다 약하다.[11]
알칼리 금속 등에서 이온화 에너지가 낮고, 비활성 기체에 가까워짐에 따라 값이 높아지는 경향이 있지만, 베릴륨과 붕소, 질소와 산소 등에서는 그 경향이 약간 역전되는 경우가 있다.[49] 이러한 이유는 원자 궤도함수와 훈트의 규칙을 고려해야 하기 때문이다.
질소 원자와 산소 원자를 예로 들어 설명하면 다음과 같다. 두 원자의 전자 배치는 다음 표와 같다. (이온화 에너지(IE)의 단위는 eV)
N: 1s2 2s2 2p3
IE1:14.53, IE2:29.60
O: 1s2 2s2 2p4
IE1:13.61, IE2:35.12
| 1s | 2s | 2px | 2py | 2pz | |
|---|---|---|---|---|---|
| N | ↑↓ | ↑↓ | ↑ | ↑ | ↑ |
| O | ↑↓ | ↑↓ | ↑↓ | ↑ | ↑ |
광전자 분광학을 이용하여 측정할 수 있다.
일반적으로 같은 주기에서 원자 번호가 증가할수록 이온화 에너지는 증가하고, 같은 족에서는 원자 번호가 증가할수록 감소한다.[12] 비활성 기체 배열을 지날 때 연속적인 몰 이온화 에너지에서 큰 변화가 발생한다.
산소 원자의 첫 번째 이온화 에너지가 질소 원자보다 작은 것은, 2p 궤도에 들어가는 네 번째 전자가 삼중으로 축퇴된 p 궤도 중 어느 하나의 궤도에 서로 다른 스핀 각운동량을 가지고 들어가 전자 사이의 정전기적 반발 에너지가 전자를 불안정하게 만들기 때문이다.
두 번째 이온화 에너지의 경우에는 모두 구별할 수 없는 2p 궤도에서 하나씩 제거하므로, 유효 핵전하가 큰 산소 원자의 IE2가 더 커진다. 이것은 다른 주기에서도 볼 수 있다.
전기 음성도(멀리컨의 전기 음성도)는 전자 친화도와 이온화 에너지의 산술 평균이지만, 전자 친화도에 비해 이온화 에너지가 훨씬 크기 때문에 전기 음성도는 거의 이온화 에너지에 비례한다.
3. 이온화 에너지의 측정
원자의 이온화 에너지(''E''i로 표기)는 광량자(광자) 또는 알려진 에너지로 가속된 전자 중에서 가장 약하게 결합된 원자 전자를 방출하는 데 필요한 최소 에너지를 측정하여 구한다.[7] 이 측정은 단일 원자의 기체 상태에서 수행된다. 비활성 기체만이 단원자 기체로 존재하지만, 다른 기체도 단일 원자로 분리할 수 있다.[8] 또한 많은 고체 원소를 가열하여 단일 원자로 기화할 수 있다. 단원자 증기는 이전에 진공 처리된 두 개의 평행 전극이 전압원에 연결된 관에 포함된다. 이온화 여기는 관의 벽을 통해 도입되거나 내부에서 생성된다.
자외선을 사용하는 경우 파장은 자외선 범위에서 감소된다. 특정 파장(λ)과 빛의 진동수(ν=c/λ, 여기서 c는 광속)에서, 진동수에 비례하는 에너지를 가진 광량자는 가장 약하게 결합된 전자를 제거할 만큼 충분히 높은 에너지를 갖게 된다. 이 전자는 양극으로 끌리고, 광이온화 후 남은 양이온은 음극으로 끌린다. 이 전자와 이온은 관을 통해 전류를 생성한다. 이온화 에너지는 전류의 급격한 증가를 유발한 광자의 에너지 ''hν''i(''h''는 플랑크 상수)와 같다: ''E''i = ''hν''i.
고속 전자를 사용하여 원자를 이온화하는 경우, 이 전자는 유사한 진공관 내부의 전자총에 의해 생성된다. 전자빔의 에너지는 가속 전압으로 제어할 수 있다. 관을 통과하는 이온과 방출된 전자의 전류가 급격하게 시작되는 이 전자의 에너지는 원자의 이온화 에너지와 일치한다.
4. 원자: 값과 경향
이온화 에너지는 주기율표 내에서 주기적 경향을 보인다. 주기 내에서 왼쪽에서 오른쪽으로 이동하거나 족 내에서 위쪽으로 이동하면 첫 번째 이온화 에너지는 일반적으로 증가한다.[9] 주기를 가로질러 원자핵의 핵전하가 증가함에 따라 전자와 양성자 사이의 정전기적 인력이 증가하여 원자 반지름이 감소하고 전자 구름이 원자핵에 더 가까워지기 때문이다.[10] 특히 가장 바깥쪽 전자가 더 높은 유효 핵전하에 의해 더 단단히 결합된다.
주어진 족 내에서 아래로 이동하면 전자는 원자핵에서 더 멀리 떨어져 있는 더 높은 주양자수를 가진 더 높은 에너지 껍질에 위치하며, 따라서 더 느슨하게 결합되어 이온화 에너지가 감소한다. 유효 핵전하는 느리게만 증가하므로 그 영향이 주양자수의 증가보다 약하다.[11]
하지만 이러한 경향에는 예외가 존재한다. 예를 들어, 베릴륨(Be)에서 붕소(B)로, 질소(N)에서 산소(O)로 이동할 때 이온화 에너지 값이 감소한다.[12]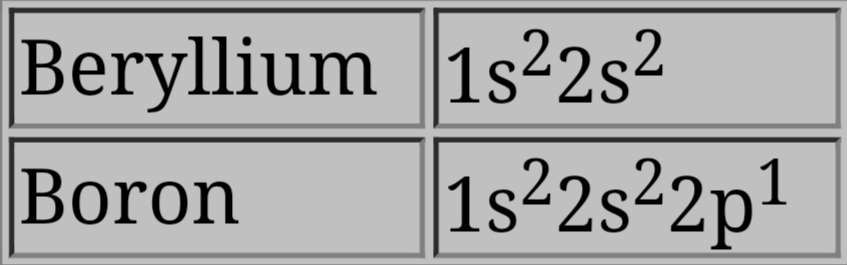
붕소의 경우, 마지막 전자는 2p 궤도에 있으며, 이는 같은 껍질에 있는 2s 전자보다 평균적으로 핵에서 더 멀리 떨어져 있다. 2s 전자가 2p 전자를 핵으로부터 어느 정도 차폐하여, 베릴륨에서 2s 전자를 제거하는 것보다 붕소에서 2p 전자를 제거하는 것이 더 쉽다. 결과적으로 B의 이온화 에너지가 더 낮아진다.[2]
산소의 경우, 마지막 전자는 반대 스핀을 가진 전자와 이중으로 채워진 p-궤도를 공유한다. 같은 궤도에 있는 두 전자는 서로 다른 궤도에 있는 두 전자보다 평균적으로 더 가까이 있으므로, 서로를 핵으로부터 더 효과적으로 차폐하고 전자 하나를 제거하기가 더 쉬워 이온화 에너지가 더 낮아진다.[2][13]
비활성 기체 원소 이후에 이온화 에너지는 급격히 감소한다. 이는 알칼리 금속의 바깥쪽 전자를 원자에서 제거하는 데 필요한 에너지 양이 안쪽 껍질보다 훨씬 적기 때문이다. 이는 또한 알칼리 금속의 낮은 전기 음성도 값을 야기한다.[14][15][16]
같은 족 원소들을 비교할 때, 일반적으로 원자 번호가 클수록 이온화 에너지는 감소하지만,[12] 항상 그런 것은 아니다. 10족 원소인 팔라듐(Pd)의 이온화 에너지는 니켈(Ni)보다 높은데, 이는 테크네튬(Tc)에서 크세논(Xe)까지의 원소에서 일반적으로 나타나는 이온화 에너지 감소 경향과 상반된다.
이러한 경향성과 예외는 원자 궤도와 훈트의 규칙을 고려하여 설명할 수 있다.
4. 1. 이온화 에너지 목록 (kJ/mol)
| 원자번호 | 원소기호 | 원소 이름 | 제1 | 제2 | 제3 | 제4 | 제5 | 제6 | 제7 | 제8 | 제9 | 제10 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | H | 수소 | 1312.0 | |||||||||
| 2 | He | 헬륨 | 2372.3 | 5250.5 | ||||||||
| 3 | Li | 리튬 | 520.2 | 7298.1 | 11815.0 | |||||||
| 4 | Be | 베릴륨 | 899.5 | 1757.1 | 14848.7 | 21006.6 | ||||||
| 5 | B | 붕소 | 800.6 | 2427.1 | 3659.7 | 25025.8 | 32826.7 | |||||
| 6 | C | 탄소 | 1086.5 | 2352.6 | 4620.5 | 6222.7 | 37831 | 47277.0 | ||||
| 7 | N | 질소 | 1402.3 | 2856 | 4578.1 | 7475.0 | 9444.9 | 53266.6 | 64360 | |||
| 8 | O | 산소 | 1313.9 | 3388.3 | 5300.5 | 7469.2 | 10989.5 | 13326.5 | 71330 | 84078.0 | ||
| 9 | F | 플루오린 | 1681.0 | 3374.2 | 6050.4 | 8407.7 | 11022.7 | 15164.1 | 17868 | 92038.1 | 106434.3 | |
| 10 | Ne | 네온 | 2080.7 | 3952.3 | 6122 | 9371 | 12177 | 15238 | 19999.0 | 23069.5 | 115379.5 | 131432 |
| 11 | Na | 나트륨 | 495.8 | 4562 | 6910.3 | 9543 | 13354 | 16613 | 20117 | 25496 | 28932 | 141362 |
| 12 | Mg | 마그네슘 | 737.7 | 1450.7 | 7732.7 | 10542.5 | 13630 | 18020 | 21711 | 25661 | 31653 | 35458 |
| 13 | Al | 알루미늄 | 577.5 | 1816.7 | 2744.8 | 11577 | 14842 | 18379 | 23326 | 27465 | 31853 | 38473 |
| 14 | Si | 규소 | 786.5 | 1577.1 | 3231.6 | 4355.5 | 16091 | 19805 | 23780 | 29287 | 33878 | 38726 |
| 15 | P | 인 | 1011.8 | 1907 | 2914.1 | 4963.6 | 6273.9 | 21267 | 25431 | 29872 | 35905 | 40950 |
| 16 | S | 황 | 999.6 | 2252 | 3357 | 4556 | 7004.3 | 8495.8 | 27107 | 31719 | 36621 | 43177 |
| 17 | Cl | 염소 | 1251.2 | 2298 | 3822 | 5158.6 | 6542 | 9362 | 11018 | 33604 | 38600 | 43961 |
| 18 | Ar | 아르곤 | 1520.6 | 2665.8 | 3931 | 5771 | 7238 | 8781 | 11995 | 13842 | 40760 | 46186 |
| 19 | K | 칼륨 | 418.8 | 3052 | 4420 | 5877 | 7975 | 9590 | 11343 | 14944 | 16963.7 | 48610 |
| 20 | Ca | 칼슘 | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 | 10496 | 12270 | 14206 | 18191 | 20385 |
| 21 | Sc | 스칸듐 | 633.1 | 1235.0 | 2388.6 | 7090.6 | 8843 | 10679 | 13310 | 15250 | 17370 | 21726 |
| 22 | Ti | 티타늄 | 658.8 | 1309.8 | 2652.5 | 4174.6 | 9581 | 11533 | 13590 | 16440 | 18530 | 20833 |
| 23 | V | 바나듐 | 650.9 | 1414 | 2830 | 4507 | 6298.7 | 12363 | 14530 | 16730 | 19860 | 22240 |
| 24 | Cr | 크롬 | 652.9 | 1590.6 | 2987 | 4743 | 6702 | 8744.9 | 15455 | 17820 | 20190 | 23580 |
| 25 | Mn | 망간 | 717.3 | 1509.0 | 3248 | 4940 | 6990 | 9220 | 11500 | 18770 | 21400 | 23960 |
| 26 | Fe | 철 | 762.5 | 1561.9 | 2957 | 5290 | 7240 | 9560 | 12060 | 14580 | 22540 | 25290 |
| 27 | Co | 코발트 | 760.4 | 1648 | 3232 | 4950 | 7670 | 9840 | 12440 | 15230 | 17959 | 26570 |
| 28 | Ni | 니켈 | 737.1 | 1753.0 | 3395 | 5300 | 7339 | 10400 | 12800 | 15600 | 18600 | 21670 |
| 29 | Cu | 구리 | 745.5 | 1957.9 | 3555 | 5536 | 7700 | 9900 | 13400 | 16000 | 19200 | 22400 |
| 30 | Zn | 아연 | 906.4 | 1733.3 | 3833 | 5731 | 7970 | 10400 | 12900 | 16800 | 19600 | 23000 |
| 31 | Ga | 갈륨 | 578.8 | 1979.3 | 2963 | 6180 | ||||||
| 32 | Ge | 저마늄 | 762 | 1537.5 | 3302.1 | 4411 | 9020 | |||||
| 33 | As | 비소 | 947.0 | 1798 | 2735 | 4837 | 6043 | 12310 | ||||
| 34 | Se | 셀레늄 | 941.0 | 2045 | 2973.7 | 4144 | 6590 | 7880 | 14990 | |||
| 35 | Br | 브롬 | 1139.9 | 2103 | 3470 | 4560 | 5760 | 8550 | 9940 | 18600 | ||
| 36 | Kr | 크립톤 | 1350.8 | 2350.4 | 3565 | 5070 | 6240 | 7570 | 10710 | 12138 | 22274 | 25880 |
| 37 | Rb | 루비듐 | 403.0 | 2633 | 3860 | 5080 | 6850 | 8140 | 9570 | 13120 | 14500 | 26740 |
| 38 | Sr | 스트론튬 | 549.5 | 1064.2 | 4138 | 5500 | 6910 | 8760 | 10230 | 11800 | 15600 | 17100 |
| 39 | Y | 이트륨 | 600 | 1180 | 1980 | 5847 | 7430 | 8970 | 11190 | 12450 | 14110 | 18400 |
| 40 | Zr | 지르코늄 | 640.1 | 1270 | 2218 | 3313 | 7752 | 9500 | ||||
| 41 | Nb | 나이오븀 | 652.1 | 1380 | 2416 | 3700 | 4877 | 9847 | 12100 | |||
| 42 | Mo | 몰리브데넘 | 684.3 | 1560 | 2618 | 4480 | 5257 | 6640.8 | 12125 | 13860 | 15835 | 17980 |
| 43 | Tc | 테크네튬 | 702 | 1470 | 2850 | |||||||
| 44 | Ru | 루테늄 | 710.2 | 1620 | 2747 | |||||||
| 45 | Rh | 로듐 | 719.7 | 1740 | 2997 | |||||||
| 46 | Pd | 팔라듐 | 804.4 | 1870 | 3177 | |||||||
| 47 | Ag | 은 | 731.0 | 2070 | 3361 | |||||||
| 48 | Cd | 카드뮴 | 867.8 | 1631.4 | 3616 | |||||||
| 49 | In | 인듐 | 558.3 | 1820.7 | 2704 | 5210 | ||||||
| 50 | Sn | 주석 | 708.6 | 1411.8 | 2943.0 | 3930.3 | 7456 | |||||
| 51 | Sb | 안티모니 | 834 | 1594.9 | 2440 | 4260 | 5400 | 10400 | ||||
| 52 | Te | 텔루륨 | 869.3 | 1790 | 2698 | 3610 | 5668 | 6820 | 13200 | |||
| 53 | I | 아이오딘 | 1008.4 | 1845.9 | 3180 | |||||||
| 54 | Xe | 크세논 | 1170.4 | 2046.4 | 3099.4 | |||||||
| 55 | Cs | 세슘 | 375.7 | 2234.3 | 3400 | |||||||
| 56 | Ba | 바륨 | 502.9 | 965.2 | 3600 | |||||||
| 57 | La | 란타넘 | 538.1 | 1067 | 1850.3 | 4819 | 5940 | |||||
| 58 | Ce | 세륨 | 534.4 | 1050 | 1949 | 3547 | 6325 | 7490 | ||||
| 59 | Pr | 프라세오디뮴 | 527 | 1020 | 2086 | 3761 | 5551 | |||||
| 60 | Nd | 네오디뮴 | 533.1 | 1040 | 2130 | 3900 | ||||||
| 61 | Pm | 프로메튬 | 540 | 1050 | 2150 | 3970 | ||||||
| 62 | Sm | 사마륨 | 544.5 | 1070 | 2260 | 3990 | ||||||
| 63 | Eu | 유로피움 | 547.1 | 1085 | 2404 | 4120 | ||||||
| 64 | Gd | 가돌리늄 | 593.4 | 1170 | 1990 | 4250 | ||||||
| 65 | Tb | 터븀 | 565.8 | 1110 | 2114 | 3839 | ||||||
| 66 | Dy | 디스프로슘 | 573.0 | 1130 | 2200 | 3990 | ||||||
| 67 | Ho | 홀뮴 | 581.0 | 1140 | 2204 | 4100 | ||||||
| 68 | Er | 에르븀 | 589.3 | 1150 | 2194 | 4120 | ||||||
| 69 | Tm | 툴륨 | 596.7 | 1160 | 2285 | 4120 | ||||||
| 70 | Yb | 이터븀 | 603.4 | 1174.8 | 2417 | 4203 | ||||||
| 71 | Lu | 루테튬 | 523.5 | 1340 | 2022.3 | 4370 | 6445 | |||||
| 72 | Hf | 하프늄 | 658.5 | 1440 | 2250 | 3216 | ||||||
| 73 | Ta | 탄탈럼 | 761 | 1500 | ||||||||
| 74 | W | 텅스텐 | 770 | 1700 | ||||||||
| 75 | Re | 레늄 | 760 | 1260 | 2510 | 3640 | ||||||
| 76 | Os | 오스뮴 | 840 | 1600 | ||||||||
| 77 | Ir | 이리듐 | 880 | 1600 | ||||||||
| 78 | Pt | 백금 | 870 | 1791 | ||||||||
| 79 | Au | 금 | 890.1 | 1980 | ||||||||
| 80 | Hg | 수은 | 1007.1 | 1810 | 3300 | |||||||
| 81 | Tl | 탈륨 | 589.4 | 1971 | 2878 | |||||||
| 82 | Pb | 납 | 715.6 | 1450.5 | 3081.5 | 4083 | 6640 | |||||
| 83 | Bi | 비스무트 | 703 | 1610 | 2466 | 4370 | 5400 | 8520 | ||||
| 84 | Po | 폴로늄 | 812.1 | |||||||||
| 85 | At | 아스타틴 | 890±40 | |||||||||
| 86 | Rn | 라돈 | 1037 | |||||||||
| 87 | Fr | 프랑슘 | 380 | |||||||||
| 88 | Ra | 라듐 | 509.3 | 979.0 | ||||||||
| 89 | Ac | 악티늄 | 499 | 1170 | ||||||||
| 90 | Th | 토륨 | 587 | 1110 | 1930 | 2780 | ||||||
| 91 | Pa | 프로탁티늄 | 568 | |||||||||
| 92 | U | 우라늄 | 597.6 | 1420 | ||||||||
| 93 | Np | 넵투늄 | 604.5 | |||||||||
| 94 | Pu | 플루토늄 | 584.7 | |||||||||
| 95 | Am | 아메리슘 | 578 | |||||||||
| 96 | Cm | 퀴륨 | 581 | |||||||||
| 97 | Bk | 버클륨 | 601 | |||||||||
| 98 | Cf | 캘리포늄 | 608 | |||||||||
| 99 | Es | 아인슈타이늄 | 619 | |||||||||
| 100 | Fm | 페르뮴 | 627 | |||||||||
| 101 | Md | 멘델레븀 | 635 | |||||||||
| 102 | No | 노벨륨 | 642 | |||||||||
| 103 | Lr | 로렌슘 | 470 | |||||||||
| 104 | Rf | 러더포듐 | 580 |
4. 2. 이온화 에너지의 예외
주기율표에서 이온화 에너지가 증가하는 일반적인 경향에는 예외가 있다. 예를 들어, 베릴륨(Be: 9.3 eV영어)에서 붕소(B: 8.3 eV영어)로, 질소(N: 14.5 eV영어)에서 산소(O: 13.6 eV영어)로 이동할 때 이온화 에너지 값이 감소한다.[12]붕소의 마지막 전자는 2p 궤도에 있으며, 이는 같은 껍질에 있는 2s 전자보다 평균적으로 핵에서 더 멀리 떨어져 있다. 2s 전자가 2p 전자를 핵으로부터 어느 정도 차폐하여, 베릴륨에서 2s 전자를 제거하는 것보다 붕소에서 2p 전자를 제거하는 것이 더 쉽고, 결과적으로 B의 이온화 에너지가 더 낮아진다.[2]
산소의 마지막 전자는 반대 스핀을 가진 전자와 이중으로 채워진 p-궤도를 공유한다. 같은 궤도에 있는 두 전자는 서로 다른 궤도에 있는 두 전자보다 평균적으로 더 가까이 있으므로, 서로를 핵으로부터 더 효과적으로 차폐하고 전자 하나를 제거하기가 더 쉬워 이온화 에너지가 더 낮아진다.[2][13]
비활성 기체 원소 이후에 이온화 에너지는 급격히 감소한다. 이는 알칼리 금속의 바깥쪽 전자를 원자에서 제거하는 데 필요한 에너지 양이 안쪽 껍질보다 훨씬 적기 때문이다. 이는 알칼리 금속의 낮은 전기 음성도 값을 야기한다.[14][15][16]
주기율표에서 같은 족의 원소들을 비교할 때, 일반적으로 원자 번호가 클수록 이온화 에너지는 감소하는 경향이 있다.[12] 하지만 항상 그런 것은 아니다. 예외적으로 10족 원소인 팔라듐(Pd: 8.34 eV영어)의 이온화 에너지는 니켈(Ni: 7.64 eV영어)보다 높은데, 이는 테크네튬(Tc)에서 크세논(Xe)까지의 원소에서 일반적으로 나타나는 이온화 에너지 감소 경향과 상반된다.
이러한 예외는 다음과 같다.
- 1족:
- 수소의 이온화 에너지는 (13.59844 eV영어로) 알칼리 금속에 비해 매우 높다.[28]
- 프랑슘의 이온화 에너지는 앞선 알칼리 금속인 세슘보다 높다. 이는 상대론적 효과로 인한 작은 이온 반지름 때문이다.[29]
- 2족: 라듐의 이온화 에너지는 앞선 알칼리 토금속인 바륨보다 높은데, 이는 프랑슘과 마찬가지로 상대론적 효과 때문이다.
- 4족:
- 하프늄의 이온화 에너지는 지르코늄과 거의 유사하다. 란타넘족 수축의 영향은 란타넘족 원소 ''이후에도'' 느껴진다.[25]
- 티타늄의 이온화 에너지는 하프늄과 지르코늄보다 작다.
- 5족: 4족과 마찬가지로, 나이오븀과 탄탈럼은 전자 배치와 란타넘족 수축의 영향을 받는 후자 원소 때문에 서로 유사하다.[35]
- 6족: 4족과 5족과 마찬가지로 6족도 아래로 내려갈수록 높은 값을 기록한다. 텅스텐은 전자 배치 때문에 몰리브덴과 유사하다.[36]
- 7족~12족 6주기 원소(레늄, 오스뮴, 이리듐, 백금, 금, 수은): 이 원소들은 각 족에서 앞선 원소들에 비해 매우 높은 이온화 에너지를 가진다. 이는 란타넘족 수축의 영향과 6s 오비탈의 상대론적 안정화 때문이다.
- 13족:
- 갈륨의 이온화 에너지는 알루미늄보다 높다.
- 탈륨의 이온화 에너지는 4f 전자의 불완전한 차폐[37]와 란타넘족 수축으로 인해 앞선 원소인 인듐에 비해 증가한다.
- 14족: 납의 비정상적으로 높은 이온화 에너지(: 7.42 eV영어)는 13족의 탈륨과 마찬가지로 완전히 채워진 5d 및 4f 부껍질의 결과이다.[38][37]
알칼리 금속의 이온화 에너지는 낮고, 비활성 기체에 가까워짐에 따라 값이 높아지는 경향이 있지만, 베릴륨과 붕소, 질소와 산소 등에서는 그 경향이 약간 역전되는 경우가 있다.[49]
질소 원자와 산소 원자를 예로 들어 설명하면 다음과 같다. (IE 단위는 eV)
| 1s | 2s | 2px | 2py | 2pz | |
|---|---|---|---|---|---|
| N | ↑↓ | ↑↓ | ↑ | ↑ | ↑ |
| O | ↑↓ | ↑↓ | ↑↓ | ↑ | ↑ |
산소 원자의 첫 번째 이온화 에너지가 질소 원자보다 작은 것은, 2p 궤도에 들어가는 네 번째 전자가 삼중으로 축퇴된 p 궤도 중 어느 하나의 궤도에 서로 다른 스핀 각운동량을 가지고 들어가 전자 사이의 정전기적 반발 에너지가 전자를 불안정하게 만들기 때문이다.
5. 분자: 수직 및 단열 이온화 에너지
분자의 이온화는 종종 분자 구조의 변화를 초래하며, 두 가지 유형의 (첫 번째) 이온화 에너지, 즉 ''단열적'' 이온화 에너지와 ''수직적'' 이온화 에너지가 정의된다.[43]
분자의 단열 이온화 에너지는 중성 분자에서 전자를 제거하는 데 필요한 ''최소'' 에너지량, 즉 중성 종의 진동 바닥 상태(v" = 0 준위)의 에너지와 양이온(v' = 0)의 에너지 차이이다. 각 종의 특정 평형 기하학적 구조는 이 값에 영향을 미치지 않는다.
이온화에 따른 분자 기하 구조의 변화 가능성으로 인해, 중성 분자의 진동 기저 상태와 양이온의 진동 여기 상태 사이에 추가적인 전이가 존재할 수 있다. 다시 말해, 이온화는 진동 여기를 수반한다. 이러한 전이의 세기는 프랑크-콘돈 원리에 의해 설명되는데, 이 원리는 가장 가능성이 높고 강한 전이는 중성 분자와 같은 기하 구조를 갖는 양이온의 진동 여기 상태에 해당한다고 예측한다. 이 전이는 퍼텐셜 에너지 다이어그램에서 완전히 수직선으로 나타내어지기 때문에 "수직" 이온화 에너지라고 한다 (그림 참조).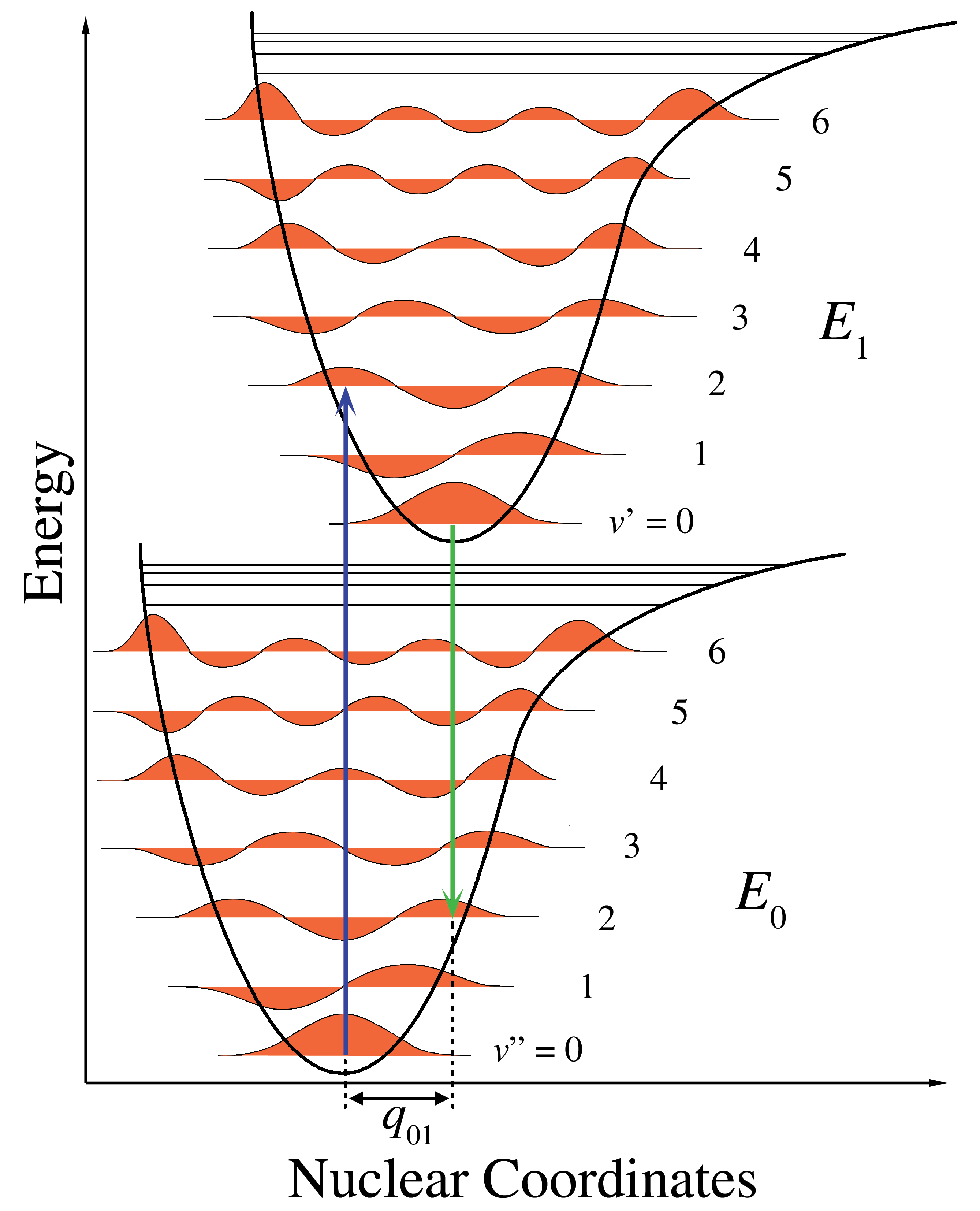
이원자 분자의 경우, 기하 구조는 단일 결합의 길이로 정의된다. 결합 분자 궤도에서 전자를 제거하면 결합이 약해지고 결합 길이가 증가한다. 그림 1에서 아래쪽 퍼텐셜 에너지 곡선은 중성 분자에 대한 것이고, 위쪽 곡면은 양이온에 대한 것이다. 두 곡선 모두 결합 길이의 함수로 퍼텐셜 에너지를 나타낸다. 수평선은 진동 준위와 관련된 진동 파동 함수에 해당한다. 이온은 결합이 약하기 때문에 결합 길이가 더 길다. 이 효과는 퍼텐셜 에너지 곡선의 최소값을 중성 종의 오른쪽으로 이동시켜 나타낸다. 단열 이온화는 이온의 진동 기저 상태로의 대각선 전이이다. 수직 이온화는 이온 상태의 진동 여기를 포함할 수 있으며, 따라서 더 많은 에너지를 필요로 한다.
많은 경우, 단열 이온화 에너지는 두 퍼텐셜 에너지 곡면 사이의 에너지 차이를 나타내기 때문에 더욱 흥미로운 물리량이다. 그러나 실험적 제한으로 인해 단열 이온화 에너지는 종종 결정하기 어려운 반면, 수직 이온화 에너지는 쉽게 식별하고 측정할 수 있다.
6. 다른 시스템에 대한 이온화 에너지의 유사체
이온화 에너지라는 용어는 주로 기체 상태의 원자, 양이온 또는 분자 종에만 사용되지만, 다른 물리적 시스템에서 전자를 제거하는 데 필요한 에너지의 양을 나타내는 여러 유사 개념들이 있다.
6. 1. 전자 결합 에너지
이온화 에너지는 주로 기체 상태의 원자, 양이온 또는 분자 종에 사용되지만, 다른 물리적 시스템에서 전자를 제거하는 데 필요한 에너지량을 고려하는 여러 유사한 양들이 있다.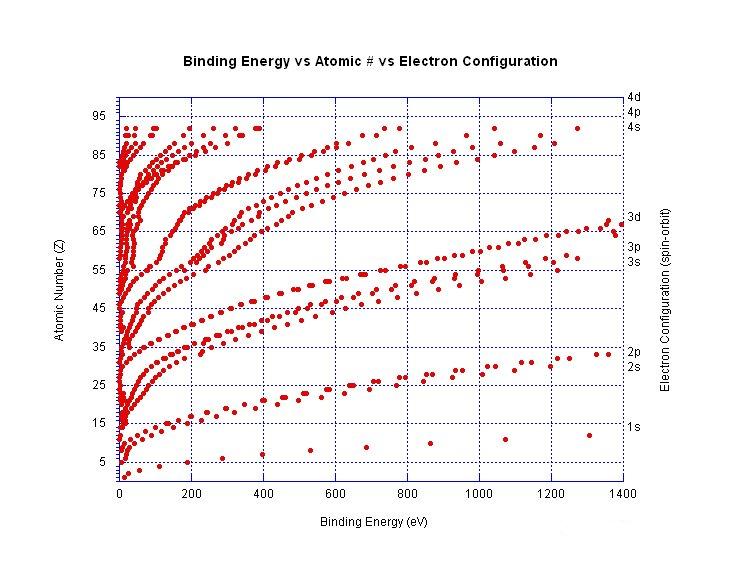
전자 결합 에너지는 원자 또는 이온의 특정 전자껍질에서 전자를 제거하는 데 필요한 최소 에너지를 나타내는 일반적인 용어이다. 이는 음전하를 띤 전자가 양전하를 띤 원자핵의 정전기적 인력에 의해 제자리에 고정되어 있기 때문이다.[44] 예를 들어, 염화 이온에서 3p3/2 전자를 제거하기 위한 전자 결합 에너지는 -1의 전하를 띤 염소 원자에서 전자를 제거하는 데 필요한 최소 에너지량이다. 이 특정 예에서 전자 결합 에너지는 중성 염소 원자의 전자 친화도와 같은 크기를 갖는다. 또 다른 예로, 전자 결합 에너지는 디카르복실레이트 이온 −O2C(CH2)8CO2−에서 전자를 제거하는 데 필요한 최소 에너지량을 나타낸다.
오른쪽 그래프는 중성 원자에서 다른 껍질의 전자에 대한 결합 에너지를 보여준다. 이온화 에너지는 특정 원자에 대한 가장 낮은 결합 에너지이다.
6. 2. 고체 표면: 일함수
일함수는 고체 표면에서 전자를 제거하는 데 필요한 최소 에너지량이며, 주어진 표면의 일함수 ''W''는 다음 식으로 정의된다.[45]:
여기서 -''e''는 전자의 전하량, ''ϕ''는 표면 근처 진공 상태의 정전기적 전위, ''E''F는 물질 내부의 페르미 준위(전기화학적 전위)이다.
7. 양자 역학적 설명
양자역학 이론에 따르면, 전자의 위치는 전자구름, 즉 원자 궤도함수 내의 확률 분포로 설명된다.[40][41] 에너지는 이 구름에 대한 적분을 통해 계산할 수 있다. 구름의 기본적인 수학적 표현은 파동 함수이며, 이는 분자 스핀 궤도함수로 구성된 슬레이터 행렬식으로 구성된다. 이들은 파울리의 배타 원리에 의해 원자 또는 분자 궤도함수의 반대칭화된 곱과 관련이 있다.
이온화 에너지를 계산하는 방법은 크게 두 가지가 있다. 첫 번째는 ''N''번째 이온화 에너지 계산에 및 전자계의 에너지를 계산하는 것이다. 그러나 전자 상관 항을 적분하는 데 어려움이 있어, 가장 간단한 계(수소 및 수소 유사 원소)를 제외하고는 이러한 에너지를 정확하게 계산하는 것은 불가능하다. 따라서 근사법이 일반적으로 사용되며, 방법마다 복잡성(계산 시간)과 실험 데이터에 대한 정확도가 다르다. 이는 계산 화학에서 일반적으로 수행되는 잘 연구된 문제이다.
두 번째 방법은 주로 가장 낮은 수준의 근사에서 사용된다. 이 방법은 쿠프만스 정리를 이용하는데, 이 정리에 따르면 원자 또는 분자의 이온화 에너지는 전자가 방출되는 궤도( 최고 점유 분자 궤도함수(HOMO)) 에너지의 음수 값과 같다.[42] 즉, 이온화 에너지는 HOMO 에너지의 음수 값과 같으며, 다음 공식으로 표현할 수 있다.
:
참조
[1]
웹사이트
Periodic Trends
https://chem.librete[...]
2020-09-13
[2]
서적
Inorganic Chemistry
Prentice Hall
1999
[3]
웹사이트
Ionization Energy
https://web.archive.[...]
University of California, Davis
2014-01-05
[4]
웹사이트
Chapter 9: Quantum Mechanics
https://web.archive.[...]
2020-10-31
[5]
문서
ionization potential
[6]
서적
Advanced Inorganic Chemistry
John Wiley
1988
[7]
웹사이트
Ionization Energy
https://archive.org/[...]
College of Chemistry, University of California Berkeley
1962
[8]
웹사이트
Monatomic Gas - an overview
https://www.scienced[...]
2022-01-08
[9]
웹사이트
Atomic Structure : Periodic Trends
https://web.archive.[...]
Texas A&M University
2020-12-19
[10]
웹사이트
Anomalous trends in ionization energy
https://chemistry.st[...]
2020-09-20
[11]
서적
General Chemistry
Prentice Hall
2002
[12]
웹사이트
Ionization Energy Trends
https://www.grandine[...]
2020-09-13
[13]
웹사이트
First Ionization Energy
https://www.kentchem[...]
KentChemistry
2020-12-06
[14]
웹사이트
Group IA
https://chemed.chem.[...]
2020-09-20
[15]
웹사이트
Alkali Metals
http://hyperphysics.[...]
2020-09-13
[16]
웹사이트
The Alkali Metals
https://courses.lume[...]
2020-09-13
[17]
웹사이트
Chemical elements listed by ionization energy
https://www.lenntech[...]
Lenntech BV
2020-12-06
[18]
웹사이트
The Parts of the Periodic Table
https://web.archive.[...]
Angelo State University
2020-12-19
[19]
웹사이트
18.10: The Group 6A Elements
https://chem.librete[...]
2020-09-20
[20]
웹사이트
Covalent Radius for all the elements in the Periodic Table
https://periodictabl[...]
2020-09-13
[21]
웹사이트
Some Comments on the Position of Lawrencium in the Periodic Table
https://web.archive.[...]
2015-09-20
[22]
서적
Sterling Dictionary of Physics
Sterling Publishers Pvt. Ltd
1999
[23]
서적
Chemistry of the Elements
[24]
eBook
Inorganic Chemistry
https://www.pearson.[...]
Pearson Prentice-Hall
1993-11-01
[25]
서적
Advanced Inorganic Chemistry
[26]
논문
Modern Inorganic Chemistry (Jolly, William L.)
1985
[27]
웹사이트
Patterns and trends in the periodic table - Periodicity - Higher Chemistry Revision
https://www.bbc.co.u[...]
2020-09-20
[28]
웹사이트
Ionization Energies
https://chem.librete[...]
2020-09-20
[29]
웹사이트
IYPT 2019 Elements 087: Francium: Not the most reactive Group 1 element
https://www.compound[...]
2020-09-20
[30]
웹사이트
Hafnium
https://www.gordonen[...]
Gordon England
2020-12-07
[31]
웹사이트
Zirconium (Element) - Atomic Radius
https://pubchem.ncbi[...]
PubChem
2020-12-08
[32]
논문
Atomic Radii in Crystals
1964-11-15
[33]
웹사이트
WebElements Periodic Table » Titanium » radii of atoms and ions
https://www.webeleme[...]
2020-09-20
[34]
웹사이트
Periodic Table of the Elements: Zirconium - Electronic configuration
https://www.tabulka.[...]
2020-09-20
[35]
웹사이트
Tantalum
https://www.britanni[...]
2020-09-20
[36]
논문
Patty's Toxicology
[37]
학술지
Ionization Energies of Atoms and Atomic Ions
2003-08-00
[38]
웹사이트
The Group 14 elements
https://www.webeleme[...]
2015-12-02
[39]
학술지
I. On the constitution of atoms and molecules
https://zenodo.org/r[...]
1913-07-00
[40]
웹사이트
Orbitals, Electron Clouds, Probabilities, and Energies
https://chem.librete[...]
UC Davis ChemWiki
2019-05-23
[41]
웹사이트
Quantum numbers and orbitals- The quantum mechanical model of the atom
https://www.khanacad[...]
[42]
웹사이트
Background Reading for Ionization Energy
https://www.shodor.o[...]
The Shodor Education Foundation, Inc.
2000-00-00
[43]
웹사이트
The difference between a vertical ionization energy and adiabatic ionization energy
http://cccbdb.nist.g[...]
National Institute of Standards and Technology
[44]
웹사이트
Electron binding energy
https://radiopaedia.[...]
Radiopaedia
2019-00-00
[45]
논문
Introduction to Solid State Physics
https://doku.pub/doc[...]
John Wiley & Sons, Inc.
1996-01-01
[46]
웹사이트
ionization energy
[47]
서적
Shriver & Atkins (2001)
[48]
서적
Shriver & Atkins (2001)
[49]
서적
Shriver & Atkins (2001)
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

