결합 에너지
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
결합 에너지는 특정 분자 내에서 동일한 유형의 모든 결합에 대한 결합 해리 에너지의 평균값이다. 물 분자의 결합 에너지를 예로 들어 설명하며, 원자 반지름을 비교하여 결합 세기를 예측하는 방법과 이온 결합에서 전기 음성도가 미치는 영향, 격자 에너지와의 관계를 설명한다.
더 읽어볼만한 페이지
- 화학 결합 - 원자가 전자
원자가 전자는 원자의 최외각 전자껍질에 존재하며 화학적 성질을 결정하는 데 중요한 역할을 하고, 주족 원소는 최외각 전자껍질의 전자로 정의되지만 전이 원소는 (n-1)d 궤도의 전자도 포함하며, 주기율표 족에 따라 예측 가능하지만 예외도 존재하고, 화학 결합, 산화 상태, 전기 전도도에 영향을 미친다. - 화학 결합 - 파울리 배타 원리
파울리 배타 원리는 1925년 볼프강 파울리가 제시한 양자역학 원리로, 동일한 페르미온은 동일한 양자 상태에 존재할 수 없으며, 원자의 전자 배치, 화학 결합, 천체 특성 등을 설명하는 데 중요한 역할을 한다.
2. 결합 에너지와 결합 해리 에너지
결합 에너지(''BE'')는 주어진 분자 내에서 단일 유형의 결합에 대한 모든 결합 해리 에너지의 평균값이다.[7] 동일한 유형의 여러 다른 결합의 결합 해리 에너지는 단일 분자 내에서도 다를 수 있다.
2. 1. 물 분자의 결합 에너지
물 분자는 H–O–H로 결합된 두 개의 O–H 결합으로 구성된다. H₂O의 결합 에너지는 두 개의 O–H 결합 각각을 순차적으로 끊는 데 필요한 평균 에너지이다.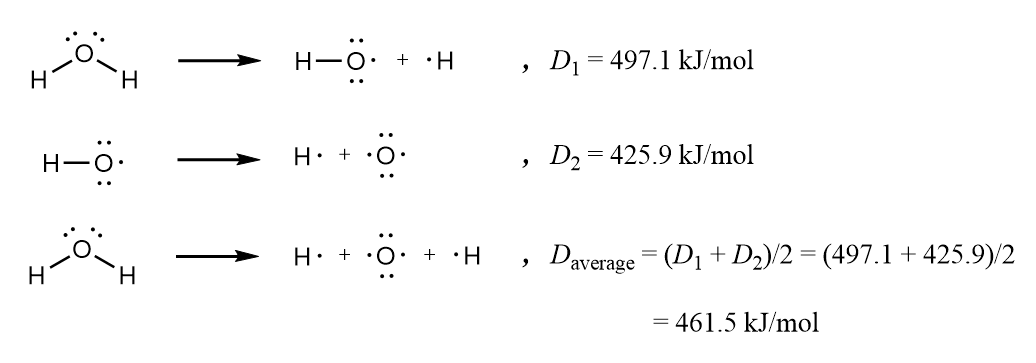
두 결합이 원래의 대칭 분자에서 동일하지만, 산소–수소 결합의 결합 해리 에너지는 산소 원자에 다른 수소 원자가 결합되어 있는지 여부에 따라 약간 다르다. 따라서 물 분자의 결합 에너지는 461.5kJ/mol(110.3kcal/mol)이다.[8]
2. 2. 균일 분해
결합이 끊어지면 결합 전자쌍은 생성물에 균등하게 분리된다. 이 과정을 균일 분해(균일 분해; 균일 분열)라고 하며 라디칼 형성을 초래한다.[9]3. 원자 반지름을 이용한 결합 세기 예측
결합의 세기는 결합을 형성하는 원자의 원자 반지름과 결합 길이의 비교를 통해 예측할 수 있다.
예를 들어 붕소의 원자 반지름(85pm)과 B₂Cl₄의 B-B 결합 길이(175 pm) 비율은 1.03이다.[10][11] 이 값은 1보다 약간 커서 B-B 결합은 약한 단일 결합으로 볼 수 있다. 반면 레늄의 원자 반지름(135 pm)과 [Re₂Cl₈]²⁻ 화합물 내 Re-Re 결합 길이(224 pm) 비율은 0.83으로,[10] 1보다 현저히 작아 Re-Re 결합은 매우 강한 결합임을 알 수 있다. 실제로 [Re₂Cl₈]²⁻의 Re-Re 결합은 사중 결합으로 확인되었다.[12] 이러한 결합 세기 예측 방법은 공유 결합 화합물에 유용하다.[13]
3. 1. 붕소-붕소 결합 (B-B)
붕소의 원자 반지름은 약 85 pm이며,[10] B₂Cl₄에서 B-B 결합 길이는 175 pm이다.[11] 결합 길이를 각 붕소 원자 반지름의 합으로 나누면 1.03으로, 1보다 약간 크다. 이는 B-B 결합이 상대적으로 약한 단일 결합임을 시사한다.3. 2. 레늄-레늄 결합 (Re-Re)
레늄의 원자 반지름은 135 pm이며,[10] [Re₂Cl₈]²⁻ 화합물에서 Re-Re 결합 길이는 224 pm이다. 결합 길이를 각 레늄 원자 반지름의 합으로 나누면 다음과 같다.:
이 비율은 1보다 현저히 낮아서, 두 레늄 원자의 원자가 전자 구름 사이에 많은 양의 겹침이 있다는 것을 나타낸다. 따라서, Re-Re 결합은 매우 강한 결합이라고 결론 내릴 수 있다. 실험적으로, [Re₂Cl₈]²⁻의 Re-Re 결합은 사중 결합으로 밝혀졌다.[12]
3. 3. 결합 세기 예측 방법의 유용성
결합의 세기는 결합을 형성하는 원자의 원자 반지름을 결합 자체의 길이와 비교하여 추정할 수 있다. 이러한 예측 방법은 공유 결합 화합물에 가장 유용하다.[13]예를 들어, 붕소의 원자 반지름은 85 pm로 추정되며,[10] B₂Cl₄의 B-B 결합 길이는 175 pm이다.[11] 이 결합의 길이를 각 붕소 원자 반지름의 합으로 나누면 1.03의 비율을 얻을 수 있다. 이 비율은 1보다 약간 커서, 결합 자체가 두 붕소 원자의 원자가 전자 구름 사이의 예상 최소 겹침보다 약간 더 길다는 것을 나타내며, 따라서 이 결합이 상당히 약한 단일 결합이라고 결론 내릴 수 있다.
다른 예로, 레늄의 원자 반지름은 135 pm이며,[10] [Re₂Cl₈]⁻² 화합물에서 Re-Re 결합 길이는 224 pm이다. 위와 동일한 단계를 거치면 0.83의 비율을 얻을 수 있다. 이 비율은 1보다 현저히 낮아서, 두 레늄 원자의 원자가 전자 구름 사이에 많은 양의 겹침이 있다는 것을 나타낸다. 이 데이터를 통해, 우리는 이것이 매우 강한 결합이라고 결론 내릴 수 있다. 실험적으로, [Re₂Cl₈]⁻²의 Re-Re 결합은 사중 결합으로 밝혀졌다.[12]
4. 이온 결합 에너지에 영향을 미치는 요인
이온 화합물에서 결합하는 두 원자의 전기 음성도 차이는 결합 에너지에 큰 영향을 미치며, 이는 격자 에너지로 설명된다.[14] 격자 에너지가 더 음의 값을 가질수록 이온 간의 인력이 강해지는데, 일반적으로 전기 음성도 차이가 클수록 이온 결합이 강해진다.[15][16]
4. 1. 전기 음성도와 격자 에너지
이온 화합물에서, 결합하는 두 원자의 전기 음성도는 결합 에너지에 큰 영향을 미친다.[14] 이러한 영향의 정도는 화합물의 격자 에너지로 설명되며, 더 음의 격자 에너지는 이온 간의 더 강한 인력에 해당한다. 일반적으로 전기 음성도의 차이가 클수록 이온 결합이 강해진다. 예를 들어, 염화 나트륨(NaCl) 화합물은 나트륨과 염소 사이의 전기 음성도 차이가 2.23으로 격자 에너지가 -786kJ/mol이다. 반면, 요오드화 나트륨(NaI) 화합물은 나트륨과 요오드 사이의 전기 음성도 차이가 1.73으로 더 낮아 격자 에너지가 -704kJ/mol로 낮다.[15][16]4. 2. 염화 나트륨(NaCl)과 요오드화 나트륨(NaI)의 비교
이온 화합물에서 결합하는 두 원자의 전기 음성도는 결합 에너지에 큰 영향을 미친다.[14] 이러한 영향의 정도는 화합물의 격자 에너지로 설명되며, 더 음의 격자 에너지는 이온 간의 더 강한 인력에 해당한다. 일반적으로 전기 음성도의 차이가 클수록 이온 결합이 강해진다. 예를 들어 염화 나트륨(NaCl) 화합물은 나트륨과 염소 사이의 전기 음성도 차이가 2.23으로 격자 에너지가 -786 kJ/mol이다. 반면 요오드화 나트륨(NaI) 화합물은 나트륨과 요오드 사이의 전기 음성도 차이가 1.73으로 더 낮아 격자 에너지가 -704 kJ/mol로 낮다.[15][16]참조
[1]
논문
Strength of Chemical Bonds
1973-03-01
[2]
문서
REDIRECT
[3]
논문
Bond Energies and Enthalpies: An Often Neglected Difference
[4]
서적
CRC Handbook of Chemistry and Physics, 97th Edition (CRC Handbook of Chemistry & Physics) 97th Edition
CRC Press; 97 edition
2016–2017
[5]
문서
Luo, Yu-Ran and Jin-Pei Cheng "Bond Dissociation Energies". In Lide, David R. (ed) 2017, ''CRC Handbook of Chemistry and Physics'', 97th edition (2016–2017). Boca Raton: Taylor & Francis Group. 9-73.
[6]
문서
Bond energy (mean bond energy)
[7]
문서
Madhusha (2017), Difference Between Bond Energy and Bond Dissociation Energy, Pediaa
https://pediaa.com/d[...]
[8]
서적
Lehninger principles of biochemistry
W.H. Freeman
2005
[9]
웹사이트
Illustrated Glossary of Organic Chemistry - Homolytic cleavage (homolysis)
http://www.chem.ucla[...]
2019-11-27
[10]
논문
Atomic Radii in Crystals
https://pubs.aip.org[...]
1964-11-15
[11]
논문
Crystal and Molecular Structure of Diboron Tetrachloride, B2Cl4
https://doi.org/10.1[...]
1957-07-01
[12]
논문
Mononuclear and Polynuclear Chemistry of Rhenium (III): Its Pronounced Homophilicity
https://www.science.[...]
1964-09-18
[13]
서적
Bonding and Structure: Structural Principles in Inorganic and Organic Chemistry
Ellis Horwood
1990
[14]
서적
Handbook of Chemistry & Physics
CRC Press
1984-06-27
[15]
서적
Shriver and Atkins' Inorganic Chemistry
W. H. Freeman and Company
[16]
서적
Inorganic chemistry: principles of structure and reactivity
Harper
2009
[17]
문서
Clark, J (2013), BOND ENTHALPY (BOND ENERGY), Chemguide
https://www.chemguid[...]
[18]
논문
Strength of chemical bonds
1973-03-01
[19]
문서
넘겨주기
[20]
논문
Bond Energies and Enthalpies: An Often Neglected Difference
[21]
문서
Schmidt-Rohr, K. (2015). "Why Combustions Are Always Exothermic, Yielding About 418 kJ per Mole of O2", ''J. Chem. Educ.'' '''92''': 2094-2099.
http://dx.doi.org/10[...]
[22]
서적
CRC Handbook of Chemistry and Physics, 97th Edition (CRC Handbook of Chemistry & Physics) 97th Edition
https://archive.org/[...]
CRC Press; 97 edition
2016-2017
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com