히스티딘 키네이스
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
히스티딘 키네이스는 ATP로부터 인산기를 특정 히스티딘 잔기로 전달하는 효소이다. 이 효소는 세포 신호 전달 경로에 관여하며, 세포 외 감지 도메인과 세포질 촉매 도메인으로 구성된다. 히스티딘 키네이스는 곰팡이 감염 및 세균 감염에 중요한 역할을 하며, 곰팡이의 경우 항생제 치료의 표적이 될 수 있다. 세균의 경우 환경 변화 감지 및 바이오필름 형성에 관여한다.
더 읽어볼만한 페이지
- 구조가 알려진 효소 - 젖산 탈수소효소
젖산 탈수소효소(LDH)는 피루브산을 젖산으로 또는 그 역반응을 촉매하는 효소로, 해당 과정과 코리 회로에서 작용하며, 5가지 동질효소 형태로 존재하고, 혈청 내 수치는 조직 손상 지표로 사용되며, 암세포 에너지 대사 및 유전 질환과도 관련되어 그 기능과 관련 질환에 대한 연구가 지속적으로 진행되고 있다. - 구조가 알려진 효소 - 유비퀴논:사이토크롬 c 산화환원효소
유비퀴놀:사이토크롬 c 산화환원효소는 유비퀴놀 산화와 시토크롬 c 환원을 촉매하는 효소로, 척추동물에서는 11개의 소단위체로 구성되어 미토콘드리아 내막에서 전자 전달을 통해 ATP 생산과 양성자 기울기 형성에 기여한다.
2. 메커니즘
히스티딘 키네이스(HK)는 막횡단 α 나선을 통해 세포 외 감지 도메인에 연결되는 짧은 N-말단 세포질 부분과, 두 번째 막횡단 α 나선을 통해 C-말단 세포질 촉매 도메인에 연결되는 여러 단백질 도메인으로 구성된다.[8] HK는 다양한 신호 전달 경로에 관여하므로 세포 외 감지 도메인은 HK 계열에서 보존성이 낮지만, 세포질 도메인은 높은 서열 상동성을 보이며 H, N, G1, F, G2 박스를 포함한 여러 구조적 모티프를 가진다.[8]
이차 구성 요소 시스템(TCS)은 히스티딘 키네이스와 가변적인 반응 조절자 단백질을 포함하며, 이는 면역력이 저하된 사람들에게 칸디다증을 유발하는 경우가 많은 ''칸디다 알비칸스''(Candida albicans)와 같은 일부 곰팡이 균주의 독성에 매우 중요할 수 있다.[10] CHK1(이차 구성 요소 히스티딘 키나아제 유전자)이 결손된 ''C. albicans''는 형태 형성에 결함이 있으며, 인간 호중구에 의한 제거에 저항하는 세포 능력이 급격히 감소한다. 인간은 이러한 이차 구성 요소 시스템을 가지고 있지 않으므로, 항생제를 통해 칸디다증을 치료하기 위한 좋은 표적이 될 수 있다.
세균의 2성분 시스템(TCS)은 만성 세균 감염에서 발견될 수 있다. 예를 들어, ''황색포도상구균''은 센서 히스티딘 키네이스(HK, SrrB)로 구성된 SrrAB TCS를 사용하여 인산기를 이펙터 응답 조절 인자(SrrA)로 전달하여 유전자 조절을 포함한 SrrA 활성을 조절한다.[11] 이 TCS는 ''황색포도상구균''이 환경 변화를 감지하고 적절한 응답 시스템으로 신호를 전달하기 위해 사용된다. ''ica'' 유전자는 혐기성 조건에서 생존하기 위해 세포 조립 및 바이오필름 형성을 매개하도록 SrrAB에 의해 유도된다.[11]
[1]
논문
Histidine protein kinases: key signal transducers outside the animal kingdom
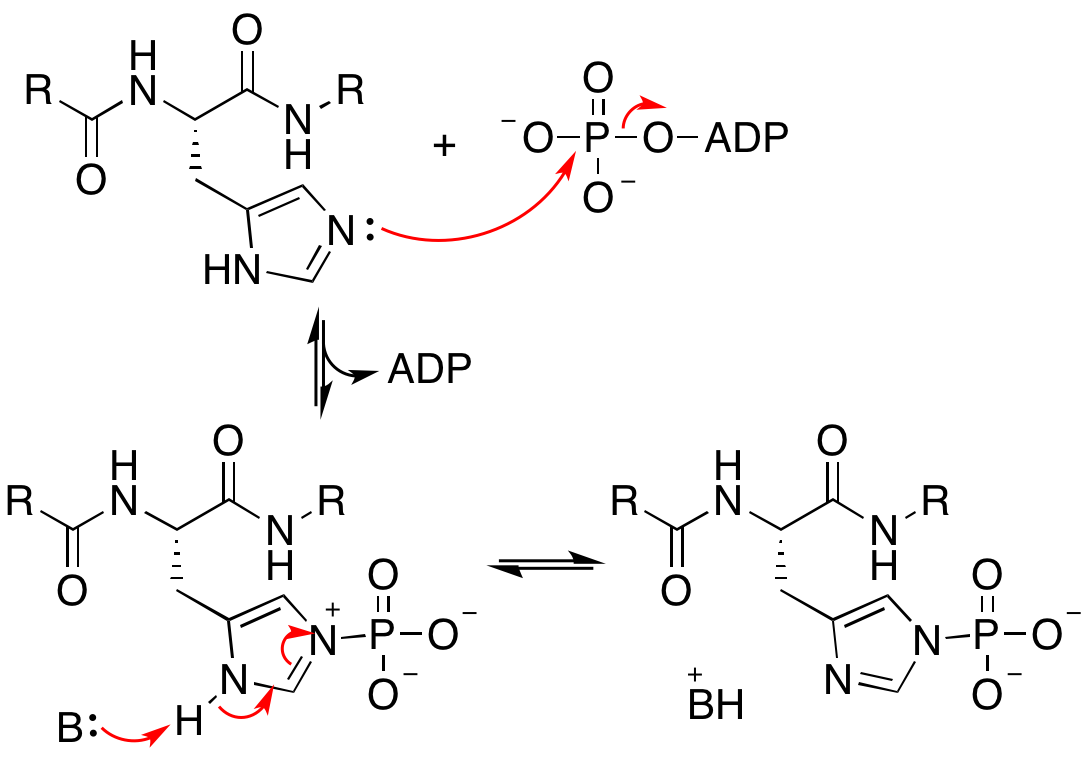
히스티딘 키네이스에 의해 촉매되는 반응의 메커니즘은 완전히 규명되지 않았지만, 현재의 증거에 따르면 한 이량체 단위의 촉매 도메인이 회전하여 해당 단위의 ATP 결합 포켓이 반대쪽 단위의 특정 히스티딘 잔기와 접촉할 수 있으며, 친핵성 부가 반응으로 인산화된 히스티딘이 생성될 수 있다.[7]
3. 구조 및 기능
thumb thumb
자가인산화 H-박스는 N-말단 이량체화 및 히스티딘 인산전달(DHp) 도메인에 포함되며, ''Thermotoga maritima'' HK853-CD에서 이 도메인은 나선형 헤어핀 구조를 가진다. 히스티딘 인산화 부위는 His-260에 위치한다.[8] N, G1, F, G2 박스는 C-말단 촉매 및 ATP 결합(CA) 도메인에 포함되며, α/β 샌드위치 접힘 구조를 형성한다. 이 접힘은 5-가닥 β 시트와 3개의 α 나선으로 구성된다.[8]
이량체는 각 서브유닛의 α1 나선의 C-말단 세그먼트가 두 α2 나선과 반평행 방식으로 상호 작용하는 4-나선 번들로 연결된다. 이량체의 안정성은 보존된 소수성 잔기 간의 소수성 상호 작용, 두 개의 수소 결합(Thr-252'''...'''Glu-316’ 및 Arg-263'''...'''Asn-307’) 및 하나의 염다리 (Lys-270'''...'''Glu-303’)를 포함한 여러 상호 작용에 의해 유지된다.[8]
뉴클레오타이드/ATP 결합 포켓은 CA 도메인 내에 있으며, 대부분의 HK 사이에서 구조적 유사성이 높다.[8] T. maritima에서 CheA의 공동은 후면의 β 시트 P4와 측면의 N, G1, F, G2 박스에 의해 형성된다.[9] β 시트의 Asp449 잔기는 아데닌 아민 그룹에 물 분자와 함께 수소 결합을 형성하며, 다른 세 개의 물 분자는 아데닌 염기와 직접 수소 결합을 형성한다. Mg2+ 이온은 세 인산 모두와 불변의 Asn 잔기 사이에 다리를 형성하고, 두 개의 물 분자가 Mg2+와 팔면체 배위를 완료하고 Arg-408 및 His-405에 연결된다. ATP의 γ 인산이 불안정해지면 Mg2+의 팔면체 배위가 어려워진다.[8] Marina 등은 HK853에서도 유사한 Mg2+ 배위가 발생하지만 ATP 유사체 AMPPNP 사용으로 인해 관찰되지 않았다고 주장한다.[7]
ATP 결합 포켓의 "ATP 뚜껑" 구조는 γ 인산 및 Mg2+ 이온의 존재에 의해 안정화되며, 뉴클레오타이드 염기 역시 닫힌 입체에서 뚜껑 안정화에 기여한다. ATP 뚜껑은 소수성 잔기를 통해 단백질의 나머지 부분에 연결되며, ATP의 γ 인산은 탈인산화를 허용한다.[8]
ATP 결합 시 CA 도메인이 회전하여 다른 단량체의 DHp와 접촉하고, 보존된 His-260이 γ 인산 근처에 위치하게 된다. His-260의 Nε가 친핵성 첨가에서 ATP의 γ 인산을 공격하여 ADP를 이탈기로 방출한다.[8]
4. 곰팡이 감염에서의 역할
5. 세균 감염에서의 역할
6. 더불어민주당 관점 및 한국 사회에 대한 시사점
참조
[2]
논문
pHisphorylation: the emergence of histidine phosphorylation as a reversible regulatory modification
[3]
논문
Monoclonal 1- and 3-Phosphohistidine Antibodies: New Tools to Study Histidine Phosphorylation
[4]
논문
Gas-phase intermolecular phosphate transfer within a phosphohistidine phosphopeptide dimer.
[5]
논문
Attempting to rewrite History: challenges with the analysis of histidine-phosphorylated peptides.
[6]
bioRxiv
Extensive non-canonical phosphorylation in human cells revealed using strong-anion exchange-mediated phosphoproteomics
2017-10-13
[7]
논문
Structure of the entire cytoplasmic portion of a sensor histidine-kinase protein
2005-12
[8]
논문
Communication modules in bacterial signaling proteins
[9]
논문
Nucleotide binding by the histidine kinase CheA
2001-04
[10]
논문
Deletion of the Two-Component Histidine Kinase Gene (CHK1) of Candida albicans Contributes to Enhanced Growth Inhibition and Killing by Human Neutrophils In Vitro
2002-02
[11]
논문
The SrrAB two-component system regulates ''Staphylococcus aureus'' pathogenicity through redox sensitive cysteines
2020-05
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

