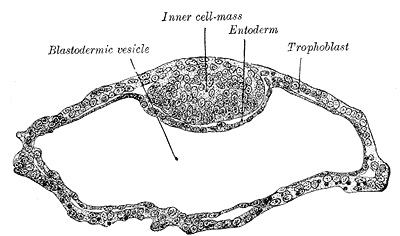
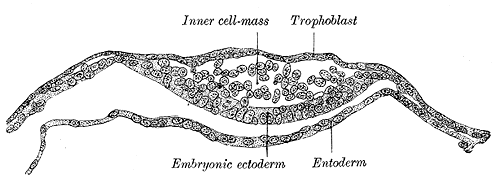
내세포집단
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
내세포집단은 포유류 배아의 발달 과정에서 영양막과 분리되어 형성되는 세포 덩어리이다. 수정 후 배아의 초기 분열 과정에서 발생하며, 배아의 상배엽과 하배엽으로 분화된다. 내세포집단은 배아줄기세포를 포함하며, 이 세포들은 신체의 모든 세포 유형으로 분화할 수 있는 다능성을 가진다. 내세포집단의 세포 분화와 관련된 전사 인자 및 신호 전달 물질에 대한 연구가 활발히 진행되고 있으며, 넉아웃 마우스 제작 등 다양한 연구 및 응용 분야에 활용된다.
더 읽어볼만한 페이지
2. 발달
포유류의 발달 과정에서 내세포집단과 영양막의 분리는 배아 단계에서 처음으로 일어나는 세포 계통 분화이다.[17]
내세포집단과 영양외배엽은 착상이 시작되고 배아 발생이 진행됨에 따라 뚜렷이 다른 세포 유형을 생성한다. 영양외배엽 세포는 배아 바깥 조직을 형성하여 배아를 보호하고 보조하는 역할을 하며, 태반을 형성한다. 반면, 내세포집단은 배반엽 상층과 원시 내배엽(primitive endoderm, 닭 배아에서의 배반엽 하층에 상당)의 2층으로 분리되어 2층 배반(bilaminar germ disc)이라고 불리는 구조를 형성한다.
배반엽 상층에서는 배체와 양막이 형성된다. 원시 내배엽은 배체 외부의 층이며, 배체의 세포를 만들지 않고 난황낭을 형성한다.[16]
2. 1. 초기 분화
영양막과 내세포집단의 물리적 및 기능적 분리는 포유류 발달 과정 중 중요한 이벤트 중 하나이며, 배아 단계에서 처음으로 일어나는 세포 계통 분화이다.나팔관에서 수정이 일어나면, 포유류의 배아는 상대적으로 느린 속도로 분열되며 8세포배의 오디배를 형성한다.
세포배의 난할구(blastomere)라고 불리는 각각의 세포는 추가적인 분할(compaction)을 진행하여 접촉할 수 있는 표면적을 넓히며 그 결과 약 32세포배의 주머니배를 형성한다.[17]
쥐에서는 12개의 내부 세포가 내세포괴를 구성하고 20–24개의 세포가 주변 영양막을 구성하게 된다.[18][19] 이러한 구성에는 종간 차이를 보이는데, 소에서는 좀 더 빠른 시기인 9-15개 세포일 때, 토끼는 32개 세포까지는 내세포집단(ICM)의 구분이 되지 않는다.[20] 또한 초기 배아에서의 유전자 발현 패턴도 종간 변화를 보인다.[21]
착상이 시작되고 배아 발생이 되면서 내세포괴와 영양외배엽은 서로 완전히 구분된 세포들로 나뉜다.
영양외배엽 세포는 배아 바깥에서 조직을 형성하며, 배아를 보호하고 보조하는 역할을 한다. 또한 속세포덩이 내로 유체를 전달하여 속세포덩이가 극성을 갖게 하면서 영양외배엽 세포의 한 쪽에 내세포집단이 모이도록 한다.
이러한 세포의 이동은 내세포집단을 유체에 노출시켜 아래판을 형성하게 만든다. 아래판은 주로 조류의 발생 초기 원시선조 형성 이전의 배반엽이 상하 두 층으로 구분되는 시기에서 아래쪽 층을 가리키며, 내배엽과 중배엽의 일부로 발달하고 배아 바깥의 막에도 기여한다. 반면 남아 있는 세포들은 위판을 형성하여 궁극적으로 배아가 제대로 생길 수 있게끔 한다.[17]
2. 2. 착상 및 배아 발생
영양막과 내세포집단의 물리적 및 기능적 분리는 포유류 발달 과정 중 중요한 이벤트이며, 배아 단계에서 처음으로 일어나는 세포 계통 분화이다.나팔관에서 수정이 일어나면, 포유류의 배아는 느리게 분열하여 8세포배의 오디배를 형성한다. 각 세포는 추가적인 분할(compaction)을 통해 접촉 표면적을 넓히며, 그 결과 약 32세포배의 주머니배를 형성한다.[17]
착상이 시작되고 배아 발생이 진행되면서 내세포집단과 영양외배엽은 뚜렷하게 구분되는 세포 유형으로 분리된다. 영양외배엽 세포는 배아 바깥 조직을 형성하여 배아를 보호하고 보조하는 역할을 한다. 또한, 내세포집단 안으로 유체를 전달하여 극성을 갖게 하고, 영양외배엽 세포의 한쪽에 내세포집단이 모이도록 한다.
이러한 세포의 이동은 내세포집단을 유체에 노출시켜 아래판(배엽의 가장 안쪽 층)을 형성하게 한다. 아래판은 주로 조류의 발생 초기 원시선조 형성 이전의 배반엽이 상하 두 층으로 구분되는 시기에서 아래쪽 층을 가리키며, 내배엽과 중배엽의 일부로 발달하고 배아 바깥의 막에도 기여한다. 반면 남아 있는 세포들은 위판을 형성하여 궁극적으로 배아가 제대로 생길 수 있게끔 한다.[17]
3. 세포 운명 조절
내세포집단의 다분화능 세포는 포유 동물 발달에 필수적이기 때문에, 이 과정을 조절하는 세포 및 분자 메커니즘에 대한 연구가 활발하게 진행되고 있다. 특히, 어떤 전사 인자와 신호전달물질이 난할구의 비대칭 분열을 조절하는지에 대한 관심이 높다. 그러나 포유류 태아의 다양성과 조절 기작의 복잡성으로 인해 초기 운명을 조절하는 메커니즘은 아직 완전히 밝혀지지 않았다.[18]
3. 1. 주요 전사 인자
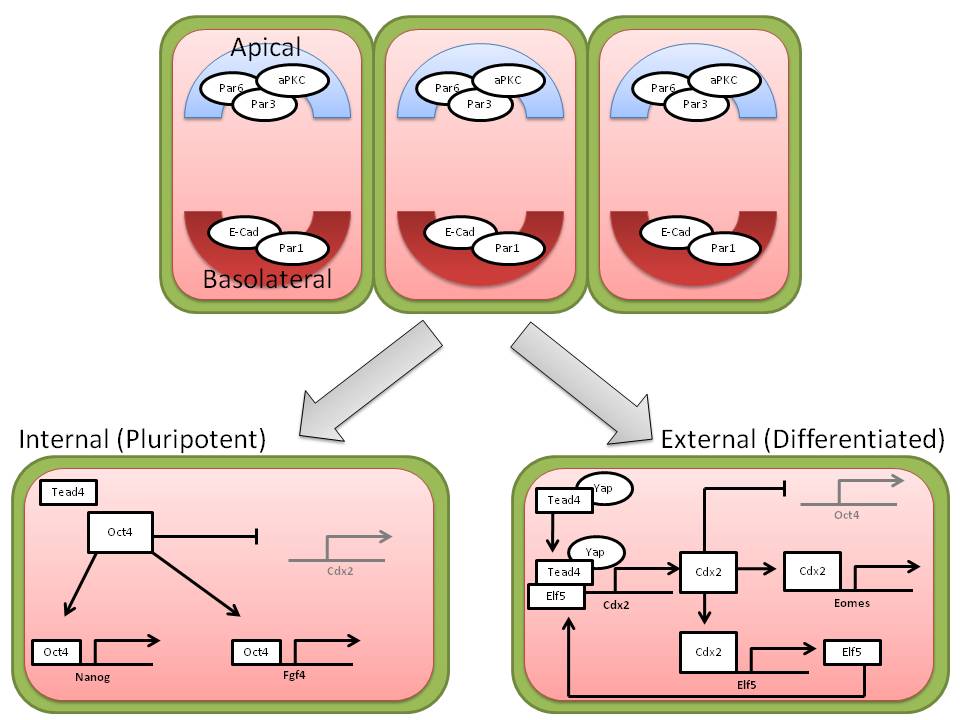
초기 마우스 배아의 내세포집단(ICM) 및 영양외배엽(TE) 조절에는 Oct4, Nanog, Cdx2, Tead4 등의 전사 인자들이 전사 수준에서 관여한다.[18]
- Oct4: 내세포집단에서 발현되며 다능성 유지에 필요하다. Oct4가 없으면 세포는 영양외배엽의 형태적 특징을 보인다. Oct4는 Fgf4와 같은 타겟 유전자를 조절하며, 이는 인접한 영양외배엽의 증식을 유도하는 리간드를 분비한다.[22]
- Nanog: 내세포집단에서 발현되며 다능성 유지에 관여한다. Nanog의 부재는 내세포집단이 원시 내배엽을 생성하지 못하게 한다.[23]
- Cdx2: 영양외배엽에서 강하게 발현되며 영양외배엽 유지에 필요하다. Cdx2는 이 세포들에서 Oct4의 발현을 억제한다.[24]
- Tead4: 영양외배엽 기능에 필요하며, Tead4의 전사 활성은 보조 활성 인자 Yap에 의존한다.[27]
이러한 전사 인자들은 양성 피드백을 통해 영양외배엽 또는 내세포집단 분화에 기여하며, 8-16세포기에 시작되는 분극화 과정과 관련이 있다. 정단면-하측면 극성은 정단면 마커인 Par3, Par6, aPKC와 하측면 마커인 E-Cadherin을 통해 확인할 수 있다.[18]
압축 과정 중 극성의 확립은 배아의 내외부 세포에 대한 환경에 따라 생성되며, 전사 인자들의 확률적 발현은 외부 세포를 영양외배엽 운명으로, 내부 세포를 내세포집단 운명으로 지정하는 피드백 루프로 증폭된다.
3. 2. 극성 확립 및 피드백 루프
8-16세포기에 정단면-하측면 극성이 확립되며, 이는 정단면 마커인 Par3, Par6, aPKC와 하측면 마커인 E-Cadherin을 통해 확인할 수 있다.[18] 이러한 극성 확립은 배아의 내외부 세포에 대한 환경적 차이를 생성하는 것으로 생각된다. 결과적으로, 전사 인자들의 확률적 발현은 피드백 루프를 통해 증폭되어 외부 세포는 영양외배엽 운명을, 내부 세포는 내세포집단 운명을 갖게 된다.모델에서, 정단면 환경은 Cdx2를 활성화하며, Cdx2는 하위 전사 인자인 Elf5를 통해 자신의 발현을 상향 조절한다(양성 피드백). 세 번째 전사 인자인 Eomes와 함께 외부 세포에서 Oct4와 Nanog와 같은 다능성 유전자를 억제하는 역할을 한다.[18][24] 따라서, 영양외배엽은 특성화되고 분화된다. 그러나 이와 다른 안쪽 세포에서는 Cdx2 유전자를 활성화시키지 않고, Oct4, Nanog, Sox2를 높은 수준으로 발현한다.[18][19] 이 유전자들은 Cdx2를 억제하고 내부 세포는 다능성을 유지하여 내세포집단을 생성하고 궁극적으로는 나머지 배아가 적절하게 분화하게 한다.
이러한 유전자 상호작용은 마우스 배아의 난할구들을 내세포집단과 영양외배엽으로 분열시키는 것에 분명히 필요하지만, 이러한 피드백 고리의 개시는 논쟁의 여지가 있다. 확률적으로 또는 비대칭성을 통해 시작되었는지 여부는 불분명하며, 요즘의 연구는 초기의 비대칭 마커를 밝히려 하고 있다.[28][29]
4. 줄기 세포
포유류 배아의 내세포덩어리(ICM)에서 분리되어 배양된 세포는 배아줄기세포(ESC)로 알려져 있다. 이 다능한(pluripotent) 세포는 알맞게 조성된 배지에서 자랄 때 줄기세포로써 성인 신체의 세 가지 배엽(외배엽, 내배엽, 중배엽) 모두를 만들 수 있다.[30] 예를 들어, 전사 인자 LIF4는 쥐의 배아줄기세포가 체외에서 유지되는 데 필요하다.[31]
내세포덩어리의 세포를 분리하여 피더 세포 위에서 배양하면 만능성을 가진 ES 세포를 얻을 수 있다.
4. 1. 배아줄기세포의 특징
배아줄기세포는 포유류 배아의 내세포집단으로부터 분리되어 배양된 난할구이다. 이 다능한(pluripotent) 세포는 적절한 조건의 배지에서 성장할 때, 성인 신체의 세 가지 배엽(외배엽, 내배엽, 중배엽) 모두를 형성할 수 있다.[30] 예를 들어, 전사 인자 LIF4는 쥐의 배아줄기세포가 체외에서 유지되는 데 필요하다.[31] 난할구는 초기 배반포에서 분리된 내세포집단에서 분리될 수 있으며, Oct4, Sox2, Nanog에 의해 유지되는 전사 발현은 줄기 세포 상태(undifferentiated state)를 유지하는 데 도움을 준다.4. 2. 배아줄기세포의 응용
배아줄기세포는 유전자 넉아웃 마우스 제작 등에 활용될 수 있다. 관심 유전자의 돌연변이를 배아줄기세포에 도입하고, 이를 다시 배아의 내세포덩어리(ICM)에 도입하여 키메라 마우스를 만들 수 있다. 이러한 기술은 유전자의 기능을 연구하는 데 널리 사용된다.[30][17]마우스에서는 관심 있는 유전자의 돌연변이를 배양된 배아 줄기(ES) 세포에 바이러스 등을 통해(retrovirally) 도입할 수 있으며, 그대로 배아 줄기(ES) 세포를 배아의 내세포집단(ICM)에 재도입할 수 있다. 그 결과 관심 있는 유전자의 돌연변이를 가진 배아 줄기(ES) 세포 일부가 포함된 키메라 마우스를 만들 수 있다. 이러한 과정의 목적은 돌연변이된 유전자를 생쥐의 생식 세포계에 도입하여(확률적으로) 그 자손이 관심 유전자의 하나 또는 둘 모두의 대립 유전자를 결실시키는 것이다.
5. 참고 이미지
참조
[1]
웹사이트
Early Mammalian Development
https://www.ncbi.nlm[...]
2022-05-13
[2]
서적
Principles of Development
Oxford University Press Inc.
[3]
논문
Establishment of Trophectoderm and Inner Cell Mass Lineages in the Mouse Embryo
[4]
논문
Blastomeres of the mouse embryo lose totipotency after the fifth cleavage division: Expression of Cdx2 and Oct4 and developmental potential of inner and outer blastomeres of 16- and 32-cell embryos.
[5]
웹사이트
Analysis of Polarity of Bovine and Rabbit Embryos by Scanning Electron Microscopy
http://www.biolrepro[...]
2015-09-23
[6]
웹사이트
Validation of reference genes for quantitative RT-PCR studies in porcine oocytes and preimplantation embryos
http://www.biomedcen[...]
[7]
논문
Formation of pluripotent stem cells in the mammalian embryo depends on the POU transcription factor Oct4.
[8]
논문
Transcriptional regulation of nanog by OCT4 and SOX2.
[9]
논문
Cdx2 is required for correct cell fate specification and differentiation of trophectoderm in the mouse blastocyst.
[10]
논문
"''Tead4'' is required for specification of trophectoderm in pre-implantation mouse embryos."
[11]
논문
The Hippo signaling pathway components Lats and Yap pattern Tead4 activity to distinguish mouse trophectoderm from inner cell mass.
[12]
논문
Formation of the embryonic-abembryonic axis of the mouse blastocyst: relationships between orientation of early cleavage divisions and pattern of symmetric/asymmetric divisions.
[13]
논문
Role of Cdx2 and cell polarity in cell allocation and specification of trophectoderm and inner cell mass in the mouse embryo.
[14]
논문
Germ-line transmission of genes introduced into cultured pluripotential cells by retroviral vector.
1986-10-02
[15]
논문
Inhibition of pluripotential embryonic stem cell differentiation by purified polypeptides.
[16]
서적
ギルバート発生生物学
メディカル・サイエンス・インターナショナル
[17]
서적
Principles of Development: Third Edition
Oxford University Press
[18]
논문
Establishment of Trophectoderm and Inner Cell Mass Lineages in the Mouse Embryo.
[19]
논문
Blastomeres of the mouse embryo lose totipotency after the fifth cleavage division: Expression of Cdx2 and Oct4 and developmental potential of inner and outer blastomeres of 16- and 32-cell embryos.
[20]
웹사이트
Analysis of Polarity of Bovine and Rabbit Embryos by Scanning Electron Microscopy
http://www.biolrepro[...]
2015-09-23
[21]
웹사이트
Validation of reference genes for quantitative RT-PCR studies in porcine oocytes and preimplantation embryos
http://www.biomedcen[...]
[22]
논문
Formation of pluripotent stem cells in the mammalian embryo depends on the POU transcription factor Oct4.
[23]
논문
Transcriptional regulation of nanog by OCT4 and SOX2.
[24]
논문
Cdx2 is required for correct cell fate specification and differentiation of trophectoderm in the mouse blastocyst.
[25]
문서
보편적
[26]
논문
"''Tead4'' is required for specification of trophectoderm in pre-implantation mouse embryos."
[27]
논문
The Hippo signaling pathway components Lats and Yap pattern Tead4 activity to distinguish mouse trophectoderm from inner cell mass.
[28]
논문
Formation of the embryonic-abembryonic axis of the mouse blastocyst: relationships between orientation of early cleavage divisions and pattern of symmetric/asymmetric divisions.
[29]
논문
Role of Cdx2 and cell polarity in cell allocation and specification of trophectoderm and inner cell mass in the mouse embryo.
[30]
논문
Germ-line transmission of genes introduced into cultured pluripotential cells by retroviral vector.
1986-10-02
[31]
논문
Inhibition of pluripotential embryonic stem cell differentiation by purified polypeptides.
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com