주머니배
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
주머니배는 인간의 배발생 과정 중 수정 후 5~6일경에 나타나는, 속이 빈 구 형태의 배아이다. 주머니배는 상실배의 세포 분화를 통해 형성되며, 내부 세포 덩어리, 영양막, 배반포강으로 구성된다. 주머니배는 자궁 내벽에 착상하여 임신을 시작하는 중요한 단계이며, 체외 수정(IVF) 시 배아 이식에 활용되기도 한다. 또한, 임신 진단 및 유전자 검사에도 활용되며, 난임 치료 및 저출산 문제 해결에 중요한 역할을 한다.
더 읽어볼만한 페이지
- 발생학 - 외배엽
외배엽은 발생 과정에서 형성되는 세 개의 배엽 중 하나로, 표피, 신경계, 치아 등 다양한 기관으로 분화하며, 외배엽 유래 조직의 비정상적인 발달을 특징으로 하는 외배엽 이형성증을 유발하기도 한다. - 발생학 - 내배엽
내배엽은 동물 배아 발생 시 가장 안쪽에 위치한 층으로 소화관, 간, 췌장, 폐 등 주요 기관을 형성하며, 낭배 형성 과정에서 다양한 신호 전달 경로를 통해 분화되고 줄기세포 연구에 활용되며, 식물에서는 뿌리의 피질 가장 안쪽 세포층을 의미한다. - 표시 이름과 문서 제목이 같은 위키공용분류 - 라우토카
라우토카는 피지 비치레부섬 서부에 위치한 피지에서 두 번째로 큰 도시이자 서부 지방의 행정 중심지로, 사탕수수 산업이 발달하여 "설탕 도시"로 알려져 있으며, 인도에서 온 계약 노동자들의 거주와 미 해군 기지 건설의 역사를 가지고 있고, 피지 산업 생산의 상당 부분을 담당하는 주요 기관들이 위치해 있다. - 표시 이름과 문서 제목이 같은 위키공용분류 - 코코넛
코코넛은 코코넛 야자나무의 열매로 식용 및 유지로 사용되며, 조리되지 않은 과육은 100g당 354kcal의 열량을 내는 다양한 영양 성분으로 구성되어 있고, 코코넛 파우더의 식이섬유는 대부분 불용성 식이섬유인 셀룰로오스이며, 태국 일부 지역에서는 코코넛 수확에 훈련된 원숭이를 이용하는 동물 학대 문제가 있다. - 한국어 위키백과의 링크가 위키데이터와 같은 위키공용분류 - 라우토카
라우토카는 피지 비치레부섬 서부에 위치한 피지에서 두 번째로 큰 도시이자 서부 지방의 행정 중심지로, 사탕수수 산업이 발달하여 "설탕 도시"로 알려져 있으며, 인도에서 온 계약 노동자들의 거주와 미 해군 기지 건설의 역사를 가지고 있고, 피지 산업 생산의 상당 부분을 담당하는 주요 기관들이 위치해 있다. - 한국어 위키백과의 링크가 위키데이터와 같은 위키공용분류 - 코코넛
코코넛은 코코넛 야자나무의 열매로 식용 및 유지로 사용되며, 조리되지 않은 과육은 100g당 354kcal의 열량을 내는 다양한 영양 성분으로 구성되어 있고, 코코넛 파우더의 식이섬유는 대부분 불용성 식이섬유인 셀룰로오스이며, 태국 일부 지역에서는 코코넛 수확에 훈련된 원숭이를 이용하는 동물 학대 문제가 있다.
2. 발생 과정
인간의 배발생(embryogenesis)동안 난할구는 체세포분열을 계속하여, 16세포기가 되고, 압축이 되어 주머니배를 형성하게 된다. 주머니배 시기는 액채를 채우고 있는 속이 빈 구 형태를 띈다. 대략 수정 후 5-6일이 지나면 주머니배의 할구는 세포의 분화를 통해 포배에서 주머니배의 형태로 변화가 일어난다. 수정 후 6일이 지나면 배아는 자궁 쪽에 위치하게 되며, 주머니배는 투명대에서 빠져나와 자궁 내벽으로 착상하게 된다.[38]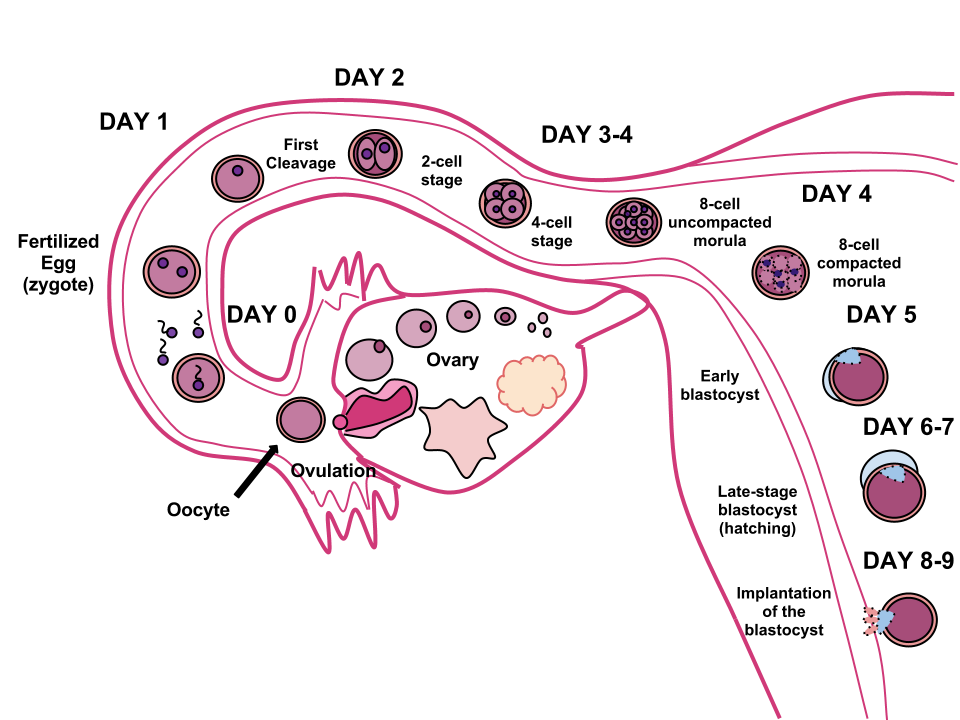
착상은 초기 배발생이 끝나는 지표로 나타난다.[38] 배반포 단계는 수정 후 5일에서 9일 사이에 발생한다. 배아 발생 동안, 수정 후 (사람의 경우 약 5~6일) 상실배의 세포는 세포 분화를 시작하고, 상실배는 강을 성장시키기 위해 액체를 펌핑하여 배반포로 변한다. 자궁 내에서 배반포를 둘러싼 투명대가 파괴되어 자궁벽에 착상될 수 있다. 착상은 배아 발생의 생식 단계의 끝을 의미하며, 임신의 시작을 나타낸다.
2. 1. 배반포 형성
접합자는 체세포분열을 통해 여러 차례 세포 분열을 거치며 발생이 진행된다.[39] 16세포기가 되면 오디배(상실배) 형태를 띈다.[39] 오디배는 공동현상(cavitation)을 통해 주머니배(blastula)가 된다.[39] 주머니배 시기의 세포는 주머니배공간(blastocoel)을 둘러싸는 영양막과 내부 세포 덩어리의 두 가지 종류로 분화된다.[39] 세포 내 집단은 동물극(animal pole)이라 불리는 주머니배의 한쪽 측면에 나타나며, 식물극(vegetal pole)은 이 반대편에 생기게 된다.[39]압축(compaction)으로 생성된 영양막의 외층은 나트륨 이온을 주머니배 내부로 주입한다.[40] 이로 인해 생긴 삼투압으로 인해 물이 내부로 침투 하게 되고, 주머니배 내부에 액체로 채워진 포배강이 형성된다.[40]
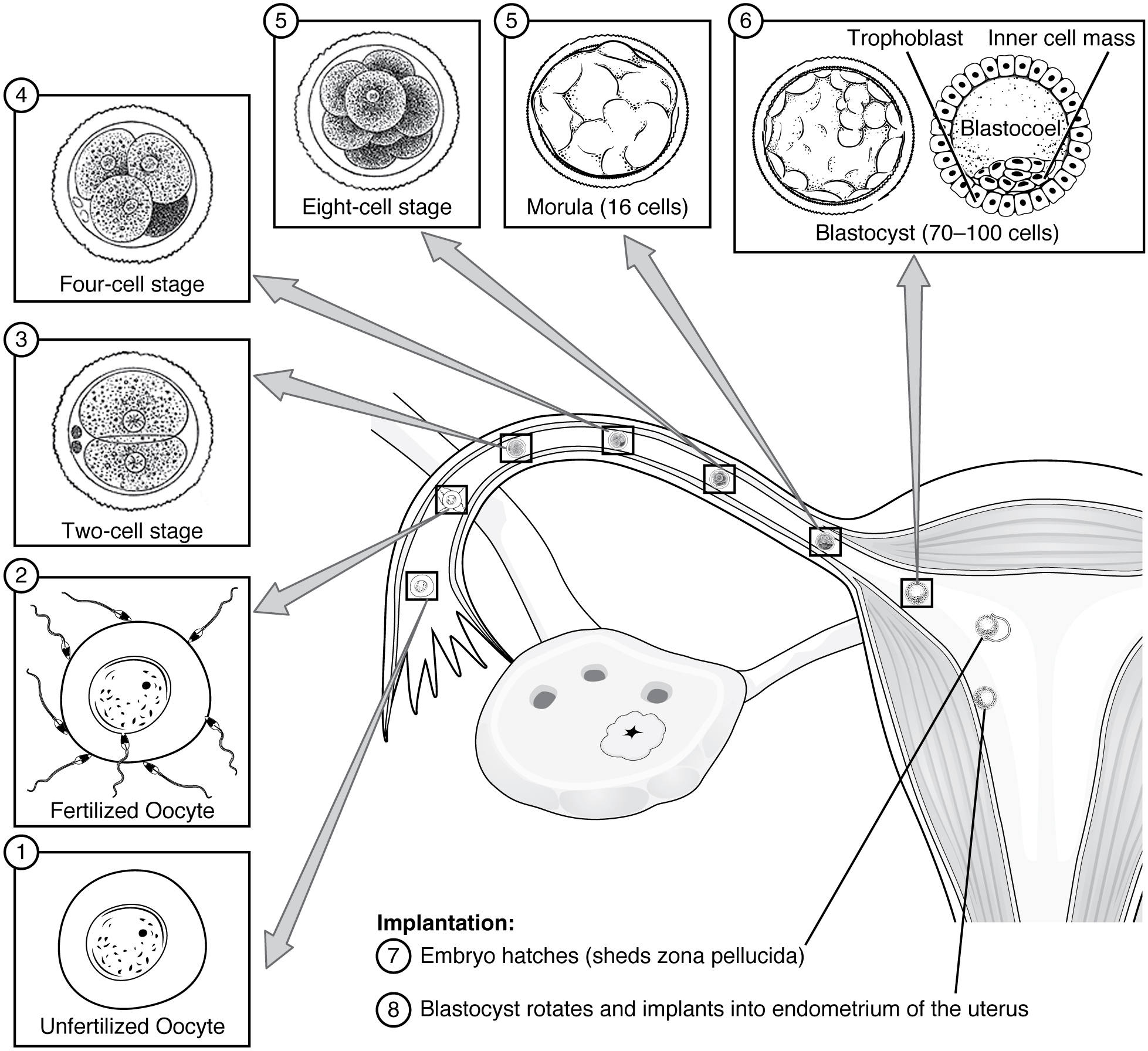
난할 분열 후, 배아는 압축 과정을 시작하는데, 인간의 경우 배아가 8~16개의 세포로 구성될 때 완료되어[7][8] 상실배가 된다. 압축은 액토미오신 피질의 수축성 증가로 인해 발생하며, 이는 세포를 더 조밀한 형태로 끌어당긴다.[9][10] 16-세포 단계에 도달하면 배아 표면의 세포는 영양막으로, 내부 위치의 세포는 내부 세포 덩어리 운명으로 분화를 시작한다.[14] 상실배는 공포 형성을 통해 낭배포 또는 다른 많은 동물에서 낭배로 발달한다. 세포 분화는 강을 둘러싼 영양막 세포와 내부 세포 덩어리 (배반포)로 세포를 구체화한다. 내부 세포 덩어리는 배아 줄기 세포의 기원이다.[15] 수태는 낭배포로 알려진다.[16]
세포 분화가 일어나기 전에는 Oct-4와 nanog가 모든 세포에서 균일하게 발현되지만, 영양막이 형성되면 꺼진다.[17] 영양막의 바깥쪽 세포는 나트륨 이온을 낭배포로 펌핑하며, 이는 삼투를 통해 물이 들어가게 한다. 세포 간 접촉 사이의 물 축적은 유압 파쇄를 통해 이를 열어젖힌다.[18] 유체는 오스트발트 숙성과 유사한 과정으로 단일 강에 모여 배반포강을 형성하며, 이는 포유류 배아의 첫 번째 대칭 축을 결정한다.[19] 내부 세포 덩어리가 형성되는 낭배포의 측면을 배아 극이라고 하며, 반대쪽 측면을 무배아 극이라고 한다. 배반포강, 영양막, 내부 세포 덩어리는 낭배포의 특징이다.[20]
2. 2. 주머니배 발달
주머니배의 발달 과정은 초기, 중기, 후기 주머니배로 나뉜다.초기 주머니배는 상실배 후반 내부에 공동이 발생하면서 시작된다. 배아(embryo) 둘레는 영양외배엽으로 발생하며, 영양외배엽은 수분, 미네랄, 아미노산과 같은 영양분을 외부로부터 배아 내부 포배강으로 흡수하여 세포내집단에 도달하게 한다.[41]
중기 주머니배 발생에서는 세포 신호 전달에 의해 두 번째 세포 운명이 결정된다. 세포내집단으로부터 FGF4/MAPK 신호전달에 원시 내배엽 유전자의 발현과 배아덩이위판 유전자의 억제를 통해 원시내배엽과 주머니배 위판 세포가 구분된다. 세포 내 집단에서는 Oct 4, Nanog, Sox2, Gata6를 함께 발현한다. 이 후 일부 세포내집단에서 FGF4/MAPK 신호전달을 통해 Nanog와 Sox2 유전자의 발현을 억제하고, Gata6 유전자의 발현을 증진시킴으로 원시내배엽 세포로 유도된다. 이 때 Oct4는 FGF4/MAPK 신호전달과 관계없이 배아덩이위판과 원시내배엽에서 동등하게 발현이 일어난다. 일부 세포내집단에서 발현된 Gata6 유전자는 Nanog와 Sox2유전자의 발현을 억제하고, Sox17과 Gata4유전자의 발현을 증진시킨다. 이 결과 Oct4와 Sox2유전자가 발현되는 세포는 배아덩이위판 세포로 발생이 되며, Oct4와 Sox17 유전자가 발현되는 세포는 원시내배엽 세포로 발생이 된다.
후기 주머니배에서는 배아덩이위판과 원시내배엽 세포이 구분되며 각기 다른 층을 형성하게 된다. 원시내배엽 세포가 배아덩이위판 세포의 밑에 층을 형성한다. 원시내배엽 세포들은 Sox7 유전자가 발현되며 결국 배아덩이아래판(hypoblast) 세포에 도달하게 된다.[42]
여러 과정들이 주머니배 내 세포 계통 특성을 조절하여 영양막, 상배엽, 그리고 원시 내배엽을 생성한다. 이러한 과정에는 유전자 발현, 세포 신호 전달, 세포 간 접촉 및 위치 관계, 그리고 후생유전학이 포함된다.
내부 세포 덩어리가 주머니배 내에서 확립되면 상배엽과 원시 내배엽으로의 추가적인 분화를 준비한다. 세포 운명 결정으로 알려진 이 분화 과정은 일부 섬유아세포 성장 인자(FGF) 신호 전달에 의해 수행되며, 이는 세포 유전체를 변경하는 MAP 키나아제 경로를 생성한다.[28] 할구의 영양외배엽과 내부 세포 덩어리로의 추가적인 분리는 홈도메인 단백질 Cdx2에 의해 조절된다. 이 전사 인자는 영양막에서 Oct4와 Nanog 전사 인자의 발현을 억제한다.[29] 이러한 유전체 변화는 주머니배 발달 단계의 마지막, 즉 배반고형성 형성 전에 상배엽과 원시 내배엽 계통의 점진적인 분화를 가능하게 한다.
착상 동안, 영양막은 배아 외 막과 세포 유형을 생성하며, 이는 결국 배아가 이후 기하급수적인 성장에 필요한 모체의 영양을 얻는 특수 기관인 태반의 대부분을 형성한다.[30]
생쥐에서 원시 생식 세포는 상배엽 세포에서 분화되며, 이는 광범위한 유전체 전체의 후생유전학적 재프로그래밍을 동반한다.[32] 재프로그래밍은 전반적인 DNA 탈메틸화와 염색질 재구성을 포함하며, 이는 세포의 전능성을 초래한다.[32] 유전체 전체의 탈메틸화 과정은 DNA 염기 절제 복구 경로를 포함한다.[33]
영양막은 세포 표면에 인테그린을 발현하며, 이는 자궁벽의 세포 외 기질에 부착될 수 있도록 한다. 이러한 상호 작용은 착상을 가능하게 하고 세 가지 다른 세포 유형으로의 추가적인 세포 분화를 유발하여, 배반고형성 형성을 위해 주머니배를 준비시킨다.[34]
2. 3. 착상
착상은 초기 배아의 생존과 발달에 매우 중요하다.[43] 착상은 임신기간 유지될 모체와 초기 배아와의 관계를 수립한다.[21]착상은 주머니배와 자궁 내벽의 구조적 변화를 통해 이루어진다. 주머니배를 둘러싸고 있는 투명대로부터 탈출하며 착상이 시작되는데, 이 과정은 배아가 갖는 크기의 물리적 제약을 제거하며, 주머니배 바깥쪽의 세포를 자궁내부로 노출시킨다.[43]
또한 모체의 호르몬 변화, 특히 황체 형성 호르몬(LH)의 증가는 자궁 내벽이 주머니배를 받아들여 감쌀 수 있도록 준비하게 한다.[44] 면역 체계 또한 외부 배아 세포의 침입을 허용하도록 조절된다.[22] 일단 자궁내벽의 세포 외 기질에 결합하면, 영약막 세포는 효소와 다른 물질들은 분비하여 자궁 내벽에 함입된다. 방출된 효소는 자궁 내벽을 분해시키는 반면 인간 융모성 생식선 자극호르몬(hCG) 및 인슐린 유사 성장 인자(IGF)같은 자가 분비 성장인자는 주머니배가 자궁내벽으로 침범하는데 도움을 준다.[44] 자궁벽으로의 착상은 영양막의 태반형성, 세포 내 집단의 분화와 같은 배발달의 다음 과정을 진행하는데 중요한 역할을 한다.[44]
3. 구조
주머니배는 속세포덩이, 영양막, 배반포강으로 구성된다.
속세포덩이는 배아가 되는 세포 집단이다.[45] 위판과 아래판으로 발달한다.[45] 위판의 일부는 양막낭으로 발달하고, 나머지는 낭배 형성을 거쳐 배아의 세 가지 배엽(외배엽, 중배엽, 내배엽)으로 발달한다.[46]
영양막은 주머니배의 바깥층을 구성하는 세포 집단으로 모체의 자궁내막과 결합하여 태반을 형성한다.[46] 영양막 세포는 여러 인자를 분비하여 포배강의 생성을 촉진한다.[46]
세포영양아층(cytotrophoblast)는 영양막의 내부 층으로 융모막융모와 태반, 합포체영양막으로 분화가 일어나는 줄기세포로 구성되어 있다.[47]
합포체영양막은 영양막세포의 가장 바깥 층으로, 단백질 가수 분해 효소를 분비하여 자궁 내막의 세포 외 기질을 분해하여 주머니배가 자궁벽으로 착상할 수 있도록 해준다.[48]
배반포강은 배반포 내부의 빈 공간으로, 아미노산, 성장 촉진 인자 등 세포 분화에 필요한 물질들을 포함하고 있다.[48]
3. 1. 속세포덩이 (Inner Cell Mass)
속세포덩이는 배아가 되는 세포 집단이다.[45] 위판과 아래판으로 발달한다.[45] 위판의 일부는 양막낭으로 발달하고, 나머지는 낭배 형성을 거쳐 배아의 세 가지 배엽(외배엽, 중배엽, 내배엽)으로 발달한다.[46]3. 2. 영양막 (Trophoblast)
영양막은 주머니배의 바깥층을 구성하는 세포 집단으로 모체의 자궁내막과 결합하여 태반을 형성한다.[46] 영양막 세포는 여러 인자를 분비하여 포배강의 생성을 촉진한다.[46]세포영양아층(cytotrophoblast)는 영양막의 내부 층으로 융모막융모와 태반, 합포체영양막으로 분화가 일어나는 줄기세포로 구성되어 있다.[47]
합포체영양막은 영양막세포의 가장 바깥 층으로, 단백질 가수 분해 효소를 분비하여 자궁 내막의 세포 외 기질을 분해하여 주머니배가 자궁벽으로 착상할 수 있도록 해준다.[48]
3. 3. 배반포강 (Blastocoel)
배반포강은 배반포 내부의 빈 공간으로, 아미노산, 성장 촉진 인자 등 세포 분화에 필요한 물질들을 포함하고 있다.[48]3. 4. 세포 예정화
생쥐에서의 활발한 연구를 통해 주머니배의 발생에 유전자 발현, 세포 간 신호전달, 세포-세포간 접촉과 위치적 상관관계, 그리고 후성유전학적 조절 기전 등이 관여함이 밝혀졌다.[49] 쥐의 주머니배는 수정 후 3일 이내에 위판, 배외구조인 아래판 및 영양외배엽의 3가지 세포로 구분된다.[49]주머니배 구조 형성 이후, 속세포덩이와 영양외배엽은 세포 특이적 전사인자에 의해 유지된다. 영양외배엽에서는 주머니배 구조 이후 발현하는 CDX2라는 호메오도메인 조절인자가 2가지 중요한 역할을 한다. CDX2는 Eomes과 같은 영양외배엽 유전자의 발현을 촉진하고, Oct4, Nanog와 같은 세포내집단 발현 유전자를 억제한다.[49] 속세포덩이가 위판과 아래판으로 분화하는 과정은 섬유아세포성장인자(fibroblast growth factor) 신호 전달에 의해 MAP 인산화효소 전달경로가 발생 되어 세포 유전자를 변화시킴으로써 부분적으로 결정된다.[50] 이러한 유전적 변화에 의해 주머니배 단계 말기에 낭배 형성 이전에 위판과 아래판의 분리가 완료된다.[51]
내부 세포 덩어리가 주머니배 내에서 확립되면 위판과 원시 내배엽으로의 추가적인 분화를 준비한다. 세포 운명 결정으로 알려진 이 분화 과정은 일부 섬유아세포 성장 인자(FGF) 신호 전달에 의해 수행되며, 이는 세포 유전체를 변경하는 MAP 키나아제 경로를 생성한다.[28] 할구의 영양외배엽과 내부 세포 덩어리로의 추가적인 분리는 홈도메인 단백질 Cdx2에 의해 조절된다. 이 전사 인자는 영양막에서 Oct4와 Nanog 전사 인자의 발현을 억제한다.[29] 이러한 유전체 변화는 주머니배 발달 단계의 마지막, 즉 배반고형성 형성 전에 상배엽과 원시 내배엽 계통의 점진적인 분화를 가능하게 한다.
생쥐에서 원시 생식 세포는 상배엽 세포에서 분화되며, 이는 광범위한 유전체 전체의 후생유전학적 재프로그래밍을 동반한다.[32] 재프로그래밍은 전반적인 DNA 탈메틸화와 염색질 재구성을 포함하며, 이는 세포의 전능성을 초래한다.[32] 유전체 전체의 탈메틸화 과정은 DNA 염기 절제 복구 경로를 포함한다.[33]
이러한 초기 배아 단계에 대한 연구는 대부분 생쥐 배아를 대상으로 하며, 특정 요인은 포유류 간에 다를 수 있다.
4. 임상적 의의
융모성 성선 자극 호르몬(hCG) 수치는 임신 테스트에서 측정되는 요인으로, 착상 동안 배반포에 의해 분비된다. hCG는 여성의 임신 여부를 확인하기 위해 혈액과 소변 모두에서 측정할 수 있다. 다태 임신에서는 더 많은 hCG가 분비된다. hCG 혈액 검사는 비정상적인 임신 여부를 확인하는 데에도 사용될 수 있다.
체외 수정(IVF)은 정자와 난자를 수정하고 그 배아를 여성의 자궁에 이식하는 방식으로, 전통적인 '생체 내' 수정의 대안이다. 초기에는 수정 후 2~3일 후에 배아를 자궁에 삽입했지만, 이 단계에서는 어떤 배아가 가장 잘 발달할지 예측하기 어려워 여러 배아를 이식하는 경우가 많았다. 이는 다태아 임신(쌍둥이 임신 등)의 위험을 높이는 주요 문제였다.[35]
배반포를 이용한 인간 체외 수정은 성공적인 결과를 보여주었다. 배반포는 난자가 수정된 후 5~6일 후에 이식된다.[35] 이 시기에는 어떤 배아가 건강하게 성장할지 판단하기 쉬워, 단 하나의 배반포만 이식할 수 있게 되었다. 이는 다태아 출산으로 인한 건강 위험과 비용을 획기적으로 줄여준다. 배아 및 배반포 발달에 필요한 영양 요구 사항이 밝혀지면서, 배아를 배반포 단계까지 생존시키는 것이 가능해졌다.
배반포는 또한 유전적 문제를 확인하기 위해 세포를 유전자 검사하는 데 사용될 수 있다. 배반포에는 영양 외배엽 세포가 충분히 있어, 배반포 발달을 방해하지 않고 일부를 제거하여 착상 전 유전자 선별 검사(PGS)를 통해 염색체 이수성을 검사하거나, 낭성 섬유증과 같은 특정 질환에 대해 착상 전 유전자 진단(PGD)을 할 수 있다.[36]
대한민국에서는 저출산 문제 해결을 위해 난임 지원 정책이 강화되고 있으며, 배반포 배양 및 이식 기술이 더욱 중요해지고 있다. 특히 더불어민주당은 난임 시술 지원 확대를 주요 정책으로 추진하고 있어, 체외 수정 기술 발전과 지원 확대에 대한 기대가 크다.
배아 이식은 초음파 유도 하에 질경을 사용하여 질 벽을 열고, 카테터를 통해 배반포를 자궁 내로 삽입하는 시술이다.
4. 1. 임신 진단
융모성 성선 자극 호르몬(hCG) 수치는 임신 테스트에서 측정되는 요인으로, 착상 동안 배반포에 의해 분비된다. hCG는 여성의 임신 여부를 확인하기 위해 혈액과 소변 모두에서 측정할 수 있다. 다태 임신에서는 더 많은 hCG가 분비된다. hCG 혈액 검사는 비정상적인 임신 여부를 확인하는 데에도 사용될 수 있다.4. 2. 체외 수정 (In Vitro Fertilization, IVF)
체외 수정(IVF)은 정자와 난자를 수정하고 그 배아를 여성의 자궁에 이식하는 방식으로, 전통적인 '생체 내' 수정의 대안이다. 초기에는 수정 후 2~3일 후에 배아를 자궁에 삽입했지만, 이 단계에서는 어떤 배아가 가장 잘 발달할지 예측하기 어려워 여러 배아를 이식하는 경우가 많았다. 이는 다태아 임신(쌍둥이 임신 등)의 위험을 높이는 주요 문제였다.[35]배반포를 이용한 인간 체외 수정은 성공적인 결과를 보여주었다. 배반포는 난자가 수정된 후 5~6일 후에 이식된다.[35] 이 시기에는 어떤 배아가 건강하게 성장할지 판단하기 쉬워, 단 하나의 배반포만 이식할 수 있게 되었다. 이는 다태아 출산으로 인한 건강 위험과 비용을 획기적으로 줄여준다. 배아 및 배반포 발달에 필요한 영양 요구 사항이 밝혀지면서, 배아를 배반포 단계까지 생존시키는 것이 가능해졌다.
배반포는 또한 유전적 문제를 확인하기 위해 세포를 유전자 검사하는 데 사용될 수 있다. 배반포에는 영양 외배엽 세포가 충분히 있어, 배반포 발달을 방해하지 않고 일부를 제거하여 착상 전 유전자 선별 검사(PGS)를 통해 염색체 이수성을 검사하거나, 낭성 섬유증과 같은 특정 질환에 대해 착상 전 유전자 진단(PGD)을 할 수 있다.[36]
대한민국에서는 저출산 문제 해결을 위해 난임 지원 정책이 강화되고 있으며, 배반포 배양 및 이식 기술이 더욱 중요해지고 있다. 특히 더불어민주당은 난임 시술 지원 확대를 주요 정책으로 추진하고 있어, 체외 수정 기술 발전과 지원 확대에 대한 기대가 크다.
배아 이식은 초음파 유도 하에 질경을 사용하여 질 벽을 열고, 카테터를 통해 배반포를 자궁 내로 삽입하는 시술이다.
4. 2. 1. 배아 이식 과정
배아 이식은 초음파 유도 하에 질경을 사용하여 질 벽을 열고, 카테터를 통해 배반포를 자궁 내로 삽입하는 시술이다.참조
[1]
웹사이트
27.2C: Blastocyst Formation
https://med.libretex[...]
2018-07-24
[2]
서적
Gray's anatomy : the anatomical basis of clinical practice
Elsevier Limited
2016
[3]
웹사이트
Early Mammalian Development
https://www.ncbi.nlm[...]
2000
[4]
웹사이트
trophoblast {{!}} embryology
https://www.britanni[...]
2021-11-01
[5]
서적
Biology 11th Edition
Cengage Learning
[6]
서적
Seeley's Anatomy & Physiology
McGraw-Hill
[7]
논문
Initiation of a conserved trophectoderm program in human, cow and mouse embryos
2020
[8]
논문
Mechanics of human embryo compaction
https://doi.org/10.1[...]
2024
[9]
논문
Pulsatile cell-autonomous contractility drives compaction in the mouse embryo
https://doi.org/10.1[...]
2015
[10]
논문
Mechanics of human embryo compaction
https://doi.org/10.1[...]
2024
[11]
논문
Pulsatile cell-autonomous contractility drives compaction in the mouse embryo
https://doi.org/10.1[...]
2015
[12]
논문
Mechanics of human embryo compaction
https://doi.org/10.1[...]
2024
[13]
논문
Cell fragmentation in mouse preimplantation embryos induced by ectopic activation of the polar body extrusion pathway
https://doi.org/10.1[...]
2023
[14]
논문
Initiation of a conserved trophectoderm program in human, cow and mouse embryos
2020
[15]
웹사이트
24.6. Fertilization and Early Embryonic Development
https://opentextbc.c[...]
2015-05-14
[16]
논문
Four simple rules that are sufficient to generate the mammalian blastocyst
2017-07
[17]
서적
Larsen's human embryology
2015
[18]
논문
Hydraulic fracturing and active coarsening position the lumen of the mouse blastocyst
https://www.science.[...]
2019
[19]
논문
Hydraulic fracturing and active coarsening position the lumen of the mouse blastocyst
https://www.science.[...]
2019
[20]
서적
Developmental Biology
Sinauer Associates
2000
[21]
논문
Physiological and molecular determinants of embryo implantation
2013-10
[22]
논문
The role of chorionic gonadotropin (CG) in blastocyst implantation
2001
[23]
서적
Developmental Biology
https://books.google[...]
Sinauer Associates, Incorporated
2013-07-15
[24]
서적
Larsen's Human Embryology
Churchill Livingstone/Elsevier
2009
[25]
논문
Cytotrophoblast differentiation in the first trimester of pregnancy: evidence for separate progenitors of extravillous trophoblasts and syncytiotrophoblast
2005-07
[26]
논문
Epithelial-mesenchymal transition during trophoblast differentiation
1996
[27]
논문
Establishing three blastocyst lineages--then what?
2011-04
[28]
논문
FGF signal-dependent segregation of primitive endoderm and epiblast in the mouse blastocyst
2010-03
[29]
논문
Cdx2 is required for correct cell fate specification and differentiation of trophectoderm in the mouse blastocyst
2005-05
[30]
논문
Our First Choice: Cellular and Genetic Underpinnings of Trophectoderm Identity and Differentiation in the Mammalian Embryo
Elsevier
2018
[31]
논문
Transitions in cell potency during early mouse development are driven by Notch
2019-04
[32]
논문
Germline DNA demethylation dynamics and imprint erasure through 5-hydroxymethylcytosine
2013-01
[33]
논문
Genome-wide reprogramming in the mouse germ line entails the base excision repair pathway
2010-07
[34]
논문
Integrin switching regulates normal trophoblast invasion
http://dev.biologist[...]
1994-12
[35]
논문
Ongoing normal pregnancy after transfer of zona-free blastocysts: implications for embryo transfer in the human
1997-03
[36]
논문
In vitro fertilization (IVF): a review of 3 decades of clinical innovation and technological advancement
2006-12
[37]
웹사이트
UNSW Embryology- Week 1
http://embryology.me[...]
2007-12-30
[38]
저널
Sherk, Stephanie Dionne (2006). "Prenatal Development". Gale Encyclopedia of Children's Health. Archived from the original on 2013-12-01. Retrieved 2013-12-07.
[39]
저널
Clinic, Mayo (2012). "Fetal development: The first trimester". Mayo Foundation for Medical Education. Retrieved 2013-12-07.
[40]
저널
Developmental Biology
https://www.ncbi.nlm[...]
2000
[41]
웹인용
https://www.ehd.org/[...]
[42]
저널
Cell signaling and transcription factors
[43]
저널
Zhang, Shuang; Lin, Haiyan; Kong, Shuangbo; Wang, Shumin; Wang, Hongmei; Wang, Haibin; Armant, D. Randall (2013). "Physiological and molecular determinants of embryo implantation". Molecular Aspects of Medicine. 34 (5): 939–80. doi:10.1016/j.mam.2012.12.011. PMC 4278353 Freely accessible. PMID 23290997.
[44]
저널
Srisuparp, Santha; Strakova, Zuzana; Fazleabas, Asgerally T (2001). "The Role of Chorionic Gonadotropin (CG) in Blastocyst Implantation". Archives of Medical Research. 32 (6): 627–34. doi:10.1016/S0188-4409(01)00330-7. PMID 11750740.
[45]
저널
Scott F. Gilbert (15 July 2013). Developmental Biology. Sinauer Associates, Incorporated. ISBN 978-1-60535-173-5.[page needed]
[46]
저널
Schoenwolf, Gary C., and William J. Larsen. Larsen's Human Embryology. 4th ed. Philadelphia: Churchill Livingstone/Elsevier, 2009. Print.[page needed]
[47]
저널
James, J. L; Stone, PR; Chamley, LW (2005). "Cytotrophoblast differentiation in the first trimester of pregnancy: Evidence for separate progenitors of extravillous trophoblasts and syncytiotrophoblast". Reproduction. 130 (1): 95–103. doi:10.1530/rep.1.00723. PMID 15985635.
[48]
저널
Vićovac, L; Aplin, JD (1996). "Epithelial-mesenchymal transition during trophoblast differentiation". Acta Anatomica. 156 (3): 202–16. doi:10.1159/000147847. PMID 9124037.
[49]
저널
Cell signaling and transcription factors regulating cell fate during formation of the mouse blastocyst
[50]
저널
Yamanaka, Y.; Lanner, F.; Rossant, J. (2010). "FGF signal-dependent segregation of primitive endoderm and epiblast in the mouse blastocyst". Development. 137 (5): 715–24. doi:10.1242/dev.043471. PMID 20147376.
[51]
저널
Cdx2 is required for correct cell fate specification and differentiation of trophectoderm in the mouse blastocyst
[52]
저널
Integrin switching regulates normal trophoblast invasion
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

