수소 이온
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
수소 이온은 수소 원자가 전자를 잃거나 얻어 생성되는 양이온(H+) 또는 음이온(H−)을 통칭한다. 수소 양이온은 히드론, 양성자, 중수소핵, 삼중수소핵 등으로 불리며, 물과 결합하여 하이드로늄 이온, 춘델 양이온, 아이겐 양이온과 같은 수화물을 형성한다. 춘델 양이온과 아이겐 양이온은 양성자 확산에 중요한 역할을 한다. 수소 음이온은 경수소 음이온, 중수소 음이온, 삼중수소 음이온 등이 있으며, 수소화물 이온이라고도 불린다. 수소 이온은 광합성, 세포 호흡 과정에서 ATP 합성에 관여하며, pH를 결정하여 물질의 산성 또는 염기성을 나타낸다. 또한, 해양 산성화의 주요 원인이 되기도 한다.
더 읽어볼만한 페이지
- 수소물리학 - 보어 모형
보어 모형은 닐스 보어가 러더퍼드 모형의 한계를 극복하기 위해 양자 개념을 도입하여 전자의 궤도와 각운동량이 양자화된다는 가정으로 수소 원자의 스펙트럼을 설명했지만, 다전자 원자와 불확정성 원리의 모순으로 양자역학에 의해 대체된 원자 모형이다. - 수소물리학 - 금속성 수소
금속성 수소는 고압 상태에서 수소가 금속처럼 전기를 통하는 상태로, 2017년 고체 금속성 수소 생성이 보고되었으나 재현성 문제로 논란이 있으며, 행성 내부 존재 추정 및 상온 초전도체, 에너지 저장 매체 등으로의 응용 가능성이 연구되고 있다. - 수소 - 금속성 수소
금속성 수소는 고압 상태에서 수소가 금속처럼 전기를 통하는 상태로, 2017년 고체 금속성 수소 생성이 보고되었으나 재현성 문제로 논란이 있으며, 행성 내부 존재 추정 및 상온 초전도체, 에너지 저장 매체 등으로의 응용 가능성이 연구되고 있다. - 수소 - 양성자
양성자는 양(+) 전하를 띠는 기본 입자이자 원자핵을 구성하는 핵자이며, 수소 원자핵으로 화학에서 수소 이온을 의미하며, 브뢴스테드-로우리 산-염기 이론에서 양성자 주개로 정의된다. - 색인 모음 문서 - 검은 월요일
검은 월요일은 대규모 인명 피해, 사회적 혼란, 경제적 위기 등 부정적인 사건을 지칭하는 명칭으로, 1209년 더블린 학살부터 2022년 스리랑카 시위대 공격과 경제적, 사회적 위기, 미국프로풋볼 감독 경질, 겨울방학 후 개학일 등 다양한 사건을 포함하며, 각 사건의 의미는 시대적 맥락을 고려해야 한다. - 색인 모음 문서 - 등심
등심은 구이에 적합한 여러 동물의 고기 부위로, 소고기는 척추 양쪽 앞쪽과 갈비살 부근, 돼지고기는 최고급 부위, 양고기는 부드러운 육질과 고가로 특징지어진다.
2. 양이온 (양이온)
수소 원자는 +1의 전하를 띤 원자핵과 단일 전자로 구성된다. 따라서 가능한 유일하게 양으로 하전된 이온은 +1의 전하를 띠며, H+로 표기된다. 수소는 전자가 없는 유일한 양이온을 형성하지만, (수소와 달리) 하나 이상의 전자를 여전히 유지하는 양이온조차도 그 기원이 되는 중성 원자 또는 분자보다 작다.
2. 1. 수소 양이온의 종류
수소가 전자를 잃으면 다음과 같은 양이온이 만들어진다.- 히드론: 모든 수소 동위 원소의 양이온(H+)을 지칭하는 일반적인 이름
- 양성자: 1H+ (즉, 경수소 양이온)
- 중수소핵: 2H+, D+ (중수소 양이온)
- 삼중수소핵: 3H+, T+ (삼중수소 양이온)
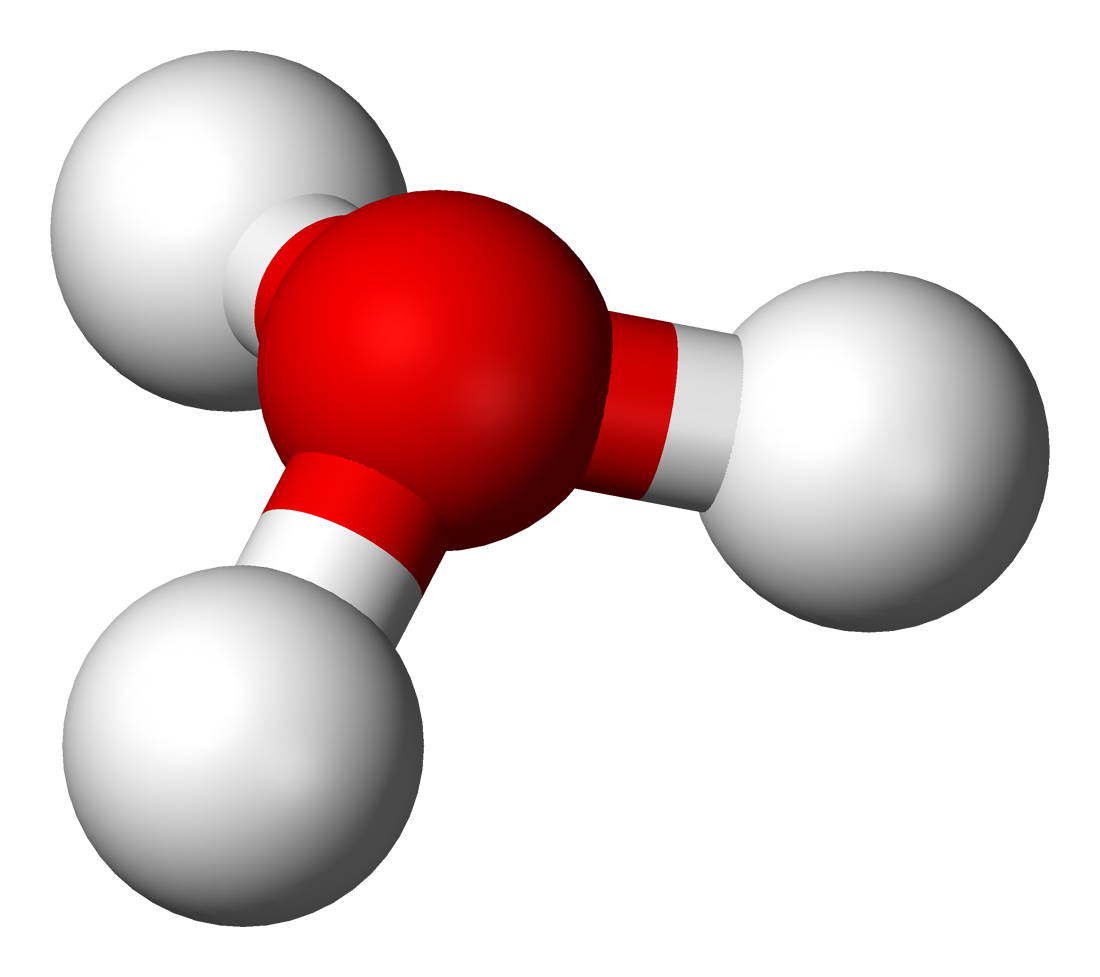
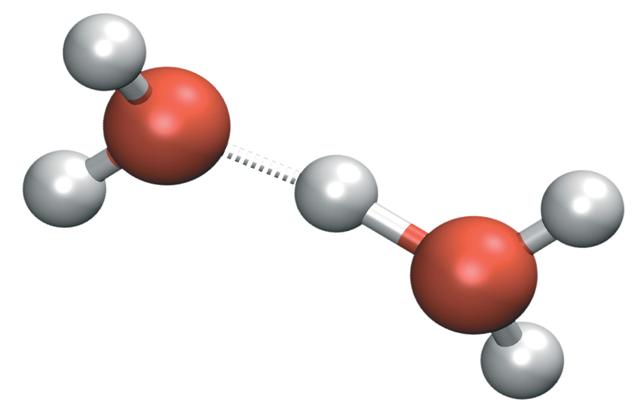
추가로 수소 양이온은 물과 결합해 수화물을 이룬다.
춘델 양이온과 아이겐 양이온은 그로투스 메커니즘에 따라 양성자 확산에 중요한 역할을 한다.
2. 2. 수화물
수소 양이온이 물과 결합해 생성되는 수화물에는 다음과 같은 것들이 있다.춘델 양이온과 아이겐 양이온은 그로투스 메커니즘에 따라 양성자 확산에 중요한 역할을 한다.
2. 3. 양성자 확산 메커니즘
춘델 양이온과 아이겐 양이온은 그로투스 메커니즘(Grotthuss mechanism)에 따라 양성자 확산에 중요한 역할을 한다.
3. 음이온 (음이온)
수소가 전자를 얻으면 음이온이 만들어진다. 수소 음이온은 추가적인 전자를 얻을 때 형성되며, '''수소화물'''이라고 부른다.
3. 1. 수소 음이온의 종류
수소가 전자를 얻으면 음이온이 만들어진다.- 수소화물(H−): 모든 수소 동위원소의 음이온을 지칭하는 일반적인 명칭
- 프로타이드(1H−)
- 듀테라이드(2H−, D−)
- 트리타이드(3H−, T−)
4. 수소 이온의 역할
수소 이온(H+)은 생물학적, 화학적 과정에서 중요한 역할을 한다.
수소 이온은 광합성에서 ATP 합성효소를 작동시켜 ATP를 생성하고, 세포 호흡에서도 비슷한 역할을 한다. 수소 이온 농도는 pH로 측정되며, 용액의 산성 또는 염기성 여부를 결정한다. 물 분자는 수소 이온과 수산화 음이온으로 자동 이온화된다.
4. 1. 생물학적 역할
수소 이온은 광합성에서 ATP 합성효소를 작동시킨다. 이는 수소 이온이 막을 가로질러 이동하여 틸라코이드 막 내부에 높은 농도를, 세포질에는 낮은 농도를 만들 때 발생한다. 그러나 삼투 현상으로 인해 H+는 ATP 합성효소를 통해 막 밖으로 나가려 한다. 양성자는 막을 빠져나가는 운동 에너지를 이용하여 ATP 합성효소를 회전시키고, 이는 ATP를 생성한다. 이 과정은 세포 호흡에서도 일어나지만, 이 경우 농축된 막은 미토콘드리아의 내막이 된다.수소 이온 농도는 pH로 측정되며, 화합물의 산성 또는 염기성을 결정한다. 물 분자는 H+와 수산화 음이온으로 분해된다. 이 과정을 물의 자동 이온화라고 한다.
4. 2. 화학적 역할
수소 이온은 광합성에서 ATP 합성효소를 작동시킨다. 이는 수소 이온이 막을 가로질러 이동하여 틸라코이드 막 내부에 높은 농도를, 세포질에는 낮은 농도를 만들 때 발생한다. 그러나 삼투 현상으로 인해 H+는 ATP 합성효소를 통해 막 밖으로 나가려 한다. 양성자는 막을 빠져나가는 운동 에너지를 이용하여 ATP 합성효소를 회전시키고, 이는 ATP를 생성한다. 이 과정은 세포 호흡에서도 일어나지만, 이 경우 농축된 막은 미토콘드리아의 내막이 된다.수소 이온 농도는 pH로 측정되며, 화합물의 산성 또는 염기성을 결정한다. 물 분자는 H+와 수산화 음이온으로 분해된다. 이 과정을 물의 자동 이온화라고 한다. 수소 이온 농도와 pH는 반비례 관계이다. 수용액에서 수소 이온 농도가 증가하면 pH가 낮아지고 산성 물질이 생성된다. 정의에 따르면, 산은 양성자를 내놓을 수 있는 이온 또는 분자이며, 용액에 도입되면 물 분자(H₂O)와 반응하여 물의 짝산인 히드로늄 이온(H₃O⁺)을 형성한다.[4] 단순화를 위해 수소 이온(H⁺)을 히드로늄 이온의 약자로 사용하는 경우가 많다.
해양 산성화는 전 세계 해양이 이산화탄소(CO₂)를 상당량 흡수함으로써 수소 이온 농도와 탄산염 포화도가 높아진 직접적인 결과이다.[5] 산업혁명 이전 해양의 탄산염 화학은 pH 균형을 포함하여 상당히 안정적이었다.[6] 산업혁명 이후 화석 연료 연소, 시멘트 생산 및 토지 이용 변화와 같은 인위적 배출로 인해 대기 중 이산화탄소의 해양 흡수량이 30% 증가했다.[7] 해양에서 이러한 온실 가스의 흡수 용량은 대기보다 59배 더 높다.[8] 해양은 지구상에서 가장 큰 탄소 흡수원으로서 기후 조절에 중요한 역할을 한다.[9]
탄소 플럭스 외에도, 대기에서 심해로의 탄소 격리 자연 과정은 생물 펌프와 용해도 펌프라는 두 가지 시스템에 의해 촉진된다. 용해도 펌프는 기체-액체 계면에서 CO₂를 이동시키는 물리화학적 과정이다.[10] 헨리의 법칙에 따르면, 수용액에 용해된 CO₂의 양은 대기 중 CO₂의 분압에 정비례한다.[11] 평형을 유지하기 위해, 대기 중 CO₂의 분압이 높으면 분자 확산에 의해 이 기체의 해양 교환이 증가한다.
표층수에서 용해된 대기 중 이산화탄소(CO₂(aq))는 물 분자와 반응하여 약한 이양성자산인 탄산(H₂CO₃)을 형성한다. 이양성자산은 각 분자에 두 개의 이온화 가능한 수소 원자를 가지고 있다.[12] 수용액에서 탄산의 부분 해리로 수소 양성자(H⁺)와 중탄산 이온(HCO₃⁻)이 방출되고, 이후 중탄산 이온은 추가적인 수소 양성자와 탄산 이온(CO₃²⁻)으로 해리된다.[13] 이러한 무기 탄소 종의 용해 및 해리는 수소 이온 농도를 증가시키고 주변 표층 해양의 pH를 역으로 낮춘다. 탄산염 완충 시스템은 화학적 평형 상태에서 용해된 무기 탄소 종을 유지함으로써 해수의 산도를 조절한다.
화학 방정식은 양방향으로 반응할 수 있는 반응물과 생성물로 구성된다. 시스템에 더 많은 반응물을 추가하면 생성물이 더 많이 생성되고(화학 반응이 오른쪽으로 이동) 생성물을 더 많이 추가하면 추가적인 반응물이 형성되어 화학 반응이 왼쪽으로 이동한다. 따라서 이 모델에서 초기 반응물인 이산화탄소의 농도가 높으면 최종 생성물(H⁺ 및 CO₃²⁻)의 양이 증가하여 pH가 낮아지고 더 산성인 용액이 생성된다. 해양의 자연적인 완충 시스템은 자유 산성 양성자와 탄산 이온이 반응하여 알칼리성을 형성하는 더 많은 중탄산 이온을 생성함으로써 pH 변화에 저항한다.[14] 그러나 대기 중 CO₂ 농도가 증가하면 완충 용량 한계를 초과하여 해양 산성화 속도가 더 빨라질 수 있다. 해양 탄산염 화학의 변화는 많은 원소와 화합물의 해양 생지화학 순환을 조작하여 해양 생태계에 심각한 영향을 미칠 수 있다. 또한 CO₂의 용해도는 온도에 따라 달라진다. 표층수 온도가 높아지면 CO₂의 용해도가 감소한다. 대기 중 CO₂의 분압이 계속 증가하면 해양이 흡수원(탄소를 해양 심층으로 수직 이동)에서 배출원(해양에서 CO₂가 방출됨)으로 전환되어 지구 온도가 더 상승할 수 있다.[15]
4. 3. 환경적 역할: 해양 산성화
해양 산성화는 전 세계 해양이 이산화탄소(CO₂)를 상당량 흡수함으로써 수소 이온 농도와 탄산염 포화도가 높아진 직접적인 결과이다.[5] 산업 혁명 이전 해양의 탄산염 화학은 pH 균형을 포함하여 상당히 안정적이었다.[6] 산업 혁명 이후 화석 연료 연소, 시멘트 생산 및 토지 이용 변화와 같은 인위적 배출로 인해 대기 중 이산화탄소의 해양 흡수량이 30% 증가했다.[7] 해양에서 이러한 온실 가스의 흡수 용량은 대기보다 59배 더 높다.[8] 해양은 지구상에서 가장 큰 탄소 흡수원으로서 기후 조절에 중요한 역할을 한다.[9]표층수에서 용해된 대기 중 이산화탄소(CO₂(aq))는 물 분자와 반응하여 약한 이양성자산인 탄산(H₂CO₃)을 형성한다. 이양성자산은 각 분자에 두 개의 이온화 가능한 수소 원자를 가지고 있다.[12] 수용액에서 탄산의 부분 해리로 수소 양성자(H⁺)와 중탄산 이온(HCO₃⁻)이 방출되고, 이후 중탄산 이온은 추가적인 수소 양성자와 탄산 이온(CO₃²⁻)으로 해리된다.[13] 이러한 무기 탄소 종의 용해 및 해리는 수소 이온 농도를 증가시키고 주변 표층 해양의 pH를 역으로 낮춘다. 탄산염 완충 시스템은 화학적 평형 상태에서 용해된 무기 탄소 종을 유지함으로써 해수의 산도를 조절한다.
화학 방정식은 양방향으로 반응할 수 있는 반응물과 생성물로 구성된다. 시스템에 더 많은 반응물을 추가하면 생성물이 더 많이 생성되고(화학 반응이 오른쪽으로 이동) 생성물을 더 많이 추가하면 추가적인 반응물이 형성되어 화학 반응이 왼쪽으로 이동한다. 따라서 이 모델에서 초기 반응물인 이산화탄소의 농도가 높으면 최종 생성물(H⁺ 및 CO₃²⁻)의 양이 증가하여 pH가 낮아지고 더 산성인 용액이 생성된다. 해양의 자연적인 완충 시스템은 자유 산성 양성자와 탄산 이온이 반응하여 알칼리성을 형성하는 더 많은 중탄산 이온을 생성함으로써 pH 변화에 저항한다.[14] 그러나 대기 중 CO₂ 농도가 증가하면 완충 용량 한계를 초과하여 해양 산성화 속도가 더 빨라질 수 있다.
참조
[1]
웹사이트
Hydrogen ion - chemistry
https://www.britanni[...]
2018-03-18
[2]
문서
due to its extremely high charge density of approximately 2×1010 times that of a sodium ion
[3]
서적
Compendium of Chemical Terminology
http://www.iupac.org[...]
Blackwell Science
1997
[4]
웹사이트
Chemistry
http://cnx.org/conte[...]
OpenStax CNX
2016-06-20
[5]
논문
Neutralization of fossil fuel CO2 by marine calcium carbonate
1997
[6]
논문
Atmospheric carbon dioxide concentrations over the past 60 million years
2000
[7]
논문
The oceanic sink for anthropogenic CO2
2004
[8]
논문
Carbon sequestration
2008
[9]
논문
Climate change feedbacks on future oceanic acidification
2007
[10]
논문
Carbon Sequestration in Ecosystems: The Role of Stoichiometry
http://www.jstor.org[...]
2004
[11]
웹사이트
Henry's Law
https://www.ncbi.nlm[...]
StatPearls Publishing
2020-09-07
[12]
웹사이트
Chemistry
http://cnx.org/conte[...]
OpenStax CNX
2016-06-20
[13]
웹사이트
Chemistry
http://cnx.org/conte[...]
OpenStax CNX
2016-06-20
[14]
논문
Ocean Alkalinity, Buffering and Biogeochemical Processes
2020
[15]
논문
Biology-mediated temperature control on atmosphericpCO2and ocean biogeochemistry
2007
[16]
서적
Compendium of Chemical Terminology
http://www.iupac.org[...]
Blackwell Science
1997
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

