수소화물
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
수소화물은 수소와 다른 원소 간의 화합물을 통칭하며, 결합 방식에 따라 이온성, 공유결합성, 틈새형 수소화물로 분류된다. 이온성 수소화물은 알칼리 금속 및 알칼리 토금속과 결합하며, 공유결합성 수소화물은 비금속 원소와 수소의 결합으로 형성된다. 틈새형 수소화물은 전이 금속 또는 희토류 금속 내부에 수소가 침투하여 저장되는 형태를 갖는다. 수소화물은 환원제, 염기, 건조제 등으로 사용되며, 화학 합성 및 에너지 저장 분야에서 활용된다. 특히 금속 수소화물은 수소 경제에서 수소 저장 매체로 연구되고 있으며, 수소화물 이온은 강력한 환원제로 작용한다. 또한, 수소 동위원소를 포함하는 프로타이드, 중수소화물, 삼중수소화물과 같은 다양한 형태의 수소화물이 존재한다.
더 읽어볼만한 페이지
- 수소화물 - 다이실레인
다이실레인은 규소 두 개가 결합된 화합물로, 규소화 마그네슘 가수분해, 실레인 광화학 반응 또는 열분해로 생성되며, 실리콘 웨이퍼 생산, 태양 전지 제조의 비정질 실리콘 증착 공정, 탄화 규소 열분해를 이용한 그래핀 성장 시 실리콘 증기압 조절 등에 사용된다. - 수소화물 - 실레인
실레인은 규소의 수소화물로, 반도체 산업과 태양광 발전 모듈 제조에 사용되지만 자연 발화성과 독성이 강해 취급에 주의해야 한다. - 음이온 - 황화물
황화물은 황이 다른 원소와 결합한 화합물로, 금속 황화물, 황화광물, 유기 황화물 등 다양한 형태로 존재하며 반도체 특성, 안료, 촉매 등으로 활용되지만 부식성과 유해성을 지니기도 한다. - 음이온 - 산화물
산화물은 산소와 다른 원소의 화합물로, 다양한 화학량론적 조성을 가지며, 여러 분야에 응용되고, 화학 조성이 같더라도 결정 구조가 다른 다형성을 띠기도 하는 비화학량론적 화합물이다. - 작용기 - 황화물
황화물은 황이 다른 원소와 결합한 화합물로, 금속 황화물, 황화광물, 유기 황화물 등 다양한 형태로 존재하며 반도체 특성, 안료, 촉매 등으로 활용되지만 부식성과 유해성을 지니기도 한다. - 작용기 - 에스터
에스터는 옥소산의 수산화기에서 수소 원자가 유기 원자단으로 치환된 화합물로, 카복실산 에스터가 대표적이며, 자연계에 널리 분포하고 향료 및 향수 산업에 사용되며 폴리에스터와 같은 중합체에서도 발견된다.
2. 수소화물의 분류
수소화물은 결합하는 원소의 종류와 결합 방식에 따라 크게 세 가지로 분류된다.
- 이온성 수소화물: 알칼리 금속이나 알칼리 토금속과 같이 전기 양성도가 큰 금속과 수소가 결합하여 생성되며, 이온 결합 성질을 가진다.
- 공유결합성 수소화물: 비금속 원소와 수소가 공유 결합하여 생성되며, 탄화수소와 같이 분자 형태로 존재하는 경우가 많다.
- 침투형 수소화물 (금속 수소화물): 전이 금속 또는 희토류 금속과 수소가 결합하여 생성되며, 금속 격자 내에 수소가 침투하여 저장되는 형태를 띤다. 금속 결합을 가지고 있다.
이러한 분류가 보편적으로 사용되는 것은 아니지만, 다양한 수소화물의 성질을 이해하는 데 유용하다. 수소와 다른 원소 사이의 결합은 보레인 수소화물과 같이 다중 중심 결합을 하는 경우도 있고, 틈새형 수소화물처럼 금속 결합을 포함하는 경우도 있다. 수소화물은 루이스 염기나 환원제로 작용하는 경우가 일반적이지만, 일부 금속 수소화물은 수소 원자를 제공하며 산으로 작용하기도 한다.[6]
2. 1. 이온성 수소화물
이온성 수소화물은 이온 결합 특성이 강한 수소화물이다.[6] 알칼리 금속(리튬, 나트륨, 칼륨 등)이나 알칼리 토금속(칼슘, 스트론튬 등)처럼 전기 양성도가 큰 금속과 수소가 결합하여 생성된다.[17] 유로퓸, 이테르븀 같은 란타넘족 원소들도 더 무거운 알칼리 토금속과 유사한 수소화물을 형성한다.[6] 이 화합물에서 수소화물은 유사 할로젠화물로 간주된다.[6] 염성 수소화물은 비분자 구조이기 때문에 일반적인 용매에 녹지 않는다.[6]이온성 수소화물에서 수소는 음이온(H-) 형태로 존재하며, 강한 염기성 및 환원성을 띤다.[17] 이러한 성질 때문에 유기 합성에서 환원제나 염기로 사용된다.[11] 예를 들어 수소화 칼륨은 아세토페논을 환원시킨다.[11]
:
이 반응에는 주로 에터가 용매로 사용된다.[11] 물과 같은 양성자성 용매는 이온성 수소화물과 반응해 수소 기체를 발생시키므로 사용할 수 없다.
:
:Δ''H'' = −83.6 kJ/mol, Δ''G'' = −109.0 kJ/mol
알칼리 금속 수소화물은 금속 할로젠화물과 반응하여 복분해를 일으킨다. 예를 들어 수소화 리튬과 염화 알루미늄의 반응으로 수소화 알루미늄 리튬이 생성된다.
:
주요 금속 수소화물은 다음과 같다.[17]
2. 2. 공유결합성 수소화물
비금속 원소 (붕소, 탄소, 질소, 산소, 규소, 인, 황 등)와 수소가 공유 결합하여 생성되는 화합물이다. 이들은 주로 분자 형태로 존재하며, 분자 간 힘에 따라 다양한 물리적 성질을 가진다. 탄화수소, 암모니아, 물 등이 대표적인 예시이다.[6][17]분자 형태의 수소화물에서는 이따금 추가적인 리간드가 결합될 수 있다. 예를 들어 디이소부틸알루미늄 수소화물(DIBAL)은 수소화물의 리간드로 연결된 두 개의 알루미늄으로 구성된다. 일반적인 용매에 용해되는 수소화물은 유기 합성에서 폭넓게 사용된다. 그 중에서도 특히 자주 쓰이는 것은 수소화붕소나트륨(NaBH4), 수소화알루미늄리튬과 같은 물질이다.[6][17]
수소 원자가 거의 전기적으로 중성인 경우, 그 수소화물 분자에 작용하는 분자간 힘은 반데르발스 힘 뿐이므로, 저비점 화합물이 된다. 예를 들어, 포스핀(PH3)의 비점은 -90℃이며, 이러한 특징을 가진 수소화물이다.[17]
수소 원자가 양전하를 띤 수소화물의 경우에는, 그로 인해 발생한 쌍극자에 기인하는 분자간 힘(프로톤성 가교)이 발생하므로, 높은 비점과 융점을 갖는다.[17]
수소 원자가 음성으로 기울어진 수소화물(히드리드)성 수소는 반응성이 높고, 이러한 특징을 가진 디보란(B2H6) 등은 산소와 격렬하게 반응한다.[17]
2. 3. 침투형 수소화물 (금속 수소화물)
전이 금속(타이타늄, 지르코늄, 팔라듐 등) 또는 희토류 금속과 수소가 결합하여 생성된다. 금속 격자 내 빈 공간에 수소가 침투하여 저장되는 형태이다. Interstitial hydride영어는 금속이나 합금 속에 흔하게 존재하며, 화합물의 정의에 정확하게 맞지는 않지만 일반적으로 화합물이라고 불린다. 강철과 같은 일반적인 합금과 유사하며, 수소는 단일 원자 또는 이원자 상태로 존재할 수 있다. 기계적 또는 열적 처리로 인해 탈기가 일어나 수소가 용액에서 침전될 수 있다. 이들의 결합은 일반적으로 금속성 결합이다. 벌크 전이 금속들은 수소에 노출되었을 때 틈새형 이원자 수소화물을 형성하며, 이러한 체계는 보통 격자 단위마다 다양한 양의 수소가 존재하는 비화학량적인 시스템이다. 재료 공학에서 수소 취성 현상은 틈새형 수소화물의 형성으로 인해 발생한다.[6]팔라듐은 실온에서 자기 부피의 최대 900배에 달하는 수소를 흡수하여 팔라듐 수소화물을 형성한다. 이 물질은 차량 연료전지의 수소 이송 수단으로 거론되기도 했다. 틈새형 수소화물은 안전한 수소 저장 방법으로서의 확실한 가능성을 보여 준다. 중성자 회절 연구에 의하면, 수소 원자는 금속 격자의 팔면체 간극을 차지한다. (fcc 격자에는 금속 원자당 하나의 팔면체 구멍이 있다) 상압에서의 흡수 한계는 PdH 0.7로 팔면체 구멍의 약 70%가 채워져 있음을 나타낸다.[12]
실온 대기압 환경에서 쉽게 수소를 흡수하고 방출하는 여러 가지 수소화물이 만들어져 왔다. 이들은 대개 금속간 화합물과 고용체 합금을 기반으로 한다. 그러나 이것의 응용 분야는 여전히 제한적인데, 수소를 저장할 수 있는 양은 2중량%에 불과하기 때문에 차량 등에 사용하는 용도로써 이용하기에는 부적합하다.[13]

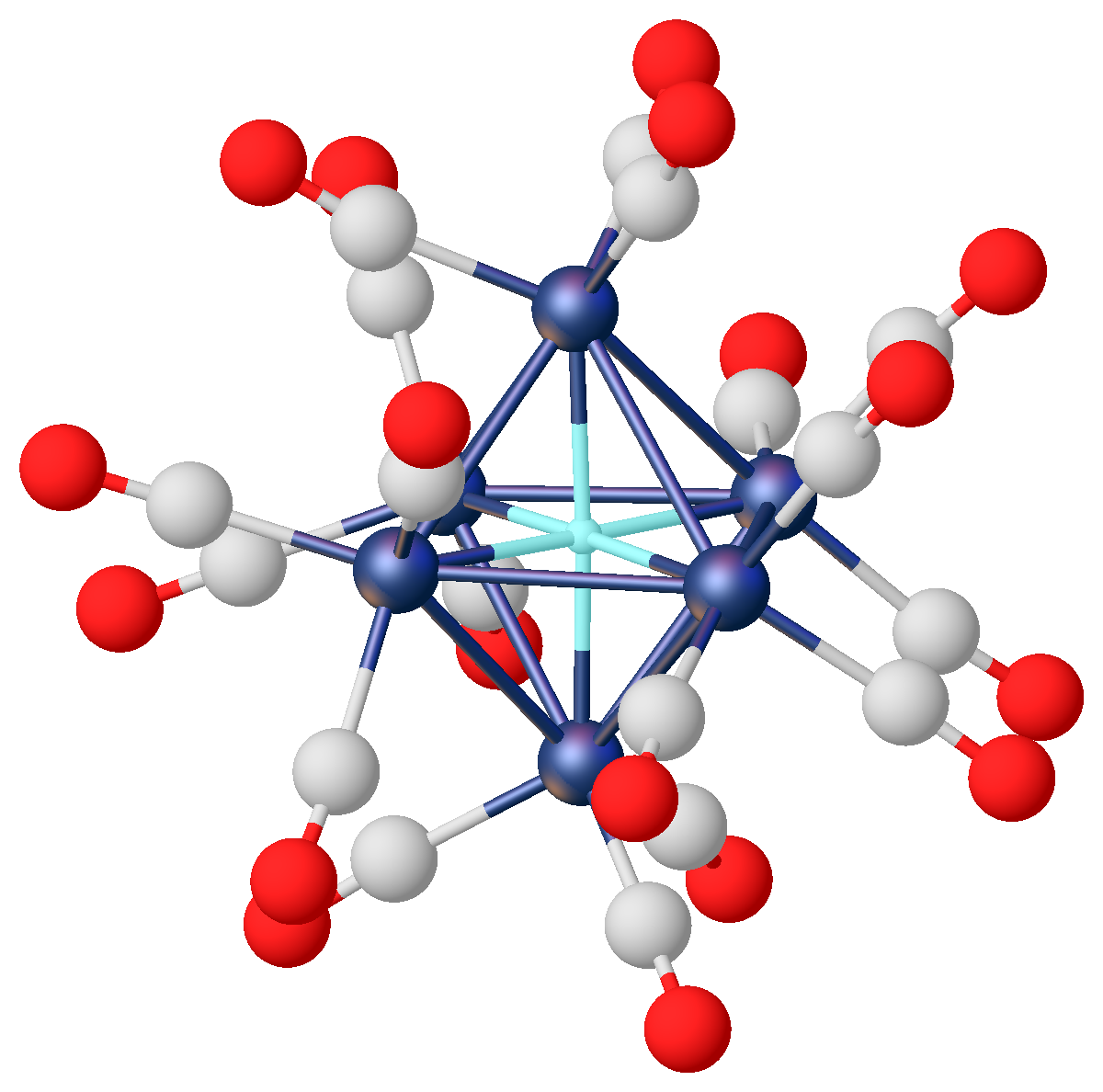
특정 전이금속은 금속간 화합물(金属類似水素化物)을 형성한다. 예를 들어, 수소화티타늄(TiH₂)의 조성은 (Ti^{4+})(H^{-})_{1.9} (e^{-})_{2.1}로 여겨지며, 이러한 화합물이 금속 광택과 높은 전기전도성을 나타내는 것은 이러한 자유 전자의 효과 때문이라고 생각할 수 있다.
금속간 화합물(金属類似水素化物)은 대부분 고압 하에서 금속과 수소를 가열하여 합성할 수 있다.
금속간 화합물(金属類似水素化物) 중에는 수소를 효율적으로 저장하고, 가열함으로써 다시 수소 가스로 추출할 수 있는 성질을 가진 것이 있으며(수소흡장합금), 수소 자동차에의 응용이 기대되고 있다.
3. 수소화물의 성질
수소와 다른 원소 사이의 결합은 공유 결합 정도가 매우 다양한데, 보레인 수소화물처럼 다중 중심 결합을 하는 경우도 있고, 틈새형 수소화물처럼 금속 결합을 포함하는 경우도 있다. 수소화물은 이산 분자, 올리고머, 중합체, 이온성 화합물, 틈새형 벌크 금속 등 다양한 형태로 존재할 수 있다. 일반적으로 루이스 염기나 환원제로 작용하지만, 일부 금속 수소화물은 수소 원자를 제공하며 산으로 작용하기도 한다.[6]
수소화물은 결합 특성에 따라 크게 세 가지로 분류된다.
전자화물을 제외하고, 수소화물 이온(H-)은 두 개의 전자와 하나의 양성자로 구성된 가장 간단한 음이온이다. 수소는 상대적으로 낮은 전자 친화도(72.77 kJ/mol)를 가지며, 루이스 염기로서 양성자와 발열 반응을 한다.
:
수소의 낮은 전자 친화도와 H-H 결합의 강도는 수소화물 이온이 강력한 환원제가 됨을 의미한다.
:
일반적으로 주기율표의 대부분의 원소는 수소화물을 형성한다.
3. 1. 대표적인 원소 수소화물
주요 금속 수소화물은 다음과 같다.
- 리튬: 수소화리튬(LiH)
- 베릴륨: 수소화베릴륨(BeH2)
- 나트륨: 수소화나트륨(NaH)
- 마그네슘: 수소화마그네슘(MgH2)
- 칼륨: 수소화칼륨(KH)
- 칼슘: 수소화칼슘(CaH2)
- 루비듐: 수소화루비듐(RbH)
- 스트론튬: 수소화스트론튬(SrH2)
대표 원소의 수소 화합물은 주기율표의 족에 따라 독특한 성질을 나타낸다.
- 1족 원소 수소화물 - '''1H''', 3Li, 11Na, 19K, 37Rb, 55Cs, 87Fr
- 2족 원소 수소화물 - 4Be, 12Mg, 20Ca, 38Sr, 56Ba, 88Ra
- 13족 원소 수소화물 - 5B, 13Al, 31Ga, 49In, 81Tl
- 14족 원소 수소화물 - 6C, 14Si, 32Ge, 50Sn, 82Pb
- 15족 원소 수소화물 - 7N, 15P, 33As, 51Sb, 83Bi
- 16족 원소 수소화물 - 8O, 16S, 34Se, 52Te, 84Po
- 17족 원소 수소화물 - 9F, 17Cl, 35Br, 53I, 85At
비금속과의 수소 화합물에서 수소의 산화수는 +1이다. 이들은 수소화물 이온을 가지지 않으므로 수소화물이라고 부르지 않는다. 17족 원소와의 수소 화합물은 할로젠화수소라고 불리며, 플루오르화수소가 약산인 것을 제외하고는 모두 강산이다.
또한, 탄소와의 수소 화합물은 탄화수소이며 석유 속에 많은 종류가 산출된다.
1족, 2족 원소의 수소화물은 이온성이 강하고, 13족 ~ 17족 원소의 수소화물은 공유결합성이 강하다.
3. 2. 금속 수소화물
금속 수소화물에서 수소는 -1의 산화수를 가진다. 이들은 금속 양이온과 수소화물 이온(H−)의 이온성 화합물이다. 금속 수소화물은 물과 쉽게 반응하여 수소를 발생시킨다.[11]:MH''n'' + ''n'' H2O → M(OH)''n'' + ''n'' H2
수소화 붕소 나트륨, 수소화 알루미늄 리튬, 디이소부틸알루미늄하이드라이드(DIBAL)와 같은 수소화물은 화학 합성에서 환원제로 흔히 사용된다. 이들은 불포화 탄소인 친전자성 중심에 더해지는 특징이 있다. 또한, 수소화 나트륨과 수소화 칼륨 등은 유기 합성에서 강력한 염기로 작용한다. 이들은 브뢴스테드 약산이 수소 분자(H2)를 방출할 때 반응한다.[11]
:C6H5C(O)CH3 + KH → C6H5C(O)CH2K + H2
이러한 반응에는 주로 에터가 용매로 사용된다. 물은 수소화물 이온이 수산화물 및 대부분의 수산기 음이온보다 강한 염기성을 띠기 때문에 사용할 수 없다. 일반적인 산-염기 반응에서는 수소 가스가 방출된다.[11]
:
:Δ''H'' = −83.6 kJ/mol, Δ''G'' = −109.0 kJ/mol
수소화 칼슘과 같은 수소화물은 유기 용매에서 극소량의 물을 제거하기 위한 건조제로 사용된다. 이들은 물과 반응하여 수소 및 수산화 염을 생성한다. 알칼리 금속 수소화물은 금속 할로젠화물과 반응하는 경향이 있다. 예를 들어, 수소화 알루미늄 리튬(LAH)은 수소화 리튬과 염화 알루미늄의 반응으로 생성된다.[11]
:4 LiH + AlCl3 → LiAlH4 + 3 LiCl
주요 금속 수소화물은 다음과 같다.
3. 3. 비금속 수소화물
비금속 원소와의 수소 화합물에서 수소의 산화수는 +1이다. 이들은 수소화물 이온을 포함하지 않으므로 엄밀한 의미에서 수소화물이라고 부르지 않는다. 17족 원소와의 수소 화합물은 할로젠화수소라고 불리며, 플루오르화수소를 제외하고는 모두 강산이다.[1]탄소와의 수소 화합물은 탄화수소이며, 석유의 주성분으로 많은 종류가 존재한다.[1]
4. 수소화물의 응용
수소화물은 니켈-금속 수소화물 전지와 같은 축전지 기술에서 중요한 역할을 한다. 다양한 금속 수소화물이 연료 전지로 구동되는 전기 자동차 및 수소 경제의 다른 측면을 위한 수소 저장 수단으로 사용하기 위해 조사되었다.[10]
수소화물 착물은 균일 및 불균일 촉매 사이클에서 촉매 및 촉매 중간체이다. 수소화, 히드로포르밀화, 히드로실릴화, 수소화탈황 촉매가 그 예시이다. 특정 효소인 수소화효소도 수소화물 중간체를 통해 작동하며, 에너지 운반체인 니코틴아마이드 아데닌 디뉴클레오티드는 수소화물 공여체 또는 수소화물 등가물로 반응한다.
4. 1. 화학 합성
수소화 붕소 나트륨, 수소화 알루미늄 리튬과 같은 수소화물은 화학 합성에서 환원제로 흔하게 사용된다. 수소화 나트륨, 수소화 칼륨 등의 수소화물은 유기 합성에서 강한 염기로 작용한다. 수소화 칼슘과 같은 수소화물은 유기 용매에서 미량의 물을 제거하기 위한 건조제로 사용된다.4. 2. 에너지 저장 및 수소 경제
금속 수소화물은 수소 저장 능력이 뛰어나 수소 연료 전지 자동차 및 수소 에너지 저장 시스템에 활용된다. 니켈-금속 수소화물 배터리는 축전지 기술에 사용된다.[10] 수소화물 복합체는 수소화, 수소화 탈황 등 촉매 반응에 중요한 역할을 한다.대한민국은 수소 경제 활성화 로드맵을 발표하고, 수소 생산, 유통, 활용 전반에 걸쳐 기술 개발과 인프라 구축을 추진하고 있다.
5. 수소화물 이온
자유 수소화물 음이온은 극한적인 환경 속에서만 존재하며, 균일 용액에는 적용되지 않는다. 그러나 많은 화합물들이 수소화물의 특성을 가진 수소 중심을 가지고 있다. 수소화물 이온은 전자화물을 제외하고 전자 2개와 양성자 1개로 이루어진 가장 간단한 음이온이다. 수소는 전자 친화도가 72.77kJ/mol로 비교적 낮으며, 루이스 강염기로서 양성자와 발열 반응을 한다.
:
수소의 낮은 전자 친화력과 H-H 결합의 강도 때문에 수소화물은 강력한 환원제가 된다.
:
6. 기타
프로튬을 포함하고 있는 수소화물은 프로타이드라고 한다.[1]
중수소를 포함하고 있는 수소화물은 중수소화물이라고 한다.[2] LiD와 같은 몇몇 중수소화물은 수소폭탄의 중요한 핵융합 원료이며 원자로의 유용한 감속재로 사용된다.[2]
삼중수소를 포함한 수소화물은 삼중수소화물이라고 한다.[3]
다른 음이온들과 함께 수소화물을 포함하는 혼합 음이온 화합물이 존재한다. 여기에는 붕소 수소화물, 탄수화물, 수소화질화물, 옥시수소화물 등이 있다.[4]
참조
[1]
논문
hydron (H02904)
https://goldbook.iup[...]
2021-05-11
[2]
문서
Helium hydride
[3]
문서
Neonium
[4]
문서
Argonium
[5]
문서
Kryptonium ion
[6]
서적
Chemistry of the elements
Butterworth-Heinemann
[7]
서적
Concise Inorganic Chemistry
https://books.google[...]
Wiley
[8]
서적
Main Group Chemistry
https://books.google[...]
Wiley
[9]
논문
Thirty Years of (TMS)3SiH: A Milestone in Radical-Based Synthetic Chemistry
[10]
논문
Thermal Decomposition of the Non-Interstitial Hydrides for the Storage and Production of Hydrogen
2004-03-01
[11]
서적
Organic Syntheses via Boranes
https://archive.org/[...]
John Wiley & Sons
1975
[12]
문서
Palladium hydride
[13]
논문
Materials for hydrogen storage
[14]
논문
Direct location of the interstitial hydride ligand in [HRu6(CO)18]– by both X-ray and neutron analyses of [Ph4As][HRu6(CO)18] by Both X-ray and Neutron Analyses of [Ph4As][HRu6(CO)18]
[15]
서적
Transition Metal Hydrides
Wiley-VCH
[16]
서적
Nomenclature of Inorganic Chemistry ("The Red Book")
http://old.iupac.org[...]
[17]
서적
レイナーキャナム無機化学
東京化学同人
2009-03-19
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
