카르니틴 팔미토일기전이효소 I
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
카르니틴 팔미토일기전이효소 I (CPT1)은 미토콘드리아 외막에 위치한 막 단백질로, 장쇄 지방산이 미토콘드리아 기질로 수송되는 것을 조절하는 효소이다. CPT1은 CPT1A, CPT1B, CPT1C의 세 가지 이소형으로 존재하며, 각 이소형은 조직별로 다르게 발현된다. CPT1은 팔미토일-CoA의 아실기를 카르니틴으로 전달하여 팔미토일카르니틴을 생성하는 반응을 촉매하며, 말로닐-CoA에 의해 억제된다. CPT1A 결핍증, 제2형 당뇨병, 인슐린 저항성과 관련이 있으며, HIV 감염과도 연관되어 연구되고 있다.
더 읽어볼만한 페이지
2. 구조
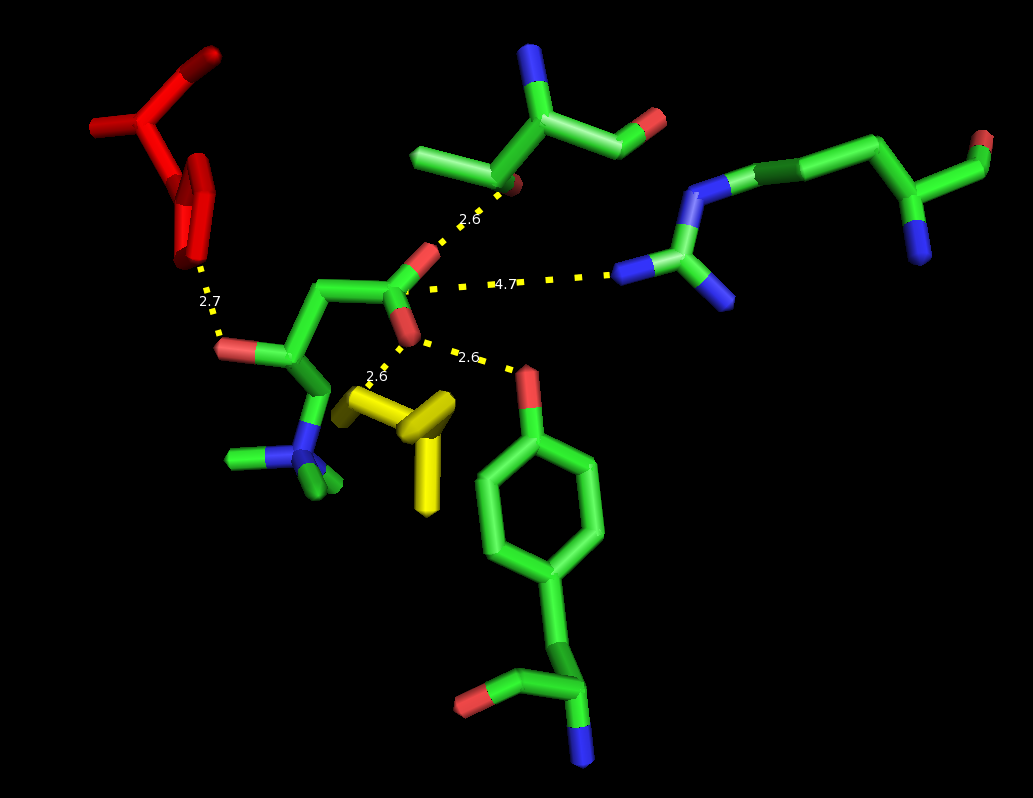
CPT1은 포유류 조직에서 CPT1A, CPT1B, CPT1C의 세 가지 이소형으로 존재하는 막 단백질이다.[4][5] CPT1A는 주로 간과 같은 지방 생성 조직에서 발현되며,[29][30] CPT1B는 심장, 골격근, 갈색 지방 세포와 같이 지방산 산화 능력이 높은 조직에서 주로 발현된다.[4][5][29][30] CPT1C는 주로 뇌(뉴런)에서 발현되며,[7][32] 특정 암세포 유형에서도 발현이 변경될 수 있다.[8][9][33][34]
CPT1A와 CPT1B는 펩타이드 사슬의 두 개의 막횡단 영역을 통해 미토콘드리아 외막에 결합하며, N-말단과 C-말단 모두 세포질 쪽에 노출되어 있다.[6][31] 두 막횡단 도메인을 연결하는 짧은 루프는 미토콘드리아 내막 공간으로 돌출되어 있다.
CPT1 이소형의 정확한 구조는 아직 결정되지 않았지만, 카르니틴 아세틸전이효소(CRAT)와 같이 밀접하게 관련된 카르니틴 아실전이효소를 기반으로 CPT1에 대한 다양한 ''생물 정보학'' 모델이 생성되었다.[10][35] CPT1과 CPT2, CRAT 및 카르니틴 옥타노일전이효소(COT) 사이의 중요한 구조적 차이점은 CPT1이 약 160개의 아미노산으로 구성된 N-말단에 추가적인 도메인을 포함하고 있다는 것이다. 이 추가적인 N-말단 도메인이 CPT1의 주요 억제 분자인 말로닐-CoA에 중요하며, CPT1A를 말로닐-CoA 억제에 대해 더 민감하게 또는 덜 민감하게 만드는 스위치 역할을 한다는 것이 밝혀졌다.[11][36]
CPT1A와 CPT1B에는 "A 부위"(또는 "CoA 부위")와 "O 부위"의 두 가지 결합 부위가 존재하는 것으로 제안되었다. "A 부위"는 말로닐-CoA와 팔미토일-CoA 및 조효소 A를 포함하는 다른 분자를 모두 결합하며, 효소가 조효소 A 부분과의 상호 작용을 통해 이러한 분자를 결합함을 시사한다. 이 부위에서 말로닐-CoA가 CPT1A의 경쟁적 억제제로 작용할 수 있다. "O 부위"는 A 부위보다 말로닐-CoA를 더 단단하게 결합하며, 말로닐-CoA의 말론산 부분의 디카르보닐 그룹을 통해 결합한다. 말로닐-CoA가 A 및 O 부위에 결합하면 CPT1A에 카르니틴의 결합을 배제하여 CPT1A의 작용을 억제한다.[12][37]
2. 1. CPT1 이소형
CPT1은 포유류 조직에서 CPT1A, CPT1B, CPT1C의 세 가지 이소형으로 존재하는 막 단백질이다.[4][5] CPT1A는 주로 간과 같은 지방 생성 조직에서 발현되며,[29][30] CPT1B는 심장, 골격근, 갈색 지방 세포와 같이 지방산 산화 능력이 높은 조직에서 주로 발현된다.[4][5][29][30] CPT1C는 주로 뇌(뉴런)에서 발현되며,[7][32] 특정 암세포 유형에서도 발현이 변경될 수 있다.[8][9][33][34]CPT1A와 CPT1B는 펩타이드 사슬의 두 개의 막횡단 영역을 통해 미토콘드리아 외막에 결합하며, N-말단과 C-말단 모두 세포질 쪽에 노출되어 있다.[6][31] 두 막횡단 도메인을 연결하는 짧은 루프는 미토콘드리아 내막 공간으로 돌출되어 있다.
CPT1 이소형의 정확한 구조는 아직 결정되지 않았지만, 카르니틴 아세틸전이효소(CRAT)와 같이 밀접하게 관련된 카르니틴 아실전이효소를 기반으로 CPT1에 대한 다양한 ''생물 정보학'' 모델이 생성되었다.[10][35] CPT1과 CPT2, CRAT 및 카르니틴 옥타노일전이효소(COT) 사이의 중요한 구조적 차이점은 CPT1이 약 160개의 아미노산으로 구성된 N-말단에 추가적인 도메인을 포함하고 있다는 것이다. 이 추가적인 N-말단 도메인이 CPT1의 주요 억제 분자인 말로닐-CoA에 중요하며, CPT1A를 말로닐-CoA 억제에 대해 더 민감하게 또는 덜 민감하게 만드는 스위치 역할을 한다는 것이 밝혀졌다.[11][36]
CPT1A와 CPT1B에는 "A 부위"(또는 "CoA 부위")와 "O 부위"의 두 가지 결합 부위가 존재하는 것으로 제안되었다. "A 부위"는 말로닐-CoA와 팔미토일-CoA 및 조효소 A를 포함하는 다른 분자를 모두 결합하며, 효소가 조효소 A 부분과의 상호 작용을 통해 이러한 분자를 결합함을 시사한다. 이 부위에서 말로닐-CoA가 CPT1A의 경쟁적 억제제로 작용할 수 있다. "O 부위"는 A 부위보다 말로닐-CoA를 더 단단하게 결합하며, 말로닐-CoA의 말론산 부분의 디카르보닐 그룹을 통해 결합한다. 말로닐-CoA가 A 및 O 부위에 결합하면 CPT1A에 카르니틴의 결합을 배제하여 CPT1A의 작용을 억제한다.[12][37]
2. 2. N-말단 도메인
CPT1은 CPT2, 카르니틴 아세틸전이효소(CRAT), 카르니틴 옥타노일전이효소(COT)와는 달리 약 160개의 아미노산으로 구성된 N-말단 도메인을 가지고 있다.[11][36] 이 N-말단 도메인은 CPT1의 주요 억제 분자인 말로닐-CoA에 대한 민감도를 조절하는 스위치 역할을 하며, CPT1A를 말로닐-CoA 억제에 대해 더 민감하게 또는 덜 민감하게 만든다.[11][36]CPT1A와 CPT1B에는 "A 부위" 또는 "CoA 부위", 그리고 "O 부위"라고 불리는 두 개의 뚜렷한 결합 부위가 존재하는 것으로 제안되었다.[12][37] "A 부위"는 말로닐-CoA와 팔미토일-CoA 및 조효소 A를 포함하는 다른 분자를 모두 결합하며, 효소가 조효소 A 부분과의 상호 작용을 통해 이러한 분자를 결합함을 시사한다. 이 부위에서 말로닐-CoA가 CPT1A의 경쟁적 억제제로 작용할 수 있다는 제안이 있었다. "O 부위"는 A 부위보다 말로닐-CoA를 더 단단하게 결합하는 것으로 제안되었다. A 부위와 달리 O 부위는 말로닐-CoA의 말론산 부분의 디카르보닐 그룹을 통해 말로닐-CoA에 결합한다. 말로닐-CoA가 A 및 O 부위에 결합하면 CPT1A에 카르니틴의 결합을 배제하여 CPT1A의 작용을 억제한다.[12][37]
2. 3. 결합 부위
CPT1A와 CPT1B에는 "A 부위"(또는 "CoA 부위")와 "O 부위" 두 가지 결합 부위가 존재한다.[12][37] "A 부위"는 말로닐-CoA, 팔미토일-CoA 및 조효소 A를 포함하는 다양한 분자를 결합하며, 효소가 조효소 A 부분과의 상호작용을 통해 이들을 결합하는 것으로 보인다.[12][37] 이 부위에서 말로닐-CoA는 CPT1A의 경쟁적 억제제로 작용할 수 있다.[12][37] "O 부위"는 A 부위보다 말로닐-CoA를 더 단단하게 결합하며, 말로닐-CoA의 말론산 부분의 디카르보닐 그룹을 통해 결합한다.[12][37] 말로닐-CoA가 A 부위 또는 O 부위에 결합하면 카르니틴의 결합을 방해하여 CPT1A의 작용을 억제한다.[12][37]3. 기능
3. 1. 효소 반응 기전
카르니틴 팔미토일기전이효소 I (CPT1)의 정확한 작용 기전은 현재 결정 구조 데이터가 없어 완전히 밝혀지지 않았다.[3] CPT1에 대해 몇 가지 가능한 작용 기전이 제시되었으며, 이들 모두 히스티딘 잔기 473을 핵심 촉매 잔기로 포함한다.[3]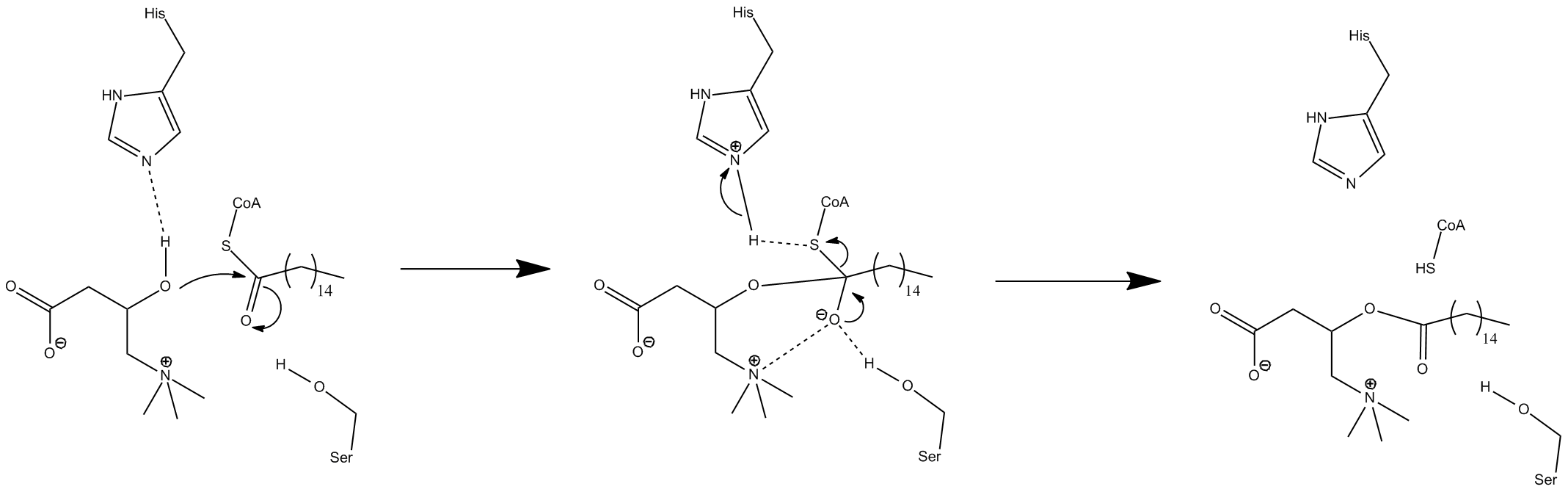
카르니틴 아세틸전이효소 모델을 기반으로 한 기전에서는 His 473이 카르니틴을 탈양성자화하고, 인접한 세린 잔기가 사면체 옥시음이온 중간체를 안정화시킨다.[3][26] 다른 기전에서는 Cys-305, His-473, Asp-454 잔기로 구성된 촉매 삼인조가 촉매작용의 아실기 전달 단계를 수행한다고 제안한다.[13][38] 이 촉매 기전은 Cys-305와 티오아실-효소 공유 결합 중간체의 형성을 포함한다.[13]
3. 2. 생물학적 기능
카르니틴 팔미토일기전이효소 I(CPT1)은 카르니틴 팔미토일기전이효소 시스템의 첫 번째 구성 요소이자 반응 속도 제한 단계 효소이다.[39] CPT1은 아실-CoA의 아실기를 카르니틴으로 전달하여 팔미토일카르니틴(아실카르니틴)을 형성하는 반응을 촉매한다.[14][39] 이후 트랜스로케이스가 아실카르니틴을 미토콘드리아 내막을 가로질러 수송하고, 카르니틴 팔미토일기전이효소 II(CPT2)가 다시 팔미토일-CoA(아실-CoA)로 전환한다.[39]장쇄 지방산은 미토콘드리아 외막에서 활성화되어 조효소 A(CoA)와 티오에스터 결합을 형성하지만, 베타 산화는 미토콘드리아 기질에서 일어나기 때문에 미토콘드리아 내막을 통과해야 한다. 장쇄 지방산은 단쇄 및 중쇄 지방산과 달리 미토콘드리아 내막을 자유롭게 통과할 수 없어 카르니틴 팔미토일기전이효소 시스템이 필요하다.[14][39] 카르니틴은 아실기 수용체로 작용하여 세포 내 CoA:아실-CoA 비율을 조절하는 역할을 할 수 있다.[15][40]
3. 3. 조절
CPT1은 말로닐-CoA에 의해 억제되지만, 정확한 억제 기전은 아직 알려지지 않았다.[16][41] CPT1의 골격근 및 심장 이소형인 CPT1B는 CPT1A보다 말로닐-CoA 억제에 30~100배 더 민감한 것으로 나타났다.[16][41] 이러한 억제는 대사 질환 치료를 위해 CPT1을 조절하려는 향후 시도의 좋은 표적이 된다.[16][41]아세틸-CoA 카르복실화효소(ACC)는 아세틸-CoA로부터 말로닐-CoA의 형성을 촉매하는 효소로, 지방산 대사 조절에 중요하다.[17][42] 과학자들은 ACC2 녹아웃 마우스가 야생형 마우스에 비해 체지방과 체중이 감소한다는 것을 입증했다.[17] 이는 ACC 활성 감소로 인해 말로닐-CoA 농도가 감소한 결과이다.[17][42] 이러한 말로닐-CoA 수치의 감소는 CPT1의 억제를 막아 궁극적으로 지방산 산화를 증가시킨다.[17][42] 심장 및 골격근 세포는 지방산 합성을 위한 낮은 능력을 가지고 있으므로, ACC는 이러한 세포에서 순수하게 조절 효소로 작용할 수 있다.[17]
4. 임상적 의의
"CPT1A" 형태는 카르니틴 팔미토일기전이효소 I 결핍증과 관련이 있다.[18][43] 이 드문 질환은 간성 뇌증, 저케톤성 저혈당증, 발작, 영아 돌연사 위험을 수반한다.[19][44]
CPT1은 제2형 당뇨병, 인슐린 저항성과 관련이 있다.[20][21][45][46] 이러한 질환에서는, 다른 많은 건강 문제와 함께, 유리 지방산(FFA) 농도의 상승, 골격근으로의 지방 축적, 근육의 지방산 산화 능력 저하가 발생한다. 고혈당증이나 고인슐린혈증/Hyperinsulinemia영어에 의한 말로닐 CoA 농도의 증가는 CPT1을 억제하고, 근육과 심장의 미토콘드리아로의 장쇄 지방산 수송을 저하시켜, 이러한 세포에서의 지방산 산화가 저하된다. 미토콘드리아로의 장쇄 지방산 수송 저하는 FFA 농도 상승으로 관찰되며, 골격근으로의 지방 축적을 초래한다.[20][21][45][46]
지방산 대사에서 CPT1의 중요성으로 인해, 다른 많은 대사 질환 치료법 개발에 있어서 주목해야 할 유용한 효소일 가능성이 있다.[22][47]
4. 1. CPT1A 결핍증
카르니틴 팔미토일기전이효소 I 결핍증은 간성 뇌증, 저케톤성 저혈당증, 발작, 영아 돌연사 위험을 수반하는 드문 질환이다.[18][19][43][44]4. 2. 제2형 당뇨병 및 인슐린 저항성
CPT1은 제2형 당뇨병 및 인슐린 저항성과 관련이 있다.[20][21][45][46] 이러한 질병은 유리 지방산(FFA) 수치를 상승시키고, 골격근에 지방이 축적되게 하며, 근육의 지방산 산화 능력을 감소시킨다. 고혈당증과 고인슐린혈증으로 인해 증가된 말로닐-CoA 수치는 CPT1을 억제하여, 장쇄 지방산이 근육과 심장 미토콘드리아로 수송되는 것을 감소시키고, 지방산 산화를 저해한다.[20][21][45][46] 장쇄 지방산이 미토콘드리아에서 벗어나면 유리 지방산 수치 증가와 골격근의 지방 축적이 발생한다.[45][46]지방산 대사에서 CPT1의 중요성은 다른 많은 대사 질환의 치료법 개발에 초점을 맞출 수 있는 잠재적으로 유용한 효소로 만든다.[22][47]
4. 3. 치료제 개발 가능성
"CPT1A" 형태는 카르니틴 팔미토일기전이효소 I 결핍증과 관련이 있다.[18] 이 드문 질환은 간성 뇌증, 저케톤성 저혈당증, 발작, 영아 돌연사 위험을 수반한다.[19]CPT1은 제2형 당뇨병 및 인슐린 저항성과 관련이 있다.[20][21] 고혈당증과 고인슐린혈증으로 인해 증가된 말로닐-CoA 수치는 CPT1을 억제하여, 장쇄 지방산이 근육과 심장 미토콘드리아로 수송되는 것을 감소시키고, 지방산 산화를 감소시킨다.[20][21]
지방산 대사에서 CPT1의 중요성은 다른 많은 대사 질환의 치료법 개발에 초점을 맞출 수 있는 잠재적으로 유용한 효소로 만든다.[22]
5. HIV와의 관계
HIV의 Vpr 단백질은 PPARβ/δ를 통해 PDK4와 카르니틴 팔미토일기전이효소 I (CPT1)의 mRNA 발현을 항진시킨다.[24][48] CPT1A의 녹다운은 배양된 Jurkat T 세포에서 HIV-1 복제를 억제한다.[25][49]
참조
[1]
논문
Genomics of the human carnitine acyltransferase genes
[2]
논문
Carnitine palmitoyltransferases 1 and 2: biochemical, molecular and medical aspects
[3]
논문
Crystal structure of carnitine acetyltransferase and implications for the catalytic mechanism and fatty acid transport
2003-01
[4]
논문
Mouse white adipocytes and 3T3-L1 cells display an anomalous pattern of carnitine palmitoyltransferase (CPT) I isoform expression during differentiation. Inter-tissue and inter-species expression of CPT I and CPT II enzymes
1997-10
[5]
논문
Adipose fatty acid oxidation is required for thermogenesis and potentiates oxidative stress-induced inflammation
2015-01
[6]
논문
Topology of carnitine palmitoyltransferase I in the mitochondrial outer membrane.
1997-05
[7]
논문
A novel brain-expressed protein related to carnitine palmitoyltransferase I
2002-10
[8]
논문
Carnitine palmitoyltransferase 1C: From Cognition to Cancer
http://wrap.warwick.[...]
2016-12
[9]
논문
Downregulation of fatty acid oxidation by involvement of HIF-1α and PPARγ in human gastric adenocarcinoma and its related clinical significance
https://pubmed.ncbi.[...]
2021-05
[10]
논문
Structural model of carnitine palmitoyltransferase I based on the carnitine acetyltransferase crystal
2004-05
[11]
논문
An environment-dependent structural switch underlies the regulation of carnitine palmitoyltransferase 1A
[12]
논문
Definition by functional and structural analysis of two malonyl-CoA sites in carnitine palmitoyltransferase 1A
2007-06
[13]
논문
Cysteine-scanning mutagenesis of muscle carnitine palmitoyltransferase I reveals a single cysteine residue (Cys-305) is important for catalysis
2005-02
[14]
서적
Biochemistry
Berg JM, Tymoczo JL, Stryer L
2007
[15]
논문
Structure and function of carnitine acyltransferases
2004-11
[16]
논문
The first 28 N-terminal amino acid residues of human heart muscle carnitine palmitoyltransferase I are essential for malonyl CoA sensitivity and high-affinity binding
2000-02
[17]
논문
Acetyl-CoA carboxylase 2 mutant mice are protected against obesity and diabetes induced by high-fat/high-carbohydrate diets
2003-09
[18]
논문
Expression analysis of two mutations in carnitine palmitoyltransferase IA deficiency
[19]
논문
Carnitine palmitoyltransferase 1A (CPT1A) P479L prevalence in live newborns in Yukon, Northwest Territories, and Nunavut
[20]
논문
Malonyl coenzyme A and the regulation of functional carnitine palmitoyltransferase-1 activity and fat oxidation in human skeletal muscle
2002-12
[21]
논문
Observations on the affinity for carnitine, and malonyl-CoA sensitivity, of carnitine palmitoyltransferase I in animal and human tissues. Demonstration of the presence of malonyl-CoA in non-hepatic tissues of the rat
1983-07
[22]
논문
Regulatory enzymes of mitochondrial beta-oxidation as targets for treatment of the metabolic syndrome
[23]
논문
A census of human soluble protein complexes
2012-08
[24]
논문
HIV-1 Vpr enhances PPARβ/δ-mediated transcription, increases PDK4 expression, and reduces PDC activity
2013-09
[25]
논문
A genome-wide short hairpin RNA screening of jurkat T-cells for human proteins contributing to productive HIV-1 replication
2009-07
[26]
논문
Crystal structure of carnitine acetyltransferase and implications for the catalytic mechanism and fatty acid transport
2003-01
[27]
논문
Genomics of the human carnitine acyltransferase genes
[28]
논문
Carnitine palmitoyltransferases 1 and 2: biochemical, molecular and medical aspects
[29]
논문
Mouse white adipocytes and 3T3-L1 cells display an anomalous pattern of carnitine palmitoyltransferase (CPT) I isoform expression during differentiation. Inter-tissue and inter-species expression of CPT I and CPT II enzymes
1997-10
[30]
논문
Adipose fatty acid oxidation is required for thermogenesis and potentiates oxidative stress-induced inflammation
2015-01
[31]
논문
Topology of carnitine palmitoyltransferase I in the mitochondrial outer membrane.
1997-05
[32]
논문
A novel brain-expressed protein related to carnitine palmitoyltransferase I
2002-10
[33]
논문
Carnitine palmitoyltransferase 1C: From Cognition to Cancer
http://wrap.warwick.[...]
2016-12
[34]
논문
Downregulation of fatty acid oxidation by involvement of HIF-1α and PPARγ in human gastric adenocarcinoma and its related clinical significance
https://pubmed.ncbi.[...]
2021-05
[35]
논문
Structural model of carnitine palmitoyltransferase I based on the carnitine acetyltransferase crystal
2004-05
[36]
논문
An environment-dependent structural switch underlies the regulation of carnitine palmitoyltransferase 1A
[37]
논문
Definition by functional and structural analysis of two malonyl-CoA sites in carnitine palmitoyltransferase 1A
2007-06
[38]
논문
Cysteine-scanning mutagenesis of muscle carnitine palmitoyltransferase I reveals a single cysteine residue (Cys-305) is important for catalysis
2005-02
[39]
서적
Biochemistry
https://www.worldcat[...]
W.H. Freeman
2007
[40]
논문
Structure and function of carnitine acyltransferases
2004-11
[41]
논문
The first 28 N-terminal amino acid residues of human heart muscle carnitine palmitoyltransferase I are essential for malonyl CoA sensitivity and high-affinity binding
2000-02
[42]
논문
Acetyl-CoA carboxylase 2 mutant mice are protected against obesity and diabetes induced by high-fat/high-carbohydrate diets
2003-09
[43]
논문
Expression analysis of two mutations in carnitine palmitoyltransferase IA deficiency
[44]
논문
Carnitine palmitoyltransferase 1A (CPT1A) P479L prevalence in live newborns in Yukon, Northwest Territories, and Nunavut
[45]
논문
Malonyl coenzyme A and the regulation of functional carnitine palmitoyltransferase-1 activity and fat oxidation in human skeletal muscle
2002-12
[46]
논문
Observations on the affinity for carnitine, and malonyl-CoA sensitivity, of carnitine palmitoyltransferase I in animal and human tissues. Demonstration of the presence of malonyl-CoA in non-hepatic tissues of the rat
1983-07
[47]
논문
Regulatory enzymes of mitochondrial beta-oxidation as targets for treatment of the metabolic syndrome
[48]
논문
HIV-1 Vpr enhances PPARβ/δ-mediated transcription, increases PDK4 expression, and reduces PDC activity
2013-09
[49]
논문
A genome-wide short hairpin RNA screening of jurkat T-cells for human proteins contributing to productive HIV-1 replication
2009-07
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
