이성질화 효소
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
이성질화 효소는 기질의 분자 내 원자 배열을 변경하는 반응을 촉매하는 효소의 한 종류이다. 효소위원회번호(EC)는 EC5로 분류되며, 라세미화 효소, 시스-트랜스 이성질화 효소, 분자 내 산화환원효소, 분자 내 전이효소, 분자 내 리아제, 기타 이성질화 효소 등 6개의 아강으로 나뉜다. 이성질화 효소는 고리 열림 및 닫힘, 에피머화, 분자 내 전이, 분자 내 산화 환원 등의 메커니즘을 통해 작용하며, 포스포헥소스 이성질화효소 결핍증과 삼탄당 인산 이성질화효소 결핍증과 같은 질병과 관련이 있다. 산업적으로는 고과당 옥수수 시럽 및 바이오 연료 생산에 사용된다.
더 읽어볼만한 페이지
- 이성질화 효소 - 변위효소
변위효소는 분자 내 원자단의 위치를 바꾸는 반응을 촉매하며, 기질의 구조는 변하지만 원자 조성은 변하지 않고, 비스포스포글리세린산 무타제 등이 이에 해당한다. - 이성질화 효소 - 에피머화효소 및 라세미화효소
- 효소 - 활성 부위
활성 부위는 효소 분자 내에서 기질과 결합하여 촉매 작용을 하는 특정 부위이며, 다양한 모델로 설명되고, 결합 부위, 촉매 부위, 보조인자를 포함하며, 저해제와 알로스테릭 부위와 관련되어 신약 개발에 활용된다. - 효소 - 제한 효소
제한 효소는 DNA의 특정 염기서열을 인식하여 절단하는 효소로, 유전체학과 생명공학 발전에 기여하여 노벨상을 수상했으며, 인식 서열 특이성 등에 따라 다양한 유형으로 분류되어 여러 연구 및 응용 분야에 활용된다.
| 이성질화 효소 | |
|---|---|
| 일반 정보 | |
| 명칭 | 이성질화 효소 (異性質化酵素) |
| 영어 명칭 | Isomerase |
| 일본어 명칭 | 異性化酵素(いせいかこうそ) |
| 분류 | |
| EC 번호 | EC 5 |
| 기능 | 분자 내 재배열 |
| 반응 유형 | 산화환원효소 전이효소 가수분해효소 리아제 연결효소 |
| 상세 분류 | |
| EC 5.1 | 라세미화효소 및 에피머화효소 |
| EC 5.2 | 시스-트랜스 이성질화효소 |
| EC 5.3 | 분자 내 산화환원효소 |
| EC 5.4 | 분자 내 전이효소 (mutase) |
| EC 5.5 | 분자 내 리아제 |
| 예시 | |
| 예시 효소 | 트라이오스 인산 이성질화효소 포도당-6-인산 이성질화효소 뷰티릴-CoA 뮤테이스 메틸말로닐-CoA 뮤테이스 |
2. 명명법
이성질화효소의 이름은 "기질 이성질화효소" (예: 에노일 CoA 이성질화 효소) 또는 "기질 이성질화효소의 종류" (예: 포스포글루코뮤테이스)와 같이 붙여진다.[7]
이성질화효소는 효소위원회번호(EC)에서 EC 5로 분류되며, 다음과 같이 6개의 하위 분류로 나뉜다.[8]
3. 분류
이성질화효소는 촉매하는 반응에 따라 다음과 같이 분류되기도 한다.3. 1. EC 5.1: 라세미화효소 및 에피머화효소
EC 5.1은 라세미화 및 에피머화를 촉매하는 효소를 포함한다. 이들은 표적 분자의 키랄 탄소에서 입체화학을 반전시키는 역할을 한다. 라세미화 효소는 하나의 키랄 탄소를 가진 분자에 작용하여 입체화학을 반전시키는 반면, 에피머화 효소는 여러 개의 키랄 탄소를 가진 분자를 표적으로 하여 그 중 하나에 작용한다.[2]
하나의 키랄 탄소만 있는 분자는 두 가지 거울상 이성질체 형태를 가진다. 예를 들어, 세린은 키랄 탄소에 대한 절대 배치에서만 다른 D-세린과 L-세린의 이성질체를 갖는다. 여러 개의 키랄 탄소를 가진 분자는 각 키랄 탄소에서 두 가지 형태를 갖는다. 이 중 하나의 키랄 탄소에서 이성질화가 일어나면, 단 하나의 키랄 탄소에서만 절대 배치가 서로 다른 에피머가 생성된다.[2] 예를 들어 D-글루코스와 D-만노스는 단 하나의 키랄 탄소에서 배치가 다르다.
이 부류는 효소가 작용하는 그룹에 따라 더 세분화된다.
3. 2. EC 5.2: 시스-트랜스 이성질화효소
EC 5.2는 시스-트랜스 이성질화 효소에 의한 이성질화를 다룬다. 알켄과 사이클로알케인은 시스-트랜스 입체 이성질체를 가질 수 있는데, 이는 절대 배열이 아닌 이중 결합이나 고리 구조에서 기준 평면 대비 치환기 위치로 구분된다. ''시스'' 이성질체는 치환기가 같은 쪽에, ''트랜스'' 이성질체는 반대쪽에 위치한다.[2]이 분류는 더 세분화되지 않는다.
| EC 번호 | 예시 |
|---|---|
| EC 5.2.1.1 | 말레산 이성질화 효소 |
| EC 5.2.1.2 | 말레일아세토아세트산 이성질화 효소 |
| EC 5.2.1.4 | 말레일피루브산 이성질화 효소 |
| EC 5.2.1.5 | 리놀레산 이성질화 효소 |
| EC 5.2.1.6 | 푸릴푸르아미드 이성질화 효소 |
| EC 5.2.1.8 | 펩티딜프롤릴 이성질화 효소 |
| EC 5.2.1.9 | 파네솔 2-이성질화 효소 |
| EC 5.2.1.10 | 2-클로로-4-카복시메틸렌부트-2-엔-1,4-올라이드 이성질화 효소 |
| EC 5.2.1.12 | 제타-카로틴 이성질화 효소 |
| EC 5.2.1.13 | 프로리코펜 이성질화 효소 |
| EC 5.2.1.14 | 베타-카로틴 이성질화 효소 |
3. 3. EC 5.3: 분자 내 산화환원효소
이 분류(EC 5.3)는 분자 내 산화 환원 효소를 포함한다. 이들 이성질화 효소는 분자 내의 한 부분에서 다른 부분으로 전자를 이동시키는 반응을 촉매한다. 즉, 분자 내의 한 부분의 산화와 다른 부분의 동시적인 환원을 촉매한다.[8]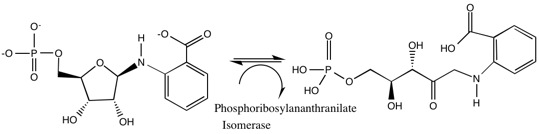
| EC 번호 | 설명 | 예시 |
|---|---|---|
| EC 5.3.1 | 알도스와 케토스 상호 변환 | 트라이오스 인산 이성질화 효소, 리보스-5-인산 이성질화 효소 |
| EC 5.3.2 | 케토- 및 엔올-기 상호 변환 | 페닐피루브산 토토머라제, 옥살아세트산 토토머라제 |
| EC 5.3.3 | C=C 이중 결합 전위 | 스테로이드 델타-이성질화 효소, L-도파크롬 이성질화 효소 |
| EC 5.3.4 | S-S 결합 전위 | 단백질 이황화물 이성질화 효소 |
| EC 5.3.99 | 기타 분자 내 산화 환원 효소 | 프로스타글란딘-D 합성 효소, 알렌-산화물 사이클라제 |
3. 4. EC 5.4: 분자 내 전이효소 (뮤테이스)
EC 5.4는 분자 내 전이효소(뮤테이스)를 포함한다. 이러한 이성질화효소는 분자 내의 한 부분에서 다른 부분으로 작용기를 전이하는 반응을 촉매한다.[8] 1983년까지는 인산전이효소(EC 5.4.2)가 공여체의 재생과 함께 전이효소(EC 2.7.5)로 분류되었다.[9]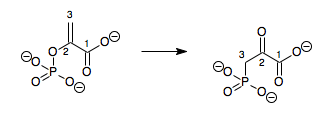
이 하위 분류는 효소가 전이하는 작용기에 따라 분류할 수 있다.
| EC 번호 | 설명 | 예시 |
|---|---|---|
| EC 5.4.1 | 아실기 전이 | 라이소레시틴 아실뮤테이스, 프리코린-8X 메틸뮤테이스 |
| EC 5.4.2 | 인산전이효소(포스포뮤테이스) | 포스포글루코뮤테이스, 포스포펜토뮤테이스 |
| EC 5.4.3 | 아미노기 전이 | 베타-라이신 5,6-아미노뮤테이스, 타이로신 2,3-아미노뮤테이스 |
| EC 5.4.4 | 하이드록시기 전이 | (하이드록시아미노)벤젠 뮤테이스, 이소코리스마테 신타아제 |
| EC 5.4.99 | 기타 그룹 전이 | 메틸아스파르테이트 뮤테이스, 코리스마테 뮤테이스 |
분자 내 전이 반응 효소는 뮤테이스라고 불리기도 한다.
3. 5. EC 5.5: 분자 내 리아제
이 분류(EC 5.5)에는 분자 내 리아제가 포함된다. 이 효소는 "분자의 한 부분에서 그룹이 제거되어 이중 결합을 형성하는 반응을 촉매하며, 동시에 분자에 공유 결합으로 부착되어 있는 반응"을 촉매한다.[8] 이러한 반응 중 일부는 고리 구조의 파괴를 포함한다.이 분류는 더 세분화되지 않는다. 현재 모든 항목은 다음을 포함한다.
| EC 번호 | 예시 |
|---|---|
| EC 5.5.1.1 | 무코네이트 시클로이소머라제 |
| EC 5.5.1.2 | 3-카르복시-시스,시스-무코네이트 시클로이소머라제 |
| EC 5.5.1.3 | 테트라하이드록시프테리딘 시클로이소머라제 |
| EC 5.5.1.4 | 이노시톨-3-인산 합성 효소 |
| EC 5.5.1.5 | 카르복시-시스,시스-무코네이트 시클라제 |
| EC 5.5.1.6 | 칼콘 이성질화 효소 |
| EC 5.5.1.7 | 클로로무코네이트 시클로이소머라제 |
| EC 5.5.1.8 | (+)-보르닐 이인산 합성 효소 |
| EC 5.5.1.9 | 시클로유칼레놀 시클로이소머라제 |
| EC 5.5.1.10 | 알파-피넨-옥사이드 데사이클라제 |
| EC 5.5.1.11 | 디클로로무코네이트 시클로이소머라제 |
| EC 5.5.1.12 | 코파릴 이인산 합성 효소 |
| EC 5.5.1.13 | Ent-코파릴 이인산 합성 효소 |
| EC 5.5.1.14 | 신-코파릴-이인산 합성 효소 |
| EC 5.5.1.15 | 테르펜테디에닐-이인산 합성 효소 |
| EC 5.5.1.16 | 할리마디에닐-이인산 합성 효소 |
| EC 5.5.1.17 | (S)-베타-마크로카르펜 합성 효소 |
| EC 5.5.1.18 | 리코펜 엡실론-사이클라제 |
| EC 5.5.1.19 | 리코펜 베타-사이클라제 |
| EC 5.5.1.20 | 프로솔라나파이론-III 시클로이소머라제 |
| EC 5.5.1.n1 | D-리보스 피라나제 |
분자 내 리아제는 분자 내 절단 반응 효소로도 불린다.
3. 6. EC 5.99: 기타 이성질화효소
EC 5.99는 토포아이소머레이스와 같은 다른 이성질화효소들을 포함한다.4. 이성질화 반응 메커니즘
이성질화 효소는 한 분자 내에서 변화를 촉매하여 하나의 이성질체를 다른 이성질체로 변환시킨다.[1] 이때, 생성물은 원래 분자와 분자식은 같지만 물리적 구조가 다르다. 이성질체는 구조 이성질체와 입체 이성질체로 분류할 수 있다. 구조 이성질체는 결합 순서나 연결성이 다른 반면, 입체 이성질체는 결합 순서와 연결성은 같지만 원자의 3차원 배열이 다르다.
예를 들어, 헥세인은 5가지 구조 이성질체를 가지며, 2-뷰텐은 시스-2-뷰텐과 트랜스-2-뷰텐의 두 가지 입체 이성질체로 존재한다.[2]
이성질화 효소의 하위 범주에는 라세미화효소, 에피머화효소 및 시스-트랜스 이성질화 효소가 있으며, 이들은 입체 이성질체의 상호 변환을 촉매한다. 분자 내 라이에이스, 산화환원효소, 전이효소는 구조 이성질체의 상호 변환을 촉매한다.
자연계에서 각 이성질체의 비율은 활성화 에너지에 따라 달라진다. 에너지 준위가 비슷한 이성질체는 쉽게 상호 변환되며 비슷한 비율로 존재한다. 예를 들어, 안정한 시스 이성질체가 덜 안정한 트랜스 이성질체로 변환되는 데 필요한 에너지는 역반응보다 크다. 따라서 이성질화 효소나 외부 에너지원이 없으면 시스 이성질체가 트랜스 이성질체보다 더 많이 존재한다. 이성질화 효소는 이성질화 에너지를 낮춰 반응 속도를 증가시킨다.[3]
이성질화 효소의 효소 반응속도론은 실험 데이터로 계산하기 어렵다. 이성질화는 비가역 반응이 아니고, 반응 용기에 하나의 기질과 하나의 생성물이 존재하여 미카엘리스-멘텐 식을 적용하기 어렵기 때문이다.[4]
이러한 기술적 어려움을 극복하기 위해 트레이서 섭동 기술이 사용된다. 이 기술은 동위 원소 표지를 사용하여 두 가지 형태의 자유 효소 간의 가역 반응을 간접적으로 측정한다. 방사성 동위원소로 표지된 기질과 생성물은 시간에 따라 확산되며, 화학 평형 상태에서 표지되지 않은 기질을 첨가하면 평형이 깨진다. 평형이 다시 설정될 때 방사성 동위원소로 표지된 기질과 생성물을 추적하여 에너지 정보를 얻는다.[5]
이 기술은 인산글루코뮤테이스의 작용 기전과 역학을 밝히는 데 처음 사용되었으며, 인산의 간접적 이동 모델과 글루코스의 직접적 이동 모델을 지지하는 결과를 얻었다.[6] 이후 프롤린 라세메이스 연구에도 활용되어, 이 효소의 두 가지 형태와 전이상태에 대한 정보를 제공했다.[5]
4. 1. 고리 열림 및 닫힘
포도당-6-인산 이성질화 효소는 D-포도당-6-인산을 D-과당-6-인산으로 전환시키는 분자 내 산화환원효소이다. 이 반응은 산-염기 촉매를 통해 고리를 열어 알도스를 형성하고, 시스-엔다이올 중간체를 거쳐 케토스를 형성한 후 고리가 다시 닫히는 과정을 포함한다.[10]포도당-6-인산 이성질화 효소의 활성 부위에 포도당-6-인산이 결합하면, 효소의 His388 잔기가 포도당 고리의 산소를 양성자화하여 고리를 연다. 동시에 Lys518이 C1 하이드록실 산소를 탈양성자화한다. 고리가 열리면 산성 C2 양성자를 가진 직선형 알도스가 형성된다. 이후 C3-C4 결합이 회전하고 Glu357이 C2를 탈양성자화하여 C1과 C2 사이에 이중 결합을 형성, 시스-엔다이올 중간체가 만들어진다. C1 산소는 촉매 잔기에 의해 양성자화되고, 엔다이올 C2 산소의 탈양성자화가 동반되어 직선형 케토스가 형성된다. 마지막으로 과당 고리를 닫기 위해 고리 열림의 역반응이 일어나고 케토스가 양성자화된다.[10]
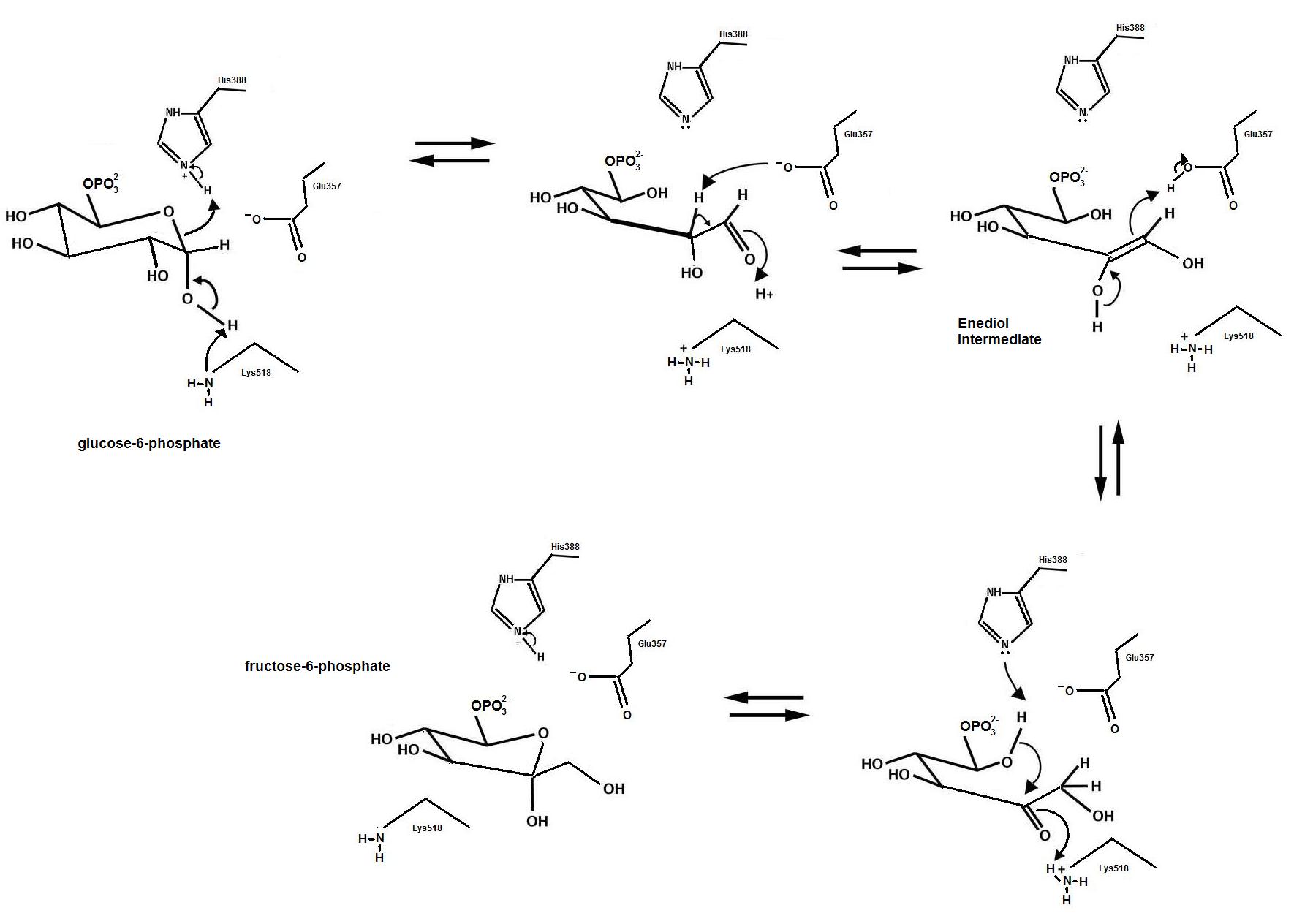
4. 2. 에피머화
'''에피머화 효소'''(영어: epimerase)는 광학 이성질체의 상호 변환을 촉매하는 이성질화 효소 중, 기질 분자 내에 복수의 입체 구조 중 하나를 이성화하는 효소이다.[31] 기질 분자가 불균등점을 하나만 가지고 그것을 이성화하는 효소를 '''라세미화 효소'''(영어: racemase)라고 부른다. 아미노산은 통상적으로 불균등점을 하나만 가지므로 아미노산의 이성화 효소는 일반적으로 라세미화 효소라고 불린다. 반면 당은 다수의 불균등점을 가지기 때문에 이성화 효소는 일반적으로 에피머화 효소라고 불린다. 당이라도 불균등점이 한 곳이라면 라세미화 효소라고 불린다.[31]
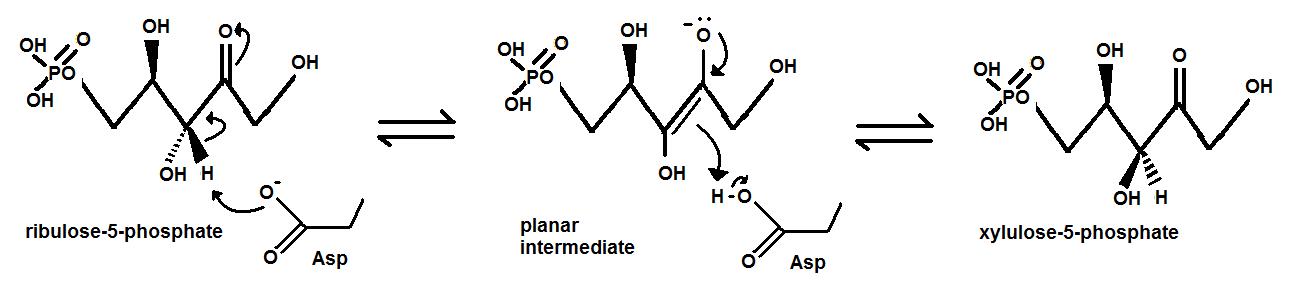
에피머화의 한 예는 캘빈 회로에서 리불로스 인산 3-에피머화효소에 의해 D-리불로스-5-인산이 D-자일룰로스 5-인산으로 전환될 때 발견된다. 기질과 생성물은 사슬의 세 번째 탄소에서의 입체화학에서만 차이가 있다. 기본적인 메커니즘은 반응성 엔올레이트 중간체를 형성하기 위해 세 번째 탄소의 탈양성자화와 관련된다. 효소의 활성 부위에는 두 개의 Asp 잔기가 포함되어 있다. 기질이 효소에 결합된 후, 첫 번째 Asp는 분자의 한쪽에서 세 번째 탄소의 양성자를 제거한다. 이것은 평면 sp2-혼성화된 중간체를 남긴다. 두 번째 Asp는 활성 부위의 반대쪽에 위치하며 분자를 양성자화하여 뒷면에서 양성자를 효과적으로 추가한다. 이러한 결합된 단계는 세 번째 탄소에서 입체 화학을 반전시킨다.[11]
일부 효소는 균일화, 결정화되거나 보조 인자 요구성 등 특징이 명확해졌지만, X선 해석 등 효소의 입체 구조 해석이 진전되지 않아 이성화 반응 기구가 불명확한 것도 많다.[32]
4. 3. 분자 내 전이
이성질화 효소는 한 분자 내에서 일어나는 변화를 촉매하는 효소이다.[1] 이들은 하나의 이성질체를 다른 이성질체로 변환시키는데, 이는 최종 생성물이 원래 분자와 동일한 분자식을 갖지만, 물리적인 구조는 다르다는 것을 의미한다. 이성질체는 그 자체로 다양한 종류가 있지만, 일반적으로 구조 이성질체와 입체 이성질체로 분류할 수 있다.분자 내 라이에이스, 산화환원 효소 및 전이 효소는 구조 이성질체의 상호 변환을 촉매한다.
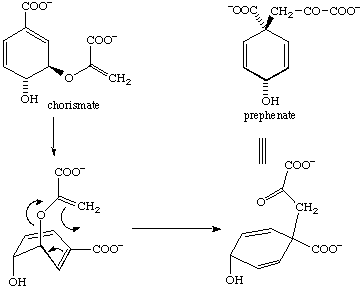
코리스메이트 뮤테이스는 분자 내 전이 효소의 일종으로, 일부 식물과 박테리아에서 L-타이로신과 L-페닐알라닌의 전구체로 사용되는 코리스메이트를 프레페네이트로 전환하는 반응을 촉매한다. 이 반응은 클레이센 재배열이며, 이성질화 효소의 유무에 관계없이 진행될 수 있지만, 코리스메이트 뮤테이스가 존재할 경우 반응 속도가 106배 증가한다. 이 반응은 기질이 트랜스-디액시얼 위치에 있는 의자 전이 상태를 거친다.[12] 실험적 증거에 따르면, 이성질화 효소는 의자 전이 상태에 선택적으로 결합하지만, 촉매 작용의 정확한 메커니즘은 알려져 있지 않다.
4. 4. 분자 내 산화 환원
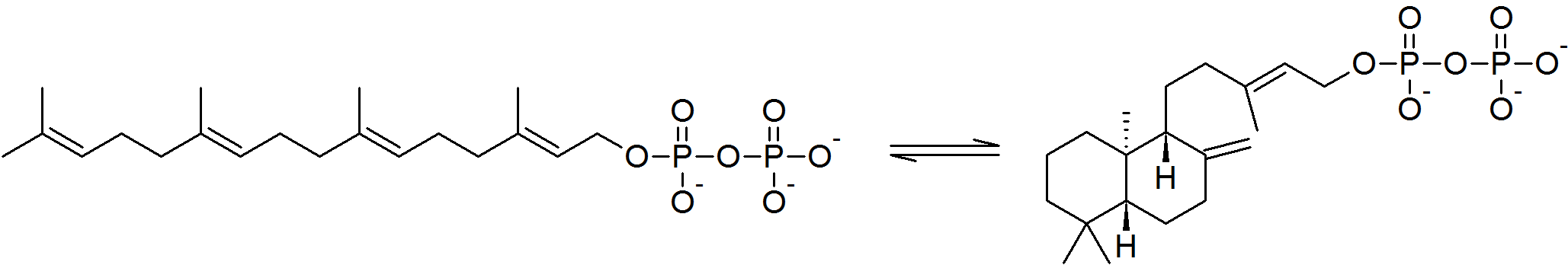
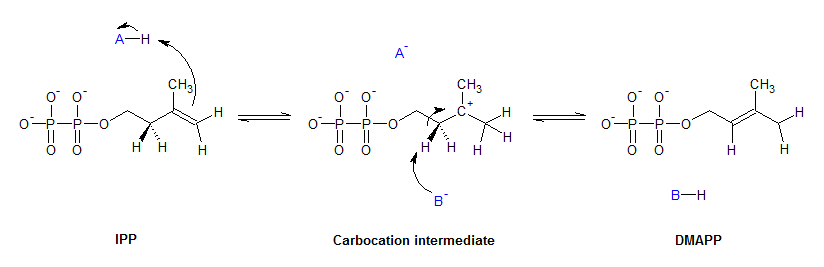
이성질화 효소는 분자 내의 변화를 촉매하여, 한 이성질체를 다른 이성질체로 변환시킨다.[1] 이 과정에서 생성물은 원래 분자와 동일한 분자식을 갖지만, 물리적 구조는 달라진다. 이성질체에는 여러 종류가 있지만, 크게 구조 이성질체와 입체 이성질체로 나눌 수 있다. 분자 내 산화 환원 효소는 분자 내에서 전자의 이동을 촉매하여 이성질체 간의 변환을 일으킨다.아이소펜테닐 이인산 델타 이성질화 효소 I형(IPP 이성질화 효소)은 콜레스테롤 생합성 과정에서 중요한 역할을 하며, 아이소펜테닐 이인산(IPP)을 다이메틸알릴 이인산(DMAPP)으로 바꾸는 반응을 촉매한다. 이 반응에서 탄소-탄소 이중 결합이 재배열되어 친전자체적인 알릴 전위 이성질체가 생성된다. IPP 이성질화 효소는 단일 양성자의 입체 선택성적인 반대면 전위를 통해 이 반응을 촉매한다. C4 위치에 양성자가 첨가되어 C3에 삼차 탄소 양이온 중간체가 형성되고, 이어서 반대쪽 면의 C2에서 양성자가 제거되면서 이중 결합이 이동한다.[14]
5. 인간 질병과의 관련성
이성질화 효소는 인간 질병에 관여한다. 이 효소의 결핍은 인간에게 질환을 유발할 수 있는데, 대표적인 예로 포스포헥소스 이성질화효소 결핍증과 삼탄당 인산 이성질화효소 결핍증이 있다.
5. 1. 포스포헥소스 이성질화효소 결핍증
포스포헥소스 이소머라제 결핍증(PHI)은 포스포글루코스 이소머라제 결핍증 또는 글루코스-6-인산 이소머라제 결핍증이라고도 하며, 유전 효소 결핍증이다. PHI는 해당과정에서 피루브산 키네이스 결핍증 다음으로 두 번째로 흔한 적혈구 효소병증이며, 다양한 중증도의 비구상 적혈구 용혈성 빈혈과 관련이 있다.[15][17] 이 질병은 글루코스-6-인산 단백질에 중점을 두는데, 이 단백질은 일부 암세포의 분비물에서 발견될 수 있다.[16] PHI는 과당-6-인산과 글루코스-6-인산의 가역적인 상호 변환을 촉매하는 이량체 효소의 결과이다.[15]PHI는 매우 드문 질병으로 현재까지 문헌에 50건의 사례만 보고되었다.[15] 진단은 임상 양상과 함께 적혈구 GPI 결핍(정상 수준의 7~60%)을 나타내는 생화학적 연구 및 분자 분석을 통한 GPI 유전자 돌연변이 식별을 기반으로 한다.[15]
포스포헥소스 이소머라제의 결핍은 용혈성 증후군이라고 하는 질환으로 이어질 수 있다. 사람과 마찬가지로, 적혈구 수 감소, 헤마토크릿 감소, 헤모글로빈 감소, 망상 적혈구 수 증가 및 혈장 빌리루빈 농도 증가, 간 및 비장 체형 지수 증가를 특징으로 하는 용혈성 증후군은 동형 접합 돌연변이에서만 나타났다.[17]
5. 2. 삼탄당 인산 이성질화효소 결핍증
삼탄당 인산 이성질화효소(TPI) 결핍증은 당분해 대사의 심각한 상염색체 열성 유전 다계통 질환이다.[18] 이 질환은 용혈성 빈혈과 신경 퇴행을 특징으로 하며, 혐기성 대사 기능 장애로 인해 발생한다. 이러한 기능 장애는 암호화된 TPI 단백질에 영향을 미치는 미스센스 돌연변이로 인해 발생한다.[19] 가장 흔한 돌연변이는 유전자 치환, Glu104Asp이며, 이는 가장 심각한 표현형을 생성하며 임상 TPI 결핍의 약 80%를 차지한다.[18]TPI 결핍은 매우 드물며 문헌에 50건 미만이 보고되었다.[20] 상염색체 열성 유전 질환이므로, TPI 결핍은 이형 접합 부모의 경우 25%의 재발 위험이 있다.[18][20] 이 질환은 선천성 질환으로, 용혈성 빈혈과 함께 가장 흔하게 발생하며 황달로 나타난다.[18] Glu104Asp 돌연변이가 있거나 TPI 무효 대립 유전자와 Glu104Asp에 대해 이형 접합성을 가진 TPI 환자의 대부분은 영아기에서 유아기 초기에 생존할 것으로 예상된다. 다른 돌연변이가 있는 TPI 환자는 일반적으로 더 긴 수명을 보인다. TPI가 있는 개인이 6세 이상 생존한 경우는 단 두 건이 있다. 이 사례는 헝가리 출신의 두 형제로, 한 명은 12세가 될 때까지 신경학적 증상이 나타나지 않았고, 형은 신경학적 증상이 없고 빈혈만 앓고 있다.[21]
TPI 환자는 생후 6~24개월 후에 뚜렷한 증상을 보인다. 이러한 증상에는 근육 긴장 이상, 떨림, 운동 이상증, 추체로 증상, 심근증 및 척수 운동 신경원 침범이 포함된다.[18] 환자는 또한 호흡기계 세균 감염이 자주 나타난다.[18]
TPI는 효소 활성의 결핍과 적혈구 내의 독성 기질인 디히드록시아세톤 인산(DHAP)의 축적을 통해 감지된다.[18][20] 이는 신체 검사 및 일련의 실험실 검사를 통해 감지할 수 있다. 검사에서 일반적으로 근육에서 근병증 변화가 보이고 신경에서 만성 축삭 신경병증이 발견된다.[18] TPI의 진단은 분자 유전학을 통해 확인할 수 있다.[18] 융모막 융모 DNA 분석 또는 태아 적혈구 분석을 사용하여 산전 진단에서 TPI를 감지할 수 있다.[18]
TPI에 대한 치료는 구체적인 것은 아니지만, 다양한 경우에 따라 다르다. TPI가 유발하는 증상의 범위로 인해 단일 개인에게 치료를 제공하기 위해 여러 전문가 팀이 필요할 수 있다. 해당 전문가 팀은 소아과 의사, 심장 전문의, 신경과 의사 및 포괄적인 행동 계획을 개발할 수 있는 기타 의료 전문가로 구성된다.[22] 심한 빈혈의 경우 적혈구 수혈과 같은 지지 요법도 TPI를 치료하기 위해 사용할 수 있다. 경우에 따라 비장 절제술(비장 제거)은 빈혈을 개선할 수 있다. 질병의 다른 비혈액학적 임상 증상의 진행성 신경학적 손상을 예방할 수 있는 치료법은 없다.[23]
6. 산업적 응용
이성질화 효소는 다양한 산업 분야에서 활용되는데, 특히 설탕 제조와 바이오 연료 생산에 중요한 역할을 한다.
고과당 옥수수 시럽 생산에서 이성질화 효소는 글루코스를 과당으로 전환시켜 고과당 옥수수 시럽을 만드는 데 핵심적인 역할을 한다. 이는 기존의 화학적 방법보다 효율적이고 순수한 과당을 생산할 수 있게 한다. 또한, 글루코스 이성질화 효소는 자일로스를 자일룰로스로 전환하는 데에도 사용될 수 있다.[24]
바이오 연료 생산에서 자일로스를 자일룰로스로 전환하는 것은 중요한 상업적 응용 분야이다. 이 반응은 자연적으로 부패하는 식물성 물질을 먹는 부식자에서 자주 관찰된다. 산업적으로는 자일룰로스를 발효시켜 에탄올을 생산하는 데 사용된다. 이 과정에서 헤미셀룰로스를 원료로 사용하며, 헤미셀룰로스에 포함된 자일란은 β(1,4) 결합으로 연결된 자일로스로 구성되어 있다.[27] 글루코스 이성질화 효소는 자일로스를 자일룰로스로 효율적으로 전환하여 발효 효모가 작용할 수 있도록 한다.
글루코스 이성질화 효소는 D-리보스, D-알로스, L-아라비노스 등 다양한 설탕의 이성질화를 촉매할 수 있다. 이 효소의 가장 효율적인 기질은 글루코스와 자일로스와 유사하며, 세 번째 및 네 번째 탄소에 적도 수산기를 갖는다.[28] 현재 밝혀진 글루코스 이성질화 효소의 메커니즘은 X-선 결정학 및 동위원소 교환 연구를 기반으로 한 수소화물 이동이다.[24]
전반적으로, 글루코스 이성질화 효소를 최적화하고 산업적 응용 분야에서 재사용을 위해 회수를 용이하게 하기 위한 유전 공학에 대한 광범위한 연구가 투자되었다.
6. 1. 고과당 옥수수 시럽 생산
이성질화 효소의 산업적 응용에서 가장 흔한 사용은 설탕 제조 분야이다. 글루코스 이성질화 효소(일명 자일로스 이성질화 효소)는 D-자일로스와 D-글루코스를 D-자일룰로스와 D-과당으로 전환하는 반응을 촉매한다. 대부분의 설탕 이성질화 효소와 마찬가지로, 글루코스 이성질화 효소는 알도스와 케토스 간의 상호 변환을 촉매한다.[24]글루코스를 과당으로 전환하는 것은 고과당 옥수수 시럽 생산의 핵심 요소이다. 이성질화는 과당 생산의 오래된 화학적 방법보다 더 구체적이어서 더 높은 수율의 과당을 얻을 수 있으며 부산물이 발생하지 않는다.[24] 이 이성질화 반응으로 생성된 과당은 오염으로 인한 잔류 맛이 없어 순수하다. 고과당 옥수수 시럽은 과당의 높은 감미력(자당의 두 배[25]), 상대적으로 낮은 가격, 결정화되지 않는 특성 때문에 많은 제과 및 청량 음료 제조업체에서 선호한다. 과당은 또한 당뇨병 환자가 사용할 감미료로도 사용된다.[24]
글루코스 이성질화 효소 사용의 주요 문제점은 더 높은 온도에서 비활성화되고 반응 환경에서 높은 pH (7.0에서 9.0 사이)가 필요하다는 것이다. 70°C 이상의 적당히 높은 온도는 이성질화 단계에서 과당 수율을 최소한 절반 이상 증가시킨다.[26] 이 효소는 최고 활성을 위해 2가 양이온, 예를 들어 Co2+ 및 Mg2+을 필요로 하며, 이는 제조업체에 추가 비용을 발생시킨다. 또한 글루코스 이성질화 효소는 글루코스보다 자일로스에 대한 친화력이 훨씬 높으므로, 주의 깊게 제어된 환경이 필요하다.[24]
6. 2. 바이오 연료 생산
이성질화 효소는 산업적으로 설탕 제조 분야에서 흔히 사용된다. 글루코스 이성질화 효소(자일로스 이성질화 효소)는 D-자일로스와 D-글루코스를 D-자일룰로스와 D-과당으로 전환하는 반응을 촉매한다. 대부분의 설탕 이성질화 효소와 마찬가지로 글루코스 이성질화 효소는 알도스와 케토스 간의 상호 변환을 촉매한다.[24]글루코스를 과당으로 전환하는 것은 고과당 옥수수 시럽 생산의 핵심이다. 이성질화는 과당 생산의 오래된 화학적 방법보다 더 구체적이어서 더 높은 수율의 과당을 얻을 수 있으며 부산물이 발생하지 않는다.[24] 이 이성질화 반응으로 생성된 과당은 오염으로 인한 잔류 맛이 없어 순수하다. 고과당 옥수수 시럽은 과당의 높은 감미력(자당의 두 배[25]), 상대적으로 낮은 가격, 결정화되지 않는 특성 때문에 많은 제과 및 청량 음료 제조업체에서 선호한다. 과당은 당뇨병 환자가 사용할 감미료로도 사용된다.[24]
자일로스를 자일룰로스로 이성질화하는 것은 바이오 연료에 대한 관심이 증가함에 따라 자체적인 상업적 응용 분야를 갖는다. 이 반응은 부패하는 식물성 물질을 먹는 부식자에서 자연적으로 자주 관찰된다. 가장 일반적인 산업적 사용은 자일룰로스의 발효를 통해 에탄올을 생산하는 것이다. 헤미셀룰로스를 원료로 사용하는 것이 매우 일반적이다. 헤미셀룰로스는 자일란을 함유하고 있으며, 자일란 자체는 β(1,4) 결합으로 연결된 자일로스로 구성된다.[27] 글루코스 이성질화 효소는 자일로스를 매우 효율적으로 자일룰로스로 전환하며, 자일룰로스는 발효 효모에 의해 작용할 수 있다.
참조
[1]
서적
Enzyme nomenclature, 1978 recommendations of the Nomenclature Committee of the International Union of Biochemistry on the nomenclature and classification of enzymes.
https://archive.org/[...]
Academic Press
[2]
서적
Compendium of Chemical Terminology
http://goldbook.iupa[...]
Blackwell Scientific Publications
[3]
서적
Organic Chemistry
Jones and Bartlett
[4]
서적
Fundamentals of Enzyme Kinetics
Wiley-VCH
2013-02-22
[5]
논문
Energetics of proline racemase: tracer perturbation experiments using [14C]proline that measure the interconversion rate of the two forms of free enzyme
1986-05
[6]
논문
The mechanism of the phosphoglucomutase reaction. Studies on rabbit muscle phosphoglucomutase with flux techniques
1968-11
[7]
서적
Essential Organic Chemistry
Prentice Hall
[8]
서적
Enzyme nomenclature 1992 : recommendations of the Nomenclature Committee of the International Union of Biochemistry and Molecular Biology on the nomenclature and classification of enzymes
https://archive.org/[...]
Published for the International Union of Biochemistry and Molecular Biology by Academic Press
[9]
서적
The Enzyme List Class 5 - Isomerases
http://www.enzyme-da[...]
Nomenclature Committee of the International Union of Biochemistry and Molecular Biology (NC-IUBMB)
[10]
논문
The crystal structure of mouse phosphoglucose isomerase at 1.6A resolution and its complex with glucose 6-phosphate reveals the catalytic mechanism of sugar ring opening
2004-09
[11]
논문
Characterization of an enzyme which catalyzes isomerization and epimerization of D-erythrose 4-phosphate
1985-04
[12]
서적
Introduction to Enzyme and Coenzyme Chemistry
Wiley
[13]
논문
A strategically positioned cation is crucial for efficient catalysis by chorismate mutase
2000-11
[14]
논문
The crystal structure of human isopentenyl diphosphate isomerase at 1.7 A resolution reveals its catalytic mechanism in isoprenoid biosynthesis
2007-03
[15]
논문
Glucose-6-phosphate isomerase deficiency
2000-03
[16]
논문
Detection of phosphohexose isomerase deficiency in human fibroblast cultures
1970-01-01
[17]
논문
Glucose-6-phosphate isomerase deficiency associated with nonspherocytic hemolytic anemia in the mouse: an animal model for the human disease
http://www.bloodjour[...]
[18]
웹사이트
Triose phosphate-isomerase deficiency
http://www.orpha.net[...]
2013-11-14
[19]
논문
Drosophila model of human inherited triosephosphate isomerase deficiency glycolytic enzymopathy
2006-11
[20]
논문
Triosephosphate isomerase deficiency: a neurodegenerative misfolding disease
http://www.enzim.hu/[...]
2013-11-27
[21]
논문
Hereditary triosephosphate isomerase (TPI) deficiency: two severely affected brothers one with and one without neurological symptoms
1993-11
[22]
웹사이트
Triosephosphate Isomerase Deficiency
http://www.raredisea[...]
NORD
2013-12-14
[23]
웹사이트
Triose phosphate isomerase deficiency -TPI
http://www.enerca.or[...]
2013-11-26
[24]
논문
Molecular and industrial aspects of glucose isomerase
1996-06
[25]
논문
Pure fructose syrups
[26]
논문
Glucose isomerase production of high fructose syrups
[27]
논문
Fermentation of a pentose by yeasts
1980-05
[28]
논문
Glucose isomerase
1980-08
[29]
웹사이트
Superfamilies of single-pass transmembrane lyases
http://membranome.or[...]
[30]
문서
イソメラーゼ
岩波書店
[31]
문서
エピメラーゼ
岩波書店
[32]
문서
異性化酵素
平凡社
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
