텔로미어
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
텔로미어는 염색체 말단을 보호하는 구조로, 1930년대 허먼 J. 뮬러와 바버라 매클린톡에 의해 처음 발견되었다. 텔로미어는 DNA의 특정 반복 서열과 단백질로 구성되며, 텔로미어 DNA는 T-루프 또는 G-쿼드러플렉스와 같은 독특한 구조를 형성하여 염색체를 보호하고 안정화시킨다. 텔로미어는 세포 분열 시마다 짧아지며, 텔로머레이스라는 효소에 의해 길이를 유지하거나 연장될 수 있다. 텔로미어의 길이와 텔로머레이스 활성은 노화, 암 발생, 그리고 수명과 관련된 중요한 요소로 연구되고 있다.
더 읽어볼만한 페이지
- 텔로미어 - 염색분체
염색분체는 염색체를 구성하는 두 가닥 중 하나로, 동일한 염색체의 복제본인 자매 염색분체와 상동 염색체 쌍을 이루는 비자매 염색분체로 나뉘며, 자매 염색분체는 유사 분열 또는 감수 분열 II 후기에 분리되고 비자매 염색분체는 감수 분열 전기 I에 염색체 교차를 통해 유전 물질을 교환한다. - 텔로미어 - 텔로머레이스
텔로머레이스는 진핵세포 염색체 말단의 텔로미어 DNA 반복 서열을 연장하는 역전사 효소로, 세포 분열 시 텔로미어 단축을 막아 세포 수명 유지에 중요한 역할을 하며, RNA 구성 요소(TERC)와 역전사 효소(TERT) 복합체로 구성되어 세포 노화, 암, 유전 질환 연구와 관련이 있고, 텔로미어와 텔로머레이스 기능 연구로 엘리자베스 블랙번, 캐럴 W. 그리더, 잭 W. 쇼스택이 2009년 노벨 생리학·의학상을 수상했다. - 비부호화 DNA - 인트론
진핵생물 유전자에서 엑손 사이에 존재하는 비코딩 DNA 서열인 인트론은 스플라이싱 과정을 거쳐 제거되며 유전자 발현 조절, 선택적 스플라이싱 등 다양한 기능에 관여하는 것으로 여겨진다. - 비부호화 DNA - 비번역 DNA
비번역 DNA는 단백질을 암호화하지 않지만 유전자 발현 조절, 염색체 구조 유지, 유전체 안정성에 중요한 역할을 하며 프로모터, 인핸서, 인트론, 텔로미어, 유사유전자 등의 다양한 종류가 있고 질병 관련 유전자 변이 연구에 활용된다. - 염색체 - 종분화
종분화는 하나의 종이 두 개 이상의 별개 종으로 갈라지는 진화 과정으로, 유성생식, 이소적·주변적·측지적·동소적 종분화 메커니즘, 생태적·성 선택, 강화, 다배수체 형성, 잡종 종분화, 인위적 종분화 등 다양한 요인과 과정을 통해 발생하며, 점진적 진화와 단속평형설이라는 속도에 대한 논쟁이 존재한다. - 염색체 - 감수분열
감수분열은 유성생식을 하는 생물에서 배우자를 형성하는 세포분열 과정으로, 염색체 수를 줄여 유전적 다양성을 확보하며, 감수분열 I과 II 두 단계로 구성되어 상동염색체 및 자매염색분체 분리, 독립적 분리 및 교차를 통해 유전적 다양성을 증가시키지만, 염색체 비분리 오류는 염색체 이상 질환을 유발할 수 있고 진핵생물 유성생식과 진화에 필수적인 과정이다.
| 텔로미어 | |
|---|---|
| 정의 | |
| 설명 | 염색체의 반복적인 뉴클레오타이드 서열 부위이다. |
| 상세 정보 | |
| 기능 | 세포 분열 시 염색체를 보호하는 역할을 한다. |
| 구성 | 반복적인 DNA 서열과 단백질 복합체로 구성된다. |
| 위치 | 진핵생물 염색체의 말단에 위치한다. |
| 관련 정보 | |
| 관련 질병 | 텔로미어 단축은 노화 및 암과 관련될 수 있다. |
| 연구 분야 | 텔로미어는 노화, 암, 세포 사멸 등 다양한 생물학적 과정 연구에 중요한 역할을 한다. |
| 추가 정보 | |
| 어원 | 그리스어 "τέλος" (텔로스, 끝)와 "μέρος" (메로스, 부분)에서 유래했다. |
2. 발견
1930년대에 허먼 J. 뮬러와 바바라 매클린톡은 각각 초파리와 옥수수 연구를 통해 염색체 말단에 특수한 구조가 존재한다는 것을 발견했다.[1] 뮬러는 방사선에 노출된 초파리 염색체 끝부분에서 결실이나 역위와 같은 변형이 나타나지 않는 것을 관찰하고, 텔로미어라는 "염색체의 말단을 보호하는 염색체의 요소"를 정의했다.[2] 매클린톡영어은 옥수수를 사용한 유전학적 연구를 통해 염색체의 말단에 캡 구조가 있을 것이라고 추측했다.[1]
텔로미어는 DNA의 특징적인 반복 서열(텔로미어 DNA)과 거기에 국한되는 다양한 단백질로 구성되어 있다. 인공적으로 구축한 포유류의 텔로미어는 전자 현미경을 사용하여 '''T-루프'''라고 불리는 특징적인 구조를 하고 있는 것이 관찰되었다.
1970년대 초, 소련의 이론가 알렉세이 올로브니코프는 염색체가 끝부분을 완전히 복제할 수 없다는 것을 인식하고, "말단 복제 문제"를 제기했다. 그는 세포가 복제될 때마다 DNA 서열이 손실되어 세포 분열이 종료된다고 제안했다.[3][4][5]
1975년부터 1977년까지, 엘리자베스 블랙번은 예일 대학교에서 조셉 G. 갈과 함께 텔로미어의 특이한 특성을 발견했다.[8] 엘리자베스 블랙번, 캐럴 그리더, 잭 쇼스택은 텔로미어와 효소 텔로머라아제에 의해 염색체가 보호되는 방식을 발견하여 2009년 노벨 생리학·의학상을 수상했다.[9]
텔로미어의 염기 서열은 1978년 엘리자베스 H. 블랙번과 Joseph G. Gall영어에 의해 단세포 진핵생물인 테트라히메나를 이용한 연구에서 처음 밝혀졌다. 블랙번, 캐럴 W. 그리더, 잭 W. 쇼스택은 텔로미어와 텔로머라아제 기능 연구를 통해 2006년 앨버트 래스커 의학 연구상과 2009년 노벨 생리학·의학상을 공동 수상했다.
이후 텔로미어를 합성하는 효소인 텔로머라아제가 블랙번 연구실에서 테트라히메나를 이용한 연구에서 발견됨으로써 염색체의 "말단 복제 문제"가 해결되었다(1985년).
3. 구조
게놈 DNA는 두 가닥으로 이루어진 이중 나선 구조를 하고 있지만, 텔로미어의 최말단 부위에서는 DNA의 3' 말단이 돌출(오버행)되어 한 가닥으로 되어 있다. 포유류의 텔로미어 DNA는 구부러져서 T-루프를 형성하고, 돌출된 부분은 이중 가닥 DNA 사이에 숨어 들어가 '''D-루프'''라고 불리는 삼중 가닥 구조를 형성한다. 이 구조는 엑소뉴클레아제 등에 의한 DNA 분해를 회피하여 말단의 안정성을 유지한다고 생각된다.
텔로미어 DNA의 배열은 생물에 따라 다소 다르지만, 많은 모델 생물에서는 구아닌(G)과 티민(T)이 풍부한 반복 배열이다. 포유류나 노랑털점균에서는 TTAGGG의 6 염기가 반복된다. 선충의 ''C. elegans''에서는 TTAGGC, 곤충의 누에에서는 TTAGG, 식물의 애기장대에서는 TTTAGGG, 출아 효모에서는 TG, TGG, TGGG가 무작위로 반복되는 배열이다. 다만, 일부 곤충에서는 다른 양식이 보인다. 초파리에서는 이러한 고 GT 배열이 없고, 트랜스포존의 일종인 레트로포존이 많이 보인다. 초파리에서는 텔로머라제보다 이러한 외래성 배열의 전이에 의해 텔로미어가 유지된다. 누에는 약한 텔로머라제 활성을 보이지만, 레트로포존의 일종(텔로미어 특이적 LINE; SART/TRAS)에 의한 염색체 말단의 유지가 이루어지고 있다.
텔로미어의 길이는 종에 따라 크게 다르며, 효모의 경우 약 300 염기쌍[24]에서 인간의 경우 수 킬로베이스에 이른다. 암세포는 정상 세포에 비해 짧은 텔로미어를 갖는다.
3. 1. 말단
텔로미어의 말단은 3' 말단이 단일 가닥으로 돌출되어 있는데, 이 부분은 T-loop (telomeric-loop)라는 안정된 구조를 형성하며 'end-capping' 구조라고 불린다. 이중 가닥 중 튀어나온 한 가닥을 G-strand라 하는데, 이는 치환되어 (displace) 'D-loop (displacement-loop)'를 형성한다. 이러한 구조들은 염색체 말단 구조를 보호한다.[81] 그러나 텔로미어가 융합되면 두 개의 동원체를 갖는 염색체(dicentric chromosome)를 만들 수 있고, 이는 유전자 재배열을 일으켜 유전체의 불안정성을 초래할 수 있다.[81]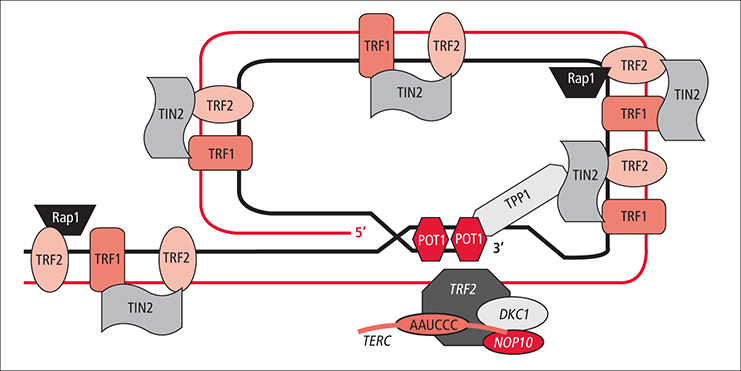
텔로미어의 가장 3' 말단에는 약 300개의 염기쌍 오버행이 존재하며, 이는 텔로미어의 이중 가닥 부분으로 침투하여 T-loop 구조를 형성한다. 이 루프는 매듭과 유사하며, 텔로미어를 안정화시키고 DNA 복구 기구에 의해 텔로미어 말단이 절단 지점으로 인식되는 것을 방지한다. T-loop은 쉘터린 복합체로 불리는 여러 단백질에 의해 유지된다. 사람의 경우, 쉘터린 복합체는 TRF1, TRF2, TIN2, POT1, TPP1, RAP1의 6개 단백질로 구성된다.[14]
텔로미어 DNA는 구부러져서 T-루프를 형성하고, 돌출된 부분은 이중 가닥 DNA 사이에 숨어 들어가 D-루프를 형성한다(그림의 빨간 선). 이 구조는 DNA 분해를 막아 말단의 안정성을 유지한다. T-루프를 형성할 수 없게 되면 DNA 수복 기구가 절단된 DNA로 인식하여 세포 주기를 정지시키거나, 염색체 융합이 일어날 수 있다.
3. 2. 텔로미어-연합단백질 (Telomere-associated proteins)
현재까지 포유류에서 발견된 텔로미어 DNA에 염기서열 특이적으로 직접 결합할 수 있는 텔로미어 단백질은 TRF1, TRF2, POT1이다.
| 텔로미어 DNA 서열에 결합하는 단백질 | |
|---|---|
| TRF1 | 텔로미어 길이 유지의 음성적 조절(negatively regulated) |
| TRF2 | 텔로미어 말단 보호에 중요한 조절 역할 |
| POT1 | 단일가닥 DNA 부분인 텔로미어 TTAGGG overhang에 결합 |
텔로미어에 직접적으로 결합하지는 못하지만(TRF1, TRF2, POT1과 달리) 텔로미어 단백질 복합체에 참여할 수 있는 단백질도 있는데 이를 텔로미어 연합 단백질이라 한다. 위 언급한 세 단백질 포함하여 RAP1, TPP1, TIN2 등이 그 예다. 이들을 쉘터린 복합체라 일컫는다. 텔로미어에 쉘터린 복합체가 결합해 온전한 텔로미어를 구성하면 텔로미어에서 DNA 수선 기작이 작동하여 재조합을 일으키는 것을 막아준다. 또한, 텔로머레이스가 텔로미어로 접근하려 하는 것을 저지한다. TIN2는 텔로미어 DNA 서열에 직접적으로 결합하지는 못하지만, 그 대신 다른 단백질인 TPP1과의 결합으로 TRF1 및 TRF2와 POT1을 이어주는 다리 역할을 한다. TPP1은 POT1과 POT1-TPP1 복합체를 형성한다(TPP1은 텔로미어 DNA 서열에 직접적으로 결합하지 못한다).[82][83]
| 텔로미어 연합 단백질(인간) | 기능(추정) | 텔로미어 결합 자리 | |
|---|---|---|---|
| 이중가닥 | 단일가닥 | ||
| TRF1 | 텔로미어 길이 조절, 기능 유지 | o | |
| TRF2 | 텔로미어 말단 보호, 텔로미어 길이 조절 | o | |
| Ku70/80, DNA-PK 복합체 | DNA 손상 수선, 텔로미어 길이와 구조 조절 | o | |
| Tankyrase (TANK1, TANK2) | TRF1의 ADP 리보실화를 통한 텔로미어 길이 조절(positively regulate telomere length) | DNA에 직접 결합 못하고 TRF1과 상호 작용함으로써 참여 | |
| TIN2(TRF-interacting protein 2) | TRF1의 구조적 기능을 중재(negatively regulate telomere length) | TRF1과 상호 작용 | |
| RAP1(repression and activation protein 1) | 텔로미어 길이 조절(positively regulate telomere length) | TRF2와 상호 작용 | |
| POT1 | 텔로미어 길이 조절, 텔로미어 말단 보호, 단일가닥 overhang(돌출부분)부분의 보호 | o | |
| hTERT | 텔로머레이스의 촉매 소단위(catalytic subunit) | ||
| Ku | DNA 수선(repair) | TRF1, TRF2와 상호작용 | |
| MRN(MRE11/RAD50/NBS1) | 세포주기확인점(cell cycle checkpoint) 조절, DNA 수선 | TRF2와 상호 작용 | |
| PinX1 | 텔로머레이스 억제 | TRF1, 텔로머레이스와 상호 작용 |
TRF1이나 TIN2를 과발현 시킬 경우 텔로미어 길이가 짧아진다.
텔로미어 DNA에는 다양한 단백질이 결합하여 텔로미어의 형성, 보호, 길이 조절에 관여한다. 텔로미어에 국한되는 단백질에는 텔로미어의 수복에 관여하는 것과 이중 가닥 DNA 절단을 감지·수복하는 것 등이 포함되어 있으며, 세포의 상태에 따라 이러한 단백질 복합체의 조성과 효소 활성이 변화함으로써 텔로미어를 제어한다고 생각된다.
D-루프에는 Pot1이라고 불리는 단백질(그림의 노란색 원)이 결합하여 안정화시키고 있으며, 이것이 T-루프의 형성 및 보호에 관여한다고 생각된다. 인간의 조로증 베르너 증후군의 원인 유전자는 D-루프 형성에 기능하는 것으로 보인다. 또한 TRF라고 불리는 단백질이 루프된 이중 가닥 DNA 부분에 결합하고 있으며, 이것을 통해 다른 단백질이 텔로미어에 결합하고 있다.
자매 염색 분체의 텔로미어끼리 결합시켜 놓는 단백질도 있으며, 세포 주기의 M기(분열기)에 이상한 염색체 분배가 일어나지 않도록 억제하는 기능을 담당하고 있다는 것을 알게 되었다. 이 단백질은 동원체나 팔 부분의 접착에 기능하는 코헤신과는 다른 것이다.
3. 3. 열린 구조와 닫힌 구조
텔로미어는 닫힌 구조(T-loop)와 열린 구조 사이를 전환할 수 있다. 닫힌 구조에서는 텔로머레이스가 텔로미어 길이를 늘리는 것을 방해하고, 열린 구조에서는 텔로머레이스와의 결합을 쉽게 하여 텔로미어 길이 증가를 유도한다. 텔로미어가 닫힌 상태여야 안정된 상태라고 할 수 있다. 쉘터린 구조는 텔로머레이스가 텔로미어에 접근하는 것을 간접적으로 제한하여 텔로미어 길이의 음성적 조절에 관여한다. 따라서 쉘터린 단백질은 '닫힌 텔로미어 구조' 형성을 촉진하고, 텔로미어 단일 가닥 돌출 부분(3`-overhang)에 텔로머레이스가 접근하는 것을 막는다.[84]텔로미어의 가장 3' 말단에는 약 300개 염기쌍 오버행이 존재하며, 이는 텔로미어의 이중 가닥 부분으로 침투하여 T-loop이라는 구조를 형성할 수 있다. 이 루프는 매듭과 유사하며, 텔로미어를 안정화시키고 DNA 복구 기구에 의해 텔로미어 말단이 절단 지점으로 인식되는 것을 방지한다. 텔로미어 말단에서 비상동 말단 결합이 발생하면 염색체 융합이 일어날 수 있다. T-loop은 쉘터린 복합체로 불리는 여러 단백질에 의해 유지된다. 사람의 경우, 쉘터린 복합체는 TRF1, TRF2, TIN2, POT1, TPP1, RAP1의 6개 단백질로 구성된다.[14] 많은 종에서, 염기서열 반복은 구아닌이 풍부하며(예: 척추동물의 TTAGGG),[15] 이는 G-쿼드러플렉스 형성을 가능하게 한다. G-쿼드러플렉스는 비-왓슨-크릭 염기쌍을 포함하는 DNA의 특별한 구조이다. 여기에는 단일 가닥 또는 이중 가닥 DNA의 관여 등에 따라 다양한 하위 유형이 있다. 섬모충류(척추동물에서 발견되는 것과 유사한 텔로미어 반복을 가짐)의 3'-오버행이 T-loop 대신 G-쿼드러플렉스를 형성하여 수용한다는 증거가 있다. G-쿼드러플렉스는 DNA 중합효소와 같은 효소에 대한 장애물이며, 따라서 복제 및 전사 조절에 관여하는 것으로 생각된다.[16]
3. 4. 성별에 따른 텔로미어 길이의 차이
여성의 텔로미어가 남성보다 길다고 밝혀졌다. 서던 법(Southern blot)을 통해 이와 같은 결론을 도출했으나, 이 발견은 아직 방법론적 차이에 대한 추가적인 설명이 필요하다.[85]4. 텔로미어의 작용
텔로미어는 종마다 다른 길이와 특이적인 DNA 염기서열 반복으로 구성되며, 세포 분열 시 염색체 손실을 막는 완충 역할을 한다. 세포 분열 시마다 텔로미어 DNA는 일정 부분 손실되며, 텔로미어 길이가 짧아질수록 세포 노화가 촉진된다.[80] 텔로미어는 6개(인간의 경우)의 특이적인 DNA 염기서열이 수백에서 수천 번 반복되며, 염색체의 말단에 위치하고 있어서 세포가 분열할 때 염색체가 분해되는 것을 막아준다. 세포가 한 번 분열할 때마다 염색체 말단으로부터 50~200개의 텔로미어 DNA 뉴클레오타이드를 잃어버린다. 텔로미어의 길이가 짧아질수록 세포가 늙었다는 것을 의미한다. 그렇기 때문에 여러 차례 세포분열을 하면서 대부분의 텔로미어 DNA가 손실되면 세포는 세포분열을 멈춘다.
DNA 복제 과정에서 DNA 중합 효소는 모(母) 가닥의 3' 말단에 존재하는 염기 서열을 복제할 수 없다. 이는 DNA 합성의 단방향성 모드의 결과이다. 즉, 새로운 뉴클레오티드를 기존의 3' 말단에만 부착할 수 있고(즉, 합성은 5'-3' 방향으로 진행됨) 따라서 복제를 시작하려면 프라이머가 필요하다. 선도 가닥(복제 분기점에서 5'-3' 방향으로 정렬됨)에서 DNA 중합 효소는 개시 지점에서 프라이머가 있는 가닥의 끝까지 연속적으로 복제한 다음(RNA로 구성) 절제되고 DNA로 대체된다. 그러나 지연 가닥은 복제 분기점에 대해 3'-5' 방향으로 정렬되어 DNA 중합 효소에 의한 연속적인 복제가 불가능하므로 개시 지점의 5'에서 프라이머의 반복적인 합성을 포함하는 불연속적인 복제가 필요하다(지연 가닥 복제 참조). 지연 가닥 복제에 관여하는 마지막 프라이머는 주형의 3' 말단 근처에 위치한다. 마지막 지연 가닥 프라이머가 주형의 정확히 3' 말단에 배치되는지에 대한 의문이 제기되었고, 약 70–100개의 뉴클레오타이드 떨어진 위치에서 합성된다는 것이 입증되었다. 이는 배양된 인간 세포의 DNA가 세포 분열당 50–100 염기쌍만큼 짧아진다는 발견과 일치한다.[11]
이 과정에서 코딩 서열이 손상되면 잠재적으로 중요한 유전 암호가 손실될 수 있다. 텔로미어는 선형 염색체의 말단에 위치한 비코딩 반복 서열로, 뒤에 있는 코딩 서열에 대한 완충 역할을 한다. 텔로미어는 말단 서열을 "캡"하며 DNA 복제 과정에서 점진적으로 손상된다.
"말단 복제 문제"는 원형 염색체에는 DNA 중합 효소가 닿지 않는 끝이 없기 때문에 선형 염색체에만 해당한다. 대부분의 원핵생물은 원형 염색체에 의존하므로 텔로미어를 가지고 있지 않다.[12] 그러나 ''Streptomyces'', ''Agrobacterium'', ''Borrelia''와 같은 소수의 세균 염색체는 선형이며 텔로미어를 가지고 있는데, 이는 구조와 기능면에서 진핵생물 염색체의 텔로미어와 매우 다르다. 알려진 세균 텔로미어의 구조는 선형 염색체의 끝에 결합된 단백질 또는 선형 염색체의 끝에 있는 단일 가닥 DNA의 헤어핀 루프 형태를 취한다.[13]
텔로미어의 길이는 종에 따라 크게 다르며, 효모의 경우 약 300 염기쌍[24]에서 인간의 경우 수 킬로베이스에 이르며, 일반적으로 구아닌이 풍부하고 6~8 염기쌍 길이의 반복 서열로 구성된다. 진핵생물 텔로미어는 일반적으로 75~300개의 염기로 구성된 3' 단일 가닥 DNA 돌출부로 끝나며, 이는 텔로미어 유지 및 캡핑에 필수적이다. 단일 가닥 및 이중 가닥 텔로미어 DNA에 결합하는 다수의 단백질이 확인되었다.[25] 이들은 텔로미어 유지와 캡핑 모두에서 기능을 한다. 텔로미어는 텔로미어 루프 또는 T-루프라고 하는 큰 루프 구조를 형성한다. 여기서 단일 가닥 DNA는 텔로미어 결합 단백질에 의해 안정화되어 긴 원을 그리며 감긴다.[26] T-루프의 맨 끝에서 단일 가닥 텔로미어 DNA는 텔로미어 가닥이 이중 나선 DNA를 파괴하고 두 가닥 중 하나에 염기쌍을 형성하여 이중 가닥 DNA의 영역에 고정된다. 이 삼중 가닥 구조를 변위 루프 또는 D-루프라고 한다.[27]
진핵생물의 염색체는 직선형이며, DNA에는 말단이 존재한다. 세포 내에 존재하는 텔로미어 이외의 DNA 말단은 감염된 바이러스에서 유래하거나, DNA 손상에 의한 절단으로 인해 생긴 것이다. 이러한 말단은 세포가 가진 DNA 분해 효소와 DNA 수복 기구의 표적이 되지만, 텔로미어의 DNA 말단은 정상적인 것이므로, 이러한 분해나 수복을 받아서는 안 된다. 따라서 텔로미어는 그 특이한 구조를 통해 DNA의 분해와 수복으로부터 염색체를 보호하고, 물리적 및 유전적 안정성을 유지하는 역할을 한다. 텔로미어를 잃은 염색체는 세포에 의해 비정상적인 DNA 말단으로 간주되어 효소에 의한 분해 또는 수복 기구에 의한 염색체 말단 간의 비정상적인 융합이 일어난다. 이러한 염색체의 불안정성은 세포사나 발암의 원인이 된다. 또한, 텔로미어는 세포 분열에서 염색체의 정상적인 분배에 필요하다.
텔로미어의 신장은 텔로머라제라고 불리는 효소에 의해 이루어진다. 이 효소가 없는 세포에서는 세포 분열 시마다 텔로미어가 짧아진다. 텔로머라제는 사람의 체세포에서는 발현되지 않거나, 약한 활성만을 가진다. 따라서, 사람의 체세포를 채취하여 배양하면, 텔로미어의 단축이 일어난다. 텔로미어가 일정 길이보다 짧아지면, 비가역적으로 증식을 멈추고, 세포 노화라고 불리는 상태가 된다. 세포 노화는 세포 분열을 멈춤으로써, 전술한 텔로미어 결실에 의한 염색체의 불안정성이 일어나는 것을 막아, 발암 등으로부터 세포를 보호하는 역할을 한다고 생각된다.
thumb(파란 원)에 의해 복제되지만, 가장 말단의 프라이머(빨간 선) 부분은 복제되지 않는다. 이 때문에 복제할 때마다 DNA는 짧아지고, 결국에는 사라지게 된다. 이것이 "말단 복제 문제"이다. 오른쪽) 생식 세포나 암세포에서는 텔로머라아제에 의해 말단 부분의 복제가 이루어진다. 텔로머라아제 활성이 없는 체세포에서는 분열마다 단축이 일어나고, 일정 이상 짧아지면 분열을 멈추고 세포 노화가 일어난다.]]
1960년대에는 사람의 배양 세포를 이용한 연구에서, 체세포 조직에서 추출한 세포는 분열 횟수에 제한이 있으며, 이를 넘으면 세포는 증식을 멈춘다는 것이 보고되었다. 이 현상은 발견자의 이름을 따서 "헤이플릭 한계"라고 불린다. 또한, 세포 분열이 멈춘 이 상태를 개체의 노화에 비유하여 "세포 노화"라고 부르게 되었다. 그 후의 연구에서, 세포 노화 상태에 있는 세포에서는 텔로미어가 짧아져 있는 것이 관찰되었으며, 텔로미어의 길이가 세포의 분열 횟수를 제한하고 있을 가능성이 시사되었다.
5. 텔로미어 염기서열
다양한 생물 종에서 텔로미어 염기서열이 밝혀졌으며, 종마다 고유한 반복 서열을 가진다. 예를 들어 사람의 텔로미어 염기서열은 TTAGGG이고, 애기장대는 TTTAGGG이다. 1978년 엘리자베스 H. 블랙번과 Joseph G. Gall영어은 단세포 진핵생물인 테트라히메나를 이용한 연구에서 텔로미어 염기서열을 처음 밝혔다. 테트라히메나는 대핵과 소핵을 가지며, 대핵에서는 염색체 증폭이 일어나기 때문에 하나의 세포당 4만 개가 넘는 텔로미어가 존재하여 텔로미어 분석의 모델 생물로 적합했다. 테트라히메나의 텔로미어 염기서열은 TTGGGG(T: 티민, G: 구아닌)가 반복되는 것이었다.
다음은 다양한 생물 종의 텔로미어 염기서열을 나타낸 표이다.
| 그룹 | 유기체 | 텔로미어 반복 서열(5에서 3 방향) |
|---|---|---|
| 척추동물 | 사람, 생쥐, Xenopus | TTAGGG |
| 사상 균류 | Neurospora crassa | TTAGGG |
| 점균류 | Physarum, Didymium | TTAGGG |
| Dictyostelium | AG(1-8) | |
| 키네토플라스트 원생생물 | Trypanosoma, Crithidia | TTAGGG |
| 섬모충 원생생물 | Tetrahymena, Glaucoma | TTGGGG |
| Paramecium | TTGGG(T/G) | |
| Oxytricha, Stylonychia, Euplotes | TTTTGGGG | |
| 아피콤플렉사 원생생물 | Plasmodium | TTAGGG(T/C) |
| 고등 식물 | 애기장대 | TTTAGGG |
| Cestrum elegans | TTTTTTAGGG[45] | |
| Allium | CTCGGTTATGGG[46] | |
| 녹조류 클라미도모나스 | TTTTAGGG | |
| 곤충 | Bombyx mori | TTAGG |
| Bombus terrestris | TTAGGTTGGGG[47] | |
| Vespula vulgaris | TTGCGTCTGGG[47] | |
| 선충류 | Ascaris lumbricoides | TTAGGC |
| 분열 효모 | Schizosaccharomyces pombe | TTAC(A)(C)G(1-8) |
| 출아 효모 | Saccharomyces cerevisiae | TGTGGGTGTGGTG (RNA 템플릿에서 유래) 또는 G(2-3)(TG)(1-6)T (공통 서열) |
| Saccharomyces castellii | TCTGGGTG | |
| Candida glabrata | GGGGTCTGGGTGCTG | |
| Candida albicans | GGTGTACGGATGTCTAACTTCTT | |
| Candida tropicalis | GGTGTA[C/A]GGATGTCACGATCATT | |
| Candida maltosa | GGTGTACGGATGCAGACTCGCTT | |
| Candida guillermondii | GGTGTAC | |
| Candida pseudotropicalis | GGTGTACGGATTTGATTAGTTATGT | |
| Kluyveromyces lactis | GGTGTACGGATTTGATTAGGTATGT |
텔로미어 DNA 배열은 생물에 따라 다르지만, 많은 모델 생물에서는 구아닌(G)과 티민(T)이 풍부한 반복 배열이다. 포유류나 노랑털점균에서는 TTAGGG의 6 염기가 반복되며, 선충의 ''C. elegans''에서는 TTAGGC, 곤충의 누에에서는 TTAGG, 식물의 애기장대에서는 TTTAGGG, 출아 효모에서는 TG, TGG, TGGG가 무작위로 반복되는 배열이다.
6. 텔로머레이스
텔로머레이스(말단소립 복제효소, telomerase)는 손실되는 텔로미어 DNA를 복구하는 효소이다. 이 효소 덕분에 세포가 분열해도 텔로미어의 길이를 어느 정도 유지할 수 있다. 텔로머레이스가 지나치게 활성화되면 세포가 계속 분열할 수 있다. 진핵 세포 생물에서 텔로머레이스가 활발한 세포는 소장 내부의 표피세포(상피세포), 골수세포, 암세포 등이다. 소장 내부의 표피세포는 끊임없이 음식물, 체액과 접촉하면서 상처를 입거나 떨어져 나가곤 한다. 하지만, 활성화된 텔로머레이스에 의해서 세포분열이 지속적으로 일어나면서 상처입거나 떨어져 나간 표피세포를 보충할 수 있다.
텔로머레이스는 텔로미어 DNA 염기서열과 상보적인 염기쌍을 가지는 RNA를 이용하여 텔로미어 DNA를 만들어내는 일종의 역전사 효소를 생성한다. (RNA의 상보적인 염기쌍: C(Cytosine)-G(Guanine), A(Adenine)-U(Uracil)) 예를 들어 역전사효소의 RNA 염기서열이 AAUCCC이면 TTAGGG를 갖는 텔로미어 DNA염기서열이 만들어진다. 이와 같은 방법으로 텔로머레이스는 염색체 말단의 텔로미어 길이가 짧아지지 않도록 해준다.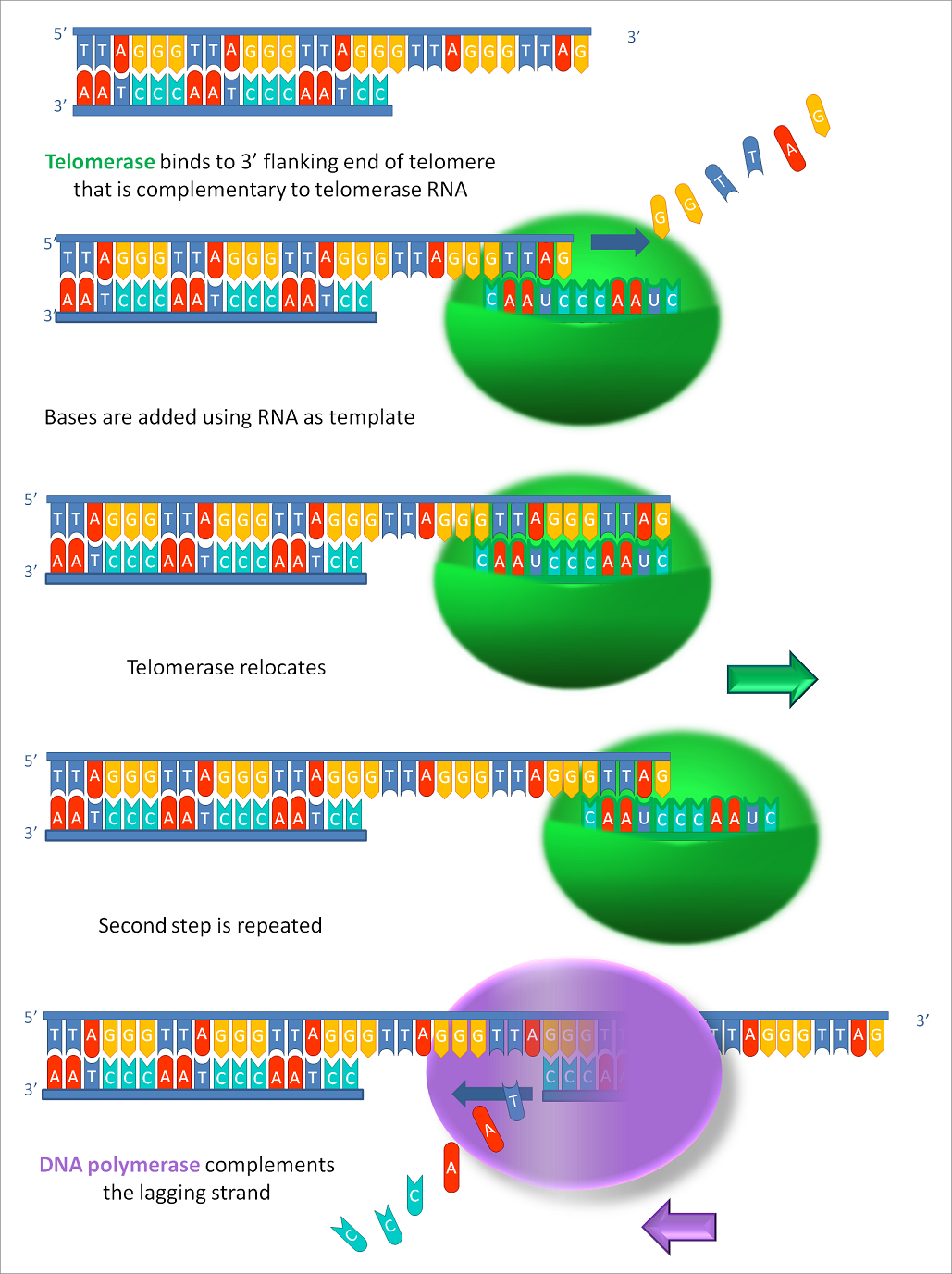
많은 유기체는 텔로머라아제라는 리보핵단백질 효소를 가지고 있으며, 이는 DNA 말단에 반복적인 뉴클레오티드 서열을 추가하는 작업을 수행한다. 텔로머라아제는 텔로미어 "캡"을 "보충"하며 ATP를 필요로 하지 않는다.[17] 대부분의 다세포 진핵생물에서 텔로머라아제는 생식 세포, 배아 줄기 세포와 같은 일부 유형의 줄기 세포, 그리고 특정 백혈구에서만 활성화된다. 체세포 핵 이식을 통해 텔로머라아제를 재활성화하고 텔로미어를 배아 상태로 되돌릴 수 있다.[18]
텔로미어의 신장은 텔로머라제라는 효소에 의해 이루어진다. 이 효소가 없는 세포에서는 세포 분열 시마다 텔로미어가 짧아진다. 텔로머라아제는 사람의 체세포에서는 발현되지 않거나, 약한 활성만을 가진다. 따라서 사람의 체세포를 채취하여 배양하면, 텔로미어의 단축이 일어난다.
염색체의 최말단부는 프라이머가 세팅될 수 없기 때문에 복제되지 않으며, '''텔로머라아제'''에 의해 연장이 이루어진다. 텔로머라아제가 없는 경우, 염색체는 복제될 때마다 50~200개의 염기쌍씩 짧아진다. 텔로머라아제 자체도 텔로미어 유지에 기능하는 것으로 여겨진다.
이 효소는 사람의 경우 일반적인 체세포에서는 발견되지 않고, 생식 세포에서 발현된다. 다만 체세포에서도 세포 분열을 반복하여 딸세포를 공급하는 줄기 세포에서는 약간의 활성이 관찰된다. 난소나 정소 등의 생식 세포에서는 항상적으로 발현된다. 또한 암세포에서도 다량 존재하며, 암세포의 불멸화 원인 중 하나로 여겨진다. 한편, 쥐에서는 체세포에서도 텔로머라아제의 발현이 있다.
텔로머라아제는 세포 주기의 S기(DNA 합성기)에 텔로미어로 유도되어 기능한다.
7. 텔로미어의 축소 (세포 노화)
DNA 복제는 DNA 말단에서 시작되지 않고 중앙(복제 분기점)에서 시작되며, DNA 중합효소는 DNA의 5'에서 3' 방향으로 이동한다. 이러한 DNA 복제의 특성 때문에 텔로미어는 점차 짧아지게 된다.[86][87]
선도 가닥에서는 DNA 중합효소가 5'에서 3'로 진행하여 상보적인 DNA 가닥을 만들 수 있다. 그러나 지연 가닥은 이와 같이 진행되지 않아 문제가 발생한다. 이 문제를 해결하기 위해 프라이머 역할을 하는 짧은 RNA 조각(RNA 프라이머)이 복제 분기점 앞에 붙는다. DNA 중합효소는 이 부분에서 복제를 시작하여 복제 분기점에서 끝으로(5'에서 3' 방향으로) 이동한다. 그러나 지연 가닥에서는 DNA 중합효소가 연속적으로 5'에서 3'로 이동할 수 없어 오카자키 절편이 만들어진다. 더 많은 RNA 프라이머들이 DNA 가닥에 붙은 후에야 DNA 중합효소들이 복제를 계속 진행한다.
마지막 RNA 프라이머가 붙으면 DNA 중합효소, RNA 뉴클레이스, DNA 연결효소가 RNA 조각 부분을 DNA로 변환하고 오카자키 절편 사이를 메운다. 그러나 RNA 부분을 DNA로 전환하려면 RNA 프라이머 앞에 또 다른 DNA 가닥이 있어야 한다. 말단의 RNA 프라이머가 제거된 후, 5' 쪽에 dNTP를 중합할 3'-OH가 없기 때문이다. 이는 지연 가닥 모든 부분에서 항상 일어나지만, 마지막 RNA 프라이머가 붙은 부분 끝에서는 그 앞에 DNA 부분이 없어 RNA 프라이머는 복제된 DNA에서 RNA 부분을 분해하는 효소에 의해 제거된다. 따라서 DNA 복제가 일어날 때 딸 세포의 지연 가닥 5' 말단의 텔로미어는 지속적으로 점차 조금씩 사라진다.[86][87]
DNA 중합 효소는 모(母) 가닥의 3' 말단에 존재하는 염기 서열을 복제할 수 없다. 이는 DNA 합성의 단방향성 모드(5'-3' 방향)와 복제를 시작하기 위해 프라이머가 필요하기 때문이다. 선도 가닥에서는 DNA 중합 효소가 개시 지점에서 프라이머가 있는 가닥 끝까지 연속적으로 복제하지만, 지연 가닥은 불연속적인 복제가 필요하다(지연 가닥 복제 참조). 마지막 프라이머는 주형의 3' 말단 근처(지연 가닥의 잠재적 5' 말단)에 위치한다. 마지막 프라이머가 제거되면, DNA 중합 효소가 마지막 프라이머에 짝지어진 주형 뉴클레오티드가 복제되지 않도록 지연 가닥의 5' 말단에서 "대체 DNA"를 합성할 수 없다고 여겨졌다.[10] 그러나 마지막 지연 가닥 프라이머는 주형의 3' 말단에서 약 70–100개의 뉴클레오티드 떨어진 위치에서 합성된다는 것이 밝혀졌다. 이는 배양된 인간 세포의 DNA가 세포 분열당 50–100 염기쌍만큼 짧아진다는 발견과 일치한다.[11]
이 과정에서 코딩 서열이 손상되면 중요한 유전 암호가 손실될 수 있다. 텔로미어는 선형 염색체 말단에 위치한 비코딩 반복 서열로, 코딩 서열에 대한 완충 역할을 한다.
몇몇 시험관 연구들은 텔로미어가 산화 스트레스에 매우 민감하며, 텔로미어 단축에 산화 스트레스 매개 DNA 손상이 중요하다는 증거를 제시했다.[88] Long Island Breast Cancer Study Project (LIBCSP)는 텔로미어가 가장 짧고 베타 카로틴, 비타민 C와 E 섭취가 적은 여성들이 유방암 위험이 더 크다고 밝혔다.[89] 이는 텔로미어 단축으로 인한 암 위험이 DNA 손상, 산화 스트레스와 상호작용함을 시사한다.
프라이머 축소 현상은 노화, 나이 관련 질병, 사망과 관련이 있다고 예측된다. Richard Cawthon는 더 긴 텔로미어를 가진 생물이 더 오래 살 수 있음을 밝혔지만,[90] 짧은 텔로미어가 세포 나이를 표시하는지, 노화에 직접 기여하는지는 밝혀지지 않았다.[91] 노화가 진행되었다고 해서 모든 장기나 기관 세포에서 텔로미어가 일괄 단축되지는 않는다. 쥐의 텔로미어 길이(20~100 kb)가 사람(5~15 kb)보다 김에도 불구하고 오래 살지 못하는 것을 보면 더욱 그러하다.
에이즈 감염은 에이즈 바이러스가 세포, 생물학적 노화와 나이 관련 질병에 간접 영향을 주는 짧은 텔로미어에 영향을 준다고 제시했다. 에이즈 바이러스 감염군과 비감염군 비교 시, 비감염군이 흡연율과 알코올 섭취량이 높았음에도 바이러스 감염군의 텔로미어가 더 짧았다.[92]
한 연구에서 흡연 경험 유무에 따른 텔로미어 길이를 통계 낸 결과, 흡연은 폐 기능을 감소시켜 긴 텔로미어 축소를 야기했다. 짧은 텔로미어를 가진 흡연자들은 강제호기량이 상당히 줄어들어, 흡연으로 인한 폐 기능 감소가 가속화되었다.[93]
폐 이식 수술에서 기증자와 환자 텔로미어 길이의 단면적 특성은 이전에는 알려지지 않았다. 획득 및 선천적 텔로미어 축소 현상은 COPD(만성 폐색성 폐질환)와 IPF(특발성 폐섬유증)를 포함한 말기 폐병에서 언급되었기에, 한 연구진은 폐 이식 환자가 기증자보다 짧은 텔로미어를 가질 것이라고 가설을 세웠다. 108명을 대상으로 조사한 결과, 이식 수술을 받은 환자들의 텔로미어 길이가 기증자들에 비해 상당히 짧았다. 이는 기증자와 환자의 나이가 같을 때에도 발견되었다. 환자들의 텔로미어 길이 감소는 선천적 현상이나 가속화된 축소 때문일 것이다. 그러나 장기 이식 이후 기증자와 환자의 변화된 텔로미어 길이 역할은 밝혀지지 않았다.[94]
"말단 복제 문제"는 원형 염색체에는 DNA 중합 효소가 닿지 않는 끝이 없어 선형 염색체에만 해당한다. 대부분의 원핵생물은 원형 염색체에 의존하므로 텔로미어가 없다.[12] 그러나 ''Streptomyces'', ''Agrobacterium'', ''Borrelia''와 같은 소수 세균 염색체는 선형이며, 진핵생물 염색체의 텔로미어와 구조 및 기능이 다른 텔로미어를 갖는다. 알려진 세균 텔로미어 구조는 선형 염색체 끝에 결합된 단백질 또는 헤어핀 루프 형태이다.[13]
텔로미어 복제 종결 문제 외에도, 시험관 내 연구에 따르면 텔로미어는 산화 스트레스로 손상을 축적하며, 산화 스트레스 매개 DNA 손상은 생체 내 텔로미어 단축에 주요 영향을 미친다. 활성 산소 (ROS) 매개 산화 스트레스가 DNA 손상을 일으키는 방법은 다양하다. 텔로미어에서 증가된 속도가 고유 감수성 때문인지, DNA 복구 시스템 활성 감소 때문인지는 불분명하다.[28] 연구 결과에 대한 광범위한 합의에도 불구, 측정 및 샘플링 관련 결함이 지적되었다. 텔로미어 산화 손상의 종 및 조직 의존성은 충분히 고려되지 않았다.[29] 인구 기반 연구는 항산화제 섭취와 텔로미어 길이 상호 작용을 나타냈다. 롱아일랜드 유방암 연구 프로젝트(LIBCSP)는 텔로미어 길이가 가장 짧고 베타카로틴, 비타민 C 또는 E 식이 섭취가 적은 여성에게서 유방암 위험이 다소 증가함을 발견했다.[30] 이는[31] 텔로미어 단축으로 인한 암 위험이 산화 스트레스 등 다른 DNA 손상 기전과 상호 작용할 수 있음을 시사한다.
개인 수명 동안 텔로미어는 짧아지지만, 종 수명과 관련된 것은 텔로미어 길이보다 단축 속도이다.[48] 임계적으로 짧아진 텔로미어는 DNA 손상 반응과 세포 노화를 유발한다.[48] 생쥐는 텔로미어가 길지만, 인간과 코끼리에 비해 단축 속도가 빠르고 수명이 짧다.[32]
텔로미어 단축은 실험 동물에서 노화, 사망률 및 노화 관련 질병과 관련 있다.[8][33] 흡연, 식단, 운동 등 많은 요인이 인간 수명에 영향을 미치지만, 기대 수명 상한선에 가까워질수록 더 긴 텔로미어가 수명과 관련될 수 있다.[34]
메타 분석에 따르면 지각된 심리적 스트레스 증가는 텔로미어 길이의 작은 감소와 관련 있지만, 출판 편향 고려 시 유의미한 연관성이 없는 수준으로 약화된다. 스트레스와 역경에 대한 노출의 통합적 바이오마커로서 텔로미어 문헌은 횡단면 연구와 상관 관계 연구가 주를 이루어 인과 관계 해석에 어려움이 있다.[31][35] 2020년 리뷰는 정신 사회적 스트레스와 텔로미어 길이 관계는 자궁 내 또는 초기 생애 스트레스에서 가장 강하게 나타난다고 주장했다.[36]
예비 연구에 따르면 노화 과정에서의 질병 위험은 텔로미어 단축, 노쇠 세포 또는 SASP (노쇠 관련 분비 표현형)와 관련 있을 수 있다.[48]
8. 텔로미어 연장
텔로머레이스(텔로미어 신장 효소) 촉매 물질을 복제하여 특정 조건에서 텔로머레이스 작용이 텔로미어 축소를 방지하고 인간 세포를 불멸로 만들 수 있는지 확인하는 실험이 진행되었다. 1998년, 텔로머레이스가 세포 수명을 연장할 수 있다는 연구 결과가 발표되었고, 현재는 인체 세포를 불멸화할 수 있을 것으로 기대된다.[98]
텔로머레이스를 활성화하면 텔로미어 축소를 역전시켜 노화를 늦출 수 있다는 것이 밝혀지고 있다. 이는 헤이플릭 한계를 연장하여 인간 수명을 늘릴 수 있음을 의미한다. 약물, 유전자 치료, 동면과 같이 물질 대사를 억제하는 방법으로 텔로미어 축소를 되돌릴 수 있다고 제시되었으나, 아직 인체에서 직접적인 효과가 입증되지는 않았다. 그러나 동면 상태에서 텔로미어 축소가 역전되어 노화가 억제된다는 것과 동면이 수명을 연장시킨다는 것은 입증되었다. 또한 실험용 쥐[99][100]와 예쁜꼬마선충[101]을 이용한 실험에서 텔로미어 연장이 노화 신호를 역전시키는 것으로 나타났다. 다만, 텔로머레이스가 작용하는 긴 텔로미어는 암세포 발생 가능성을 높일 수 있다는 가설도 있다. 반대로 긴 텔로미어가 암으로부터 보호한다는 연구 결과도 있는데, 이는 짧은 텔로미어가 암과 밀접한 관련이 있기 때문이다. 긴 텔로미어는 에너지 소비량을 증대시킬 수 있다는 연구 결과도 제시되었다.[102]
텔로미어 연장 기술은 생물 의학 치료에 사용될 수 있는 충분한 양의 건강하고 암세포로 변하지 않은 포유류 세포 배양을 가능하게 하여 조직공학에 기여할 것으로 전망된다.
캘리포니아 대학에서 진행된 연구에 따르면, 초기 전립선암 진단을 받은 35명 중 10명에게 채식(과일, 채소, 통곡물, 저지방, 정제된 당질 제한), 적당한 운동(주 6일, 30분 걷기), 스트레스 감소(요가, 호흡, 명상), 주간 그룹 지원 등의 생활 습관 개선을 시행한 결과, 나머지 25명에 비해 텔로미어가 약 10% 더 길게 관찰되었다. 생활 습관 개선을 얼마나 충실히 이행했는지에 따라 더 큰 차이가 나타났다.
9. 텔로미어와 암세포
암세포는 끊임없이 세포 분열을 하기 위해 텔로미어 DNA 길이를 유지하는 메커니즘이 필요하다. 텔로미어 길이를 연장하거나 유지하는 것은 세포 단위의 끊임없는 증식을 위해 필수적이다. 텔로미어를 연장하는 효소인 텔로머라아제는 종양의 90%에서 활성화되어 암세포의 수명을 연장시킨다.[106][107] 따라서 암세포의 텔로머레이스 기능을 억제하거나 텔로미어 DNA를 제거하면 암세포의 세포 분열을 막을 수 있다.
텔로머라아제에 의한 텔로미어 신장 복구는 염색체를 유지하여 영구적인 세포 분열, 즉 세포의 불사화에 중요한 역할을 한다. 형질전환된 인간 암세포의 90% 가까이에서 텔로머라아제의 재활성화가 보고되었다. 최근에는 텔로미어 길이를 늘이는 방법(TERT 시퀀스가 코딩된 mRNA를 이용)이 발견되기도 하였다.[108]
이러한 이유들로 텔로머라아제를 표적으로 하는 항암제 개발이 이루어지고 있다. 텔로머라아제의 안티센스 RNA나 기능 저해형 텔로머라아제 도입 실험 등을 통해, 암세포 분열을 억제하고 정상 세포에는 영향을 미치지 않아 부작용을 줄일 수 있을 것으로 기대된다.
10. 텔로미어 연구의 의의 (한국 사회의 관점)
텔로미어와 텔로머라제는 세포의 세포 노화와 불멸화에 중요한 역할을 하며, 생체 항상성 유지 및 암과 밀접하게 관련되어 있다.
사람 등 동물 조직에서 채취한 초대 배양 세포는 분열 횟수가 제한되어 있으며, 일정 횟수 분열 후에는 세포 주기가 정지하여 더 이상 분열할 수 없다. 이를 세포 노화라고 한다. 반면, 암세포 등은 제한 없이 분열하는 것이 가능하며, 이 형질을 세포의 불멸화라고 한다. 여기서 "불멸"은 세포 자체가 죽지 않는다는 의미가 아니라, 세포가 분열 영속성을 획득하고 있다는 의미이다. 게놈 안정성 측면에서 보면, 노화와 불멸화는 상반되는 현상이다. 불안정해진 게놈은 노화를 통해 불안정화를 억제하거나, 일시적으로 노화 상태로 만들어 수복할 여유를 주는 메커니즘을 갖추고 있으며, 암세포와 같은 불멸화된 세포는 이러한 감시 기구를 벗어난 상태에 있다. 여기에 텔로미어와 텔로머라제가 크게 관여한다.
세포 암화에는 (1) 증식능 항진, (2) 불사화, (3) 세포자멸사 회피의 세 단계 변화가 필수적이다. 텔로미어와 텔로머라아제는 세포 노화와 불사화를 제어함으로써 암 발생에도 관여한다.
텔로머라아제에 의한 텔로미어 신장 복구는 염색체를 유지함으로써 영구적인 세포 분열, 즉 세포 불사화에 중요한 역할을 한다. 생쥐 세포는 텔로머라아제 활성이 높아 p53이나 Rb 단백질을 억제하는 것만으로도 쉽게 불사화시킬 수 있다. 인간 세포에서도 이들 억제를 더하여 텔로머라아제를 도입함으로써 불사화시키는 것이 가능하다. 이처럼 텔로머라아제 활성 항진 등에 의해 텔로미어 길이가 유지되는 것이 세포 불사화의 필요 조건 중 하나이다.
형질전환된 인간 암세포의 90% 가까이에서 텔로머라아제 재활성화가 보고되었다. 이로 인해 텔로머라아제를 표적으로 하는 항암제 개발이 이루어지고 있다. 임상 적용을 위한 기초 연구로, 배양 암세포에 대해 텔로머라아제 안티센스 RNA나 기능 저해형 텔로머라아제 도입 실험 등이 진행되고 있다. 그 결과, 암세포 분열을 억제할 수 있다는 것이 보고되었으며, 특히 전자는 정상 세포에 영향을 미치지 않아 부작용을 줄일 수 있을 것으로 기대된다. 부작용이 적은 것은 암세포 텔로미어가 정상 세포에 비해 짧다는 것과 관련이 있다.
많은 암세포에서는 염색체가 불안정해져 있다는 것도 알려져 있다. 텔로미어가 결손되면 자매 염색체 사이에서 융합이 일어나고, 이러한 염색체는 복제 시에 배가된다. 이 기구에 의해 염색체 이상이 가속화되어 암화로 이어진다는 모델이 제시되어 있다.
한국 사회에 주는 의의
- 고령화 사회 문제 해결: 한국은 세계적으로 고령화가 가장 빠르게 진행되는 국가 중 하나로, 텔로미어 연구는 노화 관련 질환 예방 및 건강 수명 연장에 기여할 수 있다.
- 세포 치료 및 재생 의학 발전: 텔로미어 및 텔로머라아제 조절 기술은 세포 치료제 개발, 조직 공학, 재생 의학 분야 발전에 핵심적인 역할을 할 수 있다.
- 암 정복: 텔로머라아제는 대부분의 암세포에서 활성화되므로, 텔로머라아제 억제제 개발은 새로운 항암 치료 전략으로 주목받고 있다.
11. 텔로미어 연구의 한계 및 윤리적 문제
고메즈 외 연구진(Gomes et al)은 포유류 동물 텔로미어의 비교 생물학적 연구에서 서로 다른 포유류 종의 텔로미어 길이는 수명과 직접적이지 않다고 밝혔으며, 수명에 대한 텔로미어 길이의 영향이 여전히 의문이라고 결론을 내렸다. 헤리스 외 연구진(Harris et al)은 "인간 텔로미어 길이는 인지적 능력과 신체 능력에 대한 노화의 중요한 생물지표다"라는 증거를 찾았다. 길리와 블랙번(Gilley and Blackburn)은 짚신벌레를 이용하여 세포 노쇠기가 텔로미어 축소에 의한 것인지를 알아보기 위해 실험했으나, 세포 노쇠기 동안 텔로미어는 줄어들지 않았다.[105]
개인의 수명 동안 텔로미어는 짧아지지만, 종의 수명과 관련된 것은 텔로미어 길이보다는 텔로미어 단축 속도이다.[48] 임계적으로 짧아진 텔로미어는 DNA 손상 반응과 세포 노화를 유발한다.[48] 생쥐는 텔로미어가 훨씬 길지만, 인간과 코끼리에 비해 텔로미어 단축 속도가 훨씬 빠르고 수명이 크게 짧다.[32]
텔로미어 단축은 실험 동물에서 노화, 사망률 및 노화 관련 질병과 관련이 있다.[8][33] 흡연, 식단, 운동 등 많은 요인이 인간의 수명에 영향을 미칠 수 있지만, 인간의 기대 수명 상한선에 가까워질수록 더 긴 텔로미어가 수명과 관련될 수 있다.[34]
참조
[1]
논문
2009 Nobel Prize in Physiology or Medicine: telomeres and telomerase
https://www.nature.c[...]
2010-03-01
[2]
서적
The Remaking of Chromosomes
Woods Hole
[3]
논문
Principle of marginotomy in template synthesis of polynucleotides
https://pubmed.ncbi.[...]
1971-01-01
[4]
논문
A theory of marginotomy: The incomplete copying of template margin in enzymic synthesis of polynucleotides and biological significance of the phenomenon
https://dx.doi.org/1[...]
1973-09-14
[5]
논문
Telomeres, telomerase, and aging: origin of the theory
https://pubmed.ncbi.[...]
1996-01-01
[6]
논문
«He always talked about something else…» Alexey Matveyevich Olovnikov and his unusual science.
https://pubmed.ncbi.[...]
2023-01-01
[7]
웹사이트
Library Index
https://olovnikov.co[...]
2024-10-13
[8]
논문
A tandemly repeated sequence at the termini of the extrachromosomal ribosomal RNA genes in Tetrahymena
1978-03-01
[9]
웹사이트
Elizabeth H. Blackburn, Carol W. Greider, Jack W. Szostak: The Nobel Prize in Physiology or Medicine 2009
http://nobelprize.or[...]
Nobel Foundation
2009-10-05
[10]
논문
A theory of marginotomy. The incomplete copying of template margin in enzymic synthesis of polynucleotides and biological significance of the phenomenon
1973-09-01
[11]
논문
Early and late steps in telomere overhang processing in normal human cells: the position of the final RNA primer drives telomere shortening
2012-06-01
[12]
서적
Lehninger Principles of Biochemistry
https://archive.org/[...]
W.H. Freeman
2008-01-01
[13]
웹사이트
Bacterial Chromosome Structure
http://www.sci.sdsu.[...]
2002-07-12
[14]
논문
Role of shelterin in cancer and aging
2010-10-01
[15]
논문
Conservation of the human telomere sequence (TTAGGG)n among vertebrates
1989-09-01
[16]
논문
G-quadruplex structures: in vivo evidence and function
2009-08-01
[17]
논문
Telomerase Repeated Amplification Protocol (TRAP)
2015-11-01
[18]
논문
Extension of cell life-span and telomere length in animals cloned from senescent somatic cells
2000-04-01
[19]
논문
Telomere shortening rate predicts species life span
[20]
논문
Senescence and immortalization: role of telomeres and telomerase
2005-05-01
[21]
논문
Telomeres, telomerase, and tumorigenesis--a review
2004-07-01
[22]
논문
Telomeres, telomerase and senescence
1990-08-01
[23]
논문
Telomeric 8-oxo-guanine drives rapid premature senescence in the absence of telomere shortening
https://www.nature.c[...]
2022-06-30
[24]
논문
DNA sequences of telomeres maintained in yeast
[25]
논문
Characterization of the yeast telomere nucleoprotein core: Rap1 binds independently to each recognition site
2010-11-01
[26]
논문
Mammalian telomeres end in a large duplex loop
1999-05-01
[27]
논문
Quadruplex DNA: sequence, topology and structure
[28]
논문
The impact of oxidative DNA damage and stress on telomere homeostasis
2019-01-01
[29]
논문
Does oxidative stress shorten telomeres in vivo? A review
2017-12-01
[30]
논문
Telomere length, oxidative damage, antioxidants and breast cancer risk
2009-04-01
[31]
논문
Perceived stress and telomere length: A systematic review, meta-analysis, and methodologic considerations for advancing the field
2016-05-01
[32]
논문
Telomerase as a Therapeutic Target in Cardiovascular Disease
2021-01-01
[33]
논문
Divergence of sperm and leukocyte age-dependent telomere dynamics: implications for male-driven evolution of telomere length in humans
2012-11-01
[34]
논문
Telomeres and the natural lifespan limit in humans
2017-01-01
[35]
논문
Telomeres as integrative markers of exposure to stress and adversity: a systematic review and meta-analysis
2018-08-01
[36]
저널
Psychosocial Stressors and Telomere Length: A Current Review of the Science
2020-04-00
[37]
저널
The serial cultivation of human diploid cell strains
1961-12-00
[38]
저널
The limited in vitro lifetime of human diploid cell strains
1965-03-00
[39]
저널
The RNA component of human telomerase
1995-09-00
[40]
저널
Extension of life-span by introduction of telomerase into normal human cells
1998-01-00
[41]
저널
Measuring vertebrate telomeres: applications and limitations
http://eprints.white[...]
2004-09-00
[42]
저널
Comparative biology of mammalian telomeres: hypotheses on ancestral states and the roles of telomeres in longevity determination
2011-10-00
[43]
저널
Telomere length and aging biomarkers in 70-year-olds: the Lothian Birth Cohort 1936
2012-07-00
[44]
저널
TeloBase: a community-curated database of telomere sequences across the tree of life
https://doi.org/10.1[...]
2023-08-21
[45]
저널
Characterisation of an unusual telomere motif (TTTTTTAGGG)n in the plant Cestrum elegans (Solanaceae), a species with a large genome
2015-05-00
[46]
저널
Allium telomeres unmasked: the unusual telomeric sequence (CTCGGTTATGGG)n is synthesized by telomerase
2016-02-00
[47]
저널
Telomerase RNA in Hymenoptera (Insecta) switched to plant/ciliate-like biogenesis
https://academic.oup[...]
2023-01-11
[48]
저널
Telomere dysfunction in ageing and age-related diseases
2022-00-00
[49]
저널
Human telomeres contain at least three types of G-rich repeat distributed non-randomly
1989-06-00
[50]
저널
Telomere length dynamics in human lymphocyte subpopulations measured by flow cytometry
1998-08-00
[51]
저널
WALTER: an easy way to online evaluate telomere lengths from terminal restriction fragment analysis
2021-12-00
[52]
저널
Telomere measurement by quantitative PCR
2002-05-00
[53]
저널
Estimating telomere length from whole genome sequence data
[54]
저널
Telomerecat: A ploidy-agnostic method for estimating telomere length from whole genome sequencing data.
[55]
저널
TelomereHunter–in silico estimation of telomere content and composition from cancer genomes.
[56]
저널
Flow cytometry and FISH to measure the average length of telomeres (flow FISH)
2006-12-00
[57]
뉴스
A Blood Test Offers Clues to Longevity
https://www.nytimes.[...]
2011-05-18
[58]
저널
Will your telomeres tell your future?
2012-03-00
[59]
저널
Spit test offers guide to health
[60]
저널
Heritability of telomere variation: it is all about the environment!
http://dx.doi.org/10[...]
2018-01-15
[61]
저널
Decline in telomere length with increasing age across nonhuman vertebrates: A meta-analysis
http://dx.doi.org/10[...]
2021-09-07
[62]
저널
No sex differences in adult telomere length across vertebrates: a meta-analysis
http://dx.doi.org/10[...]
2020-11-00
[63]
저널
On the comparative biology of mammalian telomeres: Telomere length co-evolves with body mass, lifespan and cancer risk
2021-03-16
[64]
저널
The association between stressors and telomeres in non-human vertebrates: a meta-analysis
2019-11-27
[65]
저널
Ectothermic telomeres: it's time they came in from the cold
2018-03-00
[66]
웹사이트
若返りたいなら運動せよ! アンチエイジングに影響を与える話題の「テロメア」と運動の関係
https://www.parasapo[...]
[67]
저널
The teleost Oryzias latipes shows teleomere shortning with age despite telomerase activity throughout life
2008-00-00
[68]
저널
Telomere attrition and restoration in the normal teleost Oryzias latipes are linked to growth rate and telomeraseactivity at each life stage
2016-01-00
[69]
웹사이트
우리말샘 - 말단소립 등
[70]
저널
Principle of marginotomy in template synthesis of polynucleotides (Принцип маргинотомии в матричном синтезе полинуклеотидов)
1971-00-00
[71]
저널
A theory of marginotomy. The incomplete copying of template margin in enzymic synthesis of polynucleotides and biological significance of the phenomenon
1973-09
[72]
웹사이트
No Nobel physiology and medicine award for Russian gerontologist Aleksey Olovnikov
http://www.telegraph[...]
2009-10-21
[73]
저널
A tandemly repeated sequence at the termini of the extrachromosomal ribosomal RNA genes in Tetrahymena
1978-03
[74]
웹인용
The 2009 Nobel Prize in Physiology or Medicine - Press Release
http://nobelprize.or[...]
Nobelprize.org
2009-10-05
[75]
서적
Harrison's Principles of Internal Medicine
[76]
웹인용
Portfolio
http://www.senescenc[...]
[77]
뉴스
Unravelling the secret of ageing
http://www.cosmosmag[...]
2009-10-05
[78]
서적
Human Senescence: Evolutionary and Biocultural Perspectives
https://books.google[...]
Cambridge University Press
[79]
서적
Public Enemy Number 1--stress: A Practical Guide to the Effects of Stress and Nutrition on the Aging Process and Life Extension
https://books.google[...]
Nova Publishers
2000
[80]
웹인용
Structure and function of telomeres
http://www.nature.co[...]
nature
1991-04-18
[81]
서적
노화의 생물학:분자생물학적 원인에 대하여
[82]
저널
Role of shelterin in cancer and aging
http://www.ncbi.nlm.[...]
2010-06-21
[83]
서적
노화의 생물학:분자생물학적 원인에 대하여
[84]
서적
노화의 생물학
탐구당
[85]
저널
Gender and telomere length: systematic review and meta-analysis.
https://www.ncbi.nlm[...]
[86]
저널
Telomerase
https://books.google[...]
[87]
서적
Telomeres and Telomerase in Aging, Disease, and Cancer: Molecular Mechanisms of Adult Stem Cell Ageing
https://books.google[...]
Springer Science & Business Media
2007-11-07
[88]
저널
A continuous correlation between oxidative stress and telomere shortening in fibroblasts
2007
[89]
저널
Telomere length, oxidative damage, antioxidants and breast cancer risk
2009-04
[90]
저널
Association between telomere length in blood and mortality in people aged 60 years or older
http://www.thelancet[...]
2003-02-01
[91]
저널
Is Telomere Length a Biomarker of Aging? A Review
http://biomedgeronto[...]
2010
[92]
저널
HIV Infection Is Associated with Shortened Telomere Length in Ugandans with Suspected Tuberculosis
http://journals.plos[...]
2016-09-21
[93]
저널
Associations Between Smoking, Telomere Length and Lung Function Decline: Findings from a Population-Based Longitudinal Study
http://www.atsjourna[...]
[94]
저널
Association of Donor and Recipient Telomere Length with Clinical Outcomes following Lung Transplantation.
https://www.ncbi.nlm[...]
2016-09
[95]
저널
The serial cultivation of human diploid cell strains
1961
[96]
저널
The limited in vitro lifetime of human diploid cell strains
1965
[97]
저널
The RNA component of human telomerase
1995-09
[98]
저널
Extension of life-span by introduction of telomerase into normal human cells
1998
[99]
뉴스
Harvard scientists reverse the ageing process in mice – now for humans
http://www.guardian.[...]
The Guardian
2010-11-28
[100]
저널
Telomerase reactivation reverses tissue degeneration in aged telomerase-deficient mice
http://www.nature.co[...]
[101]
저널
Long lifespan in worms with long telomeric DNA
2004
[102]
저널
An evolutionary review of human telomere biology: The thrifty telomere hypothesis and notes on potential adaptive paternal effects
2011
[103]
저널
Measuring vertebrate telomeres: applications and limitations
2004-09
[104]
저널
Telomere shortening in a long-lived marine bird: Cross-sectional analysis and test of an aging tool
2006
[105]
저널
Comparative biology of mammalian telomeres: hypotheses on ancestral states and the roles of telomeres in longevity determination
https://www.ncbi.nlm[...]
2011-06-01
[106]
서적
Telomeres and Telomerase in Cancer
https://books.google[...]
Springer Science & Business Media
2009-03-18
[107]
서적
노화의 생물학:분자생물학적 원인에 대하여
탐구당
[108]
저널
Transient delivery of modified mRNA encoding TERT rapidly extends telomeres in human cells
http://www.fasebj.or[...]
2015-01-22
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com


