B세포
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
B 세포는 닭의 파브리키우스 낭에서 항체 생성에 관여하는 세포로 처음 발견되었으며, 포유류에서는 골수에서 생성된다. B 세포는 조혈모세포에서 분화하여 성숙하며, 이 과정에서 다양한 유전자 발현과 V(D)J 재조합을 거친다. B 세포는 골수에서 양성 및 음성 선택 과정을 통해 자기 항원에 반응하는 세포를 제거하여 자가 관용을 확립한다. 성숙한 B 세포는 림프절 등에서 항원을 인식하여 활성화되며, T 세포의 도움을 받거나 받지 않고도 활성화될 수 있다. 활성화된 B 세포는 형질 세포, 기억 B 세포 등으로 분화하여 항체를 생성하고 면역 반응을 조절한다. B 세포는 다양한 종류로 나뉘며, 자가면역 질환, 암, 림프구 감소증 등 다양한 병리와 관련된다.
더 읽어볼만한 페이지
- B세포 - 형질 세포
형질 세포는 B 림프구에서 분화된 항체 생산 세포로, 풍부한 세포질과 특징적인 핵을 가지며, 면역글로불린 생산을 통해 면역 반응에 중요한 역할을 하지만, 비정상적 증식은 질병을 유발하고 분화 결함은 면역 결핍을 초래할 수 있다. - B세포 - 기억 B세포
기억 B세포는 동일한 항원에 재노출 시 빠르고 강력한 면역 반응을 유도하여 면역 기억을 담당하는 특수한 B세포이다. - 림프구 - 형질 세포
형질 세포는 B 림프구에서 분화된 항체 생산 세포로, 풍부한 세포질과 특징적인 핵을 가지며, 면역글로불린 생산을 통해 면역 반응에 중요한 역할을 하지만, 비정상적 증식은 질병을 유발하고 분화 결함은 면역 결핍을 초래할 수 있다. - 림프구 - 자연 살해 T세포
자연 살해 T세포는 αβ T 세포 수용체와 자연 살해 세포 관련 분자 마커를 발현하며 CD1d 분자에 의해 제시되는 지질 및 당지질 항원을 인식하는 T 세포의 일종으로, 활성화 시 사이토카인을 생산하여 면역 반응 조절에 중요한 역할을 수행하고 다양한 질병과의 관련성이 밝혀져 임상적 잠재력이 주목받고 있다. - 인간 세포 - 무축삭 세포
무축삭 세포는 망막 내부에서 양극 세포와 망막 신경절 세포 간의 시냅스 연결을 조절하며, 연결 영역, 내부 얼기층 위치, 신경 전달 물질 종류에 따라 분류되고, 다양한 기능을 수행한다. - 인간 세포 - 망막 신경절 세포
망막 신경절 세포는 시각 정보를 뇌로 전달하는 망막 신경세포로, P형, M형, K형, 광수용성 신경절 세포 등으로 나뉘어 색상, 대비, 움직임 등 시각 정보 처리와 일주기 리듬 조절에 관여하며, 병리학적 변화는 시각 질환을 유발할 수 있다.
| B세포 | |
|---|---|
| 일반 정보 | |
 | |
| 라틴어 | lymphocytus B |
| 전구 세포 | 조혈모세포 |
| 계통 | 면역계 |
| 상세 정보 | |
| 역할 | 항체 생산, 면역 기억 형성, 항원 제시 |
| 유형 | 백혈구 |
| 역사 | |
| 발견 | 브루스 글릭, 티모시 S. 창, R. 조지 잽 |
| 발견 년도 | 1956년 |
| 명명 유래 | 조류의 파브리키우스낭 (Bursa of Fabricius) |
2. 역사
1965년, 오하이오 주립 대학교의 브루스 글릭은 갓 부화한 닭의 파브리키우스 낭 (''Bursa Fabricii'')을 제거하면 항체 생성이 일어나지 않는 것을 발견했다. 이후, 맥스 쿠퍼와 로버트 A. 굿에 의해 조류의 항체 생성 전구 세포의 분화 및 성숙에 필요하다는 것이 증명되었고, 기관의 머리글자를 따서 B세포라고 명명되었다. 포유류에는 이 기관이 존재하지 않으며, 골수 (''bone marrow'')에서 만들어지는 것이 확인되었다. 우연히 머리글자가 같아서 그대로 B세포라는 명칭이 정착되었다.
2. 1. B 세포의 발견
1965년, 오하이오 주립 대학교의 브루스 글릭은 갓 부화한 닭의 파브리키우스 낭 (''Bursa Fabricii'')을 제거하면 항체 생성이 일어나지 않는 것을 발견했다. 이후, 맥스 쿠퍼와 로버트 A. 굿에 의해 조류의 항체 생성 전구 세포의 분화 및 성숙에 필요하다는 것이 증명되었고, 기관의 머리글자를 따서 B세포라고 명명되었다. 포유류에는 이 기관이 존재하지 않으며, 골수 (''bone marrow'')에서 만들어지는 것이 확인되었다. 우연히 머리글자가 같아서 그대로 B세포라는 명칭이 정착되었다.3. 분화 및 성숙
사람의 경우 B 세포는 태생기 8~9주 동안에는 간에서, 그 후에는 주로 골수에서 분화를 시작한다.[40] B 세포는 조혈모세포(HSC)로부터 발생하며, 이는 골수에서 기원한다.[6][7] HSC는 먼저 다분화 전구 세포(MPP)로 분화된 다음 공통 림프구 전구 세포(CLP)로 분화된다.[7] 여기서 B 세포로의 발달은 여러 단계를 거치며(오른쪽 그림 참조), 각 단계는 다양한 유전자 발현 패턴과 면역글로불린 H쇄 및 L쇄 유전자좌 배열로 표시된다. 후자는 B 세포가 발달하면서 V(D)J 재조합을 겪기 때문이다.[8]
B 세포는 골수에서 발달하는 동안 적절한 발달을 보장하기 위해 두 가지 유형의 선택을 거치며, 둘 다 세포 표면의 B 세포 수용체(BCR)와 관련된다. 양성 선택은 전-BCR과 BCR 모두와 관련된 항원 독립적인 신호 전달을 통해 발생한다.[9][10] 이러한 수용체가 해당 리간드에 결합하지 않으면 B 세포는 적절한 신호를 수신하지 못하고 발달을 중단한다.[9][10] 음성 선택은 자기 항원과 BCR의 결합을 통해 발생한다. BCR이 자기 항원에 강하게 결합할 수 있는 경우 B 세포는 네 가지 운명 중 하나를 겪는다: 클론 제거, 수용체 편집, 무반응, 또는 무시(B 세포가 신호를 무시하고 발달을 계속함).[10] 이 음성 선택 과정은 중추 내성 상태로 이어지며, 여기서 성숙한 B 세포는 골수에 존재하는 자기 항원에 결합하지 않는다.[8]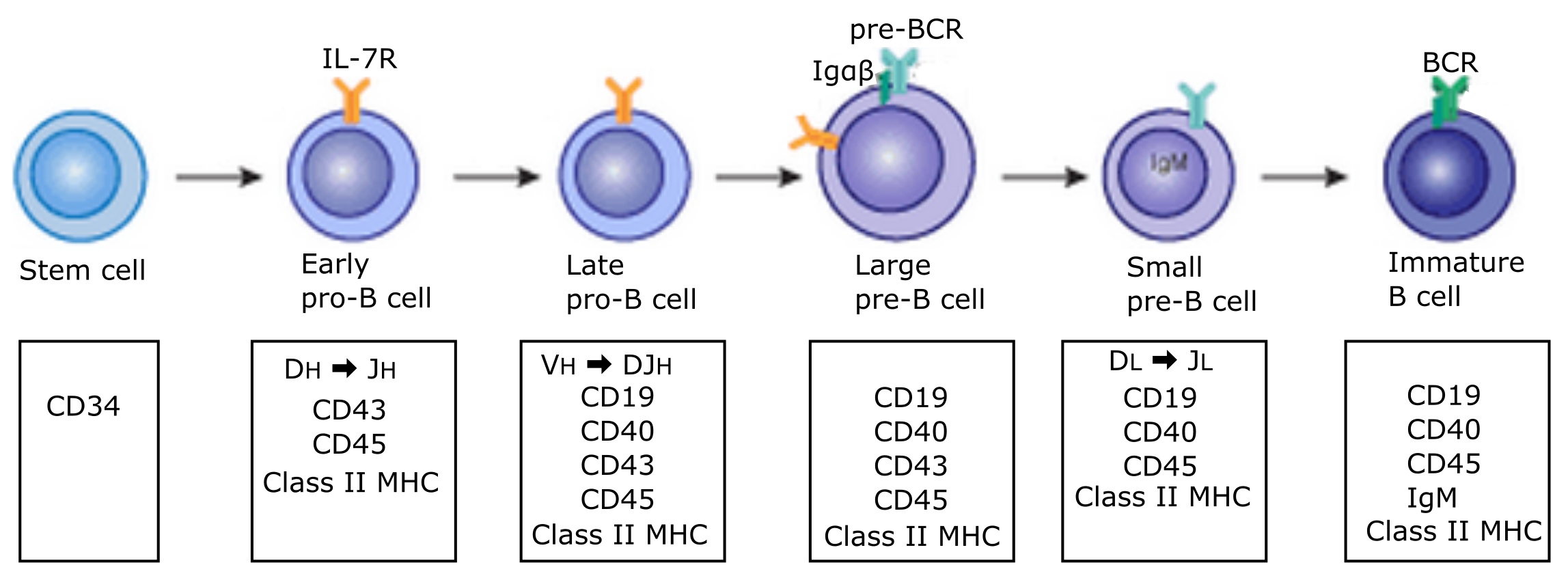
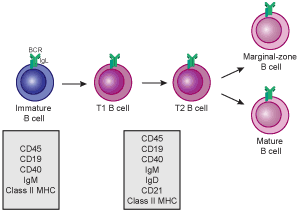
발달을 완료하기 위해 미성숙 B 세포는 전이 B 세포로 골수에서 비장으로 이동하며, 두 개의 전이 단계를 거친다: T1과 T2.[11] 비장으로의 이동 과정과 비장 진입 후, 이들은 T1 B 세포로 간주된다.[12] 비장 내에서 T1 B 세포는 T2 B 세포로 전환된다.[12] T2 B 세포는 BCR 및 기타 수용체를 통해 수신된 신호에 따라 여포(FO) B 세포 또는 변연대(MZ) B 세포로 분화된다.[13] 일단 분화되면, 이들은 성숙 B 세포 또는 나이브 B 세포로 간주된다.[12]
3. 1. B 세포 발달 과정
사람의 경우 B 세포는 태생기 8~9주 동안에는 간에서, 그 후에는 주로 골수에서 분화를 시작한다.[40] B 세포는 조혈모세포(HSC)로부터 발생하며, 이는 골수에서 기원한다.[6][7] HSC는 먼저 다분화 전구 세포(MPP)로 분화된 다음 공통 림프구 전구 세포(CLP)로 분화된다.[7] 여기서 B 세포로의 발달은 여러 단계를 거치며, 각 단계는 다양한 유전자 발현 패턴과 면역글로불린 H쇄 및 L쇄 유전자좌 배열로 표시된다. 후자는 B 세포가 발달하면서 V(D)J 재조합을 겪기 때문이다.[8]B 세포는 골수에서 발달하는 동안 적절한 발달을 보장하기 위해 두 가지 유형의 선택을 거친다. 양성 선택은 전-BCR과 BCR 모두와 관련된 항원 독립적인 신호 전달을 통해 발생한다.[9][10] 음성 선택은 자기 항원과 BCR의 결합을 통해 발생하며, BCR이 자기 항원에 강하게 결합할 수 있는 경우 B 세포는 클론 제거, 수용체 편집, 무반응등의 과정을 거친다.[10] 이 음성 선택 과정은 중추 내성 상태로 이어지며, 여기서 성숙한 B 세포는 골수에 존재하는 자기 항원에 결합하지 않는다.[8]
B 세포는 다음과 같은 과정으로 성숙한다.
- 공통 림프모세포(Common lymphoid cell, CLP)
- Pro-B 세포(Pro B cell)
- Pre-B 세포(Pre B cell)
- 미성숙 B 세포(Immature B cell)
- 성숙 B 세포(Mature B cell)
이 과정은 주로 골수에서 일어난다. B 세포는 성숙 과정에서 V(D)J 유전자 재조합을 일으켜 다양한 형태의 항체를 만들어낼 수 있는 능력을 갖추게 된다. 양성 선택과 음성 선택을 통해 면역능이 없거나 자가면역성을 가진 B 세포가 제거되어, 극히 소수의 면역에 적합한 B 세포만이 성숙 B 세포에 이르게 된다.
만약 자기반응성 림프구가 제거되지 않거나 불활성되지 않는다면 면역계는 결국 자신의 세포 또는 조직을 공격하게 된다. 하지만 정상의 경우 림프구들이 골수에서 성숙되는 동안 자기반응성이 점검되며 이러한 과정동안 자기 분자에 특이적인 수용체를 가진 림프구들은 세포자살 (아폽토시스)에 의해 죽거나 무반응세포로 변하게 된다. 즉, 비자기분자와 반응하는 림프구만 남게되고 이러한 과정을 자기관용기작(Self-tolerance)이라고 한다. 만약 자기관용기작이 정상적이지 못할 경우에는 류마티스 관절염과 같은 자가면역질환을 유발하게 된다.[41]
발달을 완료하기 위해 미성숙 B 세포는 전이 B 세포로 골수에서 비장으로 이동하며, 두 개의 전이 단계를 거친다: T1과 T2.[11] 비장 내에서 T1 B 세포는 T2 B 세포로 전환된다.[12] T2 B 세포는 BCR 및 기타 수용체를 통해 수신된 신호에 따라 여포(FO) B 세포 또는 변연대(MZ) B 세포로 분화된다.[13] 일단 분화되면, 이들은 성숙 B 세포 또는 나이브 B 세포로 간주된다.[12]
3. 2. 자가관용
B 세포는 골수에서 성숙 과정을 거치며 V(D)J 유전자 재조합을 통해 다양한 항체를 생산할 수 있는 능력을 갖추게 된다.[41] 이 과정에서 양성 선택과 음성 선택을 통해 면역 능력이 없거나 자가면역성을 가진 B 세포는 제거된다.[41]정상적인 경우, 림프구는 골수에서 성숙하는 동안 자기반응성이 점검되며, 이 과정에서 자기 분자에 특이적인 수용체를 가진 림프구는 세포자살 (아폽토시스)에 의해 제거되거나 무반응세포로 변하여 비자기분자와 반응하는 림프구만 남게 된다.[41] 이러한 과정을 자기관용기작(Self-tolerance)이라고 한다.[41] 자기관용기작이 정상적이지 못할 경우 류마티스 관절염과 같은 자가면역질환을 유발할 수 있다.[41]
4. 활성화
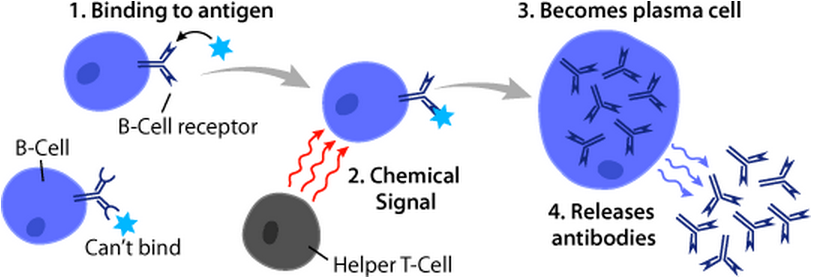
성숙 B 세포는 주로 림프절과 같은 말초림프기관에 머물게 되는데, 이 곳에서 일부 B 세포는 외부 항원을 인식하게 되면서 활성화된다. 활성화된 B 세포는 스스로 증식하게 되어 결과적으로 항원 특이적인 B 세포의 비율이 높아지게 된다. 이후 B 세포는 항체를 활발히 분비하는 플라즈마 세포나 항원에 대한 특이성을 장기간 기억하며 살아가는 기억 B 세포로 분화한다.
B 세포 활성화는 비장 및 림프절과 같은 2차 림프 기관 (SLO)에서 발생한다.[1] B 세포는 골수에서 성숙된 후 혈액을 통해 SLO로 이동하며, SLO는 순환하는 림프를 통해 항원을 지속적으로 공급받는다.[14] SLO에서 B 세포 활성화는 B 세포가 BCR을 통해 항원에 결합하면서 시작된다.[15]
B 세포 활성화는 CD21의 활성을 통해 강화되며, 이는 표면 단백질 CD19 및 CD81과 복합체를 이루는 표면 수용체이다 (세 가지 모두를 통칭하여 B 세포 코수용체 복합체라고 한다).[17] BCR이 C3 보체 단편으로 태그된 항원에 결합하면 CD21이 C3 단편에 결합하고, 결합된 BCR과 함께 공동 결합하며, 신호는 CD19 및 CD81을 통해 전달되어 세포의 활성화 역치를 낮춘다.[18]
기억 B 세포 활성화는 표적 항원을 감지하고 결합하는 것으로 시작하며, 이 항원은 모(母) B 세포와 공유된다.[25] 일부 기억 B 세포는 T 세포 도움 없이 활성화될 수 있는데, 특정 바이러스 특이적 기억 B 세포가 이에 해당하며, 다른 세포들은 T 세포의 도움이 필요하다.[28] 항원 결합 시, 기억 B 세포는 수용체 매개 엔도사이토시스를 통해 항원을 흡수하고, 이를 분해하여 세포막의 MHC-II 분자와 복합체를 이룬 펩타이드 조각 형태로 T 세포에 제시한다.[25] 동일한 항원으로 활성화된 T 세포에서 유래한 기억 T 도우미(TH) 세포, 전형적으로 기억 여포 T 도우미(TFH) 세포는 TCR을 통해 이러한 MHC-II-펩타이드 복합체를 인식하고 결합한다.[25] TCR-MHC-II-펩타이드 결합 및 기억 TFH 세포로부터의 다른 신호 전달에 따라, 기억 B 세포는 활성화되어 여포 외 반응을 통해 형질모세포와 형질 세포로 분화하거나, 생식 중심 반응에 들어가 형질 세포와 더 많은 기억 B 세포를 생성한다.[25][28]
4. 1. T 세포 의존적 활성화
T 세포 의존성(TD) 항원은 이물질 단백질을 포함하며, T 세포의 도움을 받아 B 세포를 활성화시킨다.[1] 이러한 항원에 대한 B 세포 반응은 수일이 걸리지만, 생성된 항체는 T 세포 비의존성 활성화로 생성된 항체보다 친화력이 높고 기능적으로 다양하다.[1]BCR이 TD 항원에 결합하면, 항원은 수용체 매개 세포내이입을 통해 B 세포로 흡수되어 단백질 분해를 거쳐 세포막의 MHC-II 분자와 복합체를 이루어 펩타이드 조각으로 T 세포에 제시된다.[19] T 헬퍼 (TH) 세포, 일반적으로 여포 T 헬퍼 (TFH) 세포는 T 세포 수용체 (TCR)를 통해 이러한 MHC-II-펩타이드 복합체를 인식하고 결합한다.[20] TCR-MHC-II-펩타이드 결합 후, T 세포는 표면 단백질인 CD40L과 IL-4 및 IL-21과 같은 사이토카인을 발현한다.[20] CD40L은 B 세포 표면 수용체 CD40에 결합하여 B 세포 증식, 면역글로불린 동형 전환, 체세포 과돌연변이를 촉진하고 T 세포 성장 및 분화를 유지함으로써 B 세포 활성화에 필요한 공동 자극 인자로 작용한다.[1] B 세포 사이토카인 수용체에 결합된 T 세포 유래 사이토카인은 B 세포 증식, 면역글로불린 동형 전환, 체세포 과돌연변이를 촉진하고 분화를 유도한다.[20] B 세포가 이러한 신호를 수신하면 활성화된 것으로 간주된다.[20]
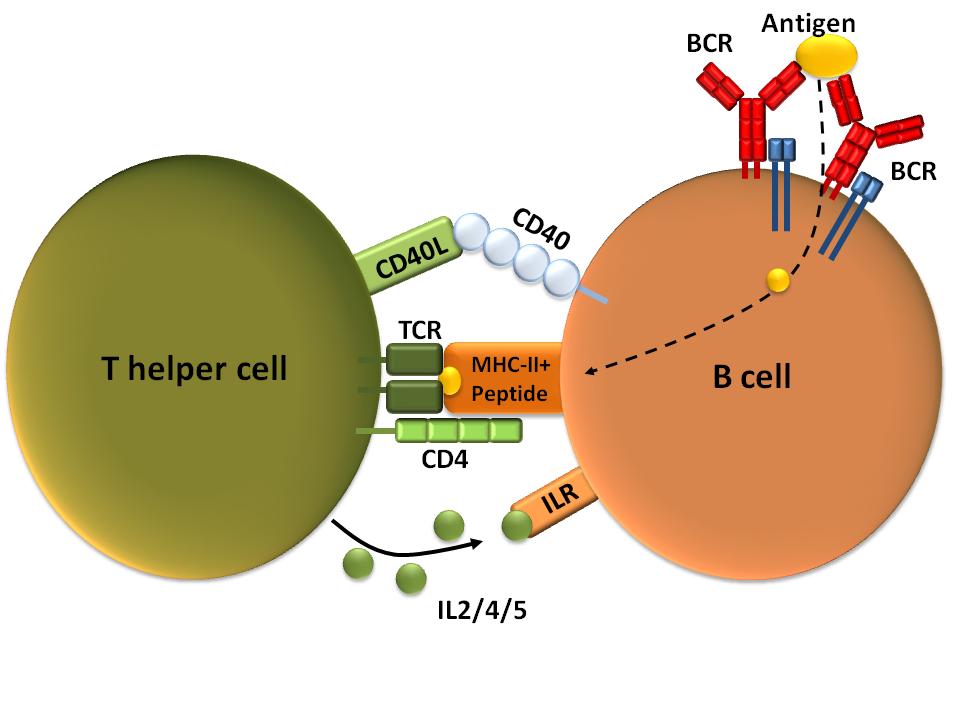
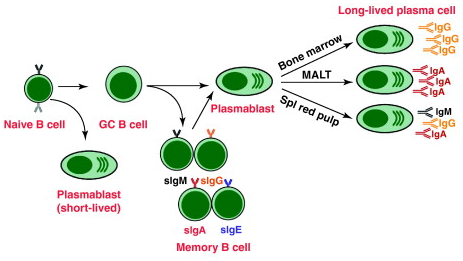
활성화된 B 세포는 즉각적인 보호를 위한 단기 플라스마모세포와 지속적인 보호를 위한 장기 생존 형질 세포 및 기억 B 세포를 모두 생성하는 2단계 분화 과정에 참여한다.[16] 첫 번째 단계는 림프 여포 외부에서 발생하지만 여전히 SLO 내에서 발생하는 여포 외 반응이라고 알려져 있으며, 이 단계에서 활성화된 B 세포는 증식하고 면역글로불린 동형 전환을 겪을 수 있으며, 주로 IgM 클래스의 초기에 약한 항체를 생성하는 플라스마모세포로 분화한다.[16][21]
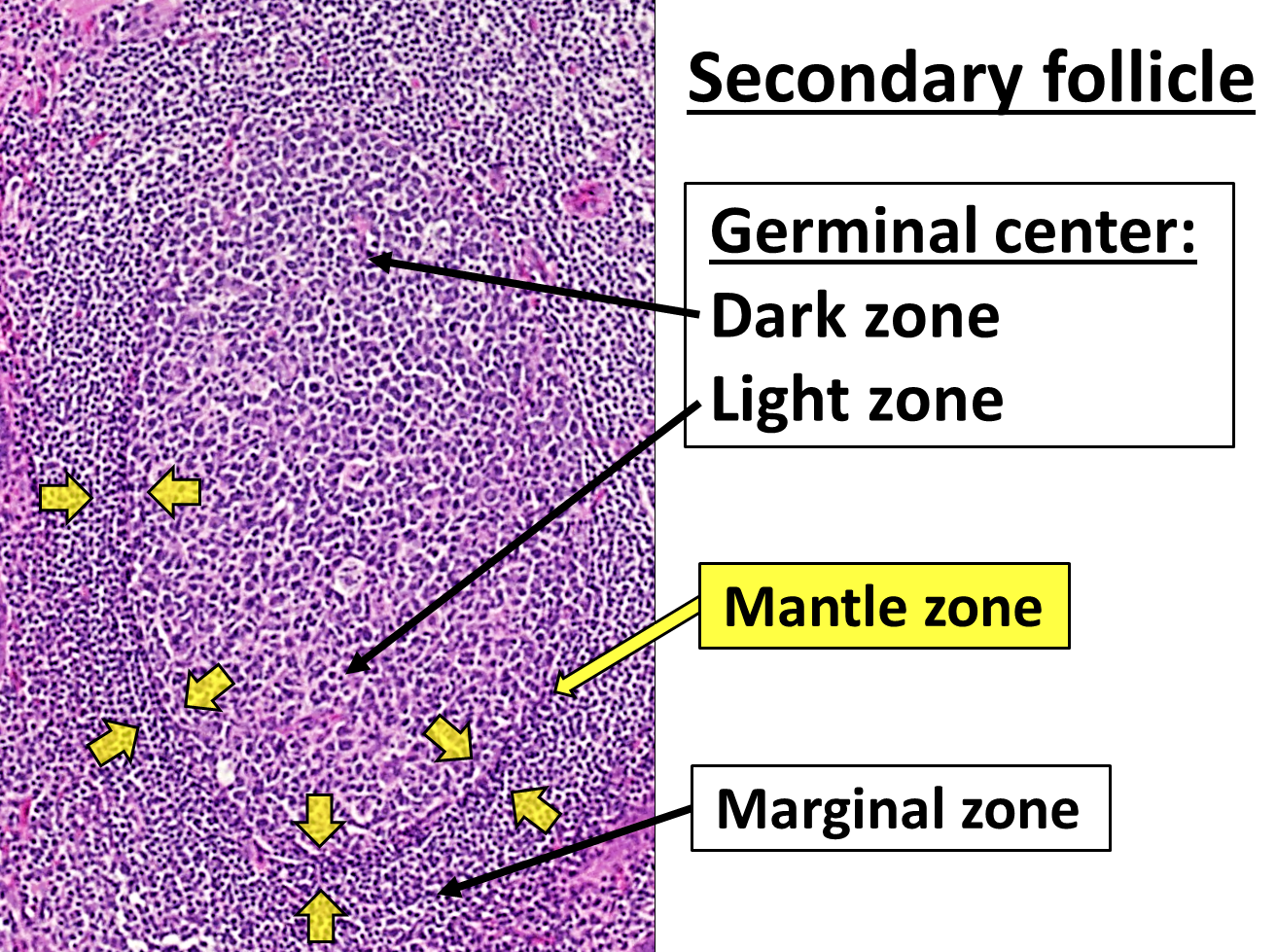
두 번째 단계는 활성화된 B 세포가 림프 여포에 들어가 배 중심 (GC)을 형성하는 것으로 구성되며, 이곳은 B 세포가 광범위한 증식, 면역글로불린 동형 전환, 및 체세포 과돌연변이에 의해 유도되는 친화성 성숙을 겪는 특수 미세 환경이다.[22] 이러한 과정은 GC 내의 TFH 및 여포 수지상 세포에 의해 촉진되며, 고친화성 기억 B 세포와 장기 생존 형질 세포를 모두 생성한다.[16][23] 결과적으로 형질 세포는 많은 수의 항체를 분비하고 SLO 내에 머물거나, 더 선호적으로 골수로 이동한다.[22]
B 세포의 활성화에는 일반적으로 B 세포 수용체, B 세포 보조 수용체 및 CD4 양성 T 세포로부터의 신호 3가지가 필요하다.[38]
성숙 나이브 B 세포는 표면에 IgM을 발현하며, 이것이 미생물 표면의 항원에 의해 가교되면 B 세포 내로 신호가 전달된다. B 세포막에서 IgM은 Igα 및 Igβ라고 하는 막관통 단백질과 회합하며, 이들 회합체가 기능적인 B 세포 항원 수용체 (BCR)이다. 이 Igβ의 세포질 부분에 존재하는 티로신 잔기가 인산화됨으로써 신호 전달 경로가 시작된다.
B 세포 보조 수용체는 CD21(보체 수용체 2, CR2), CD19, 및 CD81로 구성된다. 어떤 종류의 병원체 표면은 보체를 분해하는 특성을 가지고 있다. 이 때문에 보체 단편 C3d가 침착되는데, CD21은 이 분자와 결합할 수 있다. 이와 같이 B 세포 수용체와 B 세포 보조 수용체가 동시에 회합하면, Igα에 세포질 부분에서 회합한 티로신 키나아제에 의해 CD19가 인산화되어 신호 전달 경로가 시작된다.
흉선 비의존성 항원을 제외한 항원에 의한 활성화에서는 CD4 양성 T 세포가 분비하는 사이토카인이 필요하다. B 세포는 B 세포 항원 수용체에 의해 수용체 매개 세포내이입으로 항원을 섭취할 수 있다. 섭취한 항원을 제시한 MHC II와 CD4 양성 T 세포가 상호 작용하면, B 세포 표면의 CD40과 T 세포 표면의 CD40L의 결합, 및 T 세포에서 생산되는 사이토카인의 자극에 의해 B 세포가 활성화된다.
결합된 CD4 양성 T 세포로부터의 사이토카인에 의해 활성화되면, B 세포는 증식을 시작하여 일차 반응 덩어리(primary focus)를 형성한다. 그 후, 이 세포들은 수질 끈과 림프 소절로 이동한다. 수질 끈으로 이동한 것은 TH2 세포로부터의 사이토카인에 의해 형질 세포로 분화한다. 여기서 형성된 형질 세포는 주로 IgM을 생산한다. 한편, 림프 소절로 이동한 것은 대형화되어, 더욱 활발하게 분열하게 된다. 이 세포는 중심모세포(centroblast)라고 불린다. 중심모세포는 증식함에 따라 배 중심을 형성하고, 림프절에 종창을 가져온다. 이윽고 분열이 정지하고, 중심 세포(centrocyte)가 되면, 배 중심의 바깥쪽에 위치하는 명 영역으로 이동하여 여포 수지상 세포와 상호 작용한다.
4. 2. T 세포 비의존적 활성화
T 세포의 도움 없이 B 세포를 활성화하는 항원은 T 세포 비의존 항원(TI)으로 알려져 있으며, 여기에는 외래 다당류와 비메틸화 CpG DNA가 포함된다.[1][16] 이러한 항원에 대한 B 세포 반응은 빠르지만, 생성된 항체는 T 세포 의존적 활성화에서 생성된 항체보다 친화력이 낮고 기능적으로 덜 다재다능한 경향이 있다.[1]TD 항원과 마찬가지로, TI 항원에 의해 활성화된 B 세포는 활성화를 완료하기 위해 추가적인 신호가 필요하다. T 세포로부터 받는 대신, 일반적인 미생물 구성 성분이 톨 유사 수용체(TLR)에 인식되어 결합하거나, 세균 세포의 반복적인 에피토프에 대한 B 세포 수용체(BCR)의 광범위한 가교 결합에 의해 제공된다.[1] TI 항원에 의해 활성화된 B 세포는 림프oid 소포 밖에서, SLOs (GC는 형성되지 않음)에서 증식하고, 면역글로불린 클래스 전환을 거칠 수 있으며, 주로 IgM 클래스의 초기 약한 항체를 생성하는 단명 형질모세포로 분화되지만, 일부 장수명 형질 세포 집단도 생성한다.[24]
B세포의 활성화에는 일반적으로 B세포 수용체, B세포 보조 수용체 및 CD4 양성 T세포로부터의 신호 3가지가 필요하다[38]
성숙 나이브 B 세포는 표면에 IgM을 발현하며, 이것이 미생물 표면의 항원에 의해 가교되면 B세포 내로 신호가 전달된다. B세포 막에서 IgM은 Igα 및 Igβ라고 하는 막관통 단백질과 회합하며, 이들 회합체가 기능적인 B세포 항원 수용체(BCR)이다. 이 Igβ의 세포질 부분에 존재하는 티로신 잔기가 인산화됨으로써 신호 전달 경로가 시작된다.
B세포 보조 수용체는 CD21(보체 수용체 2, CR2), CD19, 및 CD81로 구성된다. 어떤 종류의 병원체 표면은 보체를 분해하는 특성을 가지고 있다. 이 때문에 보체 단편 C3d가 침착되는데, CD21은 이 분자와 결합할 수 있다. 이와 같이 B세포 수용체와 B세포 보조 수용체가 동시에 회합하면, Igα에 세포질 부분에서 회합한 티로신 키나아제에 의해 CD19가 인산화되어 신호 전달 경로가 시작된다.
또한, 흉선 비의존성 항원을 제외한 항원에 의한 활성화에서는 CD4 양성 T세포가 분비하는 사이토카인이 필요하다. B세포는 B세포 항원 수용체에 의해 수용체 매개 엔도사이토시스에 의해 항원을 섭취할 수 있다. 섭취한 항원을 제시한 MHC II와 CD4 양성 T세포가 상호 작용하면, B세포 표면의 CD40과 T세포 표면의 CD40L의 결합, 및 T세포에서 생산되는 사이토카인의 자극에 의해 B세포가 활성화된다.
4. 3. 보조 T 세포의 역할
보조 T세포(T Helper cell)는 면역계에서 중요한 역할을 하는 림프구의 일종이다. 이들은 세포독성작용이나 식세포작용을 통해 감염된 세포나 항원을 직접 제거하지는 않지만, 다른 면역 세포들을 활성화하고 지시하는 핵심적인 기능을 수행한다.[1] 특히 B 세포의 항체 생성, 세포독성 T세포 활성화, 대식세포 등 식세포의 항박테리아 활동 촉진에 필수적이다.[1]B 세포 활성화에 T 세포의 도움이 필요한 항원을 T 세포 의존성(TD) 항원이라고 하며, 여기에는 이물질 단백질이 포함된다.[1] 이러한 항원에 대한 B 세포 반응은 며칠이 걸리지만, 생성되는 항체는 T 세포 비의존성 활성화를 통해 생성된 항체보다 친화력이 높고 기능적으로 다양하다.[1]
B 세포가 T 세포 의존성 항원을 만나면, 항원은 수용체 매개 세포내이입을 통해 B 세포 내부로 들어와 단백질 분해를 거친다. 이후 세포막의 MHC-II 분자와 결합하여 펩타이드 조각 형태로 T 세포에 제시된다.[19] T 헬퍼 세포, 그 중에서도 여포 T 헬퍼 (TFH) 세포는 T 세포 수용체 (TCR)를 통해 이 MHC-II-펩타이드 복합체를 인식하고 결합한다.[20]
TCR과 MHC-II-펩타이드 복합체가 결합하면, T 세포는 CD40L과 같은 표면 단백질과 IL-4, IL-21 등의 사이토카인을 발현한다.[20] CD40L은 B 세포 표면의 CD40과 결합하여 B 세포 증식, 면역글로불린 동형 전환, 체세포 과돌연변이를 촉진하고, T 세포의 성장과 분화를 돕는 공동 자극 인자로 작용한다.[1] T 세포 유래 사이토카인은 B 세포의 사이토카인 수용체에 결합하여 B 세포 증식, 면역글로불린 동형 전환, 체세포 과돌연변이를 더욱 촉진하고 분화를 유도한다.[20] 이러한 신호를 모두 받으면 B 세포는 활성화된 것으로 간주된다.[20]
활성화된 B 세포는 즉각적인 방어를 위한 단기 플라스마모세포와 장기적인 면역을 담당하는 장기 생존 형질 세포 및 기억 B 세포를 생성하는 2단계 분화 과정을 거친다.[16] 첫 번째 단계는 여포 외 반응으로, 림프 여포 외부에서 발생하지만 여전히 SLO 내에서 진행된다.[16] 이 단계에서 활성화된 B 세포는 증식하고 면역글로불린 동형 전환을 거쳐 주로 IgM 클래스의 초기 항체를 생성하는 플라스마모세포로 분화한다.[21]
|thumb|배 중심을 가진 정상적인 림프 여포의 조직학]]
두 번째 단계에서 활성화된 B 세포는 림프 여포로 들어가 배 중심 (GC)을 형성한다.[22] 배 중심은 B 세포가 광범위하게 증식하고, 면역글로불린 동형 전환을 겪으며, 체세포 과돌연변이에 의해 친화성 성숙이 일어나는 특수한 환경이다.[22] 이 과정은 GC 내의 TFH 세포와 여포 수지상 세포에 의해 촉진되며, 고친화성 기억 B 세포와 장기 생존 형질 세포를 생성한다.[16][23] 생성된 형질 세포는 다량의 항체를 분비하며 SLO에 머무르거나 골수로 이동한다.[22]
기억 B 세포는 표적 항원을 감지하고 결합하는 것으로 활성화가 시작되며, 이 항원은 모(母) B 세포와 공유된다.[25] 일부 기억 B 세포는 T 세포 도움 없이 활성화될 수 있지만(특정 바이러스 특이적 기억 B 세포), 대부분은 T 세포의 도움이 필요하다.[28] 항원과 결합한 기억 B 세포는 수용체 매개 엔도사이토시스를 통해 항원을 흡수하고, 분해하여 MHC-II 분자와 복합체를 이룬 펩타이드 조각 형태로 T 세포에 제시한다.[25] 동일 항원에 의해 활성화된 기억 T 도우미(TH) 세포, 주로 기억 여포 T 도우미(TFH) 세포는 TCR을 통해 MHC-II-펩타이드 복합체를 인식하고 결합한다.[25] TCR-MHC-II-펩타이드 결합 및 기억 TFH 세포의 추가 신호에 따라, 기억 B 세포는 활성화되어 형질모세포와 형질 세포로 분화하거나, 생식 중심 반응을 통해 더 많은 형질 세포와 기억 B 세포를 생성한다.[25][28]
B 세포 활성화에는 일반적으로 세 가지 신호가 필요하다.[38] 첫째, 성숙 나이브 B 세포 표면의 IgM이 미생물 표면 항원과 결합하면 B 세포 내로 신호가 전달된다. IgM은 Igα 및 Igβ와 함께 기능적인 '''B 세포 항원 수용체'''(BCR)를 형성하며, Igβ의 세포질 부분에 있는 티로신 잔기가 인산화되어 신호 전달 경로가 시작된다. 둘째, '''B 세포 보조 수용체''' (CD21, CD19, CD81)가 관여한다. 특정 병원체는 보체를 분해하여 보체 단편 C3d를 침착시키는데, CD21이 C3d와 결합한다. B 세포 수용체와 보조 수용체가 동시에 결합하면 Igα와 연관된 티로신 키나아제가 CD19를 인산화시켜 신호 전달을 강화한다. 셋째, 흉선 비의존성 항원을 제외한 대부분의 항원에 의한 활성화에는 CD4 양성 T 세포가 분비하는 사이토카인이 필요하다. B 세포는 B 세포 항원 수용체를 통해 수용체 매개 세포내이입으로 항원을 섭취하고, MHC II에 항원을 제시하여 CD4 양성 T 세포와 상호작용한다. B 세포 표면의 CD40과 T 세포 표면의 CD40L 결합, 그리고 T 세포가 생산하는 사이토카인의 자극이 B 세포 활성화를 유도한다.
CD4 양성 T 세포의 사이토카인에 의해 활성화된 B 세포는 증식하여 일차 반응 덩어리(primary focus)를 형성한다. 이후 세포들은 수질 끈과 림프 소절로 이동한다. 수질 끈으로 이동한 B 세포는 TH2 세포의 사이토카인에 의해 형질 세포로 분화하여 주로 IgM을 생산한다. 림프 소절로 이동한 B 세포는 크기가 커지고 활발하게 분열하는 가 된다. 중심모세포는 증식하면서 배 중심을 형성하고 림프절을 붓게 만든다. 이후 분열을 멈추고 중심 세포(centrocyte)가 되면 배 중심 바깥쪽의 명 영역으로 이동하여 여포 수지상 세포와 상호작용한다.
5. B 세포 종류
B 세포는 여러 종류로 나뉜다.[1]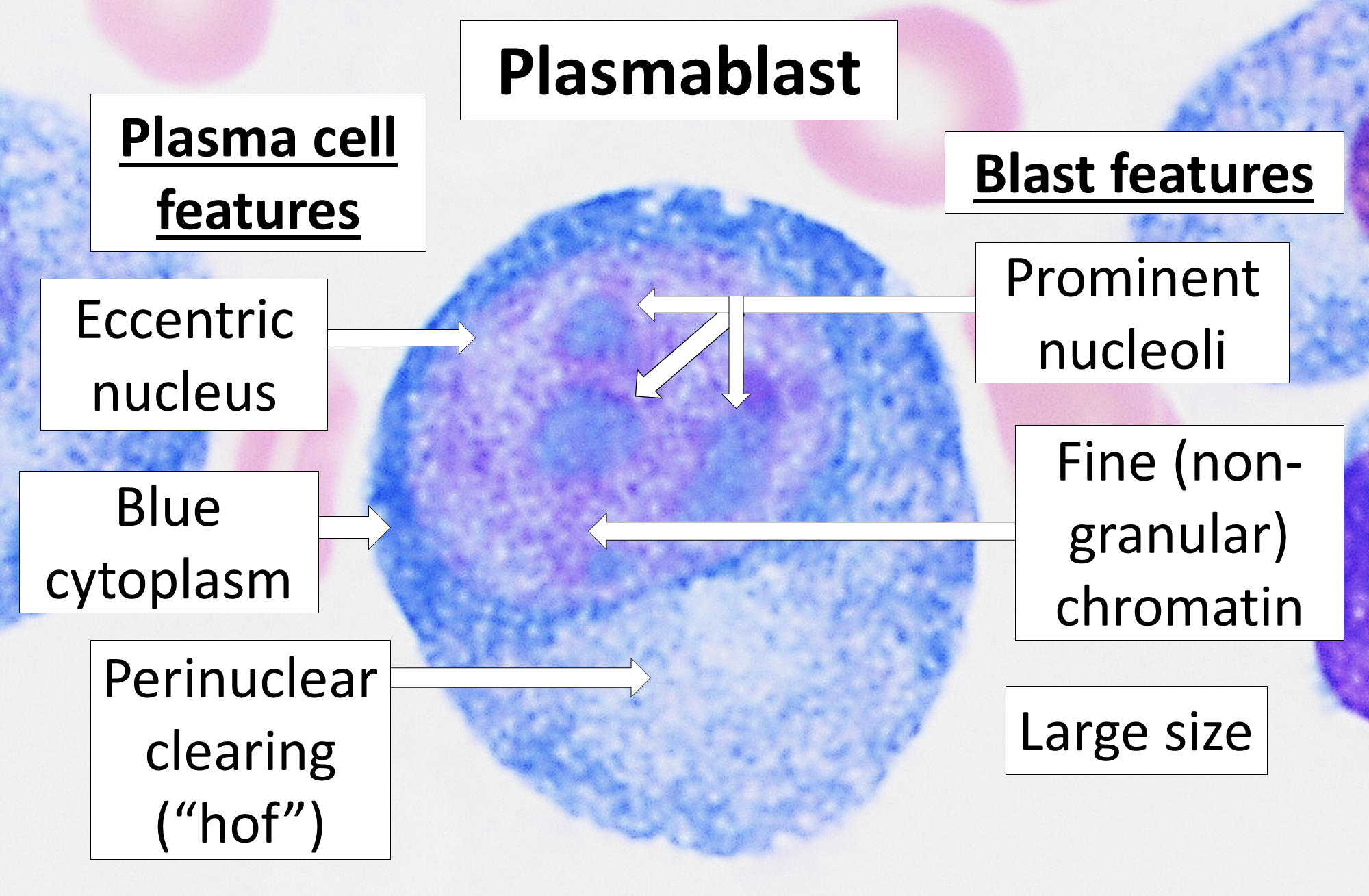
- 형질모세포: B 세포 분화에서 발생하는 단명하고 증식하는 항체 분비 세포이다.[1] 형질모세포는 감염 초기에 생성되며, 이들이 생성하는 항체는 표적 항원에 대한 친화도가 형질 세포에 비해 약한 경향이 있다.[16] 형질모세포는 B 세포의 T 세포 비의존적 활성화 또는 B 세포의 T 세포 의존적 활성화로부터의 여포외 반응으로 생성될 수 있다.[1]
- 형질 세포: B 세포 분화에서 발생하는 장수명 비증식 항체 분비 세포이다.[1] B 세포는 먼저 형질모세포 유사 세포로 분화된 다음 형질 세포로 분화된다는 증거가 있다.[16] 형질 세포는 감염 후반에 생성되며, 형질모세포에 비해 배 중심(GC)에서의 친화성 성숙으로 인해 표적 항체에 대한 친화도가 더 높은 항체를 가지며 더 많은 항체를 생성한다.[16] 형질 세포는 일반적으로 B 세포의 T 세포 의존적 활성화로부터 배 중심 반응으로 생성되지만, B 세포의 T 세포 비의존적 활성화로도 생성될 수 있다.[24]
- 림프형질세포양 세포: B 림프구와 형질 세포의 형태학적 특징을 혼합하여 나타내는 세포로, 형질 세포와 밀접하게 관련되어 있거나 형질 세포의 하위 유형으로 여겨진다. IgM 단클론성 단백질의 분비와 관련된 전악성 및 악성 형질 세포 이형성증에서 발견된다. 이러한 이형성증에는 IgM 단클론 감마병증 및 왈덴스트롬 마크로글로불린혈증이 포함된다.[27]
- 기억 B 세포: B 세포 분화에서 발생하는 휴면 B 세포이다.[1] 이들의 기능은 신체를 순환하면서 부모 B 세포를 활성화시킨 항원을 감지할 경우 더 강력하고 신속한 항체 반응(후기 면역 반응이라고 함)을 시작하는 것이다(기억 B 세포와 부모 B 세포는 동일한 BCR을 공유하므로 동일한 항원을 감지한다).[28] 기억 B 세포는 T 세포 의존적 활성화로부터 여포외 반응과 배 중심 반응 모두를 통해 생성될 수 있으며, B1 세포의 T 세포 비의존적 활성화로부터도 생성될 수 있다.[28]
- B-2 세포: FO B 세포 및 MZ B 세포.[30]
- 여포(FO) B 세포 (B-2 세포라고도 함): 가장 흔한 유형의 B 세포이며 혈액을 순환하지 않을 때는 주로 이차 림프 기관(SLO)의 림프 여포에서 발견된다.[16] 이들은 감염 중 고친화성 항체의 대부분을 생성하는 역할을 한다.[1]
- 변연대(MZ) B 세포: 주로 비장의 변연대에서 발견되며, 변연대가 일반 순환계로부터 많은 양의 혈액을 받기 때문에 혈액 매개 병원체에 대한 1차 방어선 역할을 한다.[29] T 세포 비의존적 활성화와 T 세포 의존적 활성화 모두를 겪을 수 있지만, T 세포 비의존적 활성화를 선호한다.[16]
- B-1 cell: FO B 세포 및 MZ B 세포와 다른 발달 경로에서 발생한다.[30] 쥐에서는 주로 복강 및 흉막강에 분포하며, 자연 항체 (감염 없이 생성된 항체)를 생성하고, 점막 병원체에 대항하며, 주로 T 세포 비의존적 활성화를 나타낸다.[30] 쥐 B-1 세포의 진정한 상동체는 인간에서는 발견되지 않았지만, B-1 세포와 유사한 다양한 세포 집단이 설명되었다.[30]
- 조절 B (Breg) 세포: IL-10, IL-35 및 TGF-β의 분비를 통해 병원성, 염증성 림프구의 확장을 억제하는 면역 억제 B 세포 유형이다.[31] 또한 T 세포와 직접 상호 작용하여 T 세포 분화를 Tregs 방향으로 유도함으로써 조절 T (Treg) 세포 생성을 촉진한다.[31] 일반적인 Breg 세포 정체성은 설명되지 않았으며, 조절 기능을 공유하는 많은 Breg 세포 하위 집단이 쥐와 인간 모두에서 발견되었다.[31] Breg 세포 하위 집단이 발달적으로 연결되어 있는지, Breg 세포로의 분화가 정확히 어떻게 발생하는지는 현재 알려져 있지 않다.[31] 거의 모든 B 세포 유형이 염증 신호 및 BCR 인식을 포함하는 메커니즘을 통해 Breg 세포로 분화될 수 있다는 증거가 있다.[31]
6. B 세포 관련 병리
자가면역 질환은 자가항원에 대한 비정상적인 B 세포 인식과 그에 따른 자가항체 생성으로 인해 발생할 수 있다.[32] B 세포 활성과 질병 활성이 연관된 자가면역 질환에는 경피증, 다발성 경화증, 전신성 홍반성 루푸스, 제1형 당뇨병, 감염 후 과민성 대장 증후군, 류마티스 관절염 등이 있다.[32]
B 세포와 그 전구 세포의 악성 형질전환은 암을 유발할 수 있으며, 여기에는 만성 림프구성 백혈병, 급성 림프모구 백혈병, 털세포 백혈병, 여포 림프종, 비호지킨 림프종, 호지킨 림프종, 형질 세포 질환과 같은 다발성 골수종, Waldenström's 거대글로불린혈증, 특정 형태의 아밀로이드증이 포함된다.[33][34]
비정상적인 B 세포는 비교적 클 수 있으며, 미만성 거대 B 세포 림프종 (DLBCL)과 혈관내 거대 B 세포 림프종 등이 그 예시이다.
B 세포 림프구 감소증 환자는 감염에 취약하다.[35]
6. 1. 자가면역질환
자가면역 질환은 자가항원에 대한 비정상적인 B 세포 인식과 그에 따른 자가항체 생성으로 인해 발생할 수 있다.[32] B 세포 활성과 질병 활성이 연관된 자가면역 질환에는 경피증, 다발성 경화증, 전신성 홍반성 루푸스, 제1형 당뇨병, 감염 후 과민성 대장 증후군, 류마티스 관절염 등이 있다.[32]6. 2. B 세포 관련 암
자가면역 질환은 자가항원에 대한 비정상적인 B 세포 인식과 그에 따른 자가항체 생성으로 인해 발생할 수 있다.[32] B 세포 활성과 질병 활성이 연관된 자가면역 질환에는 경피증, 다발성 경화증, 전신성 홍반성 루푸스, 제1형 당뇨병, 감염 후 과민성 대장 증후군, 류마티스 관절염 등이 있다.[32]B 세포와 그 전구 세포의 악성 형질전환은 암을 유발할 수 있으며, 여기에는 만성 림프구성 백혈병, 급성 림프모구 백혈병, 털세포 백혈병, 여포 림프종, 비호지킨 림프종, 호지킨 림프종, 형질 세포 질환과 같은 다발성 골수종, Waldenström's 거대글로불린혈증, 특정 형태의 아밀로이드증이 포함된다.[33][34] 비정상적인 B 세포는 비교적 클 수 있으며, 미만성 거대 B 세포 림프종 (DLBCL)과 혈관내 거대 B 세포 림프종 등이 그 예시이다.
B 세포 림프구 감소증 환자는 감염에 취약하다.[35]
6. 3. B 세포 림프구 감소증
B 세포 림프구 감소증 환자는 감염에 취약하다.[35] 자가면역 질환은 자가항원에 대한 비정상적인 B 세포 인식과 그에 따른 자가항체 생성으로 인해 발생할 수 있다.[32] B 세포 활성과 질병 활성이 연관된 자가면역 질환에는 경피증, 다발성 경화증, 전신성 홍반성 루푸스, 제1형 당뇨병, 감염 후 과민성 대장 증후군, 류마티스 관절염 등이 있다.[32] B 세포와 그 전구 세포의 악성 형질전환은 암을 유발할 수 있으며, 여기에는 만성 림프구성 백혈병, 급성 림프모구 백혈병, 털세포 백혈병, 여포 림프종, 비호지킨 림프종, 호지킨 림프종, 형질 세포 질환과 같은 다발성 골수종, Waldenström's 거대글로불린혈증, 특정 형태의 아밀로이드증이 포함된다.[33][34] 비정상적인 B 세포는 비교적 클 수 있으며, 일부 질병은 이러한 특징을 질병명에 포함하는데, 예를 들어 미만성 거대 B 세포 림프종 (DLBCL)과 혈관내 거대 B 세포 림프종 등이 있다.7. 후성유전학
전체 유전체 바이설파이트 시퀀싱(WGBS)을 사용하여 배아 세포 분화 주기에 따른 B세포의 메틸롬을 연구한 결과, 가장 초기 단계에서 가장 분화된 단계까지 저메틸화가 일어난다는 것이 밝혀졌다. 가장 큰 메틸화 차이는 배 중심 B 세포와 기억 B 세포 사이에서 나타났다. 또한, 이 연구는 B 세포 종양과 장수하는 B 세포가 DNA 메틸화 지표에서 유사성을 보인다는 것을 보여주었다.[36]
참조
[1]
서적
Janeway's Immunobiology
Garland Science
[2]
서적
Molecular Biology of the Cell
Garland Science
2002
[3]
논문
The early history of B cells
2015-03
[4]
논문
The Bursa of Fabricius and Antibody Production
1956-01-01
[5]
논문
Antibody Specific B-Cell Epitope Predictions: Leveraging Information From Antibody-Antigen Protein Complexes
2019
[6]
논문
Cell Fate Decisions: The Role of Transcription Factors in Early B-cell Development and Leukemia
2020-11
[7]
논문
Lymphoid and myeloid lineage commitment in multipotent hematopoietic progenitors
2010-11
[8]
논문
Central B-cell tolerance: where selection begins
2012-04
[9]
논문
The pre-B cell receptor checkpoint
2010-06
[10]
논문
B lymphocytes: how they develop and function
2008-09
[11]
논문
B cell development in the spleen takes place in discrete steps and is determined by the quality of B cell receptor-derived signals
1999-07
[12]
논문
Transitional B cells: step by step towards immune competence
2003-06
[13]
논문
Marginal zone B cells: virtues of innate-like antibody-producing lymphocytes
2013-02
[14]
논문
Early events in B cell activation
2010-01-01
[15]
논문
How B cells capture, process and present antigens: a crucial role for cell polarity
2013-07
[16]
논문
The generation of antibody-secreting plasma cells
2015-03
[17]
논문
Human complement receptor 2 (CR2/CD21) as a receptor for DNA: implications for its roles in the immune response and the pathogenesis of systemic lupus erythematosus (SLE)
2013-01
[18]
논문
Cell-specific regulation of the CD21 gene
2001-03
[19]
논문
Pathways of antigen processing
2013-01-01
[20]
논문
A brief history of T cell help to B cells
2015-03
[21]
논문
Extrafollicular antibody responses
2003-08
[22]
논문
Germinal center selection and the development of memory B and plasma cells
https://zenodo.org/r[...]
2012-05
[23]
논문
Endocytosis and Recycling of Immune Complexes by Follicular Dendritic Cells Enhances B Cell Antigen Binding and Activation
https://www.scienced[...]
2013-06-27
[24]
논문
Long-lived bone marrow plasma cells are induced early in response to T cell-independent or T cell-dependent antigens
2012-06
[25]
논문
Molecular programming of B cell memory
2011-12
[26]
논문
Optimization of a human IgG B-cell ELISpot assay for the analysis of vaccine-induced B-cell responses
2013-05-31
[27]
논문
Plasma cell morphology in multiple myeloma and related disorders
2015-06
[28]
논문
Memory B cells
2015-03
[29]
논문
Marginal zone B cells
2005-01-01
[30]
논문
The double life of a B-1 cell: self-reactivity selects for protective effector functions
2011-01
[31]
논문
Regulatory B cells: origin, phenotype, and function
2015-04
[32]
논문
B-lymphocyte contributions to human autoimmune disease
2008-06
[33]
논문
Pathogenesis of human B cell lymphomas
2012-01-01
[34]
논문
Plasma Cell Disorders
2016-12
[35]
간행물
Peripheral B Cell Deficiency and Predisposition to Viral Infections: The Paradigm of Immune Deficiencies
https://www.frontier[...]
[36]
논문
Whole-genome fingerprint of the DNA methylome during human B cell differentiation
2015-07
[37]
웹사이트
抗原の情報はどうやってT細胞からB細胞へ伝わるの?
http://kawamoto.fron[...]
京都大学ウイルス・再生医科学研究所 河本宏研究室
2014-12-16
[38]
서적
エッセンシャル免疫学
メディカル・サイエンス・インターナショナル
[39]
서적
Cellular and Molecular Immunology
Saunders Elsevier
[40]
서적
인체생리학
고문사
[41]
문서
고급생명과학
서울특별시교육청
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com