방광암
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
방광암은 방광 세포의 DNA 변화로 인해 발생하는 질병으로, 전 세계적으로 암 발병률 10위, 암 사망 원인 13위를 기록한다. 흡연, 특정 화학 물질 노출, 만성 방광 감염 등이 주요 위험 요인이며, 남성이 여성보다 발병률이 높다. 주요 증상은 통증 없는 혈뇨이며, 진단은 신체 검사, 소변 검사, 방광경 검사, 영상 검사 등을 통해 이루어진다. 치료는 종양의 침윤 정도에 따라 경요도 방광 종양 절제술, 방광 절제술, 항암 화학 요법, 방사선 치료, 면역 요법 등이 사용되며, 예후는 암의 진행 정도에 따라 달라진다.
더 읽어볼만한 페이지
- 방광암 - 개와 고양이의 방광암
개와 고양이의 방광암은 혈뇨, 배뇨 곤란, 빈뇨, 요실금 등의 증상을 보이는 방광 내 암으로, 정확한 진단을 위해 혈액, 소변, 영상 검사 및 생검이 필요하며, 화학 요법과 비스테로이드성 소염 진통제로 치료하고, 특히 스코티시 테리어에서 발병 위험이 높다. - 암의 종류 - 피부암
피부암은 피부 세포에서 발생하는 악성 종양으로, 자외선 노출, 유전적 요인, 면역 저하 등이 원인이 되며 기저세포암, 편평상피세포암, 흑색종으로 나뉘고 조기 발견과 자외선 차단이 중요하다. - 암의 종류 - 전립선암
전립선암은 전립선 세포 DNA의 유전자 돌연변이로 발생하는 남성 암으로, 초기 증상이 없다가 진행되면 배뇨장애, 발기부전 등이 나타날 수 있으며, PSA 검사, 직장수지검사, 생검 등을 통해 진단하고, 병기, 글리슨 등급, PSA 수치에 따라 치료하며, 전이성 암에는 호르몬 요법, 거세 저항성 암에는 추가 치료를 시행하고, 발병 위험은 나이, 유전, 생활 습관 등에 영향을 받는다.
| 방광암 | |
|---|---|
| 질병 정보 | |
| 분야 | 종양학, 비뇨기과 |
| 증상 | 소변의 혈액 |
| 발병 연령 | 65세 이상 |
| 종류 | 비근침윤성 방광암 (NMIBC), 근침윤성 방광암 (MIBC), 전이성 방광암 |
| 위험 요인 | 흡연, 특정 독성 화학 물질 노출, 주혈흡충증 감염 |
| 진단 | 방광경 검사와 조직 생검 |
| 치료 | 경요도 절제술 (TURBT), 화학 요법, BCG 백신, 면역 요법, 근치적 방광 절제술, 분자 표적 치료 |
| 예후 | 5년 생존율은 병기에 따라 5%에서 96%까지 다양함 |
| 빈도 | 연간 약 50만 건 |
| 사망자 수 | 연간 약 20만 명 |
| 기타 정보 | |
| DiseasesDB | 1427 |
| ICD-10 | , |
| ICD-9 | , |
| OMIM | 109800 |
| MeshID | D001749 |
| 이미지 | |
 | |
 | |
2. 원인
방광암은 방광 세포의 DNA 변화로 인해 세포가 제어 불능적으로 성장하는 질병이다.[12] 이러한 변화는 무작위로 발생하거나, 담배 섭취 등 독성 물질에 노출되어 유발될 수 있다.[11] 유전적 손상은 수년에 걸쳐 축적되어 결국 방광 세포의 정상 기능을 방해하고, 종양이라고 불리는 세포 덩어리로 성장하게 한다.[12] 암세포는 증식함에 따라 추가적인 DNA 변화를 축적하여 종양이 면역 체계를 회피하고, 정상적인 세포 사멸 경로를 억제하며, 결국 신체의 다른 부위로 전이될 수 있다.
같은 조직에서 발생하지만, 비근육침윤성 방광암(NMIBC)과 근육침윤성 방광암(MIBC)은 서로 다른 경로를 따라 발달하고 서로 다른 유전자 돌연변이를 나타낸다. NMIBC는 대부분 저등급 유두형 종양으로 시작하며, FGFR3 활성화 돌연변이가 가장 흔하다. PI3K/AKT/mTOR 경로 성장 경로를 활성화하는 돌연변이도 흔하며, PIK3CA, ERBB2/ERBB3, TSC1 등의 유전자 변이가 포함된다.
MIBC는 종종 저위치, 평평하고 고등급의 종양으로 시작하여 빠르게 방광 너머로 전이된다. 폐암과 흑색종을 제외한 어떤 암보다도 돌연변이가 더 빈번하며, 종양억제유전자 TP53과 RB을 비활성화하는 돌연변이가 흔하다.
NMIBC와 MIBC에 공통적인 유전적 이상으로는 9번 염색체의 전부 또는 일부 상실, 텔로미어를 연장하는 유전자 TERT의 돌연변이 등이 있다.
방광암의 주요 원인으로는 흡연, 직업적 노출, 만성 방광 감염, 의학적 치료, 유전적 요인, 기타 요인(비위생적인 환경, 화학 물질(특히 방향족 아민)[17], 빌하르트 주혈흡충(편평상피암) 감염[18]) 등이 있다. 9번 염색체 장완 이형접합성 소실, 17번 염색체 단완 이형접합성 소실도 방광암 발생에 관여한다.
2. 1. 흡연
담배 흡연은 방광암의 주요 위험 원인이며, 방광암 환자의 약 절반이 흡연으로 인한 것으로 추정된다.[13] 담배 연기에는 발암 물질이 포함되어 있으며, 이러한 물질은 혈액으로 들어가 신장을 통해 소변으로 걸러진다. 소변 속 발암 물질은 방광 세포의 DNA를 손상시켜 암을 유발할 수 있다.[13] 방광암 위험은 하루에 피우는 담배 개수와 흡연 기간에 비례하여 증가하며, 흡연자는 치료 실패, 전이, 사망 위험도 증가한다. 금연하면 방광암 발생 위험이 감소하며, 금연 5년 후에는 30% 감소한다. 그러나 금연을 하더라도 위험도는 전혀 흡연하지 않은 사람들보다 높다. 전자 담배 사용이 담배 흡연과 같은 위험을 가지는지는 아직 밝혀지지 않았지만, 전자 담배 사용자들은 비흡연자보다 소변 내 일부 발암 물질 수치가 높다.2. 2. 직업적 노출
방광암 환자의 최대 10%는 직업적으로 유해 화학 물질에 노출된 것이 원인이다.[12] 벤지딘, 베타-나프틸아민, 오르토-톨루이딘 등 특정 방향족 아민에 노출되면 금속 작업자, 염료 생산자, 화가, 인쇄공, 미용사, 섬유 작업자의 방광암 위험이 증가할 수 있다. 이들 방향족 아민은 금속 가공 및 염료 산업에서 사용된다.[12] 국제암연구소는 고무 가공, 알루미늄 생산, 소방 활동을 방광암 발생 위험을 증가시키는 직업으로 추가 분류한다.[12] 직업적 노출이나 지하수에 비소가 자연적으로 오염된 지역의 식수 섭취를 통한 비소 노출 또한 일반적으로 방광암 위험과 관련이 있다.[12]2. 3. 만성 방광 감염
만성 방광 감염은 방광암 발생 위험을 증가시킬 수 있다. 가장 두드러진 것은 주혈흡충증으로, 편형동물인 ''혈뇨주혈흡충''의 알이 방광벽에 박혀 만성적인 방광염과 반복적인 방광 감염을 유발할 수 있다. 주혈흡충증이 풍토병으로 존재하는 지역에서는 방광암 환자의 최대 16%가 이전 주혈흡충 감염으로 인해 발생한다. 프라지콴텔 치료를 통해 기생충을 제거할 수 있으며, 이는 주혈흡충증 풍토 지역의 방광암 발생률을 감소시킨다. 마찬가지로, 장기간 유치 도뇨관을 사용하는 사람들은 반복적인 요로 감염 위험이 높고 방광암 발생 위험도 증가한다.2. 4. 의학적 치료
방광암은 방광 세포의 DNA 변화로 인해 세포가 제어 불능적으로 성장하는 질병이다.[12] 이러한 변화는 무작위로 발생하거나, 담배 섭취 등 독성 물질에 노출되어 유발될 수 있다.[11] 유전적 손상은 수년에 걸쳐 축적되어 결국 방광 세포의 정상 기능을 방해하고, 종양이라고 불리는 세포 덩어리로 제어 불능적으로 성장하게 한다.[12] 암세포는 증식함에 따라 추가적인 DNA 변화를 축적하여 종양이 면역 체계를 회피하고, 정상적인 세포 사멸 경로를 억제하며, 결국 신체의 다른 부위로 전이될 수 있다.2. 5. 유전적 요인
방광암은 일반적으로 가족력이 없는 것으로 알려져 있다.[12] 방광암 진단을 받은 환자 중 부모나 형제자매에게 같은 질병이 있는 경우는 4% 정도이다.[12] 다만, 예외적으로 린치 증후군이나 카우덴 증후군이 있는 가족에서는 방광암을 포함한 여러 암 발생 위험이 증가한다.[12]대규모 인구 연구를 통해 방광암 위험을 약간씩 증가시키는 여러 유전자 변이가 확인되었다. 이들 유전자 변이의 대부분은 발암 물질의 대사 (NAT2, GSTM1, UGT1A6)에 관여하거나, 세포 성장을 조절하거나 (TP63, CCNE1, MYC, FGFR3), 또는 DNA 손상을 복구하는 유전자 (NBN, XRCC1, XRCC3, ERCC2, ERCC4, ERCC5)의 변이이다.[12]
9번 염색체 장완 이형접합성 소실, 17번 염색체 단완 이형접합성 소실이 관여하는 유형도 보고되고 있다.
2. 6. 기타 요인
방광암 발병 위험 요인으로는 비위생적인 환경, 화학 물질(특히 방향족 아민)[17], 빌하르트 주혈흡충(편평상피암) 감염[18], 흡연 등이 있습니다.세계암연구기금과 미국암연구소의 2018년 보고서에 따르면, 차, 과일, 채소를 많이 섭취하는 식단은 방광암 발병 위험을 낮출 수 있다는 제한적인 증거가 있습니다.[14] 과체중이나 비만은 방광암 발병 위험을 약간 높일 수 있으며, 고강도 신체 활동은 위험을 약간 낮출 수 있습니다. 체액 섭취와 방광암 위험 간의 관계는 불분명합니다.[14]
9번 염색체 장완 이형접합성 소실, 17번 염색체 단완 이형접합성 소실도 방광암 발생에 관여하는 것으로 알려져 있습니다.
3. 역학
매년 약 50만 명이 방광암 진단을 받고, 20만 명이 사망한다. 이는 방광암을 암 발병률 10위, 암 사망 원인 13위에 해당하게 한다. 방광암은 특정 발암물질에 대한 노출이 가장 높은 세계의 부유한 지역에서 가장 흔하며, 혈관흡충 감염이 흔한 북아프리카 지역에서도 많이 발생한다.
방광암은 여성보다 남성에게 훨씬 더 흔하다. 남성의 약 1.1%, 여성의 0.27%가 방광암에 걸린다. 이는 남성에게는 여섯 번째로 흔한 암, 여성에게는 열일곱 번째로 흔한 암에 해당한다. 여성이 방광암 진단을 받으면 더 진행된 질병을 앓고 있고, 결과적으로 예후가 좋지 않은 경향이 있다. 이러한 결과의 차이는 발암 물질 노출의 차이, 유전학, 사회적 요인 및 의료의 질과 같은 여러 요인에 기인한다.[16]
대부분의 암과 마찬가지로 방광암은 고령자에게서 더 흔하다. 평균적으로 방광암 환자는 73세에 진단받는다. 방광암 진단을 받은 사람의 80%는 65세 이상이고, 20%는 85세 이상이다.
한국의 경우, 방광암 사망자 수는 남성의 경우 악성 종양 사망 원인 중 11위, 여성의 경우 14위이다. 발생률은 남성이 여성의 3배 많다. 70대의 발병률이 높으며, 50세 미만의 청년층 발병은 드물다. 당뇨병 치료제인 피오글리타존을 장기간 사용하는 경우, 다른 당뇨병 치료제와 비교하여 방광암 발생률이 유의미하게 높아진다.[20] 흡연은 방광암 위험을 증가시킨다.[21] 비흡연자의 경우 커피, 카페인 섭취량이 많을수록 위험이 증가한다.[21] 니코틴은 CYP1A2를 유도하므로, CYP1A2에 의한 카페인 대사가 촉진된다.[22]
4. 증상
방광암의 가장 흔한 증상은 통증이 없는 혈뇨이다. 이는 방광암 진단을 받는 사람들의 약 75%에게 나타난다.[1] 일부 환자들은 현미경으로만 확인 가능한 혈뇨를 보이거나, 배뇨 시 통증을 느끼거나, 혹은 아무런 증상이 없을 수도 있다. 증상이 없는 경우에는 다른 검사를 통해 우연히 발견되기도 한다.[1]
드물게 종양이 소변 흐름을 막아 수신증을 유발, 옆구리 통증을 일으킬 수 있다.[1] 방광암은 뼈, 폐, 간, 림프절 등으로 전이될 수 있으며, 전이 부위에 따라 증상이 다르다. 뼈 전이는 뼈 통증이나 골절 위험 증가, 폐 전이는 지속적인 기침, 객혈, 호흡 곤란, 간 전이는 권태감, 식욕 부진, 체중 감소, 복수, 황달, 피부 가려움증을 유발할 수 있다. 림프절 전이는 통증과 부기를 동반할 수 있다.[1]
4. 1. 혈뇨

방광암의 가장 흔한 증상은 통증 없이 소변에 피가 섞여 나오는 혈뇨(haematuria)이다. 방광암 진단을 받는 사람들 중 약 75%에게서 혈뇨가 나타난다.[1] 어떤 사람들은 현미경으로만 확인할 수 있는 소량의 혈뇨("현미경적 혈뇨")를 보이거나, 소변을 볼 때 통증이 있거나, 아무런 증상이 없는 경우도 있다. 증상이 없는 경우에는 다른 이유로 영상의학검사를 하다가 종양이 발견되기도 한다.[1] 혈뇨가 있다고 해서 모두 방광암은 아니다. 눈에 보이는 혈뇨가 있는 사람들 중 최대 22%, 현미경적 혈뇨가 있는 사람들 중 5% 정도가 방광암으로 진단받는다.[1] 혈뇨가 있는 방광암 여성은 요로감염으로 오진되는 경우가 많아 진단과 치료가 늦어지기도 한다.[1]
빈뇨(소변을 자주 보는 것)나 배뇨통(소변을 볼 때 통증) 등이 없는 무증상 육안적 혈뇨, 즉 눈으로 확인 가능한 혈뇨가 유일한 증상인 경우가 많다. 다만, 상피내암(암세포가 상피에만 있는 경우)이나 침윤암(암세포가 상피를 뚫고 다른 조직으로 침범한 경우)에서는 빈뇨나 배뇨통 등이 함께 나타나기도 한다.
4. 2. 배뇨 관련 증상
방광암은 빈뇨나 배뇨통 등을 동반하는 경우도 있다.[1]4. 3. 기타 증상
드물게 종양이 방광으로의 소변 흐름을 막으면 소변이 역류하여 신장이 부풀어 오르는 증상으로 인해 갈비뼈와 엉덩이 사이의 옆구리에 통증이 생길 수 있다.[1] 방광 밖으로 전이된 종양은 전이된 위치에 따라 다른 증상을 유발하는데, 간으로 전이된 암은 전반적인 권태감, 식욕 부진, 체중 감소를 유발할 수 있다.[1]5. 병리학적 분류
방광 종양은 현미경으로 관찰한 외형과 기원 세포의 종류에 따라 분류된다. 방광 종양의 90% 이상은 방광 내벽을 구성하는 세포, 즉 요로상피세포 또는 이행상피세포에서 발생하며, 이 경우 요로상피암 또는 이행세포암으로 분류된다.[3] 사례의 약 5%는 방광 내벽의 드문 세포에서 발생하는 편평세포암이며, 쉬스토소마증이 발생하는 국가에서는 비교적 흔하지 않다.[3] 최대 2%의 경우 점액을 생성하는 선세포에서 발생하는 선암이다.[3] 나머지 사례는 방광 근육에서 발생하는 육종 또는 신경내분비세포에서 발생하는 소세포암이며, 모두 비교적 드물다.[3]
병리학자는 또한 암세포가 건강한 세포와 얼마나 다른지에 따라 종양 샘플의 등급을 매긴다. 방광암은 저등급(건강한 세포와 더 유사함) 또는 고등급(건강한 세포와 유사하지 않음)으로 나뉜다.
6. 병기
방광암은 미국암연구협회(American Joint Committee on Cancer)에서 정의한 TNM 분류에 따라 병기가 결정된다.[4] TNM 분류는 원발 종양의 범위(T), 인접 림프절로의 전이(N), 원격 전이(M)를 기준으로 한다.[4]
- T 병기: 원발 종양의 범위를 나타낸다.
- Tis (CIS 종양): 방광의 가장 안쪽 층에 국한된 종양이다.
- Ta (그 외 모든 경우): 방광의 가장 안쪽 층에 국한된 종양이다.
- T1: 방광의 결합 조직으로 침윤된 종양이다.
- T2: 근육으로 침윤된 종양이다.
- T3: 근육을 뚫고 주변 지방 조직으로 침윤된 종양이다.
- T4: 방광 바깥으로 완전히 침윤된 종양이다.[4]
- N 병기: 인접 림프절로의 전이를 나타낸다.
- N0: 전이가 없다.
- N1: 인접한 단일 림프절로 전이되었다.
- N2: 여러 개의 인접 림프절로 전이되었다.
- N3: 골반 바깥의 더 먼 림프절로 전이되었다.[4]
- M 병기: 더 먼 기관으로의 전이를 나타낸다.
- M0: 전이되지 않은 종양이다.
- M1: 전이된 종양이다.[4]
TNM 점수를 합쳐 0~4단계로 암의 병기를 결정하며, 병기가 높을수록 암이 더 광범위하게 진행되었음을 나타내고 예후가 좋지 않다.
| 병기 | T | N | M | 5년 생존율 |
|---|---|---|---|---|
| 0 | Tis/Ta | N0 | M0 | 96% |
| 1 | T1 | N0 | M0 | 90% |
| 2 | T2 | N0 | M0 | 70% |
| 3 | T3 | N0 | M0 | 50% |
| 3 | 모든 T | N1-3 | M0 | 36% |
| 4 | 모든 T | 모든 N | M1 | 5% |
방광암 진단이 확정되면 치료 방침을 결정하기 위해 병기를 진단해야 한다. 병기 분류는 UICC/AJCC의 TNM 분류에 따라 결정된다.
방광암 TNM 분류 (TNM 악성종양 분류 제7판 2009)[24]
| 구분 | 내용 |
|---|---|
| 원발 종양의 벽내 진행도 | |
| 속한 림프절 전이 | |
| 원격 전이 |
TNM 분류는 2016년에 제8판으로 개정되었고, 2018년에 추가 업데이트가 이루어졌다. 주요 변경 사항은 다음과 같다.[25]
- T1 하위 분류 권고.
- 憩室(게실)암에서 T2 폐지.
- 전립선 간질 침윤은 방광벽을 통한 침윤을 T4로 하고, 상피하 간질을 통한 침윤을 T2로 한다.
- M1이 M1a (영역 외 원격 림프절 전이)와 M1b (다른 장기 전이)로 세분화.
- Stage III을 림프절 전이 상황에 따라 IIIA와 IIIB로 세분화.
- Stage IV을 M1a 및 M1b 세분화에 따라 IVA 및 IVB로 세분화.
Ta부터 T1까지를 근층 비침윤성 방광암 (NMIBC, non-muscle-invasive bladder cancer), T2 이상을 근층 침윤성 방광암 (MIBC, muscle-invasive bladder cancer)이라고 한다. T1은 NMIBC이지만, invasive urothelial carcinoma (침윤성 요로상피암)이다.
7. 진단
방광암 진단에는 신체 검사, 요검사 및 요세포 검사, 방광경 검사, 영상 검사, 경요도 방광 종양 절제술(TURBT) 등이 활용된다.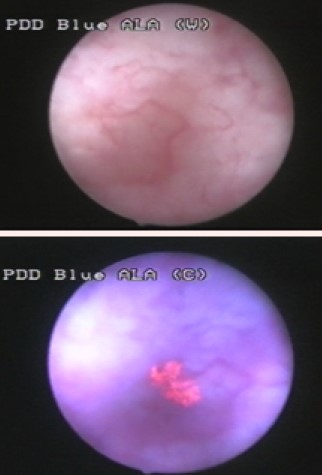
7. 1. 신체 검사
방광암이 의심되는 경우, 종양 유무와 범위를 평가하기 위해 여러 검사를 받을 수 있다. 먼저, 직장수지검사 및 골반검사를 포함한 신체 검사를 통해 의사가 골반 부위를 만져보며 종양일 수 있는 비정상적인 종괴를 찾는다.[2]심각한 방광 종양은 종종 세포를 소변으로 배출하는데, 이는 소변 샘플에서 세포를 채취하여 현미경으로 관찰하는 소변 세포 검사를 통해 검출할 수 있다.[2] 세포 검사는 약 3분의 2의 고등급 종양을 검출할 수 있지만, 저등급 종양의 경우 8개 중 1개만 검출한다.
7. 2. 요검사 및 요세포 검사
방광암이 의심되는 경우, 종양 유무와 범위를 평가하기 위해 여러 검사를 받을 수 있다. 많은 환자들이 직장수지검사 및 골반검사를 포함한 신체 검사를 받는데, 의사는 골반 부위를 만져보며 종양일 가능성이 있는 비정상적인 덩어리를 찾는다.[2]심각한 방광 종양은 종종 세포를 소변으로 배출하는데, 이는 소변 샘플에서 세포를 채취하여 현미경으로 관찰하는 소변 세포 검사를 통해 검출할 수 있다.[2] 세포 검사는 고등급 종양의 약 2/3를 검출할 수 있지만, 저등급 종양의 경우 8개 중 1개만 검출한다. 방광암과 관련된 분자를 검출하기 위해 추가적인 소변 검사를 할 수 있다. 일부 검사는 방광암 환자의 소변에서 수치가 높아지는 경향이 있는 방광종양항원(BTA) 단백질 또는 NMP22를 검출하고, 다른 검사는 종양 관련 유전자의 mRNA를 검출하며, 또 다른 검사는 형광 현미경을 사용하여 암세포를 검출하는데, 이는 일반 현미경보다 민감도가 더 높다.
7. 3. 방광경 검사
방광암이 의심되는 경우, 종양 유무와 범위를 평가하기 위해 여러 검사를 받을 수 있다. 많은 환자들이 방광경 검사를 받는데, 이는 유연한 카메라를 요도를 통해 방광으로 삽입하여 암 조직을 시각적으로 검사하는 것이다.[2] 방광경 검사는 유두종양(방광에 소변이 저장되는 부분으로 자라는 손가락 모양의 종양)을 검출하는 데 가장 효율적이며, 작고 낮게 위치한 상피내암(CIS)에는 효율이 낮다.청색광 방광경 검사는 암세포에 축적되는 염료(헥사민올레불리네이트)를 방광경 검사 중 방광에 주입하여 CIS 검출을 개선한다. 염료는 방광경에서 청색광을 비추면 형광을 발하여 작은 종양을 더 정확하게 검출할 수 있다.[2]
7. 4. 영상 검사
방광암이 의심되는 경우, 종양 유무와 범위를 평가하기 위해 여러 영상 검사를 받을 수 있다. 소변에 피가 섞여 나올 수 있는 상부 요로(요관 및 신장) 종양은 영상 촬영을 한다. 일반적으로 신장이 요로로 걸러내는 혈액에 염료를 주입한 다음 CT 스캔으로 영상을 촬영한다.[2] 신장 기능이 염료를 걸러낼 만큼 충분하지 않은 경우, MRI로 스캔할 수 있다.[2] 또는 초음파로 상부 요로를 영상 촬영할 수도 있다.[2]7. 5. 경요도 방광 종양 절제술 (TURBT)
방광암이 의심되는 경우, 경요도 방광 종양 절제술(TURBT)을 통해 요도로 기구를 삽입하여 의심되는 종양을 제거한다. 이때 모든 종양과 기저부 방광 근육 조직도 함께 제거한다. 제거된 조직은 병리학자가 암 여부를 확인하기 위해 검사한다.[2] 종양이 불완전하게 제거되었거나 고위험군으로 판단되는 경우, 4~6주 후에 TURBT를 반복하여 추가 종양을 검출하고 제거한다.8. 치료
방광암 치료는 종양의 형태, 크기, 위치뿐만 아니라 환자의 건강 상태와 선호도에 따라 달라진다.
- '''경요도적 방광종양절제술(TURBT)'''
- * 방광암의 약 70%를 차지하는 근층 비침윤성 방광암 치료에 중요한 역할을 하며, 근층 침윤성 방광암에 대한 진단 목적으로도 시행된다.
- * 방광경을 이용한 관찰과 더불어, 보조 진단 기술로 형광 방광경을 이용한 PDD(photodynamic diagnosis)나 NBI(narrow band imaging)와 같은 방법이 개발되었다.
- ** PDD: 형광 전구 물질인 5-ALA(알라그리오)를 사용하여 종양세포를 관찰한다.
- ** NBI: 혈중 헤모글로빈에 흡수되기 쉬운 빛을 조사하여 병변을 검출한다.
- '''방광내 주입 요법'''
- * 경요도적 방광종양절제술(TURBT) 후 재발 및 진행 위험을 낮추기 위해, 항암제나 BCG 주입을 고려한다.
- '''방광 전적출술'''
- * 초고위험군(Highest risk) NMIBC 및 근침윤성 방광암(MIBC)의 경우 고려된다.
- * 표준 수술법은 남성의 경우 방광, 전립선, 정낭, 원위 요관을 적출하고, 골반 림프절 박리술을 시행한다. 여성의 경우에는 방광, 자궁, 질벽, 원위 요관, 요도를 적출하고 골반 림프절 박리술을 시행한다.
- * 복강경이나 로봇을 이용한 방광 전적출술은 개복 수술보다 덜 침습적이며, 항암 효과는 비슷한 것으로 보고되었다.
- * 방광 전적출술 후에는 요로 전환술을 시행하며, 환자의 건강 상태, 가정 환경, 사회적 배경 등을 고려하여 환자와 의료진이 충분히 상의하여 결정한다.
- ** '''요관 피부루 누공술''': 장관을 이용한 요로 전환이 어려운 환자에게 적합하다.
- ** '''회장 도관 조설술''': 방광 전적출술이 가능한 모든 환자에게 적용 가능하다.
- ** '''신방광 조설술''': 특정 조건을 만족하는 환자에게 시행 가능하다.
- '''근층 침윤성 방광암에 대한 방광 온존 요법'''
- * 경요도적 방광종양절제술(TURBT), 시스플라틴을 중심으로 한 화학 요법, 방사선 요법을 병행하는 치료를 통해 방광을 보존하는 치료법이다.
- * 방광 전적출술과 비교했을 때 5년 생존율에 큰 차이가 없는 것으로 나타났다.[29]
- '''전신 약물 요법'''
- * 1차 치료 (시스플라틴 적격 환자): 메토트렉세이트+빈블라스틴+독소루비신+시스플라틴(M-VAC) 요법, 젬시타빈+시스플라틴(GC) 요법, Dose-dense M-VAC 요법 등이 사용된다.
- * 1차 치료 (시스플라틴 부적격 환자): 젬시타빈+카보플라틴 요법, 젬시타빈 요법, 젬시타빈+파클리탁셀 요법 등이 사용된다.
- * 2차 치료: 펨브롤리주맙이 표준 치료로 사용된다.
- * 전이가 없는 근층 침윤성 방광암에 대한 수술 전/수술 후 화학 요법: 시스플라틴 기반의 수술 전 화학 요법(네오아쥬반트 요법)은 생존 기간을 늘리는 효과가 있다.[30][31][32]
8. 1. 비근육침윤성 방광암 (NMIBC) 치료
비근육침윤성 방광암(NMIBC)은 주로 경요도 방광 종양 절제술(TURBT)을 통해 모든 종양을 수술적으로 제거하는 방식으로 치료하며, 이는 진단을 위한 생검 조직 채취에 사용되는 절차와 동일하다.[26] 종양 재발 위험이 비교적 낮은 환자의 경우, 단일 방광 내 항암화학요법 주입(미토마이신 C, 에피루비신, 또는 젬시타빈)을 통해 종양 재발 위험을 약 40% 감소시킬 수 있다. 위험이 높은 환자는 대신 BCG 백신(생균 백신으로, 전통적으로 결핵 치료에 사용됨)을 방광 내 주입하는 방식으로 치료받는데, 6주 동안 매주 주입한다. 이는 종양 재발률을 거의 절반으로 줄인다. 최소 1년 동안 정기적으로 실시하는 일련의 "유지" BCG 주입을 통해 재발 위험을 더욱 줄일 수 있다. BCG에 반응하지 않는 종양은 나도파라젠 피라데노벡(유전자 치료의 일종), 노가펜데킨 알파 인바키셉트(면역자극제 단백질의 조합), 또는 펨브롤리주맙(면역관문억제제)과 같은 대체 면역 자극제로 치료할 수 있다.[5]
종양이 계속 자라는 환자는 종종 방광 및 주변 장기를 제거하는 수술인 근치적 방광 절제술을 받는다. 방광, 여러 개의 인접한 림프절, 하부 요관, 그리고 근처 내부 생식기관 – 남성의 경우 전립선과 정낭, 여성의 경우 자궁과 일부 질벽 – 이 모두 제거된다. 외과의는 소변이 배출될 새로운 경로를 만든다. 가장 일반적인 방법은 회장루로, 이는 회장(소장의 일부)의 일부를 제거하여 요관에서 복부의 새로운 수술 개구부(루)로 소변을 운반하는 데 사용하는 것이다. 소변은 신체 외부에 착용하는 루 가방으로 배출되어 착용자가 정기적으로 비울 수 있다.[6] 또는 대변 저장 루를 사용할 수 있는데, 이는 요관이 소장과 대장 사이의 판막을 포함하는 회장 조각에 연결되는 방식이다. 이 판막은 자연스럽게 닫혀 소변을 루 가방이 아닌 신체에 보유할 수 있도록 한다. 환자는 자가 도뇨 – 좁은 관을 루를 통해 통과시키는 것 – 를 통해 하루에 여러 번 새로운 소변 저장소를 비운다.[7] 일부 환자는 회장 조각을 요도에 직접 부착하여 수술 전과 같이 요도를 통해 소변을 볼 수 있지만, 원래 방광 신경이 없으므로 소변 저장소가 가득 차도 소변을 보려는 욕구를 느끼지 못한다.[8]
근치적 방광 절제술은 즉각적인 부작용과 평생 지속되는 부작용을 모두 가지고 있다. 수술에서 회복 중인 사람들은 위장 문제(근치적 방광 절제술을 받은 사람의 29%), 감염(25%), 그리고 다른 수술 상처 관련 문제(15%)를 경험하는 것이 일반적이다. 수술을 받은 사람 중 약 25%가 30일 이내에 병원에 재입원하며, 최대 2%가 수술 후 30일 이내에 사망한다. 요관 경로 변경은 또한 영구적인 대사 문제를 일으킬 수 있다. 소변 흐름을 재경로하는 데 사용되는 회장 조각은 원래 방광보다 소변에서 더 많은 이온을 흡수하여 대사성 산증(혈액이 너무 산성화됨)을 유발할 수 있으며, 이는 중탄산나트륨으로 치료할 수 있다. 소장이 짧아지면 비타민 B12 흡수가 감소될 수 있으며, 이는 경구 비타민 B12 보충제로 치료할 수 있다. 새로운 요로계의 문제는 요정체를 유발하여 요관과 신장에 손상을 줄 수 있으며 요로 감염 위험을 증가시킨다.
근치적 방광 절제술을 받기에 건강 상태가 좋지 않거나 원하지 않는 사람들은 대신 미토마이신 C, 젬시타빈, 독세탁셀, 또는 발루비신과 같은 추가적인 방광 내 항암화학요법 주입 또는 펨브롤리주맙의 정맥 주사로부터 이점을 얻을 수 있다. NMIBC 환자 중 약 5명 중 1명은 결국 MIBC로 진행된다.
- 경요도적 방광종양절제술(TURBT)
- 방광암의 약 70%를 차지하는 근층 비침윤성 방광암 치료의 핵심적인 역할을 한다.
- 일반적으로 루프형 전극을 사용하여 종양을 조각조각 절제하지만, 최근에는 소화기암에 대한 내시경적 점막하층 박리술(ESD)처럼 종양을 한 덩어리로 절제하는 방법이 시행되기도 한다.
- TURBT로 얻은 병리 조직 진단을 바탕으로 재발·진전 위험도를 평가하고 추가 치료를 고려한다.
- 1차 TURBT에서 T1 종양이 확인된 경우에는, 다시 TUR 흉터 부위 주변과 심부를 절제하는 2차 TUR을 시행하여 잔존 종양 유무를 확인해야 한다.
- TURBT는 근층 채취가 필수이지만, 1차 TURBT에서 근층이 채취되지 않았을 경우에는, 다시 근층 침윤 확인을 위해 TUR을 시행한다(좁은 의미로는 restaging TUR이라고 부르지만, 넓은 의미로는 2차 TUR에 포함한다).
- TURBT 시 방광경을 이용한 주의 깊은 관찰은 필수이지만, 기존의 백색광 하 관찰(WLI)에서는 미세한 종양이나 CIS 등의 편평형 종양, 그리고 돌출형 종양에 수반되는 편평 병변의 확산을 확인하기 어렵다.
- TURBT 시 보조 진단 기술로 형광 방광경을 이용한 PDD(photodynamic diagnosis)나 NBI(narrow band imaging)와 같은 방법이 개발되었다.
- PDD는 형광 전구 물질인 5-ALA(알라그리오)를 TURBT 수술 전에 투여한 후, 종양 세포에 선택적으로 축적되는 프로토포르피린 IX를 형광 방광경을 이용하여 관찰하고, 적색 형광을 나타내는 병변을 검출하는 것으로, 검출 감도, 특히 CIS의 검출률 향상이 보고되었다.
- NBI는 혈중 헤모글로빈에 흡수되기 쉬운 415nm(청색)과 540nm(녹색)의 두 종류 파장의 빛을 조사함으로써, 혈관에 의한 미세 무늬나 색조에 따라 암 점막과 정상 점막의 차이를 강조하여 병변을 검출하는 것이다. 백색 광원과 비교하여 암 검출 감도가 높다는 것이 보고되었다.
- 방광내 주입 요법
- TURBT 후 재발·진전 위험을 낮추기 위해, 항암제나 BCG의 방광내 주입 요법이 위험 분류에 따라 권고되고 있다.
- 항암제 방광내 주입 요법에는, TURBT 수술 후 항암제 수술 후 단회 주입과, 항암제 수술 후 단회 주입을 실시한 후에 다회 주입하는 항암제 유지 주입 요법이 있다.
- 저위험군: 항암제(마이토마이신 C, 에피루비신, 피랄루비신 등) 즉시 단회 주입을 하는 것이 권고된다. 일반적으로 TUR 후 24시간 이내에 실시된다.
- 중위험군: 항암제(마이토마이신 C, 에피루비신, 피랄루비신 등) 유지 요법을 추가하는 것이 권고된다. 치료 스케줄에 대해서는 정해진 것이 없지만, 피랄루비신의 수술 후 단회 주입 요법에 8회의 유지 요법을 추가하는 치료의 유용성이 일본에서 발표되었다.[27]
- 고위험군: BCG 도입 요법(주 1회, 6회~8회)에 더하여 유지 요법을 하는 것이 재발 예방 효과의 관점에서 권고된다.
- BCG 유지 요법은 완료율의 저하, 부작용 문제로 구체적인 투여 스케줄은 정해져 있지 않지만, SWOG8507 시험[28]의 3, 6, 12, 18, 24, 30, 36개월에 3주간 주입하는 프로토콜이 유명하다.
- 일반적인 양의 BCG 방광내 주입 요법의 부작용이 문제가 되는 환자, 신체 위험이 높은 환자, 중위험군에 대해서는, 저용량 BCG 방광내 주입 요법이 선택지 중 하나로 권고된다.
- 방광 전적출술
- 【적응증】
- Stage Ⅰ NMIBC: 초고위험(Highest risk)군에 대해서는, 즉시 방광 전적출술을 고려하는 것이 권고된다.
- 【표준 수술법】
- 남성의 경우, 방광, 전립선, 정낭, 원위 요관을 적출하고, 골반 림프절 박리술을 시행한다. 신방광 조설을 고려하지 않는 방광 전적출술의 경우, 요도 적출을 고려하는 것이 권고된다.
- 여성의 경우에는, 방광, 자궁, 질벽, 원위 요관, 요도를 적출하고 골반 림프절 박리술을 시행하는 것이 표준 수술법으로 여겨진다.
- 【신경 보존 방광 전적출술】
- 신경 보존 방광 전적출술에 의해 자가 배뇨형 신방광의 요실금이나 성 기능이 양호하게 확보된다는 보고도 있다.
- 현재로서는, 신경 보존 수술의 적응 기준은 없고, 선택된 증례에 대해 시행하는 것이 권고된다.
- 【복강경하/로봇 지원 복강경하 방광 전적출술】
- 복강경하/로봇 지원 복강경하 방광 전적출술은 개복 방광 전적출술보다 덜 침습적이며, 동등한 항암 효과가 보고되어 고려하는 것이 권고된다.
- 【부인과 장기 보존 수술】
- 여성의 방광 전적출술은 원칙적으로 방광·자궁·질 전벽을 한 덩어리로 적출하는 것이 권고되어 왔지만, 여성 생식기를 보존해도 예후에 영향을 미치지 않는다는 보고도 있다.
- 부인과 장기 보존 수술은 표준 치료 외라는 것을 승낙한 위에서, 심달도 T2 이하의 국한암으로, 방광 경부나 요도에 종양을 확인하지 못하고, 부인과 장기 보존을 희망하는 증례에 대해서는 고려해도 좋다고 여겨진다.
- 【요로 재건】
- 현재, 국내에서 실시되고 있는 주요 요로 전환술은, 요관 피부루 누공 조설술, 회장 도관 조설술, 신방광 조설술 등이다.
- 방광 전적출술 후 요로 전환술의 선택에 있어서는, 환자의 의학적 요소, 가정 및 사회적 배경을 고려하면서, 환자와 그 가족, 의료 스태프와 충분한 의견 교환을 하고 결정해 나가는 것이 중요하다.
- '''요관 피부루 누공술'''
- 요관 피부루 누공술은, 단시간에 시행할 수 있고, 간편하다는 점에서, 장관 이용 요로 전환이 위험을 수반하는 환자나 합병증을 가진 환자에게 적응이 된다.
- '''회장 도관 조설술'''
- 회장 도관 조설술의 적응 범위는 넓고, 방광 전적출술이 가능한 모든 환자에게 적응이 있다.
- '''신방광 조설술'''
- 전부 요도에 종양성 병변을 가지고 있는 경우나 문합하는 요도 단편에 종양이 존재하는 경우는 요도 적출이 필요하며, 자가 배뇨형 신방광 조설술의 적응이 되지 않는다. 또한 복압성 요실금, 신기능 저하(혈청 크레아티닌 1.5 mg/dL 이상), 크론병 등의 소화기 질환, 남성의 전립선 부위 요도의 암, 여성의 방광 경부의 암은 적응 외로 여겨진다.
8. 2. 근육침윤성 방광암 (MIBC) 치료
근육침윤성 방광암(MIBC)은 종양이 방광 근육층까지 침범한 상태를 의미하며, 비근육침윤성 방광암(NMIBC)에 비해 더 공격적인 치료가 필요하다.근치적 방광 절제술근치적 방광 절제술은 방광 전체와 주변 림프절, 그리고 인접 장기를 제거하는 수술이다.[6] 남성의 경우 전립선과 정낭, 여성의 경우 자궁, 질 일부, 요도 등을 함께 제거한다.[6] 수술 후에는 소변을 배출하기 위한 새로운 경로를 만들어야 한다. 가장 일반적인 방법은 회장(소장의 일부)을 이용하여 요관에서 복부의 새로운 구멍(루)으로 소변을 운반하는 회장루 요관전환술이다.[6] 소변은 몸 밖에 부착하는 루 가방에 모이게 되며, 주기적으로 비워야 한다.[6] 다른 방법으로는 대변 저장 루를 만들 수 있는데, 이는 요관을 소장과 대장 사이의 판막에 연결하는 방식이다.[7] 이 판막은 자연스럽게 닫혀 소변을 몸 안에 저장할 수 있게 해주며, 환자는 자가 도뇨를 통해 하루에 여러 번 소변을 배출한다.[7] 일부 환자는 회장 조각을 요도에 직접 연결하여 이전처럼 요도를 통해 소변을 볼 수 있지만, 방광 신경이 없어 소변이 가득 차도 요의를 느끼지 못한다.[8]
근치적 방광 절제술은 합병증 위험이 따르는 큰 수술이다. 수술 후 회복 과정에서 위장 문제, 감염, 상처 관련 문제 등이 발생할 수 있다.[6] 또한, 요로 변경으로 인해 대사 문제, 비타민 B12 흡수 감소, 요로 감염 위험 증가 등이 발생할 수 있다.[6]
항암 화학 요법근육침윤성 방광암 환자는 수술 전 또는 후에 항암 화학 요법을 받을 수 있다. 수술 전 항암 화학 요법(신보조요법)은 시스플라틴을 포함한 약물 조합(젬시타빈+시스플라틴; 또는 메토트렉세이트, 빈블라스틴, 독소루비신, 시스플라틴)으로 시행되며, 생존율을 향상시키는 데 도움이 된다.[30][31][32]
방사선 치료방사선 치료는 고에너지 방사선을 사용하여 암세포를 파괴하는 치료법이다. 방광암 치료에서는 단독으로 사용되기보다는 항암 화학 요법과 함께 사용되는 경우가 많다.
방광 보존 요법특정 저위험군 환자의 경우, 방광 전체를 제거하지 않고 종양 부위만 제거하는 부분적 방광 절제술을 시행할 수 있다.[9] 또는 경요도 방광 종양 절제술(TURBT)로 종양을 제거한 후 항암 화학 요법과 방사선 치료를 병행하는 방광 보존 요법을 시행할 수 있다.[9] 이러한 치료 후에는 정기적인 추적 검사를 통해 재발 여부를 확인해야 한다.[9]
전신 약물 요법
- 1차 치료 (시스플라틴 적격 환자)
- M-VAC (메토트렉세이트+빈블라스틴+독소루비신+시스플라틴) 요법
- GC (젬시타빈+시스플라틴) 요법: M-VAC 요법보다 부작용이 적어 현재 더 많이 선택된다.
- Dose-dense M-VAC 요법: M-VAC 요법에서 시스플라틴 강도를 높인 요법으로, 장기 생존율 향상이 보고되었다.
- 1차 치료 (시스플라틴 부적격 환자)
- 젬시타빈+카보플라틴 요법
- 젬시타빈 요법
- 젬시타빈+파클리탁셀 요법
- 2차 치료
- 펨브롤리주맙: 면역관문억제제로, 1차 치료 후 진행된 경우 표준 치료로 사용된다.
경요도적 방광 종양 절제술(TURBT)경요도 방광 종양 절제술(TURBT)은 내시경을 통해 방광 내 종양을 제거하는 수술이다. 근육침윤성 방광암의 진단 목적으로도 시행된다.
8. 3. 전이성 방광암 치료
전이성 방광암의 표준 치료는 항암제 시스플라틴과 젬시타빈 병용 요법이다.[10] 이 병용 요법을 받는 환자의 평균 생존 기간은 약 1년이지만, 15%는 완화를 경험하며 5년 이상 생존한다.[10] 전이성 방광암 환자 중 약 절반은 건강 상태가 좋지 않아 시스플라틴을 투여받을 수 없다. 이러한 환자들은 대신 관련 약물인 카보플라틴과 젬시타빈을 투여받는데, 이 요법을 받는 환자의 평균 생존 기간은 약 9개월이다.[10]항암 화학요법에 반응하는 환자는 장기적인 유지 요법을 위해 펨브롤리주맙 또는 아테졸리주맙(Tecentriq)과 같은 면역관문억제제로 전환하는 것이 좋다.[10] 면역관문억제제는 또한 종양이 항암 화학요법에 반응하지 않는 환자와 항암 화학요법을 받기에 건강 상태가 좋지 않은 환자에게도 일반적으로 투여된다.[10]
백금 기반 항암 화학요법과 면역관문억제제 치료 후에도 종양이 계속 자라는 경우 항체 약물 접합체인 엔포르투맙 베도틴(Padcev, 단백질 넥틴-4를 가진 종양 세포를 표적으로 함)을 투여받을 수 있다.[10] 엔포르투맙 베도틴과 펨브롤리주맙 병용 요법은 항암 화학요법 대신 1차 치료로도 사용할 수 있다.[10] 단백질 FGFR2 또는 FGFR3을 활성화하는 유전적 변이가 있는 환자(전이성 방광암 환자의 약 20%)는 FGFR 억제제인 에르다피티닙(Balversa)으로부터도 이점을 얻을 수 있다.[10]
계속 성장하는 방광암은 2차 항암 화학요법으로 치료할 수 있다. 유럽에서는 빈플루닌이 사용되고, 미국에서는 파클리탁셀, 도세탁셀, 페메트렉세드가 사용된다. 이러한 치료법으로 호전되는 환자는 소수에 불과하다.[10]
9. 예후
방광암의 예후는 진단 당시 암의 확산 정도에 따라 달라진다. 종양이 방광의 가장 안쪽 층에 국한된 경우(0기) 진단 후 5년 생존율은 96%이다.[1] 종양이 인근 림프절로 전이된 경우(3기)에는 예후가 더 나빠지며, 진단 후 5년 이상 생존하는 비율은 36%이다. 전이성 방광암(4기)의 경우 예후가 가장 심각하며, 진단 후 5년 생존율은 5%이다.[1]
비근육침윤성 방광암(NMIBC)과 근육침윤성 방광암(MIBC)은 같은 조직에서 발생하지만, 서로 다른 경로를 따라 발달하고 서로 다른 유전자 돌연변이를 나타낸다. 대부분의 NMIBC 종양은 저등급 유두형(손가락 모양으로 방광으로 돌출되는) 종양으로 시작한다. 세포 성장 경로의 돌연변이는 흔하며, 가장 빈번하게 FGFR3의 활성화 돌연변이(NMIBC 종양의 최대 80%에서)가 나타난다. PI3K/AKT/mTOR 경로 성장 경로를 활성화하는 돌연변이도 흔하며, PIK3CA의 활성화 돌연변이(약 30%의 종양)와 ERBB2/ERBB3(최대 15%의 종양), 그리고 TSC1의 손실(50%의 종양) 등이 포함된다. 크로마틴(다른 유전자의 발현에 영향을 미침)의 주요 조절인자는 65% 이상의 NMIBC 종양에서 비활성화된다.
MIBC는 종종 저위치, 평평하고 고등급의 종양으로 시작하여 빠르게 방광 너머로 전이된다. 이러한 종양은 전반적으로 더 많은 유전자 돌연변이와 염색체 이상을 가지고 있으며, 폐암과 흑색종을 제외한 어떤 암보다도 돌연변이가 더 빈번하다. 종양억제유전자 TP53과 RB을 비활성화하는 돌연변이가 흔하며, 전이에 관여하는 CDH1과 세포 성장 및 전이에 관여하는 VEGFR2의 돌연변이도 흔하다.
일부 유전적 이상은 NMIBC와 MIBC 종양에 공통적이다. 각각의 약 절반은 여러 종양억제유전자 조절인자를 포함하는 9번 염색체의 전부 또는 일부를 상실했다. 최대 80%의 종양은 세포의 텔로미어를 연장하여 확장된 복제를 허용하는 유전자 TERT에 돌연변이를 가지고 있다.
10. 예방
여러 연구에서 생활 습관 요인이 방광암 발병 위험에 미치는 영향을 조사했다. 세계암연구기금(World Cancer Research Fund)과 미국암연구소(American Institute for Cancer Research)의 2018년 증거 요약에 따르면 차 섭취와 과일 및 채소 섭취가 많은 식단이 방광암 발병 위험을 줄인다는 "제한적이나 시사하는 증거"가 있다고 결론지었다.[14] 또한 운동, 체지방, 유제품, 적색육, 생선, 곡물, 콩류, 계란, 지방, 청량음료, 알코올, 주스, 카페인, 감미료 및 다양한 비타민과 미네랄 섭취에 대한 이용 가능한 데이터를 검토했는데, 각 요인에 대해 생활 습관 요인과 방광암 위험을 연결할 수 있는 충분한 데이터가 없다는 것을 발견했다.[14] 다른 여러 연구에서는 과체중이거나 비만인 사람의 방광암 발병 위험이 약간 증가하고, 고강도 신체 활동을 하는 사람의 위험이 약간 감소한다는 것을 보여주었다.[14] 여러 연구에서 체액 섭취량과 방광암 위험 간의 연관성을 조사했다. 고체액 섭취가 소변의 독소를 희석시키고 더 잦은 배뇨를 통해 신체에서 독소를 제거한다는 이론을 검증했지만, 결과가 일관되지 않았으며, 관계는 불분명하다.[14]
11. 관련 인물
- 류소민(柳宗民)
- 야마자키타카아키(山崎孝明)
- 주은래(周恩来): 1972년 방광암이 발견된 후에도 정치의 격무를 계속했다.[1]
- 최양일(崔洋一)[2]
- 쿠로사와토시오(黒沢年雄): 대장암, 방광암, 식도암, 위암을 극복했다.[3]
- 마츠다유사쿠(松田優作): 영화 촬영 중에 암 선고를 받고 치료를 거부했다.[4]
- 무라야마히지리(村山聖)[5]
- 스가와라겐타(菅原文太): 방광 보존 요법을 선택했다.[6]
- 타케하라신지(竹原慎二): "5년 생존율은 40%"에서 생환했다.[7]
- 타케미츠토루(武満徹)[8]
- 야마모토코지(山本浩二): 2019년 방광암과 폐암 수술 후 생환했다.[9]
- 레오나르도쿠마(レオナルド熊): 말기암 발견 후 "암을 축하하는 모임"을 열었다.[10]
- 오구라토모아키(小倉智昭)[11]
- 노로다요시나리(野呂田芳成)[12]
12. 수의학
방광암은 반려견과 반려묘에서 비교적 드물게 발생하는 질병이다. 개의 경우, 진단된 암 중 약 1%가 방광암이다.[1] 셰틀랜드 쉽독, 비글, 그리고 여러 테리어 종은 다른 품종에 비해 위험도가 높다. 방광 종양의 징후 (혈뇨, 빈뇨, 배뇨곤란)는 다른 개의 비뇨기 질환과 공통적이므로 진단이 종종 지연된다.[1] 소변 검사는 진단에 도움이 될 수 있으며, 방광 종양 항원(방광 종양에서 높게 나타나는 단백질) 또는 BRAF 유전자의 돌연변이(방광암 또는 전립선암 개의 약 80%에서 발견됨)를 검사한다.[1]
암이 확인된 개는 피록시캄, 데라콕시브, 멜록시캄과 같은 COX-2 억제제 (Cyclooxygenase-2 inhibitor) 약물로 치료받는다. 이러한 약물은 개의 약 50%에서 질병 진행을 멈추게 하고, 약 12%에서 종양을 축소시키며, 약 6%에서 종양을 제거한다.[2] COX-2 억제제는 종종 미톡산트론, 빈블라스틴, 또는 클로람부실과 같은 항암 화학요법 약물과 병용된다.[1]
고양이의 경우 방광암은 개보다 훨씬 흔하지 않으며, 치료는 개의 방광암 치료와 유사하게 화학요법과 COX-2 억제제를 일반적으로 사용한다.[3][4]
참조
[1]
웹사이트
Symptoms of Metastatic Bladder Cancer
https://www.cancerre[...]
Cancer Research UK
2024-11-11
[2]
웹사이트
Tests for Bladder Cancer
https://www.cancer.o[...]
American Cancer Society
2024-08-08
[3]
웹사이트
Types of Bladder Cancer
https://www.cancerre[...]
Cancer Research UK
2024-08-26
[4]
웹사이트
Stages of Bladder Cancer
https://www.cancerre[...]
Cancer Research UK
2024-08-29
[5]
웹사이트
Treatment of Bladder Cancer, Based on Stage and Other Factors
https://www.cancer.o[...]
American Cancer Society
2024-05-01
[6]
웹사이트
Surgery to Remove the Bladder (Cystectomy)
https://www.cancerre[...]
Cancer Research UK
2024-09-16
[7]
웹사이트
Continent Urinary Diversion (Internal Pouch)
https://www.cancerre[...]
Cancer Research UK
2024-09-17
[8]
웹사이트
Bladder Reconstruction (Neobladder)
https://www.cancerre[...]
Cancer Reseaerch UK
2024-09-17
[9]
웹사이트
Living as a Bladder Cancer Survivor
https://www.cancer.o[...]
American Cancer Society
2024-11-15
[10]
웹사이트
Gilead Pulls Trodelvy's Approval in Bladder Cancer after Trial Flop, FDA Discussions
https://www.fierceph[...]
Fierce Pharma
2024-11-15
[11]
웹사이트
How Does Cancer Start
https://www.cancerre[...]
Cancer Research UK
2024-10-24
[12]
웹사이트
What Causes Bladder Cancer?
https://www.cancer.o[...]
American Cancer Society
2024-07-02
[13]
웹사이트
Causes – Bladder Cancer
https://www.nhs.uk/c[...]
National Health Service
2024-10-16
[14]
웹사이트
Diet, Nutrition, Physical Activity and Bladder Cancer
https://www.aicr.org[...]
World Cancer Research Fund, American Institute for Cancer Research
2024-10-17
[15]
웹사이트
WHO Disease and injury country estimates
https://www.who.int/[...]
World Health Organization
2009-11-11
[16]
논문
Female with bladder cancer: what and why is there a difference?
2016-10
[17]
논문
P-031 膀胱発がん物質N-ブチル-N-(4-ヒドロキシブチル,安全・安心のための知的ネットワークの構築:分子生物学的からレギュラトリーサイエンスまで)ニトロソアミン投与によるラットDNA損傷の系統差・性差(ポスターセッション,安全・安心のための知的ネットワークの構築:分子生物学的からレギュラトリーサイエンスまで)
https://dl.ndl.go.jp[...]
日本環境変異原学会
[18]
논문
血尿を初発症状として発症したビルハルツ住血吸虫症の1例
https://hdl.handle.n[...]
泌尿器科紀要刊行会
2006-04
[19]
웹사이트
WHO Disease and injury country estimates
http://www.who.int/h[...]
World Health Organization
2009-11-11
[20]
논문
Pioglitazone use and risk of bladder cancer: population based cohort study.
http://www.bmj.com/c[...]
2016-03-30
[21]
웹사이트
喫煙、コーヒー、緑茶、カフェイン摂取と膀胱がん発生率との関係について
http://epi.ncc.go.jp[...]
国立研究開発法人 国立がん研究センター 社会と健康研究センター 予防研究グループ
2016-07-13
[22]
논문
2. 臨床におけるCYP研究とその意義
2003
[23]
서적
やさしい腫瘍学
南江堂
[24]
간행물
腎盂・尿管・膀胱癌取扱い規約
2011-04
[25]
논문
Updates in the eighth edition of the tumor-node-metastasis staging classification for urologic cancers
https://doi.org/10.1[...]
Elsevier
[26]
웹사이트
膀胱癌診療ガイドライン2019年版
https://minds.jcqhc.[...]
[27]
논문
Randomized study of intravesical pirarubicin chemotherapy with low and intermediate-risk nonmuscle-invasive bladder cancer in Japan: comparison of a single immediate postoperative intravesical instillation with short-term adjuvant intravesical instillations after transurethral resection
https://doi.org/10.1[...]
Wolters Kluwer Health
[28]
논문
Maintenance bacillus Calmette-Guerin immunotherapy for recurrent TA, T1 and carcinoma in situ transitional cell carcinoma of the bladder: a randomized Southwest Oncology Group Study
https://doi.org/10.1[...]
Wolters Kluwer Philadelphia, PA
[29]
논문
Alternative Therapeutic Approach to Urothelial Cell Carcinoma with Medicinal Mushroom Extracts
https://pubs.sciepub[...]
2016
[30]
논문
Neoadjuvant chemotherapy plus cystectomy compared with cystectomy alone for locally advanced bladder cancer
https://doi.org/10.1[...]
Mass Medical Soc
[31]
논문
International phase III trial assessing neoadjuvant cisplatin, methotrexate, and vinblastine chemotherapy for muscle-invasive bladder cancer: long-term results of the BA06 30894 trial
https://doi.org/10.1[...]
American Society of Clinical Oncology
[32]
논문
Randomised phase III study of neoadjuvant chemotherapy with methotrexate, doxorubicin, vinblastine and cisplatin followed by radical cystectomy compared with radical cystectomy alone for muscle-invasive bladder cancer: Japan Clinical Oncology Group Study JCOG0209
https://doi.org/10.1[...]
Elsevier
[33]
웹사이트
Bladder Cancer Treatment (PDQ®)–Patient Version - National Cancer Institute
https://www.cancer.g[...]
2020-05-11
관련 사건 타임라인
( 최근 20개의 뉴스만 표기 됩니다. )
“업계 최초 주5일 재택근무, ‘혁신 신약 한국 도입’ 10개월 앞당겨” [건강한겨레]
경영 일선 물러난 카카오 김범수, 'SM 시세조종' 재판 불출석
카카오 김범수, 건강상 이유로 물러난다…정신아 단독 체제로 전환
카카오 주가 2.15% 하락...김범수 창업자 경영일선 물러나자 낙폭 확대
카카오 김범수 창업자 CA협의체 의장 사임…"건강상 문제"
카카오 창업자 김범수, 경영 일선서 물러난다…포털 ‘다음’은 분사
반려동물 방광암 예방, 방향제도 조심…먼지 제거 청소 열심히
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
