생물무기화학
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
생물무기화학은 생체 내 금속 이온의 역할과 중요성을 연구하는 학문 분야이다. 이 분야는 필수 금속 이온과 유독 금속 이온의 작용, 금속 이온의 존재 양식, 금속 이온 수송 및 저장, 효소학, 전자 전달, 산소 수송 및 활성화, 생물유기금속 화학, 의학 속 금속, 환경 화학, 생체 광물화 등 다양한 분야를 포괄한다. 생명체는 금속 이온의 농도를 조절하고, 효소의 활성 부위나 산소 운반체로 금속을 활용하며, 금속 함유 전자 전달 단백질을 사용한다. 생물무기화학은 의학, 환경 화학, 생명 과학 등 다양한 분야에 걸쳐 연구되며, 금속 이온의 생체 내 역할과 중요성을 이해하는 데 기여한다.
더 읽어볼만한 페이지
- 무기화학 - 알칼리
알칼리는 아랍어에서 유래하여 식물 재를 의미하며, 물에 녹아 수산화 이온을 생성하고 pH가 높으며 부식성이 있고 피부에 미끈거리는 특징을 보이는 물질을 지칭하며, 염기의 하위 집합으로 알칼리 금속 또는 알칼리 토금속의 염기성 염, 또는 물에 녹아 수산화 이온을 형성하는 염기를 포함한다. - 무기화학 - 동소체
동소체는 동일한 원소로 이루어졌으나 원자 배열의 차이로 물리화학적 성질이 다른 물질을 지칭하며, 탄소의 다이아몬드와 흑연, 산소의 산소와 오존 등이 대표적인 예시이다. - 생화학 - 부패
부패는 미생물에 의한 유기체의 사후 분해 과정으로, 악취 물질 생성, 시신 외형 변화를 동반하며 환경적·내적 요인에 따라 속도가 달라지고 법의학 등에서 연구된다. - 생화학 - 광합성
광합성은 생물이 빛에너지를 이용하여 이산화탄소와 물로부터 유기물을 합성하고 산소를 방출하는 과정으로, 엽록체 내 틸라코이드 막에서 일어나는 명반응과 스트로마에서 일어나는 암반응으로 구성되며, 환경에 따라 탄소 농축 메커니즘을 통해 효율을 높이기도 하고, 지구 대기의 산소를 생성하는 주요 원천이다.
| 생물무기화학 | |
|---|---|
| 개요 | |
| 분야 | 생물학, 무기화학 |
| 연구 대상 | 생물학적 시스템에서 금속의 역할 |
| 관련 분야 | 생화학, 무기화학, 약학, 분광학 |
| 상세 정보 | |
| 중요성 | 생명 유지에 필수적인 금속 이온의 역할 규명 |
| 연구 방법 | 다양한 분광학적 방법 (전자 상자성 공명 분광법, X선 흡수 분광법, 원자 흡수 분광법) 전기화학적 방법 자기 공명 분광법 결정학 이론적 방법 |
| 연구 목표 | 금속 단백질의 구조와 기능 규명, 새로운 약물 개발 |
| 관련 물질 | 금속 효소 금속 단백질 조효소 |
| 활용 분야 | 의약품 개발 환경 개선 에너지 생산 |
| 연구 대상 생물 | 인간 동물 식물 미생물 |
| 역사 | |
| 초기 연구 | 클로드 베르나르의 헤모글로빈 연구 |
| 현대적 정의 | 1960년대에 제기 |
| 주요 발전 | 금속 효소의 구조와 기능 규명, 질소 고정 연구 |
| 응용 | |
| 의학 | 항암제, MRI 조영제, 방사성 의약품 개발 |
| 산업 | 촉매 개발, 생체 재료 개발 |
| 환경 | 생물 정화 기술 개발 |
| 에너지 | 인공 광합성 시스템 개발 |
2. 생체 내 금속 이온의 역할 및 중요성
포유류 질량의 약 99%는 탄소, 질소, 칼슘, 나트륨, 염소, 칼륨, 수소, 인, 산소, 황 원소로 구성된다.[3] 유기 화합물(단백질, 지질, 탄수화물)은 탄소와 질소의 대부분을 차지하며, 산소와 수소의 대부분은 물로 존재한다.[3] 세포 내 금속 함유 생체 분자 전체를 메탈롬이라고 한다.
생체 내에서는 금속 이온 농도가 정밀하게 조절되며, 다양한 생화학 및 생리학 반응에 관여한다. 이러한 금속 이온 중, 생체에 필수적인 필수 금속 이온과 유독 금속 이온이 있다. 생체는 필수 금속 이온을 저장, 운반, 활용하면서, 유독 금속 이온을 축적, 배출하는 기구를 가지고 있다. 필수 금속 이온에는 칼슘, 나트륨, 칼륨 등의 경금속 이온부터 아연, 철, 망가니즈 등의 중금속 이온이 있으며, 유독 금속 이온에는 수은, 카드뮴, 크롬 등이 있다.
금속 이온의 생체 내 존재 양식에는 2가지 종류가 있으며, 다른 원자와의 결합을 거치지 않는 것과, 다른 원자와의 배위 결합에 의해 위치가 고정된 것이 있다. 칼륨, 나트륨, 칼슘 등의 금속 이온의 대부분은, 그 이온 농도가 막 전위를 만들어내며, 신경 활동 등에 관여하고 있다. 또한, 칼슘 이온은 세포 내 신호 전달에서 메신저로서 작용하고 있다. 다른 원자와 배위 결합하고 있는 금속 이온은, 히스티딘, 글루탐산, 시스테인 등의 아미노산의 곁사슬과 결합하여, 단백질 내부에 고정되어 있다. 이러한 단백질은 금속 함유 단백질이라고 불린다. 효소의 대부분도 그 효소 반응을 일으키는 부분에 금속 이온을 포함하는 것이 많이 존재하며, 금속 이온을 매개로 효소 반응을 하고 있다. 한편, 헤모글로빈에는 철 이온이 존재하며, 그 철 이온에 산소가 결합함으로써 산소 운반을 수행하고 있다.
2. 1. 필수 금속 이온
포유류 질량의 약 99%는 탄소, 질소, 칼슘, 나트륨, 염소, 칼륨, 수소, 인, 산소, 황 원소로 구성된다.[3] 유기 화합물(단백질, 지질, 탄수화물)은 탄소와 질소의 대부분을 차지하며, 산소와 수소의 대부분은 물로 존재한다.[3] 세포 내 금속 함유 생체 분자 전체를 메탈롬이라고 한다.생체 내에서는 금속 이온 농도가 정밀하게 조절되며, 다양한 생화학 및 생리학 반응에 관여한다. 이러한 금속 이온 중에는 생체에 필수적인 필수 금속 이온과 유독 금속 이온이 있다. 생체는 필수 금속 이온을 저장, 운반, 활용하면서, 유독 금속 이온을 축적, 배출하는 기구를 가지고 있다. 필수 금속 이온에는 칼슘, 나트륨, 칼륨 등의 경금속 이온부터 아연, 철, 망가니즈 등의 중금속 이온이 있으며, 유독 금속 이온에는 수은, 카드뮴, 크롬 등이 있다.
금속 이온의 생체 내 존재 양식에는 2가지 종류가 있으며, 다른 원자와의 결합을 거치지 않는 것과, 다른 원자와의 배위 결합에 의해 위치가 고정된 것이 있다. 칼륨, 나트륨, 칼슘 등의 금속 이온의 대부분은, 그 이온 농도가 막 전위를 만들어내며, 신경 활동 등에 관여하고 있다. 또한, 칼슘 이온은 세포 내 신호 전달에서 메신저로서 작용하고 있다. 다른 원자와 배위 결합하고 있는 금속 이온은, 히스티딘, 글루탐산, 시스테인 등의 아미노산의 곁사슬과 결합하여, 단백질 내부에 고정되어 있다. 이러한 단백질은 금속 함유 단백질이라고 불린다. 효소의 대부분도 그 효소 반응을 일으키는 부분에 금속 이온을 포함하는 것이 많이 존재하며, 금속 이온을 매개로 효소 반응을 하고 있다. 한편, 헤모글로빈에는 철 이온이 존재하며, 그 철 이온에 산소가 결합함으로써 산소 운반을 수행하고 있다.
2. 2. 유독 금속 이온
여러 금속 이온은 인간과 다른 동물에게 독성이 있으며, 납의 독성과 관련된 생물무기화학에 대한 연구가 진행되었다.[4] 생체 내에서는 금속 이온 농도가 정밀하게 조절되며, 다양한 생화학 및 생리학 반응에 관여한다. 필수 금속 이온에는 칼슘, 나트륨, 칼륨 등의 경금속 이온부터 아연, 철, 망가니즈 등의 중금속 이온이 있으며, 유독 금속 이온에는 수은, 카드뮴, 크롬 등이 있다.금속 이온의 생체 내 존재 양식에는 다른 원자와의 결합을 거치지 않는 것과, 다른 원자와의 배위 결합에 의해 위치가 고정된 것 2가지가 있다. 칼륨, 나트륨, 칼슘 등의 금속 이온의 대부분은, 그 이온 농도가 막 전위를 만들어내며, 신경 활동 등에 관여하고 있다. 또한, 칼슘 이온은 세포 내 신호 전달에서 메신저로서 작용한다. 다른 원자와 배위 결합하고 있는 금속 이온은, 히스티딘, 글루탐산, 시스테인 등의 아미노산의 곁사슬과 결합하여, 단백질 내부에 고정되어 있다. 이러한 단백질은 금속 함유 단백질이라고 불린다. 효소의 대부분도 그 효소 반응을 일으키는 부분에 금속 이온을 포함하는 것이 많이 존재하며, 금속 이온을 매개로 효소 반응을 하고 있다. 한편, 헤모글로빈에는 철 이온이 존재하며, 그 철 이온에 산소가 결합함으로써 산소 운반을 수행하고 있다.
2. 3. 금속 이온의 존재 양식
포유류 질량의 약 99%는 탄소, 질소, 칼슘, 나트륨, 염소, 칼륨, 수소, 인, 산소, 황 원소로 구성된다.[3] 유기 화합물(단백질, 지질, 탄수화물)은 탄소와 질소의 대부분을 차지하며, 산소와 수소의 대부분은 물로 존재한다.[3] 세포 내 금속 함유 생체 분자 전체를 메탈롬이라고 한다.생체 내에서는 금속 이온 농도가 정밀하게 조절되며, 다양한 생화학 및 생리학 반응에 관여한다. 생체는 필수 금속 이온을 저장, 운반, 활용하면서, 유독 금속 이온을 축적, 배출하는 기구를 가지고 있다. 필수 금속 이온에는 칼슘, 나트륨, 칼륨 등의 경금속 이온부터 아연, 철, 망가니즈 등의 중금속 이온이 있으며, 유독 금속 이온에는 수은, 카드뮴, 크롬 등이 있다.
금속 이온의 생체 내 존재 양식에는 2가지 종류가 있으며, 다른 원자와의 결합을 거치지 않는 것과, 다른 원자와의 배위 결합에 의해 위치가 고정된 것이 있다. 칼륨, 나트륨, 칼슘 등의 금속 이온의 대부분은, 그 이온 농도가 막 전위를 만들어내며, 신경 활동 등에 관여하고 있다. 또한, 칼슘 이온은 세포 내 신호 전달에서 메신저로서 작용하고 있다. 다른 원자와 배위 결합하고 있는 금속 이온은, 히스티딘, 글루탐산, 시스테인 등의 아미노산의 곁사슬과 결합하여, 단백질 내부에 고정되어 있다. 이러한 단백질은 금속 함유 단백질이라고 불린다. 효소의 대부분도 그 효소 반응을 일으키는 부분에 금속 이온을 포함하는 것이 많이 존재하며, 금속 이온을 매개로 효소 반응을 하고 있다. 한편, 헤모글로빈에는 철 이온이 존재하며, 그 철 이온에 산소가 결합함으로써 산소 운반을 수행하고 있다.
3. 생물무기화학의 주요 분야
생물체는 금속 이온의 농도와 생체 이용률을 조절하기 위해 다양한 종류의 수송체(예: 이온 펌프 NaKATPase), 액포, 저장 단백질(예: 페리틴), 소분자(예: 시데로포어)를 사용한다. 특히 많은 필수 금속은 수용액에서의 낮은 용해도나 세포 환경에서의 희소성 때문에 하위 단백질에 쉽게 접근할 수 없다. 생물체는 이러한 원소를 수집하고 운송하는 동시에 세포 독성을 제한하기 위한 여러 가지 전략을 개발해 왔다.
생명 과학 분야의 많은 반응에는 물이 관여하며, 금속 이온은 종종 이러한 효소의 촉매 중심(활성 부위)에 위치한다. 즉, 이들은 금속 단백질이다. 반응하는 물은 종종 리간드이다(금속 아쿠아 복합체 참조). 수분 분해 효소의 예로는 탄산 탈수 효소, 금속인산분해효소, 금속 단백질 분해 효소 등이 있다. 생물 무기 화학자들은 이러한 금속 단백질의 기능을 이해하고 복제하려 한다.
금속 함유 전자 전달 단백질 또한 흔하다. 이들은 세 가지 주요 종류로 분류될 수 있다: 철-황 단백질 (예: 루브레독신, 페레독신, 리스케 단백질), 푸른 구리 단백질, 사이토크롬이다. 이들 전자 전달 단백질은 비금속 전자 전달체인 니코틴아미드 아데닌 디뉴클레오타이드(NAD) 및 플라빈 아데닌 디뉴클레오타이드(FAD)와 상호 보완적인 관계를 갖는다. 질소 순환은 산화 환원 상호 변환에 금속을 광범위하게 사용한다.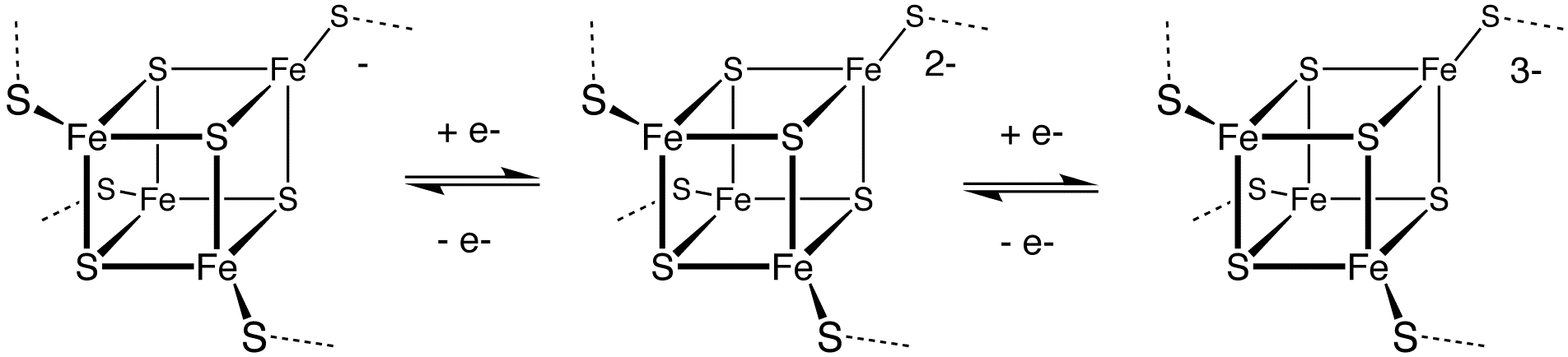
3. 1. 금속 이온 수송 및 저장
생물체는 금속 이온의 농도와 생체 이용률을 조절하기 위해 다양한 종류의 수송체(예: 이온 펌프 NaKATPase), 액포, 저장 단백질(예: 페리틴), 소분자(예: 시데로포어)를 사용한다. 특히 많은 필수 금속은 수용액에서의 낮은 용해도나 세포 환경에서의 희소성 때문에 하위 단백질에 쉽게 접근할 수 없다. 생물체는 이러한 원소를 수집하고 운송하는 동시에 세포 독성을 제한하기 위한 여러 가지 전략을 개발해 왔다.3. 2. 효소학 (Enzymology)
생명 과학 분야의 많은 반응에는 물이 관여하며, 금속 이온은 종종 이러한 효소의 촉매 중심(활성 부위)에 위치한다. 즉, 이들은 금속 단백질이다. 반응하는 물은 종종 리간드이다(금속 아쿠아 복합체 참조). 수분 분해 효소의 예로는 탄산 탈수 효소, 금속인산분해효소, 금속 단백질 분해 효소 등이 있다. 생물 무기 화학자들은 이러한 금속 단백질의 기능을 이해하고 복제하려 한다.금속 함유 전자 전달 단백질 또한 흔하다. 이들은 세 가지 주요 종류로 분류될 수 있다: 철-황 단백질 (예: 루브레독신, 페레독신, 리스케 단백질), 푸른 구리 단백질, 사이토크롬이다. 이들 전자 전달 단백질은 비금속 전자 전달체인 니코틴아미드 아데닌 디뉴클레오타이드(NAD) 및 플라빈 아데닌 디뉴클레오타이드(FAD)와 상호 보완적인 관계를 갖는다. 질소 순환은 산화 환원 상호 변환에 금속을 광범위하게 사용한다.
3. 3. 전자 전달
3. 4. 산소 수송 및 활성화
호기성 생물은 철, 구리 및 망간과 같은 금속을 광범위하게 사용한다. 헴은 적혈구에서 헤모글로빈 형태로 산소 수송에 사용되며, 생물학에서 가장 잘 알려진 금속 시스템일 것이다. 다른 산소 수송 시스템으로는 미오글로빈, 헤모시아닌, 헤메리트린이 있다. 산화 효소와 산소화 효소는 시토크롬 c 산화 효소의 에너지 생성이나 시토크롬 P450 산화 효소 또는 메탄 모노옥시게네이스의 작은 분자 산화와 같이 산소를 이용하여 중요한 반응을 수행하는 자연에서 발견되는 금속 시스템이다.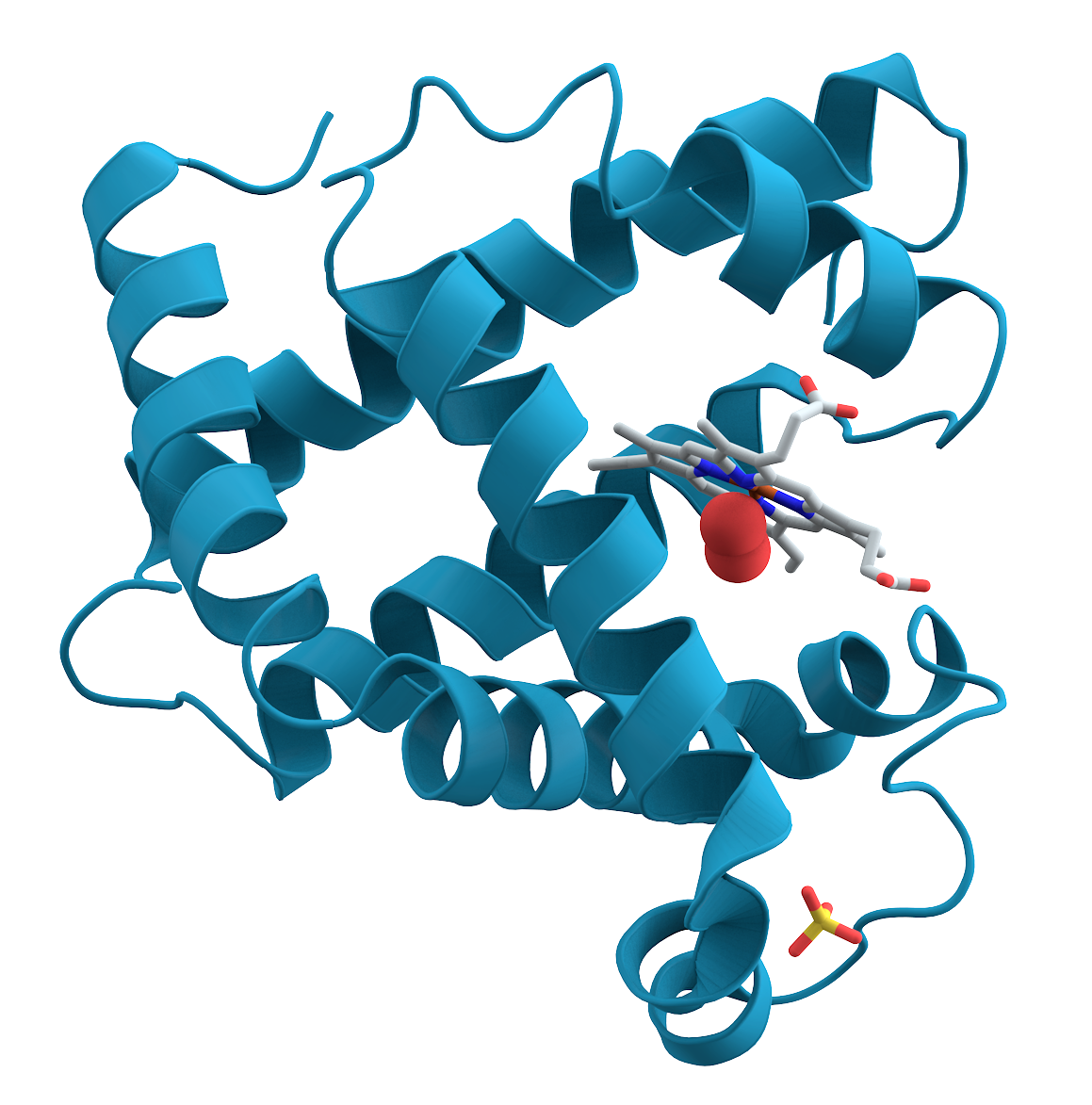
일부 금속 단백질은 생물학적 시스템을 산소 및 과산화 수소와 같은 다른 반응성 산소 함유 분자의 잠재적으로 해로운 영향으로부터 보호하도록 설계되었다. 이러한 시스템에는 과산화 효소, 카탈라아제 및 슈퍼옥시드 불균등화 효소가 있다. 산소와 반응하는 금속 단백질을 보완하는 것은 식물에 존재하는 산소 발생 복합체이다. 이 시스템은 식물이 광합성을 수행할 때 산소를 생산하는 복잡한 단백질 기계의 일부이다.
3. 5. 생물유기금속 화학 (Bioorganometallic chemistry)
생물유기금속 시스템은 금속-탄소 결합을 구조적 요소 또는 중간체로 특징으로 한다. 생물유기금속 효소 및 단백질에는 수소화 효소, 질소 고정 효소의 FeMoco, 메틸코발라민 등이 포함된다.[5] 이러한 자연 발생 유기금속 화합물은 단세포 유기체가 금속을 활용하는 데 더 초점을 맞추고 있다. 생물유기금속 화합물은 환경 화학에서 중요하다.[5]
3. 6. 의학 속 금속 (Metals in medicine)
수많은 약물에는 금속이 포함되어 있다. 이 주제는 금속 함유 제약의 설계 및 작용 기전, 그리고 효소 활성 부위에서 내인성 금속 이온과 상호 작용하는 화합물에 대한 연구에 기반한다. 가장 널리 사용되는 항암제는 시스플라틴이다.[6] MRI 조영제는 일반적으로 가돌리늄을 포함한다.[6] 탄산 리튬은 양극성 장애의 조증 단계를 치료하는 데 사용되어 왔다.[6] 금 항관절염 약물, 예를 들어 아우라노핀이 상용화되었다.[6] 일산화탄소 방출 분자는 소량의 일산화탄소를 방출하여 염증을 억제하도록 개발된 금속 복합체이다.[6] 질산화 효소를 포함하여 심혈관 및 신경에서 산화 질소의 중요성이 검토되었다.[6] (참고: 질소 동화 작용.) 게다가, 트리아졸로피리미딘을 기반으로 한 금속 전이 복합체가 여러 기생충 균주에 대해 시험되었다.[6]3. 7. 환경 화학 (Environmental chemistry)
환경 화학은 전통적으로 중금속과 유기체의 상호 작용을 강조한다. 메틸수은은 미나마타병이라고 불리는 주요 재앙을 일으켰다. 비소 중독은 주로 지하수의 비소 오염으로 인해 널리 퍼진 문제로, 개발 도상국의 수백만 명에게 영향을 미친다. 수은 및 비소 함유 화합물의 대사에는 코발라민 기반 효소가 관여한다.3. 8. 생체 광물화 (Biomineralization)
생물 광물화는 살아있는 유기체가 광물을 생성하는 과정으로, 종종 기존 조직을 경화시키거나 굳게 만들 때 사용된다. 이러한 조직을 광물화 조직이라고 한다.[7][8][9] 예시에는 조류와 규조류의 규산염, 무척추동물의 탄산염, 척추동물의 인산칼슘 및 탄산염 등이 있다. 다른 예시로는 박테리아가 관여하는 구리, 철, 금 침전물이 있다. 생물학적으로 형성된 광물은 자성 세균의 자기 감지기(Fe3O4), 중력 감지 장치(CaCO3, CaSO4, BaSO4) 및 철 저장 및 동원(단백질 페리틴 내의 Fe2O3•H2O)과 같은 특수한 용도를 갖는 경우가 많다. 세포 외[10] 철은 석회화를 유도하는 데 강력하게 관여하므로,[11][12] 껍질을 발달시키는 데 있어 그 제어가 필수적이다. 단백질 페리틴은 철의 분포를 제어하는 데 중요한 역할을 한다.[13]4. 생물 무기 물질의 종류
4. 1. 알칼리 및 알칼리 토금속
풍부한 무기 원소는 이온 전해질로 작용한다. 가장 중요한 이온은 나트륨, 칼륨, 칼슘, 마그네슘, 염화물, 인산염, 탄산 수소염이다. 세포막을 가로지르는 정확한 이온 구배 유지는 삼투압과 pH를 유지한다.[15] 이온은 또한 신경과 근육에 매우 중요한데, 이 조직의 활동 전위는 세포 외액과 세포질 사이의 전해질 교환에 의해 생성된다.[16] 전해질은 이온 채널이라고 하는 세포막의 단백질을 통해 세포로 들어가고 나간다. 예를 들어, 근육 수축은 세포막과 T-튜불에 있는 이온 채널을 통한 칼슘, 나트륨, 칼륨의 이동에 달려 있다.[17]
4. 2. 전이 금속
전이 금속은 일반적으로 유기체 내에서 미량 원소로 존재하며, 아연과 철이 가장 풍부하다.[18][19][20] 이 금속들은 단백질 보조 인자 및 신호 분자로 사용된다. 많은 금속들이 카탈레이스와 같은 효소와 헤모글로빈과 같은 산소 운반 단백질의 활성에 필수적이다.[21] 이러한 보조 인자는 특정 단백질에 단단히 결합되어 있으며, 효소 보조 인자는 촉매 작용 중에 변형될 수 있지만, 촉매 작용이 완료된 후에는 항상 원래 상태로 돌아간다. 금속 미량 영양소는 특정 수송체에 의해 유기체 내로 흡수되며, 사용되지 않을 때는 페리틴 또는 메탈로티오네인과 같은 저장 단백질에 결합된다.[22][23] 코발트는 비타민 B12의 기능에 필수적이다.[24]4. 3. 주족 화합물
황과 인은 모든 생명체에 필요하다. 인은 거의 독점적으로 인산염과 다양한 에스터 형태로 존재한다. 황은 황산염(SO42−)에서 황화물(S2−)까지 다양한 산화 상태로 존재한다. 셀레늄은 항산화 물질인 단백질에 관여하는 미량 원소이다. 카드뮴은 독성 때문에 중요하다.5. 생물무기화학의 역사
파울 에를리히는 유기비소 ("비소 화합물")를 사용하여 매독을 치료했으며, 이는 금속, 적어도 준금속이 의학에 관련이 있음을 보여주었다. 이는 시스플라틴 (cis-PtCl2(NH3)2)의 항암 활성을 로젠버그가 발견하면서 더욱 발전했다. 최초로 결정화된 단백질(참조: 제임스 B. 서머너)은 유레이스였으며, 이후 그 활성 부위에 니켈이 포함되어 있음이 밝혀졌다. 비타민 B12, 악성 빈혈의 치료제는 도로시 크로풋 호지킨에 의해 결정학적으로 코발트가 코린 매크로사이클에 포함되어 있는 것으로 밝혀졌다.
6. 추가 정보 (대한민국 관련)
7. 참고 문헌
- 하인츠-베른하르트 크라츠(편집자), 닐스 메츨러-놀테(편집자), ''생물 무기 화학의 개념과 모델'', 존 와일리 앤드 선스, 2006, ISBN 3-527-31305-2
- 이바노 베르티니, 해리 B. 그레이, 에드워드 I. 스티펠, 조안 셀버스톤 발렌타인, ''생물학적 무기 화학'', 유니버시티 사이언스 북스, 2007, ISBN 1-891389-43-2
- 볼프강 카임, 브리지트 슈베데르스키 "생물 무기 화학: 생명체의 화학에서 무기 원소." 존 와일리 앤드 선스, 1994, ISBN 0-471-94369-X
- 로제트 M. 로아트-말론, ''생물 무기 화학: 단기 과정'', 와일리-인터사이언스, 2002, ISBN 0-471-15976-X
- J.J.R. 프라우스토 다 실바 및 R.J.P. 윌리엄스, ''원소의 생물학적 화학: 생명체의 무기 화학'', 제2판, 옥스퍼드 대학교 출판부, 2001, ISBN 0-19-850848-4
- 로렌스 큐 주니어, 편집, ''생물 무기 화학의 물리적 방법'', 유니버시티 사이언스 북스, 2000, ISBN 1-891389-02-5
참조
[1]
서적
Principles of Bioinorganic Chemistry
University Science Books
1994
[2]
논문
Interweaving Disciplines to Advance Chemistry: Applying Polyoxometalates in Biology
2021-03-31
[3]
논문
Chemical and elemental analysis of humans in vivo using improved body composition models
[4]
서적
Lead: Its Effects on Environment and Health
de Gruyter
2017
[5]
서적
Organometallics in Environment and Toxicology
RSC publishing
[6]
논문
In vitro leishmanicidal and trypanocidal evaluation and magnetic properties of 7-amino-1,2,4-triazolo[1,5-a]pyrimidine Cu(II) complexes
2018-03
[7]
서적
Biomineralization: From Nature to Application
Wiley
[8]
서적
On biomineralization
Oxford University Press
[9]
서적
Biominerals and fossils through time
Cambridge
[10]
논문
The role of iron in the mechanism of experimental calcification
[11]
논문
Effect of trace metal availability on coccolithophorid calcification.
https://epic.awi.de/[...]
[12]
논문
On the mechanism of soft tissue calcification induced by complexed iron
[13]
논문
Dynamic expression of ancient and novel molluscan shell genes during ecological transitions
[14]
서적
Chemistry of the Elements
Butterworth-Heinemann
[15]
논문
Yeast as a model organism to study transport and homeostasis of alkali metal cations
http://www.biomed.ca[...]
[16]
논문
Modulation of ion channels in neurons and other cells
[17]
논문
Excitation-contraction coupling from the 1950s into the new millennium
[18]
서적
Metallomics and the Cell
Springer
[19]
논문
Macro- and micromineral composition of pigs from birth to 145 kilograms of body weight
http://jas.fass.org/[...]
[20]
논문
Elemental fingerprint analysis of barley (Hordeum vulgare) using inductively coupled plasma mass spectrometry, isotope-ratio mass spectrometry, and multivariate statistics
[21]
논문
Transition metal speciation in the cell: insights from the chemistry of metal ion receptors
[22]
논문
Mammalian zinc transport, trafficking, and signals
[23]
논문
Iron uptake and metabolism in the new millennium
[24]
서적
Metallomics and the Cell
Springer
[25]
서적
Cadmium: From Toxicology to Essentiality
Springer
[26]
서적
Principles of Bioinorganic Chemistry
University Science Books
1994
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com