프리온
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
프리온은 핵산 없이 단백질 구조 변형을 통해 복제되는 감염성 인자로, 단백질성 감염 입자라고도 불린다. 18세기부터 스크래피와 같은 질병과 연관되어 연구되었으며, 1982년 스탠리 B. 프루시너에 의해 명명되었다. 프리온은 PrPC와 PrPSc 두 가지 형태로 존재하며, PrPSc는 뇌에 아밀로이드 플라크를 형성하여 전파성 해면상뇌증, 즉 프리온 질환을 유발한다. 이러한 질환은 치명적이며, 스크래피, 소 해면상 뇌병증, 크로이츠펠트-야코프병 등을 포함한다. 프리온의 정확한 기능과 복제 방식에 대해서는 논란이 있으며, 단백질 단독 가설, 다인자 가설, 바이러스 가설 등이 제시되었다. 또한, 프리온은 다른 신경퇴행성 질환과 일부 전신 아밀로이드증에서도 역할을 할 수 있으며, 생물학적 무기로 사용될 가능성도 제기된다.
더 읽어볼만한 페이지
- 프리온 - 스탠리 B. 프루시너
스탠리 B. 프루시너는 프리온 가설을 제시하고 발전시켜 1997년 노벨 생리학·의학상을 수상한 미국의 생화학자이자 신경과학자로, 캘리포니아 대학교 샌프란시스코(UCSF)에서 교수로 재직하며 UCSF 신경퇴행성 질환 연구소 소장을 역임하고 미국 국립과학원 회원으로 활동하고 있다. - 프리온 - 쿠루병
쿠루병은 파푸아뉴기니 포레족의 식인 풍습으로 전파된 전염성 해면뇌병증으로, 프리온 감염에 의해 떨림 증상과 병적인 웃음을 유발하며 크로이츠펠트-야코프병과 연관이 있다고 여겨지나 식인 풍습 근절로 감소되었다. - 대사 장애 - 저혈당증
저혈당증은 혈당 수치가 70 mg/dL 미만으로 감소한 상태를 의미하며, 뇌에 포도당 공급 부족으로 신경당결핍 증상과 교감신경성 증상이 나타나고, 당뇨병 환자에게서 흔히 발생하며, 인슐린 과다 복용 등이 주요 원인이다. - 대사 장애 - 알츠하이머병
알츠하이머병은 뇌의 아밀로이드 플라크와 신경원섬유 엉킴 축적을 특징으로 하는 진행성 신경퇴행성 질환으로, 인지 기능 저하, 일상생활 기능 장애, 기억 상실, 언어 장애 등을 동반하며 완치법은 없지만 증상 완화 치료와 관리가 중요하다. - 유전학 - 우생학
우생학은 인간의 유전적 특질 개선을 목표로 19세기 후반 골턴에 의해 체계화되었으며, 긍정적·부정적 방식으로 전개되었으나, 나치 독일의 인종정책과 결부되어 비판받으며 쇠퇴하였지만, 현대 사회에서도 유전자 선별과 관련된 논쟁이 지속되고 있다. - 유전학 - 행동유전학
행동유전학은 행동에 영향을 주는 유전적 요인과 환경적 요인을 연구하는 학문으로, 프랜시스 골턴의 연구에서 시작되었으나 우생학 논란을 겪었으며, 가족 연구, 쌍둥이 연구 등을 통해 발전해 왔지만 사회적 논쟁과 방법론적 한계에 대한 비판도 존재한다.
| 프리온 | |
|---|---|
| 기본 정보 | |
 | |
| 분야 | 감염병 |
| 상세 정보 | |
| 유형 | 병원성 형태의 잘못 접힌 단백질 |
| 추가 정보 | |
| 관련 질병 | 프리온 질병 |
2. 역사
18세기와 19세기, 스페인에서 양의 수출이 스크래피라는 질병과 관련이 있다는 것이 관찰되었다.[140] 이 질병은 감염된 동물들이 등을 비비는 등의 증상을 보였고, 긴 잠복기를 갖는 전달성 해면상 뇌병증(TSE)의 특징을 보였다.[140][141]
1950년대, 칼턴 가이두섹은 쿠루가 새로운 감염원에 의해 침팬지에게 전염될 수 있음을 보여주었고, 이 연구로 1976년 노벨상을 수상했다.[142] 1960년대, 티크바 알퍼와 존 스탠리 그리피스는 전달성 해면상 뇌병증이 단백질만으로 구성된 감염원에 의해 발생한다는 가설을 제창했다.[142][143] E.J. 필드의 스크래피와 쿠루에 대한 이전 연구에서 병리학적으로 비활성인 다당류가 전이 후 숙주에서만 감염성을 갖는다는 증거를 발견했다.[144][145] 알퍼와 그리피스는 스크래피와 크로이츠펠트-야코프병을 유발하는 미스터리한 감염원이 이온화 방사선에 저항한다는 사실을 설명하고자 했다.[146] 그리피스는 단백질이 병원체가 될 수 있는 세 가지 방식을 제안했는데, 두 번째 가설은 세포 단백질의 비정상적인 형태가 정상적인 단백질을 비정상적인 형태로 변환하여 복제를 유도할 수 있다는 내용으로, 현대 프리온 이론의 기초를 형성한다.[148]
프랜시스 크릭은 그의 저서 "분자 생물학의 중심 원리"(1970)의 두 번째 판에서 스크래피 전파에 대한 그리피스의 단백질만으로 이루어진 가설의 잠재적 중요성을 인식했다.[149] 그는 단백질에서 RNA 및 DNA로의 서열 정보 흐름은 "배제된다"고 주장하면서도, 그리피스의 가설이 잠재적인 모순이라고 언급했다.[149] 이 수정된 가설은 나중에 부분적으로 역전사를 수용하기 위해 공식화되었다(이는 하워드 마틴 테민과 데이비드 볼티모어가 1970년에 발견했다).[150]
1982년, 캘리포니아 대학교 샌프란시스코의 스탠리 B. 프루시너는 그의 그룹이 가설상의 존재였던 감염성 인자의 정제에 성공했으며, 해당 인자의 주성분이 특정 단백질 한 종류임이 밝혀졌다고 발표했다(다만, 이 단백질의 분리에 만족스러운 성공을 거둔 것은 이 발표의 2년 후이다).[164]
프루시너는 이 감염성 인자를 "프리온"(prion)이라고 명명했는데, 프리온을 구성하는 특정 단백질 자체는 프리온 단백질('''Pr'''ion '''P'''rotein, PrP)이라는 명칭으로 불리며, 감염형과 비감염형의 두 가지 구조를 가질 수 있는 물질로 취급된다. 1997년, 프루시너는 프리온 연구 업적으로 노벨 생리학·의학상을 수상했다[165]。
2. 1. 초기 연구
18세기와 19세기, 스페인에서 양의 수출이 스크래피라는 질병과 관련이 있다는 것이 관찰되었다.[140] 이 질병은 감염된 동물들이 등을 비비는 등의 증상을 보였고, 긴 잠복기를 갖는 전달성 해면상 뇌병증(TSE)의 특징을 보였다.[140][141]1950년대, 칼턴 가이듀섹은 쿠루가 새로운 감염원에 의해 침팬지에게 전염될 수 있음을 보여주었고, 이 연구로 1976년 노벨상을 수상했다.[142] 1960년대, 티크바 알퍼와 존 스탠리 그리피스는 전달성 해면상 뇌병증이 단백질만으로 구성된 감염원에 의해 발생한다는 가설을 제창했다.[142][143] 그리피스는 단백질이 병원체가 될 수 있는 세 가지 방식을 제안했는데, 두 번째 가설은 세포 단백질의 비정상적인 형태가 정상적인 단백질을 비정상적인 형태로 변환하여 복제를 유도할 수 있다는 내용으로, 현대 프리온 이론의 기초를 형성한다.[148]
프랜시스 크릭은 그의 저서 "분자 생물학의 중심 원리"(1970)의 두 번째 판에서 스크래피 전파에 대한 그리피스의 단백질만으로 이루어진 가설의 잠재적 중요성을 인식했다.[149] 그는 단백질에서 RNA 및 DNA로의 서열 정보 흐름은 "배제된다"고 주장하면서도, 그리피스의 가설이 잠재적인 모순이라고 언급했다.[149]
2. 2. 프리온의 발견과 명명
'''프리온'''(prion)이라는 단어는 1982년 스탠리 B. 프루시너가 '단백질'(protein)과 '감염'(infection)을 합쳐 만든 것으로,[152] "단백질성 감염 입자"(proteinaceous infectious particle)의 줄임말이다.[13][14] 프루시너는 이 용어를 처음 소개하는 논문에서 "pree-on"으로 발음한다고 명시했다.[152]1950년대에 다니엘 칼턴 가이두섹은 쿠루가 새로운 감염원에 의해 침팬지에게 전염될 수 있음을 보여주는 연구로 1976년 노벨상을 수상했다. 1960년대에 티크바 알퍼와 존 스탠리 그리피스는 전달성 해면상 뇌병증이 단백질만으로 구성된 감염원에 의해 발생한다는 가설을 세웠다.[142][143] 그리피스는 단백질이 병원체가 될 수 있는 세 가지 방식을 제안했는데, 그중 두 번째 가설은 세포 단백질의 비정상적인 형태가 동일한 유형의 정상적인 단백질을 비정상적인 형태로 변환하여 복제를 유도할 수 있다는 것으로, 현대 프리온 이론의 기초를 형성한다.
프랜시스 크릭은 분자 생물학의 중심 원리의 두 번째 판에서 스크래피 전파에 대한 그리피스의 단백질만으로 이루어진 가설의 잠재적 중요성을 인식했다.[149]
1982년, 샌프란시스코 캘리포니아 대학교의 스탠리 B. 프루시너는 자신의 연구팀이 가설적인 감염성 단백질을 정제했다고 발표했다.[151][152] 이 단백질은 프리온이라고 명명되었으며, 이후 프리온을 구성하는 특정 단백질은 프리온 단백질(PrP)로 명명되었다. 프루시너는 프리온 연구로 1997년 노벨 생리의학상을 수상했다.[154][155]
3. 구조
주요 프리온 단백질 (PrP)의 변형된 형태로 구성되어 있으며, 이는 인간과 다른 동물의 신체에 자연적으로 존재하는 단백질이다. 감염성 프리온에서 발견되는 PrP는 다른 단백질 구조를 가지고 있으며, 일반적으로 단백질을 분해할 수 있는 신체 내 효소인 프로테아제에 저항한다. 단백질의 정상적인 형태는 PrPC라고 불리며, 감염성 형태는 PrPSc라고 불린다. 여기서 ''C''는 '세포' PrP를 나타내고, ''Sc''는 양에서 발생하는 전형적인 프리온 질환인 '스크래피'를 나타낸다.[19] PrP는 또한 시험관 내에서 다른 비교적 잘 정의된 이소형으로 접힐 수 있다. 비록 그들이 생체 내에서 병원성이 있는 형태와의 관계는 종종 불분명하지만, 고해상도 구조 분석은 프리온 감염성과 상관관계가 있는 구조적 특징을 밝히기 시작했다.[20]
PrPC는 건강한 사람이나 동물의 세포막에서 발견되는 정상적인 단백질이다.[216] 반면, PrPSc는 PrPC의 구조가 변형된 형태로, 감염성을 가지며 프로테아제(단백질을 분해하는 효소의 총칭)에 의해 잘 분해되지 않는다.[216] 여기서 ''C''는 '세포' PrP를 나타내고, ''Sc''는 양에서 발생하는 전형적인 프리온 질환인 '스크래피'를 나타낸다.[19]
'''PrPC'''는 명확한 구조를 가지지만, '''PrPSc'''는 다분산계로 비교적 불명확한 구조를 가진다.[166] PrPC는 구조적으로 잘 정의되어 있는 반면 PrPSc는 확실한 다분산성(polydisperse)을 보이며 그 구조가 상대적으로 잘 정의되어 있지 않다.[216]
PrPC는 세포막에서 발견되는 정상적인 단백질로, 인간에서는 한 개의 이황화 결합이 있는 209개의 아미노산으로 구성되어 있으며, 분자량은 35-36kDa으로 대개 알파 나선 구조로 이뤄져 있다. 위상학적으로는 몇 가지 형태들이 있는데 당지질(glycolipid)을 통해 세포 표면에 단단히 붙어 있는 형태 한 종류와 막관통 단백질 형태 두 종류가 있다.[217] 무슨 기능을 수행하는지는 아직 전부 알려져 있지는 않다. PrPC는 구리2가 이온과 강하게 결합하는데 아마 PrP의 구조나 기능에 연관이 있을 것이라 추정되지만,[218] 확실한 의의는 알 수 없다. PrPC는 쉽게 단백질분해효소인 proteinase K에 의해 분해되며, 시험관내에서는 phosphoinositide phospholipase C (PI-PLC)같은 효소를 써서 당지질을 분해함으로써 쉽게 세포 표면에서 떼어낼 수 있다.[219] 혈소판이 인간에서 가장 큰 저장소를 구성하는 여러 혈액 성분을 포함한다.[21]PrP는 ''생체 내'' 세포 간 부착과 세포 내 신호 전달에 중요한 역할을 하며,[30] 따라서 뇌의 세포 간 통신에 관여할 수 있다.[31]
PrPSc는 PrP의 감염성 이소형으로, 정상 PrPC 단백질의 단백질 구조를 변경하여 감염성 이소형으로 변환시킨다. PrPSc는 정상적인 알파 나선 구조 대신 베타 시트 구조의 비율이 더 높다.[32][33][34] 이러한 이상 형태의 단백질이 축적되면 고도로 구조화된 아밀로이드 섬유가 형성된다. 이 섬유의 끝은 자유 단백질 분자에 대해 주형으로 작용하여 섬유가 계속 길어진다. 대부분의 경우 감염성 PrPSc와 동일한 아미노산 서열을 가진 PrP 분자만 성장하는 섬유에 통합되지만, 드물게 종간 전파가 발생하기도 한다.[46]
단백질 분해 효소 저항성 PrPSc 유사 단백질(PrPres)은 구조적으로 변형되어 단백질 분해 효소 K에 저항적인 형태로 변환된 PrPc의 모든 이소형에 부여된 이름이다.[47] PrPC가 PrPSc로 전환되는 것을 ''in vitro''에서 모델링하기 위해, Kocisko 등은 PrPSc가 무세포 조건 하에서 PrPC를 PrPres로 전환시킬 수 있음을 보여주었고,[48] Soto 등은 단백질 잘못 접힘의 주기적 증폭을 포함하는 절차를 통해 PrPres 및 프리온 감염성의 지속적인 증폭을 입증했다.[49] "PrPres"라는 용어는 전염성 해면상 뇌병증 인자와 관련된 감염성 조직에서 분리된 PrPSc의 단백질 분해 효소 저항성 형태 또는 예를 들어 ''in vitro''에서 생성될 수 있는 다른 단백질 분해 효소 저항성 PrP 형태를 지칭할 수 있다.[50] 따라서 PrPSc와 달리 PrPres는 반드시 감염성이 아닐 수 있다.
3. 1. 아이소형(Isoform)
PrPC는 건강한 사람이나 동물의 세포막에서 발견되는 정상적인 단백질이다.[216] 반면, PrPSc는 PrPC의 구조가 변형된 형태로, 감염성을 가지며 프로테아제(단백질을 분해하는 효소의 총칭)에 의해 잘 분해되지 않는다.[216] 여기서 ''C''는 '세포' PrP를 나타내고, ''Sc''는 양에서 발생하는 전형적인 프리온 질환인 '스크래피'를 나타낸다.[19]'''PrPC'''는 명확한 구조를 가지지만, '''PrPSc'''는 다분산계로 비교적 불명확한 구조를 가진다.[166] PrPC는 구조적으로 잘 정의되어 있는 반면 PrPSc는 확실한 다분산성(polydisperse)을 보이며 그 구조가 상대적으로 잘 정의되어 있지 않다.[216]
3. 1. 1. PrPC
PrPC는 세포막에서 발견되는 정상적인 단백질로, 인간에서는 한 개의 이황화 결합이 있는 209개의 아미노산으로 구성되어 있으며, 분자량은 35-36kDa으로 대개 알파 나선 구조로 이뤄져 있다. 위상학적으로는 몇 가지 형태들이 있는데 당지질(glycolipid)을 통해 세포 표면에 단단히 붙어 있는 형태 한 종류와 막관통 단백질 형태 두 종류가 있다.[217] 무슨 기능을 수행하는지는 아직 전부 알려져 있지는 않다. PrPC는 구리2가 이온과 강하게 결합하는데 아마 PrP의 구조나 기능에 연관이 있을 것이라 추정되지만,[218] 확실한 의의는 알 수 없다. PrPC는 쉽게 단백질분해효소인 proteinase K에 의해 분해되며, 시험관내에서는 phosphoinositide phospholipase C (PI-PLC)같은 효소를 써서 당지질을 분해함으로써 쉽게 세포 표면에서 떼어낼 수 있다.[219] 혈소판이 인간에서 가장 큰 저장소를 구성하는 여러 혈액 성분을 포함한다.[21]PrP는 ''생체 내'' 세포 간 부착과 세포 내 신호 전달에 중요한 역할을 하며,[30] 따라서 뇌의 세포 간 통신에 관여할 수 있다.[31]3. 1. 2. PrPSc
PrPSc는 PrP의 감염성 이소형으로, 정상 PrPC 단백질의 단백질 구조를 변경하여 감염성 이소형으로 변환시킨다. PrPSc는 정상적인 알파 나선 구조 대신 베타 시트 구조의 비율이 더 높다.[32][33][34] 이러한 이상 형태의 단백질이 축적되면 고도로 구조화된 아밀로이드 섬유가 형성된다. 이 섬유의 끝은 자유 단백질 분자에 대해 주형으로 작용하여 섬유가 계속 길어진다. 대부분의 경우 감염성 PrPSc와 동일한 아미노산 서열을 가진 PrP 분자만 성장하는 섬유에 통합되지만, 드물게 종간 전파가 발생하기도 한다.[46]3. 1. 3. PrPres
단백질 분해 효소 저항성 PrPSc 유사 단백질(PrPres)은 구조적으로 변형되어 단백질 분해 효소 K에 저항적인 형태로 변환된 PrPc의 모든 이소형에 부여된 이름이다.[47] PrPC가 PrPSc로 전환되는 것을 ''in vitro''에서 모델링하기 위해, Kocisko 등은 PrPSc가 무세포 조건 하에서 PrPC를 PrPres로 전환시킬 수 있음을 보여주었고,[48] Soto 등은 단백질 잘못 접힘의 주기적 증폭을 포함하는 절차를 통해 PrPres 및 프리온 감염성의 지속적인 증폭을 입증했다.[49] "PrPres"라는 용어는 전염성 해면상 뇌병증 인자와 관련된 감염성 조직에서 분리된 PrPSc의 단백질 분해 효소 저항성 형태 또는 예를 들어 ''in vitro''에서 생성될 수 있는 다른 단백질 분해 효소 저항성 PrP 형태를 지칭할 수 있다.[50] 따라서 PrPSc와 달리 PrPres는 반드시 감염성이 아닐 수 있다.4. 기능
프리온 단백질(PrP)의 정확한 생리적 기능은 아직 완전히 밝혀지지 않았다. 시험관 내 실험에서는 다양한 역할이 제시되었지만, PrP 유전자 제거 생쥐를 이용한 연구에서는 제한적인 정보만 제공되었는데, 이는 해당 동물들이 경미한 이상만을 보였기 때문이다. 생쥐 연구에서는 말초 신경에서 PrP의 절단이 슈반 세포에서 미엘린 수리를 활성화시키고, PrP 단백질 부족이 해당 세포의 탈수초화를 유발한다는 사실이 밝혀졌다.[51]
MAVS, RIP1, 그리고 RIP3는 신체의 다른 부분에서 발견되는 프리온 유사 단백질이다. 이들은 필라멘트형 아밀로이드 섬유로 중합되어 바이러스 감염 시 주변 세포로의 바이러스 입자 확산을 막기 위해 조절된 세포 사멸을 시작한다.[52]
PrP의 기능에 대해서는 여전히 논란이 있지만, 구리 의존적으로 항산화제로 작용하는 것으로 보고되고 있다.[172]
PrP와 장기 기억PrP가 장기 기억 유지에 관여한다는 증거가 일부 존재한다.[53] 2004년 연구에서는 정상적인 세포 PrP 단백질에 대한 유전자가 없는 쥐가 변형된 해마 장기 연접 가소성을 보인다는 것을 발견했다.[54][55] 마글리오 등은 PrPC를 코드하는 유전자가 결손된 마우스가 해마의 장기 기억 증강에 변화를 준다는 것을 나타냈다.[174]
PrP와 줄기 세포 재생2006년 화이트헤드 생의학 연구소의 논문에서는 줄기 세포에서 PrP가 발현되는 것이 골수의 자기 재생에 필수적이라고 주장했다. 이 연구는 모든 장기 조혈모 세포가 세포막에 PrP를 발현하고 있으며, PrP를 발현하지 않는 조혈모 세포들은 세포 고갈에 대한 민감도가 증가한다는 것을 보여주었다.[57][175]
PrP와 선천 면역PrP 유전자 PRNP의 발현이 많은 바이러스 감염에서 상향 조절되고 PrP가 HIV를 포함한 많은 바이러스에 대해 항바이러스 특성을 갖는다는 점에서, PrP가 선천 면역에서 역할을 할 수 있다는 일부 증거가 있다.[58]
4. 1. PrP와 장기 기억
PrP가 장기 기억 유지에 관여한다는 증거가 일부 존재한다.[53] 2004년 연구에서는 정상적인 세포 PrP 단백질에 대한 유전자가 없는 쥐가 변형된 해마 장기 연접 가소성을 보인다는 것을 발견했다.[54][55] 마글리오 등은 PrPC를 코드하는 유전자가 결손된 마우스가 해마의 장기 기억 증강에 변화를 준다는 것을 나타냈다.[174]4. 2. PrP와 줄기 세포 재생
2006년 화이트헤드 생의학 연구소의 논문에서는 줄기 세포에서 PrP가 발현되는 것이 골수의 자기 재생에 필수적이라고 주장했다. 이 연구는 모든 장기 조혈모 세포가 세포막에 PrP를 발현하고 있으며, PrP를 발현하지 않는 조혈모 세포들은 세포 고갈에 대한 민감도가 증가한다는 것을 보여주었다.[57][175]4. 3. PrP와 선천 면역
PrP 유전자 PRNP의 발현이 많은 바이러스 감염에서 상향 조절되고 PrP가 HIV를 포함한 많은 바이러스에 대해 항바이러스 특성을 갖는다는 점에서, PrP가 선천 면역에서 역할을 할 수 있다는 일부 증거가 있다.[58]5. 복제
프리온은 핵산 없이 단백질 구조 변형을 통해 복제된다.[59][60][61] 프리온의 복제 방식에 대해서는 여러 가설이 제시되었는데, 대표적으로 이종이량체 모델과 섬유 모델이 있다. 이종이량체 모델은 PrPSc 분자가 PrPC 분자에 결합하여 PrPSc로 전환하는 과정을 촉매한다고 가정한다.[59] 하지만 이 모델은 PrPSc가 매우 효과적인 촉매여야 한다는 문제점이 있다.[60] 섬유 모델은 PrPSc가 섬유 형태로만 존재하며, 섬유 끝이 PrPC를 PrPSc로 전환한다고 가정한다.[62][63][64] 이 모델은 섬유 파괴를 통해 PrPSc와 감염성 입자량의 지수 성장을 설명할 수 있다.[65][120]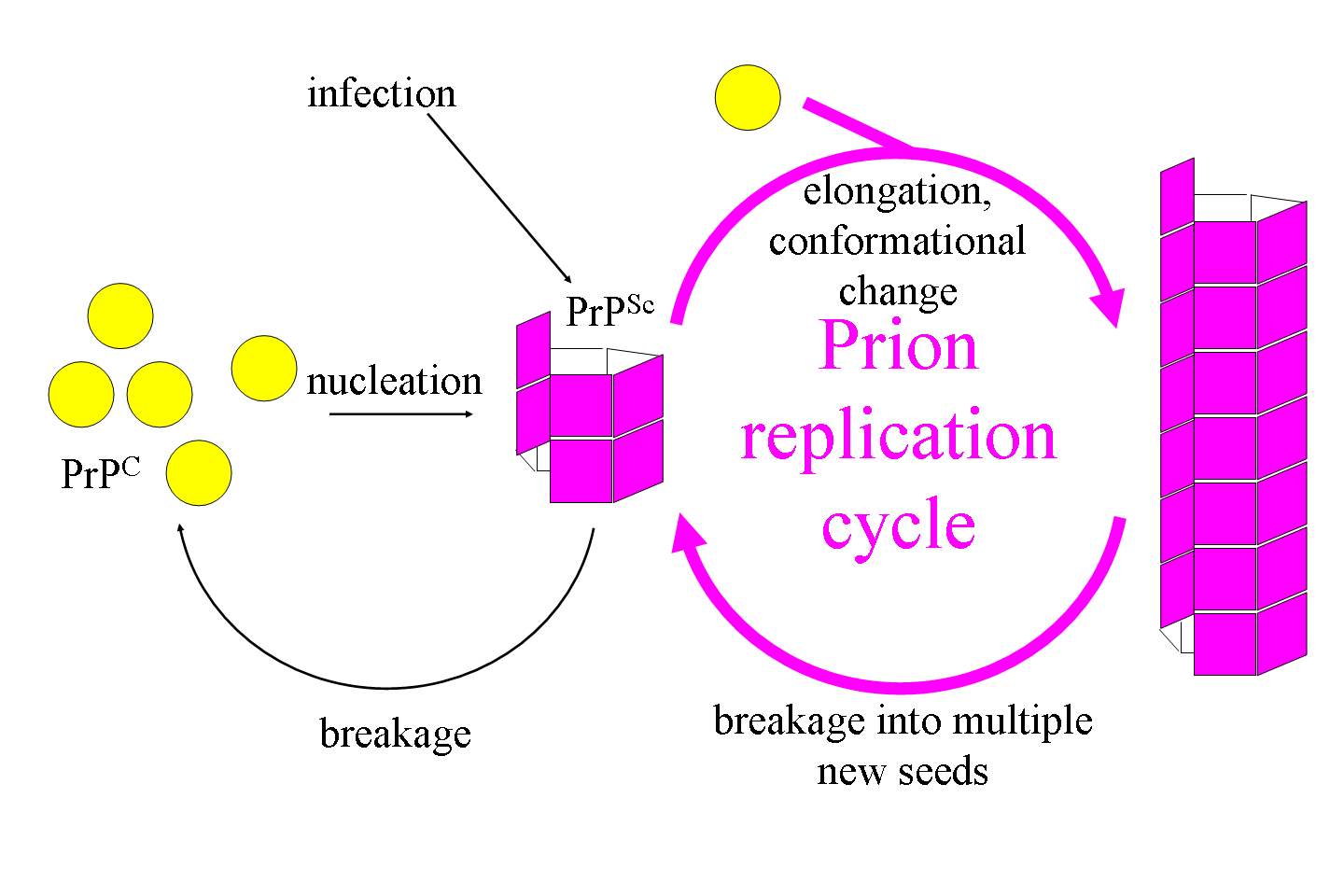
프리온 복제 메커니즘은 아직 정확하게 밝혀지지 않았지만, 약물 설계에 중요한 영향을 미친다.[67] 프리온 질환의 긴 잠복기를 고려할 때, 약물은 모든 프리온을 제거하는 대신 지수 성장 속도를 늦추는 방향으로 개발되어야 한다.[67]
다트머스 대학교 연구에 따르면 특정 인지질 및 폴리음이온과 같은 내생 숙주 보조 인자가 PrPSc 분자 형성에 필요하며, 단백질만으로 구성된 PrPSc 분자는 생물학적 감염성이 낮은 것으로 나타났다.[68][69]
"단백질 X" 가설은 미지의 세포성 단백질이 PrPC와 PrPSc를 연결하여 복합체 형성을 돕는다는 가설이다.[188] 현재까지의 연구에 따르면 포유류에서 프리온의 주요 감염 경로는 경구 섭취이며,[189] 프리온은 체액을 통해 토양으로 유입될 수 있다.[189] 혈액 감염 여부는 2014년 7월 현재 밝혀지지 않았으며, 일부 국가에서는 광우병 오염 지역 귀국자의 헌혈을 금지하고 있다.
6. 전파성 해면상뇌증 (프리온 질환)
프리온은 중추 신경계에 세포 외적으로 응집하여 아밀로이드로 알려진 플라크를 형성하고, 정상적인 조직 구조를 파괴하여 신경퇴행성 질환을 일으킨다.[220] 이러한 현상은 뉴런의 공포 형성으로 인해 조직 내에 "구멍"이 보이는 스펀지 모양의 구조로 나타나며, 성상교세포증 및 염증 반응의 부재와 같은 조직학적 변화가 동반된다.[75][76]
프리온 질환은 일반적으로 매우 긴 잠복기를 가지지만(5~20년), 일단 증상이 나타나면 질병은 빠르게 진행되어 뇌 손상과 사망에 이른다.[77] 신경퇴행성 증상으로는 경련, 치매, 운동실조 (균형 및 협응 기능 장애), 행동 또는 성격 변화 등이 있다.[78][79]
thumb
프리온 단백질(PrP)은 모든 포유류에서 매우 유사하기 때문에 다양한 포유류가 프리온 질환의 영향을 받을 수 있다.[80] 그러나 종 간 PrP의 작은 차이로 인해 종간 전파는 드물게 발생한다. 예외적으로 인간의 변종 크로이츠펠트-야코프병(vCJD)은 소해면상뇌증을 일으키는 소의 프리온이 감염된 육류를 통해 전염되는 것으로 알려져 있다.[81]
알려진 모든 프리온 질환(전파성 해면상뇌증)은 치료법이 없으며 치명적이다.[9][82][83][179] 쥐에서 프리온 감염에 대한 백신이 개발되어 사람 백신 개발의 실마리가 될 것으로 기대되기도 한다.[180]
프리온에 의해 발생하는 질환은 다음과 같다.
| 영향을 받는 동물 | 질병 |
|---|---|
| 양, 염소 | 스크래피[70] |
| 소 | 소 해면상 뇌병증[70] |
| 낙타[71] | 낙타 해면상 뇌병증 (CSE) |
| 밍크[70] | 전염성 밍크 뇌병증 (TME) |
| 흰꼬리사슴, 엘크, 뮬 사슴, 무스[70] | 만성 소모성 질환 (CWD) |
| 고양이[70] | 고양이 해면상 뇌병증 (FSE) |
| 니아라, 오릭스, 큰 쿠두[70] | 이국적인 발굽동물 뇌병증 (EUE) |
| 타조[72] | 해면상 뇌병증 (전염 여부 불확실) |
| 사람 | 크로이츠펠트-야코프병 (CJD)[70] |
| 의인성 크로이츠펠트-야코프병 (iCJD) | |
| 변종 크로이츠펠트-야코프병 (vCJD) | |
| 가족성 크로이츠펠트-야코프병 (fCJD) | |
| 산발성 크로이츠펠트-야코프병 (sCJD) | |
| 게르스트만-슈트라우슬러-샤인커 증후군 (GSS)[70] | |
| 치명적 불면증 (FFI)[73] | |
| 쿠루병 (Kuru)[70] | |
| 가족성 해면상 뇌병증[74] | |
| 가변성 프로테아제 민감성 프리온병 (VPSPr) | |
6. 1. 인간에게 발생하는 질환
6. 2. 동물에게 발생하는 질환
6. 3. 전이
프리온의 감염은 주로 섭취를 통해 이루어지는 것으로 알려져 있다.[87] 동물 사체, 소변, 타액 등의 체액을 통해 프리온이 환경에 축적되고,[87] 이것이 다시 오염된 육류나 토양 등을 통해 전파될 수 있다.[87] "Protein X" 가설은 아직 확인되지 않은 세포 단백질이 PrPC를 PrPSc로 변환하는 데 관여한다는 가설이다.[86][188]캘리포니아 대학교 연구팀은 분뇨를 통해 프리온 감염이 발생할 수 있다는 증거를 제시하기도 했다.[88] 2011년에는 에어로졸 입자를 통한 공기 중 전파 가능성이 보고되었으나,[89] 해당 보고서는 2024년에 철회되었다.[90]
대부분의 인간 프리온 질환은 산발성 크로이츠펠트-야코프병(sCJD)으로 분류된다. 유전 연구에 따르면, 프리온 단백질(PrP)을 암호화하는 PRNP 유전자의 129번 코돈 다형성과 sCJD 감수성 사이에 연관성이 있다. 동형접합 메티오닌/메티오닌(MM) 유전형은 이형접합 메티오닌/발린(MV) 유전형에 비해 sCJD 발병 위험을 유의하게 증가시킨다.[92]
2015년, 텍사스 대학교 연구원들은 식물이 프리온의 매개체가 될 수 있음을 발견했다. 만성 소모성 질환(CWD)에 걸린 사슴이 묻힌 땅에서 자란 풀을 햄스터에게 먹였을 때 햄스터가 CWD에 감염된 것을 확인했는데, 이는 프리온이 식물을 통해 초식 동물에게 전파될 수 있음을 보여준다.[93][94]
6. 4. 살균
프리온은 바이러스와 유사하지만, 열, 자외선, 소독물질 등 일반적인 소독 방법으로는 불활성화되지 않는 강한 내성을 가지고 있다.[215] 프리온을 멸균하려면 단백질이 더 이상 정상 단백질의 비정상적인 접힘을 유도할 수 없는 상태로 변성시켜야 한다.[95] 일반적으로 프리온은 프로테아제, 열, 이온화 방사선, 포름알데히드 처리에 상당히 강하지만,[95] 이러한 처리를 통해 감염성을 줄일 수 있다.고압증기멸균(autoclave)기에서 134도로 18분 이상 가열하면 프리온의 성질이 변형될 수 있다.[215] 134°C에서 18분간 고압증기멸균(pressurised steam autoclave)을 시행하더라도 변성시키지 못할 수 있다는 연구 결과도 있다.[98][99] 오존을 이용한 멸균법이 현재 연구 중이며,[100] 완전히 변성된 프리온을 다시 감염력이 있는 상태로 만드는 것은 아직 성공하지 못했지만 부분적으로 변성된 프리온은 인공환경 하에서 다시 감염력이 있는 형태로 돌아갈 수 있다.[104]
세계 보건 기구(WHO)는 프리온에 노출되었을 것으로 의심되는 수술도구 중 열을 가해도 되는 도구들에 대해 아래와 같은 소독 절차를 권장하고 있다.[97][195]
# 1N 수산화 나트륨 용액에 담그고, 중력 변위 오토클레이브에서 121°C, 30분 조건으로 고압 증기 멸균한다. 잘 씻고 물로 헹군 다음 일반적인 소독을 한다.
# 1N 수산화 나트륨 용액이나 차아염소산 나트륨(유효 염소 20,000 ppm) 용액에 1시간 동안 담근다. 기구를 물에 옮겨 담고 121°C, 60분간 고압증기멸균한다. 씻고 일반 소독을 한다.
# 1N 수산화 나트륨 용액이나 차아염소산 나트륨(유효 염소 20,000 ppm) 용액에 1시간 동안 담근다. 꺼내서 물로 헹군 다음, 개방형 팬에 옮기고 중력 변위 오토클레이브(121°C) 또는 다공성 부하 오토클레이브(134°C)에서 1시간 동안 가열한다. 씻고 일반 소독을 한다.
이 밖에도 유기물을 기본 구성요소로 환원시킬 수 있는 cold (non-equilibrium) oxygen ion plasmas법이나[221] 황산을 이용하는 방법, 산소 농도를 높인 후 고온으로 태워버리는 방법 등이 있다.
7. 논란
프리온 질환의 정확한 원인과 메커니즘에 대해서는 여전히 논쟁이 존재한다.
;Protein-only 가설
프리온이 발견되기 전에는 모든 병원체가 핵산에 의해 자기 복제를 수행한다고 생각했다. "단백질 단독 가설"에 따르면, 단백질 구조가 핵산의 도움 없이 자기 복제 능력을 갖추고 있다고 여겨진다. 이 가설은 발표 초기에는 복제 정보의 중심적 운반체가 핵산에 있다고 기술하는 소위 "분자생물학의 중심원리"와 모순된다고 하여 논란을 일으켰다.[201]
단백질 단독 가설을 지지하는 증거는 다음과 같다[201]。
- 프리온병과 결정적인 관계를 갖는 바이러스 입자, 세균, 균류가 발견되지 않았다.
- 프리온의 감염성과 결정적인 관계를 갖는 핵산이 발견되지 않았다. 또한, 감염성 인자는 뉴클레아제 내성을 갖는다.
- 감염에 대해 면역 반응이 인정되지 않는다.
- PrPSc를 어떤 종류의 세포에서 다른 종류의 세포로 실험적으로 감염시키면, 수용 세포의 종의 아미노산 서열을 가진 PrPSc가 나타난다. 이는 기증자 유래의 감염성 인자가 그대로 복제된 것이 아님을 시사한다.
- PrPSc와 PrPC 사이에 아미노산 서열의 차이는 없다. 따라서, "PrPSc 특이적"인 핵산이란 redundant한 개념이다.
- 가족성 프리온병은 PrP의 유전자에 변이를 갖는 가계에서 인정된다. 또한, PrP에 변이를 도입한 마우스는, 감염이 일어나지 않도록 관리된 환경에서도 프리온병을 발병한다.
- PrPC를 결손시킨 동물은 프리온에 이환되지 않는다.
7. 1. Protein-only 가설
프리온이 발견되기 전에는 모든 병원체가 핵산에 의해 자기 복제를 수행한다고 생각했다. "단백질 단독 가설"에 따르면, 단백질 구조가 핵산의 도움 없이 자기 복제 능력을 갖추고 있다고 여겨진다. 이 가설은 발표 초기에는 복제 정보의 중심적 운반체가 핵산에 있다고 기술하는 소위 "분자생물학의 중심원리"와 모순된다고 하여 논란을 일으켰다.[201]단백질 단독 가설을 지지하는 증거는 다음과 같다[201]。
- 프리온병과 결정적인 관계를 갖는 바이러스 입자, 세균, 균류가 발견되지 않았다.
- 프리온의 감염성과 결정적인 관계를 갖는 핵산이 발견되지 않았다. 또한, 감염성 인자는 뉴클레아제 내성을 갖는다.
- 감염에 대해 면역 반응이 인정되지 않는다.
- PrPSc를 어떤 종류의 세포에서 다른 종류의 세포로 실험적으로 감염시키면, 수용 세포의 종의 아미노산 서열을 가진 PrPSc가 나타난다. 이는 기증자 유래의 감염성 인자가 그대로 복제된 것이 아님을 시사한다.
- PrPSc와 PrPC 사이에 아미노산 서열의 차이는 없다. 따라서, "PrPSc 특이적"인 핵산이란 redundant한 개념이다.
- 가족성 프리온병은 PrP의 유전자에 변이를 갖는 가계에서 인정된다. 또한, PrP에 변이를 도입한 마우스는, 감염이 일어나지 않도록 관리된 환경에서도 프리온병을 발병한다.
- PrPC를 결손시킨 동물은 프리온에 이환되지 않는다.
7. 2. 다인자 가설
2007년, 다트머스 칼리지의 생화학자 수라차이 스파타폰 등은 특정 인자(PrPC, 공동 정제된 지질, 합성 폴리음이온 분자)로 구성된 프리온을 새롭게 정제했다고 발표했다[196]。그들은 프리온 형성에 필요한 폴리음이온 분자가 PrP 분자와 선택적으로 결합하여 고친화성 복합체를 형성한다고 보고했으며, 이 발견을 통해 감염성 프리온은 복수의 숙주 인자(PrP, 지질, 폴리음이온 분자)로 구성된 병원체이며 PrPSc 단독이 병원체가 아니라는 가설을 제창했다[197]。7. 3. 바이러스 가설
예일 대학교의 신경 병리학자 로라 마누엘리디스는 10년 이상 프리온병의 원인을 미지의 "느린 바이러스"로 주장해 왔다. 마누엘리디스는 2007년 1월, 스크래피에 감염된 배양 세포 중 10% 이하의 세포에서 바이러스가 존재함을 확인했다는 논문을 발표했다[199][200]。바이러스 가설은 전염성 해면상 뇌증(TSE)의 원인이 PrP에 결합된 복제 가능한 정보성 분자(핵산)라는 가설이다. 스크래피나 소 해면상 뇌증(BSE) 등, 많은 전염성 해면상 뇌증은 특징적인 생물학적 성질을 가지고 있지만, 바이러스 가설의 지지자는 이러한 특징을 프리온으로 설명할 수 없다고 주장한다.
바이러스 가설을 지지하는 증거는 다음과 같다[201]。
- 종간에 나타나는 프리온의 감염성, 잠복기, 증상, 진행의 차이는, 특히 RNA 바이러스와 같은 바이러스에서 나타나는 "주의 차이"와 유사하다.
- 긴 잠복기와 증상의 급격한 발생은, HIV가 일으키는 AIDS 등, 일부 바이러스 감염증과 유사하다.
- PrP로 구성된다고 생각하기 어려운 바이러스 유사 입자가, 일부 스크래피 감염 세포주, 크로이츠펠트-야콥병 감염 세포주에서 검출되었다[200]。
7. 4. 중금속 중독 가설
데이비드 R. 브라운(David R. Brown)은 프리온 단백질이 구리 이온에 결합하면 슈퍼옥시드 디스뮤테이스 활성을 띨 가능성이 있다고 발표했다. 브라운은 이러한 활성 소실이 질병을 유발한다고 보았다. 마크 퍼디(Mark Purdey)는 구리 및 망간을 비정상적으로 함유한 환경이나 먹이 등이 이러한 현상을 촉진할 수 있다고 추정했다[202]。8. 유전적 특징
정상적인 프리온 단백질을 만드는 유전자인 PRNP 유전자가 밝혀져 있다.[203] 일부 프리온 질환은 유전되기도 하는데, 모든 사례에서 PRNP 유전자의 변이가 나타나고 있다.[92] PRNP 유전자 돌연변이는 여러 가지가 보고되어 있으며, 이러한 돌연변이가 PrPC형이 좀 더 쉽게 PrPSc 형으로 변하도록 하는 것으로 생각된다. 프리온 질환은 산발성, 유전성, 감염성 발생 양상을 모두 갖는 유일한 질환군이다.
대부분의 인간 프리온 질환은 산발성 크로이츠펠트-야코프병(sCJD)으로 분류된다. 유전 연구를 통해 프리온 단백질(PrP)을 암호화하는 PRNP 유전자의 129번 코돈에서 다형성과 sCJD에 대한 감수성 사이의 연관성이 밝혀졌다. 이 위치에서 동형접합 메티오닌/메티오닌(MM) 유전형은 이형접합 메티오닌/발린(MV) 유전형에 비해 sCJD 발병 위험을 유의하게 증가시키는 것으로 나타났다. 여러 연구를 분석한 결과, MM 유전형을 가진 사람은 MV 유전형을 가진 사람보다 sCJD가 발병할 확률이 약 5배 더 높았다.[92]
''PRNP'' 유전자 상의 변이가 확인된 다양한 변이는 ''PRNP'' 유전자 전체에서 발견되고 있다. 일부 변이에서는, PrP의 N말단에 있는 옥타펩티드 반복 영역의 확장이 확인된다. 그 외, 유전성 프리온병의 원인으로 확인된 변이의 코돈 번호로는 102, 117, 198 (이상, 게르스트만-슈트라우슬러-샤잉커 증후군), 178, 200, 210, 232 (이상, 크로이츠펠트-야코프병), 178 (치명적 가족성 불면증) 등이 있다.
프리온병의 원인은 산발적인 것, 유전적인 것, 감염성인 것, 또는 이들의 복합적인 것으로 다양하다. 예를 들어, 스크래피에 감염되기 위해서는 감염성 인자와 감염되기 쉬운 유전자형이 모두 존재해야 한다.[204]
9. 균류에서의 프리온
프리온형 행동을 보이는 단백질은 일부 진균에서도 발견되는데, 이는 포유류 프리온을 이해하는 데 유용했다. 진균 프리온은 항상 숙주에게 질병을 일으키는 것은 아니다.[118] 효모에서는 프리온 형태로의 단백질 재접힘이 샤페론 단백질인 Hsp104에 의해 지원된다.[119] 알려진 모든 프리온은 단백질이 촘촘하게 쌓인 베타 시트로 구성된 응집체로 중합되는 아밀로이드 폴드의 형성을 유도한다. 아밀로이드 응집체는 섬유질이며, 끝에서 성장하며, 분열로 인해 두 개의 성장 끝이 네 개의 성장 끝이 될 때 복제된다. 프리온 질환의 잠복기는 프리온 복제와 관련된 지수 성장 속도에 의해 결정되며, 이는 응집체의 선형 성장과 파괴 사이의 균형이다.[120]
1990년대 초, 리드 위크너는 프리온 단백질을 소위 출아 효모 ''Saccharomyces cerevisiae''에서 발견했다. 이후 다른 프리온이 ''Podospora anserina''라고 불리는 균에서 발견되었다. 이러한 프리온은 PrP와 유사한 동태를 보이지만, 일반적으로 숙주에 대해서는 비독성이다. 화이트헤드 연구소의 수잔 린드퀴스트 그룹은 균류의 프리온 중 일부는 어떠한 병증도 일으키지 않고 오히려 유익한 역할을 할 가능성이 있다고 주장하고 있다. 한편, 미국 국립 보건원(NIH)의 연구자 그룹은 균류의 프리온은 질병 상태로 간주해야 한다고 강력하게 주장하고 있다[205]。균류의 프리온이 질병인지, 아니면 어떤 기능을 위해 태어난 진화의 산물인지, 이 문제는 아직 해결되지 않았다[206]。
진균 프리온에 대한 연구는 단백질-단독 개념에 강력한 지지를 제공했는데, 프리온 상태의 세포에서 추출한 정제된 단백질이 정상 형태의 단백질을 ''in vitro''에서 잘못 접힌 형태로 변환하고, 그 과정에서 프리온 상태의 서로 다른 변종에 해당하는 정보를 보존하는 것이 입증되었기 때문이다. 또한 프리온으로의 변환을 촉진하는 단백질 내 영역인 프리온 도메인에 대한 통찰력을 제공했다. 진균 프리온은 전파에 필요한 공동 인자가 부족하다는 점에서 감염성 포유류 프리온과 다르지만, 모든 프리온에 적용될 수 있는 변환 메커니즘을 제안하는 데 도움이 되었다.
| 단백질 | 자연 숙주 | 정상 기능 | 프리온 상태 | 프리온 표현형 | 식별 연도 |
|---|---|---|---|---|---|
| Ure2p | Saccharomyces cerevisiae | 질소 대사 억제자 | [URE3] | 열악한 질소 공급원에서 성장 | 1994 |
| Sup35p | S. cerevisiae | 번역 종료 인자 | [PSI+] | 무의미 억제의 증가된 수준 | 1994 |
| HET-S | Podospora anserina | 이핵체 불화합성 조절 | [Het-s] | 비호환 균주 간의 이핵체 형성 | |
| Rnq1p | S. cerevisiae | 단백질 템플릿 인자 | [RNQ+], [PIN+] | 다른 프리온의 응집 촉진 | |
| Swi1 | S. cerevisiae | 크로마틴 리모델링 | [SWI+] | 일부 탄소 공급원에서 열악한 성장 | 2008 |
| Cyc8 | S. cerevisiae | 전사 억제자 | [OCT+] | 여러 유전자의 전사 탈억제 | 2009 |
| Mot3 | S. cerevisiae | 핵 전사 인자 | [MOT3+] | 혐기성 유전자의 전사 탈억제 | 2009 |
| Sfp1 | S. cerevisiae | 추정 전사 인자 | [ISP+] | 안티억제 | 2010[125] |
10. 다른 질병에서의 역할
프리온 유사 도메인은 다양한 다른 포유류 단백질에서 발견되었다.[128] 이러한 단백질 중 일부는 근위축성 측삭 경화증(ALS), 유비퀴틴 양성 봉입체를 동반한 전두측두엽 치매(FTLD-U), 알츠하이머병, 파킨슨병, 헌팅턴병과 같은 연령 관련 신경퇴행성 질환의 발생에 관여하는 것으로 알려져 있다.[128][129][11] 또한 결핵, 크론병, 류마티스 관절염, HIV/AIDS와 같은 염증성 및 감염성 질환이 있는 인간과 동물에게서 발생하는 AA 아밀로이드증을 포함한 일부 형태의 전신 아밀로이드증에도 관여한다. AA 아밀로이드증은 프리온 질환과 마찬가지로 전염될 수 있다.[130] 이는, 그렇지 않으면 무해한 단백질이 소수의 잘못 접힌 핵 형성 단백질에 의해 병원성 형태로 변환될 수 있다는 '프리온 패러다임'을 낳았다.[131]
생물정보학적 스크린은 250개 이상의 인간 단백질이 프리온 유사 도메인(PrLD)을 포함하고 있다고 예측했다. 이러한 도메인은 PrP 및 알려진 곰팡이 단백질과 동일한 전염성, 아밀로이드 생성 특성을 갖는 것으로 추정된다. 유전자 발현 및 RNA 결합에 관여하는 단백질은 다른 종류의 단백질에 비해 특히 PrLD가 풍부한 것으로 보인다. 특히, RNA 인식 모티프를 가진 210개의 알려진 단백질 중 29개가 추정되는 프리온 도메인을 가지고 있다. 한편, 이러한 RNA 결합 단백질 중 일부는 ALS, FTLD-U, 알츠하이머병 및 헌팅턴병의 경우에 병원성으로 독립적으로 확인되었다.[133]
프리온 및 프리온 유사 도메인을 가진 단백질의 병원성은 자가 템플릿 능력과 그 결과로 생기는 아밀로이드 섬유의 기하급수적인 증식에서 기인한다고 가정한다. 퇴행성 질환 환자에게서 아밀로이드 섬유의 존재가 잘 기록되어 왔다. 이러한 아밀로이드 섬유는 자가 증식하고 매우 안정적이며 기능이 없는 응집체를 형성하는 병원성 단백질의 결과로 여겨진다.[133]
구체적으로, RNA 결합 단백질인 TDP-43의 응집은 ALS/MND 환자에게서 발견되었으며, 이러한 단백질을 코딩하는 유전자의 돌연변이가 ALS/MND의 가족성 사례에서 확인되었다. 이러한 돌연변이는 단백질이 프리온 유사 형태로 잘못 접히는 것을 촉진한다. TDP-43의 잘못 접힌 형태는 영향을 받은 뉴런에서 세포질 내 포함체를 형성하며 핵에서 고갈된 것으로 나타났다. ALS/MND 및 FTLD-U 외에도 TDP-43 병리는 알츠하이머병, 파킨슨병 및 헌팅턴병의 많은 사례의 특징이다. TDP-43의 잘못된 접힘은 주로 프리온 유사 도메인에 의해 유도된다.[128]
마찬가지로, 근육, 뇌, 뼈 및 운동 뉴런 퇴행의 가족성 사례에서 이질 핵 리보뉴클레오 단백질 hnRNPA2B1 및 hnRNPA1의 프리온 유사 도메인에서 병원성 돌연변이가 확인되었다. 이 단백질들의 야생형은 아밀로이드 섬유로 자가 조립하는 경향을 보이며, 병원성 돌연변이는 이러한 행동을 악화시키고 과도한 축적으로 이어진다.[135]
11. 무기화 가능성
프리온은 이론적으로 무기화된 제제로 사용될 수 있다는 우려가 제기된다.[136][137] 잠재적 치사율이 100%에 달하는 프리온은 생화학적 무기로서 효과적인 생물 무기가 될 수 있다. 하지만, 프리온의 매우 긴 잠복기는 불리한 점으로 작용한다. 장에 프리온이 지속적으로 심하게 노출되면 전반적인 발병 기간이 단축될 수 있다.[138] 전쟁에서 프리온을 사용하는 데 있어 또 다른 어려움은 탐지 및 제독이 어렵다는 점이다.[139]
12. 최근 연구 동향
나가사키 대학은 2022년 6월 15일까지 해부학 실습에 사용하기 위한 유해에서 변형 프리온 단백질이 검출되었다고 발표했다. 프리온병으로 진단되지 않은 해부 실습 유해에서 프리온이 발견되고, 동 질환으로 확정된 것은 세계 최초였다.[210]
참조
[1]
웹사이트
English pronunciation of prion
https://dictionary.c[...]
Cambridge University Press
2020-03-30
[2]
웹사이트
Definition of Prion
https://www.dictiona[...]
Random House, Inc.
2021-09-12
[3]
웹사이트
Transmissible Spongiform Encephalopathies
https://www.ninds.ni[...]
2023-04-23
[4]
웹사이트
Prion diseases
https://www.niaid.ni[...]
National Institute of Health
2018-06-20
[5]
서적
Robbins & Cotran Pathologic Basis of Disease
[6]
간행물
What Is a Prion?
https://www.scientif[...]
2018-05-15
[7]
문서
Encyclopaedia Britannica
https://www.britanni[...]
2018-05-15
[8]
논문
Molecular biology of prion diseases
1991-06
[9]
논문
Prions
1998-11
[10]
논문
Cellular prion protein mediates impairment of synaptic plasticity by amyloid-beta oligomers
2009-02
[11]
논문
Parkinson's disease and alpha synuclein: is Parkinson's disease a prion-like disorder?
2013-01
[12]
논문
The structural basis of protein folding and its links with human disease
2001-02
[13]
논문
Evidence for α-synuclein prions causing multiple system atrophy in humans with parkinsonism
2015-09
[14]
웹사이트
Stanley B. Prusiner – Autobiography
http://nobelprize.or[...]
NobelPrize.org
2007-01-02
[15]
논문
Etymologia: prion
2012-06
[16]
웹사이트
Dorland's Illustrated Medical Dictionary
http://dorlands.com/
Elsevier
2016-07-22
[17]
웹사이트
Merriam-Webster's Unabridged Dictionary
http://unabridged.me[...]
Merriam-Webster
2016-07-22
[18]
웹사이트
The American Heritage Dictionary of the English Language
https://ahdictionary[...]
Houghton Mifflin Harcourt
2016-07-22
[19]
논문
Biomedicine. A view from the top--prion diseases from 10,000 feet
https://zenodo.org/r[...]
2020-07-28
[20]
논문
Structural biology of ex vivo mammalian prions
2022-08
[21]
논문
Cellular prion protein is released on exosomes from activated platelets
2006-05
[22]
논문
NMR characterization of the full-length recombinant murine prion protein, mPrP(23-231)
https://www.zora.uzh[...]
1997-08
[23]
논문
Structure of the recombinant full-length hamster prion protein PrP(29-231): the N terminus is highly flexible
1997-12
[24]
논문
A transmembrane form of the prion protein in neurodegenerative disease
http://pdfs.semantic[...]
1998-02
[25]
서적
Prions and mad cow disease
Marcel Dekker
2020-06-02
[26]
논문
The cellular prion protein binds copper in vivo
[27]
논문
Spectroscopic and Theoretical Study of CuI Binding to His111 in the Human Prion Protein Fragment 106–115
https://pubs.acs.org[...]
2024-11-12
[28]
논문
A Yin-Yang role for metals in prion disease
https://pubmed.ncbi.[...]
2024-11-12
[29]
논문
The state of the prion
2004-11
[30]
논문
Regulation of embryonic cell adhesion by the prion protein
2009-03
[31]
논문
Prion Protein Signaling in the Nervous System—A Review and Perspective
2014
[32]
논문
Secondary structure analysis of the scrapie-associated protein PrP 27-30 in water by infrared spectroscopy
1991-08
[33]
논문
Conformational transitions, dissociation, and unfolding of scrapie amyloid (prion) protein
1993-09
[34]
논문
Conversion of alpha-helices into beta-sheets features in the formation of the scrapie prion proteins
1993-12
[35]
논문
High-resolution structure and strain comparison of infectious mammalian prions
2021-11
[36]
논문
Cryo-EM structure of anchorless RML prion reveals variations in shared motifs between distinct strains
2022-07
[37]
논문
2.7 Å cryo-EM structure of ex vivo RML prion fibrils
2022-07
[38]
논문
Cryo-EM structures of prion protein filaments from Gerstmann-Sträussler-Scheinker disease
2022-09
[39]
논문
Structural studies of the scrapie prion protein by electron crystallography
2002-03
[40]
논문
High-resolution structure and strain comparison of infectious mammalian prions
2021-11
[41]
논문
Non-genetic propagation of strain-specific properties of scrapie prion protein
1995-06
[42]
논문
Evidence for the conformation of the pathologic isoform of the prion protein enciphering and propagating prion diversity
1996-12
[43]
논문
Eight prion strains have PrP(Sc) molecules with different conformations
1998-10
[44]
논문
Cryo-EM of prion strains from the same genotype of host identifies conformational determinants
2022-11
[45]
논문
A structural basis for prion strain diversity
2023-05
[46]
논문
Cross-species transmission of CWD prions
2016
[47]
논문
Biochemistry and structure of PrP(C) and PrP(Sc)
2003-06
[48]
논문
Cell-free formation of protease-resistant prion protein
1994-08
[49]
논문
Sensitive detection of pathological prion protein by cyclic amplification of protein misfolding
2001-06
[50]
논문
Autocatalytic self-propagation of misfolded prion protein
2004-08
[51]
논문
Healthy prions protect nerves
2010-01-24
[52]
논문
Necroptosis in anti-viral inflammation
2019-01
[53]
논문
Prions as adaptive conduits of memory and inheritance
2005-06
[54]
논문
Hippocampal synaptic plasticity in mice devoid of cellular prion protein
2004-11
[55]
논문
PrPC controls via protein kinase A the direction of synaptic plasticity in the immature hippocampus
2013-02
[56]
논문
Long-term memory consolidation: The role of RNA-binding proteins with prion-like domains
2017-05
[57]
논문
Prion protein is expressed on long-term repopulating hematopoietic stem cells and is important for their self-renewal
2006-02
[58]
논문
Prion Protein PRNP: A New Player in Innate Immunity? The Aβ Connection
2017-12
[59]
논문
Structural clues to prion replication
1994-04
[60]
논문
Prionics or the kinetic basis of prion diseases
1996-12
[61]
논문
The Structure of Mammalian Prions and Their Aggregates
2017
[62]
논문
Copurification of Sp33-37 and scrapie agent from hamster brain prior to detectable histopathology and clinical disease
1991-12
[63]
논문
Proteinase-resistant prion protein accumulation in Syrian hamster brain correlates with regional pathology and scrapie infectivity
1991-09
[64]
논문
Sequential appearance and accumulation of pathognomonic markers in the central nervous system of hamsters orally infected with scrapie
1996-08
[65]
논문
Prion protein structure and scrapie replication: theoretical, spectroscopic, and genetic investigations
[66]
논문
An analytical solution to the kinetics of breakable filament assembly
2009-12
[67]
논문
Designing drugs to stop the formation of prion aggregates and other amyloids
2000-12
[68]
논문
Formation of native prions from minimal components in vitro
2007-06
[69]
논문
Cofactor molecules maintain infectious conformation and restrict strain properties in purified prions
2012-07
[70]
웹사이트
90. Prions
https://www.ncbi.nlm[...]
U.S. National Institutes of Health website
2002-02-14
[71]
논문
Prion Disease in Dromedary Camels, Algeria
2018-06
[72]
논문
Prion Diseases: A Review; II. Prion Diseases in Man and Animals
https://apps.kfu.edu[...]
2016-04-09
[73]
논문
Prion protein conformation in a patient with sporadic fatal insomnia
1999-05
[74]
논문
Familial spongiform encephalopathy associated with a novel prion protein gene mutation
1997-08
[75]
서적
Robbins pathologic basis of disease
Saunders
[76]
논문
Transmissible spongiform encephalopathies in humans
[77]
웹사이트
Prion Diseases
https://www.cdc.gov/[...]
US Centers for Disease Control
2006-01-26
[78]
논문
An overview of human prion diseases
2011-12
[79]
논문
The genetics of prion diseases
2010-04
[80]
논문
Prion diseases of humans and animals: their causes and molecular basis
http://pdfs.semantic[...]
[81]
논문
Variant Creutzfeldt-Jakob disease: risk of transmission by blood transfusion and blood therapies
2006-03
[82]
논문
Intracellular re-routing of prion protein prevents propagation of PrP(Sc) and delays onset of prion disease
2001-08
[83]
논문
Prion Protein Biology Through the Lens of Liquid-Liquid Phase Separation
2022-01
[84]
논문
Protein Misfolding Cyclic Amplification of Infectious Prions
2017
[85]
서적
Prion Diseases Diagnosis and Pathogeneis
Springer
[86]
논문
Prion propagation in mice expressing human and chimeric PrP transgenes implicates the interaction of cellular PrP with another protein
1995-10
[87]
논문
Oral transmissibility of prion disease is enhanced by binding to soil particles
2007-07
[88]
논문
Asymptomatic deer excrete infectious prions in faeces
2009-09
[89]
논문
Aerosols transmit prions to immunocompetent and immunodeficient mice
2011-01
[90]
논문
Retraction: Aerosols Transmit Prions to Immunocompetent and Immunodeficient Mice
2024-07
[91]
논문
Detection of prion protein in urine-derived injectable fertility products by a targeted proteomic approach
2011-03
[92]
논문
The First Meta-Analysis of the M129V Single-Nucleotide Polymorphism (SNP) of the Prion Protein Gene (PRNP) with Sporadic Creutzfeldt-Jakob Disease
https://pmc.ncbi.nlm[...]
2021-11-11
[93]
뉴스
'Surprising'' Discovery Made About Chronic Wasting Disease'
http://www.foodsafet[...]
2015-06-01
[94]
논문
Grass plants bind, retain, uptake, and transport infectious prions
2015-05
[95]
논문
Doppel: more rival than double to prion
2006-08
[96]
논문
Inactivation of transmissible spongiform encephalopathy (prion) agents by environ LpH
2004-02
[97]
논문
Methods to minimize the risks of Creutzfeldt-Jakob disease transmission by surgical procedures: where to set the standard?
2006-09
[98]
논문
Transmissible spongiform encephalopathies
2004-01
[99]
논문
New studies on the heat resistance of hamster-adapted scrapie agent: threshold survival after ashing at 600 degrees C suggests an inorganic template of replication
2000-03
[100]
웹사이트
Ozone Sterilization
http://www.hpa.org.u[...]
UK Health Protection Agency
2005-04-14
[101]
논문
Rapid chemical decontamination of infectious CJD and scrapie particles parallels treatments known to disrupt microbes and biofilms
2015
[102]
논문
Proteolysis of abnormal prion protein with a thermostable protease from Thermococcus kodakarensis KOD1
2014-03
[103]
논문
A Novel, Reliable and Highly Versatile Method to Evaluate Different Prion Decontamination Procedures
2020
[104]
논문
Transmission of prions
2002-12
[105]
논문
The Ecology of Prions
2017-09
[106]
논문
Soil humic acids degrade CWD prions and reduce infectivity
2018-11
[107]
논문
Mitigation of prion infectivity and conversion capacity by a simulated natural process--repeated cycles of drying and wetting
2015-02
[108]
논문
An Update on Autophagy in Prion Diseases
2020-08-27
[109]
논문
Enzymatic degradation of prion protein in brain stem from infected cattle and sheep
2003-12
[110]
논문
Enzymatic formulation capable of degrading scrapie prion under mild digestion conditions
2013-07-16
[111]
논문
Alkaline serine protease produced by Streptomyces sp. degrades PrP(Sc)
2004-08
[112]
논문
Enzymatic degradation of PrPSc by a protease secreted from Aeropyrum pernix K1
2012
[113]
논문
Degradation of PrP(Sc) by keratinolytic protease from Nocardiopsis sp. TOA-1
2006-05
[114]
논문
Amyloid-degrading ability of nattokinase from Bacillus subtilis natto
2009-01
[115]
논문
Microbial and enzymatic inactivation of prions in soil environments
https://linkinghub.e[...]
2013-04
[116]
논문
Decontamination of prion protein (BSE301V) using a genetically engineered protease
2009-05
[117]
논문
Degradation of the disease-associated prion protein by a serine protease from lichens
2011-05
[118]
논문
Investigating protein conformation-based inheritance and disease in yeast
2001-02
[119]
논문
Unraveling prion strains with cell biology and organic chemistry
2008-01
[120]
논문
Quantifying the kinetic parameters of prion replication
1999-03
[121]
논문
Probing the role of PrP repeats in conformational conversion and amyloid assembly of chimeric yeast prions
2007-11
[122]
논문
Blessings in disguise: biological benefits of prion-like mechanisms
2013-06
[123]
논문
Epigenetics in the extreme: prions and the inheritance of environmentally acquired traits
2010-10
[124]
논문
Prions are a common mechanism for phenotypic inheritance in wild yeasts
2012-02
[125]
논문
Non-Mendelian determinant [ISP+] in yeast is a nuclear-residing prion form of the global transcriptional regulator Sfp1
2010-06
[126]
논문
Toward Therapy of Human Prion Diseases
https://www.zora.uzh[...]
2020-03-05
[127]
웹사이트
Prion Clinic – Drug treatments
http://www.prion.ucl[...]
2017-09-13
[128]
논문
The tip of the iceberg: RNA-binding proteins with prion-like domains in neurodegenerative disease
2012-06
[129]
논문
"NEURODEGENERATION. Alzheimer's and Parkinson's diseases: The prion concept in relation to assembled Aβ, tau, and α-synuclein"
2015-08
[130]
논문
Transmission of systemic AA amyloidosis in animals
2014-03
[131]
논문
Self-propagation of pathogenic protein aggregates in neurodegenerative diseases
2013-09
[132]
논문
A systematic survey identifies prions and illuminates sequence features of prionogenic proteins
2009-04
[133]
논문
The amyloid state of proteins in human diseases
2012-03
[134]
논문
Prion protein - mediator of toxicity in multiple proteinopathies
2020-04
[135]
논문
Mutations in prion-like domains in hnRNPA2B1 and hnRNPA1 cause multisystem proteinopathy and ALS
2013-03
[136]
웹사이트
What are Biological Weapons?
https://www.un.org/d[...]
United Nations, Office for Disarmament Affairs
2021-05-21
[137]
웹사이트
Prions: the danger of biochemical weapons
http://www.scielo.br[...]
2021-05-21
[138]
웹사이트
The Next Plague: Prions are Tiny, Mysterious and Frightening
https://www.acsh.org[...]
American Council on Science and Health
2021-05-21
[139]
웹사이트
Prions as Bioweapons? - Much Ado About Nothing; or Apt Concerns Over Tiny Proteins used in Biowarfare
https://www.defencei[...]
Defence iQ
2021-05-21
[140]
웹사이트
How Prions Came to Be: A Brief History – Infectious Disease: Superbugs, Science, & Society
https://sites.duke.e[...]
2021-09-17
[141]
논문
Sheep scrapie and deer rabies in England prior to 1800
2023-12
[142]
논문
Does the agent of scrapie replicate without nucleic acid?
1967-05
[143]
논문
Self-replication and scrapie
1967-09
[144]
논문
Transmission experiments with multiple sclerosis: an interim report
1966-09
[145]
논문
The infective process in scrapie
1968-09
[146]
논문
Susceptibility of scrapie agent to ionizing radiation
1969-04
[147]
논문
Self-replication and scrapie
1967-09
[148]
서적
Prions and Mad Cow Disease
Marcel Dekker
2004-01-01
[149]
논문
Central dogma of molecular biology
1970-08
[150]
논문
The Discovery of Reverse Transcriptase
2016-09
[151]
논문
The game of name is fame. But is it science?
1986-12
[152]
논문
Novel proteinaceous infectious particles cause scrapie
https://pdfs.semanti[...]
1982-04
[153]
논문
Prion protein scrapie and the normal cellular prion protein
2016
[154]
웹사이트
The Nobel Prize in Physiology or Medicine, 1997
http://nobelprize.or[...]
NobelPrize.org
2010-02-28
[155]
웹사이트
Prions Are Forever
https://blogs.scient[...]
2021-12-28
[156]
논문
Novel proteinaceous infectious particles cause scrapie
[157]
논문
Unraveling prion strains with cell biology and organic chemistry
null
[158]
논문
Prions
[159]
논문
The structural basis of protein folding and its links with human disease
[160]
논문
Investigating protein conformation-based inheritance and disease in yeast
[161]
논문
Does the agent of scrapie replicate without nucleic acid?
[162]
논문
Self-replication and scrapie
[163]
논문
Central dogma of molecular biology
[164]
간행물
The game of name is fame. But is it science?
1986-12
[165]
웹사이트
The Nobel Prize in Physiology or Medicine 1997
https://www.nobelpri[...]
NobelPrize.org
2007-05-11
[166]
논문
A View from the Top--Prion Diseases from 10,000 Feet
http://www.sciencema[...]
2007-01-16
[167]
논문
A transmembrane form of the prion protein in neurodegenerative disease
[168]
논문
The cellular prion protein binds copper in vivo.
[169]
논문
The State of the Prion
[170]
논문
Regulation of Embryonic Cell Adhesion by the Prion Protein
[171]
논문
Conversion of alpha-helices into beta-sheets features in the formation of scrapie prion protein
http://www.pnas.org/[...]
1993-01-01
[172]
논문
Normal prion protein has an activity like that of superoxide dismutase.
[173]
논문
Prions as adaptive conduits of memory and inheritance
[174]
논문
Hippocampal synaptic plasticity in mice devoid of cellular prion protein
[175]
논문
Prion protein is expressed on long-term repopulating hematopoietic stem cells and is important for their self-renewal
null
[176]
서적
Robbins Pathologic Basis of Disease
W.B Saunders Company
[177]
논문
Transmissible Spongiform Encephalopathies in Humans
[178]
웹사이트
Prion Diseases
http://www.cdc.gov/n[...]
US Centers for Disease Control
2007-05-13
[179]
논문
Intracellular re-routing of prion protein prevents propagation of PrPSc and delays onset of prion disease
[180]
웹사이트
Active Vaccine Prevents Mice From Developing Prion Disease
http://www.scienceda[...]
2005-05-14
[181]
뉴스
Scientists Announce Mad Cow Breakthrough.
https://www.washingt[...]
The [[Washington Post]]
2007-01-01
[182]
논문
Mice devoid of PrP are resistant to scrapie
[183]
논문
Prion diseases of humans and animals: their causes and molecular basis
[184]
논문
Variant Creutzfeldt-Jakob disease: risk of transmission by blood transfusion and blood therapies
[185]
웹사이트
"90. Prions - ICTVdB Index of Viruses."
http://www.ncbi.nlm.[...]
U.S. National Institutes of Health website.
2007-09-27
[186]
간행물
"Prion Diseases: A Review; II. Prion Diseases in Man and Animals."
http://www.kfu.edu.s[...]
2007-09-27
[187]
뉴스
"BSE proteins may cause fatal insomnia."
http://news.bbc.co.u[...]
BBC News
2007-09-27
[188]
논문
Prion propagation in mice expressing human and chimeric PrP transgenes implicates the interaction of cellular PrP with another protein
[189]
논문
Oral Transmissibility of Prion Disease is Enhanced by Binding to Soil Particles
[190]
논문
Doppel: more rival than double to prion
[191]
논문
Inactivation of transmissible spongiform encephalopathy (prion) agents by environ LpH
[192]
논문
Transmissible spongiform encephalopathies
[193]
웹사이트
Agency to test method for the deactivation of prions
http://www.hpa.org.u[...]
2005-04-14
[194]
논문
Transmission of prions
[195]
논문
Methods to Minimize the Risks of Creutzfeldt-Jakob Disease by Surgical Procedures: Where to Set the Standard?
[196]
논문
Formation of native prions from minimal components in vitro
[197]
논문
Selective incorporation of polyanionic molecules into hamster prions
[198]
논문
A 25 nm virion is the likely cause of transmissible spongiform encephalopathies
[199]
뉴스
Pathogenic Virus Found in Mad Cow Cells
http://www.yale.edu/[...]
Yale
2007-02-02
[200]
논문
Cells infected with scrapie and Creutzfeldt–Jakob disease agents produce intracellular 25-nm virus-like particles
http://www.pnas.org/[...]
2007-02-06
[201]
서적
Prion Disease
Humana Press
[202]
웹사이트
Normal Function of Prions, Statement to the BSE Inquiry
http://www.bseinquir[...]
2009-11-14
[203]
논문
A cellular gene encodes scrapie PrP 27-30 protein
[204]
웹사이트
Genetics of Scrapie resistance in sheep
http://www.ansci.wis[...]
2009-11-14
[205]
논문
Probing the role of PrP repeats in conformational conversion and amyloid assembly of chimeric yeast prions
http://www.jbc.org/c[...]
[206]
논문
Prions, protein homeostasis, and phenotypic diversity
[207]
논문
Hot spots in prion protein for pathogenic conversion
http://www.pnas.org/[...]
2007-07-17
[208]
서적
Deadly Feasts: Tracking the Secrets of a Terrifying New Plague
Simon & Schuster
[209]
문서
The Pathological Protein: Mad Cow, Chronic Wasting, and Other Deadly Prion Diseases
Springer
[210]
웹사이트
世界初、プリオンが解剖実習の遺体から発見される 感染の危険も
https://news.livedoo[...]
2024-09-19
[211]
문서
아밀로이드 접힘
[212]
논문
The structural basis of protein folding and its links with human disease
[213]
문서
흔히 볼 수 있는 Saccharomyces cerevisiae
[214]
논문
Investigating protein conformation-based inheritance and disease in yeast
[215]
저널
Transmissible spongiform encephalopathies
[216]
서적
A View from the Top--Prion Diseases from 10,000 Feet
[217]
논문
A transmembrane form of the prion protein in neurodegenerative disease
[218]
논문
Copper binding to the N-terminal tandem repeat regions of mammalian and avian prion protein
[219]
논문
The State of the Prion
[220]
문서
뭉뚱그려서 transmissible spongiform encephalopathies(TSEs)라고 불린다
[221]
문서
이 방법은 유기물을 이산화탄소, 물, 질소, 산화질소, 산화인, 아황산가스 등으로 분해한다
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com