활동전위
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
활동전위는 세포막을 가로지르는 전압 변화로, 신경 세포를 포함한 다양한 생물체의 세포에서 나타나는 현상이다. 19세기에는 신경 조직의 전기 신호 전파 연구를 통해 활동전위의 전기적 특성이 처음 확인되었고, 20세기에는 전압 클램프 기술과 패치 클램프 기술을 통해 이온 채널의 역할과 활동전위의 메커니즘이 밝혀졌다. 활동전위는 탈분극, 재분극, 과분극 과정을 거치며, 전압 개폐 이온 채널, 특히 나트륨 및 칼륨 이온 채널의 개폐에 의해 발생한다. 활동전위는 축삭을 따라 전도되며, 축삭의 직경과 수초화 여부에 따라 전도 속도가 달라진다. 신경계에서 빠른 신호 전달을 위해 도약 전도가 사용되며, 미엘린 수초가 있는 뉴런은 랑비에 결절을 통해 활동전위를 빠르게 전달한다. 활동전위는 동물뿐만 아니라 식물에서도 나타나며, 식물에서는 염소 이온의 방출을 통해 탈분극이 일어난다. 활동전위는 생물체 내에서 빠르고 먼 거리에 걸쳐 신호를 전달하는 중요한 기능을 하며, 뇌 과학, 심장학 등 다양한 분야에서 연구되고 있다.
1791년 루이지 갈바니가 개구리 해부를 통해 동물 전기의 존재를 처음으로 관찰했다.[186] 갈바니의 발견은 알레산드로 볼타에게 영향을 주었고, 볼타는 최초의 전지인 볼타 전지를 개발하여 동물 전기와 직류 전압에 대한 생리학적 반응을 연구했다.[187]
활동전위 측정에는 여러 가지 실험적 방법이 사용되었다. 1955년 이전의 초기 연구는 단일 뉴런이나 축삭의 신호를 분리하고, 빠르고 민감한 전자 장치를 개발하며, 단일 세포 내부의 전압을 기록할 수 있을 정도로 작은 전극을 만드는 세 가지 목표에 초점을 맞추었다.
동물, 식물, 균류의 세포막은 전위차(전압)를 유지하는데, 이를 막 전위라 한다. 동물 세포의 전형적인 막 전위는 -70mV로, 세포 내부가 외부에 비해 음전압을 띤다. 대부분의 세포에서 막 전위는 일정하지만, 뉴런과 근육 세포처럼 전기적으로 활동적인 세포는 전압이 변화한다. 이러한 전압 변화 중 급격한 상승과 하강을 보이는 주기를 활동전위라고 한다.
뉴런의 축삭 언덕(축삭과 세포체가 만나는 부분)은 세포막에 전압 개폐 이온 채널이 많이 분포되어 있어 활동전위가 시작되는 지점이다. 활동전위는 세포막을 따라 전파되는 전기적 신호로, 신경계에서 정보를 전달하는 중요한 역할을 한다.
2. 역사
19세기에는 신경 다발에서 일어나는 전기 신호 전파에 대한 연구가 진행되었고, 신경 조직이 서로 연결된 망이 아니라 개별 세포로 구성되어 있다는 사실이 밝혀졌다. 카를로 마테우치는 세포막 안팎에 전압이 형성되어 직류 전류를 생성할 수 있음을 증명했다. 에밀 뒤 부아레몽은 1848년 마테우치의 연구에 영향을 받아 활동전위의 전기적 특성을 처음으로 확인했다.[90] 1850년 헤르만 폰 헬름홀츠는 활동전위의 전도 속도를 측정했다.[91] 산티아고 라몬 이 카할은 카밀로 골지가 개발한 염색법을 이용하여 뉴런의 다양한 형태를 밝혔고, 이들은 1906년 노벨 생리학·의학상을 수상했다.[188]
20세기는 전기생리학의 발전기였다. 1902년과 1912년에 율리우스 베른슈타인은 축삭 막의 이온 투과성 변화가 활동전위 발생의 원인이라는 가설을 제시했다.[189] 1949년 앨런 호지킨과 베르나르트 카츠는 베른슈타인의 가설을 발전시켜 나트륨 이온의 중요성을 밝혔다.[192] 1952년 호지킨, 카츠, 앤드루 헉슬리는 전압 클램프 기술을 이용하여 활동전위의 이온 메커니즘을 규명하고, 호지킨-헉슬리 모델을 제시했다.[98] 이들은 1963년 노벨 생리학·의학상을 수상했다.
1970년대 에르빈 네어와 베르트 자크만은 패치 클램프 기술을 개발하여 단일 이온 채널의 활동을 측정하는 데 성공했다.[99] 이들은 1991년 노벨 생리학·의학상을 수상했다. 20세기 후반 및 21세기 초, X선 결정법, 형광 측정법, 극저온 전자 현미경 등의 기술 발전으로 이온 채널의 구조와 기능에 대한 이해가 더욱 깊어졌다.
3. 측정 방법
오징어의 한 속인 ''Loligo'' 뉴런의 거대 축삭은 이러한 초기 연구에 중요한 역할을 했다.[175] 이 축삭은 지름이 약 1mm로 매우 커서 육안으로도 관찰이 가능하며, 추출 및 조작이 용이했다.[194][176]
전압 클램프의 개발은 활동전위를 일으키는 이온 흐름을 분리하여 연구하고, 막의 전기 용량에 의한 잡음을 제거하는 데 결정적인 역할을 했다.[177] 패러데이 새장과 고입력 임피던스를 가진 전기 장치 등 전자공학적 발전은 측정 자체로 인한 전압 영향을 최소화했다.
1949년 유리 마이크로피펫 전극이 발명되면서 단일 축삭 내 전압을 정밀하게 기록할 수 있게 되었다.[178] 이 전극은 끝이 100 Å(10 nm)에 불과할 정도로 작게 개선되어 고입력 임피던스를 제공했다.[181]
1970년대 에르빈 네어와 베르트 자크만이 개발한 패치 클램프는 단일 이온 채널의 전기적 특성 연구를 가능하게 했다.[183] 이들은 이 공로로 1991년 노벨 생리학·의학상을 수상했다.
최근에는 광학 영상 기술이 발전하여 활동전위를 동시에 여러 지점에서 측정하거나 초고해상도로 기록할 수 있게 되었다. 전압 민감성 염료를 이용하면 심근세포 막의 작은 부분에서 활동전위를 광학적으로 기록할 수 있다.[184]
EOSFET을 포함한 뉴로칩이나 Ca2+에 민감한 염료를 이용한 광학적 기록도 가능하다.[182]
활동전위 측정 방법은 다음과 같이 요약할 수 있다.측정 방법 설명 세포 내 전극 (Intracellular Electrode) 세포 내부에 미세 전극을 삽입하여 막 전위 변화를 직접 측정 패치 클램프 (Patch Clamp) 세포막의 작은 부분을 유리 전극으로 흡착하여 단일 이온 채널의 전류를 측정 광학적 방법 (Optical Method) 형광 염료를 사용하여 세포막 전위 변화를 빛의 변화로 측정 뉴로칩 (Neurochip) 반도체 기술을 이용하여 제작된 미세 전극 배열을 통해 여러 뉴런의 활동전위를 동시에 측정
4. 막 전위
세포의 전기적 특성은 세포막의 구조에 의해 결정된다. 세포막은 지질 이중층에 단백질 분자가 삽입된 형태로, 지질 이중층은 전하를 띤 이온의 이동에 저항하여 절연체 역할을 한다. 반면, 막에 삽입된 단백질은 이온이 막을 통과할 수 있는 채널을 제공한다. 활동 전위는 세포 내부와 외부 간의 전압 차이에 따라 닫히거나 열리는 전압 개폐 이온 통로 단백질에 의해 유도된다.
세포 안팎의 전위차는 세포 내외의 이온 분포와 세포막의 이온 투과성에 의해 발생한다. 활성화되지 않은 정지 상태의 세포는 세포 외부에 비해 세포 내부 전위가 음(-)의 값을 가지는데, 이를 막이 분극되었다고 한다. 활동전위는 이러한 전위차가 자극에 의해 일시적으로 역전되는 현상으로, 스파이크 또는 임펄스라고도 불린다. 활동전위의 속도와 복잡성은 세포마다 다르지만, 전위 역전의 폭은 거의 같다.
활동전위는 탈분극, 재분극, 과분극 단계를 거치며, 심장 박동 조절 세포와 같은 특수 세포에서는 중간 전압의 플라토 상이 존재하여 활동전위 지속 시간을 연장한다. 활동전위는 세포막 위를 이동하며, 척수에서 다리 근육까지 신호를 전달하는 것처럼 장거리 축삭을 따라 이동하기도 한다. 활동전위 발생에는 일반적으로 전압 의존성 Na+ 채널이 필수적이며, 이러한 채널이 없는 세포나 부위에서는 활동전위가 발생하지 않는다.
4. 1. 정지 전위
동물, 식물, 균류의 세포막은 전위차(전압)를 유지하는데, 이를 막 전위라 한다. 활동 전위에 대해 알기 위해서는 먼저 정지 막 전위(정지 전위)에 대해 대략적으로 알아야 한다.
모든 세포의 막 안팎에 존재하는 전위차는 일반적으로 세포 바깥쪽에 비해 세포 안쪽이 음(-)의 값을 가진다. 이러한 상태를 막이 분극되어 있다고 한다. 활동하지 않는 상태에 있는 막의 전위차를 정지 전위라고 부르며, 신경 세포에서는 대략 -70mV이다(세포 바깥쪽의 전위를 0으로 한다). 이러한 전위차가 발생하는 요인은 몇 가지가 있지만, 가장 중요한 것은 막 사이의 이온 수송과 선택적인 이온 투과성이다. 농도 기울기를 유지하는 요인은 Na+-K+ 펌프이지만, 정지 전위의 값을 결정하는 큰 요인은 K+ 누출 채널이다.
Na+과 K+은 열린 이온 채널을 통해 전기화학적 기울기의 영향 아래에서 확산된다. 일반적으로 세포막에서 K+의 투과성은 Na+의 투과성보다 75배 크다. 이는 K+ 누출 채널이 항상 열려 있기 때문이다. 정지 전위가 -70mV로, Na+의 평형 전위 +45mV보다 K+의 평형 전위 -90mV에 가까운 값을 가지는 것은 이러한 투과성의 차이가 주된 요인이다.
정지 전위와 마찬가지로, 많은 신경의 활동 전위는 Na+과 K+의 투과성에 의존한다. 정지 전위에서 일부 K+ 누설 채널은 열려 있는 반면, 전압 의존성 Na+ 채널은 닫혀 있다. 순 전류는 흐르지 않지만, 막 사이를 이동하는 주요 이온은 K+이며, 그 결과 정지 전위는 K+ 평형 전위에 비교적 가까운 값을 갖는다.
4. 2. 농도 기울기 형성
나트륨-칼륨 펌프는 ATP를 사용하여 세포 내부의 나트륨 이온(Na+)을 밖으로, 칼륨 이온(K+)을 안으로 능동 수송한다. 이 펌프는 세포 밖으로 3개의 Na+을 내보내고, 세포 안으로 2개의 K+을 들여보내 세포 안팎의 이온 농도 기울기를 형성한다.[7]
4. 3. 정지 전위 형성
활동 전위에 대해 알기 위해서는 먼저 정지 막전위(정지 전위)에 대해 대략적으로 알아야 한다.
모든 세포의 막 안팎에 존재하는 전위차는 일반적으로 세포 외에 비해 세포 내 쪽이 마이너스(-)이다. 이 상태를 막이 분극되어 있다고 한다. 활동하지 않는 상태에 있는 막의 전위차는 정지 전위라고 불리며, 신경 세포에서는 대략 -70mV이다(세포 바깥쪽의 전위를 0으로 한다). 이러한 전위차가 발생하는 요인은 몇 가지가 있지만, 가장 중요한 것은 막 사이의 이온 수송과 선택적인 이온 투과성이다.
농도 기울기를 유지하는 요인은 Na+-K+ 펌프이지만, 정지 전위의 값을 지배하는 큰 요인은 K+ 누출 채널이다.
Na+과 K+은 열린 이온 채널을 통해 전기화학적 기울기의 영향 아래에서 확산된다. 일반적으로 세포막에서 K+의 투과성은 Na+의 투과성보다 75배 크다. 이는 K+ 누출 채널이 항상 열려 있기 때문이다. 정지 전위가 -70mV로, Na+의 평형 전위 +45mV보다 K+의 평형 전위 -90mV에 가까운 값을 가지는 것은 이러한 투과성의 차이가 주된 요인이다.
정지 전위와 마찬가지로, 많은 신경의 활동 전위는 Na+과 K+의 투과성에 의존한다.
정지 전위에서 일부 K+ 누설 채널은 열려 있는 반면, 전압 의존성 Na+ 채널은 닫혀 있다. 순 전류는 흐르지 않지만, 막 사이를 이동하는 주요 이온은 K+이며, 그 결과 정지 전위는 K+ 평형 전위에 비교적 가까운 값을 갖는다.
5. 활동 전위의 메커니즘
활동전위는 크게 탈분극, 재분극, 과분극의 세 단계로 나눌 수 있으며, 각 단계는 특정 이온 채널의 개폐와 이온 투과성의 변화에 의해 조절된다.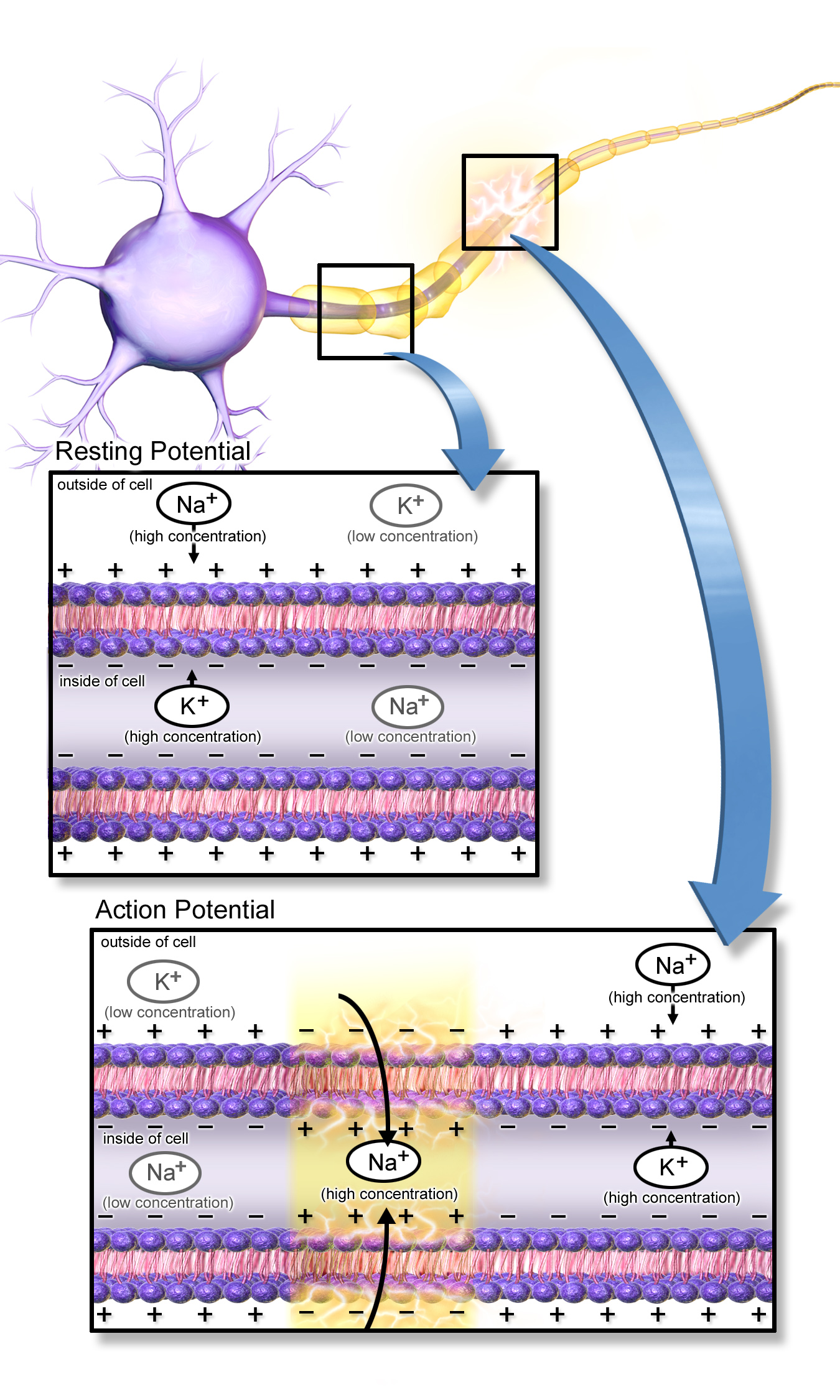
활동전위 발생에는 전압 개폐 나트륨 채널과 전압 개폐 칼륨 채널이 중요한 역할을 한다. 이 채널들은 평소에는 닫혀 있다가 막 전위가 특정 수준(역치 전위) 이상으로 상승하면 열리는 특성을 가지고 있다.
전압 개폐 이온 채널은 막에 박혀있는 단백질 집단으로 다음과 같은 세 가지 특성을 지닌다.[8]
# 한 개 이상의 입체형태를 가진다.
# 최소 한 개의 입체형태는 특정한 이온이 막을 통과하도록 한다.
# 한 입체형태에서 다른 입체형태로 전이(transition영어)는 막 전위의 영향을 받는다.
전압 개폐 이온 채널은 특정한 막 전위값에서 열리고 닫히며, 막 전위와 채널 상태 사이의 관계는 확률론적이고 개폐에 시간차가 존재한다. 막 전위는 전이 속도와 단위 시간당 각 입체형태일 확률을 결정한다.
활동전위의 발생 빈도는 '''발화율'''이라 하며, 활동전위의 크기와 지속 시간, 형태는 흥분하는 막의 특성에 대부분 의존한다. 이러한 실무율 특성은 수용기 전위, 전기긴장성 전위, 시냅스 전위 등 자극의 세기에 따라 증감하는 다단계 전위와 구별된다.[126]
활동전위는 막의 흥분성 부분에서 국소적으로 만들어지지만, 휴지 상태의 이온 흐름도 인접한 막의 연장선에서 활동전위를 유발하고 도미노처럼 퍼지게 할 수 있다. 수동적으로 퍼지는 전기긴장성 전위와 반대로, 활동전위는 흥분이 막을 따라 뻗어가면서 계속 새로 만들어지고 감소하지 않는다.[126]
활동전위에 관여하는 주요 이온은 나트륨과 칼륨 양이온이다. 활동전위 동안 나트륨 이온은 세포 안으로, 칼륨 이온은 세포 밖으로 이동하여 평형을 유지하며, 막 안팎의 이온 농도 변화는 무시할 수 있을 정도로 작다.[126]
활동전위의 크기는 전위를 생성하는 전류의 세기와 무관하며, 완전히 일어나거나 아예 일어나지 않거나 둘 중 하나이다.[129][130][131] 이러한 특성을 '''실무율'''(all-or-none영어)이라고 한다.
5. 1. 탈분극 (Depolarization)
뉴런에 시냅스 자극이 오면, 막은 탈분극(막 전위가 상승)되거나 과분극(막 전위가 감소)된다.[7] 활동전위는 막이 충분히 탈분극되어 역치 전위에 도달하면 발생한다.[7] 역치를 넘어선 탈분극은 막 전위를 급격하게 상승시키며(+100mV까지 도달하기도 함), 이후 급격히 감소하여 휴지 전위 아래까지 떨어졌다가 일정 시간 유지된 후 휴지 전위로 돌아온다.[7]
활동전위는 세포막에 있는 특별한 전압 개폐 이온 채널에 의해 일어난다.[7] 전압 개폐 이온 채널은 막 전위의 영향을 받아 한 입체형태에서 다른 입체형태로 전이(transition영어)된다.[7] 전압 개폐 이온 채널은 양성 피드백 고리로 활동전위를 만들어낸다.[7] 막 전위는 이온 채널의 상태를, 이온 채널은 막 전위를 통제한다.[7] 특정 상황에서 막 전위가 올라가면 이온 채널이 열리고, 이로 인해 막 전위가 더욱 상승한다.[7] 활동전위는 양성 피드백 주기가 폭발적으로 진행될 때 일어난다.[7]
가장 널리 연구되는 전압 의존성 이온 채널은 빠른 신경 전도에 관련된 나트륨 채널이다.[7] 막 전위가 올라감에 따라 나트륨 이온 채널이 열려 세포 내로 나트륨 이온이 들어온다.[7] 나트륨 이온의 유입은 양전하를 띤 양이온의 농도를 증가시켜 휴지 전위보다 높은 전위 상태인 탈분극을 유발한다.[7] 휴지 전위보다 15mV 높은 역치 전위를 지나 더 상승하면 나트륨 흐름이 더 우세해진다.[7] 그 결과 양성 피드백으로 나트륨 흐름은 나트륨 채널을 더 많이 활성화한다.[7] 따라서 세포는 발화하여 활동 전위를 만든다.[7]
활동전위는 일반적으로 시냅스전 뉴런에서 온 흥분성 시냅스후 전위에 의해 시작된다.[7] 신경전달물질 분자는 시냅스전 뉴런에서 방출되어 시냅스후 세포의 수용체에 결합하고, 그 결과 다양한 이온 채널이 열린다.[7] 신경전달물질이 수용체에 결합하여 전압을 증가시키면(막이 탈분극) 시냅스는 흥분한다.[7] 대개는 흥분성 전압의 일부만 축삭 언덕에 닿고 막을 탈분극시켜 드물게 새로운 활동전위를 일으킨다.[7] 가장 일반적으로는 여러 시냅스에서 온 흥분성 전위가 거의 동시에 함께 작용하여 새로운 활동전위를 일으킨다.[7]
5. 2. 정점 (Peak)
막 전위가 최고점에 도달하면, 전압 개폐 나트륨 채널이 불활성화되어 나트륨 이온(Na+)의 유입이 중단된다. 동시에, 전압 개폐성 칼륨 채널이 열려 칼륨 이온(K+)이 세포 밖으로 유출되기 시작한다. 이러한 나트륨 및 칼륨 투과성 변화는 막 전압 ''Vm''을 빠르게 떨어뜨려 재분극을 일으키고, 활동전위는 하강기에 접어든다.
5. 3. 재분극 (Repolarization)
전압 의존성 K+ 채널이 열리면, 농도 기울기와 전기적 기울기가 추진력으로 작용하여 K+가 세포 밖으로 유출된다. K+ 유출은 막 전위의 역전과 재분극을 일으킨다. 전압 개폐성 칼륨 채널은 느리게 닫히는 특성 때문에, 막 전위는 휴지 전위보다 더 낮은 값(과분극)까지 떨어진다. 이 과분극 상태를 후기 과분극(afterhyperpolarization영어 혹은 undershoot영어)이라고 한다.
5. 4. 과분극 (Hyperpolarization)
막 전위가 상승함에 따라, 나트륨 이온 채널이 열려 나트륨 이온이 세포 내로 들어온다. 이어서 칼륨 이온 채널이 열려 칼륨 이온이 세포 바깥으로 빠져나간다. 활동전위의 최고점에서 나트륨 채널은 닫히고 칼륨 채널은 계속 열려있어 칼륨이 세포 밖으로 나간다. 칼륨 이온의 유출로 막 전위가 감소하고 세포는 과분극된다.[126] 이 지점에서는 칼륨 흐름이 나트륨 보다 많아 전위는 약간 상승하고 정상적인 휴지 전위(대개 -70 mV)에 도달한다.[126]
올라간 전압은 칼륨 채널을 평소보다 더 많이 열고, 칼륨 채널 중 일부는 막이 평소의 휴지 전압으로 돌아가도 곧바로 닫히지 않는다. 또한 활동전위 동안 유입된 칼슘 이온에 반응하여 SK 채널이 추가적으로 열린다. 칼륨의 투과성은 일시적으로 매우 높아지고 막 전위 Vm는 칼륨 평형 전위인 EK에 더욱 가까워진다. 이로 인하여 과분극이 일어나고 이를 후기 과분극(afterhyperpolarization영어 혹은 undershoot영어)이라 한다. 칼륨 투과성이 원래 값으로 회복되면 정상 휴지 전위값으로 돌아온다.[126]
전압 의존성 K+ 채널의 폐쇄는 전압 및 시간에 의존한다. 이 채널은 막 전위의 변화에 즉시 반응하지 않고, 늦게 반응을 반환한다. 그렇기 때문에, 막이 충분히 재분극된 후에도 K+의 유출이 계속되어 일시적으로 막 전위가 통상의 정지 전위보다 더욱 낮아진다. 이 과분극 상태는 언더슛이라고도 불린다.
이 외에도, Cl- 채널의 개구에 의해 Cl-이 세포 내로 유입되는 것으로도 과분극을 일으킨다. 예로, 벤조디아제핀계의 수면제나 항불안제 등이 있다. 벤조디아제핀계 약물은 γ-아미노낙산GABAA 수용체-Cl- 채널 복합체의 벤조디아제핀 결합 부위에 결합하여 GABAA 수용체에 대한 γ-아미노낙산의 친화성을 높임으로써, Cl- 채널을 통한 Cl-의 세포 내 유입을 촉진하므로, 세포가 과분극을 일으키고 신경의 흥분을 억제한다.
5. 5. 불응기 (Refractory Period)
활동전위 발생 직후, 일정 시간 동안 새로운 활동전위가 발생하기 어려운 시기를 불응기라고 한다. 불응기는 절대 불응기와 상대 불응기로 나뉜다.[129][130][131] 불응기는 나트륨 채널과 칼륨 채널 분자의 상태 변화로 인해 생긴다. 활동전위가 끝날 때 나트륨 채널은 차단형(inactivated state)이 되면서 닫힌다. 차단형 나트륨 채널은 막 전위에 관계없이 열릴 수 없는 상태로 이 시기가 절대적 불응기에 해당한다.
상대적 불응기에는 활동 전위가 발생하기 어려운 두 가지 원인이 있다.
1. 세포가 약간 과분극 상태에 있다. 이는 K+의 투과성이 정지 상태일 때보다 큰 상태로 유지되기 때문이다. 이 때문에, 역치 전위에 도달하기 위해서는 더 큰 전위 변화가 필요하다.
2. 일부 Na+ 채널이 아직 불활성화 상태이기 때문에 역치 전위 자체가 상승한다.
절대적 불응기가 있어서 활동전위는 축삭을 따라 한 방향으로만 전파된다.[129] 어떤 특정한 순간에 활동전위가 치솟는 부분 바로 뒤의 축삭은 불응기이고, 앞쪽은 활동전위를 일으킨 적이 없어서 불응기에 있지 않기 때문에 탈분극에 의해 활성화될 수 있다.
흔히 오해하지만, Na+/K+ 펌프는 전위 변화에 기여하지 않는다. Na+/K+ 펌프는 농도 기울기를 유지함으로써 정지 전위 유지에 기여한다고 말할 수 있지만, 채널에 비하면 시간 규모(time scale)가 길고, 전위 변화와 관련된 투과성에 미치는 영향은 채널에 비하면 무시할 수 있을 정도로 작다.
; 전압 의존성 Na+ 채널
: 전압 의존성 Na+ 채널은 두 개의 게이트를 가지고 있다. Na+은 이 두 게이트가 모두 열려야 세포 내로 유입될 수 있다.
: 게이트 중 하나는 세포막의 전위에 반응하여 열리는 세포질 외 게이트(전압 의존성 게이트)로, 막이 탈분극되어 있는 동안 열려 있다. 또 다른 세포질 내 게이트(불활성화 게이트)는 일반적으로 열려 있지만, 전압 의존성 게이트가 열리면 즉시 닫힌다. 불활성화 게이트가 다시 열리는 것은 시간 의존적이며, 확률적이다. 불활성화 게이트가 닫혀 있는 동안 채널이 불활성화되어 있다고 하며, 불응기를 발생시키는 주요 원인이 된다.
6. 역치 (Threshold)
활동 전위를 발생시키기 위해 필요한 최소한의 막 전위 변화를 역치라고 한다. 일반적인 뉴런의 축삭 언덕에서 휴지 전위는 -70 mV, 역치 전위는 -55 mV 내외이다. 따라서 역치는 일반적으로 휴지 전위보다 15mV 정도 높은 값이다.[7] 뉴런에 시냅스 자극이 오면 막은 탈분극(막 전위가 상승)이나 과분극(감소)한다. 활동전위는 막이 충분히 탈분극하여 역치까지 도달하면 일어난다.
역치는 전압 개폐 나트륨 채널과 칼륨 누출 채널의 전류 크기가 같아지는 지점으로, 이 지점을 넘어서면 나트륨 전류가 칼륨 전류보다 커져 양성 피드백이 시작된다. 막 전위가 올라감에 따라 나트륨 이온 채널이 열려 세포 내로 나트륨 이온이 들어오고, 칼륨 이온 채널이 그 뒤를 이어 열려 칼륨 이온이 세포 바깥으로 빠져나간다. 휴지 전위보다 15 mV 높은 역치 전위를 지나 더 상승하면 나트륨 흐름이 더 우세해진다. 그 결과 양성 피드백으로 나트륨 흐름은 나트륨 채널을 더 많이 활성화한다. 따라서 세포는 발화하여 활동 전위를 만든다.[125]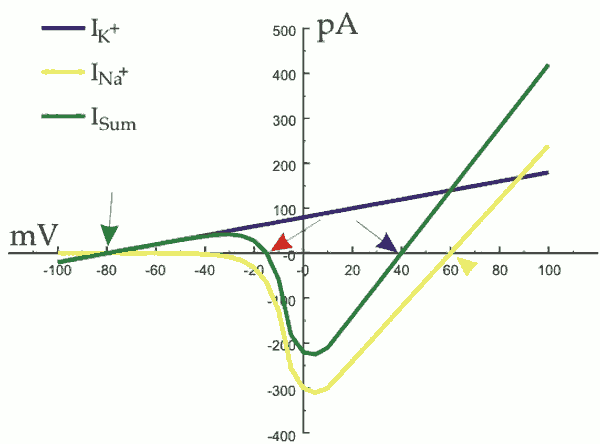
전압 개폐 나트륨 채널은 개폐가 확률적이기 때문에, 명확한 역치 전압이 존재하지 않는다.
7. 회로 모델
세포막은 전기 회로의 RC 회로(저항-축전기 회로)로 모델링할 수 있다. 이온 채널은 저항(resistor)으로 표현되며, 이 때 전압 의존성 이온 채널은 가변 저항(variable resistor), 칼륨 누출 채널은 고정 저항(fixed resistor)으로 표현된다. 지질 이중층은 축전기(capacitor)로 표현된다. 세포 안팎의 이온 농도 차이는 전압원(voltage source)으로 표현된다.[123]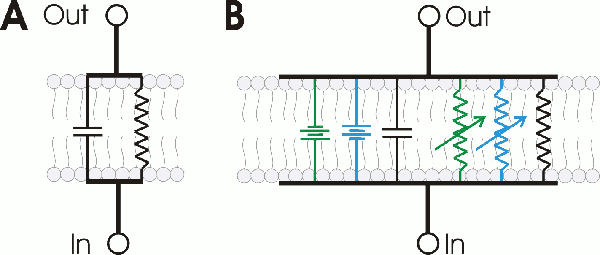
'''B.''' Na+ 채널(파랑), K+ 채널(녹색)을 포함하는 막 모델을 나타내는 더 정교한 회로.
8. 전도 (Conduction)
활동 전위는 축삭을 따라 전파되며, 이 과정을 전도라고 한다. 전도는 탈분극과 전압 개폐성 나트륨 채널의 개방이 반복되면서 일어난다. 활동 전위는 국소 회로 전류(local circuit current)를 통해 인접한 영역으로 탈분극을 확산시킨다.[136]
막 일부에서 활동전위가 일어나면 다시 발화하기 전에 막이 회복되는 시간(불응기)이 필요하다. 분자 수준에서 절대적 불응기는 전압 활성 나트륨 채널이 차단형에서 회복되어 닫힌형(불활성형)으로 돌아오는데 드는 시간에 해당한다. 뉴런에는 다양한 전압 활성 칼륨 채널이 존재하며, 일부는 빠르게 차단형으로 전이되고, 일부는 천천히 차단형으로 전이되거나 아예 전이되지 않는다. 이러한 다양성 덕분에 칼륨 채널 일부가 탈분극 과정에서 차단형이 되어도 항상 막이 재분극될 수 있는 칼륨 이온 흐름이 존재한다. 반면, 뉴런의 모든 전압 활성 나트륨 채널은 강한 탈분극 후 수 밀리초(ms) 이내에 차단형으로 전이된다. 따라서 나트륨 채널 상당수가 불활성형으로 돌아오기 전에는 다시 탈분극할 수 없다. 절대적 불응기는 발화 빈도를 제한하지만, 축삭을 따라 활동 전위가 한 방향으로만 전달되게 한다.[136] 활동 전위에서 이온 흐름은 양방향으로 전파될 수 있지만, 아직 발화되지 않은 축삭 부분만 활동 전위에 반응할 수 있다. 갓 발화한 부분은 활동 전위가 확실하게 그 범위를 벗어나 다시 자극할 수 없을 때까지 반응하지 않는다.
8. 1. 속도 (Velocity)
활동전위는 축삭 언덕에서 생성되어 축삭을 따라 파동처럼 전파된다.[136] 활동전위 동안 축삭의 한 지점에서 들어오는 이온 흐름은 축삭을 따라 퍼지면서 인접한 막을 탈분극시킨다. 탈분극이 충분히 강하면 이웃 막 부분에서도 활동전위를 일으킨다. 활동전위가 퍼지는 기초적인 기작은 앨런 로이드 호지킨이 1937년에 증명하였다. 그는 신경 절편을 부수거나 냉각시켜 활동전위를 차단한 뒤에, 차단 분절이 충분히 짧으면 차단 부위 한 쪽에 도달한 활동전위가 반대편에서 활동전위를 일으킬 수 있다는 것을 보였다.[136]활동 전위의 평균 신경 전달 속도는 1 m/s에서 100 m/s 이상으로, 일반적으로는 축삭 지름이 커질수록 속도도 증가한다.[141]
오징어는 전도 속도 향상을 위해 직경이 굵어진 거대 축삭(Giant axon)을 가지고 있다. 특히 대왕오징어의 거대 축삭은 직경이 1mm 이상이나 된다.[124]
수초가 있는 축삭은 보다 빠르게 전도할 수 있다는 장점이 있다. 최소 지름(약 1 μm)보다 큰 축삭은 수초가 많을수록 활동전위의 전도 속도가 약 10배 증가한다.[148] 예를 들어 활동전위는 수초가 있는 개구리 축삭과 수초가 없는 오징어의 거대 축삭에서 거의 같은 속도(약 25 m/s)로 이동하지만, 개구리의 축삭은 지름은 30분의 1 수준이고 단면적은 1000배나 작다.
포유류의 경우, 자율신경계의 교감 신경의 절후 신경은 무수 수초 섬유이다. 직경 2µm의 무수 수초 섬유는 대략 1m/s의 전달 속도를 보인다. 이에 비해, 같은 직경을 가진 유수 수초 섬유는 대략 18m/s의 속도를 갖는다.
8. 2. 도약 전도 (Saltatory Conduction)
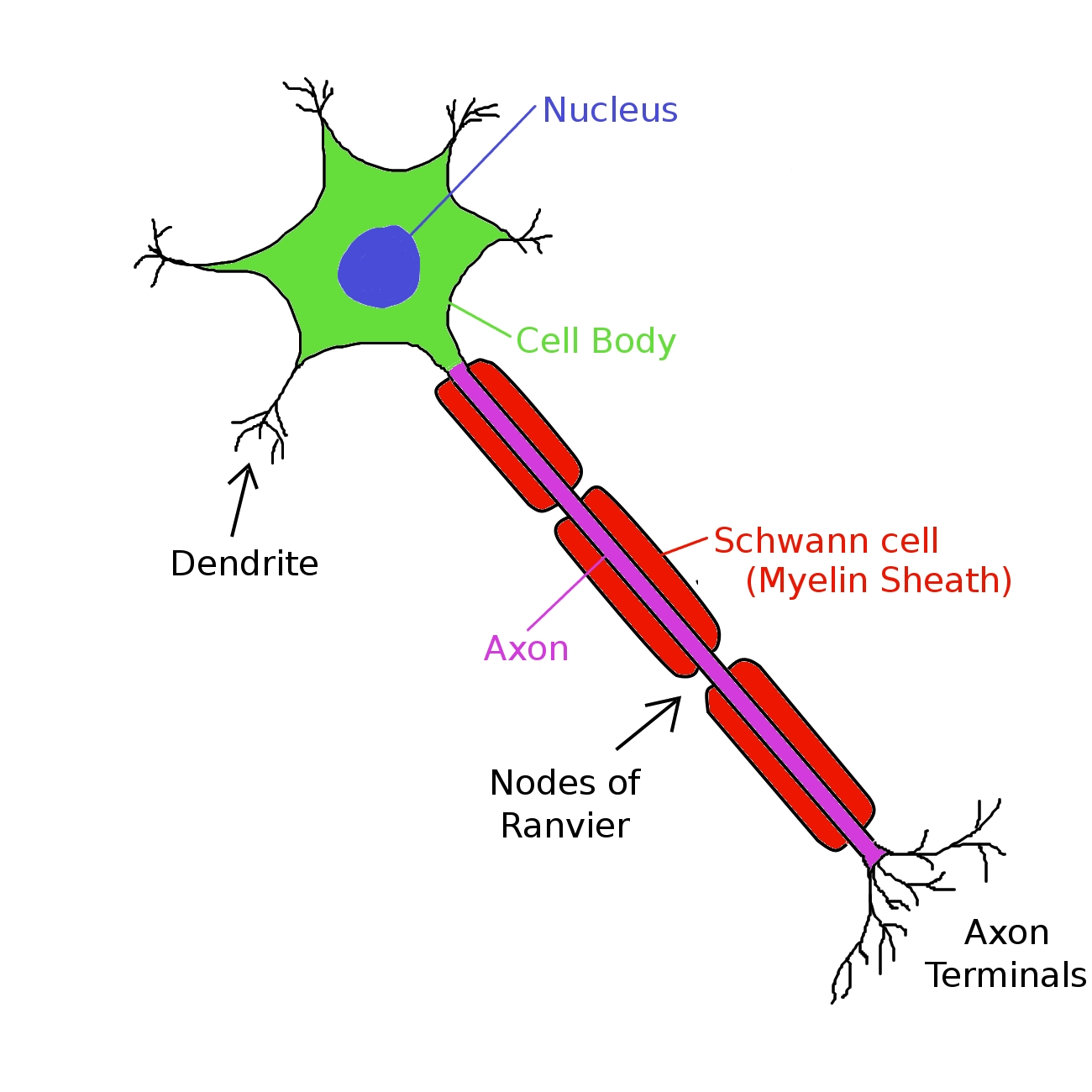
신경계에서 전기 신호를 빠르고 효율적으로 전달하기 위해 특정 뉴런에는 미엘린 수초가 존재한다. 미엘린은 여러 층으로 된 막으로, 랑비에 결절이라는 부분을 제외하고 축삭을 감싼다. 미엘린은 특수한 세포에서 생산되는데, 말초신경계에서는 슈반 세포가, 중추신경계에서는 희소돌기아교세포가 그 역할을 담당한다.[137][138][139] 미엘린 수초는 막 전기 용량을 감소시키고 랑비에 결절 사이의 저항을 증가시켜, 활동전위가 결절에서 결절로 빠르게 도약하도록 한다. 미엘린 형성은 주로 척추동물에서 나타나며, 새우 같은 십각목 갑각류에 속하는 소수의 무척추동물도 유사한 체계를 갖추고 있다.[140] 척추동물의 모든 뉴런이 수초를 가지는 것은 아니며, 자율신경계를 구성하는 뉴런의 축삭은 일반적으로 수초가 없다.
미엘린은 이온이 축삭으로 들어오거나 빠져나가는 것을 막는다. 수초가 있는 뉴런은 일반적으로 전도가 빠르고 에너지 측면에서 효율적이다. 도약 전도와 관계없이 활동전위의 평균 신경 전달 속도는 1 m/s에서 100 m/s 이상으로, 일반적으로 축삭 지름이 커질수록 속도도 증가한다.[141]
활동전위는 수초가 있는 축삭 분절의 막에는 퍼질 수 없다. 랑비에 결절 한두 개를 탈분극시킬 수 있는 이온 흐름은 세포질을 타고 이동한다. 한 결절에서 활동전위를 일으킨 흐름은 다음 결절에서도 활동전위를 일으킨다. 이렇게 결절에서 결절로 활동전위가 "깡총깡총" 이동하는 것을 도약 전도라 한다. 도약 전도 기작은 1925년 랄프 릴리(Ralph Lillie영어)가 제안하였으나,[142] 실험 증거는 타사키 이치지(田崎 一二일본어)[143]와 타케우치 타이지,[144][145] 앤드루 헉슬리와 로베르트 슈템플리(Robert Stämpflide)[146]가 처음 제시하였다. 수초가 없는 축삭에서 활동전위는 바로 인접한 막을 탈분극시키고 축삭을 따라 파동처럼 이동한다.
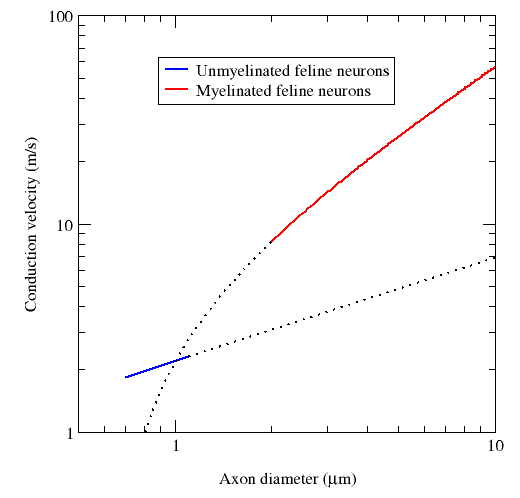
수초가 있는 축삭은 보다 빠르게 전도할 수 있고 에너지 효율이 좋다는 장점이 있다. 최소 지름(약 1 μm)보다 큰 축삭은 수초가 많을수록 활동전위의 전도 속도가 약 10배 증가한다.[148] 반대로 생각하면 주어진 전도 속도에서 수초가 있는 뉴런은 수초가 없는 뉴런에 비하여 지름이 더 작다. 예를 들어 활동전위는 수초가 있는 개구리 축삭과 수초가 없는 오징어의 거대 축삭에서 유사한 속도(약 25 m/s)로 이동하지만, 개구리의 축삭은 지름은 30분의 1 수준이고 단면적은 1000배나 작다. 이온 흐름이 랑비에 결절에만 국한되기 때문에 막 안팎으로 새나가는 이온이 훨씬 줄어들어 대사 에너지를 절감하는 효과도 있다. 사람 신경계는 전신 대사 에너지의 약 20%를 소모하기 때문에[148] 이 효과는 자연선택에서 중요한 장점으로 작용한다.
축삭의 수초가 있는 분절의 길이는 도약 전도에 중요한 요소이다. 전도의 속도를 극대화할 수 있는 만큼 길어야 하고, 그렇다고 다음 랑비에 결절에서 활동전위를 일으키지 못할 정도로 신호가 약해져서는 안 된다. 자연계에 존재하는 수초 분절은 수동적으로 전파된 신호가 최소 두 개 결절까지 이동할 수 있는 길이로, 두세 번째 랑비에 결절에서 활동전위를 일으킬 수 있는 충분한 강도가 유지된다. 따라서 결절이 일부 손상되었을 경우에도 신호 전달을 계속할 만큼 도약 전도의 안전 계수는 높다. 다만 수초가 없는 뉴런이라 하더라도 활동전위는 안전 계수가 낮은 일부 지점에서 일찍 사라질 수 있다. 축삭이 가지를 형성하여 두 개로 갈라지는 부분을 예로 들 수 있다.
미엘린 수초가 분해되어 도약 전도 능률이 떨어지고 활동전위 전도 속도가 감소하는 질병으로 가장 잘 알려진 것은 다발성 경화증이다. 수초가 분해되어 협동적인 운동 능력이 떨어진다.[150]
9. 진화적 의의
다세포 생물에서 활동 전위는 빠르고 효율적인 신호 전달을 가능하게 하여 진화적 이점을 제공한다. 활동 전위는 장거리 신호 전달, 복잡한 정보 처리, 빠른 반응 등에 중요한 역할을 한다. 예를 들어, 활동 전위의 전도 속도는 음속의 1/3 수준인 110m/s를 초과할 수 있어, 혈류를 통해 이동하는 호르몬 분자(대동맥에서 약 8m/s)보다 훨씬 빠르다.[73]
활동 전위는 실무율 특성을 가지는 신호이므로 거리에 따라 신호 강도가 감소하지 않아 디지털 전자공학과 유사한 이점을 가진다. 또한, 가지돌기에서 온 다양한 신호가 축삭 언덕에서 통합되어 역치를 넘어 복잡한 활동 전위를 생성하는 것은 생물학적 중추 패턴 발생기를 형성하고, 인공신경망에서 모방되는 연산(computation영어)의 한 형태이다.
도약 전도는 신경계의 크기를 줄이면서도 빠른 신호 전달을 가능하게 하는 진화적 이점을 제공한다.
해면동물을 제외한 대부분의 다세포생물에서 활동 전위가 발견된다는 사실은 활동 전위가 진화적으로 보존되었음을 시사한다.[73] 해면동물은 활동 전위를 전달하지 않는 주요 문에 속하지만, 전기적 신호를 가지고 있다는 연구 결과도 있다.[74] 활동 전위의 크기와 지속 시간은 진화 과정에서 크게 변하지 않았지만, 전도 속도는 축삭 지름과 미엘린 수초 형성에 따라 크게 증가했다.
| 동물 | 세포 유형 | 휴지전위 (mV) | AP 증가 정도 (mV) | AP 지속 시간 (ms) | 전도 속도 (m/s) |
|---|---|---|---|---|---|
| 오징어 (Loligo) | 거대 축삭 | −60 | 120 | 0.75 | 35 |
| 지렁이 (Lumbricus) | 중간 거대 섬유 | −70 | 100 | 1.0 | 30 |
| 바퀴벌레 (Periplaneta) | 거대 섬유 | −70 | 80–104 | 0.4 | 10 |
| 개구리 (Rana) | 좌골 신경 축삭 | −60 ~ −80 | 110–130 | 1.0 | 7–30 |
| 고양이 (Felis) | 척수 운동뉴런 | −55 ~ −80 | 80–110 | 1–1.5 | 30–120 |
40억 년 전 원핵생물/진핵생물 공통 조상이 전압 개폐 채널을 가지고 있었을 것으로 추정되며,[75] 이는 단세포 생물에서도 활동 전위가 통신 수단으로 사용될 수 있음을 시사한다.
10. 식물의 활동 전위
식물 세포와 균류 세포[59] 역시 전기적으로 흥분할 수 있다. 동물 활동 전위와 근본적인 차이점은 식물 세포의 탈분극이 양성 나트륨 이온의 유입이 아닌 음성 ''염화물'' 이온(chloride영어)의 방출로 이루어진다는 것이다.[60][61][62] 1906년, J. C. 보스(J. C. Bose)는 식물에서 활동 전위의 첫 번째 측정을 발표했는데, 이는 이전에 버든-샌더슨(Burdon-Sanderson)과 다윈(Darwin)에 의해 발견되었다.[63] 세포질 내 칼슘 이온의 증가는 음이온의 세포 내 방출의 원인이 될 수 있다. 이는 보리 잎에서 보이는 것처럼 음성 염화물 이온의 유입과 양성 칼륨 이온의 유출과 같은 이온 이동의 전구체로서 칼슘을 만든다.[64]
칼슘 이온의 초기 유입은 또한 작은 세포 탈분극을 유발하여 전압 개폐 이온 채널을 열어 염화물 이온에 의해 완전한 탈분극이 전파되도록 한다.
일부 식물(예: ''파리지옥풀'')은 나트륨 개폐 채널을 사용하여 식물 운동을 작동시키고 자극 사건을 "계산"하여 운동 임계값이 충족되었는지 결정한다. 파리지옥풀(''Dionaea muscipula'')은 비너스 파리지옥풀이라고도 하며, 노스캐롤라이나와 사우스캐롤라이나의 아열대 습지에서 발견된다.[65] 토양 영양분이 부족할 때 파리지옥풀은 곤충과 동물의 먹이에 의존한다.[66] 식물에 대한 연구에도 불구하고 파리지옥풀과 일반적으로 육식 식물의 분자적 기초에 대한 이해는 부족하다.[67]
그러나 파리지옥풀의 활동 전위와 그것이 운동과 시계열에 미치는 영향에 대한 많은 연구가 이루어졌다. 우선, 파리지옥풀의 휴지 막 전위(−120 mV)는 동물 세포보다 낮다(보통 −90 mV ~ −40 mV).[67][68] 낮은 휴지 전위는 활동 전위를 활성화하기 더 쉽게 만든다. 따라서 곤충이 식물의 덫에 착륙하면 머리카락과 같은 기계 수용체를 자극한다.[67] 이 수용체는 약 1.5ms 동안 지속되는 활동 전위를 활성화한다.[69] 이는 세포 내 양성 칼슘 이온의 증가를 유발하여 약간 탈분극시킨다. 그러나 파리지옥풀은 한 번의 자극 후 닫히지 않는다. 대신, 두 개 이상의 털의 활성화가 필요하다.[66][67] 하나의 털만 자극되면 활성화를 거짓 양성으로 간주한다. 또한 두 번째 털은 첫 번째 활성화에 등록되려면 특정 시간 간격(0.75–40 s) 내에 활성화되어야 한다.[67] 따라서 칼슘 축적이 시작된 다음 첫 번째 자극 후에 천천히 떨어진다. 두 번째 활동 전위가 시간 간격 내에 발사되면 세포를 탈분극시키는 칼슘 임계값에 도달하여 먹이를 0.1s 이내에 덫을 닫는다.[67]
식물의 활동 전위는 이어서 양성 칼륨 이온의 방출과 함께 삼투 염 손실(KCl)을 수반한다. 반면에, 동물 활동 전위는 삼투적으로 중립적인데, 이는 들어오는 나트륨과 나가는 칼륨의 양이 같아 삼투적으로 서로 상쇄되기 때문이다. 식물 세포에서 전기적 및 삼투적 관계의 상호 작용[70]은 변화하는 염분 조건에서 식물과 동물의 공통적인 단세포 조상에서 전기적 흥분성의 삼투 기능에서 비롯된 것으로 보인다. 또한, 빠른 신호 전달의 현재 기능은 보다 안정적인 삼투 환경에서 후생동물 세포의 새로운 성과로 간주된다.[71] 일부 관다발 식물(예: ''미모사 푸디카'')의 친숙한 활동 전위 신호 기능은 후생동물 흥분성 세포의 신호 기능과 독립적으로 발생했을 가능성이 높다.
상승 단계와 피크와 달리 하강 단계와 과분극 후는 주로 칼슘이 아닌 양이온에 의존하는 것으로 보인다. 재분극을 시작하기 위해 세포는 막에서 수동 수송을 통해 칼륨을 세포 밖으로 이동시켜야 한다. 이는 뉴런과 다른데, 칼륨의 이동이 막 전위 감소를 지배하지 않기 때문이다. 완전한 재분극을 위해 식물 세포는 양성자 ATPase라고 하는 수송체를 이용하여 세포에서 수소를 방출하는 데 도움을 주기 위해 ATP 형태의 에너지가 필요하다.[72][67]
참조
[1]
논문
A quantitative description of membrane current and its application to conduction and excitation in nerve
1952-08
[2]
논문
Electrical correlates of secretion in endocrine and exocrine cells
1981-02
[3]
논문
Oscillations, intercellular coupling, and insulin secretion in pancreatic beta cells
2006-02
[4]
논문
The action potential
http://pn.bmj.com/co[...]
2007-06
[5]
웹사이트
Cardiac Muscle Contraction
https://www.zoology.[...]
2021-05-28
[6]
논문
Action Potentials in Higher Plants
http://www.esalq.usp[...]
1973-06
[7]
논문
The Axon Initial Segment: An Updated Viewpoint
2018-02
[8]
서적
Neuroscience
Sinauer Associates
2001
[9]
논문
FitzHugh-Nagumo model
[10]
문서
Schmidt-Nielsen
[11]
논문
Dichotomy of action-potential backpropagation in CA1 pyramidal neuron dendrites
2001-12
[12]
논문
Ling's Adsorption Theory as a Mechanism of Membrane Potential Generation Observed in Both Living and Nonliving Systems
2016-01
[13]
서적
Development of the nervous system
Elsevier Academic Press
2012-01-01
[14]
서적
Calcium Channels: Their Properties, Functions, Regulation, and Clinical relevance
CRC Press
[15]
서적
Cellular and Molecular Biology of Neuronal Development {{!}} Ira Black {{!}} Springer
https://www.springer[...]
Springer
[16]
서적
Current Topics in Developmental Biology, Volume 39
https://archive.org/[...]
Elsevier Academic Press
[17]
문서
Sasaki, T., Matsuki, N., Ikegaya, Y. 2011 Action-potential modulation during axonal conduction Science 331 (6017), pp. 599–601
[18]
논문
Computing spike directivity with tetrodes
2005-11
[19]
문서
Aur D., Jog, MS., 2010 Neuroelectrodynamics: Understanding the brain language, IOS Press, 2010. {{doi|10.3233/978-1-60750-473-3-i}}
[20]
논문
Myelination Increases the Spatial Extent of Analog Modulation of Synaptic Transmission: A Modeling Study
https://www.research[...]
[21]
논문
Past and Future of Analog-Digital Modulation of Synaptic Transmission
[22]
논문
Neural Coding: Analog Signalling in Axons
2006-08-08
[23]
논문
Analog transmission of action potential fine structure in spiral ganglion axons
[24]
논문
Cardiac action and pacemaker potentials based on the Hodgkin-Huxley equations
1960-11
[25]
간행물
The Nobel Prize in Physiology or Medicine 1963
http://nobelprize.or[...]
The Royal Swedish Academy of Science
2010-02-21
[26]
문서
Goldin, AL in {{harvnb|Waxman|2007|loc=''Neuronal Channels and Receptors'', pp. 43–58.}}
[27]
논문
Unique features of action potential initiation in cortical neurons
http://www.volgushev[...]
2006-04
[28]
논문
Evidence for electrical transmission in nerve: Part I
1937-07
[29]
서적
Purinergic Signalling in Neuron–Glia Interactions
[30]
논문
The local differentiation of myelinated axons at nodes of Ranvier
2003-12
[31]
논문
Wrapping it up: the cell biology of myelination
2007-10
[32]
논문
Fenestration nodes and the wide submyelinic space form the basis for the unusually fast impulse conduction of shrimp myelinated axons
http://jeb.biologist[...]
1999-08
[33]
논문
Conduction velocity and diameter of nerve fibers
[34]
논문
Factors Affecting Transmission and Recovery in the Passive Iron Nerve Model
1925-03
[35]
논문
Electro-saltatory transmission of nerve impulse and effect of narcosis upon nerve fiber
[36]
논문
Der am Ranvierschen Knoten entstehende Aktionsstrom und seine Bedeutung für die Erregungsleitung
[37]
문서
Tasaki, I in
[38]
논문
Evidence for saltatory conduction in peripheral myelinated nerve fibres
1949-05
[39]
논문
A theory of the effects of fibre size in medullated nerve
1951-09
[40]
논문
Rapid conduction and the evolution of giant axons and myelinated fibers
2007-01
[41]
논문
Dissecting demyelination
2007-11
[42]
문서
Waxman, SG in
[43]
문서
Rall, W in
[44]
서적
Methods in Neuronal Modeling: From Synapses to Networks.
The MIT Press
1989
[45]
논문
On the theory of the electric telegraph
[46]
논문
The electrical constants of a crustacean nerve fibre
1946-12
[47]
서적
Pharmacology of Neurotransmitter Release
[48]
논문
Ca2+-dependent mechanisms of presynaptic control at central synapses
2006-08
[49]
논문
How botulinum and tetanus neurotoxins block neurotransmitter release
2000-05
[50]
논문
On the search for the electrical synapse: a glimpse at the future
2002-11
[51]
논문
Gap junctions in excitable cells
1996-08
[52]
논문
Neuromuscular junction in health and disease
2007-07
[53]
논문
Molecular architecture of the neuromuscular junction
2006-04
[54]
논문
Nerve agents
2007-01
[55]
논문
Current issues in organophosphate toxicology
2006-04
[56]
논문
Basic mechanisms of cardiac impulse propagation and associated arrhythmias
2004-04
[57]
문서
These Purkinje fibers are muscle fibers and not related to the Purkinje cells, which are neurons found in the cerebellum.
[58]
논문
Pharmacological approaches in the treatment of atrial fibrillation
2004-01
[59]
논문
"Action potentials" in Neurospora crassa, a mycelial fungus
1976-04
[60]
논문
Action potentials in Acetabularia: measurement and simulation of voltage-gated fluxes
1991-12
[61]
논문
Models for oscillations in plants
[62]
서적
Action Potential in Charophytes
[63]
논문
Jagdish Chandra Bose and Plant Neurobiology: Part I
http://insa.nic.in/w[...]
2019-07-01
[64]
논문
Systemic signalling in barley through action potentials
2007-06
[65]
논문
Habitats of Dionaea muscipula (Venus' Fly Trap), Droseraceae, Associated with Carolina Bays
2005-12
[66]
논문
The Venus Flytrap Dionaea muscipula Counts Prey-Induced Action Potentials to Induce Sodium Uptake
2016-02
[67]
논문
Venus Flytrap: How an Excitable, Carnivorous Plant Works
2018-03
[68]
문서
Electrical Potentials Across Nerve Cell Membranes
https://www.ncbi.nlm[...]
Sinauer Associates
2001
[69]
논문
Closing of venus flytrap by electrical stimulation of motor cells
2007-05
[70]
논문
Electrocoupling of ion transporters in plants: interaction with internal ion concentrations
1998-11
[71]
간행물
Plant action potentials
[72]
논문
Direct Coupling of Action Potential Generation in Cells of a Higher Plant (Cucurbita Pepo) with the Operation of an Electrogenic Pump.
2002
[73]
논문
Electrical signals and their physiological significance in plants
2007-03
[74]
논문
Impulse conduction in a sponge
http://jeb.biologist[...]
1999-05
[75]
논문
Early evolution of neurons
2016-10
[76]
서적
The Brain, the Nervous System, and Their Diseases
https://books.google[...]
ABC-Clio
[77]
논문
The role of giant axons in studies of the nerve impulse
[78]
논문
Playing the devil's advocate: is the Hodgkin-Huxley model useful?
2002-11
[79]
논문
Dynamic electrical characteristics of the squid axon membrane
[80]
논문
The normal membrane potential of frog sartorius fibers
1949-12
[81]
논문
The electrical activity of single muscle fibers
[82]
논문
The recording of potentials from motoneurones with an intracellular electrode
1952-08
[83]
간행물
Some Electrical Properties of Fine-Tipped Pipette Microelectrodes
[84]
논문
A large change in dye absorption during the action potential
1974-12
[85]
간행물
The Nobel Prize in Physiology or Medicine 1991
http://nobelprize.or[...]
The Royal Swedish Academy of Science
2010-02-21
[86]
논문
Uniform action potential repolarization within the sarcolemma of in situ ventricular cardiomyocytes
2009-03
[87]
논문
Some factors affecting the time course of the recovery of contracture ability following a potassium contracture in frog striated muscle
1965-07
[88]
논문
Luigi Galvani and animal electricity: two centuries after the foundation of electrophysiology
1997-10
[89]
논문
The bicentennial of the Voltaic battery (1800-2000): the artificial electric organ
2000-04
[90]
서적
Emil du Bois-Reymond : neuroscience, self, and society in nineteenth-century Germany
[91]
간행물
Experiment, Quantification and Discovery: Helmholtz's Early Physiological Researches, 1843-50
University of California
[92]
간행물
The Nobel Prize in Physiology or Medicine 1906
http://nobelprize.or[...]
The Royal Swedish Academy of Science
2010-02-21
[93]
논문
Untersuchungen zur Thermodynamik der bioelektrischen Ströme
https://zenodo.org/r[...]
[94]
논문
Electric Impedance of the Squid Giant Axon During Activity
1939-05
[95]
논문
Recherches quantitatives sur l'excitationelectrique des nerfs traitee comme une polarisation
[96]
논문
The effect of sodium ions on the electrical activity of giant axon of the squid
1949-03
[97]
논문
The Recent Evolution of a Symbiotic Ion Channel in the Legume Family Altered Ion Conductance and Improved Functionality in Calcium Signaling
http://pn.bmj.com/co[...]
BMJ Publishing Group
2013-03-23
[98]
논문
Measurement of current-voltage relations in the membrane of the giant axon of Loligo
1952-04
[99]
논문
Single-channel currents recorded from membrane of denervated frog muscle fibres
1976-04
[100]
논문
The voltage-gated potassium channels and their relatives
2002-09
[101]
논문
The structure of the potassium channel: molecular basis of K+ conduction and selectivity
1998-04
[102]
논문
Atomic scale movement of the voltage-sensing region in a potassium channel measured via spectroscopy
1999-12
[103]
논문
A 3D view of sodium channels
2001-02
[104]
논문
Potential, Impedance, and Rectification in Membranes
1943-09
[105]
논문
The influence of some cations on an adenosine triphosphatase from peripheral nerves
1957-02
[106]
보도자료
The Nobel Prize in Chemistry 1997
http://nobelprize.or[...]
The Royal Swedish Academy of Science
2010-02-21
[107]
저널
Active transport of cations in giant axons from Sepia and Loligo
1955-04
[108]
저널
The effects of injecting 'energy-rich' phosphate compounds on the active transport of ions in the giant axons of Loligo
1960-07
[109]
저널
The utilization of phosphate bond energy for sodium extrusion from giant axons
1957-06
[110]
저널
Crystal structure of the sodium-potassium pump
2007-12
[111]
저널
What the structure of a calcium pump tells us about its mechanism
2001-06
[112]
저널
Sodium currents activate without a Hodgkin-and-Huxley-type delay in central mammalian neurons
2006-01
[113]
저널
Thresholds and plateaus in the Hodgkin-Huxley nerve equations
1960-05
[113]
저널
Reduction of conductance-based neuron models
[114]
저널
Voltage oscillations in the barnacle giant muscle fiber
1981-07
[115]
저널
Impulses and Physiological States in Theoretical Models of Nerve Membrane
1961-07
[115]
저널
An active pulse transmission line simulating nerve axon
[116]
저널
Activation of passive iron as a model for the excitation of nerve
1948-09
[116]
저널
Modelle der Nervenerregung
[116]
저널
On relaxation-oscillations
[116]
저널
The heartbeat considered as a relaxation oscillation, and an electrical model of the heart
[116]
저널
The heartbeat considered as a relaxation oscillation, and an electrical model of the heart
[117]
문서
Sato, S; Fukai, H; Nomura, T; Doi, S in Bifurcation Analysis of the Hodgkin-Huxley Equations
[117]
문서
FitzHugh, R in Mathematical models of axcitation and propagation in nerve
[117]
문서
Guckenheimer
[118]
저널
Nerve axon equations. I. Linear approximations
[118]
저널
Local stability theory of the nerve impulse
[119]
문서
Nelson, ME; Rinzel, J in The Hodgkin-Huxley Model
[119]
문서
Rinzel, J & Ermentrout, GB; in Analysis of Neural Excitability and Oscillations
[120]
저널
Analogue circuitry for the Van der Pol and FitzHugh-Nagumo equations
[121]
저널
Vibrotactile sensitivity threshold: nonlinear stochastic mechanotransduction model of the Pacinian Corpuscle
https://zenodo.org/r[...]
[122]
문서
Getting, PA in Reconstruction of Small Neural Networks
[123]
저널
Central pattern generators
2000-03
[124]
서적
Squid As Experimental Animals
[125]
웹인용
FitzHugh-Nagumo model
http://www.scholarpe[...]
2014-05-24
[126]
문서
Schmidt-Nielsen
[127]
저널
Dichotomy of action-potential backpropagation in CA1 pyramidal neuron dendrites
http://jn.physiology[...]
2001-12
[128]
서적
인체생리학
라이프사이언스
2011-03-01
[129]
논문
Action-potential modulation during axonal conduction
[130]
논문
Computing spike directivity with tetrodes
[131]
서적
Neuroelectrodynamics: Understanding the brain language
http://dx.doi.org/10[...]
IOS Press
[132]
저널
Cardiac action and pacemaker potentials based on the Hodgkin-Huxley equations
[133]
보도자료
The Nobel Prize in Physiology or Medicine 1963
http://nobelprize.or[...]
The Royal Swedish Academy of Science
2010-02-21
[134]
문서
Goldin, AL in Neuronal Channels and Receptors
[135]
저널
Unique features of action potential initiation in cortical neurons
http://www.nature.co[...]
2006-04
[136]
저널
Evidence for electrical transmission in nerve, Part I
[136]
저널
Evidence for electrical transmission in nerve, Part II
[137]
저널
The acquisition of myelin: a success story
[138]
저널
The local differentiation of myelinated axons at nodes of Ranvier
[139]
저널
Wrapping it up: the cell biology of myelination
2007-10
[140]
저널
Fenestration nodes and the wide submyelinic space form the basis for the unusually fast impulse conduction of shrimp myelinated axons
http://jeb.biologist[...]
2014-11-17
[141]
저널
Conduction velocity and diameter of nerve fibers
[142]
저널
Factors affecting transmission and recovery in passive iron nerve model
[143]
저널
Electro-saltatory transmission of nerve impulse and effect of narcosis upon nerve fiber
[144]
저널
Der am Ranvierschen Knoten entstehende Aktionsstrom und seine Bedeutung für die Erregungsleitung
[145]
문서
Tasaki, I in {{harvnb|Field|1959|pp=75–121}}
[146]
저널
Evidence for saltatory conduction in peripheral myelinated nerve-fibers
[147]
저널
A theory of the effects of fibre size in the medullated nerve
[148]
저널
Rapid conduction and the evolution of giant axons and myelinated fibers
[149]
저널
Dissecting demyelination
[150]
문서
Waxman, SG in {{harvnb|Waxman|2007|loc=''Multiple Sclerosis as a Neurodegenerative Disease'', pp. 333-346.}}
[151]
문서
Rall, W in {{harvnb|Koch|Segev|1989|loc=''Cable Theory for Dendritic Neurons'', p. 9-62.}}
[152]
문서
Segev, I; Fleshman, JW; Burke, RE in {{harvnb|Koch|Segev|1989|loc=''Compartmental Models of Complex Neurons'', pp. 63-96.}}
[153]
저널
On the theory of the electric telegraph
[154]
저널
The electrical constants of a crustacean nerve fibre
[155]
저널
Neurotransmitter release
[156]
저널
Ca2+-dependent mechanisms of presynaptic control at central synapses
2006-08
[157]
저널
How botulinum and tetanus neurotoxins block neurotransmitter release
2000-05
[158]
저널
On the search for the electrical synapse: a glimpse at the future
[159]
저널
Gap junctions in excitable cells
[160]
저널
Neuromuscular junction in health and disease
http://bja.oxfordjou[...]
2007-07
[161]
저널
Molecular architecture of the neuromuscular junction
2006-04
[162]
저널
Nerve agents
[163]
저널
Current issues in organophosphate toxicology
[164]
저널
Basic mechanisms of cardiac impulse propagation and associated arrhythmias
http://physrev.physi[...]
2004-04
[165]
문서
이 푸르키네 섬유는 근섬유로 [[소뇌]]에 있는 [[뉴런]]인 [[푸르키네 세포]]와는 무관하다.
[166]
저널
Pharmacological approaches in the treatment of atrial fibrillation
2004-01
[167]
저널
Action potentials in ''[[Neurospora crassa]]'' , a mycelial fungus
[168]
저널
Action potentials in ''[[Acetabularia]]'': measurement and simulation of voltage-gated fluxes
[169]
저널
Models for oscillations in plants
[170]
저널
Action potentials in charophytes
[171]
저널
Electrocoupling of ion transporters in plants: Interaction with internal ion concentrations
[172]
문서
Gradmann, D; Mummert, H in {{harvnb|Spanswick|Lucas|Dainty|1980|loc=''Plant action potentials'', pp. 333-344.}}
[173]
저널
Electrical signals and their physiological significance in plants
[174]
저널
Impulse conduction in a sponge
http://jeb.biologist[...]
1999-05-01
[175]
저널
The role of giant axons in studies of the nerve impulse
[176]
저널
Playing the devil's advocate: is the Hodgkin-Huxley model useful?
[177]
저널
Dynamic electrical characteristics of the squid axon membrane
[178]
저널
The normal membrane potential of frog sartorius fibers
[179]
저널
The electrical activity of single muscle fibers
[180]
저널
The recording of potentials from motoneurones with an intracellular electrode
[181]
간행물
Snell, FM in Some Electrical Properties of Fine-Tipped Pipette Microelectrodes
[182]
저널
A large change in dye absorption during the action potential
[183]
보도자료
The Nobel Prize in Physiology or Medicine 1991
http://nobelprize.or[...]
The Royal Swedish Academy of Science
2010-02-21
[184]
저널
Uniform action potential repolarization within the sarcolemma of in situ ventricular cardiomyocytes
2009-03-01
[185]
저널
The effect of tetrodotoxin on electrogenic components of squid giant axons
[186]
저널
Luigi Galvani and animal electricity: two centuries after the foundation of electrophysiology
[187]
저널
The bicentennial of the Voltaic battery (1800–2000): the artificial electric organ
[188]
보도자료
The Nobel Prize in Physiology or Medicine 1906
http://nobelprize.or[...]
The Royal Swedish Academy of Science
2010-02-21
[189]
저널
Untersuchungen zur Thermodynamik der bioelektrischen Ströme
[190]
저널
Electrical impedance of the squid giant axon during activity
[191]
저널
Recherches quantitatives sur l'excitationelectrique des nerfs traitee comme une polarisation
[192]
저널
The effect of sodium ions on the electrical activity of the giant axon of the squid
[193]
웹인용
The Recent Evolution of a Symbiotic Ion Channel in the Legume Family Altered Ion Conductance and Improved Functionality in Calcium Signaling
http://pn.bmj.com.my[...]
BMJ Publishing Group
2013-03-23
[194]
저널
Measurements of current-voltage relations in the membrane of the giant axon of ''Loligo''
[195]
저널
Single-channel currents recorded from membrane of denervated frog muscle fibres
[196]
저널
The structure of the potassium channel, molecular basis of K+ conduction and selectivity
[197]
저널
Atomic-scale movement of the voltage-sensing region in a potassium channel measured via spectroscopy
[198]
저널
A 3D view of sodium channels
[199]
저널
The voltage-gated potassium channels and their relatives
[200]
저널
Potential, impedance and rectification in membranes
[201]
저널
The influence of some cations on an adenosine triphosphatase from peripheral nerves
[202]
보도자료
The Nobel Prize in Chemistry 1997
http://nobelprize.or[...]
The Royal Swedish Academy of Science
2010-02-21
[203]
저널
Active transport of cations in giant axons from ''Sepia'' and ''Loligo''
[204]
저널
The effects of injecting energy-rich phosphate compounds on the active transport of ions in the giant axons of ''Loligo''
[205]
저널
The utilization of phosphate bond energy for sodium extrusion from giant axons
[206]
저널
Crystal structure of the sodium–potassium pump
[207]
저널
What the structure of a calcium pump tells us about its mechanism
[208]
저널
Voltage oscillations in the barnacle giant muscle fiber
[209]
저널
Impulses and physiological states in theoretical models of nerve membrane
[210]
저널
Thresholds and plateaus in the Hodgkin-Huxley nerve equations
[211]
저널
Activation of Passive Iron as a Model for the Excitation of Nerve
[211]
저널
Modelle der Nervenerregung
[211]
저널
On relaxation-oscillations
[211]
저널
The heartbeat considered as a relaxation oscillation, and an electrical model of the heart
[211]
저널
The heartbeat considered as a relaxation oscillation, and an electrical model of the heart
[212]
논문
Bifurcation Analysis of the Hodgkin-Huxley Equations
Reeke, Poznanski, Lindsay, Rosenberg
[212]
논문
Mathematical models of axcitation and propagation in nerve
Schwann
[212]
서적
Guckenheimer, Holmes
[213]
저널
Nerve axon equations. I. Linear approximations
[213]
저널
Local stability theory of the nerve impulse
[214]
논문
The Hodgkin-Huxley Model
Bower, Beeman
[214]
논문
Analysis of Neural Excitability and Oscillations
Koch, Segev
[215]
저널
Analogue circuitry for the van der Pol and FitzHugh-Nagumo equations
[216]
논문
Reconstruction of Small Neural Networks
Koch, Segev
[217]
저널
Central pattern generators
2000-03
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

