염화 코발트(II)
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
염화 코발트(II)는 코발트와 염소로 이루어진 화합물로, 다양한 수화물을 형성하며 수용액의 농도와 온도에 따라 색이 변하는 특징을 가진다. 무수물은 청색, 6수화물은 적색을 띠며, 수분 지시약, 발색 안료, 비밀 잉크 등 다양한 용도로 사용된다. 염화 코발트(II)는 루이스 산으로 작용하여 착화합물을 형성하며, 다른 코발트 화합물의 전구체로 사용되기도 한다. 하지만 IARC는 염화 코발트(II)를 발암 가능 물질로 분류하며, 과다 섭취 시 심각한 건강 문제를 일으킬 수 있어 주의가 필요하다. 염화 코발트(III)는 불안정하여 염화 코발트(II)와 염소로 분해된다.
더 읽어볼만한 페이지
- 무기 화합물 - 산화 수은(II)
산화 수은(II)는 화학식 HgO를 갖는 수은의 산화물로, 350°C에서 수은을 가열하거나 질산수은(II)를 열분해하여 생성되며, 수은 생산, 수은 전지 음극 재료로 사용되지만 독성이 강하다. - 무기 화합물 - 염화 암모늄
염화 암모늄은 분자량 53.50의 흰색 결정성 고체 화합물로, 물에 잘 녹고 가열 시 암모니아와 염화 수소 기체로 분해되며, 비료, 전지 전해액, 융제, 의약품, 식품 첨가물 등 다양한 용도로 사용된다. - 금속 할로젠화물 - 염화 칼륨
염화칼륨(KCl)은 칼륨 이온과 염화물 이온으로 이루어진 이온성 화합물로, 칼륨 비료, 화학 공업, 의학, 사형 집행 등 다양한 용도로 사용되며, 면심입방구조와 광학적 특성을 지니고, 캐나다, 러시아, 벨라루스 등에서 주로 생산된다. - 금속 할로젠화물 - 염화 나트륨
염화 나트륨은 염화물 이온과 나트륨 이온으로 구성된 백색 고체 이온 결정으로, 짠맛을 내며 융점은 800.4℃이고, 다양한 용도로 사용되며 겨울철 제설에도 활용되는 정염의 일종이다.
2. 성질
무수 염화 코발트(II)는 상온에서 염화 카드뮴 구조를 가지며, 코발트(II) 이온은 팔면체 배위를 한다. 약 706 °C에서 배위 구조가 사면체로 바뀐다.[11] 무수물은 조해성이 있는 청색 삼방정계 결정이며, 6수화물은 담홍색 단사정계 결정이다. 물, 메탄올, 에탄올, 아세톤에 녹으면 청색 용액이 되고, 물에 녹으면 적색 용액이 된다.
무수물에서 수화물로 흡습될 때 청색에서 적색으로 색이 변하며, 물을 잃으면 다시 색이 변하는 가역적 변화를 보인다. 이러한 성질을 이용하여 실리카겔 등에 수분 지시약으로 첨가된다.
2. 1. 용해도
염화 코발트(II)는 물에 비교적 잘 녹는다. 대기압 하에서 염화 코발트(II)의 포화 용액의 질량 농도는 끓는점인 120.2 °C에서 약 54%, 51.25 °C에서 48%, 25 °C에서 35%, 0 °C에서 33%, -27.8 °C에서 29%이다.[3]염화 코발트(II)의 묽은 수용액은 염화물 이온 외에 [Co(H₂O)₆]²⁺ 종을 포함한다. 진한 용액은 실온에서 붉은색을 띠지만 온도가 높아지면 파란색으로 변한다.[6]
2. 2. 수화물
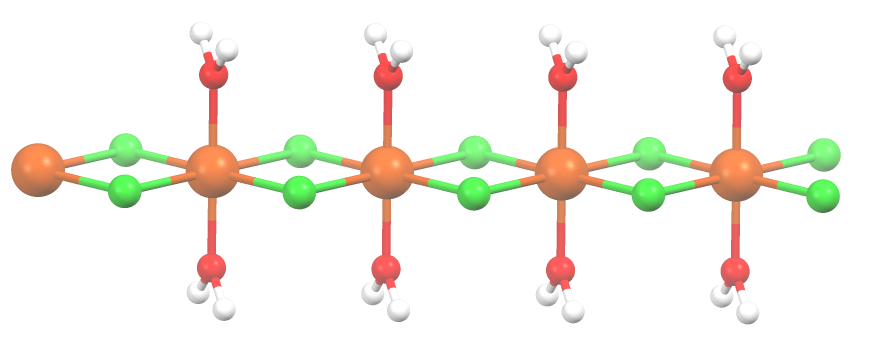
고체 6수화물(CoCl2·6H2O)의 결정 단위는 중성 분자 ''trans''-CoCl2(H2O)4과 두 분자의 결정수를 포함한다.[7] 이 물질은 물과 알코올에 쉽게 용해된다.
무수염은 조해성이며 6수화물 역시 조해성을 띈다. 2수화물(CoCl2(H2O)2)은 배위 고분자이다. 각 Co 중심은 4개의 이중 가교 염화물 리간드에 배위된다. 팔면체는 서로 ''trans''인 한 쌍의 아쿠오 리간드로 완성된다.[8]
3. 제조
염화 코발트(II)는 수용액에서 수산화 코발트(II) 또는 탄산 코발트(II)와 염산을 반응시켜 제조할 수 있다.[3]
: + 2 HCl(aq) → (aq) + +
: + 2 HCl(aq) → (aq) + 2
고체 이수화물과 육수화물은 증발을 통해 얻을 수 있다. 포화 수용액을 냉각하면 120.2°C와 51.25°C 사이에서는 이수화물이 생성되고, 51.25°C 이하에서는 육수화물이 생성된다. 29% 미만의 농도를 가진 용액에서는 염화 코발트 대신 물 얼음이 결정화된다. 일수화물과 무수 형태는 206°C 이상 및 335°C 이상과 같이 고압에서만 용액을 냉각시켜 얻을 수 있다.[3]
무수 화합물은 수화물을 가열하여 제조할 수 있다.[9]
빠른 가열 또는 밀폐된 용기에서 6-, 2-, 및 1- 수화물 각각은 다음 하위 수화물과 포화 용액의 혼합물로 부분적으로 녹는다. 각각 51.25°C, 206°C, 및 335°C에서[3] 개방된 용기에서 천천히 가열하면 고체 위의 수증기압이 거의 0이므로 고체 6-, 2-, 및 1- 수화물 각각에서 물이 증발하여 약 40°C, 89°C, 및 125°C에서 다음 하위 수화물을 남긴다. 고압 용기가 아닌 밀폐된 용기와 같이 수증기의 부분 압력이 고체와 평형을 이루는 경우, 분해는 각각 약 115°C, 145°C, 및 195°C에서 발생한다.[3]
탈수는 트리메틸실릴 클로라이드로 수행할 수도 있다.[10]
:•6 + 12 → + 6 + 12 HCl
무수 화합물은 진공에서 승화하여 정제할 수 있다.[11]
4. 반응
실험실에서 염화 코발트(II)는 다른 코발트 화합물을 만드는데 사용된다. 염화 코발트(II)의 묽은 수용액은 음이온에 관계없이 이온으로 구성되어 있어 다른 코발트(II) 염과 비슷하게 반응한다. 예를 들어, 황화 코발트(CoS)와 황화 수소(H₂S)를 반응시키면 침전물이 생긴다.
탄산 코발트(CoCO3)나 Co(OH)2 같은 2가 코발트 염을 농염산에 녹인 후 용매를 증발시켜 만들 수 있다.
:
:
금속 코발트와 염소를 직접 반응시켜서 만들 수도 있다.
:
4. 1. 착화합물 형성
염화 코발트(II)는 루이스 산으로 작용하여 다양한 착화합물을 형성한다. 피리딘(C₅H₅N)과 반응하여 팔면체 착물 [CoCl₂(C₅H₅N)₄]을 형성한다.[12]:CoCl₂·6H₂O + 4 C₅H₅N → CoCl₂(C₅H₅N)₄ + 6 H₂O
트리페닐포스핀(P(C₆H₅)₃)과 반응하여 사면체 착물 [CoCl₂(P(C₆H₅)₃)₂]을 형성한다.
:CoCl₂·6H₂O + 2 P(C₆H₅)₃ → CoCl₂[P(C₆H₅)₃]₂ + 6 H₂O
테트라에틸암모늄 클로라이드를 사용하여 음이온 착물 [CoCl₄]²⁻ 염을 제조할 수 있다.[13]
:CoCl₂ + 2 [(C₂H₅)₄N]Cl → [(C₂H₅)₄N)]₂[CoCl₄]
사염화코발트(II)산 이온 [CoCl₄]²⁻는 수화된 염화 코발트 수용액에 염산을 첨가하면 형성되는 파란색 이온이며, 원래의 수용액은 분홍색이다.
4. 2. 산화/환원 반응
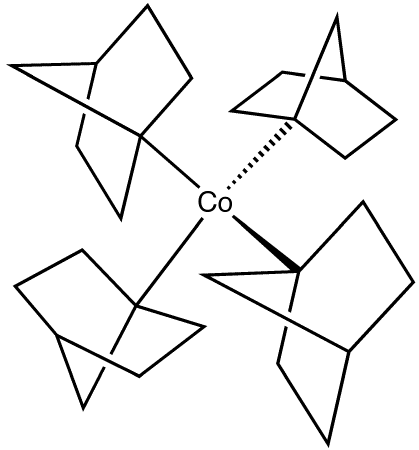
무수 염화 코발트(II)는 사이클로펜타다이에나이드 나트륨과 반응하여 코발토센(Co(C₅H₅)₂)을 생성한다. 코발토센은 전자가 19개여서 좋은 환원제로 작용하며, 쉽게 산화되어 노란색의 18 전자 코발토세늄 양이온([Co(C₅H₅)₂]⁺)을 생성한다.1-노보르닐리튬과 펜테인 용매에서 염화 코발트(II)·THF의 반응은 갈색의 열적으로 안정한 테트라키스(1-노보르닐)코발트(IV)를 생성한다.[15][16] 이는 안정적인 전이 금속/포화 알케인 화합물의 희귀한 예시이다.[4] 다른 용매에서는 다른 생성물이 얻어진다.[17]
5. 용도

염화 코발트(II)는 수화 상태에 따라 색이 변하는 성질을 가지고 있다. 이러한 성질을 이용하여 실리카겔 등에 수분 지시약으로 사용된다. 건조 시에는 푸른색을 띠지만, 수분을 흡수하면 분홍색으로 변한다.[18]
- '''비밀 잉크:''' 염화 코발트(II) 용액은 보이지 않지만, 열을 가하면 파란색으로 변하는 성질을 이용하여 비밀 잉크로 사용될 수 있다.[24]
- '''기타:''' 발색 안료, 유리 및 도자기 착색, 맥주 거품 안정제, 식물 섭취 물질 조사, 비타민 B12 원료 등으로 사용된다. 또한, 적혈구 생성과 같은 저산소증 유사 반응을 유도하거나,[25] 동물에게 폐동맥 고혈압을 유발하는 데 사용되기도 한다. 오스트레일리아 경주마 협회에서는 염화 코발트(II)를 금지 물질로 지정하였다.[26]
6. 안전성
코발트는 대부분의 고등 생명체에 필수적이지만, 하루에 몇 밀리그램 이상 섭취하면 해롭다. 코발트 화합물로 인한 중독은 드물지만, 만성적인 섭취는 치사량보다 훨씬 적은 양에서도 심각한 건강 문제를 일으킨다. 1966년, 캐나다에서 맥주 거품을 안정시키기 위해 코발트 화합물을 첨가한 것이 독소 유발 심근증의 원인이 되었고, 이는 '맥주 애호가 심근증'으로 알려지게 되었다.[19][20][21]
염화 코발트(II)는 국제 암 연구소(IARC)의 IARC 발암성 분류(IARC Monographs)에 따라 암을 유발할 가능성이 있는 발암 물질(IARC Group 2B)로 의심된다.[22]
2005-06년에 염화 코발트(II)는 첩포 검사에서 여덟 번째로 흔한 알레르겐이었다(8.4%).[23]
7. 염화 코발트(III)
'''염화 코발트(III)'''(えんかコバルト さん|, Cobalt(III) chloride일본어)는 +3가의 코발트 염화물로, 화학식 CoCl3로 나타낸다. 짙은 녹색 결정이지만 불안정하여 쉽게 불균등화되어 염화 코발트(II)와 염소로 분해된다.
:
참조
[1]
웹사이트
Cobalt muriate, CAS Number: 7646-79-9
http://www.chemindus[...]
2018-04-19
[2]
문서
Santa Cruz Biotechnology: Cobalt(II) chloride
http://datasheets.sc[...]
[3]
논문
Equilibres solide ⇄ liquide ⇆ vapeur du systeme binaire
1977
[4]
서적
Chemistry of the Elements
Butterworth-Heinemann
[5]
논문
The vapor pressure of cobalt dichloride
1977
[6]
간행물
The Merck Index
Merck & Co
1960
[7]
서적
Structural Inorganic Chemistry
https://archive.org/[...]
Clarendon Press
1984
[8]
논문
Crystal structures of manganese(II) and iron(II) chloride dihydrate
[9]
간행물
Cobalt and Cobalt Compounds
Wiley-VCH
2005
[10]
서적
Inorganic Syntheses
2007
[11]
논문
Melting and high-temperature solid state transitions in cobalt(II) halides
2007
[12]
논문
Crystal and Molecular Structures of trans-Tetrakis(pyridine)dichloroiron(II), -Nickel(II), and -Cobalt(II) and trans-Tetrakis(pyridine)dichloroiron(II) Monohydrate
[13]
서적
Inorganic Syntheses
[14]
간행물
Handbook of Chemistry and Physics
CRC Press
1990
[15]
논문
Transition metal bicyclo[2.2.1]hept-1-yls
[16]
논문
Tetrakis(1-norbornyl)cobalt, a low spin tetrahedral complex of a first row transition metal
[17]
논문
Synthesis, characterization, and electron-transfer reactivity of norbornyl complexes of cobalt in unusually high oxidation states
[18]
논문
The use of cobalt salts as indicators of humidity and moisture
https://onlinelibrar[...]
1945-02
[19]
논문
Quebec beer-drinkers' cardiomyopathy: Clinical and hemodynamic aspects
1969
[20]
논문
Cobalt
1999
[21]
문서
11.1.5 The unusual type of myocardiopathy recognized in 1965 and 1966 in Quebec (Canada), Minneapolis (Minnesota), Leuven (Belgium), and Omaha (Nebraska) was associated with episodes of acute heart failure (e/g/, 50 deaths among 112 beer drinkers).
https://pubchem.ncbi[...]
[22]
PDF
http://publications.[...]
[23]
문서
Patch-test results of the North American Contact Dermatitis Group 2005–2006
2009-05
[24]
웹사이트
Making invisible ink
https://edu.rsc.org/[...]
Royal Society of Chemistry
2023-04-07
[25]
논문
Cobalt chloride administration in athletes: a new perspective in blood doping?
2005-11
[26]
뉴스
Cobalt crisis turns the eyes of the world onto Australian racing
https://www.smh.com.[...]
2015-02-06
[27]
웹인용
Cobalt muriate, CAS Number: 7646-79-9
http://www.chemindus[...]
2018-04-19
[28]
논문
Melting and high-temperature solid state transitions in cobalt(II) halides
2007
[29]
문서
Santa Cruz Biotechnology: Cobalt(II) chloride
http://datasheets.sc[...]
[30]
논문
Equilibres solide ⇄ liquide ⇆ vapeur du systeme binaire
1977
[31]
서적
Chemistry of the Elements
Butterworth-Heinemann
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

