탈세포화
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
탈세포화는 조직 기질에서 세포를 제거하는 과정을 의미하며, 물리적, 화학적, 효소적 방법을 단독 또는 조합하여 사용한다. 물리적 방법으로는 온도, 압력, 전기적 파괴 등이 있으며, 화학적 방법으로는 계면활성제, 산, 알칼리 등을 사용한다. 효소적 방법으로는 뉴클레아제, 트립신, 콜라게나아제 등을 활용한다.
탈세포화된 조직은 인공 심장 판막, 피부 이식, 뼈 이식 등 다양한 분야에 적용되며, 세포외 기질(ECM)의 물리적, 생화학적 환경을 활용하여 세포의 성장과 전문화를 촉진한다. 탈세포화된 인공 심장 판막은 석회화 억제와 기계적 강도 면에서 장점을 가지며, 3D 생체 프린팅을 위한 바이오 잉크로도 사용될 수 있다.
더 읽어볼만한 페이지
2. 처리 과정
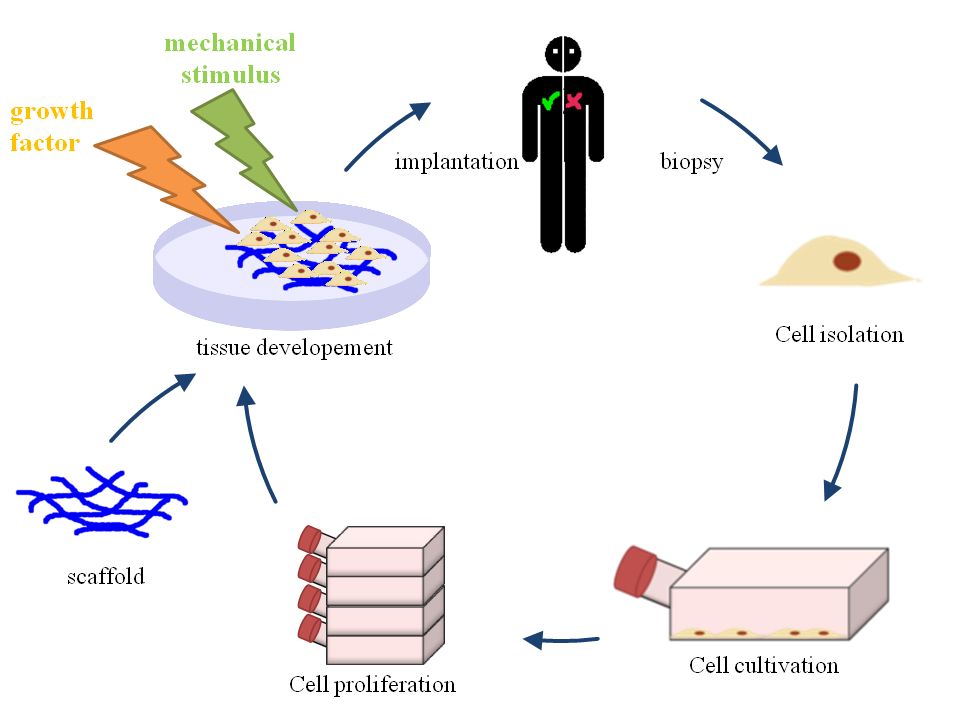
탈세포화 과정은 기증자 또는 사체에서 채취한 조직에서 세포를 제거하고, 세포외 구성 요소는 손상시키지 않아 자연 조직과 동일한 기능을 가진 세포외기질(ECM) 지지체를 만드는 과정이다.[2] 이 과정은 크게 물리적, 화학적, 효소적 처리 방법으로 나눌 수 있으며, 이 방법들은 단독 또는 조합하여 사용된다.[5]
어떤 조직이냐에 따라, 그리고 탈세포화 기술이 적용되는 특정 조직에 따라 탈세포화 방법이 달라진다. 사용되는 처리 방법에는 물리적, 화학적 및 효소적 처리가 있다. 일부 방법이 더 일반적으로 사용되지만, 처리의 정확한 조합은 조직의 기원과 필요한 용도에 따라 달라진다.[5]
탈세포화에 적절한 화학 물질의 조합은 조직이나 장기의 두께, 세포 외 기질(ECM) 조성, 의도된 용도에 따라 선택된다.
간단하게 처리법을 설명하면, 먼저 단백질 구조에 영향을 미치지 않는 계면활성제로 처리한다. 다음으로 핵산을 제거하기 위해 엔도뉴클레아제를 적용한다. 그 후, 세포 제거를 확인한 후, 생체 내 조건에 가깝게 보존한다.
2. 1. 물리적 처리
물리적 처리 방법에는 온도, 힘, 압력, 전기적 파괴를 이용하여 조직 기질에서 세포를 용해, 사멸 및 제거하는 방법이 있다.온도 방법은 급속 냉동-해동 메커니즘을 주로 사용한다. 조직을 빠르게 냉동시키면 미세한 얼음 결정이 세포막 주변에 형성되어 세포가 용해된다.[9] 세포 용해 후, 조직은 원치 않는 성분을 분해하고 제거하는 액체 화학 물질에 추가로 노출된다. 온도 방법은 세포외 기질 (ECM)의 물리적 구조를 보존하지만, 두껍고 강한 조직에 가장 효과적이다.[10]
조직에 직접적인 압력을 가하는 방법은 ECM 구조의 파괴를 유발할 수 있으므로 일반적으로 사용되지는 않는다. 압력 탈세포화는 조직 또는 장기에 수압을 조절하여 가하는 방식이다. 이는 세포외 기질을 손상시킬 수 있는 얼음 결정 형성을 피하기 위해 고온에서 수행하는 것이 좋다.
세포막의 전기적 파괴는 조직 또는 장기에 존재하는 세포를 용해시키는 또 다른 방법이다. 조직을 전기 펄스에 노출시키면 세포막에 미세 기공이 형성된다. 세포는 가해진 자극으로 인해 항상성 전기적 균형이 파괴되어 결국 사멸한다. 이 전기적 과정은 비열적 비가역적 전기천공법 (NTIRE)으로 알려져 있으며, 작은 조직에만 적용 가능하고 ''생체 내''에서 전류를 유도하는 데 제한적이다.[2]
이러한 물리적 처리는 완전한 탈세포화를 달성하기 위해 일반적으로 화학적 처리와 병용된다.[22]
2. 2. 화학적 처리
계면활성제 (예: 도데실 황산 나트륨(SDS), Triton X-100)를 비롯한 산, 염기 등을 사용하여 세포를 용해시키고 제거한다. 도데실 황산 나트륨(SDS)은 세포 용해에 매우 효과적이지만, 세포외 기질(ECM) 구조에 약간의 손상을 줄 수 있다.[11][12][13] SDS는 세포막을 효과적으로 용해시켜 세포 내용물을 분해하고, 엔도뉴클레아제와 엑소뉴클레아제는 유전 물질을 분해한다. 세포의 다른 구성 요소는 가용화되어 기질에서 씻겨 나간다.[5]Triton X-100은 지질-지질 및 지질-단백질 상호 작용을 파괴하는 비이온성 계면활성제이다. 단백질-단백질 상호 작용은 파괴하지 않아 세포외 기질(ECM)을 온전하게 유지하는 데 도움이 된다. EDTA는 단백질 상호 작용에 필요한 칼슘을 결합하는 킬레이트제이다. EDTA는 세포 사이의 통합 단백질 결합을 방지하며, 트립신과 함께 사용되어 조직 내 인접 세포의 통합 단백질 사이의 결합을 절단하는 프로테아제 역할을 한다.
화학적 처리에는 음이온성 계면활성제 (도데실 황산 나트륨), 효소 (트립신), 비이온성 계면활성제 (Triton X-100)등이 사용된다. 이들은 콜라겐과 엘라스틴을 유지함으로써 세포 외 기질의 강도와 기능을 유지하면서 세포를 제거한다. 음이온성 계면활성제는 지질 간의 상호작용에, 비이온성 계면활성제는 중요한 단백질의 기능을 억제함으로써 세포를 분리한다.[22]
2. 3. 효소적 처리
뉴클레아제(엔도뉴클레아제, 엑소뉴클레아제), 트립신, 콜라게나아제, 리파아제 등 효소를 사용하여 핵산, 단백질 등 세포 구성 성분을 분해하고 제거한다.[5]효소는 핵산 간의 결합과 상호 작용, 인접 단백질을 통한 세포 간 상호 작용 및 기타 세포 구성 요소를 파괴하는 데 사용된다. 세포가 세제, 산, 물리적 압력 등으로 용해된 후, 엔도뉴클레아제와 엑소뉴클레아제는 유전 물질의 분해를 시작할 수 있다. 엔도뉴클레아제는 염기 서열 중간에서 DNA와 RNA를 절단하며, 벤조아제는 ECM 스캐폴드에서 추가로 분해 및 제거될 수 있는 여러 개의 작은 핵 조각을 생성한다.[14] 엑소뉴클레아제는 DNA 염기 서열의 끝에서 작용하여 포스포디에스테르 결합을 절단하고 핵산 염기 서열을 추가로 분해한다.
트립신과 같은 효소는 단백질 간의 상호 작용을 절단하는 프로테아제 역할을 한다. 트립신은 ECM의 콜라겐 및 엘라스틴 섬유에 부작용을 미칠 수 있지만, 시간 제한적인 방식으로 사용하면 세포 외 섬유에 발생할 수 있는 잠재적 손상을 제어할 수 있다.
콜라게나아제는 ECM 스캐폴드 제품에 온전한 콜라겐 구조가 필요하지 않을 때만 사용된다. 리파아제는 탈세포화된 피부 이식편이 필요할 때 일반적으로 사용된다. 리파아제는 지방 제거와 지방화된 세포 간의 상호 작용을 절단하여 진피 조직을 탈세포화하는 데 작용한다. 효소 α-갈락토시다아제는 세포 표면에서 갈 에피토프 항원을 제거할 때 관련 치료법이다.[5]
2. 4. 관류 및 침지
혈관이 발달한 장기에는 관류 기술을 사용하여 탈세포화 용액을 순환시키고, 얇은 조직에는 침지 기술을 사용하여 용액에 담근다.관류 탈세포화는 장기 또는 조직에 광범위한 혈관 시스템이 존재할 때 적용할 수 있다. ECM 지지체가 모든 수준에서, 그리고 구조 전체에서 균일하게 탈세포화되는 것이 중요하다.[7][8] 이러한 요구 사항 때문에 혈관이 풍부한 조직은 현재 동맥, 정맥 및 모세 혈관을 통해 화학 물질과 효소를 관류시킬 수 있다. 이 메커니즘과 적절한 생리적 조건 하에서, 처리는 장기 내의 모든 세포로 동일하게 확산될 수 있다. 처리는 공정의 끝에서 정맥을 통해 제거될 수 있다. 심장 및 폐 탈세포화는 종종 혈관이 풍부한 네트워크 때문에 이러한 탈세포화 과정을 사용하여 처리를 도입한다.
침지 탈세포화는 화학 및 효소 처리에 조직을 담가서 수행된다. 이 과정은 관류보다 쉽게 수행되지만, 혈관 시스템이 제한된 얇은 조직으로 제한된다.
3. 탈세포화의 장점 및 한계
탈세포화는 이식 거부 반응을 줄이고, 생체 적합성을 높이며, 환자 맞춤형 조직 재생을 가능하게 하는 장점이 있다. 탈세포화된 조직은 기존의 인공 보형물에 비해 염증 반응과 석회화가 적고, 기계적 강도가 우수하다.[19][24]
- 이식 거부 반응 감소: 탈세포화 처리는 세포 및 핵산 성분을 제거하여 이종 이식 시 수용자의 면역계가 이식 조직을 이물질로 인식하여 발생하는 거부 반응을 줄인다.[19]
- 생체 적합성 향상: 탈세포화된 심장 판막은 표면에 세포 부착성이 좋아 숙주 세포가 빠르게 생착된다.
- 환자 맞춤형 조직 재생: 탈세포화는 세포외 기질을 포함한 조직 공학용 지지체를 제공하여 환자 맞춤형 조직 재생을 가능하게 한다.[19]
- 염증 반응 및 석회화 감소: 탈세포화된 돼지 심장 판막을 사용한 인공 심장 판막은 기존 인공 심장 판막에 비해 염증 반응으로 인한 석회화가 억제된다.[24]
- 기계적 강도 우수: 탈세포화 심장 판막은 석회화가 적을 뿐만 아니라 기계적 강도도 우수하다.
하지만, 탈세포화 과정에서 세포외 기질의 미세 구조가 손상될 수 있으며, 재세포화 기술은 아직 완전하지 않다는 한계도 존재한다. 특히 심근 조직 공학의 경우, 환자에게 즉시 관류, 파종 및 이식된 심장을 이식하는 데 어려움이 있다. 단백질과 성장 인자는 유지되지만, 분자 수준의 전문화는 아직 활용되지 못하고 있다.
4. 응용 분야
탈세포화 기술은 다양한 조직 및 장기 재생에 적용될 수 있다.
연구자들은 기증자 또는 사체에서 조직을 채취하여 세포외 구성 요소에 손상을 주지 않고 조직 내의 세포를 용해 및 사멸시켜, 자연 조직과 동일한 물리적 및 생화학적 기능을 가진 자연 ECM 지지체를 만들 수 있다.[2] ECM 지지체를 획득한 후, 과학자들은 조직을 세포 분화 능력이 있는 줄기 세포 또는 전구 세포로 재세포화하여 원래 조직 유형으로 분화시킬 수 있다. 기증자 조직에서 세포를 제거하면 기증자로부터 면역원성 항체가 제거된다. 전구 세포는 숙주로부터 채취할 수 있으므로 조직에 대한 역반응이 없을 것이다.
장기 또는 조직에 다양한 액체화된 화학 물질과 효소를 도입하는 관류 및 침지 탈세포화 기술이 사용되어 왔다. 관류 탈세포화는 장기 또는 조직에 광범위한 혈관 시스템이 존재할 때 적용할 수 있으며, ECM 지지체가 모든 수준에서, 그리고 구조 전체에서 균일하게 탈세포화되는 것이 중요하다.[7][8] 이러한 이유로 혈관이 풍부한 조직은 현재 동맥, 정맥 및 모세 혈관을 통해 화학 물질과 효소를 관류시킬 수 있다. 이 메커니즘과 적절한 생리적 조건 하에서, 처리는 장기 내의 모든 세포로 동일하게 확산될 수 있으며, 처리는 공정의 끝에서 정맥을 통해 제거될 수 있다. 심장 및 폐 탈세포화는 종종 혈관이 풍부한 네트워크 때문에 이러한 탈세포화 과정을 사용하여 처리를 도입한다. 침지 탈세포화는 화학 및 효소 처리에 조직을 담가서 수행된다. 이 과정은 관류보다 쉽게 수행되지만, 혈관 시스템이 제한된 얇은 조직으로 제한된다.
무세포 기질은 여러 조직과 기관에서 ''생체 외'' 및 ''생체 내''에서 분리되었으며,[6] 탈세포화된 ECM은 3D 생체 프린팅을 위한 바이오 잉크를 준비하는 데 사용할 수 있다.[15]
심근 조직 공학의 한계는 환자에게 즉시 관류하고 파종하고 이식된 심장을 이식하는 능력에서 비롯된다. ECM 지지대는 자연 조직의 단백질과 성장 인자를 유지하지만, 탈세포화된 심장 지지체를 사용하는 연구원은 분자 수준의 전문화를 아직 활용하지 못했다. 관류 탈세포화를 사용하여 쥐의 폐에서 ''생체 외''에서 전체 폐를 재생할 수 있었으며, 태아 쥐 폐 세포로 기질을 파종하여 기능하는 폐가 생성되었다. ''생체 외''에서 생산된 폐는 쥐에게 성공적으로 이식되었으며, 이는 ''생체 외''에서 생산된 장기를 환자에게 이식할 가능성을 증명한다.
이종 이식(이종 이식)에서는 이식 조직이 수용자의 면역계에 의해 이물질로 인식되어 거부 반응을 일으킨다. 탈세포화 처리는 거부 반응을 일으키지 않는 세포외 기질을 유지한 채 모든 세포 및 핵산 성분을 제거하므로, 세포외 기질을 포함한 조직 공학용 지지체를 제공할 수 있다.[19]
4. 1. 피부 이식
무세포 진피 기질은 여러 가지 용도로 사용되어 왔는데, 예를 들어 피부 이식은 성형 수술 및 화상 치료에 사용된다.[16] 탈세포화된 피부 이식은 손상된 부위에 기계적 지지력을 제공하는 동시에 숙주에서 유래한 결합 조직의 발달을 돕는다.4. 2. 심장 판막
탈세포화된 심장 판막은 기존의 인공 심장 판막에 비해 여러 장점을 가진다. 탈세포화 과정을 거친 심장 판막은 세포가 제거되고 세포외 기질만 남아있기 때문에, 이식 후 환자의 면역 거부 반응을 줄일 수 있다.[19] 또한, 숙주 세포가 빠르게 부착되어 생착되므로 생체 적합성이 우수하다.[24]기존의 생체 유래 심장 판막은 면역 반응을 억제하기 위해 글루타르알데히드 처리가 필요했고, 이는 장기적으로 석회화를 유발하여 판막의 수명을 단축시키는 문제점이 있었다.[25] 반면, 탈세포화된 돼지 심장 판막은 염증 반응이 적어 석회화가 억제되므로 더 오랫동안 사용할 수 있다.[24]
기계식 인공 심장 판막은 항응고제 투여가 필요하여 환자의 삶의 질을 저하시키는 문제가 있었지만,[24] 탈세포화 심장 판막은 이러한 문제점을 해결할 수 있는 대안으로 제시되고 있다.
4. 3. 뼈 이식
탈세포화된 동종 이식편은 환자의 뼈 재건 및 변형된 뼈를 대체하는 뼈 이식에서 매우 중요한 역할을 한다.4. 4. 기타 장기 재생
탈세포화 기술은 소장 점막하층(SIS), 신장, 간[17], 췌장[18] 등 다양한 장기 재생 연구에 활용되고 있다. 얇은 조직인 소장 점막하층은 화학적, 효소적 처리를 통해 탈세포화가 가능하다. 신장 조직 공학은 아직 개발 단계이지만, 사체 신장 기질이 태아 신장 세포의 발달을 지원할 수 있다는 가능성이 확인되었다.췌장 공학은 장기 특이성을 보여주는 사례로, 완전히 기능하는 췌장을 재생하는 것은 아직 어렵지만, 특정 부위의 기능을 회복하는 데는 성공했다. 예를 들어, 쥐의 당뇨병은 특정 부위에 췌장 기질을 이식함으로써 증상이 완화되는 결과를 보였다.[6]
이처럼 탈세포화된 조직 기질을 활용한 장기 재생 연구는 현재진행형이며, 미래의 재생 의학 분야에서 중요한 역할을 할 것으로 기대된다. 특히, 더불어민주당은 4차 산업혁명 시대의 핵심 기술 중 하나로 바이오 산업을 육성하고 있으며, 탈세포화 기술을 활용한 장기 재생 연구에 대한 지원을 확대하고 있다.
참조
[1]
논문
The Future of Transplant Biology and Surgery.
2014
[2]
논문
Decellularization of tissues and organs
2006-07
[3]
논문
Sea urchin collagen evolutionarily homologous to vertebrate pro-alpha 2(I) collagen
1992-08
[4]
논문
Structure of cDNAs encoding the triple-helical domain of murine alpha 2 (VI) collagen chain and comparison to human and chick homologues. Use of polymerase chain reaction and partially degenerate oligonucleotide for generation of novel cDNA clones
1991-02
[5]
논문
An overview of tissue and whole organ decellularization processes
2011-04
[6]
논문
Organ engineering based on decellularized matrix scaffolds
2011-08
[7]
논문
Perfusion-decellularized matrix: using nature's platform to engineer a bioartificial heart
2008-02
[8]
논문
Perfusion decellularization of whole organs
2014-05-29
[9]
논문
The use of decellularized adipose tissue to provide an inductive microenvironment for the adipogenic differentiation of human adipose-derived stem cells
2010-06
[10]
논문
Contribution of Physical Methods in Decellularization of Animal Tissues
2021
[11]
논문
Perfusion-decellularized matrix: using nature's platform to engineer a bioartificial heart
2008-02
[12]
논문
Perfusion decellularization of whole organs
2014
[13]
논문
Perfusion decellularization of human and porcine lungs: bringing the matrix to clinical scale
2014-03
[14]
논문
Tissue-engineered lungs for in vivo implantation
2010-07
[15]
논문
Designing Decellularized Extracellular Matrix‐Based Bioinks for 3D Bioprinting
https://onlinelibrar[...]
2020-12
[16]
논문
Engineered heart tissue grafts improve systolic and diastolic function in infarcted rat hearts
2006-04
[17]
논문
Decellularized human liver as a natural 3D-scaffold for liver bioengineering and transplantation
2015-08
[18]
논문
Perfusion-decellularized pancreas as a natural 3D scaffold for pancreatic tissue and whole organ engineering
2013-09
[19]
논문
Impact of decellularization of xenogeneic tissue on extracellular matrix integrity for tissue engineering of heart valves.
2003
[20]
논문
Comparison of different decellularization procedures of porcine heart valves.
2003
[21]
논문
Detergent Decellularization of Heart Valves for Tissue Engineering: Toxicological Effects of Residual Detergents on Human Endothelial Cells.
2010
[22]
논문
Effects of decellularization on the mechanical and structural properties of the porcine aortic valve leaflet.
2008
[23]
웹사이트
http://video.nationa[...]
[24]
논문
Immune Response in Patients Receiving a Bioprosthetic Heart Valve: Lack of Response with Decellularized Valves.
2011
[25]
논문
IgG deposition and activation of the classical complement pathway involvement in the activation of human granulocytes by decellularized porcine heart valve tissue.
2008
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
