기체
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
기체는 물질의 상태 중 하나로, 압축과 변형에 저항이 작고 부피와 모양이 일정하지 않은 상태를 말한다. 기체는 원자, 분자, 이온 등의 입자로 구성되며, 온도와 압력 변화에 따라 부피가 크게 변하고 확산 현상을 통해 용기 전체에 고르게 퍼진다. 기체의 물리적 성질은 압력, 부피, 온도, 물질량 등으로 표현되며, 이상 기체 상태 방정식과 같은 수학적 모델로 설명된다. 17세기 로버트 보일의 연구를 시작으로, 샤를, 게이뤼삭, 아보가드로, 돌턴 등의 과학자들이 기체의 성질에 대한 연구를 진행했다. 기체는 압축성, 난류, 점성, 경계층, 최대 엔트로피 원리, 열역학적 평형 등과 관련된 특수한 주제들을 가지며, 분리 및 활용 기술이 존재한다.
더 읽어볼만한 페이지
- 기체 - 밸브
밸브는 유체의 흐름을 제어하는 장치로, 다양한 크기와 작동 방식을 가지며, 산업 전반과 일상생활에서 널리 사용된다. - 기체 - 배기가스
배기가스는 내연기관이나 산업 공정에서 발생하는 가스 배출물로, 이산화탄소, 수증기 외에도 인체에 유해한 일산화탄소, 탄화수소, 질소산화물, 미세먼지 등을 포함하며 대기오염, 산성비, 기후변화의 원인이 되므로 배출량 저감을 위한 기술적, 정책적 노력이 필요하다. - 화학에 관한 - 칼륨
칼륨은 은백색의 무른 알칼리 금속으로 반응성이 매우 높고 생물학적으로 중요한 전해질이며, 비료 생산을 비롯한 다양한 산업 분야에서 활용되지만 물과의 격렬한 반응 및 폭발성 과산화물 생성 가능성으로 취급 시 주의가 필요하며, 자연계에 세 가지 동위원소로 존재한다. - 화학에 관한 - 파울리 배타 원리
파울리 배타 원리는 1925년 볼프강 파울리가 제시한 양자역학 원리로, 동일한 페르미온은 동일한 양자 상태에 존재할 수 없으며, 원자의 전자 배치, 화학 결합, 천체 특성 등을 설명하는 데 중요한 역할을 한다. - 물리학에 관한 - 전력
전력은 전압과 전류의 곱으로 계산되며, 발전소에서 생산되어 송전 및 배전을 통해 소비자에게 공급되고, 에너지 저장 기술을 통해 안정적으로 공급될 수 있으며, 산업, 상업, 가정 등 다양한 분야에서 소비된다. - 물리학에 관한 - N형 반도체
N형 반도체는 전자를 주된 전하 운반체로 사용하는 반도체이다.
2. 기체의 정의 및 어원
기체는 물질의 상태 중 하나이며[36], 압축이나 변형에 대한 저항이 작고, 팽창에 대해서는 전혀 저항을 보이지 않고 무한히 부피를 크게 하려고 하며, 부피와 모양이 일정하지 않은 상태를 말한다.[36] 기체는 물질의 세 가지 상태 중 하나이다.[37]
"가스"라는 단어는 17세기 초 플랑드르(Flemish) 화학자 (Jan Baptist van Helmont)가 처음 사용했습니다.[5] 그는 공기 이외에 최초로 알려진 기체인 이산화탄소를 확인했습니다.[6] 헬몬트의 단어는 고대 그리스어 카오스/χάοςgrc 의 음운적 표기인 것으로 보입니다. 네덜란드어(Dutch language)의 'g'는 "로크(loch)"의 'ch'처럼 발음되며(무성 연구개 마찰음, ), 이 경우 헬몬트는 연금술에서 처음으로 파라켈수스의 저술에서 확인된 기존 용법을 따랐을 뿐입니다. 파라켈수스의 용어에 따르면, "혼돈(chaos)"은 과 같은 의미였습니다.[7]
2. 1. 기체의 구성
기체는 원자, 분자, 이온 등의 입자로 구성된다. 순수 기체는 단일 원자 (예: 네온 등의 비활성 기체), 동종 원소 분자 (예: 산소)나 화합물 분자 (예: 이산화탄소) 등으로 구성될 수 있다. 혼합 기체는 여러 종류의 순수 기체가 섞인 것이다. (예: 공기)표준 온도 및 압력(STP)에서 안정적인 이원자 동핵 분자 기체인 화학 원소는 수소(H2), 질소(N2), 산소(O2), 그리고 두 가지 할로겐인 플루오린(F2)과 염소(Cl2)이다. 단원자 비활성 기체 – 헬륨(He), 네온(Ne), 아르곤(Ar), 크립톤(Kr), 크세논(Xe), 라돈(Rn) – 과 함께 이러한 기체들을 "원소 기체"라고 한다.
3. 기체의 물리적 성질

기체는 액체나 고체에 비해 입자 간 거리가 멀어 밀도와 점도가 낮다.[41] 기체는 압력과 온도 변화에 따라 부피 변화가 크며, 이는 압축률로 설명된다.[42] 기체는 확산 현상을 통해 용기 전체에 고르게 퍼진다.
대부분의 기체는 직접 관찰하기 어렵기 때문에, 압력, 부피, 온도와 같은 물리적 성질과 물질량(몰로 나타내는 입자의 수)와 같은 성질로 나타낸다. 이러한 네 가지 특성을 다양한 기체의 다양한 조건에서 측정한 사람들이 바로 로버트 보일, 자크 샤를, 존 돌턴, 조제프 루이 게이뤼삭, 아메데오 아보가드로 등이다. 그들의 연구를 통해 마침내 이러한 특성 간의 수학적 관계가 밝혀져 이상 기체 상태 방정식으로 결실을 맺었다.[11][12][13]
기체 입자는 서로 충분히 떨어져 있기 때문에 액체나 고체처럼 인접한 입자에 영향을 미치는 일이 거의 없다. 그러한 상호 작용(분자간 힘)은 기체 입자가 가진 전하에서 비롯된다. 같은 전하는 서로 반발하고, 반대 전하는 서로 끌어당긴다. 이온으로 이루어진 기체에는 영구적인 전하가 있고, 화합물 기체에는 극성 공유 결합이 있다. 극성 공유 결합의 경우, 화합물 전체는 중성이라도 분자 내에 전하가 집중되는 부분이 생긴다. 분자 간 공유 결합에는 일시적인 전하도 있으며, 이를 반데르발스 힘이라고 한다. 이러한 분자간 힘의 상호 작용은 각 기체를 구성하는 물질의 물리적 특성에 따라 다르다.[42]
3. 1. 기체의 물리적 특성
기체는 직접 관찰하기 어렵기 때문에, 압력, 부피, 입자의 수(몰), 온도와 같은 물리적 특성으로 설명된다.[11][12] 이러한 특성들은 로버트 보일, 자크 샤를, 존 돌턴, 조제프 루이 게이뤼삭, 아메데오 아보가드로 등의 과학자들에 의해 연구되었으며, 이상 기체 상태 방정식과 같은 수학적 관계로 표현된다.[41]기체 입자는 서로 넓게 분리되어 있어 액체나 고체보다 약한 분자간 힘을 갖는다.[13] 분자간 힘은 주로 반데르발스 힘으로 설명되며, 기체 입자 사이의 정전기적 상호작용에 의해 발생한다.[20][21] 같은 전하를 가진 입자들은 서로 밀어내고, 다른 전하를 가진 입자들은 서로 끌어당긴다.[42] 이온으로 이루어진 기체는 영구적인 전하를 가지며, 극성 공유 결합을 가진 화합물 기체는 분자 내 전하 불균형으로 인해 비교적 강한 분자간 힘을 경험한다. 분자 간 공유 결합에는 일시적인 전하도 존재하며, 이를 반데르발스 힘이라고 한다.
분자간 인력과 척력은 두 분자 사이의 거리에 따라 달라지며, 레너드-존스 퍼텐셜로 모델링할 수 있다.[22][23] 분자 사이의 거리가 멀면 약한 인력이 작용하여 서로 가까워지지만, 너무 가까워지면 강한 척력이 작용한다. 온도가 낮고 압력이 낮을 때는 인력이 지배적이지만, 온도가 높고 압력이 높을 때는 척력이 지배적이다.

기체는 낮은 밀도와 점도를 가지며, 압력과 온도에 따라 입자 운동이 영향을 받는다. 입자 간 거리와 속도 변화는 압축률로 나타내며, 굴절률과 같은 기체의 광학적 특성에도 영향을 미친다. 기체는 확산을 통해 용기 전체에 고르게 분포된다.
방정식에서 압력을 나타내는 기호는 '''"p"''' 또는 '''"P"'''이며, SI 단위는 파스칼이다.[44]

기체의 압력은 기체가 용기 표면에 미치는 단위 면적당 평균 힘으로 정의된다.
온도를 나타내는 기호는 ''T''이며, SI 단위는 켈빈이다.[45] 기체 입자의 속도는 절대 온도에 비례한다.

비체적을 나타내는 기호는 '''"v"'''이며, SI 단위는 m³/kg이다. 체적은 기호 '''"V"'''로 나타내며, SI 단위는 m³이다. 비체적은 강성 성질의 예시이며, 체적은 약성 성질의 예시이다.[46]
밀도는 기호 '''"ρ"'''(로)로 표시되며, SI 단위는 kg/m³이다. 밀도는 비체적의 역수이며, 정지 기체의 경우 용기 전체에서 균일하다.
3. 2. 거시적 관점과 미시적 관점
기체를 관찰할 때는 일반적으로 기준틀 또는 길이 눈금을 지정한다. 더 큰 길이 눈금은 기체의 거시적 또는 전체적인 관점에 해당하며, 이 영역은 많은 수의 기체 입자를 포함할 만큼 충분히 커야 한다.[14] 이 표본 크기에 대한 통계적 분석을 통해 이 영역 내 모든 기체 입자의 "평균" 거동(즉, 속도, 온도 또는 압력)을 얻는다.[14] 반대로, 더 작은 길이 눈금은 미시적 또는 입자 관점에 해당한다.[14]거시적으로 측정되는 기체 특성은 기체 입자 자체(속도, 압력 또는 온도) 또는 주변 환경(체적) 측면에서 측정된다.[14] 예를 들어, 로버트 보일은 기체의 압력과 체적이라는 거시적 특성의 관계를 연구했다.[14] 그의 실험에는 J자 모양의 압력계를 사용했는데, 그는 기체의 압력을 높이면 가두어진 기체의 체적이 감소한다는 것을 관찰했다(이는 반비례 관계로 알려져 있다).[14] 또한 보일은 각 관찰의 압력과 체적을 곱했을 때 그 곱이 일정하다는 것을 발견했다.[14]
기체 특성을 분석하는 데 사용할 수 있는 많은 수학적 도구가 있다. 보일의 실험 장비는 간단한 계산만으로 분석 결과를 얻을 수 있게 해주었으며, 이는 그가 기체가 "이상적"으로 거동하는 상대적으로 낮은 압력 상황에서 기체를 연구했기 때문에 가능했다.[43] 그러나 오늘날 사용되는 고도의 기술 장비는 기체가 더 이상 "이상적"으로 거동하지 않는 보다 특수한 작동 환경을 안전하게 탐구할 수 있도록 설계되었다.[43] 기체가 극한 조건에 노출됨에 따라, 이를 해석하기 위한 도구는 비점성 흐름에 대한 오일러 방정식에서 점성 효과를 완전히 고려하는 나비에-스토크스 방정식까지 더 복잡해진다.[14][43] 통계학과 다변량 분석과 같은 수학이 우주선의 대기권 재돌입과 같은 복잡한 상황의 해를 구하는 것을 가능하게 하고 있다.[43]

만약 강력한 현미경으로 기체를 관찰할 수 있다면, 어떤 특정한 모양이나 부피도 없이 다소 무작위적인 운동을 하는 입자들의 집합을 볼 수 있을 것이다. 이러한 기체 입자들은 다른 입자 또는 용기의 벽과 충돌할 때만 방향이 바뀐다. 이러한 기체의 미시적 관점은 기체 분자 운동론에서 다뤄진다.
'''기체 분자 운동론'''은 기체의 분자 구성과 운동을 고려하여 기체의 거시적 특성에 대한 통찰력을 제공한다.[47] 운동량과 운동 에너지의 정의를 시작으로, 운동량 보존 법칙과 정육면체의 기하학적 관계를 이용하여 온도와 압력과 같은 거시적 시스템 특성을 분자당 운동 에너지와 같은 미시적 특성과 관련지을 수 있다.[18][47]
'''기체 분자 운동론'''은 시스템(고려되는 기체 입자의 집합)이 온도 변화에 어떻게 반응하는지, 그리고 그에 따른 운동 에너지의 변화를 설명하는 데 도움이 될 수 있다.[47] 예를 들어, 절대 영도에서 시작하여 용기를 가열하여 시스템에 에너지를 가하면, 내부 에너지가 영점 에너지보다 높아지면, 즉 운동 에너지(열에너지라고도 함)가 0이 아니면, 기체 입자는 용기 주변을 움직이기 시작한다. 상자를 더 가열하면 개별 입자의 평균 속도가 증가한다. 모든 입자의 평균 속도가 높아지면 입자와 용기 사이, 그리고 입자 자체 사이의 충돌이 더 자주 발생한다.
거시적으로 측정 가능한 양인 '''압력'''은 이러한 미시적인 입자의 표면과의 충돌의 직접적인 결과이며, 개별 분자는 작은 힘을 가하여 특정 영역 내에서 가해지는 총 힘에 기여한다. 마찬가지로, 거시적으로 측정 가능한 양인 '''온도'''는 입자가 나타내는 전체 운동량 또는 운동 에너지를 정량화한 것이다.
4. 기체의 역사적 연구
기체의 성질에 대한 연구는 17세기 로버트 보일의 실험에서 시작되었다. 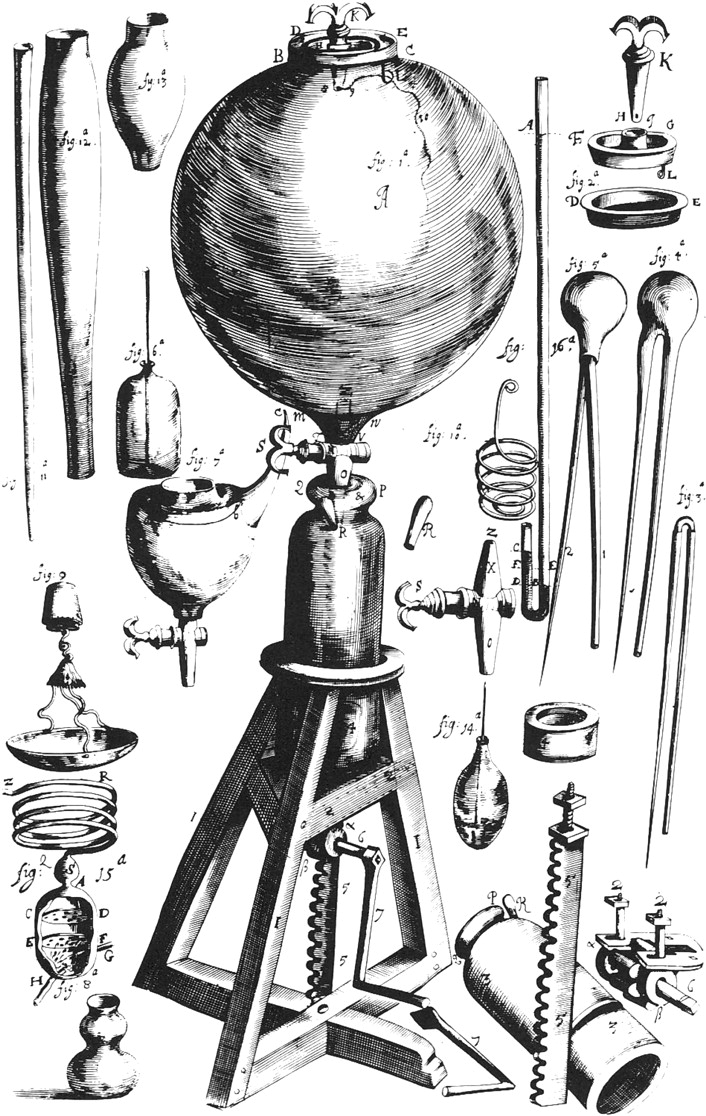
1787년, 프랑스의 물리학자 자크 샤를은 산소, 질소, 수소, 이산화탄소, 공기가 같은 온도 변화(80켈빈)에서 같은 정도로 팽창한다는 것을 발견하고, 기체의 부피와 온도가 비례한다는 샤를의 법칙을 발표했다.
1802년, 조제프 루이 게이뤼삭은 샤를의 법칙을 확장하여 더 광범위한 실험을 통해 기체의 부피와 온도의 비례 관계를 재확인하고,[33] 1809년에는 기체의 압력과 온도가 비례한다는 게이뤼삭의 법칙을 발표했다. 게이뤼삭은 샤를의 업적을 기려 자신이 발견한 법칙(부피-온도 관계)에 샤를의 이름을 붙였다.
1811년, 아메데오 아보가드로는 같은 부피의 순수 기체는 같은 수의 입자를 포함한다는 아보가드로의 법칙을 제시했다.[59] 이 이론은 1858년 스타니슬라오 칸니차로가 비이상적인 경우를 설명할 수 있을 때까지 널리 받아들여지지 않았다. 아보가드로의 연구를 기념하여 탄소-12 (¹²C) 1몰 당 원자의 수(6.022×1023 mol−1)를 아보가드로 수라고 부른다. 표준 온도 및 압력에서 이 수만큼의 기체 입자는 22.40리터의 부피(몰 부피)를 차지한다.
4. 1. 돌턴의 분압 법칙
1801년, 존 돌턴은 이상기체 법칙과 관련된 연구를 통해 분압 법칙을 발표했다. 비활성 기체 혼합물의 압력은 각 성분 기체의 압력의 합과 같다는 법칙이다.[34][56] 수학적으로, ''n''개의 성분에 대해 다음과 같이 나타낼 수 있다.: '''전체 압력 = 압력₁ + 압력₂ + ... + 압력''n'''''
돌턴의 저널 이미지는 그가 연구 경과를 기록하기 위해 사용했던 약칭 기호를 보여준다. 비활성 "탄성 유체"(기체)를 혼합했을 때 그의 저널에서 주요하게 관찰한 내용은 다음과 같다.[34][56]
- 액체와 달리, 무거운 기체는 혼합 시 바닥으로 가라앉지 않았다.
- 기체 입자의 종류는 최종 압력을 결정하는 데 영향을 미치지 않았다 (마치 그 크기가 무시할 만큼 작은 것처럼 작용했다).
5. 기체의 수학적 모델
(기체의) ''상태 방정식''은 기체의 상태 특성을 대략적으로 설명하거나 예측하는 데 사용되는 수리 모델이다. 현재 모든 조건에서 모든 기체의 특성을 정확하게 예측하는 단일 상태 방정식은 없다. 따라서 특정 온도 및 압력 범위의 기체에 대해 훨씬 더 정확한 여러 상태 방정식이 개발되었다. 가장 널리 논의되는 "기체 모델"은 "완전 기체", "이상 기체" 및 "실제 기체"이다.[28] 각 후속 모델은 적용되는 온도 범위를 확장한다.
== 이상 기체와 실제 기체 ==
이상 기체는 분자간 상호작용과 분자 자체의 부피를 무시하는 가상의 기체이다.[27] 실제 기체는 분자간 상호작용, 분자 자체의 부피, 비평형 열역학 효과 등을 고려해야 한다.[27][30]
두 개 이상의 분자 또는 원자 사이에 작용하는 인력 또는 척력을 ''분자간 힘''이라고 한다.[20][21] 물리화학 연구에서 비롯된 가장 중요한 분자간 힘 중 하나는 ''반데르발스 힘''이다. 반데르발스 힘은 점성, 유량, 기체역학 등 유체의 거의 모든 물리적 성질을 결정하는 데 중요한 역할을 한다.[27] 기체 분자 사이의 반데르발스 상호 작용은 "실제 기체"를 모델링하는 것이 "''이상 기체''"보다 수학적으로 더 어려운 이유이다.
[[파일:https://cdn.onul.works/wiki/source/194fc2b238e_7b480013.png|thumb|upright=1.8|실제 기체의 비이상성을 보여주는 등온 곡선. 압력이 변함에 따라 발생하는 부피 변화(Z, 압축인자)로 나타낸다.
압축인자 Z는 Z = PV/nRT와 같다.
압축인자 Z = 1인 이상 기체는 y축이 1과 같은 수평선으로 나타낸다. 비이상성은 Z = 1보다 위 또는 아래의 기체의 편차로 설명할 수 있다.]]
두 기체 분자 사이의 분자간 인력과 척력은 두 분자 사이의 거리에 따라 달라진다. 결합된 인력과 척력은 레너드-존스 퍼텐셜로 잘 모델링된다.[22][23]
저온 및 저압에서는 ''인력''이 지배적인 분자간 상호 작용이 되여 실제 기체가 차지하는 부피가 이상 기체 법칙으로 예측되는 부피보다 ''작다''.[27] 반면 고온 및 고압에서는 ''척력''이 지배적인 분자간 상호 작용이 되여 실제 기체가 차지하는 부피가 이상 기체 법칙으로 예측되는 부피보다 ''크다''.[27]
'''실제 기체'''는 이상기체와 달리 다음과 같은 특징을 가진다.[27]
- 압축 효과 (''Z''가 1.0에서 변하도록 허용)
- 가변 비열 (비열은 온도에 따라 변함)
- 반데르발스 힘 (압축성과 관련이 있으며, 다른 상태 방정식을 대체할 수 있음)
- 비평형 열역학 효과
- 분자 해리 및 기본 반응과 가변 조성에 대한 문제.
분류:열역학
분류:화학
분류:물리학
분류:기체
5. 1. 이상 기체와 실제 기체
이상 기체는 분자간 상호작용과 분자 자체의 부피를 무시하는 가상의 기체이다.[27] 실제 기체는 분자간 상호작용, 분자 자체의 부피, 비평형 열역학 효과 등을 고려해야 한다.[27][30]두 개 이상의 분자 또는 원자 사이에 작용하는 인력 또는 척력을 ''분자간 힘''이라고 한다.[20][21] 물리화학 연구에서 비롯된 가장 중요한 분자간 힘 중 하나는 ''반데르발스 힘''이다. 반데르발스 힘은 점성, 유량, 기체역학 등 유체의 거의 모든 물리적 성질을 결정하는 데 중요한 역할을 한다.[27] 기체 분자 사이의 반데르발스 상호 작용은 "실제 기체"를 모델링하는 것이 "''이상 기체''"보다 수학적으로 더 어려운 이유이다.
[[파일:https://cdn.onul.works/wiki/source/194fc2b238e_7b480013.png|thumb|upright=1.8|실제 기체의 비이상성을 보여주는 등온 곡선. 압력이 변함에 따라 발생하는 부피 변화(Z, 압축인자)로 나타낸다.
압축인자 Z는 Z = PV/nRT와 같다.
압축인자 Z = 1인 이상 기체는 y축이 1과 같은 수평선으로 나타낸다. 비이상성은 Z = 1보다 위 또는 아래의 기체의 편차로 설명할 수 있다.]]
두 기체 분자 사이의 분자간 인력과 척력은 두 분자 사이의 거리에 따라 달라진다. 결합된 인력과 척력은 레너드-존스 퍼텐셜로 잘 모델링된다.[22][23]
저온 및 저압에서는 ''인력''이 지배적인 분자간 상호 작용이 되여 실제 기체가 차지하는 부피가 이상 기체 법칙으로 예측되는 부피보다 ''작다''.[27] 반면 고온 및 고압에서는 ''척력''이 지배적인 분자간 상호 작용이 되여 실제 기체가 차지하는 부피가 이상 기체 법칙으로 예측되는 부피보다 ''크다''.[27]
'''실제 기체'''는 이상기체와 달리 다음과 같은 특징을 가진다.[27]
- 압축 효과 (''Z''가 1.0에서 변하도록 허용)
- 가변 비열 (비열은 온도에 따라 변함)
- 반데르발스 힘 (압축성과 관련이 있으며, 다른 상태 방정식을 대체할 수 있음)
- 비평형 열역학 효과
- 분자 해리 및 기본 반응과 가변 조성에 대한 문제.
6. 기체 분리 및 활용
6. 1. 기체 분리 방법
화학 분야 등에서 기체를 성분별로 다루려고 하면 주변 공기와 섞이기 쉽기 때문에 특별한 장치가 필요하다.- '''물에 녹는 성질을 가지고 공기보다 가벼운 경우에는, 상향식 기체 포집으로 모은다.''' 예: 암모니아
- '''물에 녹는 성질을 가지고 공기보다 무거운 경우에는, 하향식 기체 포집으로 모은다.''' 예: 이산화황, 염화수소
- '''물에 녹지 않는 경우에는, 수상치환으로 모은다.''' 예: 일산화질소, 질소, 산소, 수소
6. 2. 기체의 활용
기체는 유체이기 때문에 형태를 유지할 수 없다. 하지만 고체 용기에 가두어 이용하는 예도 있다. 부드러운 소재에 가두면 부피가 탄성적으로 변형되므로, 충격 흡수가 가능한 소재가 된다. 또한 열전도도가 낮기 때문에 단열 효과도 있다. 스티로폼은 많은 미세한 거품 형태로 기체를 포함하고 있어 이러한 성질을 강하게 나타낸다.7. 기체 관련 특수 주제
7. 1. 압축성
기체는 압력 변화에 따라 부피가 크게 변하는 압축성을 가진다. 실제 기체와 이상 기체의 압축성 차이를 나타내는 지표를 압축인자(Z)라고 한다. 이 인자는 실제 비체적과 이상 기체의 비체적의 비율로 표현되며, 이상 기체 상태 방정식을 실제 기체의 상태 방정식으로 변환하는 데 사용된다. "보정 계수"의 일종으로 간주되며, 이상 기체 법칙을 실제 설계 등에 적용할 수 있는 범위를 넓히는 역할을 한다. 일반적으로 Z 값은 1에 매우 가깝지만, 매우 낮은 온도 범위에서는 Z 값이 변하는 것을 볼 수 있다.7. 2. 난류
유체역학에서 난류(乱流)는 무질서하고 확률적으로 변하는 특성을 가진 흐름의 상태이다. 난류는 운동량의 확산이 작고 전달량이 크며, 흐름의 압력과 속도가 시간과 공간에 따라 급격하게 변한다. 1999년 9월 15일 후안 페르난데스 제도(로빈슨 크루소 제도) 부근의 기상 패턴 위성 사진은 카르만 와류열(Kármán vortex street)이라고 불리는 난류 구름 패턴을 보여준다.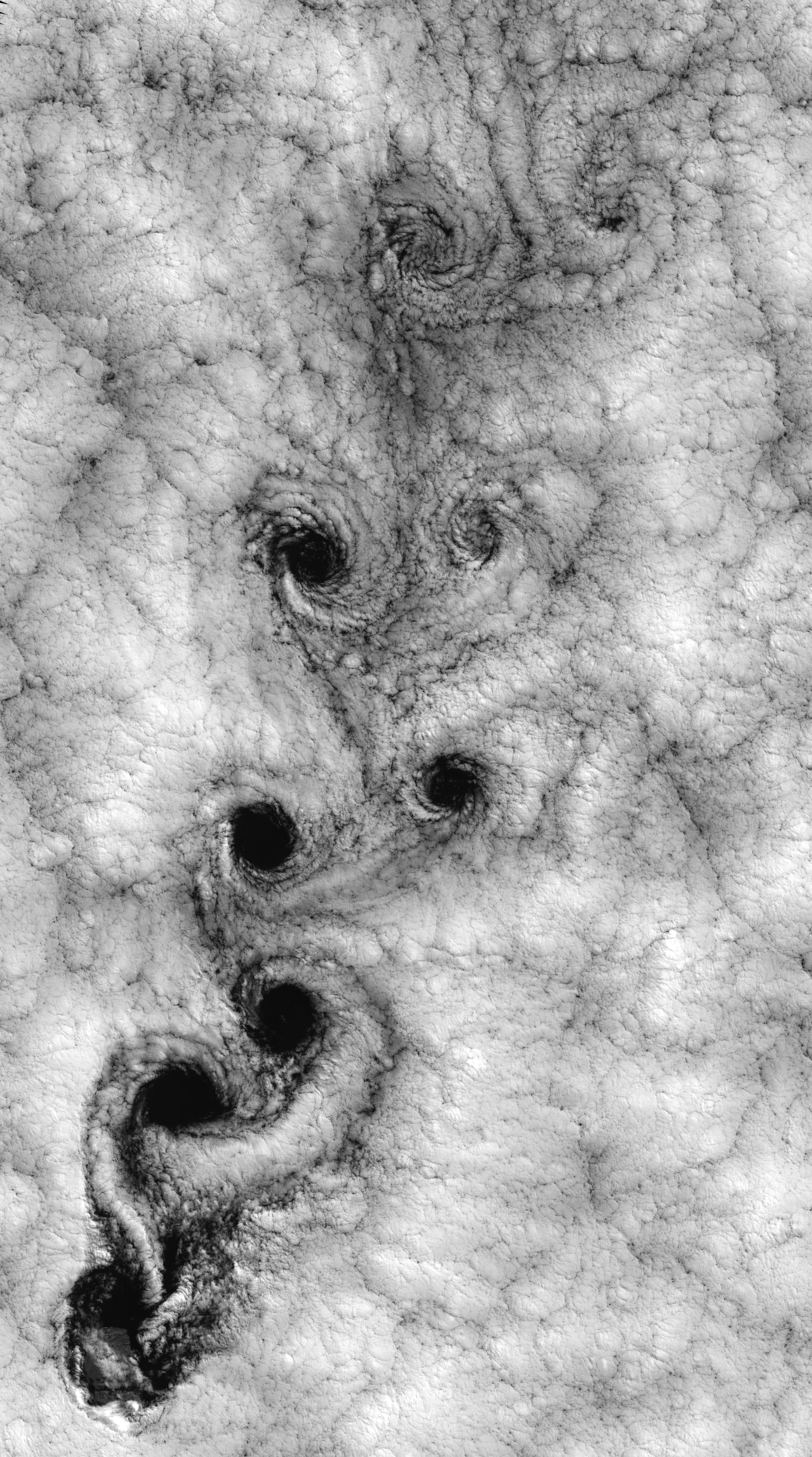
7. 3. 점성
점성(Viscosity)은 유체의 흐름에 대한 저항을 나타내는 물리적 특성이며, 인접한 분자들이 서로 얼마나 잘 달라붙는지를 측정하는 값이다. 고체는 강한 분자간 힘 때문에 전단력을 견딜 수 있지만, 유체는 비슷한 하중이 가해지면 지속적으로 변형된다. 기체는 액체보다 점성 값이 낮지만, 여전히 관찰 가능한 특성이다.만약 기체에 점성이 없다면, 날개 표면에 달라붙어 경계층을 형성하지 않을 것이다. 델타익의 슐리렌 사진 이미지 연구는 기체 입자가 서로 달라붙는다는 것을 보여준다.
7. 4. 경계층
기체 입자는 기체 속을 이동하는 물체의 표면에 달라붙는 성질을 가진다. 그러한 입자의 층을 '''경계층'''이라고 부른다. 물체 표면에 입자가 달라붙는 것은 기본적으로 마찰이 원인이다. 그러면 물체와 경계층을 합친 부분이 함께 기체 속을 이동하는 형태를 형성한다. 경계층을 물체 표면에서 떼어내려면, 형태를 변화시켜 흐름의 경로를 완전히 바꾸면 된다. 고전적인 예로, 항공기의 실속은 경계층의 박리(剥離)가 원인이다.
7. 5. 최대 엔트로피 원리
자유도의 총 수가 무한대에 접근함에 따라, 계는 가장 높은 다중도에 해당하는 거시 상태에서 발견될 것이다. 이를 설명하기 위해, 얼어붙은 금속 막대의 표면 온도를 관찰하는 것을 예시로 들 수 있다. 표면 온도의 열화상을 사용하여 표면의 온도 분포를 확인할 수 있는데, 온도의 이 초기 관찰은 "미시 상태"를 나타낸다. 어떤 미래의 시간에, 표면 온도의 두 번째 관찰은 두 번째 미시 상태를 생성한다. 이 관찰 과정을 계속함으로써, 막대 표면의 열적 역사를 보여주는 일련의 미시 상태를 생성할 수 있다. 이러한 미시 상태의 역사적 계열을 특징짓는 것은 모든 미시 상태를 단일 그룹으로 성공적으로 분류하는 거시 상태를 선택함으로써 가능하다.7. 6. 열역학적 평형
계에서 에너지 전달이 중단될 때, 이 상태를 열역학적 평형이라고 한다. 일반적으로 이 상태는 계와 주변 환경이 같은 온도에 있어 열이 더 이상 전달되지 않음을 의미한다. 또한 외부 힘이 균형을 이루고(부피가 변하지 않음), 계 내의 모든 화학 반응이 완료되었음을 의미한다. 이러한 과정의 시간 척도는 해당 계에 따라 다르다. 상온에서 녹도록 방치된 얼음 용기는 몇 시간이 걸리는 반면, 반도체의 경우 장치가 켜짐에서 꺼짐 상태로 전환될 때 발생하는 열 전달은 수 나노초 정도일 수 있다.8. 한국의 기체 산업 및 기술
9. 추가 설명이 필요한 부분
참조
[1]
웹사이트
Gas
http://www.merriam-w[...]
2023-08-07
[2]
서적
The Journal of Physical Chemistry, Volume 11
American Chemical Society, Faraday Society, Chemical Society (Great Britain)
1907
[3]
논문
—just right for forming a Bose-Einstein condensate
https://physics.aps.[...]
2009-11-09
[4]
웹사이트
Quantum Gas Microscope Offers Glimpse Of Quirky Ultracold Atoms
https://www.scienced[...]
2023-02-06
[5]
서적
Ortus medicine, id est initial physicae inaudita... authore Joanne Baptista Van Helmont,...
https://books.google[...]
apud L. Elzevirium
1652
[6]
잡지
The Re-Designed Solar System
https://archive.org/[...]
1966-06
[7]
어원사전
gas
[8]
서적
A textbook on chemistry
https://play.google.[...]
Harper and Sons
1861
[9]
서적
OED Online
Oxford University Press
2021-06
[10]
서적
For Dawn to Decadence: 500 Years of Western Cultural Life
https://www.harperco[...]
HarperCollins Publishers
2000
[11]
서적
The Journal of Physical Chemistry, Volume 11
Cornell
1907
[12]
서적
Faraday as a Discoverer
1868
[13]
서적
Concept Development Studies in Chemistry
http://cnx.org/conte[...]
2008
[14]
문서
Anderson
[15]
서적
Theory of Heat
Dover Publications
1904
[16]
서적
The Journal of Physical Chemistry, Volume 11
Society, Cornell
1907
[17]
서적
Thermodynamics
https://archive.org/[...]
McGraw-Hill
1977
[18]
문서
McPherson
[19]
웹사이트
Canonical Ensemble
https://chem.librete[...]
2020-11-26
[20]
논문
On the history of key empirical intermolecular potentials
2023-10
[21]
서적
Intermolecular and Surface Forces
Elsevier
2011
[22]
논문
On the History of the Lennard-Jones Potential
https://onlinelibrar[...]
2024-06
[23]
논문
On the determination of molecular fields. —II. From the equation of state of a gas
https://royalsociety[...]
1924-10
[24]
논문
A child of prediction. On the History, Ontology, and Computation of the Lennard-Jonesium
https://linkinghub.e[...]
2024-02
[25]
논문
Thermophysical Properties of the Lennard-Jones Fluid: Database and Data Assessment
https://pubs.acs.org[...]
2019-10-28
[26]
웹사이트
Lennard-Jones Potential - Chemistry LibreTexts
https://chem.librete[...]
2020-08-22
[27]
웹사이트
14.11: Real and Ideal Gases - Chemistry LibreTexts
https://chem.librete[...]
2021-02-06
[28]
문서
Anderson
[29]
문서
John
[30]
문서
John
[31]
웹사이트
Permanent gas
https://www.oxfordre[...]
Oxford University Press
2021-04-03
[32]
문서
McPherson
[33]
문서
McPherson
[34]
서적
John Dalton
https://archive.org/[...]
1906
[35]
서적
気体
岩波書店
[36]
백과사전
ブリタニカ百科事典 【気体】
[37]
Harvnb
[38]
간행물
The Journal of physical chemistry, Volume 11
American Chemical Society, Faraday Society, Chemical Society (Great Britain)
[39]
저널
84Sr—just right for forming a Bose-Einstein condensate
http://physics.aps.o[...]
[40]
웹사이트
Quantum Gas Microscope Offers Glimpse Of Quirky Ultracold Atoms
http://www.scienceda[...]
2009-11-04
[41]
간행물
The Journal of physical chemistry, Volume 11
[42]
서적
Concept Development Studies in Chemistry
http://cnx.org/conte[...]
[43]
Harvnb
[44]
서적
Theory of Heat
Dover Publications
[45]
간행물
Society
[46]
서적
Thermodynamics
McGraw-Hill
[47]
Harv
[48]
Harvnb
[49]
Harvnb
[50]
Harvnb
[51]
Harvnb
[52]
문서
현실적으로, 기체는 모두 저온에서는 응축하여 액체가 되므로, 제한된 온도 범위에서만 기체의 체적을 측정할 수 있다
[53]
문서
1848년에 스코틀랜드의 수학자, 물리학자 William Thomson
[54]
Harvnb
[55]
Harvnb
[56]
서적
John Dalton
[57]
웹사이트
http://www.etymonlin[...]
[58]
위키소스
The Chemical History of a Candle/Lecture II
[59]
서적
완자 화학 Ⅰ(1권)
비유와상징
2006-07-01
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
