하슘
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
하슘(Hs)은 원자 번호 108번의 인공적으로 합성된 화학 원소이다. 1984년 독일의 중이온 연구소(GSI) 연구팀에 의해 처음 합성되었으며, 헤센 주의 라틴어 이름인 'Hassia'에서 유래하여 '하슘'으로 명명되었다. 하슘은 방사성 원소로, 안정 동위원소는 존재하지 않으며, 다양한 동위원소가 실험적으로 합성되었다. 하슘은 8족 전이 금속으로, 오스뮴과 유사한 화학적 성질을 보이며, +8의 높은 산화 상태를 가질 것으로 예측된다. 하슘 사산화물(HsO₄)과 같은 화합물이 합성되었으며, 상대론적 효과로 인해 오스뮴과는 약간의 차이를 보일 것으로 예상된다.
더 읽어볼만한 페이지
- 하슘 - 하슘 동위 원소
하슘 동위 원소는 인공적으로 생성된 방사성 원소인 하슘의 다양한 동위 원소들로, 질량수가 263에서 277 사이인 14가지가 확인되었으며 모두 불안정하여 알파 붕괴를 통해 붕괴되고, 가장 안정적인 동위 원소는 반감기가 16초인 277Hs이다. - 장소 이름이 포함된 화학 원소 - 루테튬
루테튬은 원소 기호 Lu, 원자 번호 71을 갖는 희토류 원소로, 란타넘족 중 밀도, 녹는점, 경도가 가장 높고, 주로 +3의 산화 상태를 가지며, 안정 동위원소와 방사성 동위원소 형태로 존재하고, 제한적인 상업적 용도에도 불구하고 촉매, LED, PET, 연대 측정, 암 치료 등에 사용된다. - 장소 이름이 포함된 화학 원소 - 레늄
레늄은 텅스텐과 탄소 다음으로 녹는점이 높고 끓는점이 가장 높은 은백색 금속 원소이며, 몰리브데넘 광석에서 주로 추출되어 제트 엔진, 촉매, 고옥탄가 휘발유 생산 등에 사용된다. - 인공 원소 - 플루토늄
플루토늄은 명왕성에서 유래된 이름의 방사성 은백색 금속 원소로, 산화 시 황갈색으로 변하며 여러 동소체와 산화 상태를 가지고 핵무기와 원자력 발전 연료, 우주 탐사용 열원으로 사용되지만 높은 방사능 독성으로 주의가 필요하다. - 인공 원소 - 로렌슘
로렌슘은 기호 Lr, 원자 번호 103번의 악티늄족 초우라늄 인공 방사성 원소로, 1961년과 1965년 각각 다른 방법으로 합성되어 발견 공로를 인정받았으며, 현재 13개의 동위원소가 알려져 있고, 화학적 성질은 완전히 밝혀지지 않았지만 3가 이온으로 존재하며 d-구역 원소의 특징을 보인다.
2. 역사
1984년, 독일 중이온 연구소(GSI)의 페터 아름브루스터와 고트프리트 뮌첸베르크 등이 UNILAC을 이용해 납(208Pb)에 철(58Fe) 이온을 충돌시키는 실험[93]을 통해 하슘 합성에 성공했다.
:
2002년에는 스위스 베른 대학교에서 7개의 하슘 원자로부터 산화물과 옥소산염을 합성하는 실험[94]이 진행되어, 하슘의 화학적 성질 일부가 측정되었다.
:
:
2. 1. 발견
1960년대의 핵반응은 높은 들뜸 에너지를 생성하여 4개 또는 5개의 중성자를 방출해야 했고, 이는 핵융합 가능성을 감소시키고 생성된 복합핵이 분열되어 새로운 원소를 형성하지 못하게 했다. 또한 핵융합 과정은 중성자가 부족한 핵을 생성하는데, 더 무거운 원소는 안정성을 위해 양성자당 더 많은 중성자가 필요했다.[2][3] 따라서 중성자의 필요한 방출은 일반적으로 더 짧은 수명을 가진 최종 생성물을 초래했고, 가벼운 빔(6~10개의 양성자)을 사용하면 106까지의 원소만 합성할 수 있었다.[4]더 무거운 원소 합성을 위해, 소련의 물리학자 유리 오가네시안은 핵물리학 합동연구소(JINR)에서 "저온 핵융합" 메커니즘을 제안했다. 이 방법은 폭격받는 핵이 양성자와 중성자의 마법수를 가진 납-208 또는 그 근처의 핵을 사용한다.[5] 마법수를 가진 핵은 추가적인 안정성을 가지며, 이로 인해 새로 생성된 복합핵의 들뜸 에너지가 감소하여 안정된 상태에 도달하기 위해 더 적은 중성자 방출이 필요하다.[6]
저온 핵융합은 1974년 JINR에서 원소 106 합성에 처음으로 성공적으로 사용되었다.[6] 미국의 로렌스 버클리 국립 연구소도 이 기술에 관심을 보였고, 오가네시안은 "곧 우리는 이러한 반응에서 107... 108 원소를 얻으려고 할 것입니다."라고 말했다.[6]
1978년, 오가네시안 연구팀은 하슘(원소 108) 합성을 처음 시도했다. 라듐(226Ra)과 칼슘(48Ca)의 융합 반응을 사용했지만,[8] 데이터 해석에 불확실성을 느껴 명확한 발견 주장을 하지 않았다. 같은 해, JINR의 다른 연구팀은 납(208Pb)과 철(58Fe) 반응에서 원소 108 합성 가능성을 조사했지만, 역시 불확실성 때문에 발견을 주장하지 않았다.[9]

1983년, JINR에서 새로운 실험이 수행되었고, 비스무트(209Bi)와 망가니즈(55Mn), 납(207Pb, 208Pb)과 철(58Fe), 칼리포르늄(249Cf)과 네온(22Ne)의 충돌 실험을 통해 원소 108 합성을 시도했지만, 발견으로 주장되지는 않았다.
1984년, 두브나의 JINR 연구원들은 비스무트와 납 표적에 망가니즈와 철 이온을 충돌시켜 21건의 자발적 핵분열 사건을 기록하고, 264108이 발생했다고 결론지었다.
1984년 후반, 페터 아름브루스터와 고트프리트 뮌첸베르크가 이끄는 중이온 연구소(GSI) 연구팀은 가속된 철(58Fe) 핵을 납(208Pb) 표적에 충돌시켜 원소 108을 생성하려고 시도했다.[12] GSI는 265108의 원자 3개의 합성을 보고했고, 2년 후에는 짝수-짝수 동위원소인 264108의 원자 1개의 합성을 보고했다.[13]
2. 2. 명명
1984년 후반, 페터 아름브루스터와 고트프리트 뮌첸베르크가 이끄는 중이온 연구소(GSI) 연구팀은 납(208Pb) 표적에 가속된 철(58Fe) 핵을 충돌시켜 원소 108번을 생성하려 시도했다.[12] 같은 해, 두브나(Dubna)의 JINR 연구원들은 비스무트와 납 표적에 망가니즈와 철 이온을 충돌시킨 결과, 21건의 자발적 핵분열 사건을 기록했고, 이것이 264108에 의해 발생했다고 결론지었다.[13]1990년, 국제순수 및 응용화학연합(IUPAC)은 원소의 존재가 확립된 후 발견자가 이름을 제안할 수 있다고 재확인했다. 1992년 9월 7일, 공식적으로 인정받은 독일 발견자들은 중이온 연구소(GSI)에서 107번부터 109번 원소에 대한 명명식을 개최했는데, 108번 원소에 대해 과학자들은 "하슘"이라는 이름을 제안했다.[18] 이 이름은 연구소가 위치한 독일 헤센주의 라틴어 이름인 ''Hassia''에서 유래했다.[14]

그러나 1994년, IUPAC은 108번 원소를 독일 물리학자 오토 한의 이름을 딴 "하늄"(Hn)으로 명명할 것을 권고했다.[20] GSI는 이 제안이 발견자에게 이름을 제안할 권리를 부여하는 오랜 관례에 반한다고 항의했고,[22] 미국 화학 학회는 GSI를 지지했다.
1997년에 최종 타협이 이루어져 108번 원소는 ''하슘''(Hs)으로 명명되었다.[24][25]
3. 동위원소
하슘은 안정한 동위원소를 가지지 않으며, 자연적으로 발생하지 않는다. 여러 방사성 동위원소가 실험실에서 두 원자를 융합하거나 더 무거운 원소의 붕괴를 관찰하여 합성되었다. 각 하슘 동위원소의 핵은 소량만 합성되었으며, 따라서 이러한 동위원소의 반감기를 매우 정확하게 결정할 수 없다.[33][34]
1960년대까지 액체방울 모형은 핵 구조에 대한 주요 설명이었다. 이 모형은 약 280개의 핵자를 가진 핵의 경우 핵분열 장벽이 사라질 것이라고 제안했다.[36][37] 따라서 핵이 그것들을 안정시킬 수 있는 구조를 형성하기 전에 거의 즉시 자발적 핵분열이 발생할 것이라고 생각되었다.[4] 원자 번호(Z)가 103 근처인 핵은 상당한 시간 동안 존재하기에는 너무 무겁다고 여겨졌다.[38]
이후 핵 껍질 모형은 약 300개의 핵자를 가진 핵이 자발적 핵분열에 더 강하고 주로 더 긴 반감기를 가진 알파 붕괴를 겪을 안정성의 섬을 형성할 것이라고 제안했다.[36][37] 핵종의 차트에서 이러한 안정성에 해당하는 영역의 중심은 270Hs로 결정되었으며, 변형된 핵(구형에서 멀리 떨어진 핵)의 경우 양성자에 대한 마법수는 108, 중성자에 대한 마법수는 162가 될 것으로 예상된다.[39]
3. 1. 주요 동위원소
하슘은 안정 동위원소가 없으며, 자연적으로 발생하지 않는다. 실험실에서 두 원자를 융합하거나 더 무거운 원소의 붕괴를 관찰하는 방식으로 여러 방사성 동위원소가 합성되었다. 2019년까지 만들어진 하슘의 양은 수백 개 원자 수준이었다.[33][34] 질량수가 263에서 277까지(274와 276 제외)인 13가지 동위원소가 보고되었으며, 이 중 하슘-265, -266, -267, -269, -271, -277의 6가지 동위원소는 준안정 상태를 갖는 것으로 알려져 있다. 그러나 하슘-277의 준안정 상태는 확인되지 않았다.[35]대부분의 하슘 동위원소는 주로 알파 붕괴를 통해 붕괴하며, 자발적 핵분열을 하는 하슘-277은 예외적인 경우이다. 가벼운 동위원소는 보통 두 개의 가벼운 핵이 직접 융합되어 합성되지만, 무거운 동위원소는 일반적으로 원자 번호가 더 큰 핵이 붕괴하여 생성되는 것으로 관찰되었다.[27]
1991년 폴란드의 물리학자 지그문트 파티크(Zygmunt Patyk)와 아담 소비체프스키(Adam Sobiczewski)는[42] 변형된 핵에서 양성자 마법수는 108, 중성자 마법수는 162라고 예측했다. 이는 이러한 핵들이 바닥 상태에서 영구적으로 변형되었지만, 추가적인 변형에 대해 높고 좁은 핵분열 장벽을 가져 자발적 핵분열에 대해 비교적 긴 수명을 갖는다는 것을 의미한다.[43][44] 270Hs는 변형된 이중 마법 핵의 유력한 후보로 여겨진다.[45] 실험 데이터는 부족하지만, 기존 데이터는 연구자들이 ''N''=162를 마법수로 지정하는 것을 뒷받침하는 것으로 해석된다. 특히 이 결론은 269Hs, 270Hs, 271Hs의 붕괴 데이터에서 도출되었다.
4. 성질
하슘은 계산 결과에 따르면 지금까지 발견된 가장 무거운 8족 원소로 예상되며, 이는 주기율표의 법칙과 일치한다. 하슘의 성질은 오스뮴의 무거운 동족체와 비슷할 것으로 예상되지만, 모든 초악티늄 원소와 마찬가지로 상대론적 효과 때문에 약간의 차이가 있을 것으로 보인다.[57]
하슘 또는 그 화합물의 성질은 극소량만 측정되었다. 이는 하슘 생산이 매우 제한적이고 비용이 많이 들며,[57] 하슘(및 그 모원소)이 매우 빠르게 붕괴되기 때문이다. 하슘 사산화물의 흡착 엔탈피와 같이 몇 가지 특정 화학적 성질은 측정되었지만, 하슘 금속의 성질은 아직 알려지지 않았고 예측만 가능하다.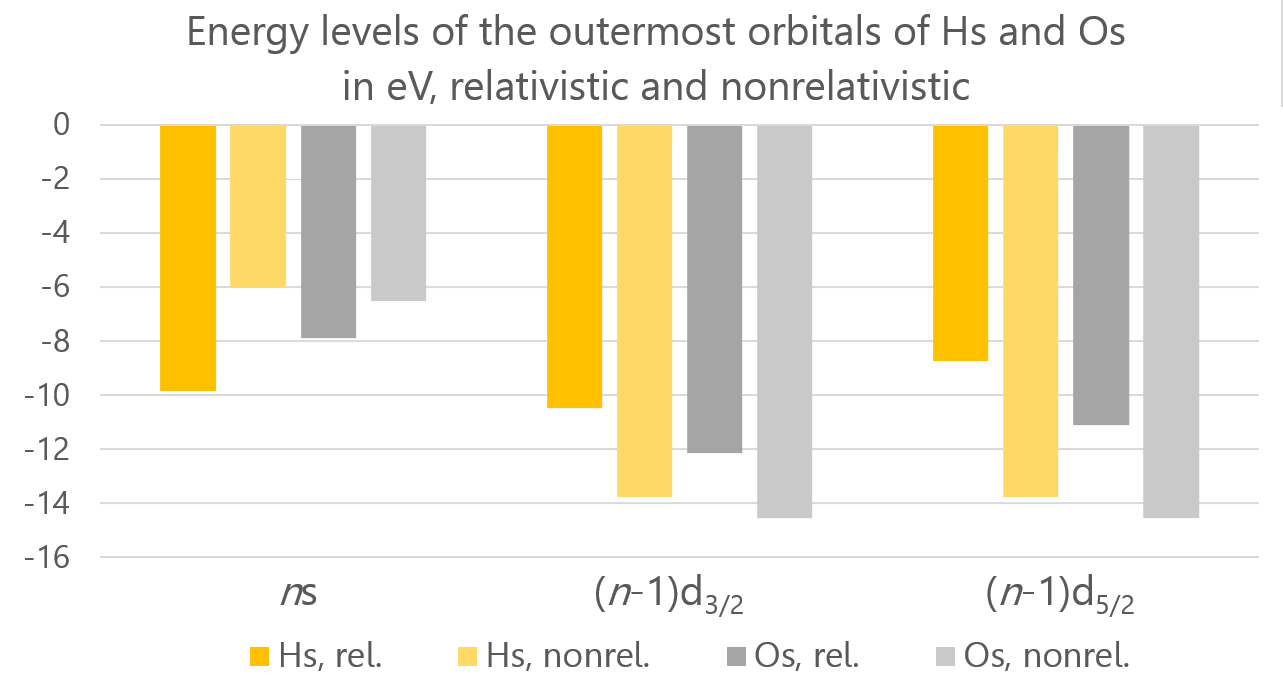
하슘에 대한 상대론적 효과는 높은 핵전하로 인해 발생하는데, 이는 핵 주변의 전자가 더 빠르게(그 속도가 빛의 속도와 비슷해질 정도로) 움직이게 만들기 때문이다.[57] 주요 효과는 다음과 같다.
- 직접 상대론적 효과: 원자 번호가 증가함에 따라 전자와 핵 사이의 정전기적 인력이 증가한다. 이로 인해 전자의 속도가 증가하고, 이는 질량 증가로 이어진다. 이는 다시 원자 궤도함수의 수축, 특히 s와 p1/2 궤도함수의 수축으로 이어진다. 이 전자들은 원자에 더 강하게 결합하고 핵에서 떼어내기 어려워진다.
- 간접 상대론적 효과: s와 p1/2 궤도함수는 핵에 더 가까이 있으므로, 핵 전하의 더 큰 부분을 "차폐"한다. 따라서 나머지 전자를 끌어들이는 전하가 줄어들고, 그 궤도함수는 팽창하여 핵에서 떼어내기 쉬워진다.
- 스핀-궤도 상호작용: 전자의 스핀은 상대론적으로 궤도와 상호작용하며, 이 상호작용은 서브쉘을 에너지가 다른 두 개로 분리시킨다. 예를 들어, 6개의 6p 전자 중 2개는 6p1/2가 되고 4개는 6p3/2가 된다.
직접 및 간접 상대론적 효과의 결합으로 인해, 중성 원자와 비교하여 Hs+ 이온은 7s 전자가 아니라 6d 전자가 부족하다. 반면 Os+는 중성 원자와 비교하여 6s 전자가 부족하다. 하슘의 이온 반지름(+8 산화 상태)은 상대론적 효과에 의한 6p3/2 궤도함수의 팽창으로 인해 오스뮴보다 크다.
이러한 상대론적 효과는 오스뮴에 비해 이온화 에너지의 증가, 전자 친화도의 감소 및 +8 산화 상태의 안정성 증가를 설명하는데, 상대론적 효과가 없다면 이러한 경향은 반대가 된다. 상대론적 효과는 하슘 화합물의 원자화 에너지를 감소시키는데, 이는 d 궤도함수의 스핀-궤도 상호작용이 전자와 핵 사이의 결합 에너지를 낮추고 상대론적 효과가 결합에서 이온 결합의 특성을 감소시키기 때문이다.
4. 1. 물리적 성질
하슘은 지구상에서 자연적으로 발견되지 않는 것으로 알려져 있다. 알려진 모든 하슘 동위원소의 반감기는 매우 짧아, 현재까지 어떠한 원시 원소 형태의 하슘도 남아 있지 않다. 그러나 아직 발견되지 않은, 더 긴 반감기를 가진 동위원소나 핵 이성질체가 존재할 가능성은 남아 있다.8족 원소에 속하는 하슘은 이전 원소들처럼 높은 녹는점을 가질 것으로 예상된다. 예를 들어, 같은 족에 속하는 철(Fe)은 1538 °C, 루테늄(Ru)은 2334 °C, 오스뮴(Os)은 3033 °C에서 녹는다. 따라서 하슘 역시 상온에서 고체 상태일 것으로 예측되지만, 정확한 녹는점은 아직 계산되지 않았다. 하슘은 육방 최밀 충진 구조를 가질 것으로 예상되며, 이는 가벼운 동족원소인 오스뮴과 유사하다. 순수한 하슘 금속의 체적 탄성률은 450 GPa로 계산되었는데,[61] 이는 다이아몬드의 442 GPa와 비슷한 수준이다.[62] 또한, 하슘은 알려진 118개 원소 중 가장 밀도가 높은 원소 중 하나로, 예상 밀도는 27~29 g/cm³이다. 이는 오스뮴의 측정 밀도인 22.59 g/cm³보다 높은 값이다.
하슘의 원자 반지름은 약 126 pm로 예상된다. 7s 오비탈의 상대론적 안정화와 6d 오비탈의 불안정화 때문에, Hs⁺ 이온은 [Rn] 5f¹⁴ 6d⁵ 7s²의 전자 배열을 가질 것으로 예측된다. 이는 7s 전자 대신 6d 전자를 잃는 것으로, 가벼운 동족 원소들의 경향과는 반대이다. Hs²⁺ 이온은 [Rn] 5f¹⁴ 6d⁵ 7s¹의 전자 배열을 가질 것으로 예상되는데, 이는 Os²⁺ 이온과 유사하다. 화합물 내에서 하슘은 d-블록 원소의 결합 특성을 보일 것으로 계산되며, 이 결합은 주로 6d₃/₂ 및 6d₅/₂ 오비탈에 의해 이루어진다. 이전 주기의 원소들과 비교했을 때, 7s, 6p₁/₂, 6p₃/₂, 7p₁/₂ 오비탈이 더 중요한 역할을 할 것이다.
원자의 거시적-미시적(MM) 이론에 따르면, 원자 번호 108번(Z=108)은 양성자 마법수로 여겨지며, 중성자 마법수(N=162)를 함께 갖는 하슘-270은 긴 반감기를 가질 가능성이 있다. 2001년 5월, 베른 대학교와 파울 셰러 연구소 등의 국제 연구팀은 퀴륨-248과 마그네슘-26을 이용하여 하슘 합성에 성공[95]했지만, 추정된 반감기는 2~7초로, 특별히 긴 수명을 가지지는 않았다. 한편, 중성자 수가 170을 넘으면 다시 안정 경향이 강해진다는 이론 연구[96]에서, 중성자 마법수(N=184)를 갖는 하슘-292를 안정의 섬 중심으로 보는 견해[97]도 존재한다.
4. 2. 화학적 성질
여러 계산 결과에 따르면 하슘은 지금까지 발견된 가장 무거운 8족 원소로 예상되며, 이는 주기율표의 법칙과 일치한다. 하슘의 성질은 일반적으로 오스뮴의 무거운 동족체에서 기대되는 성질과 비슷할 것으로 예상되지만, 모든 초악티늄 원소와 마찬가지로 상대론적 효과 때문에 약간의 차이가 있을 것으로 보인다.[57]하슘 또는 그 화합물의 성질은 극소량만 측정되었다. 이는 하슘 생산이 매우 제한적이고 비용이 많이 들며,[57] 하슘(및 그 모원소)이 매우 빠르게 붕괴되기 때문이다. 하슘 사산화물의 흡착 엔탈피와 같이 몇 가지 특정 화학적 성질은 측정되었지만, 하슘 금속의 성질은 아직 알려지지 않았고 예측만 가능하다.
8족 원소의 이전 원소들은 비교적 높은 녹는점을 갖는다. 예를 들어 철(Fe)은 1538 °C, 루테늄(Ru)은 2334 °C, 오스뮴(Os)은 3033 °C이다. 이들과 마찬가지로 하슘 또한 상온에서 고체일 것으로 예측되지만, 녹는점은 정확하게 계산되지 않았다. 하슘은 가벼운 동족 원소인 오스뮴과 비슷하게 육방 최밀 충진 구조(c/a = 1.59)로 결정화될 것으로 예상된다. 순수한 하슘 금속은 체적 탄성률(균일한 압축에 대한 저항)이 450 GPa로 계산되었는데,[61] 이는 다이아몬드(442 GPa)와 비슷하다.[62] 하슘은 알려진 118개 원소 중 가장 밀도가 높은 원소 중 하나일 것으로 예상되며, 예상 밀도는 27~29 g/cm³인데, 이는 오스뮴의 측정된 밀도 22.59 g/cm³보다 높다.
하슘의 원자 반지름은 약 126 pm로 예상된다. 7s 오비탈의 상대론적 안정화와 6d 오비탈의 불안정화로 인해, Hs⁺ 이온은 [Rn] 5f¹⁴ 6d⁵ 7s²의 전자 배열을 가질 것으로 예측되는데, 이는 7s 전자 대신 6d 전자를 잃는 것을 의미하며, 이는 가벼운 동족 원소들의 거동과 반대이다. Hs²⁺ 이온은 [Rn] 5f¹⁴ 6d⁵ 7s¹의 전자 배열을 가질 것으로 예상되는데, 이는 Os²⁺ 이온에 대해 계산된 것과 유사하다. 화합물에서 하슘은 d-블록 원소의 결합 특성을 나타낼 것으로 계산되는데, 이 결합은 주로 6d₃/₂ 및 6d₅/₂ 오비탈에 의해 수행될 것이다. 이전 주기의 원소들과 비교했을 때, 7s, 6p₁/₂, 6p₃/₂, 7p₁/₂ 오비탈이 더 중요할 것이다.
하슘은 6d 계열 전이 금속의 여섯 번째 원소이며, 백금족 금속과 매우 유사할 것으로 예상된다.[63] 이러한 성질 중 일부는 기체 상 화학 실험을 통해 확인되었다.[64][65][66] 8족 원소는 다양한 산화 상태를 나타내지만, 루테늄과 오스뮴은 +8의 족 산화 상태를 잘 나타낸다. 이 상태는 주기율표 아래로 내려갈수록 더욱 안정해진다. +8의 산화 상태는 매우 드물다. 안정한 원소 중에서는 루테늄, 오스뮴, 그리고 크세논만이 비교적 안정한 화합물에서 이 산화 상태를 달성할 수 있다. 하슘은 동족 원소와 마찬가지로 안정한 +8 상태를 가질 것으로 예상되지만,[65] 동족 원소들과 마찬가지로 +6, +4, +3, +2와 같은 더 낮은 안정적인 산화 상태를 나타낼 것이다.[87] 하슘(IV)은 수용액에서 하슘(VIII)보다 더 안정할 것으로 예상된다. 하슘은 상당히 귀금속일 것이다.[70] Hs4+/Hs 쌍에 대한 표준 환원 전위는 0.4 V로 예상된다.
8족 원소는 독특한 산화물 화학을 보인다. 모든 가벼운 원소들은 알려져 있거나 가설적인 사산화물 MO4를 갖는다.[71] 산화력은 주기율표 아래로 내려갈수록 감소한다. FeO4는 매우 큰 전자 친화도(중성 원자 또는 분자에 전자가 추가되어 음이온을 형성할 때 방출되는 에너지량) 때문에 알려진 옥소 음이온 페르산염(VI)을 형성하기 때문에 알려져 있지 않다.[73] 산성에서 루테늄(VI)의 산화에 의해 생성되는 루테늄 사산화물, RuO4는 환원되어 루테네이트(VI)가 된다.[74][75] 공기 중에서 루테늄 금속을 산화시키면 이산화물 RuO2가 생성된다.[76] 반면에 오스뮴은 연소되어 안정한 사산화물, OsO4를 형성한다.[77][78] 이것은 수산화 이온과 착화합물을 형성하여 오스뮴(VIII)-''산염'' 착물, [OsO4(OH)2]2−를 형성한다.[79] 따라서 하슘은 안정하고 매우 휘발성인 사산화물 HsO4를 형성함으로써 오스뮴의 무거운 동족체로 작용할 것이다.[64][66][80] 이것은 수산화물과 착화합물을 형성하여 하사이트(VIII), [HsO4(OH)2]2−를 형성한다.[85] 루테늄 사산화물과 오스뮴 사산화물은 모두 대칭적인 사면체 분자 기하를 가지고 있고 전하가 중성이기 때문에 휘발성이 높다. 하슘 사산화물 또한 매우 휘발성이 높은 고체일 것이다. 8족 사산화물의 휘발성 경향은 실험적으로 RuO4 < OsO4 > HsO4로 알려져 있으며, 이는 계산 결과를 확인해준다. 특히, 계산된 흡착 엔탈피—기체, 액체 또는 용해된 고체에서 원자, 분자 또는 이온이 표면에 부착하는 데 필요한 에너지—HsO4의 경우 석영에서 −(45.4 ± 1) kJ/mol은 실험값 −(46 ± 2) kJ/mol과 매우 잘 일치한다.[81]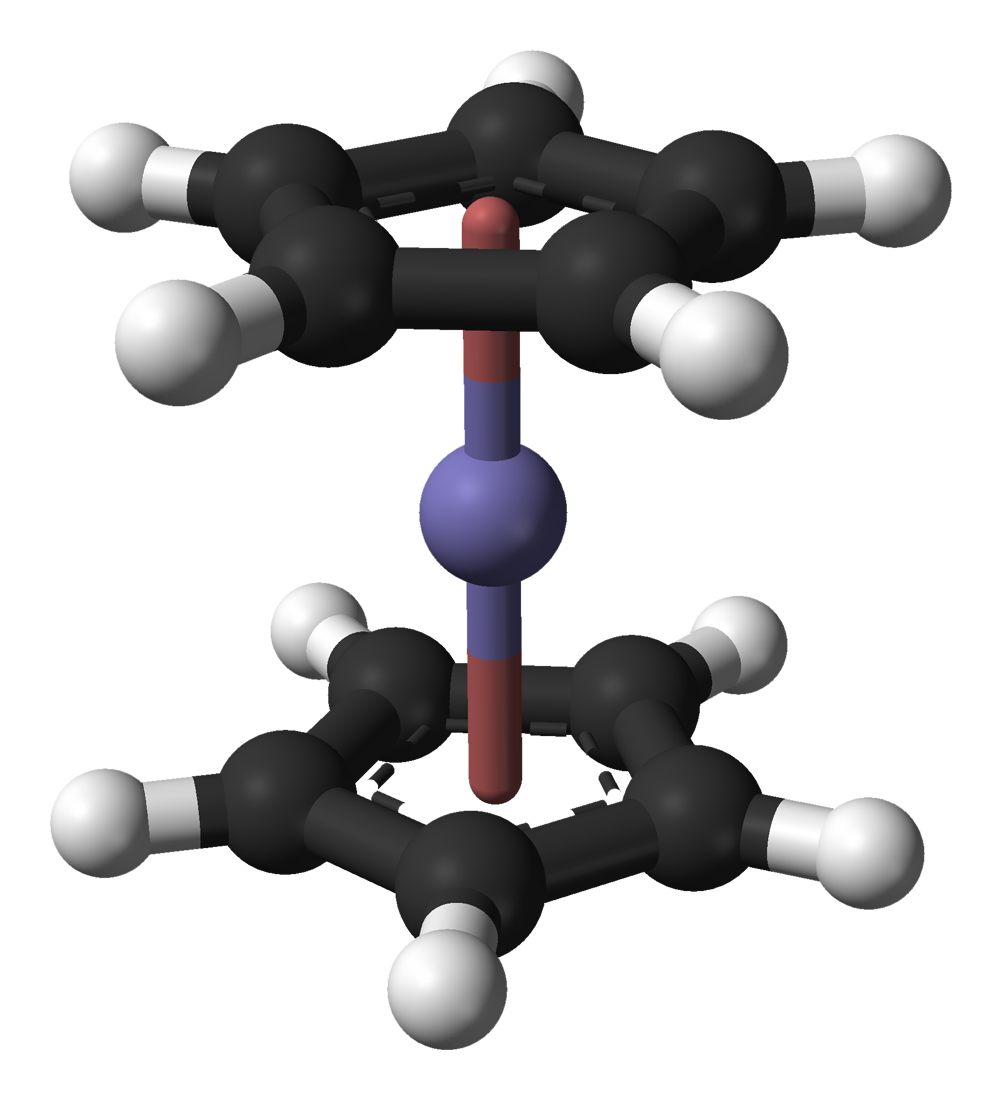
화학적 연구의 첫 번째 목표는 사산화물의 형성이었다. 루테늄과 오스뮴은 휘발성 사산화물을 형성하며, +8 산화 상태에서 안정적인 화합물을 나타내는 유일한 전이 금속이기 때문이다.[82] 가스상 화학 연구를 위한 이러한 선택이 처음부터 명확했음에도 불구하고,[80] 하슘의 화학적 특성 분석은 오랫동안 어려운 과제로 여겨졌다.[80] 하슘 동위원소가 처음으로 1984년에 합성되었지만, 화학 연구를 허용할 만큼 충분히 장수명인 하슘 동위원소가 합성된 것은 1996년이 되어서였다. 불행히도, 이 하슘 동위원소인 269Hs는 277Cn의 붕괴로부터 간접적으로 합성되었다.[80] 간접 합성 방법은 화학 연구에 유리하지 않을 뿐만 아니라, 277Cn 동위원소를 생성한 반응의 수율이 낮았다(단면적이 1pb에 불과했다).[80] 따라서 화학적 연구에 충분한 하슘 원자를 제공하지 못했다.[63] 248Cm(26Mg,x n)274−xHs (x = 4 또는 5) 반응에서 269Hs와 270Hs를 직접 합성하는 것이 더 유망해 보였는데, 이 반응의 단면적이 7 pb로 다소 더 컸기 때문이다.[80] 이 수율은 여전히 보륨의 화학적 특성 분석에 사용된 반응 수율보다 약 10배 낮았다.[80] 하슘을 성공적으로 화학적으로 특성 분석하기 전에 조사, 분리 및 검출을 위한 새로운 기술을 도입해야 했다.[80]
루테늄과 오스뮴은 란타넘족 수축으로 인해 매우 유사한 화학적 성질을 가지지만, 철은 이들과 약간의 차이를 보인다. 예를 들어, 루테늄과 오스뮴은 금속이 +8 산화 상태에 있는 안정적인 사산화물을 형성하지만, 철은 그렇지 않다.[80][71] 하슘의 화학적 특성 분석을 준비하는 과정에서, 하슘이 루테늄과 오스뮴과 유사할 것으로 예상되었기 때문에,[80] 하슘에 대한 예측 데이터가 이 두 원소의 데이터와 거의 일치했기 때문에,[83][84] 철보다는 루테늄과 오스뮴에 연구가 집중되었다.[80]
최초의 화학 실험은 2001년에 합성 오스뮴 방사성 동위원소 172Os와 173Os를 기준으로 하여 가스 열 크로마토그래피를 사용하여 수행되었다. 실험 중에 248Cm(26Mg,5n)269Hs 및 248Cm(26Mg,4n)270Hs 반응을 사용하여 7개의 하슘 원자가 합성되었다. 그런 다음 이들은 열화되어 헬륨과 산소 기체의 혼합물에서 산화되어 사산화하슘 분자를 형성했다.[64][66]
:Hs + 2 O2 → HsO4
측정된 침착 온도는 사산화오스뮴보다 사산화하슘이 더 높았는데, 이는 전자가 덜 휘발성임을 나타내며, 이는 하슘을 8족에 확실히 위치시켰다.[64][66] 측정된 HsO4의 흡착 엔탈피는 예측값보다 상당히 낮았는데, 이는 OsO4가 HsO4보다 더 휘발성임을 나타내며, 이는 이들이 매우 유사한 휘발성을 가져야 한다는 이전 계산과 모순된다. 비교를 위해 OsO4의 값은 -39 ± 1 kJ/mol이다. (실험 데이터와 더 일치하는 결과를 얻은 계산은 2008년 실험 후에 이루어졌다.)[81] 사산화하슘이 검출기에 사용된 화학 물질인 질화규소보다 이산화규소와 다르게 상호 작용할 가능성이 있다. 이러한 상호 작용의 차이가 있는지, 그리고 측정에 영향을 미쳤는지 여부를 확인하려면 추가 연구가 필요하다. 이러한 연구에는 269Hs의 핵 특성에 대한 보다 정확한 측정과 OsO4뿐만 아니라 RuO4와의 비교가 포함될 것이다.
2004년에 과학자들은 사산화하슘과 수산화나트륨을 반응시켜 사산화하슘산나트륨(VIII)을 형성했는데, 이는 오스뮴에서 잘 알려진 반응이다. 이것은 하슘 화합물을 이용한 최초의 산-염기 반응이었다.[85]
: HsO4 + 2 NaOH → Na2[HsO4(OH)2]
마인츠 대학교의 연구팀은 2008년 GSI의 새로운 TASCA 시설을 사용하여 하슘 원자의 전기 침착을 연구할 계획이었다. 그들의 목표는 226Ra(48Ca,4n)270Hs 반응을 사용하는 것이었다.[86] GSI의 과학자들은 TASCA를 사용하여 226Ra(48Ca,x n) 반응을 사용하여 하슘(II) 화합물인 하소센, Hs(C5H5)2의 합성과 특성을 연구하기를 희망했다. 이 화합물은 더 가벼운 화합물인 페로센, 루테노센 및 오스모센과 유사하며, 페로센과 같은 엇갈린 배열이 아니라 루테노센 및 오스모센과 같은 겹쳐진 배열의 두 시클로펜타디에닐 고리를 가질 것으로 예상된다.[87] 안정적이고 매우 휘발성이 높은 화합물일 것으로 예상되는 하소센은 이전에 연구되었던 높은 +8 상태가 아니라 +2의 낮은 공식 산화 상태에서 하슘을 가지고 있기 때문에 선택되었으며, 상대론적 효과는 낮은 산화 상태에서 더 강할 것으로 예상되었다. 하소센의 고도로 대칭적인 구조와 적은 원자 수는 상대론적 계산을 더 쉽게 한다.[87] 2021년 현재, 하소센에 대한 실험 보고서는 없다.[88]
4. 3. 상대론적 효과
하슘에 대한 상대론적 효과는 높은 핵전하로 인해 발생하는데, 이는 핵 주변의 전자가 더 빠르게(그 속도가 빛의 속도와 비슷해질 정도로) 움직이게 만들기 때문이다.[57] 주요 효과는 직접 상대론적 효과, 간접 상대론적 효과, 스핀-궤도 상호작용 세 가지이다.원자 번호가 증가함에 따라 전자와 핵 사이의 정전기적 인력도 증가한다. 이로 인해 전자의 속도가 증가하고, 이는 질량 증가로 이어진다. 이는 다시 원자 궤도함수의 수축, 특히 s와 p1/2 궤도함수의 수축으로 이어진다. 이 전자들은 원자에 더 강하게 결합하고 핵에서 떼어내기 어려워진다. 이것이 직접 상대론적 효과이다.
s와 p1/2 궤도함수는 핵에 더 가까이 있으므로, 핵 전하의 더 큰 부분을 "차폐"한다. 따라서 나머지 전자를 끌어들이는 전하가 줄어들고, 그 궤도함수는 팽창하여 핵에서 떼어내기 쉬워진다. 이것이 간접 상대론적 효과이다. 직접 및 간접 상대론적 효과의 결합으로 인해, 중성 원자와 비교하여 Hs+ 이온은 7s 전자가 아니라 6d 전자가 부족하다. 비교적 Os+는 중성 원자와 비교하여 6s 전자가 부족하다. 하슘의 이온 반지름(+8 산화 상태)은 상대론적 효과에 의한 6p3/2 궤도함수의 팽창으로 인해 오스뮴보다 크다.
s, p, d, f와 같은 여러 종류의 전자 궤도함수가 있는데(g 궤도함수는 원소 120 이후 원소에서 화학적으로 활성화되기 시작할 것으로 예상됨), 각각은 방위 양자수 ''l''에 해당한다. s는 0, p는 1, d는 2, f는 3이다. 각 전자는 스핀 양자수 ''s''에도 해당하며, +1/2 또는 −1/2가 될 수 있다.[58] 따라서 총 각운동량 양자수 ''j = l'' + ''s''는 ''j'' = ''l'' ± 1/2와 같다(''l'' = 0인 경우를 제외하고, 이 경우 각 궤도함수의 두 전자 모두에 대해 ''j ='' 0 + 1/2 = 1/2임).[58] 전자의 스핀은 상대론적으로 궤도와 상호작용하며, 이 상호작용은 서브쉘을 에너지가 다른 두 개로 분리시킨다(''j'' = ''l'' − 1/2인 것이 에너지가 더 낮고, 따라서 이 전자를 추출하기 어려움).[59] 예를 들어, 6개의 6p 전자 중 2개는 6p1/2가 되고 4개는 6p3/2가 된다. 이것이 스핀-궤도 상호작용(때로는 서브쉘 분리 또는 ''jj'' 결합이라고도 함)이다. 스핀에 따라 전자가 핵에 끌리거나 반발하기 때문에 분리가 발생한다.[60] p 전자에서 가장 두드러지게 나타나지만, 하슘의 화학에서 중요한 역할을 하지는 않는다. 하지만 d와 f 전자에 대한 스핀-궤도 상호작용은 같은 정도의 크기이다.[58]
이러한 상대론적 효과는 오스뮴에 비해 이온화 에너지의 증가, 전자 친화도의 감소 및 +8 산화 상태의 안정성 증가를 설명하는데, 상대론적 효과가 없다면 이러한 경향은 반대가 된다. 상대론적 효과는 하슘 화합물의 원자화 에너지를 감소시키는데, 이는 d 궤도함수의 스핀-궤도 상호작용이 전자와 핵 사이의 결합 에너지를 낮추고 상대론적 효과가 결합에서 이온 결합의 특성을 감소시키기 때문이다.
5. 핵융합
1960년대에 사용된 핵반응은 높은 들뜸 에너지를 생성하여 4개 또는 5개의 중성자를 방출해야 했다. 이러한 반응에서는 반응에서 두 원자핵 사이의 크기 차이를 극대화하기 위해 높은 원자 번호를 가진 원소로 만들어진 표적을 사용했다. 이는 표적과 발사체 사이의 정전기적 반발력이 감소하여 핵융합 가능성이 증가했지만, 생성된 복합핵은 종종 분열되어 새로운 원소를 형성하지 못했다. 또한, 핵융합 과정은 필연적으로 중성자가 부족한 핵을 생성하는데, 더 무거운 원소는 안정성을 극대화하기 위해 양성자당 더 많은 중성자를 필요로 하기 때문이다.[2][3] 따라서 중성자의 필요한 방출은 일반적으로 더 짧은 수명을 가진 최종 생성물을 초래했다. 결과적으로 가벼운 빔(6~10개의 양성자)을 사용하면 106까지의 원소만 합성할 수 있었다.[4]
더 무거운 원소로 진행하기 위해, 소련의 물리학자 유리 오가네시안은 러시아 소비에트 연방 사회주의 공화국 모스크바주 두브나에 있는 핵물리학 합동연구소(JINR)에서 다른 메커니즘을 제안했다. 이 메커니즘에서는 폭격받는 핵이 양성자와 중성자의 마법수를 가지고 있는 납-208 또는 그 근처의 다른 핵이 된다.[5] 각 양성자와 중성자는 고정된 값의 정지 에너지를 가지며, 핵에서 이 에너지의 일부는 양성자와 중성자를 결합하는 데 사용된다. 핵이 마법수의 양성자와/또는 중성자를 가지고 있다면, 더 많은 정지 에너지가 사용되고, 이는 핵종에 추가적인 안정성을 부여한다. 이 추가적인 안정성으로 인해 외부 핵이 기존 핵을 파괴하고 침투하는 데 더 많은 에너지가 필요하다.[6] 핵자 결합에 더 많은 에너지가 사용된다는 것은 더 적은 정지 에너지를 의미하며, 이는 다시 더 적은 질량을 의미한다(질량은 정지 에너지에 비례). 반응하는 핵의 원자 번호가 더 비슷할수록 그들 사이의 정전기적 반발력이 커지지만, 표적 핵의 더 낮은 질량 과잉이 이를 상쇄한다.[5] 이로 인해 새로 생성된 복합핵의 들뜸 에너지가 감소하여 안정된 상태에 도달하기 위해 더 적은 중성자 방출이 필요하다.[6] 이 에너지 차이 때문에 이전 메커니즘은 "고온 핵융합"으로, 후자는 "저온 핵융합"으로 알려지게 되었다.[7]
저온 핵융합은 1974년 JINR에서 아직 발견되지 않은 원소 106의 합성을 위해 실험되었을 때 처음으로 성공적으로 선언되었다.[6] JINR의 물리학자들은 당시 알려진 핵분열 핵 중 어느 것도 실험 중 관찰된 것과 유사한 핵분열 매개변수를 보이지 않았고, 반응에서 두 핵 중 하나를 변경하면 관찰된 효과가 사라졌기 때문에 실험에서 원소 106이 생성되었다고 결론지었다. 미국 캘리포니아주 버클리에 있는 캘리포니아 대학교 버클리의 로렌스 버클리 국립 연구소(원래 방사선 연구소, RL, 나중에 LBNL)의 물리학자들도 이 새로운 기술에 큰 관심을 표명했다.[6] 이 새로운 방법이 얼마나 나아갈 수 있는지, 납 표적이 물리학의 클론다이크인지에 대한 질문에 오가네시안은 "클론다이크는 과장일 수 있습니다 [...] 그러나 곧 우리는 이러한 반응에서 107... 108 원소를 얻으려고 할 것입니다."라고 답했다.[6]
6. 화합물
하슘(Hassium)은 6d 계열 전이 금속의 여섯 번째 원소이며, 백금족 금속과 매우 유사할 것으로 예상된다.[63] 8족 원소는 다양한 산화 상태를 나타내지만, 루테늄과 오스뮴은 +8의 족 산화 상태를 잘 나타내며, 이 상태는 주기율표 아래로 내려갈수록 더욱 안정해진다.[80][67] 하슘은 동족 원소와 마찬가지로 안정한 +8 상태를 가질 것으로 예상되지만,[65] +6, +4, +3, +2와 같은 더 낮은 안정적인 산화 상태도 나타낼 것이다.[87]
8족 원소는 독특한 산화물 화학을 보인다. 모든 가벼운 원소들은 알려져 있거나 가설적인 사산화물 MO4를 갖는다.[71] 하슘은 안정하고 매우 휘발성인 사산화물 HsO4를 형성함으로써 오스뮴의 무거운 동족체로 작용할 것이며,[64][66][80] 수산화물과 착화합물을 형성하여 하사이트(VIII), [HsO4(OH)2]2−를 형성한다.[85] 8족 사산화물의 휘발성 경향은 실험적으로 RuO4 < OsO4 > HsO4로 알려져 있으며, 이는 계산 결과를 확인해준다.[81]
화학적 연구의 첫 번째 목표는 사산화물의 형성이었다. 루테늄과 오스뮴은 휘발성 사산화물을 형성하며, +8 산화 상태에서 안정적인 화합물을 나타내는 유일한 전이 금속이기 때문이다.[82]
최초의 화학 실험은 2001년에 수행되었다. 실험 중에 269Hs와 270Hs를 합성, 열화, 산화하여 사산화하슘 분자를 형성했다.[64][66]
:Hs + 2 O2 → HsO4
측정된 침착 온도는 사산화오스뮴보다 사산화하슘이 더 높았는데, 이는 전자가 덜 휘발성임을 나타내며, 이는 하슘을 8족에 확실히 위치시켰다.[64][66]
2004년에 과학자들은 사산화하슘과 수산화나트륨을 반응시켜 사산화하슘산나트륨(VIII)을 형성했는데, 이는 오스뮴에서 잘 알려진 반응이다. 이것은 하슘 화합물을 이용한 최초의 산-염기 반응이었다.[85]
:HsO4 + 2 NaOH → Na2[HsO4(OH)2]
마인츠 대학교 연구팀은 하슘(II) 화합물인 하소센, Hs(C5H5)2의 합성과 특성을 연구하려 했으며, 이 화합물은 페로센, 루테노센, 오스모센과 유사하며, 겹쳐진 배열의 두 시클로펜타디에닐 고리를 가질 것으로 예상되었다.[87] 그러나, 하소센에 대한 실험 보고서는 아직 없다.[88]
참조
[1]
논문
On the volatility of nihonium (Nh, Z = 113)
2017
[2]
웹사이트
Modern Alchemy: Creating Superheavy Elements
https://inchemistry.[...]
American Chemical Society
2020-01-27
[3]
웹사이트
Beta Decay
https://www2.lbl.gov[...]
Lawrence Berkeley National Laboratory
[4]
논문
Nuclei in the "Island of Stability" of Superheavy Elements
2012
[5]
논문
Superheavy elements
2004
[6]
웹사이트
Популярная библиотека химических элементов. Сиборгий (экавольфрам)
http://n-t.ru/ri/ps/[...]
[7]
논문
Route to islands of stability of superheavy elements
2000
[8]
보고서
Опыты по синтезу 108 элемента в реакции 226Ra + 48Ca
https://inis.iaea.or[...]
Joint Institute for Nuclear Research
[9]
보고서
Опыты по синтезу 108 элемента в реакции 208Pb + 58Fe
https://inis.iaea.or[...]
Joint Institute for Nuclear Research
1979
[10]
웹사이트
Timeline—GSI
https://www.gsi.de/e[...]
GSI Helmholtz Centre for Heavy Ion Research
[11]
뉴스
Hassium becomes heaviest element to have its chemistry studied
https://www2.lbl.gov[...]
Lawrence Berkeley National Laboratory
2001
[12]
논문
The identification of element 108
[13]
논문
The discovery of elements 107 to 112
https://www.epj-conf[...]
2016
[14]
웹사이트
GSI - Element 107-109
https://www.gsi.de/e[...]
2012
[15]
논문
Naming of new elements (IUPAC Recommendations 2002)
http://doc.rero.ch/r[...]
2002
[16]
논문
Recommendations for the naming of elements of atomic numbers greater than 100
1979
[17]
논문
The Three-Letter Element Symbols
2016
[18]
웹사이트
GSI—Element 107-109
https://www.gsi.de/e[...]
GSI Helmholtz Centre for Heavy Ion Research
2012
[19]
논문
The Transfermium Wars
1994
[20]
논문
Names and symbols of transfermium elements (IUPAC Recommendations 1994)
http://publications.[...]
1994
[21]
논문
After the actinides, then what?
1996
[22]
웹사이트
IUPAC verabschiedet Namen für schwere Elemente: GSI-Vorschläge für die Elemente 107 bis 109 akzeptiert
http://www-alt.gsi.d[...]
Gesellschaft für Schwerionenforschung
1997
[23]
웹사이트
Naming of element 106 disputed by international committee
http://www2.lbl.gov/[...]
Lawrence Berkeley Laboratory
[24]
논문
Names of the Heavier Elements
[25]
논문
Names and symbols of transfermium elements (IUPAC Recommendations 1997)
[26]
서적
Periodic Tales
HarperCollins Publishers
2011
[27]
문서
[28]
논문
Synthesis and decay properties of isotopes of element 110: Ds 273 and Ds 275
https://journals.aps[...]
2024-05-06
[29]
논문
New isotope 276Ds and its decay products 272Hs and 268Sg from the 232Th + 48Ca reaction
2023
[30]
논문
Neutron-deficient superheavy nuclei obtained in the 240Pu+48Ca reaction
2018-01-30
[31]
논문
Investigation of 48Ca-induced reactions with 242Pu and 238U targets at the JINR Superheavy Element Factory
[32]
문서
[33]
서적
The Periodic Table: Its Story and Its Significance
https://books.google[...]
Oxford University Press
2019
[34]
웹사이트
Hassium Facts—Hs or Element 108
https://www.thoughtc[...]
2019
[35]
논문
The reaction 48Ca + 248Cm → 296116* studied at the GSI-SHIP
[36]
웹사이트
Nuclear fission
http://metronu.ulb.a[...]
Université libre de Bruxelles
2019
[37]
논문
Superheavy elements
2004
[38]
잡지
How to make a superheavy element
https://cosmosmagazi[...]
2014
[39]
논문
Chemistry of the superheavy elements
2015
[40]
학회
Biomodal spontaneous fission
1989
[41]
논문
Experimental studies of the 249Bk + 48Ca reaction including decay properties and excitation function for isotopes of element{{spaces}}117, and discovery of the new isotope 277Mt
American Physical Society
2013
[42]
논문
Ground-state properties of the heaviest nuclei analyzed in a multidimensional deformation space
1991
[43]
잡지
A Nuclear Magic Trick
https://physics.aps.[...]
2006
[44]
논문
Doubly Magic Nucleus 108270Hs162
https://www.dora.lib[...]
2006
[45]
논문
Properties of the hypothetical spherical superheavy nuclei
https://www.dora.lib[...]
1997
[46]
논문
New results on elements 111 and 112
2002
[47]
서적
The Chemistry of Superheavy Elements
https://books.google[...]
Springer Science & Business Media
2013
[48]
논문
Decay properties and stability of the heaviest elements
http://nrv.jinr.ru/k[...]
2012
[49]
논문
Первозданный заурановый изотоп в природе
1963
[50]
논문
Новый трансуран найден в природе
1970
[51]
논문
Has element 108 been discovered?
1970
[52]
논문
New outlook on the possible existence of superheavy elements in nature
[53]
논문
The possible existence of Hs in nature from a geochemical point of view
2006
[54]
보고서
Report on JINR activities and tasks accomplished in 2013 in Laboratoire Souterrain de Modane
https://fdocuments.n[...]
Joint Institute for Nuclear Research
2013
[55]
논문
Heaviest nuclei from 48Ca-induced reactions
https://www.nucleoni[...]
2007
[56]
논문
Search for superheavy elements with 292 ≤ A ≤ 310 in nature with accelerator mass spectrometry
https://www.nucastro[...]
2012
[57]
뉴스
Making New Elements Doesn't Pay. Just Ask This Berkeley Scientist
https://www.bloomber[...]
2019-08-28
[58]
웹사이트
Spin Orbit Splitting
http://www.xpsfittin[...]
University of Western Ontario
2012
[59]
서적
Relativistic Methods for Chemists
Springer Netherlands
2010
[60]
논문
Origin of the spin–orbit interaction
2015
[61]
논문
Transition metals and their carbides and nitrides: Trends in electronic and structural properties
1999
[62]
논문
Calculation of bulk moduli of diamond and zinc-blende solids
1985
[63]
논문
The Periodic Table and the Platinum Group Metals
2008
[64]
보고서
Superheavy Element Research Superheavy Element—News from GSI and Mainz
http://www.yumpu.com[...]
University Mainz
2011
[65]
논문
First chemical investigation of hassium (Hs, Z=108)
2003
[66]
웹사이트
Chemistry of Hassium
http://www.gsi.de/do[...]
Gesellschaft für Schwerionenforschung
2002
[67]
논문
Oxidation States of Ruthenium and Osmium
2004
[68]
논문
Formation and Characterization of the Iridium Tetroxide Molecule with Iridium in the Oxidation State +VIII
[69]
논문
Identification of an iridium-containing compound with a formal oxidation state of IX
2014
[70]
논문
Chemical studies of elements with Z ≥ 104 in liquid phase
https://jopss.jaea.g[...]
2015
[71]
논문
Higher Oxidation States of Iron in Solid State: Synthesis and Their Mössbauer Characterization—Ferrates—ACS Symposium Series (ACS Publications)
2008
[72]
웹사이트
electron affinity, Eea
http://goldbook.iupa[...]
International Union of Pure and Applied Chemistry
2019-11-24
[73]
논문
FeO4: A unique example of a closed-shell cluster mimicking a superhalogen
1999
[74]
서적
Chemistry of Precious Metals
Chapman and Hall
1997
[75]
서적
Encyclopedia of Reagents for Organic Synthesis
[76]
논문
New method for the characterization of domain morphology of polymer blends using ruthenium tetroxide staining and low voltage scanning electron microscopy (LVSEM)
1997
[77]
서적
Encyclopaedia of Occupational Health and Safety
https://archive.org/[...]
1998
[78]
서적
Housecroft2nd
[79]
웹사이트
Osmium tetroxide (OsO4)
http://www.chm.bris.[...]
Bristol University
2012-04-07
[80]
서적
The Chemistry of Superheavy Elements
https://books.google[...]
Springer
2003
[81]
논문
Fully relativistic density-functional-theory calculations of the electronic structures of MO4 (M = Ru, Os, and element 108, Hs) and prediction of physisorption
2008
[82]
논문
Chemistry of Superheavy Elements
https://cds.cern.ch/[...]
2006
[83]
논문
Chemical investigation of hassium (element 108)
2002
[84]
논문
On the Stability and Volatility of Group 8 Tetroxides, MO4 (M = Ruthenium, Osmium, and Hassium (Z = 108))
2002
[85]
서적
Advances in Nuclear and Radiochemistry
https://www-windows.[...]
Forschungszentrum Jülich
[86]
웹사이트
Electrodeposition experiments with hassium
https://www-win.gsi.[...]
Gesellschaft für Schwerionenforschung
2011
[87]
웹사이트
Investigation of group 8 metallocenes @ TASCA
http://www-win.gsi.d[...]
Gesellschaft für Schwerionenforschung
2008-10-31
[88]
서적
The Heaviest Metals: Science and Technology of the Actinides and Beyond
John Wiley & Sons
2019
[89]
논문
Synthesis of superheavy nuclei in 48Ca+244Pu interactions
http://www.springerl[...]
[90]
서적
元素111の新知識
講談社
1998
[91]
웹사이트
NAMES AND SYMBOLS OF TRANSFERMIUM ELEMENTS
http://iupac.org/pub[...]
[92]
웹사이트
NAMES AND SYMBOLS OF TRANSFERMIUM ELEMENTS
http://iupac.org/pub[...]
[93]
웹사이트
Chemical investigation of hassium (Hs, Z=108)
http://www.gsi.de/an[...]
[94]
웹사이트
Chemical investigation of hassium (element 108)
http://www.ncbi.nlm.[...]
[95]
웹사이트
DECAY PROPERTIES OF 269Hs AND EVIDENCE FOR THE NEW NUCLIDE 270Hs
http://www.kernchemi[...]
[96]
웹사이트
Doubly magic 270Hs
http://www.gsi.de/in[...]
[97]
이미지
Island-of-Stability
File:Island-of-Stabi[...]
[98]
논문
Chemical investigation of hassium (element 108)
https://www.nature.c[...]
2002
[99]
웹사이트
アーカイブされたコピー
http://www.gsi.de/in[...]
2008-01-30
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
