장기 칩
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
장기 칩은 인체의 장기 기능을 모방하여 질병 연구, 신약 개발, 맞춤형 치료법 개발 등에 활용되는 생체 외 모델이다. 2000년대 초 폐 칩 개발을 시작으로 심장, 눈, 동맥, 신장 등 다양한 종류의 장기 칩이 개발되었으며, 각 칩은 실제 장기와 유사한 환경을 구현하여 질환 연구, 약물 효능 평가, 동물 실험 대체 등에 기여한다. 최근에는 여러 장기를 통합한 인간-온-어-칩 기술 개발을 통해 인체 내 상호작용을 모방하려는 시도가 이루어지고 있으며, 신약 개발 과정의 효율성 증대와 윤리적 문제 해결에 기여할 것으로 기대된다.
더 읽어볼만한 페이지
- 나노기술 - 나노 기술
나노 기술은 분자 수준에서 물질을 다루는 과학 및 공학 기술로, 다양한 접근 방식을 통해 여러 분야에 응용되며 독특한 특성을 나타내지만, 독성, 환경 문제 등 윤리적 고려 사항이 존재한다. - 나노기술 - 그레이 구
그레이 구는 분자 나노기술의 자기 복제 기계가 통제 불능 상태로 증식하여 지구를 파괴할 수 있다는 가설이며, 기술 윤리, 특히 나노기술의 잠재적 위험성을 논의하는 데 중요한 개념으로 활용된다. - 생명공학 - 사이보그
사이보그는 인공 부위를 이식받아 신체 기능이 복원되거나 향상된 개조 생명체로, 보철, 인공 장기 등의 기술을 포함하며 의료, 윤리, 군사적 측면에서 다양한 논의를 낳고 있다. - 생명공학 - CRISPR
CRISPR은 세균과 고세균이 외래 유전 물질로부터 자신을 방어하는 적응 면역 시스템으로, CRISPR-Cas9 시스템은 유전자 편집 기술로 발전하여 노벨 화학상을 수상했으며, 유전 질환 치료, 농업 등 다양한 분야에 활용될 잠재력을 지닌다.
| 장기 칩 | |
|---|---|
| 개요 | |
 | |
| 한국어 명칭 | 장기 칩 |
| 분야 | 나노기술, 생명공학 |
| 관련 학문 | 생리학, 약리학, 재료공학, 미세유체공학, 생물공학 |
| 기술적 특징 | |
| 주요 기능 | 인체 장기의 생리학적 기능 시뮬레이션 약물 개발 및 독성 테스트 질병 모델링 개인 맞춤형 의학 연구 |
| 구성 요소 | 미세유체 채널 세포 배양 공간 센서 |
| 재료 | 폴리디메틸실록산(PDMS) 폴리카보네이트(PC) 폴리에틸렌 테레프탈레이트(PET) |
| 활용 | |
| 응용 분야 | 약물 스크리닝 독성학 연구 개인 맞춤형 의학 질병 모델링 |
| 장점 | 동물 실험 대체 가능성 높은 처리량 비용 절감 생체 내 환경 모사 |
| 단점 | 복잡성 대량 생산의 어려움 |
| 역사 | |
| 개발 배경 | 생체 외에서 인체 장기의 기능을 모사하려는 시도 |
| 주요 연구 기관 | 하버드 대학교, MIT, 캘리포니아 대학교 버클리 |
| 미래 전망 | |
| 발전 방향 | 다중 장기 칩 개발 3D 프린팅 기술 활용 센서 기술 발전 |
| 참고 문헌 | |
2. 역사
장기 칩 연구는 2010년 미국 하버드 대학교 위스 생체 공학 연구소(Wyss Institute)에서 허동은 교수 주도로 최초의 폐 칩을 개발하면서 시작되었다.[120] 이 초기 모델은 실제 폐의 구조와 기능을 모사하여 질병 연구 등에 활용될 가능성을 제시했다. 이후 심장[121], 눈[122][123], 동맥[124], 신장[125] 등 다양한 종류의 장기 칩 모델이 개발되었으며, 이는 신약개발이나 독성평가, 그리고 동물 실험을 대체하기 위한 연구에 중요한 도구로 주목받고 있다.[111][112][113][114] 주요 연구 기관으로는 하버드 대학교의 바이스 생체공학 연구소 등이 있으며, 미국 식품의약국(FDA)과 국립 보건원(NIH) 등의 지원을 받아 연구가 활발히 진행 중이다.[111][112]
2. 1. 초기 개발
최초의 장기 칩은 2010년 펜실베니아 대학교 바이오공학과 허동은 교수가 주도하여 미국 하버드 대학교 위스 생체 공학 연구소(Wyss Institute)와 협력하여 개발한 폐 칩이다.[120] 이 칩은 약 3cm 크기의 작은 플라스틱 칩 위에 전자회로와 함께 폐 세포를 배양한 형태이다.[120]개발 과정에서는 마이크로 칩 제조 방법을 응용하여 전자회로가 설치된 칩 위에 미세한 세포 배양 환경을 구축하였다. 이후 관류 챔버(perfusion chamber) 속에 살아있는 폐 세포와 혈관 세포를 함께 배양함으로써, 실제 폐와 유사하게 허파꽈리와 모세혈관 구조를 갖추고 산소와 이산화탄소를 교환하는 기능을 수행하도록 만들었다.
이 폐 칩은 폐 관련 질환에 감염되었을 때 질환의 진행 상황을 실제처럼 모사하여 실시간으로 관찰하는 것을 가능하게 한다. 더 나아가 단일 질환뿐만 아니라, 화학요법의 부작용으로 인해 발생하는 합병증까지 모사할 수 있는 것으로 알려져 있다.
2. 2. 다양한 장기 칩 개발
2010년 하버드 대학교 바이스 생체공학 연구소에서 개발된 폐 칩 이후, 장기 칩 기술은 다양한 장기 모델로 확장되었다.[120] 현재까지 심장[121], 눈[122][123], 동맥[124], 신장[125] 등 여러 종류의 장기 칩 모델이 개발되었다.이러한 장기 칩들은 마이크로 리액터의 일종으로, 미세 가공 기술을 활용하여 칩 위에 미세한 유로를 만들고 그 위에 특정 장기의 세포를 배양하는 방식으로 제작된다. 이를 통해 기존의 인공 장기로는 재현하기 어려웠던 생체의 복잡한 기능과 반응을 모사할 수 있게 되었다.[113][114]
다양한 장기 칩 모델 개발의 주요 목적은 다음과 같다.
- 특정 장기 세포의 운동이나 물리·화학적 반응 메커니즘을 상세하게 연구.
- 신약개발 과정에서의 약물 효능 및 독성평가 모델로 활용.
하버드 대학교의 바이스 생체공학 연구소는 미국 식품의약국(FDA)과 국립 보건원(NIH)의 지원을 받아, 동물 실험을 대체할 수 있는 인간 세포 기반 칩을 이용한 의약품 평가 시스템 개발 프로젝트를 진행하고 있다. 이 프로젝트의 일환으로 폐 칩과 소장 칩 등의 개발이 이루어지고 있다.[111][112] 이처럼 장기 칩 기술은 동물 실험의 윤리적 문제를 줄이고 보다 정확한 인체 반응 예측을 가능하게 할 대체 선택지로서 주목받으며 활발히 개발되고 있다.[113][114]
3. 장기 칩의 종류
장기 칩은 랩 온 어 칩 기술을 기반으로, 칩 위에 특정 장기의 세포를 배양하여 해당 장기의 구조와 기능을 모방하는 미세 장치이다.[6][111][112] 마이크로 리액터의 일종으로, 반도체 제조 기술을 응용하여 미세한 유로를 만들고 그 안에 세포를 배양하는 방식으로 제작된다.[111][112]
이 기술은 기존의 인공 장기나 단순 세포 배양 방식으로는 재현하기 어려웠던 복잡한 생체 환경과 기능을 작은 칩 위에서 구현할 수 있다는 장점이 있다. 특히, 신약 개발 과정에서 약물의 효과나 독성을 평가하기 위해 수행되는 동물 실험을 대체하거나 보완할 수 있는 유력한 대안으로 주목받고 있다.[113][114] 미국 하버드 대학교의 위스 연구소를 비롯한 여러 연구 기관에서는 미국 식품의약국(FDA)과 국립 보건원(NIH) 등의 지원을 받아 다양한 종류의 장기 칩 개발 연구를 활발히 진행하고 있다.[111][112] 이를 통해 보다 정확하고 효율적인 질병 연구 및 신약 개발이 가능해질 것으로 기대된다.
3. 1. 대표적인 장기 칩
다양한 장기 칩이 개발되었으며, 특히 한국계 과학자인 허동은 교수는 초기 폐 칩 개발과 이후 눈 칩 개발을 주도하며 이 분야 발전에 크게 기여했다. 주요 장기 칩 개발 사례는 다음과 같다.| 년 도 | 기 술 명 | 연 구 기 관 | 관 련 논 문 |
|---|---|---|---|
| 2010 | Lung on a chip (폐 칩) | 미국 하버드대학 위스연구소 허동은 교수팀 | A Human Breathing Lung-on-a-Chip[126] |
| 2011 | Heart on a chip (심장 칩) | 미국 하버드대학 위스연구소 Kevin Kit Parker | Ensembles of engineered cardiac tissues for physiological and pharmacological study: Heart on a chip†,‡[127] |
| 2014 | Eye on a chip (눈 칩) | 미국 펜실베니아대학 허동은 교수팀 | A HUMAN BLINKING EYE-ON-A-CHIP[128] |
| 2016 | Kidney on a chip (신장 칩) | 네덜란드 위트레흐트 대학교 Rosalinde Masereeuw팀 | Kidney-on-a-Chip Technology for Drug-Induced Nephrotoxicity Screening[129] |
3. 2. 폐 칩 (Lung on a chip)
폐 칩은 최초의 장기 칩으로, 2010년 미국 하버드 대학교의 위스 생체모방공학 연구소에서 당시 펜실베이니아 대학교 소속이던 허동은 교수가 주도하여 개발되었다.[130][131] 이 칩은 작은 칩 위에 폐 세포와 모세혈관 세포를 함께 배양하여 실제 폐의 기능을 모방하도록 설계되었다.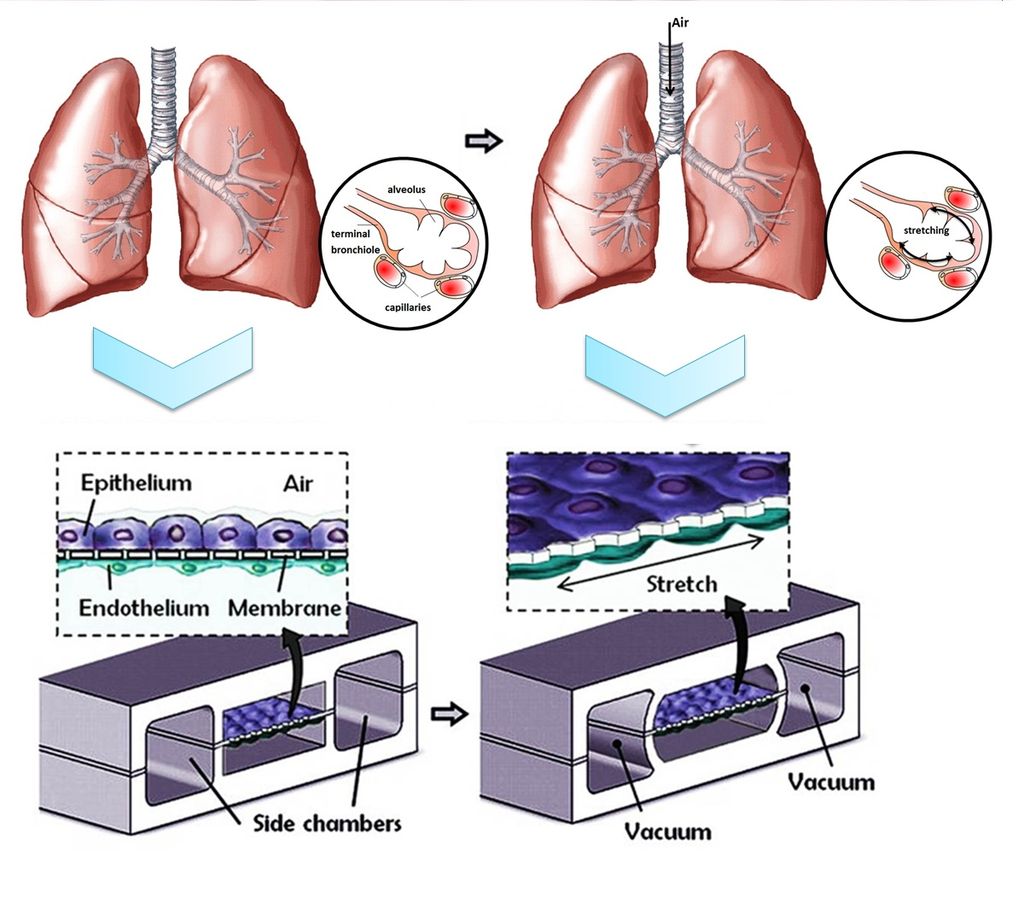
칩의 작동 원리는 다음과 같다. 먼저, 칩 위에 전자회로를 설치하고, 특정 구역에는 폐 세포를, 다른 구역에는 모세혈관 세포를 배양한다. 폐 세포가 있는 구역에는 진공펌프를 이용하여 물리적으로 팽창과 수축 운동을 반복하게 함으로써 실제 사람의 호흡 운동을 모사한다. 동시에 모세혈관 세포가 있는 구역에는 혈액과 유사한 성분의 배양액을 흘려보내, 실제 혈액처럼 산소를 공급하고 영양분과 노폐물을 교환하는 기능을 모방한다.[130][131]
폐 칩은 투명한 재질로 만들어져 있어, 현미경 등을 통해 호흡 과정에서 허파꽈리와 유사한 구조가 움직이는 모습을 실시간으로 관찰할 수 있다는 장점이 있다.[130][131]
3. 3. 심장 칩 (Heart on a chip)
심장 칩은 2011년 미국 하버드 대학교의 위스 연구소(Wyss Institute) 소속 Kevin Kit Parker 연구팀에 의해 개발되었다. 이 칩은 심근, 심혈관 관련 질환 연구 및 신약 개발 분야에서 활용되고 있다.[132]
3. 4. 눈 칩 (Eye on a chip)
망막 칩은 2014년 미국 펜실베니아대학 연구팀이 허동은 교수의 주도로 개발했다. 이 모델은 패턴이 각인된 칩 위에 망막 세포를 배양하여 만들어졌으며, 스스로 깜빡이는 세포 운동을 수행하는 것이 특징이다.[133]4. 기술의 응용 범위
장기 칩 기술은 기존의 인공 장기로는 재현하기 어려웠던 복잡한 생체 기능을 칩 위에서 모방할 수 있는 가능성을 제시한다. 이를 통해 신약 개발 과정에서의 동물 실험을 대체하거나 보완하고, 질환의 메커니즘을 깊이 있게 연구하며, 독성학 연구 및 환자 맞춤형 치료법 개발 등 다양한 분야에서 활용될 잠재력을 가진다.[113][114] 특히, 동물 실험의 윤리적, 과학적 한계를 극복하기 위한 대안으로서 주목받으며 관련 연구가 활발히 진행되고 있다.[111][112]
4. 1. 동물실험의 대체
신약 개발과 독성학 연구는 오랫동안 동물 실험에 의존해왔다. 그러나 장기 칩 기술의 발전으로 일부 동물 실험을 대체할 수 있을 것이라는 전망이 나온다. 장기 칩은 동물 대신 실제 인간의 세포를 사용하여 반응을 관찰할 수 있다는 점에서 중요한 장점을 가진다.[134] 이는 인간과 동물의 생리적 차이에서 오는 오류 가능성을 줄여준다.기존의 동물 실험은 시간과 비용이 많이 소요될 뿐만 아니라, 윤리적인 논란에서도 자유롭지 못하다. 동물을 대상으로 인위적인 상해를 가하거나 질병을 유발하는 방식에 대한 비판이 꾸준히 제기되어 왔다.[108] 또한, 동물 실험 결과를 인간에게 그대로 적용하기 어렵다는 '종간 외삽'의 문제점도 지적된다.[108] 동물 모델은 특정 변수를 통제하기 어렵고 원하는 정보를 얻기 까다로울 수 있다.
이에 대한 대안으로 장기 칩과 같은 시험관 내 모델이 주목받고 있다. 3차원 세포 배양 모델은 2차원 배양 시스템보다 높은 수준의 세포 분화와 조직 구성을 가능하게 하지만, 여전히 실제 기관의 복잡한 미세 환경을 완벽히 모방하는 데는 한계가 있다.[6] 장기 칩은 미세 유체 공학 기술을 적용하여 이러한 한계를 극복하고자 한다. 미세 유체 기술은 3차원 조직 구조 전체에 영양분과 신호를 효율적으로 전달하고, 조직 간 경계면, 화학 물질의 시공간적 기울기, 혈관의 수축 및 이완과 같은 기계적 움직임 등 생체 내 환경을 더욱 정교하게 모방할 수 있게 한다.[6][7] 이를 통해 장기 칩은 살아있는 장기의 생물학적 활동, 동적 기계적 특성 및 생화학적 기능을 재현하는 차세대 3차원 세포 배양 모델로 평가받는다.[7]
이러한 장기 칩 기술은 인간의 생리적 반응을 더 정확하게 모사하면서도 비용을 절감하고 실험 과정을 효율화할 수 있다. 특히, MEMS 기반의 바이오칩은 복잡한 장기 수준의 병리학적 반응을 재현하여 독성학, 의약품 및 화장품 개발 과정에 혁신을 가져올 잠재력을 지닌다.[109] 또한, PBPK 모델과 결합하여 약물의 흡수, 분포, 대사, 배설(ADME) 과정을 더욱 신뢰성 있게 예측하고, 약물의 효과와 독성을 시험관 내에서 연구하는 데 유용하게 활용될 수 있다.[110] 장기 칩은 인간 세포를 사용하므로 동물 실험 결과를 인간에게 적용할 때 발생하는 불확실성을 줄이고, 임상 시험의 성공률을 높이는 데 기여할 수 있다. 나아가 사람을 대상으로 하는 임상 시험의 일부 절차를 대체하여 신약 개발에 드는 막대한 비용과 시간을 단축할 가능성도 제시된다.[134]
실제로 하버드 대학교의 바이스 생체공학 연구소에서는 미국 식품의약국(FDA)과 국립 보건원(NIH)의 지원을 받아 동물 실험을 대체하기 위한 인간 세포 기반 칩 연구를 활발히 진행하고 있다. 폐 칩과 소장 칩 개발 등이 대표적인 예시다.[111][112] 이처럼 장기 칩은 기존의 인공 장기로는 불가능했던 생체 기능을 재현하고, 동물 실험의 윤리적 문제를 해결할 수 있는 중요한 대안으로 주목받으며 개발이 가속화되고 있다.[113][114]
4. 2. 체내 세포 활동 연구
기존의 2D 배양이나 3D 배양 시스템으로는 재현하기 어려웠던, 약물이나 화학물질 등에 대한 장기의 반응을 세포 수준을 넘어 조직, 장기 수준에서 연구할 수 있게 되었다.특히, 여러 종류의 조직이나 장기 세포를 동시에 배양하는 '다종 장기 칩'(Multi organs on a chip) 기술은 주목받고 있다. 이 기술은 다양한 세포나 조직 간의 물리적, 화학적 환경과 상호작용을 구현할 수 있으며, 체내 혈관을 실제 장기와 유사한 수준으로 구축하여 기존 방법보다 더욱 정교하게 인체를 모방하는 모델로 평가받는다. 이를 통해 특정 장기의 기능에 다른 장기나 조직이 미치는 영향을 파악하는 등, 더 고차원적인 연구가 가능해졌다.[135]
장기 칩은 마이크로 리액터의 한 종류로, 칩 위에 반도체 제조에 쓰이는 미세 가공 기술을 이용해 미세한 통로를 만들고 그 위에 장기의 세포를 배양하는 방식으로 만들어진다. 하버드 대학교의 바이스 생체공학 연구소에서는 미국 식품의약국(FDA)과 국립 보건원(NIH)으로부터 대규모 연구비를 지원받아, 동물 실험을 대체할 인간 세포 칩 기반의 의약품 평가 시스템 개발 프로젝트를 진행 중이다. 이 프로젝트의 일환으로 폐 칩과 소장 칩 등이 개발되고 있다.[111][112]
장기 칩 기술은 기존의 인공 장기로는 재현하기 어려웠던 생체 기능을 모방할 수 있으며, 윤리적 논란이 있는 동물 실험을 대체할 유력한 대안으로 떠오르며 최근 활발히 개발이 진행되고 있다.[113][114]
4. 3. 질환 메커니즘 연구
장기 칩은 특정 장기에 발병되는 질환의 정확한 진행 상황을 실시간으로 관찰하고 연구함으로써, 정확한 치료법을 찾는 데 이용할 수 있는 질환 모델로서 사용될 수 있다.[136][137][138] 이는 마이크로 리액터의 일종으로, 칩 위에 미세 가공 기술을 활용하여 미세한 유로를 형성하고 그 위에 장기의 세포를 배양하는 방식으로 만들어진다. 하버드 대학교의 바이스 생체공학 연구소에서는 미국 식품의약국(FDA)과 국립 보건원(NIH)의 지원을 받아, 동물 실험을 대체하는 인간 세포 칩을 사용한 의약품 평가를 실현하는 프로젝트의 일환으로 폐 칩과 소장 칩의 개발이 진행되고 있다.[111][112]장기 칩은 기존의 인공 장기로는 재현하기 어려웠던 생체의 기능을 모방하는 것이 가능하며, 동물 실험의 대안으로서도 최근 활발히 개발이 이루어지고 있다.[113][114]
4. 4. 신약 스크리닝
질환이 발병된 장기 세포를 이용하여 특정 신약의 유효성과 효과를 인체 실험과 유사한 수준으로 연구할 수 있다. 이는 동물 실험을 대체할 가능성을 제시하며, 상당한 비용 및 시간 단축 효과와 더불어 윤리적 문제 해결에도 기여할 것으로 기대된다.[139]연구자들은 신체 내 여러 장기를 모방하기 위해 3차원 세포 집합체를 배양하는 미세 환경을 구획화하는 다중 채널 3D 미세유체 세포 배양 시스템 구축에 힘쓰고 있다.[102] 하지만 현재 대부분의 장기 칩 모델은 하나의 세포 유형만 배양하기 때문에, 전체 장기 기능을 연구하는 데는 유효할 수 있으나 약물이 인체에 미치는 전신적 영향을 검증하기에는 한계가 있다.
이러한 한계를 극복하기 위해 통합 세포 배양 유사체(μCCA)가 개발되었는데, 여기에는 폐 세포, 약물 대사 간 세포, 지방 세포가 포함되었다. 세포들은 배양 배지가 혈액 대용물처럼 순환하는 2D 유체 네트워크로 연결되어, 영양분을 효율적으로 전달하고 노폐물을 제거한다.[103] C. Zhang 등은 "μCCA의 개발이 현실적인 시험관 내 약동학 모델의 토대를 마련했으며, 생체 내 상황과 유사하게 여러 세포 유형을 배양하기 위한 통합된 생체 모방 시스템을 제공했다"고 평가했다. 이들은 간, 폐, 신장, 지방의 네 가지 인간 장기를 모방하기 위해 네 가지 다른 세포 유형을 배양하는 미세유체 인간 칩을 개발했다.[104] 연구팀은 장치에 포함된 모든 세포 유형에 사용할 수 있는 표준 혈청 무첨가 배양 배지 개발에 집중했다. 일반적으로 특정 세포 유형에 최적화된 배지가 사용되지만, 인간 칩에서는 모든 세포에 적용 가능한 공통 배지(CM)가 필요하기 때문이다. 연구팀은 미세유체 장치에서 모든 세포 배양을 관류할 때 세포의 기능 수준을 유지하는 공통 배지를 확인했다고 밝혔다. 이러한 시험관 내 배양 세포의 민감도 향상은 장치의 유효성을 높여, 미세 채널에 주입된 약물이 인체의 전체 장기와 동일한 생리적 및 대사 반응을 샘플 세포에서 유도하도록 보장하는 데 기여할 수 있다.
또한, 단일 유체 액추에이터를 사용하여 여러 조직으로 미세 유체 수송을 조절할 수 있는 인간 칩 설계가 개발되어, 간 및 췌장 조직을 이용한 당뇨병 전 고혈당증 모델링에 적용 및 평가되었다.[105]
이러한 다중 장기 칩이 더욱 발전하면, 제약 회사는 한 장기의 반응이 다른 장기에 미치는 직접적인 영향을 측정할 수 있게 될 것이다. 예를 들어, 특정 생화학 물질 전달이 한 세포 유형에는 도움이 되지만 다른 세포의 기능을 손상시키지는 않는지 등을 검사할 수 있다. 3D 프린터로 이러한 장기를 인쇄하는 것도 기술적으로 가능할 수 있지만, 아직 비용이 매우 높다. 여러 장기를 연결하여 전체 신체와 유사한 환경을 만드는 것은 제약 회사가 장기 칩에 대해 가졌던 주요 우려 사항, 즉 단일 장기 연구의 한계점을 해결하는 데 도움이 된다. 그러나 이러한 장치의 접근성이 높아짐에 따라 설계의 복잡성도 기하급수적으로 증가한다. 시스템은 순환계를 통해 기계적 자극과 유체 흐름을 동시에 제공해야 할 필요성이 생긴다. 미시간 대학교의 타카야마는 "정적 제어뿐 아니라 동적 제어가 필요한 모든 것이 도전 과제"라고 언급했다.[106] 이 과제는 MIT의 조직 공학 전문가 린다 그리피스 그룹에 의해 일부 해결되었다. 이들은 유체 제어를 통해 상호 연결된 4개, 7개 또는 10개의 장기를 포함하는 복잡한 다중 장기 칩을 개발했으며,[107] 이 시스템은 해당 장기들의 기능을 수 주 동안 유지할 수 있다.
장기 칩은 마이크로 리액터의 일종으로, 반도체 제조 기술에서 파생된 미세 가공 기술을 활용하여 칩 위에 미세한 유로를 만들고 그 위에 장기의 세포를 배양하는 방식으로 작동한다. 하버드 대학교의 생체 모방 재료 및 장치 개발을 목표로 하는 바이스 생체공학 연구소에서는 미국 식품의약국(FDA)과 국립 보건원(NIH)의 대규모 연구 자금을 지원받아, 동물 실험을 대체할 인간 세포 칩 기반 의약품 평가 시스템 구축 프로젝트의 일환으로 폐 칩과 소장 칩 개발을 진행하고 있다.[111][112]
장기 칩은 기존의 인공 장기로는 재현하기 어려웠던 생체의 복잡한 기능을 모방할 수 있다는 점에서 주목받고 있으며, 동물 실험의 대안으로서 개발이 활발히 이루어지고 있다.[113][114]
4. 5. 줄기세포와 환자 맞춤형 의료기술로의 응용
줄기세포 기술의 발전과 함께, 미래 의료의 패러다임을 따라 환자 개인 맞춤형 치료제의 개발에도 큰 역할을 할 것으로 전망된다. 환자의 세포를 리프로그래밍하여 유도만능줄기세포를 만든 후 특정 장기세포로 분화시키면, 환자의 유전 정보나 질환 정보를 그대로 담고 있는 장기세포가 된다.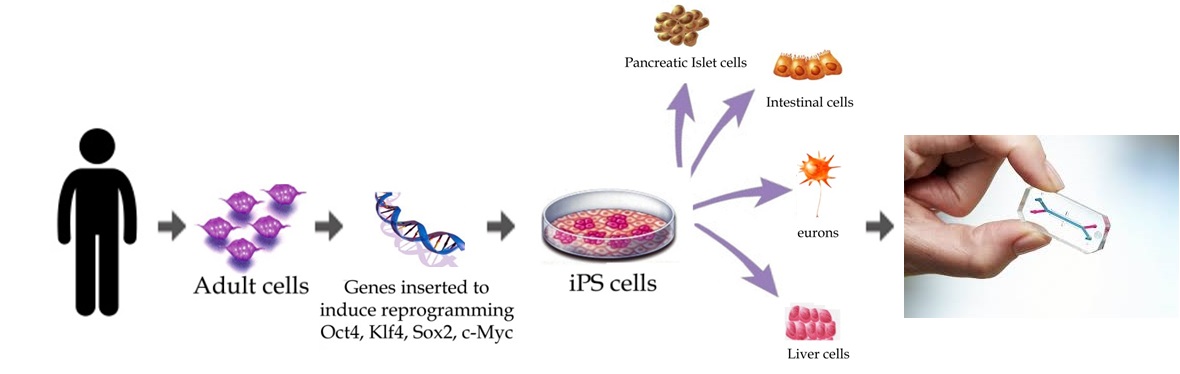
이를 장기칩 기술에 응용하면 환자에게 맞는 신약을 찾거나, 치료법을 개발하는 데 활용될 것으로 기대된다.[140]
5. 장기 (Organs)
3차원 세포 배양 모델은 세포가 더 높은 수준으로 분화하고 조직을 구성하도록 돕기 때문에 2차원 배양 시스템보다 뛰어나다. 3차원 배양 시스템은 세포 외 기질(ECM) 겔이 유연하여, 딱딱한 2차원 배양판에서는 불가능했던 세포의 형태 변화나 세포 간 연결을 가능하게 하기 때문이다. 하지만 가장 발전된 3차원 배양 모델조차도 실제 장기의 세포 환경을 완벽하게 따라 하지는 못한다. 예를 들어, 상피와 혈관 내피 같은 조직 간의 경계면, 특정 위치와 시간에 따라 농도가 달라지는 화학 물질, 그리고 기계적으로 활발한 미세 환경(예: 온도 변화에 따라 동맥이 혈관 수축하거나 혈관 확장하는 반응) 등을 제대로 모방하기 어렵다.[6]
미세 유체 공학 기술을 장기 칩에 적용하면서 이러한 한계를 극복할 수 있게 되었다. 미세 유체 기술은 살아있는 3차원 조직 구조 전체에 영양분과 다른 필요한 신호 물질들을 효율적으로 전달하고 분배할 수 있게 해준다. 장기 칩은 실제 살아있는 장기의 생물학적 활동, 역동적인 기계적 특성, 그리고 생화학적 기능을 모방하는 차세대 3차원 세포 배양 모델로 평가받고 있다.[7]
5. 1. 뇌 (Brain)
뇌-칩(Brain-on-a-chip) 장치는 미세 가공 및 미세 유체 공학 기술을 이용하여 뇌 관련 조직을 배양하고 조작하는 장치이다. 이는 배양 중인 조직의 생존력을 높이고, 단순화된 모델을 통해 고처리량 스크리닝을 가능하게 하며, 조직이나 기관 수준의 생리 현상 및 질병을 ''체외'' 또는 ''생체 외''에서 모델링할 수 있게 한다. 또한, 미세 유체 장치의 정밀한 제어 능력을 활용한다.[8][9] 뇌-칩 장치는 사용하는 세포 배양 방법에 따라 다양한 수준의 복잡성을 가질 수 있으며, 뇌 실질 조직이나 혈액-뇌 장벽 (BBB) 조직을 포함할 수 있다.[10] 이러한 장치는 전통적인 2차원(2D) 세포 배양 방식부터, 뇌의 구조를 모방한 3차원(3D) 조직인 기관형 뇌 절편, 그리고 최근에는 오가노이드에 이르기까지 다양한 플랫폼을 기반으로 제작된다.기관형 뇌 절편은 실제 살아있는 뇌(생체 내, ''in vivo'')의 생리적 특성을 실험실 환경(체외, ''in vitro'')에서 잘 모방하면서도, 대량 실험 및 광학적 관찰에 유리한 장점을 가진다.[8] 따라서 미세 유체 장치와 결합하기에 적합하다. 뇌 절편은 뇌 조직의 원래 구조가 보존되고 여러 종류의 세포들이 서로 상호작용하는 환경을 유지한다는 점에서, 단일 종류의 세포를 배양하는 1차 세포 배양보다 장점이 있다.[11][12] 뇌 절편은 채취 직후(6시간 이내) 급성 실험에 사용하거나, 배양하여 나중에 사용할 수 있어 활용도가 높다. 특히, 기관형 뇌 절편은 수 주 동안 생존 상태를 유지할 수 있어 장기간에 걸친 변화나 약물 효과 등을 연구하는 데 유용하다.[11] 또한, 절편 주변의 세포 외 환경을 정밀하게 제어하며 실험할 수 있어, 특정 질병 상태와 신경병리학적 결과 사이의 연관성을 연구하기에 좋은 플랫폼을 제공한다.[12] 이러한 뇌 절편은 쥐와 같은 실험동물뿐만 아니라 인간의 뇌 조직에서도 추출하여 배양할 수 있다.[13]
미세 유체 장치는 기관형 뇌 절편의 배양 생존력을 높이기 위해 함께 사용된다. 일반적으로 뇌 절편(두께 약 300um)을 배양할 때는 반투과성 막을 이용하여 공기와 배양액의 경계면을 만들어주지만,[14] 이 방식은 영양분이나 용해된 가스가 절편 내부까지 확산되는 데 한계가 있다. 미세 유체 시스템은 이러한 필수 물질들을 층류(laminar flow) 형태로 꾸준히 공급해주기 때문에 물질 수송 효율이 높아지고, 결과적으로 조직의 생존력이 향상된다.[9] 뇌-칩 플랫폼은 일반적인 두께의 뇌 절편을 건강하게 유지하는 것뿐만 아니라, 두꺼운 뇌 절편(약 700um)도 성공적으로 배양할 수 있게 해준다. 두꺼운 절편은 물질 수송에 어려움이 있음에도 불구하고, 더 많은 원래 뇌 조직의 구조를 보존하고 있다는 장점이 있다.[15] 따라서 뇌-칩 장치를 이용하면 세포 생존력을 유지하면서도 실제 뇌와 더 유사한("''생체 내''-유사") 환경을 구현할 수 있다.
미세 유체 장치는 2D 세포 배양 및 뇌 절편 배양 모두에서 고처리량 스크리닝과 독성 평가를 효율적으로 수행할 수 있게 하여, 뇌 질환을 표적으로 하는 새로운 치료법 개발을 촉진한다.[8] 한 예로, 특정 뇌-칩 장치를 사용하여 가장 흔한 형태의 인간 뇌암인 교모세포종(glioblastoma multiforme)에 대한 약물 조합(피타바스타틴과 이리노테칸)의 효과를 스크리닝한 연구가 있다.[16] 이러한 스크리닝 기술은 혈액-뇌 장벽(BBB) 모델링과 결합되기도 한다. BBB는 약물이 뇌로 들어가는 것을 막는 중요한 장벽인데, 뇌-칩을 이용하면 이 장벽을 통과하는 약물의 효능을 ''체외''에서 연구할 수 있다.[17][18][19] 또한, 미세 유체 프로브를 사용하여 특정 부위에만 염료나 약물을 정밀하게 전달하는 미세 관류 기술도 개발되었다.[20][21] 미세 유체 기반 BBB ''체외'' 모델은 세포가 3차원 환경에서 자랄 수 있게 하고, 혈류에 의한 전단 응력을 모방하며, 2D 모델보다 생리적으로 더 적합한 구조를 형성하고, 다양한 종류의 세포를 쉽게 통합할 수 있다는 장점이 있다.[22] 미세 유체 장치는 투명하게 제작될 수 있어 광학 현미경 등을 이용해 특정 영역이나 개별 세포의 형태 변화를 실시간으로 관찰하는 것도 가능하다.
뇌-칩 시스템은 알츠하이머병, 파킨슨병, 다발성 경화증과 같은 신경 질환의 기관 수준 생리를 기존의 2D 및 3D 세포 배양 기술보다 더 정확하게 모델링할 수 있는 잠재력을 가진다.[23][24] 실제 생체 내 조건과 유사하게 질병을 모델링하는 능력은 새로운 치료법이나 치료 전략을 개발하고 임상에 적용하는 데 매우 중요하다.[9][8] 또한, 뇌-칩 장치는 뇌 조직 절편에서 암 생체 지표(biomarker)를 검출하는 등 의료 진단 분야에서도 활용될 가능성을 보여주었다.[25]
하지만 뇌-칩 장치에도 몇 가지 한계점이 존재한다. 미세한 채널 내부를 액체가 흐르면서 발생하는 전단 응력(shear stress)이 세포나 조직에 손상을 줄 수 있다.[9] 또한, 이 작은 채널에는 기포가 쉽게 갇힐 수 있는데, 이는 흐름을 방해하고 세포에 손상을 입힐 수 있다.[26] 뇌-칩 장치 제작에 널리 사용되는 폴리디메틸실록산(PDMS) 재료도 단점을 가진다. PDMS는 저렴하고 유연하며 투명하다는 장점이 있지만, 단백질이나 작은 분자들이 PDMS 재질 자체에 흡수되었다가 나중에 예측 불가능하게 방출될 수 있어 실험의 정밀도를 떨어뜨릴 수 있다.[9]
미세 유체 기반 BBB 장치 역시 발전에도 불구하고 여전히 해결해야 할 과제들이 있다. 이러한 장치는 기술적으로 복잡하고, 작동을 위해 고도로 전문화된 장비와 설정이 필요한 경우가 많다. 또한, 세포 장벽을 통과하는 물질의 이동 속도나 양의 시간적, 공간적 변화를 정밀하게 감지하기 어렵다는 한계가 있다. 새로 형성된 미세 혈관 네트워크를 통해 물질이 얼마나 잘 투과하는지를 직접 측정하는 것도, 혈관 구조가 복잡하고 불규칙하며 관류가 제한적이기 때문에 어렵다.[22]
5. 2. 장 (Gut)
기존의 2차원(2D) 또는 3차원(3D) 세포 배양 시스템은 실제 장기의 복잡한 환경, 특히 조직 간 경계면, 화학 물질의 시공간적 기울기, 기계적으로 활발한 미세 환경 등을 완전히 모방하기 어려웠다.[6] 장기 칩 기술은 이러한 한계를 극복하며, 살아있는 장기의 생물학적 활동, 동적 기계적 특성, 생화학적 기능을 모방하는 차세대 3D 세포 배양 모델로 주목받고 있다.[7]인간의 장을 모사한 장기 칩은 주로 폴리디메틸실록산(PDMS)으로 제작된 두 개의 마이크로 채널을 포함하며, 이 채널들은 유연한 다공성 세포 외 기질(ECM) 막으로 분리된다. 이 막 위에는 장 상피 세포가 배양되는데, 인간 결장 선암종에서 유래하여 장의 보호 및 흡수 특성을 나타내는 Caco-2가 널리 사용된다.[27][28]
이 장기 칩은 실제 장의 미세 환경을 유사하게 구현하도록 설계되었다. 마이크로 채널 내에는 장의 연동 운동과 유사한 유체 흐름이 조성되며, 칩 양쪽의 진공 챔버를 이용해 주기적인 기계적 변형(신축 및 이완)을 가하여 장의 물리적 움직임을 모방한다.[28] 이러한 환경에서 배양된 세포들은 자발적으로 융모 형태를 형성하고 분화하며, 3차원 융모 구조에서는 세포 증식뿐만 아니라 대사 활동도 향상되는 모습을 보인다.[28][29][30]
장의 중요한 구성 요소인 장내 미생물군 연구에도 장기 칩이 활용된다. 특히 산소에 민감한 절대 혐기성 미생물과 호기성 환경을 선호하는 장 세포를 함께 배양하기 위해, 산소 투과성이 낮은 폴리설폰 재질의 칩이 개발되었다.[31] 이 시스템을 통해 결장 상피 세포, 술잔 세포와 함께 ''Faecalibacterium prausnitzii'', ''Eubacterium rectale'', ''Bacteroides thetaiotaomicron''과 같은 특정 장내 미생물의 성공적인 공동 배양이 가능해졌다.[31]
장기 칩은 다음과 같은 다양한 응용 분야에서 활용될 잠재력을 보여준다.
- 약물 개발: 경구 투여 약물의 효과는 장에서의 흡수 및 초회 통과 효과에 크게 영향을 받는다.[32] 장기 칩은 실제 장과 유사한 환경에서 약물의 흡수, 대사, 독성 등을 평가할 수 있게 하여, 신약 개발에 드는 시간과 비용을 절감하는 데 기여할 수 있다.[33]
- 염증성 장 질환(IBD) 연구: 원인이 복잡하고 장내 미생물군의 역할이 중요하게 여겨지는 IBD 연구에 장기 칩이 유용하게 사용된다.[34] 염증 유발 물질을 처리하여 IBD 유사 환경(장벽 기능 저하, 사이토카인 분비 증가 등)을 만들고, 질병의 발병 기전이나 약물 반응을 연구할 수 있다.[33][35] 최근에는 대식세포, 수지상 세포, CD4+ T세포와 같은 면역 세포를 포함시켜 더욱 복잡한 상호작용을 연구하거나,[36] 특정 장내 미생물의 항염증 효과를 평가하는 데에도 활용된다.[31]
- 방사선 손상 연구: 장기 칩은 생체 외 환경에서 방사선에 의한 장 손상(점액 생성 억제, 융모 구조 변화, 미세 융모 손상 등)을 세포 및 조직 수준에서 재현하고 연구하는 데 사용될 수 있다.[37]
5. 3. 폐 (Lung)
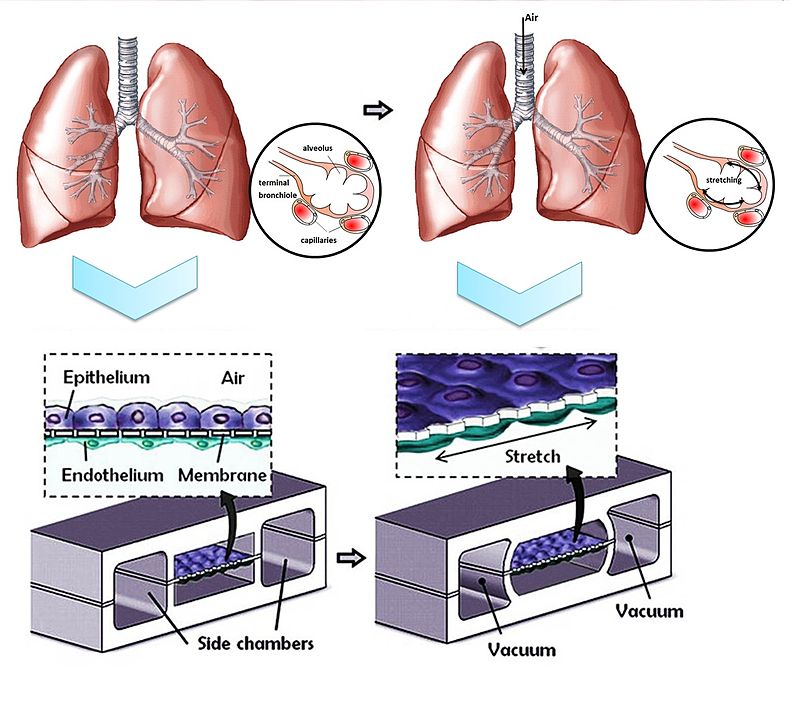
폐 칩은 최초의 장기 칩으로서, 2010년 미국 하버드대학의 위스 연구소(Wyss Institute)에서 허동은 펜실베니아 교수 주관으로 개발되었다. 이 칩은 폐 세포와 모세혈관 세포를 함께 배양하면서, 폐 세포가 있는 영역에는 진공 펌프를 이용해 실제 호흡과 유사한 팽창 및 수축 운동을 기계적으로 구현했다. 모세혈관 세포 영역에는 혈액을 모방한 배양액을 흘려보내 산소, 영양분 공급 및 노폐물 교환 기능을 모사했다. 투명한 재질 덕분에 호흡 과정에서 폐포(허파꽈리)의 움직임을 실시간으로 관찰할 수 있다.[130][131]
폐 칩은 기존의 시험관 내 생리학적 관련성을 높이기 위한 노력의 일환으로 설계되었다. 이 다기능 마이크로 장치는 인간 폐포-모세혈관 인터페이스(살아있는 폐의 기본 기능 단위)의 주요 구조적, 기능적 및 기계적 특성을 재현하는 것을 목표로 한다.
하버드 대학 위스 연구소의 허동은(Dongeun Huh) 연구팀은 얇은(10μm) 다공성 유연 세포막으로 분리된 두 개의 미세유체 채널 구조를 개발했다. 이 장치는 총 세 개의 채널로 구성되는데, 중앙 채널만이 다공성 막을 가지고 양쪽 채널과 분리된다. 막의 한쪽에는 인간 폐포 상피 세포를, 다른 한쪽에는 인간 폐 미세혈관 내피 세포를 배양하여 폐포-모세혈관 경계를 모방했다.
채널의 구획화는 공기가 상피 세포의 정점 표면으로 흐르고, 배양액(영양분 포함)이 내피 세포 쪽으로 흐르도록 한다. 또한, 중앙 채널과 양 측면 채널 사이에 압력 차이를 만들 수 있다. 실제 인간의 호흡 시 흡입 과정에서 경폐압이 감소하며 폐포가 팽창하는 원리를 모방하기 위해, 측면 채널에 진공을 가한다. 이 압력 감소는 중앙 채널을 팽창시키고 다공성 막을 늘어나게 하여, 폐포-모세혈관 인터페이스 전체에 주기적인 기계적 변형(약 10% 수준)을 가한다. 이러한 기계적 자극은 정적인 상태의 모델이나 기존의 Transwell 배양 시스템과 비교했을 때, 다공성 막을 가로지르는 나노입자의 이동 속도를 현저히 증가시키는 것으로 확인되었다.
장치의 생물학적 정확성을 검증하기 위해 다음과 같은 실험들이 수행되었다.
- '''폐 염증''': 강력한 염증 유발 물질을 배지에 첨가하여 폐 염증 반응을 유도했다. 주기적인 기계적 변형을 받은 폐 칩의 세포들은 실제 염증 반응처럼 상피 세포에서의 사이토카인 방출 증가, 백혈구 부착 분자 발현 증가 등의 반응을 보였다.
- '''폐 감염''': 살아있는 대장균 박테리아를 폐포 상피 표면에 노출시켜 박테리아성 호흡기 질환에 대한 선천적 세포 반응 모방 가능성을 확인했다. 실험 결과, 몇 시간 내에 혈관 채널에 있던 호중구가 다공성 막을 통과하여 폐포 쪽으로 이동해 침입한 박테리아를 식세포작용하는 것이 관찰되었다.
연구자들은 폐 칩 시스템이 독성학 연구, 특히 나노입자와 같은 미세 물질에 대한 폐의 반응을 연구하는 데 유용할 것으로 기대한다. 이를 통해 특정 환경 요인의 건강 위험성을 평가하고, 기존의 단순화된 시험관 내 모델의 한계를 극복할 수 있을 것으로 본다. 폐 칩은 실제 폐의 기계적 환경을 더 정확하게 모사하므로, Transwell 배양 시스템보다 생리적 반응을 더 빠르고 정확하게 예측할 수 있다. 다만, 현재 개발된 폐 칩의 반응이 실제 폐포 상피 세포의 모든 반응을 완전히 재현하는 데는 아직 한계가 있다는 점도 인정되고 있다.
5. 4. 심장 (Heart)
심장 칩은 2011년 미국 하버드 대학교의 위스 연구소(Wyss Institute) 소속 Kevin Kit Parker 연구팀이 개발했다. 심근, 심혈관 관련 질환 연구와 신약 개발 분야에서 활용된다.[132]3차원 세포 배양 모델은 더 높은 수준의 세포 분화와 조직 구성을 가능하게 하여 2차원 배양 시스템보다 우수하다. 이는 3차원 배양 시스템의 ECM 겔 유연성이, 단단한 2차원 배양 기질에서는 불가능했던 형태 변화와 세포 간 연결을 허용하기 때문이다. 그러나 기존 3차원 배양 모델도 조직 간 경계면, 화학 물질의 시공간적 기울기, 기계적으로 활성적인 미세 환경(예: 동맥의 온도 변화에 따른 혈관 수축 및 혈관 확장 반응) 등 실제 기관의 특성을 완전히 모방하기는 어렵다.[6] 미세유체역학 기술을 장기 칩에 적용하면, 살아있는 3차원 조직 구조 전체에 영양분과 기타 용해성 신호를 효율적으로 전달하고 분배할 수 있다. 장기 칩은 실제 살아있는 기관의 생물학적 활동, 동적 기계적 특성, 생화학적 기능을 모방하는 차세대 3차원 세포 배양 모델로 주목받고 있다.[7]
과거에는 생체 내 심장 조직 환경을 재현하려는 연구에서 수축성과 전기생리학적 반응을 모방하는 데 어려움이 있었다. 이러한 특성들은 시험관 내 실험의 정확성을 높이는 데 매우 중요하다. 미세유체역학은 심박수를 제어하는 전기적 자극을 생성하는 심근 세포에 대한 시험관 내 실험에 기여해왔다.[41] 예를 들어, 연구자들은 센서와 자극 전극이 정렬된 PDMS 미세 챔버 배열을 제작하여 심근 세포의 대사를 전기화학적, 광학적으로 관찰하는 도구로 사용했다.[42] 또 다른 랩온어칩 기술은 PDMS 미세 유체 네트워크와 평면 미세 전극을 결합하여 단일 성체 쥐 심근 세포의 세포외 전위를 측정하는 데 사용되었다.[43]
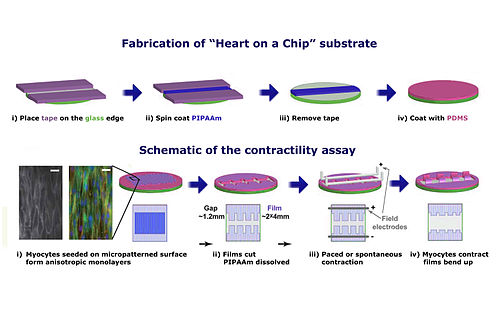
한 심장 칩 설계는 "층상 심장 근육의 계층적 조직 구조를 복제하여 구조-기능 관계를 효율적으로 측정하는 수단"을 구축했다고 보고되었다.[44] 이 칩은 심장 조직으로 만든 수축 장치에서 심근 세포의 정렬과 유전자 발현 양상(형태와 세포 구조 변형에 영향받음)이 심장 수축력에 기여함을 밝혀냈다. 이 심장 칩은 바이오하이브리드 구조로, 공학적으로 제작된 이방성 심실 심근이 탄성체 박막 위에 구현된 형태이다. 이 미세 유체 장치의 설계 및 제작 과정은 다음과 같다. 먼저 유리 표면 가장자리를 테이프로 덮어 기판 모양을 잡고, 스핀 코팅으로 PNIPA 층을 입힌다. 용해 후 테이프를 제거하면 자립형 PNIPA 본체가 만들어진다. 마지막으로 커버 슬립 위에 PDMS 보호 표면을 스핀 코팅하고 경화시킨다. 근육 박막(MTF)은 심장 근육 단층을 얇고 유연한 PDMS 기판 위에 공학적으로 구현할 수 있게 한다.[45] 2차원 세포 배양 시 적절한 파종을 위해 미세 접촉 인쇄 기술로 PDMS 표면에 피브로넥틴 '벽돌 벽' 패턴을 형성했다. 기능화된 기판에 심실 심근 세포를 파종하면, 피브로넥틴 패턴이 세포를 정렬시켜 이방성 단층을 형성한다. 박막을 직사각형 톱니 모양으로 두 줄 자르고 전체 장치를 용액에 담근 후, 전극을 이용한 전계 자극으로 심근 세포 수축을 유도하여 MTF 스트립/톱니가 구부러지게 한다. 연구팀은 수축 주기 동안 조직 응력과 MTF 스트립의 곡률 반경 사이의 상관관계를 밝혀내, 이 칩이 "응력, 전기 생리학 및 세포 구조를 정량화하기 위한 플랫폼"임을 검증했다.[1]
연구자들은 2차원 세포 배양에 집중해왔지만,[46][47][48] 3차원 세포 구조물은 ''생체 내'' 환경[49]과 인체에서 발생하는 상호 작용(예: 세포 간 상호 작용)을 더 잘 모방한다.[50] 따라서 독성학[51] 및 약물 반응 연구 등에 유망한 모델로 여겨진다.[50] Chen 등의 연구를 바탕으로[52], 심장 판막 내피세포(VECs)/간질세포(VICs)의 상호 작용이 3차원 PDMS-유리 미세 유체 장치를 통해 연구되었다. 이 장치는 상단 채널에 전단 응력 하에서 심장 판막 내피세포(VECs)가 흐르고, 균일한 기공을 가진 막 아래 하단 채널에는 심장 판막 간질세포(VICs)-하이드로겔이 포함된 구조이다.[52] 연구 결과, 심장 판막 내피세포(VECs)는 병적인 심장 판막 간질세포(VICs) 근섬유아세포로의 세포 분화를 억제하며, 이러한 억제 효과는 전단 응력에 의해 강화되는 것으로 나타났다.[52]
또 다른 PDMS 3차원 미세 유체 심장 칩 설계[50]는 단축 사이클릭 기계적 변형을 10%에서 15% 수준으로 생성할 수 있다. 이 장치는 케이징을 위한 매달린 기둥이 있는 세포 배양 구획과, PDMS 좌굴을 막기 위한 지지대 기둥이 있는 액추에이터 구획으로 구성되며, 심장 주기 압력 신호를 모방한다.[50] 이 설계로 자극받은 새끼 쥐의 미세 엔지니어링된 심장 조직(microengineered cardiac tissue, μECT)은 자극받지 않은 대조군에 비해 향상된 동시 박동, 세포 증식, 성숙 및 생존력을 보였다.[50] 인간 유도 만능 줄기 세포 유래 심근 세포(human induced pluripotent stem cell-derived cardiomyocytes, hiPSC-CM)의 경우, 전기 페이싱 신호(+ES)가 있을 때 심장 차단 치료제인 이소프레날린을 100배 적게 투여해도 ES가 없을 때보다 수축 속도가 더 빠르게 증가하는 것이 관찰되었다.[50]
3차원 미세 유체 심장 칩은 심혈관 질환 연구에도 기여했다. 예를 들어, 기계적으로 자극된 μECT를 통해 심실 비대와 심장 섬유증을 연구하는데, 각각의 생체 지표인 심방 나트륨 이뇨 펩타이드(Atrial Natriuretic Peptide, ANP)[53]와 형질 전환 성장 인자-β(Transforming Growth Factor-β, TGF-β)[54] 수준 변화를 관찰하는 방식이다. 또한 활동 전위 관찰을 통해 허혈에 대한 이해를 높일 수 있다.[55]
단일 세포 및 조직 수준에서 특정 메커니즘을 분리하는 미세 유체 접근 방식과 제작 방법은 점점 더 정교해지고 있다. 특히 저렴하고 고해상도인 3D 프린팅 기술의 빠른 보급은 이 분야에 혁신을 가져오고 있으며, 환자 맞춤형 심장 및 심혈관 시스템 구축의 새로운 가능성을 열고 있다. 고해상도 3D 프린팅, 환자 유래 iPSC와 인공 지능의 융합은 진정한 개인 맞춤형 심장 모델링과 궁극적으로 환자 치료 발전에 중요한 진전을 이룰 것으로 기대된다.[56]
5. 5. 신장 (Kidney)
신장 세포와 네프론은 미세유체공학 장치를 이용하여 시뮬레이션되고 있다. 이러한 연구는 세포 및 장기 기능에 대한 새로운 통찰력을 제공하며, 약물 스크리닝 등에 활용될 수 있다.[57] 신장-칩 장치는 손실된 신장 기능을 인공적으로 대체하는 연구를 가속화할 잠재력을 가진다. 현재 신장 투석은 환자가 일주일에 여러 번 병원을 방문해야 하는 불편함이 있다. 따라서 더 휴대 가능하고 접근성이 좋은 치료법 개발은 환자의 편의성을 높이고 치료 효과를 증진시킬 수 있다.[58] 인공 신장 연구는 미세유체, 소형화, 나노기술 등의 혁신 기술을 통해 장치의 휴대성, 착용성, 나아가 이식 가능성을 목표로 발전하고 있다.[59]네프론은 신장의 기본 기능 단위로, 사구체와 세뇨관으로 구성된다.[60] MIT 연구팀은 네프론의 사구체, 근위 세뇨관, 헨레 고리의 기능을 모방하는 생체 인공 장치를 설계했다고 발표했다.
이 장치는 각 부분마다 특화된 설계를 가지며, 보통 막으로 분리된 두 개의 미세 가공 층으로 이루어진다. 장치의 입구는 혈액 샘플 주입을 위해 설계되었다. 네프론의 사구체 부분을 모방하는 영역에서는 특정 막 구조(내피, 기저막, 상피 발돌기)를 통해 혈액 내 특정 입자만 통과시켜 여과한다. 이렇게 모세혈관 혈액에서 보우만 주머니로 여과된 액체를 여과액 또는 1차 소변이라고 부른다.[61]
세뇨관 단계에서는 소변 생성 과정의 일부로 특정 물질이 여과액에 추가되거나, 반대로 여과액에서 필요한 물질이 재흡수되어 다시 혈액으로 돌아간다. 세뇨관의 첫 부분인 근위 세뇨관에서는 포도당, 아미노산 등 영양학적으로 중요한 물질 대부분이 재흡수된다. 장치에서 이 부분은 직선 채널 형태로 구현되며, 여과액으로 이동하는 혈액 입자는 특정 막과 신장 근위 세뇨관 세포 층을 통과해야 한다. 세뇨관의 두 번째 주요 부분인 헨레 고리에서는 물과 이온의 재흡수가 일어난다. 장치의 루프형 채널은 헨레 고리의 중요한 기능인 대향류 증폭 메커니즘을 모방하도록 설계되었다. 헨레 고리 기능을 제대로 모방하기 위해서는 각기 다른 수송 특성을 가진 여러 세포 유형(하행지 세포, 얇은 상행지 세포, 두꺼운 상행지 세포, 피질 집합관 세포, 수질 집합관 세포 등)이 필요하다.[1]
미세유체 장치가 실제 네프론의 여과 및 재흡수 기능을 얼마나 잘 모방하는지 검증하기 위해서는 몇 가지 기준이 필요하다. 예를 들어, 혈액과 여과액 사이의 물질 이동 특성(위치, 통과 물질 종류)이 실제와 동일해야 한다. 물의 수동 수송은 주로 근위 세뇨관과 하행 얇은 지에서, NaCl의 능동 수송은 주로 근위 세뇨관과 두꺼운 상행 지에서 일어나는 특성을 재현해야 한다. 또한, 장치 설계 시 사구체의 여과 분획은 15–20%, 근위 세뇨관의 여과 재흡수율은 65–70% 범위 내에서 조절 가능해야 하며, 최종적으로 생성되는 소변의 요소 농도는 200–400 mM 범위여야 한다.[62]
최근 연구에서는 하이드로겔 기반 미세유체 장치에 수동 확산 기능을 구현하여 생체 모방 네프론을 제작한 사례가 보고되었다.[63] 네프론의 복잡한 생리 기능은 혈관과 세뇨관(모두 속이 빈 관 형태) 사이의 상호작용에 기반한다.[64] 기존의 2차원 페트리 접시 배양 방식으로는 이러한 3차원 구조와 생리 현상을 제대로 재현하기 어려웠다. 따라서 연구팀은 3차원 하이드로겔 내부에 기능적인 세포가 늘어선 미세 채널을 제작하는 새로운 방법을 개발했다. 혈관 내피 세포와 신장 상피 세포를 각각의 미세 채널 내부에 배양하여 혈관과 세뇨관을 모방하는 구조를 만들었다. 공초점 현미경을 이용하여 하이드로겔 내 혈관과 세뇨관 사이에서 작은 유기 분자(예: 약물)의 수동 확산을 관찰함으로써, 이 기술이 재생의학 및 약물 스크리닝 분야에서 신장 생리 모방에 유용하게 활용될 수 있는 잠재력을 보여주었다.
5. 6. 간 (Liver)
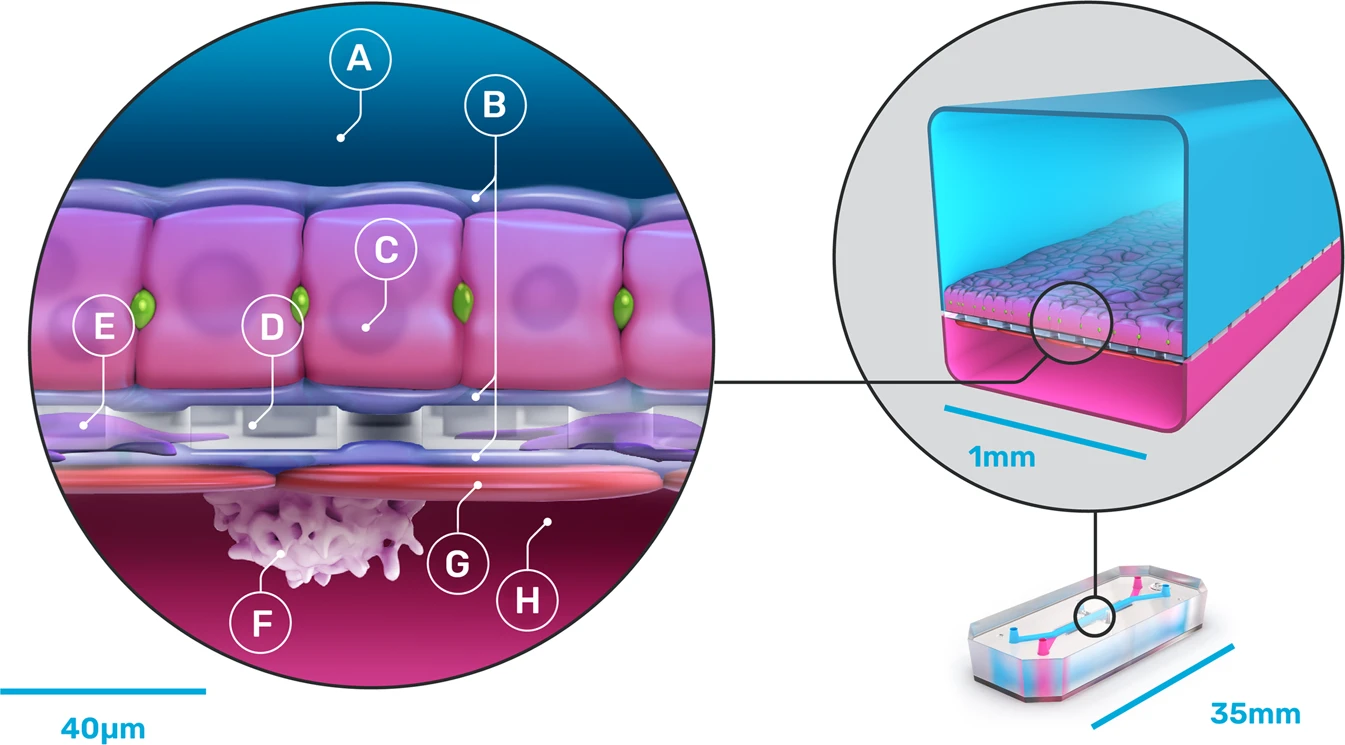
간은 신진대사의 중심 기관으로, 글리코겐 저장, 적혈구 분해, 특정 단백질 및 호르몬 합성, 해독 등 중요한 기능을 담당한다.[65] 특히 해독 기능은 신약 개발과 임상 시험 과정에서 매우 중요하다. 그러나 간은 다양한 기능을 수행하는 만큼 여러 질병에 취약하며, 간 질환은 전 세계적인 보건 문제로 대두되고 있다.[66]
기존의 2차원 세포 배양 방식은 실제 조직 환경을 제대로 모방하기 어려웠다. 3차원 세포 배양 모델은 세포 분화나 조직 구성을 더 잘 촉진하지만, 여전히 조직 간 경계면(예: 상피와 혈관 내피), 화학 물질의 시공간적 기울기, 기계적 미세 환경(예: 혈관 반응) 등 실제 기관의 복잡한 특성을 완전히 재현하는 데는 한계가 있다.[6] 장기 칩 기술, 특히 간 칩은 이러한 한계를 극복하기 위해 개발되었다. 미세 유체 기술을 이용하여 살아있는 3차원 조직 구조 전체에 영양분과 신호 물질을 효율적으로 전달하고, 실제 간의 생물학적 활동, 동적 특성, 생화학적 기능을 모방하는 차세대 모델로 주목받고 있다.[7]
간 칩 장치는 미세 유체 기술을 활용하여 복잡한 간 소엽 구조와 기능을 모방하여 간 시스템을 시뮬레이션한다. 이를 통해 연구자들은 비교적 저렴한 비용으로 간 기능 이상이나 질병 발생 과정을 연구할 수 있는 훌륭한 모델을 제공한다.[67][68][69] 연구에는 주로 1차 쥐 간세포와 다른 비실질 세포(예: 섬유아세포, 내피 세포)를 함께 배양하는 공동 배양 방법이 사용된다.[67][68][69] 이 방법은 간세포의 생존 기간을 늘리고 간 고유의 기능을 더 잘 유지하도록 돕는 것으로 밝혀졌다.[68]
많은 간 칩은 폴리(디메틸실록산)(PDMS)이라는 재료로 만들어진다. PDMS는 가격이 저렴하고 미세 유체 장치 형태로 만들기 쉽다는 장점이 있다.[67][68][69][70] 하지만 PDMS는 단백질이나 호르몬 같은 중요한 신호 분자를 흡수할 수 있다는 단점이 있다. 이러한 문제를 해결하기 위해 폴리술폰이나 폴리카보네이트와 같은 다른 재료를 사용하기도 한다.[71]
Emulate 사 연구진의 연구 결과에 따르면, 간 칩을 활용하면 약물 유발성 간 손상을 효과적으로 예측할 수 있다. 이는 약물 개발의 작업 흐름(신약 개발 파이프라인)에서 발생하는 막대한 비용과 시간을 줄이는 데 기여할 수 있으며, 제약 산업의 생산성 문제를 해결하는 데 도움이 될 것으로 기대된다.[72][73] Zaher Nahle는 간 칩과 같은 미세 생리 시스템(MPS)이 인간 질병 모델링에 더 우수한 12가지 이유를 제시하기도 했다.[72]
구체적인 간 칩 설계 사례로는 다음과 같은 것들이 있다.
- Kane 연구팀은 8x8 배열의 미세 유체 웰에서 1차 쥐 간세포와 3T3-J2 섬유아세포를 공동 배양하는 칩을 개발했다. 이 칩은 두 개의 챔버로 나뉘며, 1차 챔버에는 간세포와 섬유아세포를 배양하고 유리로 만들어 세포 부착을 돕는다. 이 챔버는 미세 유체 네트워크를 통해 대사 기질을 공급받고 부산물을 제거한다. 100 μm 두께의 PDMS 막이 1차 챔버와 2차 챔버를 분리하며, 2차 챔버는 37°C의 실내 공기(10% 이산화탄소 포함)를 관류시켜 공기 교환을 담당하는 또 다른 미세 유체 네트워크에 연결된다. 이 설계는 요소 생성 및 정상 상태 단백질 발현을 통해 대량 독성 연구에 활용될 가능성을 보였다.[67]
- Kang 연구팀은 1차 쥐 간세포와 내피 세포를 공동 배양하는 칩을 설계했다. 초기에는 단일 채널에서 두 세포를 Matrigel 층으로 분리하여 배양했으나, 이후 각 세포 유형이 별도의 채널을 갖는 이중 채널 설계를 개발하여 기질 공급 및 부산물 제거를 분리했다. 이 칩은 요소 생성뿐만 아니라 B형 간염 바이러스(HBV) 복제 실험에서도 긍정적인 결과를 보여, 간친화성 바이러스 연구에 활용될 수 있음을 시사했다.[68]
간 칩은 이 외에도 다양한 분야에 응용될 수 있다. Lu 연구팀은 탈세포화된 간 기질(DLM)과 젤라틴 메타크릴로일(GelMA) 기반 물질을 이용하여 생체 모방 간 종양 칩 모델을 개발하여 항암 연구의 가능성을 열었다.[69] Zhou 연구팀은 간 칩을 이용하여 알코올이 간세포에 미치는 손상과 신호 전달 및 회복 과정을 분석했다.[74]
간 칩은 간 관련 연구에 큰 잠재력을 보여주고 있으며, 앞으로 체액 내 시약, 세포 종류, 생존 시간 연장 등 실제 간 환경을 더욱 정밀하게 모방하는 방향으로 발전할 것으로 기대된다.[68]
5. 7. 전립선 (Prostate)
전립선 상피를 재현하려는 연구는 이것이 암 전이의 시작점이 될 수 있다는 증거에 기반한다.[75][76] 이러한 시스템은 생쥐에서 배양된 세포를 사용하는 2차원 배양 방식에서 나아가, 3차원 인간 세포 배양으로 발전하는 다음 단계로 여겨진다.[77][6] 폴리다이메틸실록세인(PDMS)를 이용한 미세 유체 시스템 개발은 표면 지형을 조절할 수 있고, 기체 및 액체 교환이 용이하며, 기존 현미경으로 쉽게 관찰할 수 있다는 장점을 제공한다.[78]그르노블 알프스 대학교 연구진은 미세 유체 시스템을 활용하여 실제와 유사한 전립선 상피 모델을 구축하는 방법론을 제시했다. 이 접근법은 인간의 분비관 형태를 모방한 원통형 마이크로채널을 만드는 데 중점을 둔다.[79][80] 다양한 마이크로채널 직경을 시험한 결과, 150-400 μm 직경에서 세포 배양이 가장 성공적이었다. 또한, 마이크로 유체 흐름 변화를 통해 물리적 스트레스를 가했음에도 불구하고 실험 전반에 걸쳐 세포 부착은 지속적으로 유지되었다.
이러한 전립선 칩 구조의 목표는 전립선액 수집을 용이하게 하고, 미세환경 변화에 대한 세포 반응을 측정하는 것이다.[81][82] 더 나아가, 전이 시나리오를 재현하여 약물 후보 및 다른 치료법을 평가하는 데 활용될 수 있다.[83][84] 이 방법은 재사용 가능한 금형을 사용하여 저렴한 비용으로 생산할 수 있어 확장성 측면에서도 연구자들에게 매력적이다.[85]
5. 8. 혈관 (Blood vessel)
심혈관 질환은 종종 작은 혈관의 구조와 기능 변화 때문에 발생한다. 예를 들어, 미국 국립 보건 영양 검사 설문조사(NHANES)의 2003년 보고서에 따르면, 고혈압의 자가 보고율이 증가하는 추세를 보인다.[86] 이러한 배경에서 동맥의 생물학적 반응을 모방하는 미세 유체 플랫폼, 즉 '동맥 칩'이 개발되었다. 이 기술은 약물 개발 과정에서 기관 기반 스크린을 더 자주 수행할 수 있게 할 뿐만 아니라, 작은 동맥의 병리학적 변화 뒤에 숨겨진 메커니즘에 대한 포괄적인 이해를 얻고 더 나은 치료 전략을 개발할 수 있게 해준다. 토론토 대학교의 액셀 귄터(Axel Gunther)는 이러한 MEMS 기반 장치가 임상 환경에서 환자 개개인의 미세 혈관 상태를 평가하는 맞춤 의학에 잠재적으로 도움이 될 수 있다고 주장한다.[87]고립된 혈관 저항 혈관(직경이 30μm와 300μm 사이인 세동맥과 작은 동맥)의 고유한 특성을 검사하는 데 사용되는 기존 방법에는 압력 근육조영술 기술이 있다. 그러나 이러한 방법은 현재 수동으로 숙련된 인력이 필요하며 확장성이 없다. 동맥 칩은 확장 가능하고, 저렴하며, 제조 과정에서 자동화될 수 있는 플랫폼에 동맥을 수용함으로써 이러한 여러 가지 제한 사항을 극복할 수 있다.
기관 기반 미세 유체 플랫폼은 섬세한 혈관을 고정할 수 있는 랩온어칩으로 개발되어 저항 동맥 기능 장애의 결정 요인을 연구할 수 있다.
동맥 미세 환경은 주변 온도, 경벽 압력 및 내강 및 외강 약물 농도에 의해 특징지어진다. 미세 환경의 여러 입력은 혈관의 바깥쪽 벽과 내강 벽에 각각 줄을 긋는 평활근 세포 (SMCs) 및 내피 세포 (ECs)에 광범위한 기계적 또는 화학적 자극을 유발한다. 내피 세포는 혈관 수축 및 혈관 확장 인자를 방출하여 혈관의 긴장도를 조절한다. 혈관 긴장도는 혈관 내부의 수축 정도를 최대 직경과 비교하여 정의된다.[88] 병인 개념은 현재 이 미세 환경의 미묘한 변화가 동맥 긴장도에 뚜렷한 영향을 미치고 말초 혈관 저항을 심각하게 변경할 수 있다고 믿는다. 이 설계를 담당하는 엔지니어는 근육조영술 프로토콜이 설계상 균질한 미세 환경만을 구축한 반면, 미세 환경 내에서 발견되는 이종 시공간적 영향을 제어하고 시뮬레이션할 수 있는 능력에 특정 강점이 있다고 믿는다.[1] 그들은 페닐에프린을 외벽에 관류를 제공하는 두 채널 중 하나를 통해서만 전달함으로써 약물에 노출된 쪽이 약물 반대쪽보다 훨씬 더 많이 수축한다는 것을 증명했다.
동맥 칩은 샘플의 가역적인 이식을 위해 설계되었다. 이 장치에는 미세 채널 네트워크, 동맥 로딩 영역 및 별도의 동맥 검사 영역이 포함되어 있다. 동맥 분절을 로딩하는 데 사용되는 미세 채널이 있으며, 로딩 웰이 밀봉되면 관류 채널로도 사용되어 동맥 혈액이 생물학적 조직 내 모세 혈관 침대에 영양을 공급하는 과정을 복제한다.[89] 다른 한 쌍의 미세 채널은 동맥 분절의 양쪽 끝을 고정하는 역할을 한다. 마지막 한 쌍의 미세 채널은 외강 벽 위에 일정한 유지 매체를 전달하여 기관의 생리적 및 대사 활성을 유지하기 위해 관류 흐름 속도를 제공하는 데 사용된다. 열전 히터와 서미스터가 칩에 연결되어 동맥 검사 영역에서 생리적 온도를 유지한다.
조직 샘플을 검사 구역에 로딩하고 고정하는 프로토콜은 이 접근 방식이 전체 기관 기능을 어떻게 인식하는지 이해하는 데 도움이 된다. 조직 분절을 로딩 웰에 담근 후, 로딩 과정은 로딩 채널의 먼 끝에서 일정한 유량의 완충 용액을 빼내는 주사기에 의해 구동된다. 이렇게 하면 동맥이 지정된 위치로 운반된다. 이 작업은 고정 및 관류 입/출구 라인이 닫힌 상태에서 수행된다. 펌프를 멈춘 후, 대기압보다 낮은 압력이 고정 채널 중 하나를 통해 가해진다. 그런 다음 로딩 웰을 닫아 밀봉한 후, 두 번째 고정 채널에 대기압보다 낮은 압력이 가해진다. 이제 동맥이 검사 구역에 대칭적으로 배치되고 분절은 경벽 압력을 느낀다. 나머지 채널이 열리고 별도의 주사기 펌프를 사용하여 일정한 관류 및 외강 관류가 조정된다.[1]
혈관 칩은 많은 질병 과정을 연구하는 데 적용되었다. 예를 들어, 알리레자 마샤기(Alireza Mashaghi)와 그의 동료들은 바이러스 유발 혈관 무결성 손실을 포함하는 바이러스성 출혈열을 연구하기 위한 모델을 개발했다. 이 모델은 에볼라 바이러스 질환을 연구하고 항에볼라 약물을 연구하는 데 사용되었다.[90] 2021년에는 라사 열병을 모델링하고 펩타이드 FX-06의 라사 바이러스 질환 치료 효과를 보여주기 위해 이 접근 방식을 적용했다.[91]
5. 9. 피부 (Skin)
인간 피부는 여러 병원체에 대한 인체의 첫 번째 방어선이며, 암이나 염증과 같은 다양한 질병 및 문제의 대상이 될 수 있다. 이러한 중요성 때문에 피부를 모방한 장기 칩, 즉 피부 칩(Skin-on-a-Chip, SoC) 개발 연구가 진행되고 있다. 피부 칩은 국소적으로 적용되는 약물이나 화장품의 안전성 및 효능 테스트, 피부 질환 및 염증의 병리학적 연구,[92] 그리고 병원체 감염 여부를 확인하기 위한 항원 또는 항체 검출 등 비침습적이고 자동화된 세포 분석 개발에 활용될 잠재력을 가진다.[93]그러나 폐나 신장 등 다른 장기 칩에 비해 피부 칩 개발 연구는 상대적으로 더딘 편이다.[94] 여기에는 몇 가지 기술적 어려움이 따른다. 예를 들어, 세포 배양 지지체로 사용되는 콜라겐 스캐폴딩(scaffolding, 지지체)이 미세 채널 내에서 분리되는 문제,[94] 세포가 완전히 분화되지 못하는 문제,[95] 그리고 장치 제작에 주로 사용되는 폴리디메틸실록산(PDMS)이라는 물질이 생물학적 샘플에 화학 물질을 유출시킬 수 있고 대량 생산이 어렵다는 점 등이 플랫폼 표준화를 방해하는 요인으로 지적된다.[96] 또한, 실제 피부의 세포외 기질(ECM) 역할을 하는 세포 배양 스캐폴딩 물질의 종류가 다양하고 그 특성이 가변적이라는 점도 어려움 중 하나이다.
인체의 세포 외 기질(ECM)은 주로 콜라겐으로 구성되어 있으며, 다양한 동물 유래 콜라겐 기반 스캐폴딩이 피부 칩 모델에서 시험되었다. 하지만 콜라겐은 배양 중 섬유아세포의 수축 작용으로 인해 미세유체 칩 구조물에서 분리되는 경향이 있다. 한 연구에서는 돼지 피부, 쥐 꼬리, 오리 발에서 얻은 콜라겐 스캐폴딩의 품질을 비교하며 이 문제를 해결하고자 했다.[94] 완전한 피부 분화 과정이 최대 몇 주까지 소요될 수 있다는 점을 고려할 때, 이러한 수축 및 분리 문제는 중요한 제약 조건이 된다.[94] 이 문제를 해결하기 위해 콜라겐 대신 수축하지 않는 피브린 기반의 진피 기질을 사용하기도 한다.[96]
한편, 전통적인 정적 배양 방식(배양액을 교체해주지만 흐름이 없는 방식)과 비교했을 때, 미세유체 기술을 이용한 동적 배양(배양액이 지속적으로 흐르는 방식) 환경에서 더 나은 세포 분화와 세포층 형성이 관찰되었다. 이는 동적 관류, 즉 지속적인 배양액 흐름이 만들어내는 압력으로 인해 세포 사이 공간을 통한 물질 투과가 증가하고, 결과적으로 세포 간 및 세포-기질 간 상호작용이 개선되기 때문으로 보인다.[8][97] 또한, 유체 흐름에 의해 발생하는 전단 응력(shear stress)도 세포 분화와 성장을 촉진하는 요인으로 여겨진다.[98] 동적 관류는 배양액에 직접 닿지 않는 세포에도 영양분을 효과적으로 공급할 수 있다. 정적 배양에서는 세포가 확산에 의해서만 영양분을 얻지만, 동적 관류는 세포 사이의 미세한 공간을 통해 영양분이 더 잘 흐르게 한다.[98] 이러한 동적 관류는 피부 표면의 가장 바깥층으로 물질 투과에 주요 장벽 역할을 하는 ''각질층''의 치밀한 구조 형성을 개선하는 효과도 보여주었다.[99]
동적 관류는 세포 생존력을 향상시키는 데도 기여한다. 상용화된 피부 모델을 미세유체 플랫폼에 적용하여 배양했을 때, 그 수명이 몇 주 더 연장되는 것이 확인되었다.[100] 이 연구는 또한 피부 모델에서 모낭의 중요성을 강조했다. 모낭은 국소 크림 등 피부 표면에 바르는 물질이 피하층으로 들어가는 주요 경로임에도 불구하고, 최근 연구들에서 종종 간과되어 왔다.[100]
피부 칩은 특정 질병 모델 연구에도 활용된다. 한 연구에서는 부종(edema), 즉 세포 외부의 체액 축적으로 인한 부기(감염이나 부상 시 흔히 나타나는 반응이자 세포 복구의 필수 단계)를 연구하기 위해 표피, 진피, 내피의 세 층으로 구성된 피부 칩을 개발했다. 이 칩을 이용하여 항염증 효과가 있는 스테로이드 크림인 Dexamethasone|덱사메타손영어(Dex)을 미리 처리했을 때 부종이 감소하는 것을 성공적으로 보여주었다.[92]
5. 10. 자궁내막 (Endometrium)
자궁내막은 착상 및 임신의 다른 단계에서 역할을 하는 것으로 모델링되었다.[101]6. 인간-온-어-칩 (Human-on-a-chip)
3차원 세포 배양 모델은 2차원 배양 시스템보다 더 높은 수준의 세포 분화와 조직 구성을 촉진한다는 장점이 있다. 이는 3차원 배양 시스템의 ECM 겔이 유연하여, 딱딱한 2차원 배양 기질에서는 불가능했던 세포의 형태 변화와 세포 간 연결을 가능하게 하기 때문이다. 하지만 이러한 3차원 배양 모델조차도 실제 기관의 복잡한 특성을 완전히 모방하는 데는 한계가 있다. 예를 들어, 상피와 혈관 내피 같은 조직 간 경계면, 화학 물질의 시공간적 농도 차이, 또는 동맥의 온도 변화에 따른 혈관 수축 및 혈관 확장 반응과 같은 기계적으로 활성적인 미세 환경을 재현하기 어렵다.[6]
이러한 한계를 극복하기 위해 미세 유체 공학 기술을 장기 칩에 적용하게 되었다. 장기 칩은 살아있는 3차원 조직 구조 전체에 영양분과 기타 필요한 물질들을 효율적으로 공급하고 분포시키는 것을 가능하게 한다. 이는 전체 살아있는 기관의 생물학적 활동, 동적 기계적 특성, 그리고 생화학적 기능을 모방하는 차세대 3차원 세포 배양 모델로 평가받는다.[7]
연구자들은 인체 내 여러 장기의 상호작용을 모방하기 위해, 다양한 종류의 3차원 세포 집합체를 동시에 배양할 수 있는 다중 채널 3D 미세유체 세포 배양 시스템을 개발하는 데 힘쓰고 있다.[102] 현재 개발된 대부분의 장기 칩 모델은 단일 종류의 세포만을 배양하기 때문에 특정 장기의 기능을 연구하는 데는 유용할 수 있지만, 약물이 인체 전체에 미치는 전신적인 영향을 평가하기에는 부족하다.
이러한 배경에서 통합 세포 배양 유사체(μCCA, microfluidic cell culture analog)가 개발되었다. 이 시스템에는 폐 세포, 약물 대사를 담당하는 간 세포, 그리고 지방 세포가 포함되었다. 각 세포들은 배양 배지가 혈액처럼 순환하는 2D 유체 네트워크로 연결되어, 영양분을 효율적으로 공급받고 노폐물을 제거할 수 있었다.[103] C. Zhang 연구팀은 μCCA 개발이 실제와 유사한 시험관 내 약동학 모델의 기초를 마련했으며, 생체 내 환경과 유사하게 여러 세포 유형을 동시에 배양할 수 있는 통합된 생체 모방 시스템을 제공했다고 평가했다. 그들은 간, 폐, 신장, 지방 등 네 가지 인간 장기를 모방하기 위해 각각 다른 세포 유형을 배양하는 미세유체 인간 칩을 개발했다.[104] 연구팀은 칩 내 모든 세포 유형에 적합한 표준 혈청 무 배양 배지(CM, common medium) 개발에 집중했다. 일반적으로 배지는 특정 세포 유형에 맞춰 최적화되지만, 여러 장기를 동시에 배양하는 인간 칩에서는 모든 세포가 생존하고 기능할 수 있는 공통 배지가 필수적이다. 연구팀은 실제로 미세유체 장치 내 모든 세포 배양을 관류시키면서 세포의 기능 수준을 유지하는 공통 배지를 성공적으로 확인했다고 밝혔다. 시험관 내에서 배양된 세포의 민감도를 높이는 것은 장치의 유효성을 보장하는 데 중요하며, 이는 미세 채널에 주입된 약물이 인체의 실제 장기와 동일한 생리적, 대사적 반응을 샘플 세포에서 유도하도록 하는 것을 목표로 한다.
또한, 단일 유체 액추에이터를 사용하여 여러 조직으로의 미세 유체 수송을 조절할 수 있는 인간 칩 설계가 개발되어, 간과 췌장 조직을 이용하여 당뇨병 전 단계의 고혈당증을 모델링하는 연구에 활용 및 평가되었다.[105]
이러한 다중 장기 칩 기술이 더욱 발전하면, 제약 회사들은 특정 약물이나 생화학 물질이 한 장기에 미치는 영향뿐만 아니라, 그 영향이 다른 장기에는 어떤 영향을 주는지 직접적으로 측정할 수 있게 될 것이다. 예를 들어, 특정 치료 물질이 목표 장기에는 긍정적인 효과를 보이더라도 다른 장기의 기능을 손상시키지는 않는지 등을 미리 검증할 수 있다. 현재 3D 프린터를 이용해 이러한 장기를 만드는 시도도 있지만, 아직 비용이 매우 높다는 문제가 있다. 전체 신체를 모방하는 장치를 설계하는 것은 제약 회사들이 기존 장기 칩에 대해 가졌던 주요 우려 사항, 즉 개별 장기가 분리되어 있다는 점을 해결할 수 있다. 하지만 이러한 장치의 접근성이 높아짐에 따라 설계의 복잡성도 기하급수적으로 증가한다. 미래의 시스템은 순환계를 모방하여 기계적인 자극과 유체 흐름을 동시에 제공해야 할 것이다. 미시간 대학교의 타카야마 교수는 "정적인 제어뿐만 아니라 동적인 제어가 필요한 모든 것이 도전 과제"라고 지적했다.[106] 이러한 과제는 MIT의 조직 공학 연구자인 린다 그리피스 그룹에 의해 일부 해결되고 있다. 이 그룹은 유체 제어를 통해 4개, 7개, 또는 10개의 장기를 상호 연결한 복잡한 다중 장기 칩을 개발했으며,[107] 이 시스템은 연결된 장기들의 기능을 수 주 동안 유지할 수 있는 것으로 나타났다.
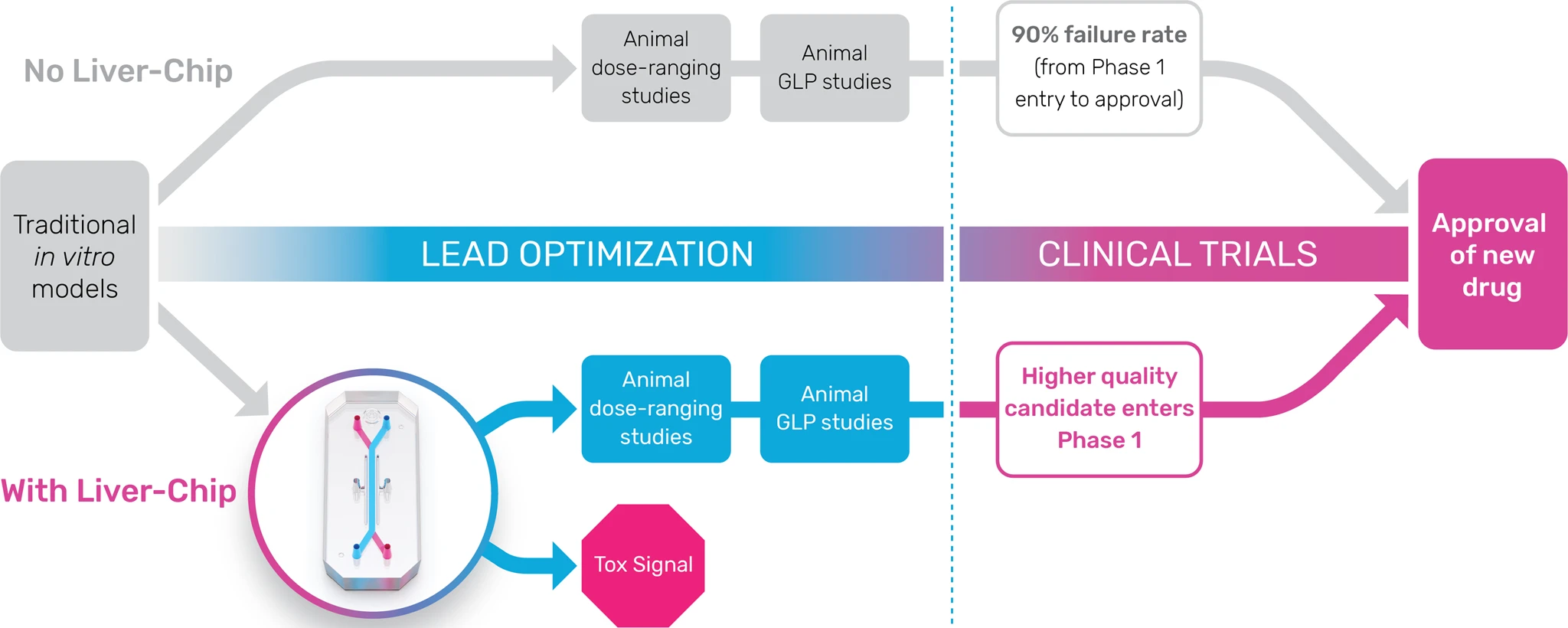
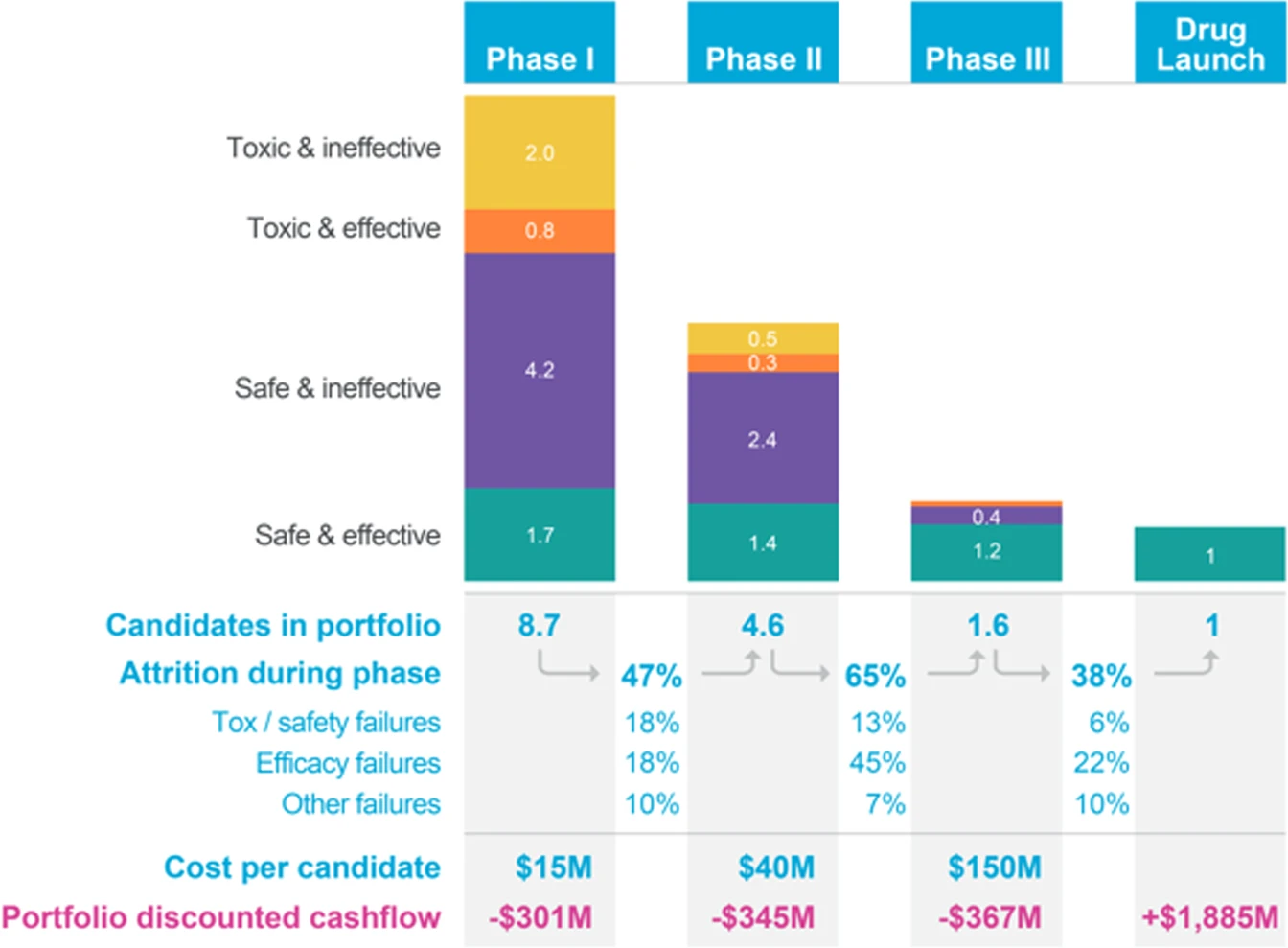
7. 동물 실험 대체 (Replacing animal testing)
기존의 신약 개발과 독성 평가는 동물 실험에 크게 의존해왔다. 그러나 장기 칩 기술은 일부 동물 실험을 대체할 가능성을 제시하며, 동물 대신 실제 인간 세포에서의 반응을 직접 관찰할 수 있다는 점에서 중요한 장점을 가진다. 이는 사람 대상 임상 시험의 일부를 대체하여 비용과 시간을 크게 줄일 수 있을 것으로 기대된다.[134]
3차원 세포 배양 모델은 2차원 배양 시스템보다 더 높은 수준의 세포 분화와 조직 구성을 가능하게 한다. 이는 3차원 배양 시스템의 ECM 겔이 2차원 배양 환경에서는 불가능했던 세포 형태 변화와 세포 간 연결을 유연하게 수용하기 때문이다. 그럼에도 불구하고, 가장 발전된 3차원 배양 모델조차 실제 기관의 복잡한 특성, 예를 들어 상피와 혈관 내피 같은 조직 간 경계면, 화학 물질의 시공간적 농도 변화, 동맥의 온도 변화에 따른 혈관 수축 및 혈관 확장과 같은 기계적으로 활성적인 미세 환경 등을 완전히 모방하는 데는 한계가 있다.[6] 미세유체학 기술을 장기 칩에 적용함으로써, 살아있는 3차원 조직 구조 전체에 영양분과 다른 용해성 신호 물질들을 효율적으로 전달하고 분포시키는 것이 가능해졌다. 장기 칩은 살아있는 전체 기관의 생물학적 활동, 역동적인 기계적 특성, 생화학적 기능을 모방하는 차세대 3차원 세포 배양 모델로 주목받고 있다.[7]
초기 약물 개발 단계에서 동물 모델은 인간의 약동학적 반응을 예측할 수 있는 생체 내 데이터를 얻는 유일한 방법으로 여겨졌다. 하지만 동물 실험은 시간과 비용이 많이 소요될 뿐만 아니라, 윤리적인 논란을 야기하기도 한다. 예를 들어, 동물 모델은 종종 인간의 특정 상태를 모방하기 위해 기계적 또는 화학적 손상을 입는다. 또한, 동물과 인간 사이의 생물학적 차이(종간 외삽의 결함) 때문에 동물 모델 실험 결과의 타당성에 대한 의문도 제기된다.[108] 동물 모델은 특정 변수에 대한 통제가 제한적이며, 원하는 정보를 정확히 얻기 어려울 수 있다.
이에 따라, 인간의 생리적 반응을 시험관 내에서 더 저렴하고 효과적으로 모방할 필요성이 커졌다. 생체 모방 미세 유체 시스템은 세포 수준의 정밀한 제어를 가능하게 하여 동물 실험을 대체할 잠재력을 지닌다. 복잡한 장기 수준의 병리 생리 반응을 재현하는 MEMS(미세 전자 기계 시스템) 기반 바이오칩의 개발은 독성학, 의약품 및 화장품 개발 등 동물 실험과 임상 시험에 의존해 온 여러 분야에 혁신을 가져올 수 있다.[109]
최근에는 생체 내 세포 환경과 유사한 조건을 제공하는 생리적 기반 관류 시험관 내 시스템이 개발되고 있다. 여러 구획으로 나뉜 관류 시스템 기반의 새로운 실험 플랫폼은 약리학 및 독성학 분야에서 큰 주목을 받고 있다. 이 시스템은 흡수(Absorption), 분포(Distribution), 대사(Metabolism), 배설(Excretion)을 포함하는 생체 내 ADME 과정을 더 신뢰성 있게 재현하는 것을 목표로 한다. 관류 시험관 내 시스템과 동역학 모델링을 결합하는 것은 외래 물질의 독성 동태와 관련된 다양한 과정을 시험관 내에서 연구하기 위한 유망한 접근법이다.
인체의 특성을 최대한 가깝게 복제하는 모델을 만들고, 약물 개발 과정에서 시너지 효과를 내는 약물 상호 작용을 식별하며, 다중 장기 대사 상호 작용을 시뮬레이션하는 등 잠재적 활용 가능성을 보여주기 위한 미세 제작 세포 배양 시스템 개발 노력이 진행 중이다. 특히, 여러 구획으로 구성된 미세 유체 기반 장치, 그중에서도 포유류 신체의 구획 모델에서 화합물의 질량 이동을 나타내는 생리 기반 약동학(PBPK) 모델의 물리적 구현은 약물 개발 과정을 개선하는 데 기여할 수 있다. 일부 신기술은 신체의 다른 부위에서 유래한 세포들, 즉 혼합된 세포 유형의 공동 배양 환경에서 여러 생물학적 과정을 동시에 측정할 수 있는 능력을 갖추고 있어, 생체 내 모델과의 유사성을 더욱 높일 것으로 기대된다.[110]
수학적 약동학(PK) 모델은 초기 약물 투여량을 바탕으로 각 장기 내 약물 농도의 시간적 변화를 예측하는 것을 목표로 한다. 이러한 모델은 약물 분포가 투여 후 빠르게 평형에 도달한다고 가정하고 신체를 단일 구획으로 단순화하여 취급할 수도 있다. 관련된 모든 매개변수가 알려져 있다면 수학적 모델은 매우 정확할 수 있다. PK 또는 PBPK 모델을 약력학(PD) 모델과 결합하면 약물의 시간에 따른 약리학적 효과를 예측할 수 있다. 현재 PBPK 모델을 사용하여 거의 모든 화학 물질의 PK를 처음부터 예측하는 것이 가능해지고 있다. 이러한 모델들은 목표와 가용 데이터에 따라 통계적 용량-반응 모델처럼 비교적 단순할 수도 있고, 시스템 생물학에 기반한 정교한 모델일 수도 있다. 중요한 것은 관심 있는 분자에 대한 정확한 매개변수 값을 확보하는 것이다.
미세 유체 세포 배양 시스템과 같은 미세 세포 배양 유사체(μCCAs)는 PBPK 모델과 함께 활용될 수 있다. '바디-온-어-칩(body-on-a-chip)'이라고도 불리는 이러한 μCCA 장치들은 축소된 형태로, 생리적인 유체 흐름 조건과 실제적인 조직 간 크기 비율을 유지하며 다중 조직 상호 작용을 시뮬레이션할 수 있다. 이 시스템에서 얻은 데이터는 기계론적 가설을 검증하고 개선하는 데 사용될 수 있다. 또한, 미세 제작 기술을 통해 장치를 맞춤 설계하고 장기 구획들을 서로 적절한 비율로 확장할 수 있다.
이 장치들은 동물 세포와 인간 세포 모두에 적용 가능하여 종간 외삽을 용이하게 할 수 있다. PBPK 모델과 함께 사용하면 동물 모델 연구에 필요한 유효 농도를 추정하거나 인간의 반응을 예측하는 데 도움을 줄 수 있다. 다중 구획 장치 개발 시 PBPK 모델에서 사용되는 인체 표현 방식을 활용하여 챔버 및 유체 채널 연결 배열 등 장치 설계를 최적화함으로써 약물 개발 과정을 강화하고 임상 시험의 성공률을 높일 수 있다.
참조
[1]
논문
Advances in organ-on-a-chip engineering
http://dx.doi.org/10[...]
2018-08-01
[2]
논문
Microfluidic organs-on-chips
http://dx.doi.org/10[...]
2014
[3]
논문
Human organs-on-chips for disease modelling, drug development and personalized medicine
Springer Science and Business Media LLC
2022-03-25
[4]
논문
Systems engineering of microphysiometry
2022-01
[5]
논문
Human Organs-on-Chips for Virology
2020-11
[6]
논문
From 3D cell culture to organs-on-chips
2011-12
[7]
논문
Organs-on-a-chip for faster drug development.
http://www.scientifi[...]
2011-03
[8]
논문
Microfluidic organs-on-chips
2014-08
[9]
논문
Brain slice on a chip: opportunities and challenges of applying microfluidic technology to intact tissues
2012-06
[10]
논문
Engineering brain-on-a-chip platforms
https://www.nature.c[...]
2024-08
[11]
논문
Organotypic brain slice cultures: A review
2015-10
[12]
논문
Brain slices as models for neurodegenerative disease and screening platforms to identify novel therapeutics
2007-03
[13]
논문
A dense poly(ethylene glycol) coating improves penetration of large polymeric nanoparticles within brain tissue
2012-08
[14]
논문
A simple method for organotypic cultures of nervous tissue
1991-04
[15]
논문
Culturing thick brain slices: an interstitial 3D microperfusion system for enhanced viability
2009-06
[16]
논문
Engineering a Brain Cancer Chip for High-throughput Drug Screening
2016-05
[17]
논문
Microfluidic organ-on-chip technology for blood-brain barrier research
2016-01-02
[18]
논문
BBB on chip: microfluidic platform to mechanically and biochemically modulate blood-brain barrier function
https://ris.utwente.[...]
2013-02
[19]
논문
Recreating blood-brain barrier physiology and structure on chip: A novel neurovascular microfluidic bioreactor
2015-09
[20]
논문
Chamber and microfluidic probe for microperfusion of organotypic brain slices
2010-02
[21]
서적
Open-Space Microfluidics: Concepts, Implementations, Applications
Wiley-VCH Verlag GmbH & Co. KGaA
2018-01-26
[22]
논문
Astrocytes and human artificial blood-brain barrier models
https://www.bjbms.or[...]
2022-04-01
[23]
논문
Three-dimensional brain-on-a-chip with an interstitial level of flow and its application as an in vitro model of Alzheimer's disease
2015-01
[24]
논문
Central Nervous System and its Disease Models on a Chip
2015-12
[25]
논문
Bioconjugated lanthanide luminescent helicates as multilabels for lab-on-a-chip detection of cancer biomarkers
2010-01
[26]
논문
Prevention of air bubble formation in a microfluidic perfusion cell culture system using a microscale bubble trap
2009-08
[27]
논문
The Caco-2 cell line as a model of the intestinal barrier: influence of cell and culture-related factors on Caco-2 cell functional characteristics
2005-01
[28]
논문
Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow
2012-06
[29]
논문
Gut-on-a-Chip microenvironment induces human intestinal cells to undergo villus differentiation
2013-09
[30]
논문
Microfluidic gut-on-a-chip with three-dimensional villi structure
2017-06
[31]
논문
Primary Human Colonic Mucosal Barrier Crosstalk with Super Oxygen-Sensitive Faecalibacterium prausnitzii in Continuous Culture
https://doi.org/10.1[...]
2021-01
[32]
논문
Microfluidic Gut-liver chip for reproducing the first pass metabolism
2017-03
[33]
논문
Development of a Gut-On-A-Chip Model for High Throughput Disease Modeling and Drug Discovery
2019-11
[34]
논문
The gut microbiota and inflammatory bowel disease
2015-01
[35]
논문
Development of a human primary gut-on-a-chip to model inflammatory processes
2020-12
[36]
논문
An immune-competent human gut microphysiological system enables inflammation-modulation by Faecalibacterium prausnitzii
https://doi.org/10.1[...]
2024
[37]
논문
Modeling radiation injury-induced cell death and countermeasure drug responses in a human Gut-on-a-Chip
2018-02
[38]
논문
An open-access microfluidic model for lung-specific functional studies at an air-liquid interface
2009-10
[39]
논문
Reconstituting organ-level lung functions on a chip
2010-06
[40]
논문
Primary human coculture model of alveolo-capillary unit to study mechanisms of injury to peripheral lung
2009-04
[41]
논문
The area composita of adhering junctions connecting heart muscle cells of vertebrates. I. Molecular definition in intercalated disks of cardiomyocytes by immunoelectron microscopy of desmosomal proteins
2006-02
[42]
논문
Metabolic monitoring of the electrically stimulated single heart cell within a microfluidic platform
2006-11
[43]
논문
A microfluidic device to confine a single cardiac myocyte in a sub-nanoliter volume on planar microelectrodes for extracellular potential recordings
2004-08
[44]
논문
Ensembles of engineered cardiac tissues for physiological and pharmacological study: heart on a chip
2011-12
[45]
논문
Biohybrid thin films for measuring contractility in engineered cardiovascular muscle
2010-05
[46]
논문
Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities
2017-06
[47]
논문
Laminar ventricular myocardium on a microelectrode array-based chip
2016-05
[48]
논문
Ensembles of engineered cardiac tissues for physiological and pharmacological study: heart on a chip
2011-12
[49]
논문
Mussel-inspired 3D fiber scaffolds for heart-on-a-chip toxicity studies of engineered nanomaterials
2018-09
[50]
논문
Beating heart on a chip: a novel microfluidic platform to generate functional 3D cardiac microtissues
2016-02
[51]
논문
Human iPSC-based cardiac microphysiological system for drug screening applications
2015-03
[52]
논문
A 3D microfluidic platform incorporating methacrylated gelatin hydrogels to study physiological cardiovascular cell-cell interactions
2013-07
[53]
논문
A microfluidic platform for the high-throughput study of pathological cardiac hypertrophy
2017-09
[54]
논문
Cardiac Fibrotic Remodeling on a Chip with Dynamic Mechanical Stimulation
2019-02
[55]
논문
Heart-on-a-Chip Model with Integrated Extra- and Intracellular Bioelectronics for Monitoring Cardiac Electrophysiology under Acute Hypoxia
2020-04
[56]
논문
The future of personalized cardiovascular medicine demands 3D and 4D printing, stem cells, and artificial intelligence
2023
[57]
논문
A multi-layer microfluidic device for efficient culture and analysis of renal tubular cells
2010-01
[57]
간행물
Kidney on a chip
http://www.rsc.org/P[...]
2009-08-26
[58]
논문
The future of extracorporeal support
2008-04
[59]
논문
The future of the artificial kidney: moving towards wearable and miniaturized devices
2011
[60]
서적
Human Biology and Health
https://archive.org/[...]
1993
[61]
서적
Renal Physiology
Mosby Inc
2001
[62]
논문
Concept and computational design for a bioartificial nephron-on-a-chip
2008-06
[63]
논문
Engineering a 3D vascular network in hydrogel for mimicking a nephron
2013-04
[64]
서적
Vander's Renal Physiology
McGraw-Hill
2009
[65]
논문
The structure of the liver of vertebrates
1952
[66]
논문
Global challenges in liver disease
2006-09
[67]
논문
Liver-specific functional studies in a microfluidic array of primary mammalian hepatocytes
2006-07
[68]
논문
Liver sinusoid on a chip: Long-term layered co-culture of primary rat hepatocytes and endothelial cells in microfluidic platforms
https://digitalcommo[...]
2015-12
[69]
논문
Development of a biomimetic liver tumor-on-a-chip model based on decellularized liver matrix for toxicity testing
2018-11
[70]
서적
Technical Digest. IEEE International MEMS 99 Conference. Twelfth IEEE International Conference on Micro Electro Mechanical Systems (Cat. No.99CH36291)
1999-01
[71]
논문
Perfused multiwell plate for 3D liver tissue engineering
http://xlink.rsc.org[...]
2010
[72]
논문
A proof-of-concept study poised to remodel the drug development process
2022
[73]
논문
Performance assessment and economic analysis of a human Liver-Chip for predictive toxicology
2022-12-06
[74]
논문
Liver injury-on-a-chip: microfluidic co-cultures with integrated biosensors for monitoring liver cell signaling during injury
2015-12
[75]
학위논문
Development of a Microfluidic Model of a Human Prostate Gland for Cancer Research
https://repository.a[...]
The University of Arizona
2019
[76]
웹사이트
Key Statistics for Prostate Cancer: Prostate Cancer Facts
https://www.cancer.o[...]
American Cancer Society
2021-04-30
[77]
논문
Prostate organogenesis: tissue induction, hormonal regulation and cell type specification
2017-04
[78]
논문
Synthetic biomaterials as instructive extracellular microenvironments for morphogenesis in tissue engineering
2005-01
[79]
논문
Facile bench-top fabrication of enclosed circular microchannels provides 3D confined structure for growth of prostate epithelial cells
2014
[80]
논문
Modelling glandular epithelial cancers in three-dimensional cultures
2005-09
[81]
논문
Review of Prostate Anatomy and Embryology and the Etiology of Benign Prostatic Hyperplasia
2016-08
[82]
논문
Disruption of prostate epithelial differentiation pathways and prostate cancer development
2013-10
[83]
논문
Delayed versus immediate surgical intervention and prostate cancer outcome
2006-03
[84]
논문
Live-cell phenotypic-biomarker microfluidic assay for the risk stratification of cancer patients via machine learning
2018-10
[85]
논문
Replica molding for multilevel micro-/nanostructure replication.
2010-10
[86]
논문
Trends in prevalence, awareness, treatment, and control of hypertension in the United States, 1988-2000
2003-07
[87]
논문
A microfluidic platform for probing small artery structure and function
2010-09
[88]
서적
Cardiovascular Physiology Concepts
Lippincott, Williams & Wilkins
2011
[89]
서적
Human Anatomy & Physiology
2006
[90]
논문
Ebola Hemorrhagic Shock Syndrome-on-a-Chip
2020-01
[91]
논문
Lassa hemorrhagic shock syndrome-on-a-chip
2021-03
[92]
논문
Skin-on-a-chip model simulating inflammation, edema and drug-based treatment
2016-11
[93]
논문
Skin-on-a-Chip: Transepithelial Electrical Resistance and Extracellular Acidification Measurements through an Automated Air-Liquid Interface
2018-02
[94]
논문
Construction of 3D multicellular microfluidic chip for an in vitro skin model
2017-06
[95]
논문
Fabrication of a pumpless, microfluidic skin chip from different collagen sources
2017-12
[96]
논문
Full-thickness human skin-on-chip with enhanced epidermal morphogenesis and barrier function
2018-05
[97]
논문
Organ-On-Chip Platforms: Skin Diseases Modeling using Combined Tissue Engineering and Microfluidic Technologies (Adv. Healthcare Mater. 19/2016)
2016-10
[98]
논문
Characterization of microfluidic human epidermal keratinocyte culture
2008-03
[99]
논문
In vitro micro-physiological immune-competent model of the human skin
2016-05
[100]
논문
Skin and hair on-a-chip: in vitro skin models versus ex vivo tissue maintenance with dynamic perfusion
http://depositonce.t[...]
2013-09
[101]
논문
Three-dimensional microengineered vascularised endometrium-on-a-chip
2021-09
[102]
논문
Human-on-chip for therapy development and fundamental science
2014-02
[103]
논문
Incorporation of 3T3-L1 cells to mimic bioaccumulation in a microscale cell culture analog device for toxicity studies
2004
[104]
논문
Towards a human-on-chip: culturing multiple cell types on a chip with compartmentalized microenvironments
2009-11
[105]
논문
Bioengineered Pancreas–Liver Crosstalk in a Microfluidic Coculture Chip Identifies Human Metabolic Response Signatures in Prediabetic Hyperglycemia
2022-10-26
[106]
논문
Tissue models: a living system on a chip
2011-03
[107]
논문
Interconnected Microphysiological Systems for Quantitative Biology and Pharmacology Studies
2018-03-14
[108]
논문
Does animal experimentation inform human healthcare? Observations from a systematic review of international animal experiments on fluid resuscitation
2002-02
[109]
논문
Workshop meeting report Organs-on-Chips: human disease models
2013-09
[110]
웹사이트
FluoSphera - BIO International Convention {{!}} BIO
https://www.bio.org/[...]
2023-09-04
[111]
웹사이트
臓器環境を模して構築したチップ上の臓器
http://www.astem.or.[...]
2016-11-02
[112]
웹사이트
新学術領域研究 バイオアセンブラ
http://www.hs.ura.os[...]
2016-11-02
[113]
웹사이트
生体機能チップ(Organs-on-a-chip)
http://www.trendswat[...]
2016-11-02
[114]
웹사이트
Organs-On-A-Chip からだをチップで再構成
https://lne.st/2013/[...]
2016-11-02
[115]
웹인용
진짜 폐처럼 팔딱팔딱, 눈처럼 깜빡깜빡… ‘생체 칩’의 진화
http://news.donga.co[...]
[116]
논문
[117]
웹인용
Organs-on-a-Chip for Faster Drug Development
http://www.scientifi[...]
[118]
논문
[119]
논문
[120]
웹인용
동아사이언스 뉴스 '장기칩의 진화'
http://news.donga.co[...]
[121]
논문
[122]
웹인용
A HUMAN BLINKING ‘EYE-ON-A-CHIP’
http://www.rsc.org/i[...]
[123]
논문
[124]
논문
[125]
논문
[126]
논문
[127]
논문
[128]
웹인용
A HUMAN BLINKING ‘EYE-ON-A-CHIP’
http://www.rsc.org/i[...]
[129]
논문
[130]
웹인용
진짜 폐처럼 팔딱팔딱, 눈처럼 깜빡깜빡… ‘생체 칩’의 진화
http://news.donga.co[...]
[131]
논문
[132]
논문
[133]
웹인용
A HUMAN BLINKING ‘EYE-ON-A-CHIP’
http://www.rsc.org/i[...]
[134]
논문
[135]
논문
[136]
논문
[137]
논문
[138]
논문
[139]
논문
[140]
논문
[141]
웹인용
Organ-on-a-chip
https://en.wikipedia[...]
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com