겔 전기영동
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
겔 전기영동은 전기장을 이용하여 겔 매트릭스 내에서 분자를 크기 또는 전하에 따라 분리하는 기술이다. 아가로스 또는 폴리아크릴아마이드 겔을 사용하여 DNA, RNA, 단백질, 나노입자 등을 분리할 수 있다. 겔은 분자를 포함하고 분리하는 역할을 하며, 분리하려는 물질의 종류와 크기에 따라 아가로스 겔 또는 폴리아크릴아마이드 겔을 선택한다. 겔 전기영동은 분자생물학, 유전학, 법의학, 생화학, 단백질체학, 나노기술 등 다양한 분야에서 활용되며, 제한 효소 처리 후 DNA 분자 크기 추정, PCR 산물 분석, 블롯팅 전 핵산 분리 등에 사용된다.
더 읽어볼만한 페이지
- 전기영동 - SDS-폴리아크릴아마이드 젤 전기영동
SDS-폴리아크릴아마이드 젤 전기영동(SDS-PAGE)은 SDS로 음전하를 띠게 하고 변성된 단백질을 전기장 내에서 분자량에 따라 분리하는 기술로, 폴리아크릴아마이드 젤 농도 조절을 통해 다양한 크기의 단백질 분리에 사용되며, 단백질 분석 및 의료 진단에 응용된다. - 전기영동 - 변성 구배 젤 전기영동
변성 구배 젤 전기영동은 DNA 염기 서열 차이를 분리하는 분자 생물학 기술로, 변성제 농도 구배 젤을 사용하며 미생물 군집 분석 등에 활용된다. - 중합효소 연쇄 반응 - DNA 추출
DNA 추출은 세포에서 DNA를 분리하는 과정으로, 세포 용해, 세포 파편 제거, DNA 정제, 그리고 DNA를 완충용액에 보관하는 단계를 거쳐 이루어진다. - 중합효소 연쇄 반응 - 실시간 중합효소 연쇄 반응
실시간 중합효소 연쇄 반응은 증폭된 DNA를 실시간으로 측정하여 정량적으로 분석하는 기술로, 형광 염료나 탐침을 이용하여 PCR 주기에 따른 형광 신호를 측정하여 DNA 양을 정량화하며, 감염병 진단, 유전자 변형 생물체 검출, 유전자 발현량 측정 등 다양한 분야에 활용된다. - 단백질 기법 - 녹색 형광 단백질
녹색 형광 단백질(GFP)은 해파리에서 발견된 단백질로, 특정 파장의 빛을 흡수하여 녹색 형광을 방출하며, 자체 발색단 형성 능력과 유전자 조작을 통한 개량형 개발로 생물학 연구에서 리포터 유전자로 널리 사용되지만, 실험 결과 해석 시 주의가 필요하고 대체 기술 또한 개발 중이다. - 단백질 기법 - 크산토프로테인 반응
크산토프로테인 반응은 단백질 내 방향족 아미노산이 진한 질산에 의해 니트로화되어 황색으로 변하고, 알칼리성 조건에서 등황색으로 변하는 단백질 검출 및 정성 분석에 사용되는 반응이다.
| 겔 전기영동 | |
|---|---|
| 겔 전기영동 | |
 | |
| 일반 정보 | |
| 분류 | 전기영동 |
| 분석 대상 | 생체 분자 |
| 관련 기술 | 모세관 전기영동 SDS-PAGE 2차원 겔 전기영동 온도 구배 겔 전기영동 |
2. 원리
겔 전기영동은 전기장 내에서 하전된 분자가 겔 매트릭스를 통과하면서 크기와 전하에 따라 이동 속도가 달라지는 현상을 이용한다.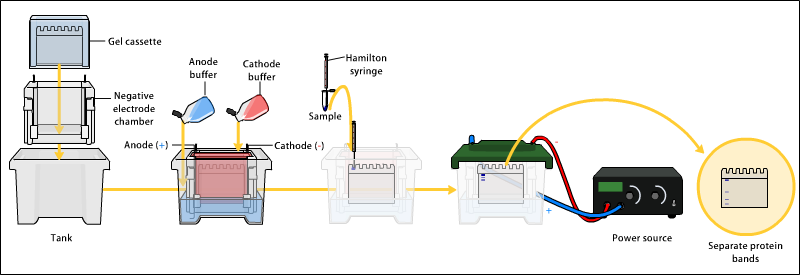
핵산의 경우, 음극에서 양극으로 이동하는 방향은 당-인산 주쇄가 갖는 자연적인 음전하 때문이다.[57] 이중나선 DNA 조각은 겔 내에서 크기에 비례하여 이동한다. 플라스미드와 같은 환상 DNA는 이완 또는 고차 코일 여부에 따라 이동 속도가 달라진다. 단일 가닥 DNA 또는 RNA는 복잡한 형태로 접혀 겔 내를 이동하므로, 수산화나트륨이나 포름아미드와 같은 수소 결합을 파괴하는 약제를 사용하여 핵산을 변성시킨다.[58]
단백질은 핵산과 달리 전하가 변하거나 모양이 복잡할 수 있다. 따라서 소듐 도데실 설페이트(SDS)와 같은 계면활성제를 사용하여 단백질을 변성시켜 음전하로 덮이게 한다.[37] 변성된 단백질은 크기에만 영향을 받아 겔 내에서 이동한다.[37]
2. 1. 전기영동
전기영동은 겔 매트릭스를 통해 분자를 이동시키는 기전력(EMF)을 이용하는 방법이다. 겔에 있는 웰(well)에 분자를 넣고 전기장을 가하면, 분자들은 전하 대 질량 비율 (Z)에 따라, 혹은 전하가 균일하지 않을 경우 전하에 따라 다른 속도로 매트릭스를 통해 이동한다.[40] 순 양전하를 띤 분자는 음극으로, 순 음전하를 띤 분자는 양극으로 이동한다. 이때, 질량은 분자가 매트릭스를 통해 이동하는 속도에 영향을 미치는 요인이다.[70]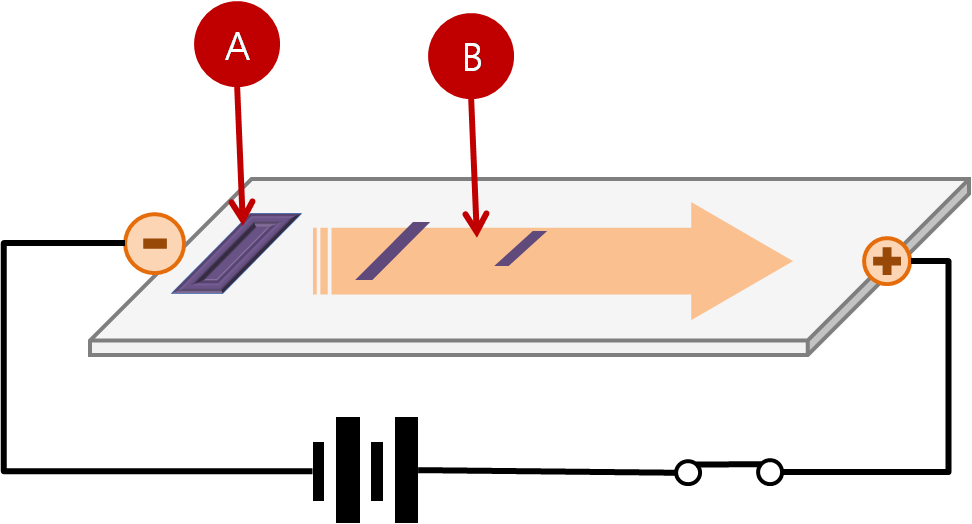
겔에 시료를 넣고 전류를 흘려보내면, DNA는 인산기 때문에 음전하를 띠므로 양극 쪽으로 끌려간다. 이때 겔은 다공성 물질이기 때문에, 작은 DNA 절편이 더 빨리 끌려가 DNA 절편은 크기에 따라 분리된다.[67]
여러 샘플을 겔의 인접한 웰에 로딩하면 개별 레인에서 병렬로 실행된다. 각 레인은 분자 수에 따라 하나 이상의 밴드를 형성한다. 불완전한 분리는 밴드 중첩 또는 구별 불가능한 얼룩으로 나타날 수 있다.[70] 상단에서 동일한 거리에 있는 다른 레인의 밴드에는 크기가 거의 같은 분자가 포함되어 있다. 알려진 크기의 분자 혼합물인 분자량 크기 마커를 사용하여 미지의 샘플의 크기를 결정할 수 있다.[7] 밴드가 이동하는 거리는 분자 크기의 로그에 대략 반비례한다.
전기영동 기술에는 한계가 있다. 전류를 흐르게 하면 겔이 가열되어 녹을 수 있다. 전기영동은 완충 용액에서 수행되지만, 너무 오래 실행하면 완충 용량이 소진될 수 있다. 또한, SDS-PAGE로 분자량을 결정하는 데에는 한계가 있으며, 특히 단백질 구조, 번역 후 변형 등은 전기영동 이동에 영향을 미칠 수 있다.[8]
2. 2. 겔의 역할
겔은 전기영동에서 분자를 포함하고 분리하는 데 사용되는 매트릭스 역할을 한다. 겔은 아가로스 또는 폴리아크릴아마이드로 만들어진다.[68] 겔은 분석 대상의 비중과 조성에 따라 조성과 다공성이 선택되는 가교 중합체이다.[69]
- '''아가로스 겔:''' 해조류에서 추출한 천연 다당류 중합체로 만들어진다. 겔 형성이 화학적 변화가 아닌 물리적 변화이기 때문에 제작 및 취급이 용이하며, 시료 회수도 간편하다.[72] 아가로스 겔은 기공 크기가 균일하지 않지만, 200kDa보다 큰 단백질이나 50 염기쌍에서 수 메가베이스(수백만 염기)에 이르는 DNA 단편 분리에 적합하다.[72]
- '''폴리아크릴아마이드 겔:''' 5~2,000 kDa 크기 범위의 단백질을 분리하는 데 사용되며, 균일한 기공 크기를 가진다. 아크릴아마이드 및 비스-아크릴아마이드 분말의 농도를 조절하여 기공 크기를 제어한다.[74] 아크릴아마이드는 신경독이므로 주의해야 한다.[69] 맥삼 길버트법 또는 생거법과 같은 DNA 시퀀싱 기술에 사용되어 단일 염기쌍 차이의 DNA 단편을 분리할 수 있다.[74]
일반적으로 큰 핵산(수백 염기 이상)을 분리할 때는 아가로스 겔이, 단백질 또는 작은 핵산(DNA, RNA, 올리고뉴클레오티드)을 분리할 때는 폴리아크릴아마이드 겔이 선호된다.[69]
3. 겔의 종류
겔 전기영동에 사용되는 겔은 분리 대상 물질의 종류와 크기에 따라 달라진다. 가장 일반적으로 사용되는 겔은 아가로스 겔과 폴리아크릴아마이드 겔이다.[9]
폴리아크릴아마이드 겔은 주로 단백질 분리에 사용되며, 5~500 bp(염기쌍) 크기의 작은 DNA 조각에 대해 매우 높은 분해능을 가진다. 반면 아가로스 겔은 DNA에 대한 분해능은 낮지만 분리 범위가 넓어, 50~20,000 bp 크기의 DNA 조각 분리에 주로 사용된다. 펄스 필드 겔 전기영동(PFGE)을 이용하면 6 Mb 이상의 DNA도 분해할 수 있다.[42]
폴리아크릴아마이드 겔은 수직으로, 아가로스 겔은 수평으로 전기영동을 진행하는 것이 일반적이다. 또한, 아가로스는 열을 가해 굳히는 반면, 폴리아크릴아마이드는 화학적 중합 반응을 통해 형성되므로 겔을 만드는 방법에도 차이가 있다.
부분적으로 가수분해된 감자 전분을 이용한 겔도 단백질 전기영동에 사용할 수 있다.[75]
3. 1. 아가로스 겔
아가로스 겔은 해조류에서 추출한 천연 다당류 중합체로 만들어진다. 아가로스 겔은 겔 형성이 화학적 변화가 아닌 물리적 변화이기 때문에 다른 매트릭스에 비해 쉽게 제작하고 취급할 수 있으며, 시료 또한 쉽게 회수할 수 있다. 실험이 끝난 후에는 생성된 겔을 비닐 봉투에 넣어 냉장고에 보관할 수 있다.아가로스 겔은 균일한 기공 크기를 갖고 있지는 않지만, 200 kDa보다 큰 단백질의 전기영동에 적합하다.[43] 아가로스 겔 전기영동은 50염기쌍부터 수 메가염기(수백만 염기)까지의 DNA 단편 분리에도 사용할 수 있으며,[11] 이 중 매우 큰 DNA 단편은 전용 장치가 필요하다. 길이가 다른 DNA 밴드 간의 거리는 겔 내 아가로스의 농도(%)에 영향을 받으며, 농도가 높을수록 더 오랜 시간이 걸리고, 경우에 따라서는 수일이 걸릴 수도 있다. 따라서 고농도 아가로스 겔은 펄스 필드 전기영동(PFE) 또는 전기장 역전 전기영동을 사용하여 실행해야 한다.
대부분의 아가로스 겔은 전기영동 완충액에 용해된 0.7%(5~10 kb의 큰 DNA 단편을 잘 분리하거나 해상도를 높이는 데 사용)에서 2%(0.2~1 kb의 작은 단편의 해상도를 높이는 데 사용)의 아가로스를 사용하여 만든다. 매우 작은 단편을 분리하기 위해서는 최대 3%까지 사용할 수 있지만, 이 경우에는 수직 폴리아크릴아미드 겔이 더 적합하다. 농도가 낮은 겔은 매우 약해서 들어 올리려고 하면 깨질 수 있다. 농도가 높은 겔은 종종 부서지기 쉽고 균일하게 굳지 않는다. 따라서 1% 겔은 많은 경우에 일반적으로 사용된다.[44]
3. 2. 폴리아크릴아마이드 겔
폴리아크릴아마이드 겔 전기 영동법(PAGE)은 균일한 기공 크기를 제공하여 5~2,000 kDa 크기의 단백질을 분리하는 데 사용된다. 겔의 기공 크기는 아크릴아마이드 및 비스-아크릴아마이드 분말의 농도를 조절하여 제어할 수 있다. 아크릴아마이드는 액체 및 분말 형태에서 강력한 신경독이므로, 겔을 만들 때 주의해야 한다.[69]맥삼 길버트법 또는 생어법과 같은 전통적인 DNA 시퀀싱 기술은 폴리아크릴아마이드 겔을 사용하여 길이가 단일 염기쌍으로 다른 DNA 단편을 분리하여 서열을 읽을 수 있었다.[74] 오늘날 대부분의 현대 DNA 분리 방법은 아가로스 겔을 사용한다.
폴리아크릴아마이드 겔은 현재 면역학 및 단백질 분석 분야에서 주로 사용되며, 서로 다른 단백질 또는 동일한 단백질의 아이소폼을 별도의 밴드로 분리하는 데 자주 사용된다. 분리된 단백질은 웨스턴 블롯과 같이 니트로셀룰로스 또는 PVDF 멤브레인으로 옮겨 항체 및 해당 마커로 탐침할 수 있다.[74]
일반적으로 분해 겔은 6%, 8%, 10%, 12% 또는 15%로 만들어지며, 그 위에 5% 농도의 스태킹 겔을 붓고 겔 빗을 삽입하여 웰과 레인을 형성한다. 겔의 백분율은 샘플에서 식별하거나 프로브하려는 단백질의 크기에 따라 결정된다. 알려진 분자량이 작을수록 더 높은 백분율을 사용해야 한다. 겔의 완충액 시스템을 변경하면 매우 작은 크기의 단백질을 추가로 분해하는 데 도움이 될 수 있다.[74]
3. 3. 녹말 겔
부분적으로 가수분해된 감자 전분은 단백질 전기영동을 위한 또 다른 무독성 배지이다. 겔은 아크릴아마이드나 아가로스보다 약간 더 불투명하다. 변성되지 않은 단백질은 전하와 크기에 따라 분리될 수 있다. 나프탈 블랙 또는 아미도 블랙 염색을 사용하여 시각화한다. 전형적인 전분 겔 농도는 5%에서 10%이다.[75][76][77]4. 과정
(섹션 제목 '과정'에 대한 내용은 원본 소스에 제공되지 않았으므로, 해당 섹션을 다루는 데 필요한 정보가 부족합니다. 따라서 이전 출력과 동일하게 빈칸으로 남겨둡니다.)
4. 1. 완충 용액 (버퍼)
겔 전기영동에서 완충 용액은 전류를 운반하는 이온을 제공하고 pH를 비교적 일정하게 유지하는 역할을 한다.[55] 이러한 완충 용액에는 전기가 통과하는 데 필요한 이온이 많이 포함되어 있다.[23]핵산 전기영동에는 주로 Tris/Acetate/EDTA (TAE)와 Tris/Borate/EDTA (TBE)가 사용된다.[24] TBE 완충 용액은 TAE 완충 용액보다 겔에서의 해상력이 좋아서, TAE는 주로 DNA 분자량이 큰 아가로스 겔 전기영동에 사용되고 TBE는 DNA 분자량이 작은 경우에 쓰이며 주로 DNA 시퀀싱을 할 때 사용한다.[71] 리튬 보레이트 (LB)와 같은 다른 완충 용액도 제안되었지만, 널리 사용되지는 않는다.[24] TAE는 완충 용량이 가장 낮지만 큰 DNA에 대해 최상의 분해능을 제공한다.[24]
단백질 전기영동에는 불연속 완충 시스템이 사용되기도 한다. 불연속 겔 시스템에서는 전기영동 초기 단계에서 이온 구배가 형성되어 모든 단백질이 하나의 날카로운 밴드에 집중된다. 크기에 따른 단백질 분리는 겔의 아래쪽 "분해" 영역에서 이루어진다.[24]
4. 2. 시각화
전기영동이 완료된 후, 겔 내의 분자들은 염색을 통해 눈으로 볼 수 있게 된다. DNA는 에티디움 브로마이드를 사용하여 시각화할 수 있는데, 이는 DNA에 삽입되면 자외선 아래에서 형광을 띈다.[67] 단백질은 은 염색이나 쿠마시브릴리언트블루 염료를 사용하여 시각화할 수 있다.[67]분리할 분자에 방사능이 포함된 경우 (예: DNA 시퀀싱 겔), 겔의 오토라디오그램을 기록하여 시각화할 수 있다. Gel Doc 시스템을 사용하여 겔 사진을 찍는 경우도 많다.[67]
4. 3. 하부 프로세싱
분리 후, 등전점 전기영동이나 SDS-PAGE와 같은 추가적인 분리 방법을 사용할 수 있다. 그런 다음 겔을 물리적으로 절단하고 각 부분에서 단백질 복합체를 개별적으로 추출한다. 각 추출물은 겔 내 소화 후 펩타이드 질량 지문 분석이나 새로운 펩타이드 시퀀싱과 같이 분석될 수 있다. 이것은 복합체에서 단백질의 정체성에 대한 많은 정보를 제공할 수 있다.[4]5. 겔의 상태
겔은 분석 대상 분자를 포함하고 분리하는 데 사용되는 매트릭스로, 대부분 가교 중합체이다. 겔의 조성과 다공성은 분석 대상의 비중과 조성에 따라 선택된다.[69] 단백질이나 작은 핵산(DNA, RNA, 올리고뉴클레오티드)을 분리할 때는 다양한 농도의 아크릴아마이드와 가교제를 사용하여 다양한 크기의 폴리아크릴아마이드 메쉬 네트워크를 생성한다. 큰 핵산(수백 염기 이상)을 분리할 때는 정제된 아가로스가 주로 사용된다. 아크릴아마이드는 신경독이므로 취급 시 주의해야 한다.[69] 아가로스는 가교가 없는 비하전 탄수화물의 긴 비분지 사슬로 구성되어 있어, 거대 분자와 거대 분자 복합체를 분리할 수 있는 큰 구멍을 가진 겔을 생성한다.[69]
겔은 변성 또는 천연 상태로 사용될 수 있다. 전기영동은 겔 매트릭스를 통해 분자를 이동시키는 데 사용되는 기전력(EMF)을 이용한다. 분자를 겔의 우물에 넣고 전기장을 가하면, 전하 대 질량 비율(Z)이 균일한 경우 질량에 따라, 전하가 균일하지 않은 경우 전하에 따라 분자가 다른 속도로 이동한다.[70]
5. 1. 변성 겔
핵산은 완충액에 요소를 포함시켜 변성시키는 경우가 많으며, 단백질은 도데실황산나트륨(SDS)을 사용하여 변성시킨다. SDS는 폴리아크릴아마이드 겔 전기영동(SDS-PAGE) 과정의 일부로 사용된다.[49] 단백질의 완전한 변성을 위해서는 단백질의 3차 구조 및 4차 구조를 안정화하는 공유 이황화 결합을 환원하는 것도 필요하며, 이 방법을 환원성 PAGE라고 한다. 환원 조건은 일반적으로 베타-머캅토에탄올 또는 디티오트레이톨을 첨가하여 유지된다.[49] 단백질 샘플의 일반적인 분석을 위해 환원성 PAGE가 가장 일반적인 단백질 전기영동 형태이다.변성 조건은 RNA의 분자량을 정확하게 추정하는 데 필요하다. RNA는 DNA보다 더 많은 분자내 상호작용을 형성할 수 있으므로 전기영동 이동성이 변할 수 있다.[49] RNA 구조를 파괴하기 위해 가장 자주 사용되는 변성제는 요소, 디메틸술폭사이드(DMSO) 및 글리옥살이다.[49] 원래는 독성이 강한 메틸수은 수산화물이 RNA 전기영동 변성에 자주 사용되었지만,[49] 일부 샘플의 경우 선택 방법일 수 있다.[50]
변성 겔 전기영동은 DNA 및 RNA 밴딩 패턴 기반 방법인 온도 구배 겔 전기영동(TGGE)[51] 및 변성제 농도 구배 겔 전기영동법(DGGE)에 사용된다.[52]
5. 2. 천연 겔
천연 겔 전기영동(Native gel electrophoresis영어)은 변성되지 않은 조건에서 수행되어 분석 대상의 자연 구조가 유지된다. 이를 통해 접힌 또는 조립된 단백질 복합체의 물리적 크기가 이동성에 영향을 미쳐 생체 분자 구조의 네 가지 수준 모두를 분석할 수 있다.[21][53] 생물학적 샘플의 경우, 세포의 지질 막을 용해하는 데 필요한 정도로만 세척제를 사용한다.[21][53] 세포에서와 마찬가지로 복합체는 대부분 연관되어 접힌 상태로 유지된다. 그러나 분자의 모양과 크기가 이동성에 어떻게 영향을 미칠지 예측하기 어렵기 때문에 복합체가 깨끗하거나 예측 가능하게 분리되지 않을 수 있다는 단점이 있다.[21][53]변성 방법과 달리, 천연 겔 전기영동은 하전된 변성제를 사용하지 않는다. 따라서 분리되는 분자(일반적으로 단백질 또는 핵산)는 분자량과 고유 전하뿐만 아니라 단면적도 다르므로 전체 구조의 모양에 따라 다른 전기영동력을 경험한다. 단백질의 경우, 네이티브 상태로 유지되므로 일반적인 단백질 염색 시약뿐만 아니라 특정 효소 결합 염색으로도 시각화할 수 있다.[21][53]
천연 겔 전기영동의 적용에 대한 특정 실험 예는 단백질 정제 중 샘플에 효소가 존재하는지 확인하기 위해 효소 활성을 확인하는 것이다. 예를 들어, 알칼리성 포스파타제 단백질의 경우, 염색 용액은 트리스 완충액에 4-클로로-2-2메틸벤젠디아조늄염과 3-포스포-2-나프토산-2'-4'-디메틸아닐린의 혼합물이다. 이 염색액은 겔 염색 키트로 시판되고 있다. 단백질이 존재하는 경우, 반응은 3-포스포-2-나프토산-2'-4'-디메틸아닐린의 탈인산화로 시작하여(반응에는 물이 필요) 인산기가 방출되고 물의 알코올기로 대체된다. 친전자체인 4-클로로-2-2메틸벤젠디아조늄(Fast Red TR Diazonium salt)이 알코올기를 치환하여 최종 생성물인 붉은 아조 염료를 형성한다. 이름에서 알 수 있듯이 이것은 반응의 최종 가시적 붉은색 생성물이다. 단백질 정제의 학부 실험에서는 일반적으로 결과를 시각화하고 정제가 성공적인지 여부를 결론짓기 위해 겔을 상업적으로 정제된 샘플 옆에 실행한다.[22][54]
네이티브 겔 전기영동은 일반적으로 프로테오믹스와 메탈로믹스에 사용된다. 그러나 네이티브 PAGE는 단일 가닥 입체 배좌 다형성과 같이 알려지지 않은 돌연변이를 검색하기 위해 유전자(DNA)를 스캔하는 데에도 사용된다.[22][54]
6. 응용
겔 전기영동은 법과학, 분자생물학, 유전학, 미생물학, 생화학 등 다양한 분야에서 널리 활용된다.
겔 전기영동은 다음과 같은 분야에서 활용된다.
- DNA 분자 크기 추정 및 제한 효소 지도 작성: 제한 효소 처리 후 DNA 분자 크기를 추정하여, 클로닝된 DNA의 제한 효소 지도를 작성할 수 있다.
- 중합효소 연쇄 반응(PCR) 산물 분석: PCR 산물을 분석하여, 분자 유전자 진단 또는 유전자 지문 분석을 수행할 수 있다.
- 서던 블롯 및 노던 블롯: 서던 블롯 전에 제한된 게놈 DNA를 분리하거나, 노던 블롯 전에 RNA를 분리할 수 있다.
겔 전기영동 결과는 일반적으로 자외선과 겔 이미징 장치를 사용하여 겔을 시각화하여 정량적으로 분석한다. 이미지는 컴퓨터 작동 카메라로 기록되며, 관심 대상인 밴드 또는 스팟의 강도를 측정하고, 이를 동일한 겔에 로딩된 표준 또는 마커와 비교한다. 이러한 측정 및 분석은 대부분 전문 소프트웨어를 사용하여 수행된다.[1]
수행되는 분석 유형에 따라 겔 전기영동 결과와 함께 다른 기술이 구현되어 다양한 분야별 응용 프로그램을 제공한다.
6. 1. 분자생물학 및 유전학
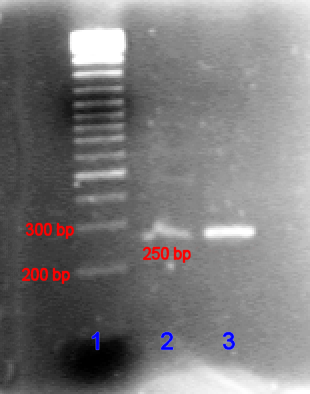
겔 전기영동은 분자생물학 및 유전학 분야에서 다음과 같은 목적으로 활용된다.
- 제한 효소 처리 후 DNA 분자 크기를 추정하여, 클로닝된 DNA의 제한 효소 지도를 작성할 수 있다.[44]
- 중합효소 연쇄 반응(PCR) 산물을 분석하여, 분자 유전자 진단 또는 유전자 지문 분석을 수행할 수 있다.[44]
- 서던 블롯 전에 제한된 게놈 DNA를 분리하거나, 노던 블롯 전에 RNA를 분리할 수 있다.[44]
핵산의 경우, 음극에서 양극으로 이동하는 방향은 핵산의 당-인산 골격에 자연적으로 존재하는 음전하 때문이다.[57] 이중 가닥 DNA 단편은 자연적으로 긴 막대 모양으로 행동하므로, 겔을 통한 이동은 크기에 따라 달라진다. 고리형 단편의 경우 회전 반지름에 따라 이동한다.[58] 그러나 플라스미드와 같은 환상 DNA는 여러 밴드를 보일 수 있으며, 이동 속도는 이완형인지 초나선형인지에 따라 달라질 수 있다. 단일 가닥 DNA 또는 RNA는 복잡한 모양의 분자로 접히는 경향이 있으며, 3차 구조에 따라 복잡한 방식으로 겔을 통과한다. 따라서 수산화나트륨이나 포름아미드와 같이 수소 결합을 파괴하는 시약을 사용하여 핵산을 변성시키고 다시 긴 막대 모양으로 행동하게 한다.[58]
큰 DNA 또는 RNA의 겔 전기영동은 일반적으로 아가로스 겔 전기영동으로 수행한다. RNA 샘플의 전기영동은 게놈 DNA 오염과 RNA 분해를 확인하는 데 사용할 수 있다. 진핵생물의 RNA는 28s 및 18s rRNA의 뚜렷한 밴드를 보이며, 28s 밴드는 18s 밴드보다 약 두 배 더 강하다. 분해된 RNA는 덜 선명하게 정의된 밴드를 가지며, 번짐이 나타나고, 강도 비율은 2:1보다 작다.
6. 2. 법의학
겔 전기영동은 법과학에서 DNA 프로파일링을 통해 범인을 식별하거나 친자 확인 등에 활용된다. 결과를 정량적으로 분석할 때에는 자외선과 겔 이미징 장치를 사용하여 겔을 시각화한다. 이미지는 컴퓨터 작동 카메라로 기록되며, 관심 대상인 밴드 또는 스팟의 강도를 측정하여 동일한 겔에 로딩된 표준 또는 마커와 비교한다. 측정 및 분석은 대부분 전문 소프트웨어를 사용하여 수행된다.[1]6. 3. 생화학 및 단백질체학
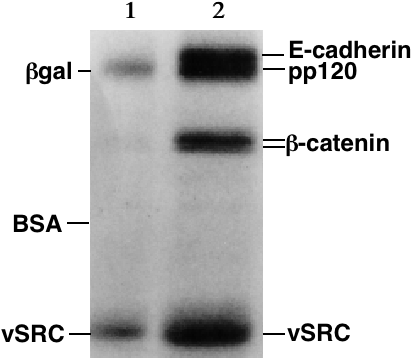
단백질은 핵산과 달리 전하가 다양하고 모양이 복잡하여, 폴리아크릴아마이드 겔에서 일정한 속도로 이동하지 않거나 아예 이동하지 않을 수 있다. 따라서 단백질은 일반적으로 소디움 도데실 설페이트(SDS)와 같은 계면활성제 존재 하에 변성되어 음전하를 띠게 된다.[3] 변성된 단백질은 3차 구조 대신 긴 막대 모양으로, SDS로 덮인 단백질이 겔에서 이동하는 속도는 크기에만 비례한다.[3]
단백질 분석에는 SDS-PAGE, 천연 겔 전기영동, 분취 전기영동(QPNC-PAGE), 2차원 전기영동 등이 사용된다.
리간드 상호작용을 통한 특성 분석은 전기블롯팅, 친화성 전기영동, 모세관 전기영동 등으로 수행될 수 있으며, 결합 상수 추정 및 렉틴 결합을 통한 글리칸 함량 등 구조적 특징 결정에 활용된다.
6. 4. 나노 기술
겔 전기영동은 금속 또는 금속 산화물 나노입자(Au, Ag, ZnO, SiO2 등)의 크기, 모양, 표면 화학적 특성에 따라 분리하거나 특성을 평가하는 데 사용될 수 있다.[27][59] 이는 보다 균질한 샘플(예: 더 좁은 입자 크기 분포)을 얻기 위함이며, 이렇게 얻어진 샘플은 추가적인 제품/공정(예: 자기 조립 공정)에 사용될 수 있다.[59] 겔 내에서 나노입자를 분리할 때 중요한 매개변수는 메시 크기에 대한 입자 크기의 비율이며, 다음 두 가지 이동 메커니즘이 확인되었다. 하나는 입자 크기가 메시 크기보다 훨씬 작은 경우의 무제한 메커니즘이고, 다른 하나는 입자 크기가 메시 크기와 비슷한 경우의 제한된 메커니즘이다.[28][59]7. 역사
겔 전기영동 기술은 1930년대 아르네 티셀리우스가 수크로스를 사용한 이동 경계 전기영동을 보고하면서 시작되었다.[15] 이후 1950년대에 "대역 전기영동"(티셀리우스)과 종이 전기영동이 도입되었다.
1955년에는 올리버 스미시스가 전분 겔을 도입하여 분리능을 향상시켰다.[15] 1959년에는 아크릴아마이드 겔이 도입되어 기공 크기와 안정성 등 매개변수를 정밀하게 제어할 수 있게 되었고, 불연속 전기영동(오른스타인과 데이비스) 기술이 개발되었다.[15] 레이몬드와 와인트라웁도 아크릴아마이드 겔을 도입하였다. 1965년에는 자유 유동 전기영동(하니그)이 도입되었다.
1966년에는 한천 겔이 처음으로 사용되었으며,[29] 1969년에는 SDS와 같은 변성제를 사용하여 단백질 소단위체를 분리하는 방법이 개발되었다(베버와 오스본).[30] 1970년에는 램리가 스태킹 겔과 SDS를 이용하여 T4 파지의 28가지 구성 요소를 분리하였다. 1972년에는 브로마이드 에티듐으로 염색된 아가로스 겔이 개발되었다.[31]
1975년에는 등전점 집중 후 SDS 겔 전기영동을 수행하는 2차원 겔 전기영동(오패럴)이 개발되었다.[15] 1977년에는 염기서열 분석에 겔이 사용되기 시작했다(생어).[15]
1981년에는 모세관 전기영동이 도입되었고((조겐슨과 루카스)),[15] 1983년에는 펄스 필드 겔 전기영동이 개발되어 큰 DNA 분자를 분리할 수 있게 되었다(슈워츠와 캔터).[15]
2004년에는 아크릴아마이드 겔 용액의 중합 시간을 표준화하여 겔 안정성을 최적화하는 방법이 도입되었다(겔 특성, 카스텐홀츠).[32]
밀란 비어의 1959년 저서에는 1800년대의 전기영동 관련 문헌이 인용되어 있지만,[33] 올리버 스미시스의 전분 겔 도입은 겔 전기영동 발전에 큰 공헌을 하였다.[33]
참조
[1]
논문
Yeast [PSI+] prion aggregates are formed by small Sup35 polymers fragmented by Hsp104.
[2]
서적
Molecular cloning : a laboratory manual
Cold Spring Harbor Laboratory Press
[3]
서적
Biochemistry
W.H. Freeman
[4]
서적
Wilson and Walker's principles and techniques of biochemistry and molecular biology
Cambridge University Press
[5]
서적
Modern experimental biochemistry
Benjamin Cummings
[6]
서적
Biochemical techniques : theory and practice
Waveland Press
[7]
논문
Agarose gel electrophoresis for the separation of DNA fragments.
[8]
웹사이트
Molecular Weight Determination by SDS-PAGE, Rev B
https://www.bio-rad.[...]
2022-03-23
[9]
서적
Molecular Cloning - A Laboratory Manual
Cold Spring Harbor Laboratory
[10]
논문
Agarose gel electrophoresis of high molecular weight, synthetic polyelectrolytes
American Chemical Society (ACS)
[11]
논문
Agarose gel electrophoresis
https://pubmed.ncbi.[...]
2023-03-01
[12]
웹사이트
Agarose gel electrophoresis (basic method)
http://www.methodboo[...]
2022-03-23
[13]
논문
Tricine-SDS-PAGE.
https://pubmed.ncbi.[...]
2022-03-23
[14]
서적
Electrophoresis of Proteins in Polyacrylamide and Starch Gels: Laboratory Techniques in Biochemistry and Molecular Biology
North-Holland Pub. Co
[15]
논문
Zone electrophoresis in starch gels: group variations in the serum proteins of normal human adults.
[16]
논문
A thin-layer starch gel method for enzyme typing of bloodstains.
https://pubmed.ncbi.[...]
2022-03-23
[17]
논문
Synthesis of full length cDNAs from four partially purified oviduct mRNAs.
[18]
논문
Enhanced full-length transcription of Sindbis virus RNA by effective denaturation with methylmercury hydroxide.
https://pubmed.ncbi.[...]
2022-03-23
[19]
논문
Statistical analysis of denaturing gel electrophoresis (DGE) fingerprinting patterns.
https://pubmed.ncbi.[...]
2022-03-23
[20]
논문
Length-independent separation of DNA restriction fragments in two-dimensional gel electrophoresis.
https://pubmed.ncbi.[...]
2022-03-23
[21]
논문
Detection of glucose-6-phosphate dehydrogenase in malarial parasites.
https://pubmed.ncbi.[...]
2022-03-23
[22]
서적
Fundamental Approaches to Biochemistry and Biotechnology
Fitzgerald Science Press
[23]
서적
fundamental laboratory approaches for biochemistry and biotechnology
Wiley
[24]
논문
History and principles of conductive media for standard DNA electrophoresis.
https://pubmed.ncbi.[...]
2022-03-23
[25]
서적
Molecular Cell Biology
https://archive.org/[...]
WH Freeman
[26]
간행물
Troubleshooting DNA agarose gel electrophoresis
[27]
논문
Separation of Nanoparticles by Gel Electrophoresis According to Size and Shape
https://pubs.acs.org[...]
[28]
논문
Restricted and Unrestricted Migration Mechanisms of Silica Nanoparticles in Agarose Gels and Their Utilization for the Separation of Binary Mixtures
American Chemical Society (ACS)
2020-02-12
[29]
논문
Electrophoretic separation of polyoma virus DNA from host cell DNA.
https://pubmed.ncbi.[...]
2022-03-23
[30]
논문
The reliability of molecular weight determinations by dodecyl sulfate-polyacrylamide gel electrophoresis.
[31]
논문
The gel electrophoresis of DNA.
https://pubmed.ncbi.[...]
2022-03-23
[32]
서적
Electrophoresis Fundamentals: Essential Theory and Practice
https://www.degruyte[...]
De Gruyter
[33]
서적
Electrophoresis: theory, methods, and applications
Academic Press
[34]
논문
Determining Biophysical Protein Stability in Lysates by a Fast Proteolysis Assay, FASTpp
Public Library of Science (PLoS)
2012-10-03
[35]
논문
Yeast [PSI+] prion aggregates are formed by small Sup35 polymers fragmented by Hsp104
[36]
서적
Molecular Cloning: A Laboratory Manual 3rd Ed.
Cold Spring Harbor Laboratory Press
[37]
서적
Biochemistry
https://www.ncbi.nlm[...]
WH Freeman
[38]
서적
Wilson and Walker's Principles and Techniques of Biochemistry and Molecular Biology.
Cambridge University Press
2018-04-19
[39]
서적
Modern Experimental Biochemistry
Pearson
2000-08-20
[40]
서적
Biochemical Techniques Theory and Practice
Waveland Press
[41]
웹사이트
Molecular Weight Determination by SDS-PAGE
http://www.bio-rad.c[...]
2021-06-19
[42]
서적
Molecular Cloning - A Laboratory Manual
[43]
학술지
Agarose gel electrophoresis of high molecular weight, synthetic polyelectrolytes
[44]
웹사이트
Agarose gel electrophoresis (basic method)
http://www.methodboo[...]
2011-08-23
[45]
학술지
Tricine–SDS-PAGE
[46]
서적
Electrophoresis of proteins in polyacrylamide and starch gels
American Elsevier Publishing Company, Inc
[47]
학술지
Zone electrophoresis in starch gels: group variations in the serum proteins of normal adults
[48]
학술지
A thin-layer starch gel method for enzyme typing of bloodstains
[49]
학술지
Synthesis of full length cDNAs from four partially purified oviduct mRNAs.
1978-04-10
[50]
학술지
Enhanced full-length transcription of Sindbis virus RNA by effective denaturation with methylmercury hydroxide.
1989-05
[51]
학술지
Statistical analysis of denaturing gel electrophoresis (DGE) fingerprinting patterns
http://doc.rero.ch/r[...]
2002-11
[52]
학술지
Length-independent separation of DNA restriction fragments in two-dimensional gel electrophoresis
1979-01
[53]
학술지
Detection of glucose-6-phosphate dehydrogenase in malarial parasites
[54]
서적
Fundamental Approaches to Biochemistry and Biotechnology
Fitzgerald Science Press
[55]
서적
fundamental laboratory approaches for biochemistry and biotechnology
Wiley
[56]
학술지
History and principles of conductive media for standard DNA electrophoresis
http://www.cc.ahs.ch[...]
2004-10
[57]
서적
Molecular Cell Biology
https://archive.org/[...]
WH Freeman
[58]
간행물
Troubleshooting DNA agarose gel electrophoresis
[59]
학술지
Restricted and Unrestricted Migration Mechanisms of Silica Nanoparticles in Agarose Gels and Their Utilization for the Separation of Binary Mixtures
https://pubs.acs.org[...]
[60]
학술지
Electrophoretic separation of polyoma virus DNA from host cell DNA
[61]
학술지
The reliability of molecular weight determinations by dodecyl sulfate-polyacrylamide gel electrophoresis
[62]
학술지
The gel electrophoresis of DNA
[63]
학술지
Preparative native continuous polyacrylamide gel electrophoresis (PNC‐PAGE): an efficient method for isolating cadmium cofactors in biological systems
[64]
서적
Electrophoresis. Theory, Methods and Applications
Academic Press
[65]
학술지
Determining biophysical protein stability in lysates by a fast proteolysis assay, FASTpp
[66]
서적
Biochemistry
http://www.ncbi.nlm.[...]
WH Freeman
[67]
서적
생명 생물의 과학
교보문고
[68]
서적
Wilson and Walker's Principles and Techniques of Biochemistry and Molecular Biology
Cambridge University Press
2018-04-19
[69]
서적
Modern Experimental Biochemistry
Pearson
2000-08-20
[70]
서적
Biochemical Techniques Theory and Practice
Waveland Press
[71]
pdf
http://local.koreasc[...]
[72]
저널
Agarose gel electrophoresis of high molecular weight, synthetic polyelectrolytes
https://pubs.acs.org[...]
1989-05
[73]
웹인용
Agarose gel electrophoresis (basic method)
http://www.methodboo[...]
2022-02-11
[74]
저널
Tricine–SDS-PAGE
http://www.nature.co[...]
2006-06
[75]
서적
Electrophoresis of proteins in polyacrylamide and starch gels
American Elsevier Publishing Company, Inc.
1975
[76]
저널
Zone electrophoresis in starch gels: group variations in the serum proteins of normal human adults
https://portlandpres[...]
1955-12-01
[77]
저널
A Thin-layer Starch Gel Method for Enzyme Typing of Bloodstains
https://linkinghub.e[...]
1968-10
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com