아민
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
아민은 암모니아의 수소 원자가 유기기로 치환된 유기 화합물로, 치환기의 종류와 수에 따라 1차, 2차, 3차 아민으로 분류된다. 지방족 아민과 방향족 아민으로 구분되며, 고리형 아민과 4차 암모늄 양이온도 존재한다. 아민은 명명법에 따라 접두사 "아미노-" 또는 접미사 "-아민"을 사용하며, 수소 결합으로 인해 끓는점과 용해도가 영향을 받는다. 아민은 친핵성과 염기성을 가지며, 알킬화, 아실화, 다이아조화 반응 등 다양한 화학 반응을 한다. 생물학적으로 중요한 아민은 아미노산, 신경전달물질, 호르몬 등에 관여하며, 염료, 의약품, 가스 처리, 에폭시 수지 경화제 등 다양한 산업 분야에서 활용된다. 저분자량 아민은 피부 자극을 유발할 수 있으며, 다양한 생물학적 활성을 나타내므로 안전에 유의해야 한다.
더 읽어볼만한 페이지
- 아민 - 암로디핀
암로디핀은 디히드로피리딘계 칼슘 채널 차단제로, 고혈압과 협심증 치료에 사용되며 혈관을 이완시켜 혈압을 낮추고 심근으로의 산소 공급을 증가시키지만, 말초 부종이나 현기증 등의 부작용이 있을 수 있고 특정 질환에서는 사용이 금지된다. - 아민 - 케타민
케타민은 NMDA 수용체 길항제로 작용하여 진통, 마취, 항우울 효과를 나타내지만, 정신과적 부작용, 남용 가능성, 장기 사용 시 독성 위험으로 인해 엄격히 규제되는 아릴시클로헥실아민 유도체이다. - 작용기 - 황화물
황화물은 황이 다른 원소와 결합한 화합물로, 금속 황화물, 황화광물, 유기 황화물 등 다양한 형태로 존재하며 반도체 특성, 안료, 촉매 등으로 활용되지만 부식성과 유해성을 지니기도 한다. - 작용기 - 에스터
에스터는 옥소산의 수산화기에서 수소 원자가 유기 원자단으로 치환된 화합물로, 카복실산 에스터가 대표적이며, 자연계에 널리 분포하고 향료 및 향수 산업에 사용되며 폴리에스터와 같은 중합체에서도 발견된다. - 화학에 관한 - 칼륨
칼륨은 은백색의 무른 알칼리 금속으로 반응성이 매우 높고 생물학적으로 중요한 전해질이며, 비료 생산을 비롯한 다양한 산업 분야에서 활용되지만 물과의 격렬한 반응 및 폭발성 과산화물 생성 가능성으로 취급 시 주의가 필요하며, 자연계에 세 가지 동위원소로 존재한다. - 화학에 관한 - 파울리 배타 원리
파울리 배타 원리는 1925년 볼프강 파울리가 제시한 양자역학 원리로, 동일한 페르미온은 동일한 양자 상태에 존재할 수 없으며, 원자의 전자 배치, 화학 결합, 천체 특성 등을 설명하는 데 중요한 역할을 한다.
| 아민 | |
|---|---|
| 아민 | |
 | |
| 유형 | 화합물 |
| 일반식 | RNH2, R2NH, R3N |
| 작용기 | 아미노기 |
| 관련 물질 | 암모니아, 아마이드, 나이트릴 |
| 명명법 | |
| IUPAC 명명법 | 알케인 + 아민 |
| 일반적인 성질 | |
| 분자량 | 17.03 g/mol (암모니아) |
| 밀도 | 0.73 kg/m³ (액체 암모니아) |
| 녹는점 | -77.73 °C (액체 암모니아) |
| 끓는점 | -33.34 °C (액체 암모니아) |
| 산도 (pKa) | 38 (암모니아) |
| 화학적 성질 | |
| 염기 | 약염기 |
| 반응 | 알킬 할로젠화물과 반응하여 4차 암모늄염을 형성 |
| 구조 | |
| 질소 원자 | 질소 원자는 비공유 전자쌍을 가짐 |
| 결합 | 질소 원자는 다른 원자와 3개의 결합을 형성 |
| 합성 | |
| 할로알케인 | 할로알케인과 암모니아 반응 |
| 나이트로 화합물 | 나이트로 화합물의 환원 |
| 아미드 | 아미드의 환원 |
| 이용 | |
| 용도 | 다양한 화학 물질 합성의 중간체, 의약품, 염료, 섬유 등 |
| 의약품 | 아드레날린, 메스암페타민 등 |
| 염료 | 아조 염료 |
| 안전 | |
| 유해성 | 독성 및 자극성 |
| 관련 화학 | |
| 아미노산 | 단백질의 구성 요소 |
| 신경전달물질 | 도파민, 세로토닌, 노르에피네프린 등 |
2. 아민의 분류
아민은 질소 원자에 결합된 유기 치환기(알킬기, 아릴기)의 수와 종류에 따라 분류된다. 질소에 결합된 치환기의 연결성에 따른 네 번째 하위 범주는 고리형 아민이다. 고리형 아민은 2차 또는 3차 아민이다. 고리형 아민의 예로는 3원 고리 아지리딘과 6원 고리 피페리딘이 있다. ''N''-메틸피페리딘과 ''N''-페닐피페리딘은 고리형 3차 아민의 예이다.[5][6]
2. 1. 1차, 2차, 3차 아민
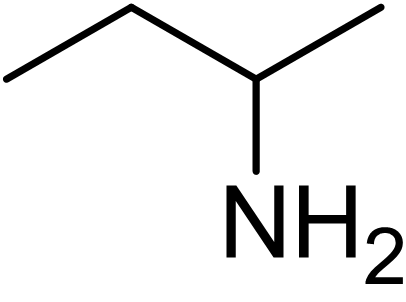
아민은 질소에 치환된 치환기의 성질과 개수에 따라 분류될 수 있다. 지방족 아민은 수소(H)와 알킬 치환기만 포함한다. 방향족 아민은 질소 원자가 방향족 고리에 연결되어 있다.| 1차(1°) 아민 | 2차(2°) 아민 | 3차(3°) 아민 |
|---|---|---|
 |  |  |
알킬 및 아릴 아민 모두 질소에 인접한 탄소 원자의 수(즉, 암모니아 분자의 수소 원자 중 몇 개가 탄화수소기로 치환되었는지)에 따라 세 가지 하위 범주로 분류된다.[5][6]
- 1차(1°) 아민: 암모니아의 수소 원자 하나가 알킬기 또는 방향족기로 치환된 것이다. 주요 1차 알킬 아민에는 메틸아민, 대부분의 아미노산, 완충제인 트리스(2-아미노-2-(하이드록시메틸)-1,3-프로판다이올)가 있으며, 1차 방향족 아민에는 아닐린이 있다.
- 2차(2°) 아민: 질소에 수소 원자 하나와 두 개의 유기 치환기(알킬기, 아릴기 또는 둘 다)가 결합된 것이다. 주요 예시로는 디메틸아민이 있으며, 방향족 아민의 예로는 디페닐아민이 있다.
- 3차(3°) 아민: 질소에 세 개의 유기 치환기가 결합된 것이다. 예로는 독특한 생선 냄새가 나는 트리메틸아민과 EDTA가 있다.
질소에 네 개의 유기 치환기가 있는 경우도 있지만, 이러한 종은 아민이 아니고 4차 암모늄 양이온이며, 전하를 띤 질소 중심을 갖는다. 4차 암모늄 염은 여러 종류의 음이온과 함께 존재한다.
암모니아, 1차 아민 또는 2차 아민에서 수소를 제거한 1가의 작용기(-NH₂,-NHR,-NRR')를 아미노기라고 한다. 방향족 고리에 치환되면 전자 주개기로서의 성질을 나타낸다.
질소 원자에 결합된 알킬기의 수에 따라 아민을 다음과 같이 표기한다.
- CH3NH2|메틸아민영어
- (CH3)2NH|디메틸아민영어
- (CH3)3N|트리메틸아민영어
2. 2. 지방족 아민과 방향족 아민
아민은 질소에 치환된 치환기의 성질과 개수에 따라 분류될 수 있다. '''지방족 아민'''은 수소(H)와 알킬 치환기만 포함한다. '''방향족 아민'''은 질소 원자가 방향족 고리에 연결되어 있다.알킬 및 아릴 아민 모두 질소에 인접한 탄소 원자의 수(즉, 암모니아 분자의 몇 개의 수소 원자가 탄화수소기로 치환되었는지)에 따라 세 가지 하위 범주로 분류된다.[5][6]
| 1차(1°) 아민 | 2차(2°) 아민 | 3차(3°) 아민 |
|---|---|---|
- '''1차(1°) 아민'''—암모니아의 세 개의 수소 원자 중 하나가 알킬기 또는 방향족기로 치환될 때 1차 아민이 생성된다. 중요한 1차 알킬 아민에는 메틸아민, 대부분의 아미노산, 및 완충제인 트리스(2-아미노-2-(하이드록시메틸)-1,3-프로판다이올)가 포함되며, 1차 방향족 아민에는 아닐린이 포함된다.
- '''2차(2°) 아민'''—2차 아민은 질소에 하나의 수소 원자와 함께 두 개의 유기 치환기(알킬기, 아릴기 또는 둘 다)가 결합되어 있다. 중요한 예로는 디메틸아민이 있으며, 방향족 아민의 예로는 디페닐아민이 있다.
- '''3차(3°) 아민'''—3차 아민에서 질소는 세 개의 유기 치환기를 가지고 있다. 예로는 독특한 생선 냄새가 나는 트리메틸아민과 EDTA가 있다.
네 번째 하위 범주는 질소에 결합된 치환기의 연결성에 따라 결정된다.
- '''고리형 아민'''—고리형 아민은 2차 또는 3차 아민이다. 고리형 아민의 예로는 3원 고리 아지리딘과 6원 고리 피페리딘이 있다. ''N''-메틸피페리딘과 ''N''-페닐피페리딘은 고리형 3차 아민의 예이다.
질소에 네 개의 유기 치환기가 있는 경우도 있다. 이러한 종은 아민이 아니지만 4차 암모늄 양이온이며, 전하를 띤 질소 중심을 갖는다. 4차 암모늄 염은 여러 종류의 음이온과 함께 존재한다.
2. 3. 고리형 아민
고리형 아민은 질소 원자가 고리 구조의 일부를 이루는 아민이다. 2차 또는 3차 아민이 될 수 있다.고리형 아민의 예는 다음과 같다.
| 5원자 고리 | 6원자 고리 | 기타 |
|---|---|---|
아민은 다양한 방법으로 명명된다. 일반적으로 화합물에는 접두사 "아미노-" 또는 접미사 "-아민"이 붙는다. 접두사 "''N''-"은 질소 원자의 치환을 나타낸다. 아미노기가 여러 개 있는 유기 화합물은 디아민, 트리아민, 테트라아민 등으로 불린다.
3. 아민의 명명법
하위 섹션에서 다루는 IUPAC 명명법, 관용명 외에 다른 명명법은 다음과 같다.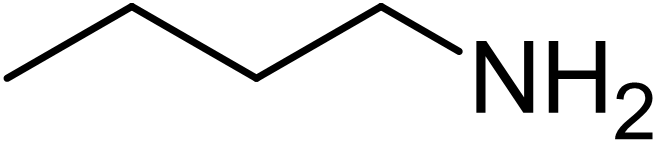
3. 1. IUPAC 명명법
아민은 일반적으로 화합물에 접두사 "아미노-" 또는 접미사 "-아민"을 붙여 명명한다. 접두사 "''N''-"은 질소 원자의 치환을 나타낸다. 아미노기가 여러 개 있는 유기 화합물은 디아민, 트리아민, 테트라아민 등으로 불린다.
IUPAC 명명법은 다음과 같다.
다음은 명명법의 예시이다.
| IUPAC 명명법 | 다른 표현 |
|---|---|
| 메틸아잔 | 메탄아민, 메틸아민, 아미노메탄, 아자에탄 |
| 디메틸(프로판-2-일)아잔 | N,N-디메틸프로판-2-아민, 디메틸(프로판-2-일)아민, 2-(디메틸아미노)프로판, 2,3-디메틸-2-아자부탄 |
또한, 아닐린, 톨루이딘, 벤지딘과 같이 허용 관용명이 인정되고 있는 화합물도 있다.
3. 2. 관용명
일부 아민은 관용명이 널리 사용된다.3. 3. 기타 명명법
간단한 아민은 알킬기 이름에 "-아민" 접미사를 붙여 명명한다. 부탄-1-아민 그림은 다음과 같다.[7]4. 아민의 물리적 성질
아민은 수소 결합을 통해 1차 및 2차 아민의 성질에 큰 영향을 미친다. 액체 아민은 "생선 비린내"와 같은 불쾌한 냄새를 낸다.
질소 원자는 암모늄 이온 R3NH+를 형성할 수 있는 고립 전자쌍을 가지고 있다. 단순 아민의 물에 대한 용해도는 이러한 고립 전자쌍이 관여하는 수소 결합에 의해 향상된다.
일반적인 아민의 질소 원자는 피라미드형 구조를 취한다. 이 때문에 세 가지 다른 치환기가 붙은 아민은 언뜻 광학 활성이 될 것 같이 보이지만, 실제로는 질소가 반전을 일으키기 쉬우므로, 특수한 경우를 제외하고는 카이랄성을 가지지 않는다. 하지만, 1991년에 처음으로 합성된 트리이소프로필아민은 이소프로필기의 크기 때문에 평면 구조를 취하는 것이 밝혀져 있다.[33]
4. 1. 끓는점과 녹는점
수소 결합은 1차 아민과 2차 아민의 성질에 큰 영향을 미친다. 예를 들어, 메틸아민과 에틸아민은 표준 조건에서 기체이지만, 메틸알코올과 에틸알코올은 액체이다. 1차 및 2차 아민은 수소 결합으로 인해 비슷한 분자량을 가진 알케인보다 끓는점이 높다. 반면 3차 아민은 수소 결합을 형성할 수 없어 끓는점이 상대적으로 낮다. 아닐린과 같은 방향족 아민은 고립 전자쌍이 벤젠 고리에 공액되어 있기 때문에 수소 결합에 참여하는 경향이 감소하여 끓는점이 높다.[33]4. 2. 용해도
수소 결합은 단순 아민의 물에 대한 용해도를 향상시킨다. 일반적으로 암모늄 화합물의 염은 물에 대한 용해도가 다음과 같은 순서를 따른다: 1차 암모늄 (RNH3+) > 2차 암모늄 (R2NH2+) > 3차 암모늄 (R3NH+). 작은 지방족 아민은 많은 용매에 상당한 용해도를 보이는 반면, 큰 치환기를 가진 아민은 친유성이다. 아닐린과 같은 방향족 아민은 고립 전자쌍이 벤젠 고리에 공액되어 있기 때문에 수소 결합에 참여하는 경향이 감소한다. 이들의 끓는점은 높고 물에 대한 용해도는 낮다.[33]4. 3. 냄새
저분자량 아민은 암모니아와 유사한 자극적인 냄새를 갖는다. 액체 아민은 생선 비린내와 유사한 불쾌한 냄새를 낸다.[36][34]4. 4. 분광학적 특성
아민의 존재는 일반적으로 질량 분석법뿐만 아니라 NMR 및 IR 분광법을 포함한 여러 기술의 조합으로 추론된다.; NMR 분광법
: 아민의 1H NMR 신호는 시료를 D2O로 처리하면 사라진다.[5]
; IR 분광법
: 적외선 스펙트럼에서 1차 아민은 두 개의 N-H 띠를 나타내는 반면, 2차 아민은 하나의 띠만 나타낸다.[5] IR 스펙트럼에서 1차 및 2차 아민은 약 3300 cm−1 근처에서 독특한 N-H 신축 띠를 나타낸다.[8] 프로필아민의 경우, H-N-H 가위 모드는 약 1600 cm−1 근처에, C-N 신축은 약 1000 cm−1 근처에, R2N-H 굽힘은 약 810 cm−1 근처에 나타난다.[8]
5. 아민의 구조
아민은 질소 원자에 결합된 치환기의 수와 종류에 따라 구조가 달라진다. 크게 알킬 아민과 방향족 아민으로 나눌 수 있다.
알킬 아민에서 질소 원자는 sp3 혼성 오비탈을 가지며, 사면체 구조를 이룬다. C-N-C 결합각과 C-N-H 결합각은 약 109°로 이상적인 사면체 각도에 가깝다. C-N 결합 길이는 C-C 결합 길이보다 약간 짧다. 질소 원자의 비공유 전자쌍은 빠른 반전(inversion)을 겪는데, 이는 강한 바람에 우산이 뒤집히는 것에 비유할 수 있다. 이러한 반전에 필요한 에너지 장벽은 트리알킬아민의 경우 약 7kcal/mol이다. NHRR' 형태의 아민은 카이랄하지만, 낮은 에너지 장벽 때문에 광학 이성질체를 분리하기 어렵다. 반면, NRR′R″ 형태의 삼차 아민은 R, R', R″기가 아지리딘과 같은 고리 구조로 제한될 때 카이랄성을 유지하여 광학 이성질체를 분리할 수 있다. (4차 암모늄염은 분리 가능하다.)[33]
방향족 아민 (아닐린)은 질소 원자의 비공유 전자쌍이 아릴 고리와 공명하여 질소 원자가 거의 평면 구조를 가진다.[9] 이에 따라 C-N 결합 길이가 알킬 아민보다 짧으며, 아닐린의 경우 C-N 결합 길이가 C-C 결합 길이와 같다.[9]
5. 1. 알킬 아민
알킬 아민은 특징적으로 사면체 질소 중심을 가진다. C-N-C 및 C-N-H 각도는 이상적인 109° 각도에 가깝다. C-N 거리는 C-C 거리보다 약간 짧다. 입체 중심의 질소 반전에 대한 에너지 장벽은 트리알킬아민의 경우 약 7kcal/mol이다. 이러한 상호 변환은 강한 바람 속에서 열린 우산이 뒤집히는 것에 비유된다.
NHRR' 및 NRR′R″형 아민은 카이랄하다. 비공유 전자쌍을 포함하여 질소 중심에는 네 개의 치환체가 있다. 반전에 대한 장벽이 낮기 때문에 NHRR'형 아민은 광학 순도로 얻을 수 없다. 카이랄 삼차 아민 NRR′R″은 R, R', R″기가 ''N''-치환 아지리딘과 같은 고리 구조로 제한될 때만 분리할 수 있다(4차 암모늄염은 분리 가능하다).[33]
5. 2. 방향족 아민
방향족 아민(아닐린)에서 질소는 비공유 전자쌍과 아릴 치환기의 공명으로 인해 거의 평면에 가깝다.[9] C-N 결합 길이는 따라서 더 짧다. 아닐린에서 C-N 결합 길이는 C-C 결합 길이와 같다.[9]6. 아민의 염기성
일반적인 아민의 질소 원자는 피라미드형 구조를 띤다. 이 때문에 세 가지 다른 치환기가 붙은 아민은 언뜻 광학 활성이 될 것처럼 보이지만, 실제로는 질소가 반전을 일으키기 쉬워 특수한 경우를 제외하고는 카이랄성을 가지지 않는다. 하지만, 1991년에 처음으로 합성된 트리이소프로필아민은 이소프로필기의 크기 때문에 평면 구조를 띠는 것으로 밝혀졌다.[33]
자연계의 아민류는 미생물에 의한 발효·부패 생성물[36][34]과 양조주[35]에 흔히 존재한다. 히스타민, 티라민, 페네틸아민 등 몇몇 물질은 알레르기 유사 증상, 고혈압, 편두통 등의 생리 작용을 일으키는 것으로 알려져 있다.[34]
6. 1. 염기성의 정의
암모니아와 마찬가지로 아민은 염기이다.[10] 알칼리 금속 수산화물에 비해 아민은 더 약하다.아민의 염기성은 다음에 따라 달라진다.
- 치환기의 전자적 특성 (알킬기는 염기성을 증가시키고, 아릴기는 감소시킨다).
- 양성자화된 아민의 용매화 정도. 여기에는 질소 원자에 결합된 기에 의한 입체 장애가 포함된다.
아민은 염기성을 가지며, 프로톤(수소 양이온)이 배위 결합한다. 이는 질소 원자가 비공유 전자쌍을 가지기 때문이다. 아민의 염기성의 세기는 질소 원자에 결합하고 있는 알킬기와 밀접한 관계가 있다. 탄소 수가 같은 경우, 2차 아민은 1차 아민보다 염기성이 강하다. 이것은 알킬기가 가지는 전자 공여성에 의해 질소 원자가 음으로 분극되기 때문이다. 하지만, 3차 아민은 2차 아민보다 염기성이 작다. 이것은 알킬기가 3개 존재함으로써 입체 장애를 가져오기 때문이다. 또한, 일반적으로 방향족 고리에 직접 연결된 아민은 염기성이 낮다. 이것은 방향족 탄화수소가 가져오는 비편재화 때문이다.
6. 2. 염기성에 영향을 미치는 요인
아민의 염기성은 다음 요인에 의해 영향을 받는다.[13]- 전자 효과:
- 알킬기는 전자를 밀어내는 효과(유도 효과)가 있어 염기성을 증가시킨다.
- 아릴기는 전자를 끌어당기는 효과가 있어 염기성을 감소시킨다.
- 용매화 효과:
- 양성자화된 아민의 용매화 정도는 염기성에 영향을 미친다.
- 질소 원자에 결합된 기에 의한 입체 장애는 용매화를 방해하여 염기성을 감소시킬 수 있다.
- 방향족 아민의 염기성:
- 아닐린과 같이 방향족 고리에 직접 결합된 아민은 질소 원자의 비공유 전자쌍이 고리로 비편재화되어 염기성이 감소한다.
- 방향족 고리에 있는 치환기와 아미노기에 대한 치환기의 위치도 염기성에 영향을 미친다.
유도 효과만 고려하면 아민의 염기성은 알킬기의 수가 증가함에 따라 증가할 것으로 예상할 수 있다. 하지만 용매화 효과는 유도 효과와 반대 경향을 나타내므로, 실제로는 복잡한 상관관계를 보인다.
DMSO, DMF, 아세토니트릴과 같은 비양성자성 극성 용매에서는 용매화 에너지가 낮아, 아민의 염기성이 주로 전자 효과에 의해 결정된다.
다음은 알킬아민 및 아닐린의 pKa 값이다.[11][12]
| 알킬아민 또는 아닐린 | 양성자화된 아민의 pKa |
|---|---|
| 메틸아민 (MeNH2) | 10.62 |
| 디메틸아민 (Me2NH) | 10.64 |
| 트리메틸아민 (Me3N) | 9.76 |
| 에틸아민 (EtNH2) | 10.63 |
| 아닐린 (PhNH2) | 4.62 |
| 4-메톡시 아닐린 (4-MeOC6H4NH2) | 5.36 |
| N,N-디메틸아닐린 (PhNMe2) | 5.07 |
| 3-니트로아닐린 (3-NO2-C6H4NH2) | 2.46 |
| 4-니트로아닐린 (4-NO2-C6H4NH2) | 1.00 |
| 4-트리플루오로메틸아닐린 (CF3C6H4NH2) | 2.75 |
6. 3. 기체상 염기성 vs. 수용액 염기성
암모니아와 마찬가지로 아민은 염기이다.[10] 아민의 염기성은 다음 요인에 따라 달라진다.# 치환기의 전자적 특성 (알킬기는 염기성을 증가시키고, 아릴기는 감소시킨다).
# 양성자화된 아민의 용매화 정도. 여기에는 질소 원자에 결합된 기에 의한 입체 장애가 포함된다.
용매화는 아민의 염기성에 큰 영향을 미친다. N-H기는 물, 특히 암모늄 이온과 강하게 상호작용한다. 결과적으로 암모니아의 염기성은 용매화에 의해 1011배 증가한다.
아민의 본질적인 염기성은 용매화가 중요하지 않은 기체상에서 평가할 수 있다. 기체상에서 아민은 유기 치환기의 전자 방출 효과에 따라 염기성 세기가 결정된다. 따라서 3차 아민이 2차 아민보다, 2차 아민이 1차 아민보다 더 염기성이 강하고, 암모니아가 가장 염기성이 약하다. 그러나 물에서의 염기성(pKb 값) 순서는 이 순서를 따르지 않는다. 마찬가지로 아닐린은 기체상에서 암모니아보다 염기성이 강하지만, 수용액에서는 만 배나 약하다.[13]
DMSO, DMF, 아세토니트릴과 같은 비양성자성 극성 용매에서는 물이나 메탄올과 같은 양성자성 극성 용매에서처럼 용매화 에너지가 높지 않다. 따라서 이러한 비양성자성 용매에서 아민의 염기성은 거의 전적으로 전자 효과에 의해 결정된다.
아민은 질소 원자가 비공유 전자쌍을 가지기 때문에 염기성을 띠며, 프로톤(수소 양이온)과 배위 결합한다. 아민의 염기성 세기는 질소 원자에 결합하고 있는 알킬기와 밀접한 관계가 있다. 탄소 수가 같은 경우, 알킬기가 가지는 전자 공여성 때문에 질소 원자가 음으로 분극되어 2차 아민이 1차 아민보다 염기성이 강하다. 하지만, 3차 아민은 알킬기가 3개 존재함으로써 입체 장애를 일으켜 2차 아민보다 염기성이 작다. 또한, 일반적으로 방향족 고리에 직접 연결된 아민은 방향족 탄화수소가 가져오는 비편재화 때문에 염기성이 낮다.
다음은 몇 가지 알킬아민과 아닐린의 양성자화된 아민의 pKa 값을 나타낸 표이다.[11][12]
| 알킬아민 또는 아닐린 | 양성자화된 아민의 pKa |
|---|---|
| 메틸아민 (MeNH2) | 10.62 |
| 디메틸아민 (Me2NH) | 10.64 |
| 트리메틸아민 (Me3N) | 9.76 |
| 에틸아민 (EtNH2) | 10.63 |
| 아닐린 (PhNH2) | 4.62 |
| 4-메톡시 아닐린 (4-MeOC6H4NH2) | 5.36 |
| N,N-디메틸아닐린 (PhNMe2) | 5.07 |
| 3-니트로아닐린 (3-NO2-C6H4NH2) | 2.46 |
| 4-니트로아닐린 (4-NO2-C6H4NH2) | 1.00 |
| 4-트리플루오로메틸아닐린 (CF3C6H4NH2) | 2.75 |
7. 아민의 합성
산업적으로 중요한 알킬아민은 알코올을 암모니아와 반응시켜 제조한다.[14]
:
할로젠화 알킬과 암모니아 또는 아민의 반응은 1차, 2차, 3차 아민 및 4차 암모늄염의 혼합물을 생성할 수 있다.[14] 이러한 반응은 알킬 요오다이드와 브로마이드에 더 유용하지만, 알킬화 정도를 제어하기 어렵다는 단점이 있다.
:
가브리엘 합성은 프탈이미드칼륨을 사용하여 1차 아민을 선택적으로 합성하는 방법이다. 델레핀 반응 또한 1차 아민 합성에 사용되는 방법 중 하나이다. 아릴 할라이드는 아민과의 반응성이 낮아, 부흐발트-하트윅 반응과 같은 팔라듐 촉매 반응을 통해 아릴 아민을 제조한다.
알켄과 아민의 반응으로 아민을 생성하는 반응을 알켄의 하이드로아미네이션이라고 하며, 제올라이트 기반의 고체산 촉매가 사용된다.[14]
수소화 과정을 통해, 불포화 질소(N) 함유 작용기는 니켈 촉매 존재 하에 수소를 사용하여 아민으로 환원된다. 적합한 작용기에는 니트릴, 아지드, 이민(옥심 포함), 아마이드 및 니트로가 포함된다.[1] 니트릴의 경우, 반응은 산성 또는 알칼리성 조건에 민감하여 시안(CN)기의 가수분해를 일으킬 수 있다.[1] 실험실 규모에서는 이와 같은 작용기의 환원에 LiAlH4이 더 일반적으로 사용된다.[1]
많은 아민은 환원성 아미노화를 통해 알데하이드와 케톤으로부터 생성되는데, 이는 촉매적으로 또는 화학량론적으로 진행될 수 있다.[1] 아닐린(C6H5NH2) 및 그 유도체는 니트로 방향족 화합물의 환원에 의해 제조된다.[1] 산업적으로는 수소가 바람직한 환원제인 반면, 실험실에서는 주석과 철이 종종 사용된다.[1]
아민은 니트로기, 아지드, 아미드, 이민, 옥심, 니트릴, 아조 화합물 등의 환원에 의해서도 얻을 수 있다.[2] 수소화 알루미늄 리튬(LAH), 팔라듐 촉매-수소계 등이 사용된다.[2]
환원적 아미노화 등의 방법에 의하면, 알데하이드나 케톤으로부터, 이민을 거쳐 원팟(one-pot)으로 아민을 얻을 수 있다.[2] 산성 조건 하, 시안화 붕소 나트륨(NaBH3CN)이나 피리딘-보란 착체 등을 사용하여 환원하는 것이 보통이다.[2] 이 형식의 명명 반응으로는 뢰카르트 반응, 에슈바이러-클라크 반응의 예가 있다.[2]
기타 합성법은 다음과 같다.
| 반응명 | 기질 | 설명 |
|---|---|---|
| 슈타우딩거 환원 | 유기 아지드 | 수소화알루미늄리튬과 같은 환원제를 사용하기도 한다. |
| 슈미트 반응 | 카르복시산 | |
| 아자-베일리스-힐만 반응 | 이민 | 알릴 아민 합성 |
| 버치 환원 | 이민 | 니트릴과의 그리냐르 반응과 같이 불안정한 이민 중간체를 포획하는 반응에 유용하다.[15] |
| 호프만 분해 | 아마이드 | 1차 아민의 제조에만 유효하며, 다른 아민으로 오염되지 않은 1차 아민을 좋은 수율로 제공한다. |
| 호프만 제거 | 4차 암모늄염 | 강염기로 처리 |
| 로이카르트 반응 | 케톤과 알데하이드 | 이민 중간체를 거쳐 개미산과 암모니아를 이용한 환원적 아미노화 |
| 호프만-뢰플러 반응 | 할로아민 | |
| 에슈바일러-클라크 반응 | 아민 | 이민 중간체를 거쳐 개미산과 포름알데히드를 이용한 환원적 아미노화 |
아미드는 이민, 이소시아네이트 등을 가수분해하면 얻을 수 있다. 이소시아네이트는 호프만 전위, 쿠르티우스 전위 등의 생성물이므로, 이러한 반응을 수용액계에서 수행한 경우 생성물로서 아민을 얻게 된다.
아민을 생성물로 하는 인명반응으로는 위에 언급한 것 외에 로센 전위, 슈미트 전위, 좀머-하우저 전위, 스티븐스 전위, 반베르거 전위 등의 전위 반응이나, 만니히 반응, 스트레커 반응, 치치바빈 반응 등의 친핵성 반응이 있다.
7. 1. 알코올의 아미노화
산업적으로 중요한 알킬아민은 알코올을 암모니아와 반응시켜 제조한다.[14]:
7. 2. 할로젠화 알킬(아릴)과의 치환 반응
할로젠화 알킬과 암모니아 또는 아민의 반응은 1차, 2차, 3차 아민 및 4차 암모늄염의 혼합물을 생성할 수 있다.[14] 이러한 반응은 알킬 요오다이드와 브로마이드에 더 유용하지만, 알킬화 정도를 제어하기 어렵다는 단점이 있다.:
가브리엘 합성은 프탈이미드칼륨을 사용하여 1차 아민을 선택적으로 합성하는 방법이다. 델레핀 반응 또한 1차 아민 합성에 사용되는 방법 중 하나이다.
한편, 아릴 할라이드는 아민과의 반응성이 낮아, 부흐발트-하트윅 반응과 같은 팔라듐 촉매 반응을 통해 아릴 아민을 제조한다.
7. 3. 알켄의 하이드로아미네이션
알켄과 아민의 반응으로 아민을 생성하는 반응이다. 제올라이트 기반의 고체산 촉매가 사용된다.[14]7. 4. 환원 반응
수소화 과정을 통해, 불포화 질소(N) 함유 작용기는 니켈 촉매 존재 하에 수소를 사용하여 아민으로 환원된다. 적합한 작용기에는 니트릴, 아지드, 이민(옥심 포함), 아마이드 및 니트로가 포함된다.[1] 니트릴의 경우, 반응은 산성 또는 알칼리성 조건에 민감하여 CN|시안영어기의 가수분해를 일으킬 수 있다.[1] 실험실 규모에서는 이와 같은 작용기의 환원에 LiAlH4이 더 일반적으로 사용된다.[1]많은 아민은 환원성 아미노화를 통해 알데하이드와 케톤으로부터 생성되는데, 이는 촉매적으로 또는 화학량론적으로 진행될 수 있다.[1]
아닐린(C6H5NH2) 및 그 유도체는 니트로 방향족 화합물의 환원에 의해 제조된다.[1] 산업적으로는 수소가 바람직한 환원제인 반면, 실험실에서는 주석과 철이 종종 사용된다.[1]
아민은 니트로기, 아지드, 아미드, 이민, 옥심, 니트릴, 아조 화합물 등의 환원에 의해서도 얻을 수 있다.[2] 수소화 알루미늄 리튬(LAH), 팔라듐 촉매-수소계 등이 사용된다.[2]
환원적 아미노화 등의 방법에 의하면, 알데하이드나 케톤으로부터, 이민을 거쳐 원팟(one-pot)으로 아민을 얻을 수 있다.[2] 산성 조건 하, 시안화 붕소 나트륨(NaBH3CN)이나 피리딘-보란 착체 등을 사용하여 환원하는 것이 보통이다.[2] 이 형식의 명명 반응으로는 뢰카르트 반응, 에슈바이러-클라크 반응의 예가 있다.[2]
7. 5. 기타 합성법
슈타우딩거 환원은 유기 아지드를 수소화알루미늄리튬과 같은 환원제를 사용하여 아민을 생성한다.[15] 슈미트 반응은 카르복시산을 이용해 아민을 생성한다. 아자-베일리스-힐만 반응은 이민을 이용하여 알릴 아민을 합성한다. 버치 환원은 이민을 환원시키는데, 니트릴과의 그리냐르 반응과 같이 불안정한 이민 중간체를 포획하는 반응에 유용하다.[15] 호프만 분해는 아마이드를 이용하여 1차 아민을 좋은 수율로 제조하는 방법이다. 이 반응은 다른 아민으로 오염되지 않은 순수한 1차 아민을 얻을 수 있다는 장점이 있다. 호프만 제거는 4차 암모늄염을 강염기로 처리하여 아민을 생성한다. 로이카르트 반응은 케톤과 알데하이드를 이민 중간체를 거쳐 개미산과 암모니아를 이용한 환원적 아미노화 반응이다. 호프만-뢰플러 반응은 할로아민을 이용한다. 에슈바일러-클라크 반응은 아민을 이민 중간체를 거쳐 개미산과 포름알데히드를 이용한 환원적 아미노화 반응이다.| 반응명 | 기질 | 설명 |
|---|---|---|
| 슈타우딩거 환원 | 유기 아지드 | 수소화알루미늄리튬과 같은 환원제를 사용하기도 한다. |
| 슈미트 반응 | 카르복시산 | |
| 아자-베일리스-힐만 반응 | 이민 | 알릴 아민 합성 |
| 버치 환원 | 이민 | 니트릴과의 그리냐르 반응과 같이 불안정한 이민 중간체를 포획하는 반응에 유용하다.[15] |
| 호프만 분해 | 아마이드 | 1차 아민의 제조에만 유효하며, 다른 아민으로 오염되지 않은 1차 아민을 좋은 수율로 제공한다. |
| 호프만 제거 | 4차 암모늄염 | 강염기로 처리 |
| 로이카르트 반응 | 케톤과 알데하이드 | 이민 중간체를 거쳐 개미산과 암모니아를 이용한 환원적 아미노화 |
| 호프만-뢰플러 반응 | 할로아민 | |
| 에슈바일러-클라크 반응 | 아민 | 이민 중간체를 거쳐 개미산과 포름알데히드를 이용한 환원적 아미노화 |
아미드는 이민, 이소시아네이트 등을 가수분해하면 얻을 수 있다. 이소시아네이트는 호프만 전위, 쿠르티우스 전위 등의 생성물이므로, 이러한 반응을 수용액계에서 수행한 경우 생성물로서 아민을 얻게 된다.
아민을 생성물로 하는 인명반응으로는 위에 언급한 것 외에 로센 전위, 슈미트 전위, 좀머-하우저 전위, 스티븐스 전위, 반베르거 전위 등의 전위 반응이나, 만니히 반응, 스트레커 반응, 치치바빈 반응 등의 친핵성 반응이 있다.
8. 아민의 반응
아민의 주요 반응은 질소 원자의 친핵성과 염기성에 기반한다. 아민과 관련된 주요 반응들은 다음과 같이 정리할 수 있다.
| 반응명 | 생성물 | 시약 | 주석 |
|---|---|---|---|
| 아민 알킬화 | 아민 | 치환 정도 증가 | |
| 쇼텐-바우만 반응 | 아마이드 | 아실 클로라이드, 산 무수물 | |
| 힌스버그 반응 | 술폰아마이드 | 술포닐 클로라이드 | |
| 아민-카르보닐 축합 | 이민 | ||
| 유기 산화 | 니트로소 화합물 | 과과산화황산 | |
| 유기 산화 | 다이아조늄염 | 아질산 | |
| 진케 반응 | 진케 알데하이드 | 피리디늄 염 | 1차 및 2차 아민과 함께 |
| 엠데 분해 | 3차 아민 | 4차 암모늄 양이온의 환원 | |
| 호프만-마르티우스 재배열 | 아릴 치환 아닐린 | ||
| 폰 브라운 반응 | 유기 시아나마이드 | 시아노겐 브로마이드를 사용 | 3차 아민만 해당 |
| 호프만 제거 반응 | 알켄 | 덜 방해받는 탄소의 β-제거에 의해 진행 | |
| 코프 반응 | 알켄 | 호프만 제거 반응과 유사 | |
| 카르빌아민 반응 | 이소니트릴 | 1차 아민만 해당 | |
| 호프만 머스타드 오일 테스트 | 이소티오시아네이트 | 이황화탄소와 염화제이수은 사용 | 티오시아네이트는 겨자 냄새가 난다. |
1차 및 2차 아민은 카르복실산 할로겐화물 및 카르복실산 무수물과 축합하여 아마이드를 생성하며, DCC와 같은 적절한 탈수제나 탈수 반응에 의해 카르복실산과 반응시켜 아마이드를 생성할 수도 있다.
2차, 3차 아민은 산화은 등의 존재하에 호프만 제거 반응을 일으켜 1차 저급 아민과 알켄이 된다. 이 반응에서는 호프만 규칙이라는 위치 선택성 규칙이 작용한다.
이 외에도 아민을 이용하는 반응으로는 우기 반응, 스토크 에나민 합성 등이 있으며, 아민을 생성물로 하는 인명반응으로는 로센 전위, 슈미트 전위, 좀머-하우저 전위, 스티븐스 전위, 반베르거 전위 등의 전위 반응이나, 만니히 반응, 스트레커 반응, 치치바빈 반응 등의 친핵성 반응이 있다.
8. 1. 알킬화, 아실화, 술폰화
아민은 할로젠화 알킬과 반응하여 알킬화된다.[16] 1차 및 2차 아민은 아실 클로라이드와 산 무수물에 의해 쇼텐-바우만 반응을 통해 아마이드를 형성한다.[16]
아민이 설포닐 클로라이드와 반응하면 설폰아마이드를 얻는데, 이 변환은 힌스버그 반응으로 알려져 있으며 아민의 존재를 확인하는 화학적 검정법이다.[16]
8. 2. 다이아조화 반응
1차 아민은 아질산 또는 아질산 에스터와 반응하여 다이아조늄 이온을 생성한다. 이는 잔트마이어 반응이나 시먼 반응 등 친핵성 치환 반응의 기질이 된다.[17] 아민은 아질산과 반응하여 다이아조늄염을 생성하는데, 알킬 다이아조늄염은 매우 불안정하다. 아닐린(페닐아민)과 같은 방향족 아민의 다이아조늄 유도체는 더 안정적이며, 결정형으로 분리될 수 있다.[17]다이아조늄염은 질소 기를 음이온으로 치환하는 다양한 변환을 거친다. 예를 들어, 시안화제일구리는 해당하는 니트릴을 생성한다. 아릴다이아조늄은 페놀과 같은 전자 풍부한 방향족 화합물과 결합하여 아조 화합물을 형성하는데, 이 반응은 염료 생산에 널리 적용된다.[18]
8. 3. 이민 형성
1차 아민은 케톤 및 알데하이드와 반응하여 이민을 형성한다. 포름알데하이드(R' = H)의 경우, 이러한 생성물은 일반적으로 고리형 삼량체로 존재한다.[19]:RNH2 + R'2C=O → R'2C=NR + H2O
이러한 이민의 환원은 2차 아민을 생성한다.[19]
:R'2C=NR + H2 → R'2CH-NHR
마찬가지로, 2차 아민은 케톤과 알데하이드와 반응하여 에나민을 형성한다.[19]
:R2NH + R'(R''CH2)C=O → R''CH=C(NR2)R' + H2O
1차 아민은 알데히드나 케톤과 축합하여 이민으로 변한다.[19]
8. 4. 에나민 형성
2차 아민은 알데하이드나 케톤과 반응하여 에나민을 형성한다.[19]:
8. 5. 산화 반응
아민은 산화되어 하이드록실아민, 옥심, 나이트로소 화합물, 나이트로 화합물이 된다.[1]8. 6. 기타 반응
1차 아민은 클로로포름과 강염기 조건에서 반응시켜 아이소나이트릴(R-NC)을 생성하는 카르빌아민 반응을 일으킨다. 아민과 이황화탄소, 염화수은(II)의 반응을 이용한 호프만 머스타드 오일 테스트도 알려져 있다. 이 외에도 아민을 이용하는 반응으로는 우기 반응, 스토크 에나민 합성 등이 있다.9. 아민의 생물학적 활성
아민은 생물학적으로 매우 흔하게 발견된다. 아미노산이 분해되면서 아민이 방출되는데, 썩은 생선에서 나는 트리메틸아민 냄새가 그 예시이다. 에피네프린, 노르에피네프린, 도파민, 세로토닌, 히스타민과 같은 다양한 신경전달물질들이 아민에 속한다. 양성자화된 아미노기는 단백질, 특히 아미노산 라이신에서 가장 흔하게 발견되는 양전하를 띤 부분이다.[20] 음이온을 띠는 고분자인 DNA는 주로 아민이 풍부한 단백질과 결합한다.[21] 라이신의 말단에 있는 양전하를 띤 1차 암모늄은 폴리펩타이드 내 다른 아미노산의 카르복실산염기와 염다리를 형성하며, 이는 단백질의 3차원 구조를 결정하는 데 중요한 역할을 한다.[22]
9. 1. 아미노산과 단백질
아미노산의 분해는 아민을 방출하는데, 썩은 생선의 트리메틸아민 냄새가 대표적인 예이다. 에피네프린, 노르에피네프린, 도파민, 세로토닌, 히스타민을 포함한 많은 신경전달물질이 아민이다. 양성자화된 아미노기()는 단백질에서, 특히 아미노산 라이신에서 가장 흔한 양전하 부분이다.[20] 음이온 고분자인 DNA는 일반적으로 다양한 아민이 풍부한 단백질에 결합되어 있다.[21] 또한, 라이신의 말단 양전하를 띤 1차 암모늄은 폴리펩타이드 내 다른 아미노산의 카르복실산염기와 염다리를 형성하는데, 이는 단백질의 3차원 구조에 주요 영향을 미치는 요인 중 하나이다.[22]9. 2. 신경전달물질
많은 신경전달물질이 아민 계열에 속한다. 여기에는 에피네프린, 노르에피네프린, 도파민, 세로토닌, 히스타민이 포함된다.[20]9. 3. 아민 호르몬
아미노산의 변형으로부터 유래된 호르몬을 아민 호르몬이라고 한다. 일반적으로 아미노산의 원래 구조는 –COOH(카르복실기)가 제거되고 –NH₃⁺(아민기)는 남도록 변형된다. 아민 호르몬은 아미노산인 트립토판 또는 티로신으로부터 합성된다.[23]10. 아민의 응용
아민은 다양한 분야에서 응용된다.
아민은 아조 염료 제조의 원료로 사용될 수 있으며, 의약품의 주요 성분으로도 활용된다. 예를 들어, 클로르페니라민은 알레르기 질환 완화에, 클로르프로마진은 진정 효과를 위해 사용된다. 또한, 에페드린과 페닐에프린은 충혈 제거제로 사용되며, 암페타민, 메탐페타민 등은 정신 자극제로 분류된다.
천연가스 및 정유 공정에서는 이산화탄소와 황화수소를 제거하는 데 아민 수용액이 사용되며, 온실가스를 줄이는 데에도 활용될 수 있다. 더불어, 아민은 에폭시 수지 경화제로 자주 사용된다.
10. 1. 염료
1차 방향족 아민은 아조 염료 제조의 원료로 사용된다. 아질산과 반응하여 디아조늄염을 형성하며, 이는 커플링 반응을 거쳐 아조 화합물을 생성한다. 아조 화합물은 색이 매우 진하기 때문에 염색 산업에서 널리 사용된다. 예를 들어 다음과 같은 염료가 있다.- 메틸오렌지
- 직접 갈색 138
- 황색 5호(Sunset Yellow FCF)
- 폰소
10. 2. 의약품
대부분의 약물과 약물 후보 물질은 아민 작용기를 포함하고 있다.[24]- 클로르페니라민은 항히스타민제의 일종으로, 감기, 건초열, 가려운 피부, 벌레 물림 및 쏘임 등으로 인한 알레르기 질환 완화에 사용된다.
- 클로르프로마진은 수면 유도 없이 진정 효과를 내는 진정제로, 불안, 흥분, 불안감 또는 정신 질환 완화에 사용된다.
- 에페드린과 페닐에프린은 아민 염산염 형태로, 충혈 제거제로 사용된다.
- 암페타민, 메탐페타민, 메스카티논은 미국 마약단속국(DEA)에서 통제 물질로 분류하는 정신 자극제 아민이다.
- 티오리다진은 항정신병 약물의 일종으로, 아민의 작용을 통해 항정신병 효과를 나타내는 것으로 알려져 있다.[25]
- 아미트립틸린, 이미프라민, 로페프라민, 클로미프라민은 삼환계 항우울제이며 3차 아민이다.
- 노르트립틸린, 데시프라민, 아목사핀은 삼환계 항우울제이며 2차 아민이다. (삼환계 항우울제는 측쇄의 최종 아미노기의 특성에 따라 분류된다.)
- 치환 트립타민과 치환 페네틸아민은 다양한 환각성 약물의 주요 기본 구조이다.
- 모르핀, 코데인, 헤로인과 같은 아편성 진통제는 3차 아민이다.
10. 3. 가스 처리
모노에탄올아민(MEA), 디글리콜아민(DGA), 디에탄올아민(DEA), 디이소프로판올아민(DIPA), 메틸디에탄올아민(MDEA) 수용액은 천연가스 및 정유 공정에서 이산화탄소(CO₂)와 황화수소(H₂S)를 제거하는 데 널리 사용된다.[26] 이들은 연소가스 및 배가스에서 CO₂를 제거하고 온실가스를 줄이는 데에도 사용될 수 있다.[26] 관련된 공정은 정제로 알려져 있다.[26]10. 4. 에폭시 수지 경화제
아민은 에폭시 수지 경화제로 자주 사용된다.[27][28] 여기에는 디메틸에틸아민, 시클로헥실아민 및 4,4-디아미노디시클로헥실메탄과 같은 다양한 디아민이 포함된다.[14] 테트라에틸렌펜타민 및 트리에틸렌테트라민과 같은 다기능 아민도 이 용도로 널리 사용된다.[29] 이 반응은 아민 질소의 비공유 전자쌍이 에폭시 수지의 옥시란 고리의 가장 바깥쪽 탄소를 공격하는 과정으로 진행된다. 이는 에폭사이드의 고리 긴장을 완화시키며 반응의 원동력이 된다.[30] 3차 아민 작용기를 가진 분자는 종종 에폭시-아민 경화 반응을 가속화하는 데 사용되며, 2,4,6-트리스(디메틸아미노메틸)페놀과 같은 물질이 포함된다. 이것은 2성분 에폭시 수지 시스템에 가장 널리 사용되는 상온 가속제라고 언급되어 있다.[31][32]11. 아민의 안전성
저분자량의 단순 아민은 에틸아민과 같이 이 100~1000 mg/kg으로 약한 독성을 나타낸다. 이들은 피부 자극을 유발할 수 있으며, 특히 피부를 통해 쉽게 흡수되는 경우 주의해야 한다.[14] 아민은 광범위한 화합물 종류이며, 이 종류의 더 복잡한 구성원은 매우 생물학적으로 활성이 강할 수 있다. 예를 들어 스트리크닌이 있다.
참조
[1]
사전
amine
American Heritage Dictionary
[2]
웹사이트
Amine definition and meaning
http://www.collinsdi[...]
2017-03-28
[3]
웹사이트
amine – definition of amine in English
https://web.archive.[...]
Oxford Dictionaries
2017-03-28
[4]
리다이렉트
[5]
서적
Organic chemistry
https://web.archive.[...]
McGraw-Hill
2018-06-26
[6]
웹사이트
3.11 Basic properties of amines
https://chem.librete[...]
2015-09-28
[7]
웹사이트
Brief Guide to the Nomenclature of Organic Chemistry
https://iupac.org/wp[...]
2021-06
[8]
저널
Organic Nitrogen Compounds II: Primary Amines
https://www.spectros[...]
2019-03
[9]
서적
Structural Chemistry of Anilines
Wiley-VCH
[10]
서적
Patai's Chemistry of Functional Groups
[11]
저널
Correlation of the Base Strengths of Amines
[12]
저널
Extension of the Self-Consistent Spectrophotometric Basicity Scale in Acetonitrile to a Full Span of 28 pKa Units: Unification of Different Basicity Scales
[13]
서적
Advanced Organic Chemistry: Reactions, Mechanisms, and Structure
https://books.google[...]
Wiley-Interscience
2007
[14]
백과사전
Amines, Aliphatic
[15]
저널
Tandem alkylation-reduction of nitriles. Synthesis of branched primary amines
1986
[16]
서적
Advanced Organic Chemistry: Reactions, Mechanisms, and Structure
Wiley
[17]
합성방법
β-Naphthylmercuric chloride
[18]
백과사전
Ullmann's Encyclopedia of Industrial Chemistry
[19]
서적
Nitrosation
https://archive.org/[...]
Cambridge University Press
[20]
저널
Adaptation of protein surfaces to subcellular location
[21]
서적
Lehninger, Principles of Biochemistry
https://archive.org/[...]
Worth Publishing
[22]
저널
Dominant forces in protein folding
[23]
서적
Anatomy & Physiology
OpenStax CNX
2023-07-26
[24]
저널
The Medicinal Chemist's Toolbox: An Analysis of Reactions Used in the Pursuit of Drug Candidates
[25]
간행물
AHFS Drug Information 2010
American Society of Health System Pharmacists
2010
[26]
백과사전
Ullmann's Encyclopedia of Industrial Chemistry
[27]
웹사이트
amine curing agent: Topics by Science.gov
https://www.science.[...]
[28]
저널
The use of water-based epoxies for anti-corrosive primers
1995-01-01
[29]
백과사전
Wiley-VCH
[30]
논문
Synthesis of a legislation compliant corrosion protection coating system based on urethane, oxazolidine and waterborne epoxy technology
Imperial College London
1997-04
[31]
저널
Development of a supramolecular accelerator simultaneously to increase the cross-linking density and ductility of an epoxy resin
https://doi.org/10.1[...]
2019-01
[32]
저널
Molecular dynamics simulation of crosslinking process and mechanical properties of epoxy under the accelerator
https://onlinelibrar[...]
2023-01-10
[33]
블로그
トリイソプロピルアミン
http://blog.livedoor[...]
[34]
저널
市販味噌及び醤油中の不揮発性アミンの分析法及びその含有量
1991
[35]
저널
洒のアミン
1978
[36]
논문
食品に含まれるアミン類
https://doi.org/10.1[...]
2014
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
