역수송체
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
역수송체는 세포막을 가로질러 두 종류 이상의 분자를 반대 방향으로 수송하는 막 단백질이다. 이는 농도 기울기를 이용한 2차 능동 수송의 한 유형으로, 세포 항상성을 유지하는 데 중요한 역할을 한다. 역수송체는 구조와 기능이 다양하며, 나트륨-칼슘 교환체(NCX), 나트륨-수소 역수송체(NHE), 염화물-중탄산염 역수송체, 염소-수소 역수송체, 환원성 엽산 운반체 단백질(RFC), 소포 신경전달물질 역수송체 등이 있다. 이러한 역수송체들은 세포 내 이온 및 분자 농도를 조절하여 심혈관 질환, 신경 질환 등 다양한 생리적 과정과 질병에 관여한다.
더 읽어볼만한 페이지
- 수송현상 - 단일수송체
단일수송체는 세포막을 가로질러 특정 분자나 이온을 농도 기울기에 따라 수동 수송하는 막 단백질이며, 영양분 흡수, 이온 항상성 유지 등 다양한 생리적 과정에 관여하고 유전자 돌연변이는 질병을 유발하기도 한다. - 수송현상 - 물질 이동
물질 이동은 천체물리학에서 별이 다른 천체로 이동하는 현상, 화학공학에서 화학 퍼텐셜 차이를 이용한 분리 공정 등 다양한 분야에서 나타나는 현상을 의미한다. - 내재성 막 단백질 - 광계
광계는 틸라코이드 막에 위치하며 빛 에너지를 화학 에너지로 전환하는 단백질 복합체로, 광수집 복합체에 둘러싸인 반응 중심을 가지며 물 분해를 통해 전자를 얻고 산소를 방출하는 광계 II와 NADPH를 생성하는 광계 I 두 가지 주요 유형으로 나뉜다. - 내재성 막 단백질 - 사이토크롬 b6f 복합체
사이토크롬 b6f 복합체는 광합성에서 광계 II와 광계 I 사이의 전자 및 에너지 전달을 매개하고 틸라코이드 막을 가로질러 양성자를 수송하여 ATP 합성을 촉진하는 단백질 복합체로서, 순환적 광인산화에도 중요한 역할을 하며 사이토크롬 bc1 복합체와 구조적 유사성을 갖는 8개의 소단위체로 구성된 이량체이다.
| 역수송체 | |
|---|---|
| 기본 정보 | |
| 유형 | 막 단백질 |
| 기능 | 물질 수송 |
| 상세 정보 | |
| 기능 | 농도 기울기에 반하여 두 개 이상의 분자 또는 이온을 막을 가로질러 동시에 수송 (2차 능동 수송) |
| 수송 분자 수 | 2개 이상 |
| 수송 방향 | 서로 반대 방향 |
| 에너지원 | 다른 분자의 농도 기울기 |
| 관련 용어 | 심포터, 유니포터, 수송체 (생물학) |
| 예시 | 나트륨-칼슘 교환기, 염소 이온-중탄산 이온 교환기 |
2. 배경
역수송체는 공동수송체의 일종으로, 특정 분자의 농도 기울기 차이를 에너지원으로 이용하여 다른 분자를 농도 기울기에 역행하여 세포막을 가로질러 수송하는 막 단백질이다. 채널이나 수송체로 분류된다.[67]
역수송체는 공동수송체의 일종으로, 특정 분자의 농도기울기 차이를 에너지원으로 사용하여 다른 분자를 농도구배에 역행하는 방향으로 세포막을 가로질러 수송하는 막 단백질이다. 채널이나 수송체로 분류된다.[67]
역수송체를 사용하는 수송 방법을 역수송(Antitransport)이라고 하며, 2차 능동수송에 포함된다. 공동수송체는 모든 생물체에서 발견되며[2], 수송 단백질이라는 더 넓은 범주에 속한다. 수송 단백질에는 유니포터, 심포터, 역수송체 등을 포함하는 다양한 막횡단 단백질 그룹이 있다. 이들은 지질 기반의 세포막을 통과할 수 없는 수용성 분자의 이동 수단을 제공한다. 이 중 가장 단순한 것은 유니포터로, 농도 기울기를 따라 한 종류의 분자를 이동시킨다.[5] 포유류에서 유니포터는 가장 일반적으로 포도당과 아미노산을 세포로 수송한다.[6]
심포터와 역수송체는 두 개 이상의 이온을 이동시키고, 이 중 하나의 이온 이동이 에너지적으로 불리한 방향으로 진행되기 때문에 더 복잡하다. 여러 분자가 관련되므로, 수송체가 막의 한쪽에서 다른 쪽으로 이동하기 위해 일련의 입체 구조 변화를 겪을 때 여러 결합 과정이 발생해야 한다.[7] 이러한 수송체가 사용하는 메커니즘은 한 번에 소수의 분자만 이동하도록 제한한다. 그 결과, 심포터와 역수송체는 1초에 102에서 104개의 분자를 이동시키는 느린 수송 속도를 보인다. 이는 촉진 확산을 통해 1초에 107에서 108개의 이온이 세포막을 통과하도록 하는 채널 단백질과 비교된다.[2]
나트륨-칼륨 펌프와 같이 ATP 가수분해에서 파생된 에너지를 결합하여 에너지적으로 불리한 방향으로 분자를 이동시키고, 입체 구조 변화를 겪는 펌프도 있지만, ATP에서 파생된 에너지를 각 이온을 수송하는 데 결합하기 때문에 다른 범주의 막 단백질에 속한다. 이러한 이온 펌프는 매우 선택적이며, 최소한 하나의 게이트가 항상 닫혀 있는 이중 게이팅 시스템으로 구성된다. 이온은 한쪽 게이트가 열려 있는 동안 막의 한쪽에서 들어올 수 있고, 그 후 닫힌다. 그런 다음 두 번째 게이트가 열려 이온이 막의 반대쪽으로 빠져나가게 된다. 교대로 게이트가 열리는 시간은 차단 상태라고 하며, 이 상태에서 이온은 결합되고 두 게이트는 모두 닫힌다.[8] 이러한 게이팅 반응은 이러한 펌프의 속도를 제한하여 수송 단백질보다 더 느리게 작용하여 1초에 100에서 103개의 이온을 이동시킨다.[2]
3. 구조 및 기능
역수송체가 능동 수송에서 기능하기 위해서는 막 단백질이 다음의 특정 요구 사항을 충족해야 한다.
역수송체는 매우 다양하기 때문에, 그 구조는 수송되는 분자의 종류와 세포 내 위치에 따라 크게 달라질 수 있다. 그러나 모든 역수송체가 공유하는 몇 가지 일반적인 특징이 있는데, 그 중 하나는 형질막의 지질 이중층을 가로질러 막 횡단 영역이 여러 개 있어 친수성 분자가 통과할 수 있는 채널을 형성한다는 것이다. 이러한 막 횡단 영역은 일반적으로 알파 나선으로 구성되어 있으며 세포 외 공간과 세포질 모두에서 루프로 연결되어 있다. 이러한 루프는 역수송체와 관련된 분자에 대한 결합 부위를 포함한다.[1]
역수송체의 이러한 특징은 세포 항상성을 유지하는 기능을 수행할 수 있게 해준다. 친수성 분자가 소수성 지질 이중층을 통과할 수 있는 공간을 제공하여 형질막의 소수성 상호 작용을 우회할 수 있게 한다. 이는 세포 환경에 필요한 분자의 효율적인 이동을 가능하게 하며, 예를 들어 세포 소기관의 산성화에 사용된다.[2]
4. 작동 메커니즘
역수송체는 공동수송체의 일종으로, 특정 분자의 농도기울기 차이를 에너지원으로 사용하여 다른 분자를 농도기울기에 역행하여 세포막을 가로질러 수송하는 막 단백질이다. 채널이나 수송체로 분류된다.[67] 역수송체를 사용하는 수송 방법은 2차 능동수송에 속한다.
능동 수송에서 기능하기 위해 막 단백질은 특정 요구 사항을 충족해야 한다. 먼저, 단백질 내부에 분자나 이온을 포함할 수 있는 공동이 있어야 한다. 또한, 단백질은 최소 두 가지 다른 입체 구조를 가질 수 있어야 하는데, 하나는 공동이 세포 외 공간에, 다른 하나는 세포질에 열려 있어야 한다. 이는 분자가 막의 한쪽에서 다른 쪽으로 이동하는 데 매우 중요하다. 마지막으로, 단백질의 공동에는 리간드 결합 부위가 있어야 하며, 이 결합 부위는 각 입체 구조에서 리간드에 대해 다른 친화력을 가져야 한다. 그래야 리간드가 형질막의 한쪽에서 수송체에 결합하여 반대쪽에서 방출될 수 있다.[9]
역수송체는 매우 다양하며, 그 구조는 수송되는 분자의 종류와 세포 내 위치에 따라 크게 달라질 수 있다. 그러나 모든 역수송체가 공유하는 몇 가지 일반적인 특징이 있다. 그중 하나는 형질막의 지질 이중층을 가로질러 막 횡단 영역이 여러 개 있어 친수성 분자가 통과할 수 있는 채널을 형성한다는 것이다. 이러한 막 횡단 영역은 일반적으로 알파 나선으로 구성되며 세포 외 공간과 세포질 모두에서 루프로 연결되어 있다. 이러한 루프는 역수송체와 관련된 분자에 대한 결합 부위를 포함한다.[1]
이러한 특징은 세포 항상성을 유지하는 기능을 수행할 수 있게 해준다. 친수성 분자가 소수성 지질 이중층을 통과할 수 있는 공간을 제공하여 형질막의 소수성 상호 작용을 우회할 수 있게 한다. 이는 세포의 환경에 필요한 분자의 효율적인 이동을 가능하게 하며, 예를 들어 세포 소기관의 산성화에 사용된다.[2] 형질막의 양쪽에서 각 이온 또는 분자에 대한 역수송체의 다양한 친화력은 에너지적으로 유리한 농도를 위해 활용되는 이온의 전기화학적 기울기에 따라 막의 적절한 쪽에 리간드를 결합시키고 방출할 수 있게 한다.[9]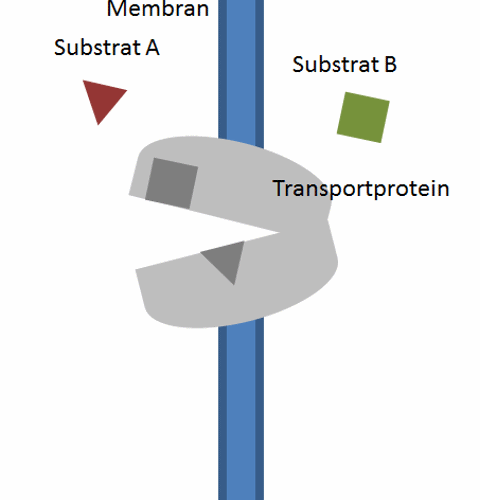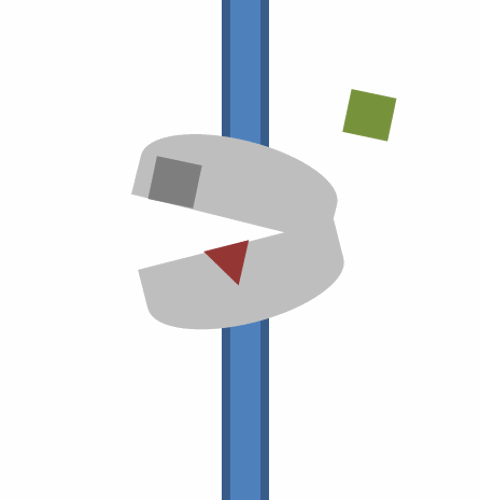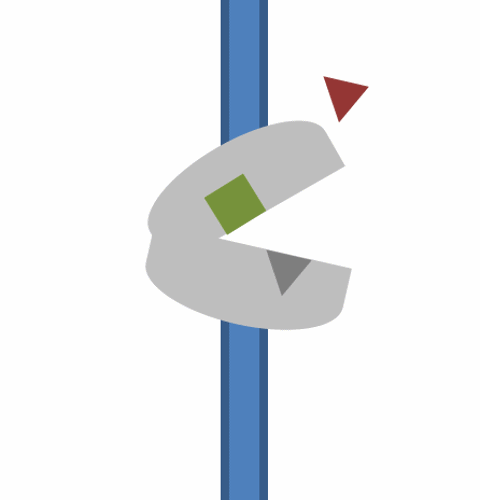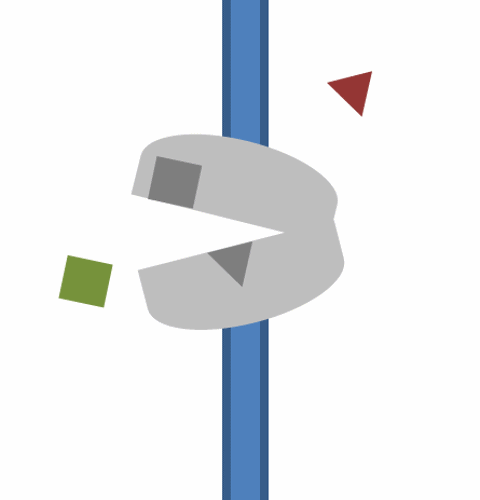
역수송체 수송 메커니즘은 일련의 핵심 단계와 입체 구조 변화를 포함한다:
1. 기질이 형질막의 세포 외 측면에 있는 특정 결합 부위에 결합하여 역수송체의 임시 기질 결합 개방 형태를 형성한다.
2. 이것은 세포 외 공간을 향하고 있는 폐쇄된 기질 결합 상태가 된다.
3. 역수송체는 입체 구조 변화를 거쳐 이제 세포질을 향하는 폐쇄된 기질 결합 단백질이 된다. 이 과정에서 일시적인 완전 폐쇄 중간 단계를 거친다.
4. 기질은 역수송체가 개방되고 안쪽을 향하는 입체 구조를 취하면서 역수송체에서 방출된다.
5. 역수송체는 이제 두 번째 기질에 결합하여 일시적인 기질 결합 개방 상태를 취함으로써 반대 방향으로 수송할 수 있다.
6. 이어서 세포질을 향하는 폐쇄된 기질 결합 상태, 일시적인 완전 폐쇄 중간 단계를 거치는 입체 구조 변화, 역수송체의 개방되고 바깥쪽을 향하는 입체 구조로의 복귀가 이어진다.
7. 두 번째 기질이 방출되고 역수송체는 원래의 입체 구조 상태로 돌아갈 수 있으며, 여기서 새로운 분자 또는 이온에 결합하고 수송 과정을 반복할 준비가 된다.[11]
5. 역사
역수송체는 과학자들이 생물학적 막을 가로지르는 이온 수송 메커니즘을 탐구하면서 발견되었다. 초기 연구는 20세기 중반에 이루어졌으며, 나트륨, 칼륨, 칼슘과 같은 이온이 세포막을 가로질러 수송되는 메커니즘에 초점을 맞추었다. 연구자들은 이러한 이온들이 반대 방향으로 이동한다는 것을 관찰하고, 이러한 유형의 수송을 촉진할 수 있는 막 단백질의 존재를 가설로 세웠다.[12]
1960년대에 생화학자 에프라임 라커(Efraim Racker)는 역수송체의 발견에 획기적인 발전을 이루었다. 라커와 그의 동료들은 소 심장 미토콘드리아에서 무기 인산을 수산화 이온과 교환할 수 있는 미토콘드리아 단백질을 정제하여 발견했다. 이 단백질은 내막에 위치하며 산화적 인산화에 사용하기 위해 인산 이온을 수송한다. 이 단백질은 인산-수산화물 역수송체 또는 미토콘드리아 인산 운반체 단백질로 알려지게 되었으며, 살아있는 세포에서 확인된 최초의 역수송체 사례가 되었다.[13][14]
시간이 지남에 따라 연구자들은 다른 막과 다양한 유기체에서 다른 역수송체를 발견했다. 여기에는 나트륨-칼슘 교환기(NCX)가 포함되며, 이는 세포막을 가로질러 나트륨 이온과 칼슘 이온을 교환하여 세포 내 칼슘 수치를 조절하는 또 다른 중요한 역수송체이다. 이 단백질은 1970년대에 발견되었으며, 현재 많은 유형의 세포에서 발견되는 것으로 알려진 잘 특성화된 역수송체이다.[15]
생화학 및 분자 생물학 분야의 발전으로 다양한 역수송체를 식별하고 특성화할 수 있게 되었다. 다양한 분자와 이온의 수송 과정을 이해함으로써 세포 수송 메커니즘뿐만 아니라 다양한 생리적 기능과 항상성 유지에서 역수송체의 역할에 대한 통찰력을 얻을 수 있었다.
6. 항상성 유지 역할
역수송체는 세포 안팎으로 다양한 물질을 수송하여 세포의 항상성을 유지하는 데 중요한 역할을 한다. 이들은 세포 내 환경을 일정하게 조절하여 생명 유지에 필수적인 여러 기능을 수행한다.
- 나트륨-칼슘 교환체 (NCX): 나트륨-칼슘 교환체(NCX)는 세포 내 칼슘 농도를 조절한다. 나트륨 이온의 농도 기울기를 이용하여 칼슘 이온을 세포 밖으로 배출하며, 특히 심장, 신장, 뇌 세포에서 중요하게 기능한다. NCX는 세포 내 칼슘 농도가 높아졌을 때 빠르게 칼슘을 제거하여 세포를 보호하고, 심장 근육의 이완, 흥분-수축 연쇄, 광수용체 활동 등 다양한 생리적 과정에 관여한다.[18] 또한, 세포 내 나트륨 농도가 높아지거나 세포가 탈분극되면 역방향으로 작동하여 칼슘을 세포 안으로 유입시키기도 한다.[4][19]
- 나트륨-수소 역수송체 (NHE): 나트륨-수소 역수송체(NHE)는 세포 내 pH와 나트륨 농도를 조절한다. 나트륨 이온을 세포 안으로, 수소 이온을 세포 밖으로 수송하며, 세포의 pH 균형을 유지하고 과도한 나트륨 축적을 방지한다.[29][33] NHE는 신장에서 나트륨 재흡수와 수소 이온 배설을 조절하고, 심장에서는 세포 내 pH와 수축력을 조절한다.[34] 식물 세포에서는 세포질의 과도한 나트륨을 제거하고 세포 내로 나트륨이 들어오는 것을 막아 염분 스트레스로부터 세포를 보호한다.[31] NHE의 기능 이상은 심혈관 질환, 신장 질환, 신경 질환 등 다양한 질병과 관련이 있다.[29]
- 염화물-중탄산염 역수송체: 염화물-중탄산염 역수송체는 세포막을 통해 중탄산염과 염화물 이온을 교환하여 pH와 체액 균형을 유지한다.[38] 이들은 심장의 푸르키네 섬유, 요관의 평활근 세포, 신장과 같은 상피 세포, 위벽 세포, 파골 세포 등 다양한 세포에서 발견된다.[38] 염화물-중탄산염 역수송체의 예로는 장 점막에서 발견되는 단백질 DRA와 적혈구 및 신장 세뇨관 세포에서 발견되는 음이온 교환기 1 (AE1)이 있다.[39][38] 이들의 기능 이상은 선천성 염화물 설사, 원위 세뇨관 산증, 유전성 구상 적혈구증 등 다양한 질병을 유발할 수 있다.[42][41][44]
- 염소-수소 역수송체: CLC 계열에 속하는 염소-수소 역수송체는 다양한 조직에 분포하며, 세포 내 소기관의 산성화, 세포막을 통한 물질 수송, 뼈 리모델링 등 다양한 기능을 수행한다.[48] CLC-4는 뇌, 간, 신장, 심장, 골격근, 창자 등에서 발견되며 내소체 산성화, 트랜스페린 수송 등에 관여한다.[48] CLC-5는 신장에서 주로 발견되며 세포내이입에 중요하다.[48] CLC-7은 리소좀과 파골세포에서 발현되며 뼈 리모델링에 필수적이다.[48] 이들의 기능 이상은 발작 장애, 덴트병, 골경화증 등 다양한 질병과 관련이 있다.[48]
- 환원성 엽산 운반체 단백질 (RFC): 환원성 엽산 운반체 단백질(RFC)은 엽산(비타민 B9)을 세포 안으로 운반하는 막관통 단백질이다.[52] 엽산은 DNA 합성, DNA 복구, 메틸화 과정에 필수적인 영양소이며, RFC 단백질은 엽산이 세포 내로 들어와 이러한 기능을 수행할 수 있도록 돕는다.[53] RFC 단백질의 기능 변화는 엽산 결핍을 악화시켜 태아 기형, 신경 질환, 심혈관 질환, 암 등 다양한 질병을 유발할 수 있다.[53][54]
- 소포 신경전달물질 역수송체: 소포 신경전달물질 역수송체는 뉴런에서 신경전달물질을 소포에 포장한다.[57] 이들은 시냅스 소포 막을 가로지르는 수소 양성자의 전기화학적 기울기를 이용하여 신경전달물질을 소포 안으로 이동시키며, 이는 시냅스 전달 과정에 필수적이다.[57] 대표적인 소포 신경전달물질 역수송체로는 소포 모노아민 수송체(VMAT)와 소포 글루탐산염 수송체(VGLUT)가 있다.[57][59] VMAT는 세로토닌, 노르에피네프린, 도파민과 같은 모노아민을 수송하며, VMAT2의 기능 이상은 기분 장애 및 파킨슨병과 관련이 있다.[58][61][63] VGLUT는 글루탐산염을 수송하며, VGLUT의 기능 변화는 간질 및 기분 장애와 관련이 있다.[65][66]
6. 1. 나트륨-칼슘 교환체 (NCX)
나트륨-칼슘 교환체(나트륨-칼슘 교환기, Na+/Ca2+ Exchanger, NCX)는 세포 밖의 나트륨 농도가 세포 안의 농도보다 30배 이상 높은 구배를 에너지원으로 사용하여 세포 안에 있는 칼슘을 세포 밖으로 수송한다. 포유동물에서 칼슘 농도는 세포 밖이 안보다 10,000배 이상 높기 때문에 나트륨-칼슘 역수송체는 나트륨의 농도구배를 에너지원으로 사용하여 칼슘을 농도구배에 역행하여 수송할 수 있다. 이때 3개의 나트륨 이온이 세포 안으로 이동하는 사이에 하나의 칼슘 이온이 세포 밖으로 수송된다.[67]나트륨-칼슘 교환체(NCX)는 심장, 신장 및 뇌에서 흔히 발견되는 이온 수송체로, 세포에서 칼슘을 제거하는 역할을 한다. 이들은 세 개의 나트륨 이온을 세포 안으로 흐르게 하고, 한 개의 칼슘 이온을 세포 밖으로 내보내는 데 나트륨의 전기화학적 기울기에 저장된 에너지를 사용한다.[4] 이 교환체는 미토콘드리아 및 흥분성 세포의 소포체 막에서 가장 흔하게 발견되지만, 다양한 종의 많은 다른 세포 유형에서도 발견될 수 있다.[16]
NCX는 칼슘 이온에 대한 친화력이 낮지만, 짧은 시간 안에 많은 양의 이온을 수송할 수 있다. 이러한 특성 때문에, 활동 전위가 발생한 후와 같이 높은 양의 칼슘을 긴급하게 배출해야 하는 상황에서 유용하다.[17] 또한, NCX는 칼슘 이온에 더 높은 친화력을 가진 다른 단백질과 그 기능을 방해하지 않고 함께 작용할 수 있게 해준다. NCX는 이러한 단백질과 협력하여 심근 이완, 흥분-수축 연쇄 및 광수용체 활동과 같은 기능을 수행한다. 또한 심장 세포의 근소포체, 흥분성 및 비흥분성 세포의 소포체, 그리고 미토콘드리아 내의 칼슘 이온 농도를 유지한다.[18]
NCX의 또 다른 주요 특징은 가역성이다. 즉, 세포가 충분히 탈분극되거나, 세포 외 나트륨 수치가 충분히 낮거나, 세포 내 나트륨 수치가 충분히 높으면, NCX는 반대 방향으로 작동하여 칼슘을 세포 안으로 가져오기 시작한다.[4][19] 예를 들어, NCX가 흥분독성 동안 기능할 때, 이러한 특성은 세포 내 칼슘 수치의 증가를 동반하여, 교환체가 나트륨 농도에 관계없이 정상적인 방향으로 작동할 수 있게 하므로 보호 효과를 갖게 한다.[4] 또 다른 예는 심근 세포의 탈분극으로, 이는 세포 내 나트륨 농도의 큰 증가를 동반하여 NCX가 역으로 작동하게 한다. 칼슘 농도는 심장 활동 전위 동안 신중하게 조절되므로, 이는 칼슘이 세포 밖으로 펌핑됨에 따라 일시적인 효과일 뿐이다.[20]
6. 2. 나트륨-수소 역수송체 (NHE)
나트륨-수소 역수송체는 나트륨-양성자 교환기, Na+/H+ 교환기 또는 NHE라고도 하며, 세포 내로 나트륨을 수송하고 세포 밖으로 수소를 수송하는 데 관여하는 역수송체이다. 따라서 세포의 pH와 나트륨 농도 조절에 중요하다.[29] 진핵생물과 원핵생물에 존재하는 NHE 역수송체 계열 사이에는 차이가 있다.인간 게놈에서 발견되는 이 수송체의 9개의 단백질 이형체는 CPA 1, CPA 2, CPA 3 및 나트륨 수송 카르복실산 탈카르복실화효소 (NaT-DC)를 포함한 여러 계열에 속한다.[30] 원핵생물에는 Na+/H+ 역수송체 계열인 NhaA, NhaB, NhaC, NhaD, NhaE가 있다.[31]
효소는 특정 pH 범위에서만 기능할 수 있으므로, 세포가 세포질 pH를 엄격하게 조절하는 것이 중요하다. 세포의 pH가 최적 범위를 벗어나면, 나트륨-수소 역수송체가 이를 감지하고 pH 균형을 회복하기 위한 항상성 기전으로 이온을 수송하도록 활성화된다.[32] 포유류 세포에서는 이온 흐름이 역전될 수 있으므로, NHE는 과도한 나트륨 축적을 막고 독성을 유발하는 것을 방지하기 위해 세포 밖으로 나트륨을 수송하는 데에도 사용될 수 있다.[33]
기능에서 알 수 있듯이, 이 역수송체는 나트륨 재흡수 조절을 위해 신장에, 세포 내 pH 및 수축력 조절을 위해 심장에 위치한다. NHE는 신장의 네프론에서, 특히 근위 세뇨관과 집합관 세포에서 중요한 역할을 한다. 나트륨-수소 역수송체의 기능은 신체가 나트륨을 재흡수하고 수소를 배설해야 할 때 근위 세뇨관에서 안지오텐신 II에 의해 상향 조절된다.[34]
식물은 다량의 염분에 민감하며, 이는 광합성을 포함한 진핵생물의 특정 필수 기능을 중단시킬 수 있다.[31] 유기체가 항상성을 유지하고 중요한 기능을 수행하기 위해 Na+/H+ 역수송체는 Na+을 세포 밖으로 펌핑하여 세포질의 과도한 나트륨을 제거하는 데 사용된다.[31] 이 역수송체는 또한 세포 내로 나트륨이 들어오는 것을 막기 위해 채널을 닫을 수 있으며, 세포 내의 과도한 나트륨이 액포로 들어갈 수 있도록 한다.[31]
나트륨-수소 역수송체의 활성 조절 장애는 심혈관 질환, 신장 질환 및 신경 질환과 관련이 있다.[29] NHE 억제제는 이러한 문제를 치료하기 위해 개발되고 있다.[35] 역수송체의 이형체 중 하나인 NHE1은 포유류 심근의 기능에 필수적이다. NHE는 비대의 경우와 허혈 및 재관류 손상과 같은 심장 근육 손상이 발생할 때 관련된다. 연구에 따르면 NHE1은 심근 경색 및 좌심실 비대를 경험하는 동물 모델에서 더 활성화되는 것으로 나타났다.[35] 이러한 심장 사건 동안 나트륨-수소 역수송체의 기능은 심근 세포의 나트륨 수치를 증가시킨다. 결과적으로 나트륨-칼슘 역수송체의 작용은 세포 내로 더 많은 칼슘을 유입시켜 심근 손상을 초래한다.[35]
NHE의 5가지 이형체가 신장의 상피 세포에서 발견된다. 가장 잘 연구된 것은 NHE3로, 주로 신장의 근위 세뇨관에 위치하며 산-염기 항상성에 중요한 역할을 한다. NHE3에 문제가 생기면 나트륨의 재흡수와 수소의 분비가 방해된다.[34] NHE3 조절 장애가 유발할 수 있는 주요 질환은 고혈압과 신세뇨관 산증 (RTA)이다. 고혈압은 신장에서 더 많은 나트륨이 재흡수될 때 발생할 수 있으며, 물이 나트륨 이온을 따라가 혈액량을 증가시키기 때문이다. 이것은 결국 혈압 상승으로 이어진다.[34] RTA는 NHE3의 비활성화와 수소 이온 분비 감소로 인해 신장이 소변을 산성화할 수 없어 대사성 산증을 특징으로 한다. 반면, 과도한 NHE3 활성은 수소 이온의 과도한 분비와 혈액이 너무 알칼리성이 되는 대사성 알칼리증을 유발할 수 있다.[34]
NHE는 또한 신경 퇴행과 관련될 수 있다. 이형체 NHE6의 조절 장애 또는 손실은 인간 뉴런의 타우 단백질에 병리학적 변화를 유발할 수 있으며, 이는 엄청난 결과를 초래할 수 있다.[36] 예를 들어, 크리스찬슨 증후군 (CS)은 NHE6의 기능 상실 돌연변이에 의해 발생하는 X-연관 질환으로, 엔도솜의 과도한 산성화를 초래한다.[37] CS 환자의 사후 뇌에 대한 연구에서, NHE6 기능 저하는 타우 축적 수준 증가와 관련이 있었다. 타우 인산화 수준도 증가하여 뉴런 손상과 사망을 유발할 수 있는 불용성 엉킴을 형성하는 것으로 밝혀졌다.[36] 타우 단백질은 알츠하이머병 및 파킨슨병과 같은 다른 신경 퇴행성 질환에도 관련되어 있다.
6. 3. 염화물-중탄산염 역수송체
염화물-중탄산염 역수송체는 세포막을 통해 중탄산염과 염화물 이온을 교환하는 기능을 통해 pH와 체액 균형을 유지하는 데 매우 중요하다. 이러한 교환은 다양한 신체 세포에서 발생한다.[38] 심장의 푸르키네 섬유와 요관의 평활근 세포에서 이 역수송체는 세포 내로 염화물을 수송하는 주요 메커니즘이다. 신장과 같은 상피 세포는 염화물-중탄산염 교환을 사용하여 부피, 세포 내 pH 및 세포 외 pH를 조절한다. 위의 벽 세포, 파골 세포 및 기타 산 분비 세포는 탄산 무수화 효소의 기능과 정단 수소 펌프에 의해 남겨진 과도한 중탄산염을 처리하기 위해 기저 외측 막에서 기능하는 염화물-중탄산염 역수송체를 가지고 있다. 그러나 염기 분비 세포는 정단 염화물-중탄산염 교환과 기저 외측 수소 펌프를 나타낸다.[38]염화물-중탄산염 역수송체의 예는 아데노마에서 하향 조절된 단백질(단백질 DRA)이라고도 하는 염화물 음이온 교환기이다. 이것은 장 점막, 특히 막의 정단 표면의 원주 상피 및 술잔 세포에서 발견되며, 여기서 염화물 및 중탄산염 교환 기능을 수행한다.[39] 단백질 DRA의 염화물 재흡수는 장이 물을 재흡수할 수 있게 해주는 삼투 기울기를 생성하는 데 매우 중요하다.[40]
잘 연구된 또 다른 염화물-중탄산염 역수송체는 음이온 교환기 1(AE1)이며, 이는 밴드 3 음이온 수송 단백질 또는 용질 수송체 계열 4 구성원 1(SLC4A1)이라고도 알려져 있다. 이 교환기는 적혈구에서 발견되며, 폐와 조직 사이에서 중탄산염과 이산화탄소를 수송하여 산-염기 항상성을 유지하는 데 도움이 된다.[38] AE1은 신장 세뇨관 세포의 기저 외측 면에서도 발현된다. AE1은 네프론의 집합관에서 매우 중요하며, 여기서 산 분비 α-간질 세포가 위치한다. 이 세포는 이산화탄소와 물을 사용하여 수소 및 중탄산염 이온을 생성하며, 이는 탄산 무수화 효소에 의해 촉매된다. 수소는 막을 통해 집합관의 루멘으로 교환되므로 산이 소변으로 배설된다.[41]
장의 물 재흡수에 중요하기 때문에 단백질 DRA의 돌연변이는 선천성 염화물 설사(CCD)라는 질환을 유발한다.[42] 이 질환은 7번 염색체의 DRA 유전자의 상염색체 열성 돌연변이에 의해 발생한다.[43] 신생아의 CCD 증상은 성장 부진을 동반한 만성 설사이며, 대사성 알칼리증을 유발하는 설사가 특징이다.
신장 AE1의 돌연변이는 소변으로 산을 분비할 수 없는 질환인 원위 세뇨관 산증을 유발할 수 있다. 이는 혈액이 너무 산성인 대사성 산증을 유발한다. 만성적인 대사성 산증 상태는 뼈, 신장, 근육 및 심혈관 건강에 영향을 미칠 수 있다.[41] 적혈구 AE1의 돌연변이는 기능의 변화를 유발하여 적혈구 형태 및 기능의 변화를 유발한다. 이는 적혈구의 모양이 폐와 조직에서 가스 교환 기능과 밀접하게 관련되어 있기 때문에 심각한 결과를 초래할 수 있다. 이러한 질환 중 하나는 둥근 적혈구가 특징인 유전 질환인 유전성 구상 적혈구증이다. 또 다른 질환은 AE1 유전자의 결실로 타원형 적혈구를 생성하는 동남아 타원 적혈구증이다.[44] 마지막으로 과수화 유전성 구상적혈구증은 적혈구의 부피가 비정상적으로 높은 희귀 유전 질환으로, 수분 상태의 변화를 유발한다.[45]
AE1의 이소형인 AE2의 적절한 기능은 위 분비, 파골 세포 분화 및 기능, 법랑질의 합성에 중요하다. 위 벽 세포와 파골 세포의 정단 표면에서의 염산 분비는 기저 외측 표면에서의 염화물-중탄산염 교환에 의존한다.[46][47] 연구에 따르면 기능이 없는 AE2를 가진 쥐는 염산을 분비하지 않았으며, 이 교환기가 벽 세포에서 염산 부하에 필요하다는 결론을 내렸다.[46] AE2 발현이 동물 모델에서 억제되었을 때, 세포주는 파골 세포로 분화하여 기능을 수행할 수 없었다. 또한 파골 세포 표지자를 가지고 있지만 AE2가 결핍된 세포는 야생형 세포와 비교하여 비정상적이었고, 광물화된 조직을 재흡수할 수 없었다. 이는 파골 세포 기능에서 AE2의 중요성을 보여준다.[47] 마지막으로, 법랑질의 인회석 결정이 형성될 때 많은 수소가 생성되어 광물화가 진행되도록 중화되어야 한다. AE2가 비활성화된 쥐는 이가 없고 불완전한 법랑질 성숙으로 고통받았다.[46]
6. 4. 염소-수소 역수송체
CLC 계열에 속하는 염소-수소 역수송체는 CLC-1부터 CLC-7까지 다양한 동형체로 존재하며, 각기 다른 조직 분포를 보인다. 이들은 두 개의 CLC 단백질 단량체가 모여 이량체 또는 이종이량체를 형성하며, 이온 이동 경로를 포함한다. CLC-1과 CLC-2는 막 염소 채널인 반면, CLC-3에서 CLC-7까지는 염소-수소 교환기이다.[48]CLC-4는 뇌에서 주로 발견되지만 간, 신장, 심장, 골격근, 창자에도 존재한다. 내소체에서 산성화에 관여하며, 소포체 및 세포막에서도 발현될 수 있다. CLC-4는 내소체 산성화, 트랜스페린 수송, 신장 세포내이입, 간 분비 경로에 관여하는 것으로 추정된다.[48]
CLC-5는 신장에서 주로 발견되며, 특히 근위 세뇨관, 집합관, 헨레 고리 오름가지에 분포한다. 내소체 막을 통한 물질 수송 기능을 담당하여 피노사이토시스, 수용체 매개 세포내이입 및 정단 표면으로부터의 세포막 단백질의 세포내이입에 중요하다.[48]
CLC-7은 리소좀과 파골세포의 물결 모양 경계에서 발현되는 염소-수소 역수송체이다. 리소좀 내 염소 농도 조절에 중요하며, Ostm1 단백질과 복합체를 형성하여 기능한다. 이들은 뼈 리모델링을 위한 흡수 락쿠나 산성화 과정에 필수적이다.[48]
CLC-4의 프레임 시프트 돌연변이 및 미스센스 돌연변이는 발작 장애, 안면 이상, 행동 장애를 포함하는 정신 지체와 관련이 있으며, X 연관될 가능성이 있다. CLC-4 기능 상실은 해마 뉴런의 손상된 신경 분지와 연관될 수 있다.[48]
CLC-5 유전자 결함은 덴트병의 60%를 차지하며, 세뇨관 단백뇨, 신장 결석, 신석회화증, 만성 신부전 등을 유발한다. 이는 세포내이입 이상으로 발생하며, 파코니 증후군의 원인이 된다.[48][49] 파코니 증후군은 다뇨증, 탈수증, 구루병, 골연화증, 산증, 저칼륨혈증을 초래한다.[50]
CLC-7의 역할은 골경화증 녹아웃 마우스 연구를 통해 밝혀졌다. CLC-7 결함은 뼈 성장 문제, 수질강 부재, 치아 맹출 실패 등을 유발한다. CLC-7은 뉴런에서 발현되며, 손실 시 마우스에서 광범위한 신경 퇴행, 특히 대뇌 피질과 해마 손상을 유발한다. CLC-7의 변형된 발현은 리소좀 축적 질환 및 망막 변성 (로돕신 돌연변이)을 일으킬 수 있다.[48]
6. 5. 환원성 엽산 운반체 단백질 (RFC)
환원성 엽산 운반체 단백질(RFC)은 엽산(비타민 B9)을 세포 안으로 옮기는 막관통 단백질이다. 유기 인산염의 큰 농도 기울기를 이용하여 엽산을 농도 기울기에 역행하여 세포 안으로 이동시킨다. RFC 단백질은 엽산, 환원형 엽산, 환원형 엽산 유도체, 약물 메토트렉세이트를 수송할 수 있다. 이 수송체는 SLC19A1 유전자에 의해 암호화되며 인간 세포에 널리 발현된다. RFC 단백질은 pH 7.4에서 최대 활성을 보이며, pH 6.4 미만에서는 활성이 나타나지 않는다.[52] 생리적 pH에서 엽산은 친수성 음이온 형태이므로 생물학적 막을 자연적으로 통과하기 어렵기 때문에 RFC 단백질은 매우 중요하다. 엽산은 DNA 합성, DNA 복구, 메틸화 과정에 필수적이며, 세포 내로 들어오지 않으면 이러한 과정이 일어날 수 없다.[53]엽산은 다양한 생명 유지 과정에 필수적이므로 엽산 결핍은 태아 기형, 신경 질환, 심혈관 질환, 암으로 이어질 수 있다. 엽산은 체내에서 합성될 수 없으므로 음식물을 통해 섭취하고 세포 내로 이동해야 한다. RFC 단백질이 이러한 이동을 돕지 않으면 발생학적 발달 및 DNA 복구와 같은 과정이 일어날 수 없다.[53]
태아의 신경관 발달에는 적절한 엽산 수치가 필요하다. 임신 중 엽산 결핍은 이분 척추, 무뇌증과 같은 결함 위험을 높인다.[54] 생쥐 모델에서 FRC 단백질 유전자 양쪽 대립 유전자를 모두 비활성화하면 배아가 사망한다. 임신 기간 동안 엽산을 보충하더라도, 생쥐는 조혈 조직의 문제로 인해 출생 후 2주 안에 사망했다.[53]
RFC 단백질 기능 변화는 엽산 결핍을 악화시켜 심혈관 질환, 신경퇴행성 질환, 암을 유발할 수 있다. 심혈관 문제와 관련하여 엽산은 호모시스테인 대사에 관여한다. 낮은 엽산 수치는 호모시스테인 수치를 높여 심혈관 질환 위험 요소로 작용한다.[53][55] 암과 관련하여 엽산 결핍은 특히 대장암 위험 증가와 관련이 있다. RFC 단백질 발현이 변형된 생쥐 모델은 대장암 관련 유전자 전사체가 증가하고 결장 세포 증식이 증가하는 것으로 나타났다.[53] 엽산 수치가 부적절하면 DNA 손상 및 비정상적인 DNA 메틸화를 유발할 수 있기 때문에, 암 위험은 FRC 단백질의 DNA 합성 역할과 관련이 있을 가능성이 높다.[56]
6. 6. 소포 신경전달물질 역수송체
소포 신경전달물질 역수송체는 뉴런에서 신경전달물질을 소포에 포장하는 역할을 한다. 이들은 시냅스 소포의 막을 가로지르는 수소 양성자의 전기화학적 기울기를 이용하여 신경전달물질을 소포 안으로 이동시킨다. 이는 신경전달물질이 다음 뉴런의 수용체에 결합하기 위해 시냅스로 방출되어야 하는 시냅스 전달 과정에 필수적이다.[57]이러한 역수송체 중 가장 잘 알려진 것 중 하나는 소포 모노아민 수송체(VMAT)이다. 이는 신경전달물질의 저장, 분류 및 방출뿐만 아니라 자동 산화를 방지하는 역할도 한다. VMAT의 수송 기능은 소포 수소 양성자-ATPase에 의해 생성된 전기화학적 기울기에 의존한다.[57] VMAT1과 VMAT2는 세로토닌, 노르에피네프린, 도파민과 같은 모노아민을 양성자 의존 방식으로 수송할 수 있는 두 가지 동질체이다. VMAT1은 신경내분비 세포에서 발견될 수 있으며, VMAT2는 중추 및 말초 신경계의 뉴런뿐만 아니라 부신 크롬친 세포에서도 발견될 수 있다.[58]
또 다른 중요한 소포 신경전달물질 역수송체는 소포 글루탐산염 수송체(VGLUT)이다. 이 단백질 계열에는 뇌에서 가장 풍부한 흥분성 신경전달물질인 글루탐산염을 시냅스 소포에 포장하는 역할을 하는 VGLUT1, VGLUT2, VGLUT3의 세 가지 동질체가 포함된다.[59] 이러한 역수송체는 위치에 따라 다르다. VGLUT1은 신피질과 같이 고위 인지 기능과 관련된 뇌 영역에서 발견된다. VGLUT2는 기본적인 생리 기능을 조절하는 역할을 하며, 뇌간 및 시상하부와 같은 피질하 영역에서 발현된다. 마지막으로, VGLUT3는 다른 신경전달물질도 발현하는 뉴런에서 볼 수 있다.[59][60]
VMAT2는 기분 장애 및 파킨슨병과 같은 신경 질환에 기여하는 것으로 밝혀졌다. 임상 우울증의 동물 모델에 대한 연구에서 VMAT2의 기능적 변화가 우울증과 관련이 있는 것으로 나타났다. 측좌핵, 흑색질의 치밀부, 복측 피개 영역 (모두 임상 우울증과 관련된 뇌의 하위 영역)에서 VMAT2 수치가 더 낮은 것으로 밝혀졌다.[61] 이는 VMAT이 우울증과 관련된 신경전달물질인 세로토닌 및 노르에피네프린과의 관계 때문일 가능성이 높다. VMAT 기능 장애는 기분 장애에서 발생하는 이러한 신경전달물질의 변화된 수치에 기여할 수 있다.[62]
VMAT2의 낮은 발현은 파킨슨병에 대한 더 높은 감수성과 관련이 있는 것으로 밝혀졌으며, 역수송체의 메신저 RNA는 파킨슨병으로 손상된 모든 세포군에서 발견되었다.[63] 이는 VMAT2 기능 장애가 소포 내 도파민 포장의 감소로 이어져 질병의 특징인 도파민 고갈을 설명할 수 있기 때문일 것이다.[64] 이러한 이유로, 이 역수송체는 파킨슨병 예방을 위해 표적으로 삼을 수 있는 보호 인자로 확인되었다.[63]
글루탐산염 방출의 변화가 간질에서 발작 발생과 관련이 있기 때문에, VGLUT의 기능 변화가 관련될 수 있다.[65] 동물 모델의 별세포와 뉴런에서 VGLUT1 유전자를 불활성화하는 연구가 수행되었다. 별세포에서 유전자를 불활성화했을 때, 역수송체 단백질 자체의 80% 손실과 그에 따른 글루탐산염 흡수 감소가 발생했다. 이 상태의 생쥐는 발작, 낮은 체질량, 높은 사망률을 경험했다. 연구자들은 별세포의 VGLUT1 기능이 따라서 간질 저항 및 정상 체중 증가에 중요하다는 결론을 내렸다.[65]
글루탐산염 시스템이 장기 세포 성장 및 시냅스 가소성에 역할을 한다는 많은 증거가 있다. 이러한 과정의 교란은 기분 장애의 병리와 관련되어 있다. 글루탐산성 신경전달물질 시스템의 기능과 기분 장애 사이의 연관성은 VGLUT를 치료 목표 중 하나로 설정한다.[66]
7. 역수송체의 예시
나트륨-칼슘 교환기(Na+/Ca2+ Exchanger, NCX)는 세포 밖의 나트륨 농도가 세포 안의 농도보다 30배 이상 높은 구배를 에너지원으로 사용하여 세포 안에 있는 칼슘을 세포 밖으로 수송한다. 포유동물에서 칼슘 농도는 세포 밖이 안보다 10,000배 이상 높기 때문에 나트륨-칼슘 교환기는 나트륨의 농도기울기를 에너지원으로 사용하여 칼슘을 농도구배에 역행하여 수송할 수 있다. 이때 3개의 나트륨 이온이 세포 안으로 이동하는 사이에 하나의 칼슘 이온이 세포 밖으로 수송된다.[67]
미토콘드리아의 ADP/ATP 역수송체는 미토콘드리아가 ATP를 합성하는데 필요한 물질과 ATP 합성 과정에서 생성되는 대사물질을 서로 교환하는 일을 한다.[67]
참조
[1]
웹사이트
Membrane proteins involved in active transport can function as uniporters
https://commons.wiki[...]
2021-09-04
[2]
서적
Molecular cell biology
Macmillan Learning
2021
[3]
웹사이트
This picture represents antiport.
https://commons.wiki[...]
2017-11-12
[4]
논문
Na(+)-Ca2+ exchange currents in cortical neurons: concomitant forward and reverse operation and effect of glutamate
1997-06
[5]
논문
Uniporters, Symporters and Antiporters
1994-09
[6]
논문
Na(+)-independent transport (uniport) of amino acids and glucose in mammalian cells
1994-11
[7]
논문
The structural basis of secondary active transport mechanisms
2011-02
[8]
논문
Ion channels versus ion pumps: the principal difference, in principle
2009-05
[9]
논문
Simple allosteric model for membrane pumps
1966-08
[10]
웹사이트
English: antiport
https://commons.wiki[...]
2013-02-07
[11]
논문
Lessons from lactose permease
2006-06-01
[12]
서적
Molecular biology of the cell. Hauptbd.
Garland
2002
[13]
논문
Stimulation of adenine nucleotide translocation in reconstituted vesicles by phosphate and the phosphate transporter
1977-04
[14]
논문
Purification and reconstitution of the phosphate transporter from bovine heart mitochondria
1977-04
[15]
서적
Cell Calcium Metabolism
Springer US
1989
[16]
논문
Sodium/calcium exchanger: influence of metabolic regulation on ion carrier interactions
2006-01
[17]
논문
Generation, control, and processing of cellular calcium signals
2001-04
[18]
논문
Sodium/calcium exchange: its physiological implications
1999-07
[19]
논문
Excitotoxic degeneration is initiated at non-random sites in cultured rat cerebellar neurons
1995-11
[20]
논문
Cardiac excitation-contraction coupling
2002-01
[21]
논문
Calcium cycling and signaling in cardiac myocytes
2008-03-01
[22]
논문
Calcium and Excitation-Contraction Coupling in the Heart
2017-07
[23]
간행물
Faculty Opinions recommendation of Molecular basis of cardioprotection: signal transduction in ischemic pre-, post-, and remote conditioning.
2015-03-31
[24]
논문
Excitotoxicity and stroke: identifying novel targets for neuroprotection
2014-04
[25]
서적
Alzheimer: 100 Years and Beyond
Springer Berlin Heidelberg
2006
[26]
논문
The origins of oxidant stress in Parkinson's disease and therapeutic strategies
2011-04
[27]
논문
What Causes the Selective Death of Dopaminergic Neurons in Parkinson's Disease?
2015-10
[28]
논문
Mitochondria, calcium, and endoplasmic reticulum stress in Parkinson's disease
2011-05
[29]
서적
The Alkali Metal Ions: Their Role for Life
Springer International Publishing
2016
[30]
논문
Ion channels and transporters in diabetic kidney disease
2019
[31]
논문
Na(+)/H(+) antiporters
2001-05
[32]
논문
Functional and structural dynamics of NhaA, a prototype for Na(+) and H(+) antiporters, which are responsible for Na(+) and H(+) homeostasis in cells
2014-07
[33]
서적
Progress in Biotechnology
Elsevier
2002-01
[34]
논문
Na+/H+ exchangers in renal regulation of acid-base balance
2006-09
[35]
논문
The Na(+)/H(+) exchanger: a target for cardiac therapeutic intervention
2005-08
[36]
논문
Loss of endosomal exchanger NHE6 leads to pathological changes in tau in human neurons
2022-09
[37]
논문
Loss of Christianson Syndrome Na+/H+ Exchanger 6 (NHE6) Causes Abnormal Endosome Maturation and Trafficking Underlying Lysosome Dysfunction in Neurons
2021-11
[38]
논문
The Band 3-Related Anion-Exchanger (AE) Gene Family
1991-01
[39]
논문
The functional and physical relationship between the DRA bicarbonate transporter and carbonic anhydrase II
2002-11
[40]
논문
LPA stimulates intestinal DRA gene transcription via LPA2 receptor, PI3K/AKT, and c-Fos-dependent pathway
2012-03
[41]
논문
Familial distal renal tubular acidosis is associated with mutations in the red cell anion exchanger (Band 3, AE1) gene
1997-10
[42]
논문
Molecular cloning and promoter analysis of downregulated in adenoma (DRA)
2007-11
[43]
논문
The solute carrier 26 family of proteins in epithelial ion transport
2008-04
[44]
서적
Hematology
Elsevier
2018
[45]
논문
Thrombo-embolic disease after splenectomy for hereditary stomatocytosis
1996-05
[46]
논문
Bicarbonate transport in cell physiology and disease
2009-01
[47]
논문
HCO3-/Cl- anion exchanger SLC4A2 is required for proper osteoclast differentiation and function
2008-11
[48]
논문
CLC Chloride Channels and Transporters: Structure, Function, Physiology, and Disease
2018-07
[49]
논문
Dent's disease; a familial proximal renal tubular syndrome with low-molecular-weight proteinuria, hypercalciuria, nephrocalcinosis, metabolic bone disease, progressive renal failure and a marked male predominance
1994-08
[50]
논문
A loss-of-function mutation in NaPi-IIa and renal Fanconi's syndrome
2010-03
[51]
논문
Loss of the ClC-7 chloride channel leads to osteopetrosis in mice and man
2001-01
[52]
논문
Mechanisms of membrane transport of folates into cells and across epithelia
2011-08
[53]
논문
Restoration of high-level transport activity by human reduced folate carrier/ThTr1 thiamine transporter chimaeras: role of the transmembrane domain 6/7 linker region in reduced folate carrier function
2003-01
[54]
서적
Neural Tube Defects
Oxford University PressNew York, NY
2005-10-13
[55]
서적
Folate in Health and Disease
CRC Press
2009-11-24
[56]
논문
Folate and colorectal cancer: an evidence-based critical review
2007-03
[57]
논문
ChemInform Abstract: Vesicular Monoamine Transporters: Structure-Function, Pharmacology, and Medicinal Chemistry
2011-10-27
[58]
서적
Basic Neurochemistry: Molecular, Cellular and Medical Aspects
https://www.ncbi.nlm[...]
Lippincott-Raven
2024-04-13
[59]
논문
VGLUTs define subsets of excitatory neurons and suggest novel roles for glutamate
2004-02
[60]
논문
The existence of a second vesicular glutamate transporter specifies subpopulations of glutamatergic neurons
2001-11
[61]
논문
Decreased limbic vesicular monoamine transporter 2 in a genetic rat model of depression
2003-03
[62]
논문
The medical management of depression
2005-10
[63]
논문
Dopamine transporters and neuronal injury
1999-10
[64]
논문
Comparison of 99mTc-TRODAT-1 SPECT and 18 F-AV-133 PET imaging in healthy controls and Parkinson's disease patients
2014-04
[65]
논문
Conditional deletion of the glutamate transporter GLT-1 reveals that astrocytic GLT-1 protects against fatal epilepsy while neuronal GLT-1 contributes significantly to glutamate uptake into synaptosomes
2015-04
[66]
논문
Targeting the glutamatergic system to develop novel, improved therapeutics for mood disorders
2008-05
[67]
웹인용
"[네이버 지식백과] 역수송체 [Antiporter] (분자·세포생물학백과)"
https://terms.naver.[...]
2022-04-15
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com