수소화 붕소 리튬
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
수소화 붕소 리튬(LiBH₄)은 수소화물의 공급원으로서 다양한 유기 반응에 사용되는 화합물이다. 수소화 붕소 나트륨과 브로민화 리튬의 반응, 또는 삼플루오린화 붕소와 수소화 리튬의 반응을 통해 제조할 수 있다. 수소화 붕소 나트륨보다 강력한 환원제이며, 에스테르, 니트릴, 1급 아미드를 환원시킬 수 있고, 에폭시드를 열 수 있다. 물과 반응하여 수소를 생성하며, 가장 높은 에너지 밀도를 가진 화학적 에너지 캐리어 중 하나로, 자동차 및 로켓 연료로 제안되기도 했지만, 재활용의 어려움으로 인해 널리 사용되지는 않는다.
더 읽어볼만한 페이지
- 붕소 화합물 - 질화 붕소
질화 붕소는 붕소와 질소의 화합물로, 다양한 결정 구조를 가지며, 높은 열적, 화학적 안정성과 우수한 윤활성을 바탕으로 절삭 공구, 연마재 등 다양한 분야에 응용된다. - 붕소 화합물 - 붕산
붕산은 붕소의 산화물로, 살충제, 난연제, 의약품 등 다양한 용도로 사용되며, 붕사에 무기산을 작용시켜 얻을 수 있고, 가열 시 산화 붕소로 분해되며, 루이스 산으로 작용하고, 과다 섭취 시 독성을 나타낼 수 있다. - 금속 수소화물 - 아르신
아르신(AsH₃)은 마늘 또는 생선 냄새가 나는 무색의 독성 기체로, 반도체 제조에 사용되지만 적혈구 파괴를 유발하는 높은 독성 때문에 취급에 주의해야 하며, 과거 화학 무기로 연구되었고 비소 중독 검출에 쓰이는 마쉬 시험의 핵심 물질이다. - 금속 수소화물 - 수소화 우라늄
수소화 우라늄은 우라늄과 수소의 화합물로서, 특정 온도와 압력 조건에서 형성되며 다양한 화학적 특성을 나타낸다. - 리튬 화합물 - 유기리튬 시약
유기리튬 시약은 탄소-리튬 결합을 가진 화합물로 카를 치글러, 게오르크 비티히, 헨리 길먼 등에 의해 개발되었으며 극성을 띠는 결합과 강염기성 및 친핵성을 이용하여 유기 합성 반응에서 친핵체, 탈양성자화제, 중합 개시제 등으로 널리 쓰인다. - 리튬 화합물 - 과산화 리튬
과산화 리튬(Li2O2)은 이산화 탄소를 흡수하고 산소를 방출하는 특징으로 밀폐된 공간의 공기 정화나 리튬-공기 전지의 핵심 구성 요소로 사용되는 무기 화합물이다.
2. 제조
수소화 붕소 리튬은 더 흔하게 사용되는 수소화 붕소 나트륨과 브로민화 리튬을 볼 밀링하여 일어나는 치환 반응을 통해 제조할 수 있다.[4]
수소화 붕소 리튬은 수소화물(H–)의 공급원으로서 유용하다. 다양한 종류의 카보닐 기질 및 기타 극성 탄소 구조와 반응하여 수소-탄소 결합을 형성할 수 있다. 또한 브뢴스테드-로우-산성 물질(H+의 공급원)과 반응하여 수소 기체를 생성할 수도 있다.
: NaBH4 + LiBr → NaBr + LiBH4
또는 삼플루오린화 붕소를 수소화 리튬과 다이에틸 에테르에서 반응시켜 합성할 수 있다.[5]
: BF3 + 4 LiH → LiBH4 + 3 LiF
3. 반응
==== 환원 반응 ====
수소화 붕소 리튬은 수소화 붕소 나트륨보다는 강력하지만[6][7] 수소화 알루미늄 리튬보다는 약한[7] 수소화물 환원제이다. 수소화 붕소 나트륨과 달리, 에스테르를 알코올로, 니트릴과 1급 아미드를 아민으로 환원시킬 수 있으며, 에폭시드를 열 수 있다. 이러한 많은 경우에서 향상된 반응성은 리튬 양이온과의 배위에 의한 카르보닐 기질의 편극 때문으로 여겨진다.[3] 수소화 알루미늄 리튬과 달리, 니트로기, 카바민산, 알킬 할라이드, 2급 및 3급 아미드와 반응하지 않는다.
==== 수소 생성 ====
수소화 붕소 리튬은 물과 반응하여 수소를 생성한다. 이 반응은 수소 발생에 사용될 수 있다.[8] 일반적으로 이 반응은 자발적이고 격렬하지만, 저온에서 탈기된 증류수를 사용하고 산소 노출을 주의 깊게 피하면 수소화 붕소 리튬의 다소 안정적인 수용액을 제조할 수 있다.[9]
3. 1. 환원 반응
수소화 붕소 리튬은 수소화 붕소 나트륨보다는 강력하지만[6][7] 수소화 알루미늄 리튬보다는 약한[7] 수소화물 환원제이다. 수소화 붕소 나트륨과 달리, 에스테르를 알코올로, 니트릴과 1급 아미드를 아민으로 환원시킬 수 있으며, 에폭시드를 열 수 있다. 이러한 많은 경우에서 향상된 반응성은 리튬 양이온과의 배위에 의한 카르보닐 기질의 편극 때문으로 여겨진다.[3] 수소화 알루미늄 리튬과 달리, 니트로기, 카바민산, 알킬 할라이드, 2급 및 3급 아미드와 반응하지 않는다.
3. 2. 수소 생성
수소화 붕소 리튬은 물과 반응하여 수소를 생성한다. 이 반응은 수소 발생에 사용될 수 있다.[8] 일반적으로 이 반응은 자발적이고 격렬하지만, 저온에서 탈기된 증류수를 사용하고 산소 노출을 주의 깊게 피하면 수소화 붕소 리튬의 다소 안정적인 수용액을 제조할 수 있다.[9]
4. 에너지 저장
수소화 붕소 리튬 재활용 개략도. 투입물은 붕산 리튬과 수소이다.
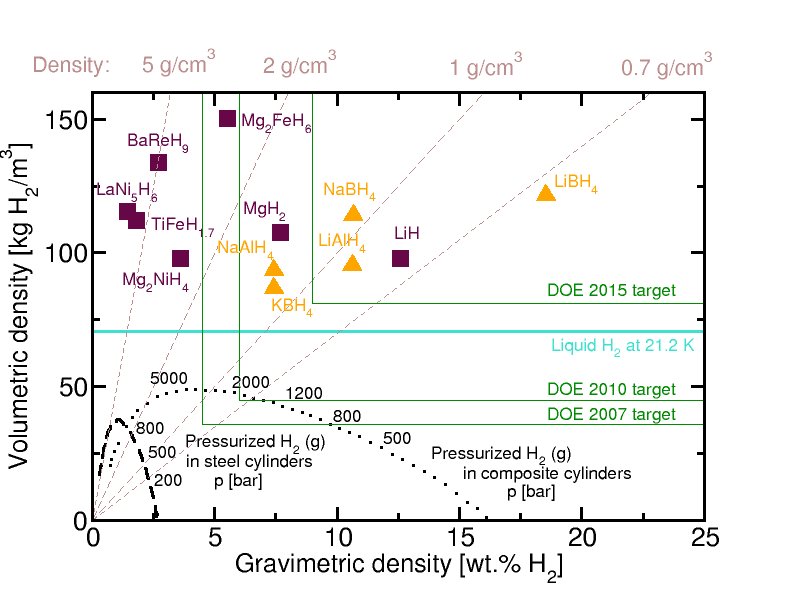
수소화 붕소 리튬은 가장 높은 에너지 밀도를 가진 화학적 에너지 캐리어 중 하나로 알려져 있다. 고체 상태에서는 대기 중의 산소와 반응할 때 65 MJ/kg의 열을 방출한다. 밀도는 0.67 g/cm3이며, 액체 수소화 붕소 리튬의 산화는 43 MJ/L를 제공한다. 이는 가솔린의 44 MJ/kg (또는 35 MJ/L), 액체 수소의 120 MJ/kg (또는 8.0 MJ/L)과 비교된다.[10]
이러한 높은 비 에너지 밀도 때문에 자동차 및 로켓 연료로 제안되기도 했지만, 연구와 옹호에도 불구하고 널리 사용되지는 않았다. 모든 화학 수소화물 기반 에너지 캐리어와 마찬가지로, 수소화 붕소 리튬은 재활용(재충전)이 매우 복잡하여 낮은 에너지 변환 효율을 보인다. 리튬 이온 배터리는 최대 0.72 MJ/kg 및 2.0 MJ/L의 에너지 밀도를 가지며, DC-DC 변환 효율은 90%까지 가능하다.[11] 금속 수소화물의 재활용 메커니즘의 복잡성을 고려할 때,[12] 현재 기술로는 높은 에너지 변환 효율은 실용적이지 않다.
참조
[1]
웹사이트
Sigma-Aldrich Product Detail Page
http://www.sigmaaldr[...]
[2]
논문
Lithium boro-hydride LiBH4: I. Crystal structure
2002-11-18
[3]
서적
Lithium Borohydride
John Wiley & Sons
2001
[4]
서적
Hydrides
Wiley-VCH, Weinheim
2002
[5]
서적
Handbook of Preparative Inorganic Chemistry
https://books.google[...]
Academic Press
1963
[6]
서적
Reduction: Selectivity, Strategy & Efficiency in Modern Organic Chemistry
Pergamon Press
1991
[7]
논문
Mixed solvents containing methanol as useful reaction media for unique chemoselective reductions within lithium borohydride
1986
[8]
논문
Hydrogen Generation by Hydrolysis Reaction of Lithium Borohydride
2004-08
[9]
논문
Preparation of Quaternary Ammonium Borohydrides from Sodium and Lithium Borohydrides
[10]
문서
[11]
간행물
The effect of PHEV and HEV duty cycles on battery and battery pack performance (PDF). 2007 Plug-in Highway Electric Vehicle Conference: Proceedings
2007
[12]
특허
1977
[13]
웹사이트
Sigma-Aldrich Product Detail Page
http://www.sigmaaldr[...]
[14]
저널
Lithium boro-hydride LiBH4: I. Crystal structure
2002-11-18
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

