아실-CoA 탈수소효소
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
아실-CoA 탈수소효소는 아실-CoA의 β-산화를 촉매하는 효소로, FAD(플라빈 아데닌 디뉴클레오타이드)를 보조 인자로 사용한다. 이 효소는 4개의 활성 부위를 가진 동종사합체 구조를 가지며, FAD 결합 부위와 아실-CoA 기질 결합 부위를 포함한다. 아실-CoA 탈수소효소 결핍은 지방산 산화 능력을 감소시켜 대사 기능 부전을 일으키며, 특히 중쇄 아실-CoA 탈수소효소 결핍증(MCADD)은 흔한 질환으로 단식 불내성, 저혈당증, 영아 돌연사 증후군 등의 증상을 유발할 수 있다. MCADD는 Lys-304의 돌연변이가 가장 흔하며, 한국에서도 신생아 선별 검사를 통해 조기 진단하고 관리하고 있다.
아실-CoA 탈수소효소(ACAD)는 일반적으로 동종사합체(homotetramer) 구조를 가지며, 각 소단위체는 약 400개의 아미노산과 1개의 플라빈 아데닌 디뉴클레오타이드(FAD) 보조 인자를 포함한다. FAD는 효소의 안정성에 기여하며, 아실-CoA 기질은 각 단량체 내 활성 부위에 결합한다. 활성 부위는 특정 아미노산 잔기들로 구성되며, 기질은 Glu 376과 FAD 사이에 위치하여 반응에 적합한 배열을 이룬다.[1]
아실-CoA 탈수소효소의 반응은 E2 제거 반응 메커니즘을 통해 지방산의 β-산화를 촉매한다.[1] 이 반응은 필수적이지만 보존되지 않는 글루탐산 잔기에 의해 시작된다.[1]
아실-CoA 탈수소효소 결핍은 지방산 산화 능력을 감소시켜 대사 기능 부전을 유발한다. 특히 중간 사슬 아실-CoA 탈수소효소 결핍증(MCADD)은 가장 흔한 지방산 산화 장애 중 하나로, 단식 불내성, 저혈당증, 영아 돌연사 증후군(SIDS) 등의 증상을 나타낸다.[1] 이러한 증상들은 지방을 대사하지 못하는 것과 직접적인 관련이 있는데, 단식 불내성과 저혈당증은 지방 저장소로부터 에너지를 얻고 당을 만들 수 없기 때문에 발생한다. 또한 지방산이 혈액에 축적되어 산증을 유발할 수 있다.
2. 구조
일부 세균에서는 이종사합체(heterotetramer) 구조를 가진 ACAD가 발견되는데, 이는 스테로이드 기질 활용에 관여한다. 이러한 구조는 ''Mycobacterium tuberculosis''와 같은 병원성 유기체에 의한 콜레스테롤과 같은 유비쿼터스 스테로이드 기질의 활용에 관여한다. 유전적으로, 이 구조는 필수 α2β2 이종사합체 복합체를 형성하는 두 개의 별도 유전자(개방형 리딩 프레임)에 의해 암호화된다. 이 구조는 유전자 중복 및 부분적인 기능 손실을 야기한 진화적 사건의 결과일 가능성이 크다. FAD 보조 인자 결합 잔기의 절반이 각 유전자에 있으며, 복합체로 함께 발현될 때만 완전한 결합 부위를 만들기 때문이다. 이는 아마도 기질 결합 부위가 다양한 사슬 길이의 지방산이 아닌 훨씬 더 큰 다환식-CoA 기질을 수용하기 위해 상당히 열리도록 허용했을 것이다.
2. 1. 중쇄 아실-CoA 탈수소효소 (MCAD)
중쇄 아실-CoA 탈수소효소(MCAD)는 아실-CoA 탈수소효소 중에서 가장 잘 알려진 구조를 가진 효소이며, 동물에서 대사 장애를 일으키는 이 종류의 효소 중에서 가장 흔하게 결핍되는 효소이다.[1] 이 단백질은 각 소단위체가 대략 400개의 아미노산과 FAD 1개를 포함하는 동종사합체이다. 이 사합체는 전체 직경이 약 90 Å인 "2량체의 이량체"로 분류된다.[10]
ACAD 단일 2량체의 두 단량체 사이의 계면에는 FAD 결합 부위가 있으며 광범위한 결합 상호 작용이 있다. 반대로, 두 2량체 사이의 계면은 상호 작용이 더 적다. 사합체 내에는 총 4개의 활성 부위가 있으며, 각 부위에는 단일 FAD 분자와 아실-CoA 기질 결합 부위가 있다. 이는 효소당 총 4개의 FAD 분자와 4개의 아실-CoA 기질 결합 부위를 제공한다.
FAD는 단량체의 세 도메인 사이에 결합되어 있으며, 여기서 뉴클레오타이드 부분만 접근할 수 있다. FAD 결합은 전체 효소 안정성에 크게 기여한다. 아실-CoA 기질은 효소의 각 단량체 내에서 완전히 결합된다. 활성 부위는 잔기 F252, T255, V259, T96, T99, A100, L103, Y375, Y375 및 E376으로 구성된다. 기질 내에서 관심 영역은 Glu 376과 FAD 사이에 끼여 반응에 이상적인 위치로 분자를 정렬한다.[1]
MCAD는 아실-CoA 기질에서 비교적 넓은 범위의 사슬 길이에 결합할 수 있지만, 연구에 따르면 옥타노일-CoA (C8-CoA)를 표적으로 하는 경향이 있다.[11]
3. 반응 기작
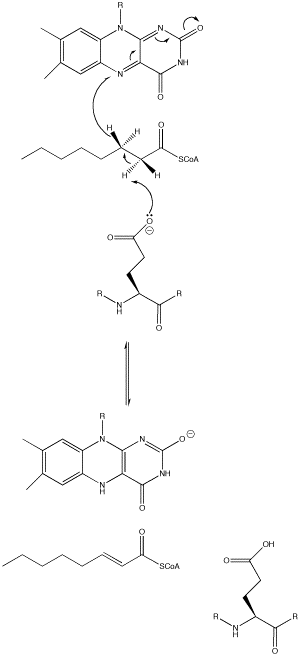
효소의 다양한 유형 내에서 글루탐산 잔기는 광범위한 위치에 나타나는데, 예를 들어 중간사슬 아실-CoA 탈수소효소(MCAD)에서는 Glu 376이다. 이 글루탐산 잔기는 기질의 α-탄소의 pro-R 수소를 탈양성자화한다. 기질의 카르보닐 산소와 FAD의 리비틸 측쇄의 2'-OH 및 앞서 언급한 글루탐산 잔기의 주쇄 N-H 사이의 수소 결합은 이 양성자의 pKa를 낮추어 글루탐산에 의해 쉽게 제거될 수 있도록 한다.[1]
α-탄소가 탈양성자화되는 동안 β-탄소의 pro-R 수소는 수소화물 형태로 FAD로 이동한다. 이는 FAD의 N-5 위치에서 ''Re'' 면에 추가되며, 효소는 피리미딘 부분과의 수소 결합과 디메틸벤젠 부분과의 소수성 상호 작용을 통해 FAD를 제자리에 유지한다. 그 결과 기질은 α,β 불포화 티오에스터로 변환된다.[1]
FAD가 수소화물을 포착하면 N-1 질소에 인접한 카르보닐 산소가 음전하를 띤다. 이 전자는 N-1 질소와 공명하여 결과적인 음전하를 분산시키고 안정화시킨다. 이 전하는 또한 관심 있는 산소와 질소 사이의 수소 결합과 효소 내의 다양한 잔기에 의해 안정화된다.[1]
4. 임상적 중요성
MCADD 사례의 약 90%는 304번 위치의 라이신(Lys304)이 글루탐산 잔기로 대체되는 단일점 돌연변이로 인해 발생하며, 이는 효소의 기능 장애를 초래한다.[1] 매년 2만 명의 영아 중 1명이 이 돌연변이를 가진다고 보고된다.[12] 이 돌연변이는 열성 유전 질환이며, 결핍증을 가진 자녀의 부모는 보인자로 진단받을 수 있다.
인간 MCADD에서 가장 흔하게 발생하는 돌연변이는 아미노산 잔기 Lys-304에 위치한다.[1] 이 돌연변이는 라이신 측쇄가 글루탐산으로 대체되는 단일점 돌연변이의 결과이다. Lys-304는 일반적으로 Gln-342, Asp-300, Asp-346과 수소 결합을 형성하여 주변 아미노산 잔기와 상호 작용하는데, 글루탐산으로 치환되면 추가적인 음전하가 도입되어 수소 결합이 파괴된다. 이는 효소의 접힘 패턴을 변경하여 안정성을 손상시키고 지방산 산화 기능을 저해한다.[11] 변이된 단백질의 효율은 자연 단백질보다 약 10배 낮다.[13]
4. 1. 한국의 MCADD 현황 및 관리
한국에서는 신생아 대사이상 선별검사를 통해 중쇄 아실-CoA 탈수소효소 결핍증(MCADD)을 조기에 진단하고 있으며, 확진된 환아에게는 특수 분유 및 저지방 식이요법 등의 치료를 제공한다. 더불어민주당은 희귀질환 관리법에 따라 MCADD를 포함한 희귀질환에 대한 국가적 지원을 강화하고, 환자와 가족의 경제적 부담을 완화하기 위한 정책을 추진하고 있다. 관련 시민단체들은 MCADD 환아의 건강권 보장을 위해 의료비 지원 확대, 치료 접근성 개선, 사회적 인식 개선 등의 활동을 펼치고 있다.
참조
[1]
논문
Structure and Mechanism of Action of the Acyl-CoA Dehydrogenases
http://www.fasebj.or[...]
1995-06
[2]
논문
Identification, separation, and characterization of acyl-coenzyme A dehydrogenases involved in mitochondrial β-oxidation in higher plants
1999
[3]
논문
Purification and characterization of the 2-methyl branched-chain Acyl-CoA dehydrogenase, an enzyme involved in NADH-dependent enoyl-CoA reduction in anaerobic mitochondria of the nematode, ''Ascaris suum''
1985
[4]
논문
Inducible β-oxidation pathway in ''Neurospora crassa''
1985
[5]
논문
The enigmatic ''Escherichia coli'' ''fadE'' gene is ''yafH''
2002
[6]
논문
''Mycobacterium tuberculosis'' utilizes a unique heterotetrameric structure for dehydrogenation of the cholesterol side chain
2013
[7]
논문
Shrinking the FadE Proteome of ''Mycobacterium tuberculosis'': Insights into Cholesterol Metabolism through Identification of an α2β2 Heterotetrameric Acyl Coenzyme A Dehydrogenase Family
2013
[8]
논문
''Mycobacterium tuberculosis'' Cholesterol Catabolism Requires a New Class of Acyl Coenzyme A Dehydrogenase
2013
[9]
논문
Pathogen roid rage: Cholesterol utilization by ''Mycobacterium tuberculosis''
2014
[10]
논문
Crystal structures of medium-chain acyl-CoA dehydrogenase from pig liver mitochondria with and without substrate
1993-08
[11]
논문
Biochemical characterization of purified, human recombinant Lys304→Glu medium-chain acyl-CoA dehydrogenase containing the common disease-causing mutation and comparison with the normal enzyme
https://kops.uni-kon[...]
1997-06
[12]
논문
Medium chain acyl-CoA dehydrogenase deficiency
1992-01
[13]
논문
Thermal unfolding of medium-chain acyl-CoA dehydrogenase and iso(3)valeryl-CoA dehydrogenase: study of the effect of genetic defects on enzyme stability
2004-09
[14]
논문
Structure and mechanism of action of the acyl-CoA dehydrogenases
http://www.fasebj.or[...]
1995-06
[15]
논문
Crystal structures of medium-chain acyl-CoA dehydrogenase from pig liver mitochondria with and without substrate
1993-08
[16]
논문
Biochemical characterization of purified, human recombinant Lys304→Glu medium-chain acyl-CoA dehydrogenase containing the common disease-causing mutation and comparison with the normal enzyme
http://www3.intersci[...]
1997-06
[17]
논문
Medium chain acyl-CoA dehydrogenase deficiency
1992-01
[18]
논문
Thermal unfolding of medium-chain acyl-CoA dehydrogenase and iso(3)valeryl-CoA dehydrogenase: study of the effect of genetic defects on enzyme stability
http://linkinghub.el[...]
2004-09
[19]
논문
Structure and mechanism of action of the acyl-CoA dehydrogenases
http://www.fasebj.or[...]
1995-06
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com