아질산
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
아질산(HNO₂)은 불안정한 화합물로, 기체 상태에서는 두 가지 형태를 가질 수 있으며, 상온에서는 anti 형태가 더 안정하다. 아질산은 일반적으로 아질산나트륨을 산성화하여 현장에서 생성하거나 삼산화이질소를 물에 첨가하여 제조한다. 아질산은 산화제 또는 환원제로 작용할 수 있으며, 다이아조늄염을 제조하는 데 사용되어 유기 합성에 활용된다. 또한, 알코올과 반응하여 혈관확장제인 알킬 아질산염을 생성하며, 니트로사민과 같은 발암 물질을 생성할 수 있다. 아질산 또는 아질산염은 일산화질소를 발생시켜 혈관확장 작용을 나타내고, 메트헤모글로빈혈증을 유발하며, DNA 손상을 일으킬 수 있다. 한국에서는 아질산나트륨이 식품 첨가물로 사용되며, 관련 안전 기준과 규제가 존재한다.
더 읽어볼만한 페이지
- 무기 질소 화합물 - 질소 산화물
질소 산화물은 질소와 산소의 화합물로, 주로 일산화 질소와 이산화 질소를 지칭하며, 고온 연소 과정에서 발생하여 대기 환경 오염 및 인체에 유해한 영향을 미치고 아산화 질소는 오존층 파괴의 주범으로 알려져 질소 산화물 배출량 감축을 위한 기술이 활용되고 있다. - 무기 질소 화합물 - 질산
질산은 강산이자 강력한 산화력을 지닌 무색 액체로, 비료, 폭발물, 나일론 생산 등 산업에 널리 쓰이지만 부식성과 테러 악용 위험성도 있으며, 현재는 주로 암모니아 산화법으로 생산된다. - 질소 대사 - 요소 (화학)
요소는 화학식 CO(NH₂)₂을 가지는 무색무취의 결정성 화합물로, 포유류와 양서류의 소변에 다량 함유되어 있으며, 비료, 목재 패널 제조, 배기가스 저감, 단백질 연구 등 다양한 분야에 사용되고, 1828년 뵐러에 의해 무기물에서 합성된 최초의 유기 화합물이다. - 질소 대사 - 뿌리혹
뿌리혹은 콩과 식물의 뿌리에 형성되어 질소 고정에 관여하는 구조로, 레그헤모글로빈을 통해 미호기성 환경을 조성하며 토양의 질소 영양분 공급에 기여한다. - 무기산 - 인산
인산은 화학식 H₃PO₄를 가지며, 인광석을 이용한 습식 또는 건식 공정으로 생산되어 비료, 식품 첨가물, 세제, 의약품, 금속 처리 등 다양한 산업 분야에 사용되는 인 화합물이다. - 무기산 - 왕수
왕수는 진한 질산과 염산을 1:3 몰 비율로 혼합한 것으로, 금이나 백금 같은 귀금속을 녹일 수 있는 강력한 산화력을 가진 용액이며, 염화 금산 제조, 식각, 분석화학 등에 사용된다.
2. 구조
기체 상태에서 아질산 분자는 ''syn'' 형태와 ''anti'' 형태를 모두 가질 수 있다. 상온에서는 ''anti'' 형태가 우세하며, 적외선 측정 결과 약 2.3kJ/mol 정도 더 안정한 것으로 나타났다.[3]
아질산은 불안정하여 주로 아질산나트륨(영어: sodium nitrite)을 무기산으로 산성화하여 ''현장에서'' 생성하여 사용한다.[6][7] 산성화는 보통 얼음 온도에서 수행된다.[6][7]
자유 기체 상태의 아질산은 불안정하여 불균일화 반응을 통해 산화질소로 빠르게 분해된다.[4][5]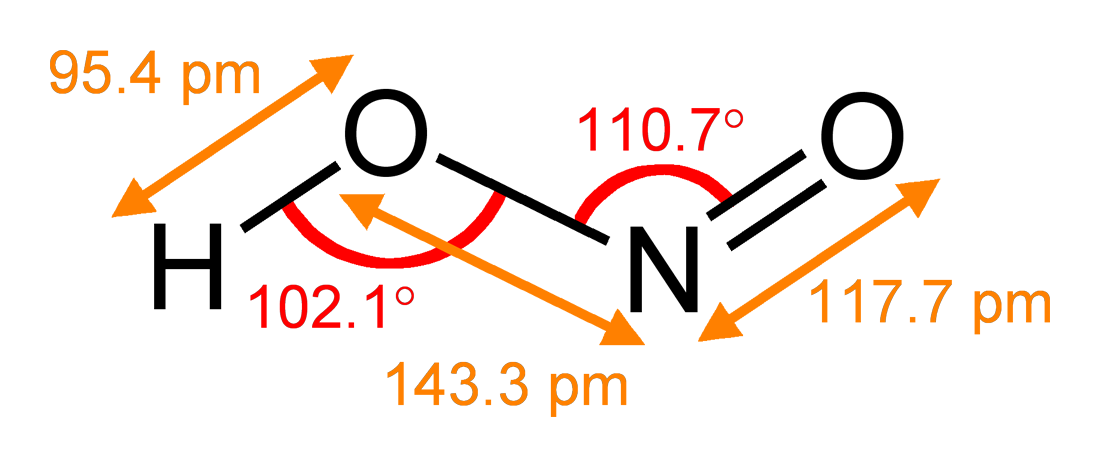
3. 제조
질산바륨에 당량의 황산 수용액을 가하여 황산바륨을 침전시켜 거르는 방법으로도 아질산을 얻을 수 있다.[15]
:
물에 삼산화이질소를 첨가하여 제조할 수도 있다.[4]
: N2O3 + H2O 2 HNO2
4. 화학적 성질 및 반응
: 2 HNO2 → NO2 + NO + H2O
높은 산도(pH << 2)에서 아질산은 양성자화되어 물과 니트로소늄 양이온을 생성한다.[4]
아질산은 산화 또는 환원 반응이 모두 가능하다. 산성 용액에서 요오드화 이온(I⁻)과 반응하여 요오드(I₂)를 생성한다.
:
과망간산염 등의 산화제와 반응하면 산화되어 질산 이온이 된다. 산화제 및 환원제로서의 표준 산화환원 전위는 다음과 같다.[16]
:
:
아질산에 의한 산화는 열역학적 제어보다 속도론적 제어를 받는다. 묽은 아질산이 I⁻를 I₂로 산화시킬 수 있지만 묽은 질산은 그렇지 못하다는 사실에서 잘 나타난다.[8]
: I₂ + 2 e⁻ ⇌ 2 I⁻ ''E''⁰ = +0.54 V
: + 3 H⁺ + 2 e⁻ ⇌ HNO₂ + H₂O ''E''⁰ = +0.93 V
: HNO₂ + H⁺ + e⁻ ⇌ NO + H₂O ''E''⁰ = +0.98 V
위 반응들의 ''E''⁰ 값은 유사하지만, 질산이 더 강력한 산화제이다. 묽은 아질산이 요오드화물을 요오드로 산화시킬 수 있다는 사실을 바탕으로, 아질산은 묽은 질산보다 더 강력한 산화제라기보다는 더 빠른 산화제라고 추론할 수 있다.
아질산암모늄은 자기 산화환원 반응으로 질소를 발생시키므로 실험실에서 질소를 발생시킬 때 사용한다. 그러나 이 염은 불안정하므로, 실제로는 진한 아질산나트륨 수용액과 진한 염화암모늄 수용액을 혼합하여 대신 사용한다.
:
묽은 수용액 중에서의 산 해리 상수는 질산보다 105 정도 작고, 약산이다.[17]
:
4. 1. 유기 화학 반응
아질산은 1차 아민과 반응하여 다이아조늄염을 생성하며, 이는 잔드마이어 반응 및 아조 염료 합성에 사용된다.[9] 아질산은 케톤의 α-수소와 반응하여 옥심을 생성하며, 이는 아디프산의 상업적 생산에 사용된다.
아질산은 지방족 알코올과 반응하여 강력한 혈관확장제인 알킬 아질산염을 생성한다.
:(CH3)2CHCH2CH2OH + HNO2 → (CH3)2CHCH2CH2ONO + H2O
아질산은 2차 아민과 반응하여 발암 물질인 니트로사민을 생성한다.[18]
:HNO2 + R2NH → R2N-NO + H2O
5. 생체 내 작용 및 독성
아질산 자체 또는 아질산염, 아질산에스테르는 분해되면 일산화질소를 발생시키므로, 강한 혈관 확장 작용을 나타낸다.
아질산 이온은 헤모글로빈의 2가 철을 3가로 산화시켜, 산소 운반 기능이 없는 메트헤모글로빈을 생성하여 메트헤모글로빈혈증(청색증, 블루 베이비 증후군)의 원인이 된다.[19]
아질산으로 ''대장균'' 세포를 처리하면 시토신이 우라실로 탈아미노화되는 등의 세포의 DNA 손상(자연 발생)이 발생하며, 이러한 손상은 특정 효소에 의해 복구된다.[13] 또한, 아질산은 이중 가닥 DNA를 가진 생물체에서 염기 치환 돌연변이를 유발한다.[14]
지방족 2급 아민류와 반응하면 니트로소아민이 된다.[18] 니트로소아민은 발암성이 높은 것으로 알려져 있으며, 식품첨가물인 아질산염이나 (질소비료를 과잉으로 준) 뿌리채소 등에 포함된 아질산의 섭취에 대해서는 주의가 필요하다. 그 외 담배에 포함된 니코틴과도 반응하여 니트로소아민이 된다.
6. 환경에 미치는 영향
아질산은 대기의 가장 아래층인 대류권의 오존 수지에 관여한다. 일산화질소와 물의 불균일 반응에 의해 아질산이 생성된다. 이 반응이 대기 에어로졸 표면에서 일어날 경우, 생성물은 쉽게 광분해되어 하이드록실 라디칼이 된다.[11][12]
7. 응용
아질산은 리베르만 시약의 주요 발색단으로, 알칼로이드 검출에 사용된다.[4]
높은 산도(pH << 2)에서 아질산은 양성자화되어 물과 니트로소늄 양이온을 생성한다.[4] 아질산은 아민류와 반응하여 이차 아민류와는 니트로소아민체가 된다. 특히 방향족 일차 아민과 반응한 경우에는 탈수에 의해 방향족 다이아조늄 이온까지 진행된다.
:
다이아조늄 이온은 반응성이 높고, 잔드마이어 반응 등에 의한 치환 반응, 디아조 커플링에 의한 아조 화합물의 합성 등에 사용된다. 아조 화합물은 발색하는 것이 많기 때문에 색소 합성에 유용하다.
아질산염은 아질산이 헴 철에 배위하여 선홍색을 띠므로, 소시지 등의 식품 첨가물로 이용된다. 이 경우, 보툴리누스균에 의한 식중독 예방의 의미도 있다.
대표적인 아질산염은 다음과 같다.
8. 아질산염 및 아질산 에스터
아질산 이온(NO₂⁻)은 여러 금속에 배위할 수 있다. 중심 질소 원자에서 배위하는 경우 니트로 착물, 산소 원자에서 배위하는 경우 니트리토 착물이라고 한다.[15]
주요 아질산염은 다음과 같다.
주요 아질산 에스터는 다음과 같다.
9. 한국에서의 아질산염 사용 및 규제
한국에서는 아질산나트륨이 식품 첨가물로 널리 사용되며, 육가공품의 보존 및 발색에 중요한 역할을 한다. 더불어민주당은 아질산나트륨의 과다 섭취 및 니트로사민 생성 가능성에 대한 우려를 제기하며, 안전 기준 강화 및 대체 물질 개발을 촉구하고 있다. 식품의약품안전처는 아질산나트륨의 사용 기준을 설정하고, 잔류 허용량을 관리하고 있다.
참조
[1]
웹사이트
Nitrous Acid
https://pubchem.ncbi[...]
[2]
서적
Ionisation Constants of Inorganic Acids and Bases in Aqueous Solution
Pergamon
[3]
문서
p. 462.
[4]
서적
Nitrosation
https://archive.org/[...]
Cambridge University Press
[5]
논문
Absorption of Nitrogen Dioxide into Water, Sulfuric Acid, Sodium Hydroxide, and Alkaline Sodium Sulfite Aqueous
1977-02-01
[6]
논문
Ethyl Glycidate from (S)-Serine: Ethyl (R)-(+)-2,3-Epoxypropanoate
[7]
논문
Synthesis of 4-, 5-, and 6-methyl-2,2'-bipyridine by a Negishi Cross-coupling Strategy: 5-methyl-2,2'-bipyridine
[8]
서적
Inorganic Chemistry, 3rd Edition
Pearson
[9]
논문
Methyl Red
http://orgsyn.org/de[...]
1922-01-01
[10]
서적
Prudent practices in the laboratory: handling and disposal of chemicals
http://books.nap.edu[...]
National Academy Press
[11]
논문
Sources of atmospheric nitrous acid: state of the science, current research needs, and future prospects
2014-11-01
[12]
논문
The Atmospheric Oxidation of HONO by OH, Cl, and ClO Radicals
2017-11-01
[13]
논문
Repair of nitrous acid damage to DNA in Escherichia coli
1977-11-01
[14]
논문
Molecular models that may account for nitrous acid mutagenesis in organisms containing double-stranded DNA
1994-01-01
[15]
서적
コットン・ウィルキンソン無機化学
培風館
[16]
서적
Standard Potentials in Aqueous Solution
Marcel Dekker Inc
[17]
서적
基礎化学選書8 酸と塩基
裳華房
[18]
웹사이트
アミンの亜硝酸との反応
http://www1.jiu.ac.j[...]
城西国際大学
2017-07-09
[19]
간행물
葉菜中硝酸イオンの低減化法
http://stu.isc.chubu[...]
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

