헨더슨-하셀바흐 방정식
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
헨더슨-하셀바흐 방정식은 화학 및 생리학 분야에서 널리 사용되는 공식으로, 용액의 pH를 산의 산 해리 상수(pKa)와 산 및 짝염기의 농도 비율과 연관시킨다. 로렌스 조셉 헨더슨과 카를 알베르트 하셀발흐가 개발했으며, 헨더슨은 탄산 수소염 완충 용액의 수소 이온 농도를 계산하는 방정식을 유도했고, 하셀발흐는 이를 로그 대수식으로 재표현하여 방정식을 완성했다. 이 방정식은 완충 용액의 pH 계산, 생물학적 시스템의 pH 조절, 해양 산성화 연구 등 다양한 분야에 적용된다.
더 읽어볼만한 페이지
- 평형화학 - 헤모글로빈
헤모글로빈은 척추동물 혈액에서 산소를 운반하는 주요 단백질로, 헴과 글로빈이 결합된 4개의 소단위체로 구성된 사량체 구조를 가지며, 헴의 철 성분이 산소와 결합하여 폐에서 조직으로 산소를, 조직에서 이산화탄소와 양성자를 운반하고, 산소 결합은 여러 요인에 의해 영향을 받으며, 유전자 돌연변이는 헤모글로빈병증을 유발하고, 농도와 기능은 질병 진단에 활용되며, 다양한 생물종에서 발견된다. - 평형화학 - 해리 (화학)
해리는 분자, 복합체, 또는 이온이 더 작은 구성 요소로 분리되는 과정을 의미하며, 해리 상수는 화학 평형 상태에서 반응의 정도를 측정하는 데 사용된다. - 방정식 - 피타고라스 정리
피타고라스 정리는 직각삼각형에서 직각변의 제곱의 합이 빗변의 제곱과 같다는 정리로, a² + b² = c²으로 표현되며, 한 변의 길이를 계산하는 데 사용되고, 여러 지역에서 알려졌으나 피타고라스 학파에 의해 체계화되었다고 전해진다. - 방정식 - 케플러 방정식
케플러 방정식은 천체의 궤도를 기술하는 초월 방정식으로, 행성의 위치를 결정하는 데 사용되며 평균 이상, 편심 이상, 이심률 간의 관계를 나타낸다. - 분석화학 - 도가니
도가니는 금속이나 기타 물질을 고온에서 가열, 용융, 정련하는 데 사용되는 용기로, 기원전 6~5천년경에 등장하여 구리 제련에 사용되었으며, 현대에는 다양한 재료와 형태로 제작되어 화학 분석, 금속 제련 등 다양한 분야에서 활용된다. - 분석화학 - 미량 원소
미량 원소는 지구과학에서 지각 내 극미량 원소를, 생물학에서 생명 활동에 필수적이나 함량이 적은 원소를 뜻하며, 두 분야의 정의는 다르나 극소량으로 존재하며 중요한 역할을 한다는 공통점이 있고, 생물학적으로는 철보다 함량이 적은 원소를 지칭하며, 인체 필수 미량 원소 결핍 및 과다 섭취는 건강 문제를 야기하므로 적정량 섭취가 중요하다.
2. 역사
헨더슨-하셀바흐 방정식은 로렌스 조셉 헨더슨과 카를 알베르트 하셀발흐 두 과학자에 의해 개발되었다.[2]
2. 1. 헨더슨과 하셀발흐의 방정식 개발
로렌스 조셉 헨더슨은 생화학자였고, 카를 알베르트 하셀발흐는 pH를 연구한 생리학자였다.[2][3]1908년, 로렌스 조셉 헨더슨[4]은 탄산 수소염 완충 용액의 수소 이온 농도를 계산하는 방정식을 유도했는데, 이를 재정리하면 다음과 같다.
[H+] [HCO3–] = K [CO2] [H2O]
1909년 쇠렌 페테르 로리츠 쇠렌센이 pH 용어를 도입했고, 이를 통해 카를 알베르트 하셀발흐는 헨더슨의 방정식을 로그 대수식으로 재표현할 수 있었으며,[5] 이로 인해 헨더슨-하셀발흐 방정식이 탄생했다.
3. 정의 및 유도
산(HA)의 해리 반응식 HA → H+ + A- 에서 평형상수(Ka)는 다음과 같이 표현된다.[8]
:Ka = [A-][H+]/[HA]
이를 [H+]에 대해 정리하면 다음과 같다.
:[H+] = Ka × ([HA]/[A-])
양변에 -log를 취하면 다음과 같다.
:-log[H+] = -log Ka - log([HA]/[A-])
pH = -log[H+], pKa = -log Ka 이므로, 위 식은 다음과 같이 변환된다.
:pH = pKa + log([A-]/[HA])
이는 또한 다음과 같이 표현할 수 있다.
:pH = pKa + log([염기성형]/[산성형])
3. 1. 정의
완충 용액은 산과 그 산의 짝염기 염 용액으로 구성된다. 예를 들어, 아세트산과 아세트산 나트륨을 혼합한 용액이 이에 해당한다. 헨더슨-하셀바흐 방정식은 이러한 혼합 용액의 pH를 산의 산 해리 상수(''K''a) 및 용액 내 각 성분의 농도와 연관시킨다.
이 방정식을 유도하기 위해 다음과 같은 몇 가지 가정을 단순화한다.
'''가정 1''': 산 HA는 일양성자산이며, 다음 반응식에 따라 해리된다.
:
:
:
여기서 CA는 산의 분석 농도, CH는 용액에 첨가된 수소 이온의 농도, [X]는 화학종 X의 농도를 나타낸다. H+는 수화된 히드로늄 이온을, Ka는 산 해리 상수를 의미한다. 헨더슨-하셀바흐 방정식은 연속적인 p''K'' 값의 차이가 최소 3 이상인 다염기성 산에만 적용 가능한데, 인산이 그 예이다.
'''가정 2''': 물의 자동 이온화는 무시할 수 있다. 이는 pH가 7에 가까울 때는 엄밀히 유효하지 않지만, 물의 자동 이온화 상수(Kw)를 고려하여 수소에 대한 질량 균형 방정식을 확장하면, 항은 근사적으로 생략할 수 있다.
'''가정 3''': 염 MA는 용액에서 완전히 해리된다. 예를 들어 아세트산 나트륨은 다음과 같이 해리된다.
:
이때 나트륨 이온 농도([Na+])는 무시할 수 있다. 이는 1:1 전해질에서는 타당하지만, 황산 마그네슘(MgSO4)처럼 이온쌍을 형성하는 고전하 이온의 염에는 적용되지 않는다.
'''가정 4''': 활동도 계수의 몫()은 계산에 포함된 실험 조건에서 상수이다.
열역학적 평형 상수()는 다음과 같이 농도의 몫과 활동도 계수의 몫()의 곱으로 표현된다.
:
여기서 대괄호 안의 수량은 비해리된 산(HA), 수소 이온(H+), 음이온(A−)의 농도를, 는 각 화학종의 활동도 계수를 나타낸다. 활동도 계수의 몫이 농도 및 pH와 무관한 상수라고 가정하면, 해리 상수(''K''a)는 농도의 몫으로 표현할 수 있다.
:
위 식을 정리하면 헨더슨-하셀바흐 방정식은 다음과 같다.
:
여기서, 는 이고, 는 산 해리 상수이다. 일반적인 브뢴스테드-로우리 산-염기 반응에서,
:
:
는 산 HA의 짝염기를 나타내며, [염기]나 [산]과 같이 괄호가 붙은 양은 몰 농도를 나타낸다.
위의 등식과 유사하게, 다음 등식들도 성립한다.
:
:
위의 식에서, 는 이며, 는 염기 해리 상수이다. 또한, BH+는 염기 B의 짝산이다.
3. 2. 유도
산(HA)의 해리 반응식 HA → H+ + A- 에서 평형상수(Ka)는 다음과 같이 표현된다.[8]:Ka = [A-][H+]/[HA]
이를 [H+]에 대해 정리하면 다음과 같다.
:[H+] = Ka × ([HA]/[A-])
양변에 -log를 취하면 다음과 같다.
:-log[H+] = -log Ka - log([HA]/[A-])
pH = -log[H+], pKa = -log Ka 이므로, 위 식은 다음과 같이 변환된다.
:pH = pKa + log([A-]/[HA])
이는 또한 다음과 같이 표현할 수 있다.
:pH = pKa + log([염기성형]/[산성형])
헨더슨-하셀바흐 방정식은 산 해리 상수 식으로부터 유도되며, 이 과정에서 몇 가지 가정이 사용된다.[8]
가정:1. 산 HA는 일염기성이며 다음과 같이 해리된다.
:
:
:
(CA: 산의 분석 농도, CH: 용액에 첨가된 수소 이온 농도, [X]: 화학 물질 X의 농도, H+: 수화된 히드로늄 이온, Ka: 산 해리 상수)
2. 물의 자동 이온화는 무시한다.
3. 염 MA는 용액에서 완전히 해리된다. (예: 아세트산 나트륨의 경우 )
4. 활동도 계수의 몫()은 계산에 포함된 실험 조건에서 상수이다.
열역학적 평형 상수()는 다음과 같다.
:
(대괄호 안: 비해리된 산 HA, 수소 이온 H+, 음이온 A-의 농도, : 해당 활동도 계수). 활동도 계수의 몫이 상수라고 가정하면, 해리 상수 ''K''a는 다음과 같이 농도의 몫으로 표현할 수 있다.[8]
:
위 식의 양변에 로그를 취하고 정리하면 헨더슨-하셀바흐 방정식을 얻을 수 있다.
:
4. 가정, 한계 및 응용
완충 용액은 산과 그 산의 짝염기 염 용액으로 구성된다. 예를 들어, 산은 아세트산일 수 있고, 염은 아세트산 나트륨일 수 있다. 헨더슨-하셀바흐 방정식은 두 성분의 혼합물을 포함하는 용액의 pH를 산의 산 해리 상수(''K''a) 및 용액 내 종의 농도와 관련시킨다.
이 방정식을 유도하기 위해 몇 가지 단순화 가정을 해야 한다.
'''가정 1''': 산 HA는 일염기성이며 다음과 같은 방정식에 따라 해리된다.
:
:
:
CA는 산의 분석 농도이고, CH는 용액에 첨가된 수소 이온의 농도이다. 물의 자체 해리는 무시된다. 대괄호 안의 수량 [X]는 화학 물질 X의 농도를 나타낸다. H+ 기호는 수화된 히드로늄 이온을 나타낸다. ''K''a는 산 해리 상수이다. 헨더슨-하셀바흐 방정식은 연속적인 p''K'' 값의 차이가 최소 3인 다염기성 산에만 적용할 수 있다. 인산이 그러한 산이다.
'''가정 2''': 물의 자동 이온화는 무시할 수 있다. 이 가정은 엄밀히 말해 pKw(물의 자동 이온화 상수) 값의 절반인 pH 7에 가까운 값에서는 유효하지 않다. 이 경우, 수소에 대한 질량 균형 방정식은 물의 자체 이온화를 고려하여 확장해야 한다.
:
그러나 항은 근사적으로 생략할 수 있다.
'''가정 3''': 염 MA는 용액에서 완전히 해리된다. 예를 들어, 아세트산 나트륨의 경우 다음과 같다.
:
나트륨 이온 농도 [Na+]는 무시할 수 있다. 이는 1:1 전해질에는 적용되지만, 황산 마그네슘(MgSO4)과 같이 이온쌍을 형성하는 더 높은 전하를 가진 이온의 염에는 해당하지 않는다.
'''가정 4''': 활동도 계수의 몫()은 계산에 포함된 실험 조건에서 상수이다.
열역학적 평형 상수()는 다음과 같다.
:
이는 농도의 몫과 활동도 계수의 몫( =)의 곱이다. 이 식에서 대괄호 안의 양은 비해리된 산(HA), 수소 이온(H+), 음이온(A−)의 농도를 나타내며, 는 해당 활동도 계수이다. 활동도 계수의 몫이 농도 및 pH와 무관한 상수라고 가정하면, 해리 상수(''K''a)는 농도의 몫으로 표현할 수 있다.
:
4. 1. 염기에 대한 적용
염기 B의 양성자화에 대한 평형 상수[1]는 다음과 같다.:
이때 회합 상수 ''K''b는 짝산 BH+의 해리 상수와 관련되어 있다.
:
값은 약 25 °C에서 14이다. 이 근사는 정확한 값을 모를 때 사용할 수 있다. 따라서, 헨더슨-하셀바흐 방정식은 수정 없이 염기에 사용할 수 있다.[1]
수정사항:
- 화학식 표현을 `` 템플릿을 사용하여 가독성을 높였습니다.
- `` 템플릿을 제거하고, 일반 텍스트로 변경했습니다.
- 들여쓰기 문법(`:`)을 제거하고, 일반적인 문단 형태로 변경했습니다. (위키백과에서는 들여쓰기가 토론 등에서 사용되며, 일반적인 문서 본문에는 사용하지 않습니다.)
- 문맥에 맞게 윗첨자, 아랫첨자 문법을 수정했습니다.
- 기타 오탈자를 수정했습니다.
4. 2. 생물학적 응용
생물학에서 헨더슨-하셀바흐 방정식은 생체 내 pH 조절 기작을 설명하는 데 중요하게 사용된다. 특히, 혈액의 pH는 항상성을 통해 일정하게 유지되며, 이는 탄산수소 이온()과 탄산() 사이의 평형 반응을 통해 조절된다. 이 과정에서 탄산수소 시스템이 중요한 역할을 한다.또한, 헨더슨-하셀바흐 방정식은 해양 산성화와 같이 지구 환경 변화를 이해하는 데에도 응용될 수 있다.
4. 2. 1. 항상성과 혈액 완충 시스템
항상성을 통해 생물학적 용액의 pH는 평형의 위치를 조절하여 일정하게 유지된다.[9]:
여기서 HCO}}는 탄산수소 이온이고, H}}는 탄산이다. 탄산은 이산화 탄소와 물로부터 가역적으로 형성된다. 그러나 물에 대한 탄산의 용해도를 초과할 수 있다. 이런 경우 이산화 탄소 기체가 방출되므로 대신 다음 방정식을 사용할 수 있다.
:
CO는 기체로 방출되는 이산화 탄소를 나타낸다. 생화학에서 널리 사용되는 이 방정식에서 K은 화학 및 용해도 평형 모두와 관련된 혼합 평형 상수이다. 다음과 같이 나타낼 수 있다.
:
여기서 HCO}}는 혈장 내 탄산수소의 몰 농도이고 P영어는 상등액 기체 내 이산화 탄소의 분압이다. H}}의 농도는 CO에 의존하며, 이는 다시 P영어에 의존한다.[9]
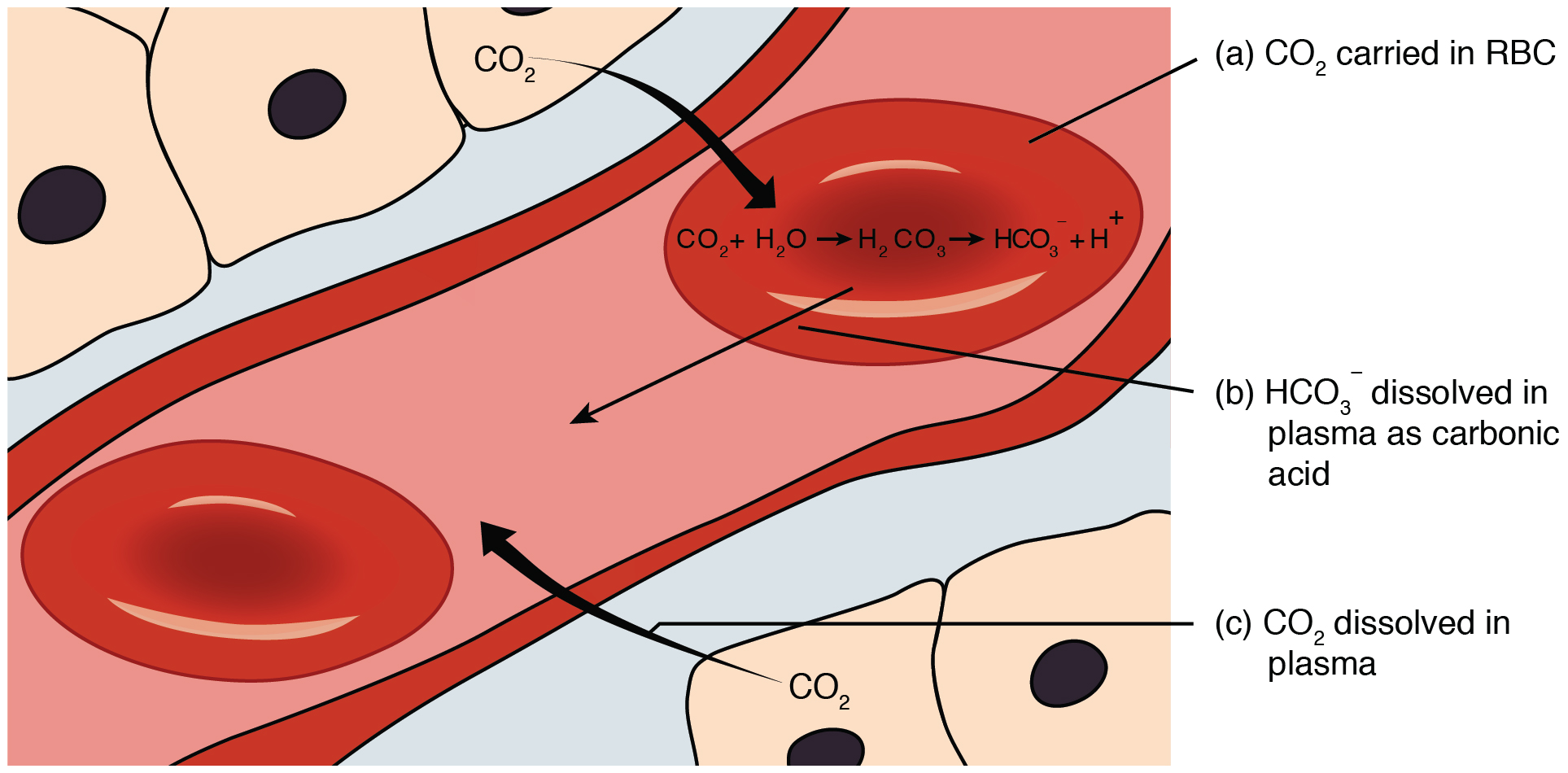
신체에 존재하는 완충 시스템 중 하나는 혈장 완충 시스템이다. 이것은 H}}인 탄산과 HCO}}인 탄산수소가 함께 작용하여 탄산수소 시스템을 형성한다.[10] 이것은 카르복실산이 폐에서 CO와 평형을 이루기 때문에 생리학적 pH인 7.4 근처에서 효과적이다.[9] 혈액이 신체를 통과하면서 젖산 발효와 단백질 이화 작용으로부터의 NH3 양성자화 등과 같은 다양한 과정에서 H+를 얻고 잃는다.[9] 이 때문에 H}}가 조직을 통과하면서 혈액 내에서 변한다. 이것은 폐에서 CO의 분압 변화와 관련이 있으며, 더 많은 또는 더 적은 CO가 필요하다면 호흡 속도의 변화를 유발한다.[9] 예를 들어, 혈액 pH가 감소하면 뇌간이 더 빈번한 호흡을 수행하도록 유발한다. 헨더슨-하셀바흐 방정식은 이러한 평형을 모델링하는 데 사용될 수 있다. 효소가 최적으로 작동하도록 하기 위해 이 pH 7.4를 유지하는 것이 중요하다.[10]
생명을 위협하는 산증 (낮은 pH로 인해 메스꺼움, 두통, 심지어 혼수 상태, 경련이 발생하는 낮은 혈액 pH)은 낮은 pH에서 효소의 기능 부족으로 인해 발생한다.[10] 헨더슨-하셀바흐 방정식으로 모델링된 바와 같이, 심각한 경우에는 정맥 내 탄산수소 용액을 투여하여 이를 되돌릴 수 있다. CO의 분압이 변하지 않으면, 이 탄산수소 용액의 첨가는 혈액 pH를 높일 것이다.
4. 2. 2. 해양 산성화
바다는 pH를 8.1에서 8.3 사이로 유지하기 위한 자연 완충 시스템을 포함하고 있다.[11] 바다의 완충 시스템은 탄산염 완충 시스템으로 알려져 있다.[12] 탄산염 완충 시스템은 탄산염을 완충제로 사용하여 이산화탄소()를 중탄산염으로 변환하는 일련의 반응이다.[12] 탄산염 완충 반응은 수소 이온을 소모하여[13] 일정한 H+ 농도를 유지하도록 도와주며, 그로 인해 일정한 pH를 유지한다.[12]바다는 인간이 대기 중의 이산화탄소()를 증가시킴으로써 해양 산성화를 겪고 있다.[14] 대기 중으로 방출되는 이산화탄소()의 약 30%가 바다에 흡수되고,[14] 이산화탄소() 흡수의 증가는 H+ 이온 생성의 증가로 이어진다.[15] 대기 중 이산화탄소()의 증가는 바다에서 이산화탄소()가 물과 반응하여 탄산을 생성하고, 탄산이 H+ 이온과 중탄산염 이온을 방출하기 때문에 H+ 이온 생성을 증가시킨다.[15] 전반적으로, 산업 혁명 이후 바다는 '''이산화탄소()''' 생산 증가로 인해 pH가 약 0.1 pH 단위 감소했다.[12]
해양 산성화는 탄산염으로 만들어진 껍질을 가진 해양 생물에 영향을 미친다. 더 산성인 환경에서는 유기체가 탄산염 껍질을 성장시키고 유지하기가 더 어렵다.[12] 해양 산성화의 증가는 탄산염 껍질을 가진 유기체의 성장과 번식을 감소시킬 수 있다.[12]
참조
[1]
서적
General Chemistry
Prentice Hall
2002
[2]
웹사이트
Henderson-Hasselbalch Equation - an overview {{!}} ScienceDirect Topics
https://www.scienced[...]
2024-11-02
[3]
웹사이트
Henderson-Hasselbalch Approximation
https://chem.librete[...]
2024-11-02
[4]
논문
Concerning the relationship between the strength of acids and their capacity to preserve neutrality
[5]
웹사이트
Biochemistry {{!}} Definition, History, Examples, Importance, & Facts {{!}} Britannica
https://www.britanni[...]
2024-11-02
[6]
서적
Fundamentals of Analytical Chemistry
Brooks/Cole
2004
[7]
논문
Henderson–Hasselbalch Equation: Its History and Limitations
[8]
서적
Lehninger principles of biochemistry
Macmillan Learning
2021
[9]
서적
Lehninger principles of biochemistry
Macmillan Learning
2021
[10]
논문
Bench-to-bedside review: A brief history of clinical acid–base
2004-04-30
[11]
웹사이트
Researching ocean buffering fact sheet
https://www.uwa.edu.[...]
2024-11-03
[12]
웹사이트
What is ocean acidification? {{!}} NIWA
https://niwa.co.nz/o[...]
2024-11-04
[13]
웹사이트
How does seawater buffer or neutralize acids created by scrubbing? – EGCSA.com
https://www.egcsa.co[...]
2024-11-04
[14]
웹사이트
Ocean acidification {{!}} National Oceanic and Atmospheric Administration
https://www.noaa.gov[...]
2024-11-04
[15]
웹사이트
Ocean Acidification {{!}} NRDC
https://www.nrdc.org[...]
2024-11-04
[16]
뉴스
Henderson-Hasselbach equation {{!}} biochemistry
https://www.britanni[...]
2017-11-12
[17]
웹인용
Henderson-Hasselbach Equation
https://www.merckman[...]
2017-11-12
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com